Introdução
Hematopoiese é o processo de formação, desenvolvimento e maturação dos componentes do sangue. Distinguem-se dois tipos de hematopoiese: a embrionária e a pós-natal. Hematopoiese embrionária ocorre durante o desenvolvimento embrionário. O processo dá-se a partir de uma célula precursora comum e indiferenciada – célula hematopoiética pluripotente ou hematopoietic stem cell (HSC) – ao nível do saco vitelino e da região que mais tarde engloba aorta, gónadas e mesonefro (AGM) em desenvolvimento. O compromisso hematopoiético é detectado primeiramente a nível do saco vitelino, onde surgem diferentes ilhas de eritrócitos primitivos revestidas externamente por células endoteliais em desenvolvimento (Sabin, 1920; Murray 1932). A hematopoiese embrionária pode ser estudada através do modelo in vitro dos corpos embrióides (EBs) (Doetschman et al, 1985; Keller, 1995). O modelo baseia-se na capacidade de diferenciação espontânea de células estaminais embrionárias (ESC) em EBs, aquando da remoção de LIF (leukemia inhibitory factor) do meio de cultura (Smith et al, 1988; Williams et al, 1988; Stewart et al, 1992). O modelo mimetiza fielmente os primeiros eventos do desenvolvimento embrionário. Vários estudos mostraram a emergência sequencial de precursores hematopoiéticos ao longo do processo de diferenciação de EBs. O primeiro a desenvolver-se é designado blast-colony forming cell (BL-CFC) e representa in vitro o hemangioblasto do saco vitelino (dia 3). Posteriormente ao dia 4 surgem os eritrócitos primitivos, seguidos, após o dia 5, pelos precursores eritro-mieloides. Estes acontecimentos celulares e morfológicos resultam da combinação de várias vias de sinalização, entre elas a via de sinalização Notch. A via Notch constitui um mecanismo ancestral e conservado de comunicação célula-a-célula, em metazoários, muito importante no desenvolvimento e na homeostase dos tecidos adultos. Os receptores Notch (Notch 1-4) e os seus ligandos (Jagged1-2, Delta1, Delta3 e Delta4) são proteínas transmembranares que regulam entre outros, a hematopoiese pós-natal (Neves et al, 2006). A importância da via de sinalização Notch foi demonstrada em vários organismos modelo, onde deficiências na presença ou estrutura de receptores ou ligandos levaram à morte do embrião. A via canónica de sinalização Notch é iniciada pela ligação entre um ligando e o receptor Notch na superfície da célula adjacente (Fehon et al, 1990). A activação da via induz mecanismos de clivagem proteólica intramembranar e posterior libertação e translocação da região intracelular do receptor
Notch (ICN) para o núcleo, onde este se liga ao factor de transcrição CSL, para formar um complexo multiproteico que regula a
transcrição de genes alvo (Jarriault et al, 1995). A activação deste complexo parece estar ainda dependente da presença de coactivadores, como o CBP (Gordon et al, 2008). Um outro co-factor importante para a activação deste complexo são as proteínas
Mastermind-like (MAML) que actuam como potentes activadores da via Notch. Estudos com mutantes nulos para MAML-1 conduziram
a fenótipos consistentes com a inibição do receptor Notch1 e Notch2, mostrando que estas proteínas interferem com a função de vários membros da família Notch (Maillard et al, 2004). Investigação na Unidade de Biologia Hematopoiética do Instituto de Medicina Molecular mostrou que a diferenciação de ESCs na presença de um inibidor de sinalização Notch afecta quantitativamente o aparecimento de BL-CFC assim como de progenitores eritro-mieloides. Contudo, não é sabido quando e com que dinâmica temporal, surgem e se desenvolvem as primeiras células progenitoras hematopoiéticas após a inibição da sinalização Notch nos diferentes estádios de desenvolvimento embrionário.
Objectivos
O objectivo deste trabalho foi caracterizar a dinâmica temporal da emergência de populações hematopoiéticas ao longo da diferenciação de EBs expressando uma forma dominant negative do gene MAML1 (DN MAML-1). Para tal, procederemos à análise quantitativa, ao longo do tempo, de células hematopoiéticas e sua progenia imediata, em EBs expressando, ou não (controlo) DN MAML-1. A análise será feita recorrendo a citometria de fluxo multi-paramétrica.
Métodos/Protocolos
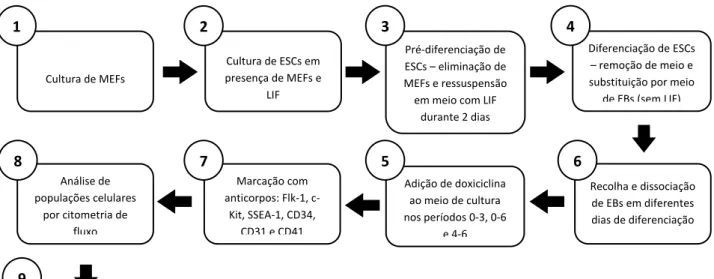
Neste trabalho utilizou-se o modelo in vitro de diferenciação de ESCs em EBs. Para investigar o papel da via de sinalização Notch utilizou-se uma linha celular estaminal embrionária em que a forma dominant negative do MAML-1 está sob o controlo de um promotor indutível por doxiciclina (Ainv15-DN MAML-1, Clone A1). Este modelo possibilita a associação de ESCs formando corpos
císticos tridimensionais (EBs) e tem a vantagem de aumentar as interacções célula-a-célula que são importantes neste tipo de estudo. O protocolo geral do estudo encontra-se esquematizado na Figura 1.
Resultados
Para caracterizar a dinâmica temporal das populações hematopoiéticas emergentes em EBs expressando DN MAML-1 foi recolhida uma amostragem estatística significativa, composta por três conjuntos independentes para cada uma das situações experimentais (excepto para a situação de dia 0). Em cada uma das condições foram adquiridas 10 000 células através de citometria de fluxo, e analisadas posteriormente no software Flow Jo.
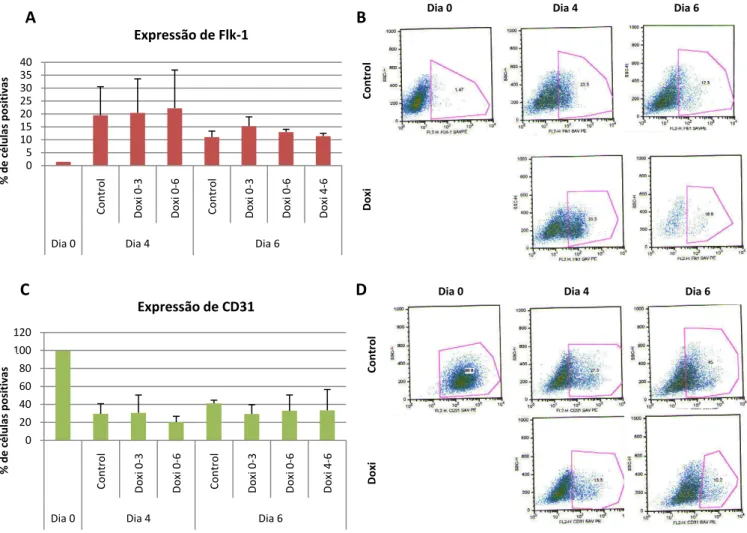
A emergência de populações celulares de precursores vasculares e sanguíneos em cultura foi testada através da avaliação da expressão do marcador transmembranar Flk-1. Segundo Kabrun et al, 1997, Flk-1 é expresso em múltiplas linhas de progenitores hematopoiéticos no início do processo de desenvolvimento, havendo diminuição da expressão com o tempo. Outros estudos mostraram que a aquisição de Flk-1 em células mesodérmicas emergentes em EBs tinham capacidade de originar células endoteliais e hematopoiéticas (Keller, 1997). A análise dos nossos dados revelou que a percentagem de células Flk-1
Emergência de precursores vasculares e sanguíneos - hemangioblasto
+ varia ao longo da diferenciação de EBs sendo mais elevada ao dia 4 e diminuindo de seguida ao dia 6. De acordo com o que está descrito, a população Flk-1+ do dia 4 corresponde ao precursor bipotente, hemangioblasto. Enquanto que a população Flk-1+ do dia 6 representa a população de células endoteliais. Verificámos igualmente que a inibição da via de sinalização Notch, pela indução da forma negativa dominante de MAML1 após adição de doxiciclina ao meio, não alterou a proporção de células Flk1+ quando comparadas com o controlo, para os dias estudados (Figura2A).
9
superfície da caixa. Recolher sobrenadante e fazer contagem das ES células. Iniciar pré-diferenciação com concentração de 6 x 104 células/ml em meio de
pré-diferenciação (IMDM, 15% FBS, 1% solução P/S, 1% solução glutamina, 1% aminoácidos não essenciais, 1% nucleósidos, 0,2% LIF e 0,2% β-mercaptoetanol). Colocar
na estufa durante 48h e mudar o meio diariamente. (4) Após a pré-diferenciação, dissociar e ressuspender as células em meio de EBs (IMDM, 15% FBS, 0,1mM β
-mercaptoetanol, 1% solução glutamina, 1% solução P/S, 1% aminoácidos não essenciais, 1% nucleósidos, 4,5mM monotioglicerol, 50µg/ml ácido ascórbico e 0,2mg/ml transferrina). Substituir o meio de 2 em 2 dias. (5) Adicionar doxiciclina à cultura nos períodos experimentais de 0-3, 0-6 e 4-6 (1µg/ml). (6) Recolher EBs, dissociar e ressuspender as células em tampão MACs (PBS1x/BSA/EDTA). (7) Imunodetecção de vários marcadores de superfície celular em células derivadas de EBs
de diferentes estádios diferenciação. A incubação dos anticorpos foi feita durante 30 minutos a 4oC. Lavar as células com tampão MACs. (8) Leitura no citómetro de
fluxo FACS Calibur das várias amostras celulares. (9) Analisar e interpretar resultados com software Flow Jo.
Figura 1. Esquema representativo do protocolo geral do estudo. Estão representadas as fases principais que marcaram o estudo. (1) Revestir com gelatina os poços de placas de cultura de células. Descongelar MEFs e suspender em meio DMEM com 10% soro
fetal de bovino (FBS), 1x P/S (penicilina/streptomicina) e 1x glutamina. Colocar as placas na incubadora 37oC e com 5% CO
2. (2)
Descongelar as ES células em meio DMEM, 15% FBS, 1% P/S, 1% glutamina, 1% aminoácidos não essenciais, 1% nucleósidos, 0,2% LIF e 0,2% β-mercaptoetanol e colocá-las sobre os MEFs. (3) Remover o meio de ESCs, lavar com PBS e adicionar tripsina para
dissociar as células. Colocar a suspensão a 37oC durante 30 a 45 minutos numa atmosfera com 5%CO
2 para que os MEFs adiram à
Cultura de ESCs em presença de MEFs e LIF
2
Pré-diferenciação de ESCs – eliminação de MEFs e ressuspensão em meio com LIFdurante 2 dias
3
Diferenciação de ESCs – remoção de meio e substituição por meio de EBs (sem LIF)
4
Adição de doxiciclina ao meio de cultura nos períodos 0-3, 0-6 e 4-65
Recolha e dissociação de EBs em diferentes dias de diferenciação6
Marcação com anticorpos: Flk-1, c-Kit, SSEA-1, CD34, CD31 e CD417
Análise de populações celulares por citometria de fluxo8
Tratamento de resultados pelo software Flow Jo Cultura de MEFs1
0 5 10 15 20 25 30 35 40 Con tr ol D ox i 0 -3 D ox i 0 -6 Con tr ol D ox i 0 -3 D ox i 0 -6 D ox i 4 -6
Dia 0 Dia 4 Dia 6
Expressão de Flk-1
0 20 40 60 80 100 120 Con tr ol D ox i 0 -3 D ox i 0 -6 Con tr ol D ox i 0 -3 D ox i 0 -6 D ox i 4 -6Dia 0 Dia 4 Dia 6
Expressão de CD31
O aparecimento de células endoteliais ao longo da diferenciação de EBs A1 DN MAML-1 foi avaliado pela expressão de CD31, uma glicoproteína de superfície, que ao dia 0 de cultura marca igualmente células indiferenciadas (ESCs) e que a partir do dia 4 é específica de células endoteliais (Stockinger et al, 1990) (Albelda et al, 1991). Desta forma, os resultados obtidos estão de acordo com o que é sabido. Ao dia 0 a maioria das células ES são positivas para este marcador. Por outro lado, verificámos que existe um aumento da percentagem de células CD31+ do dia 4 para o dia 6, correspondente à emergência de células endoteliais (Figura 2B).
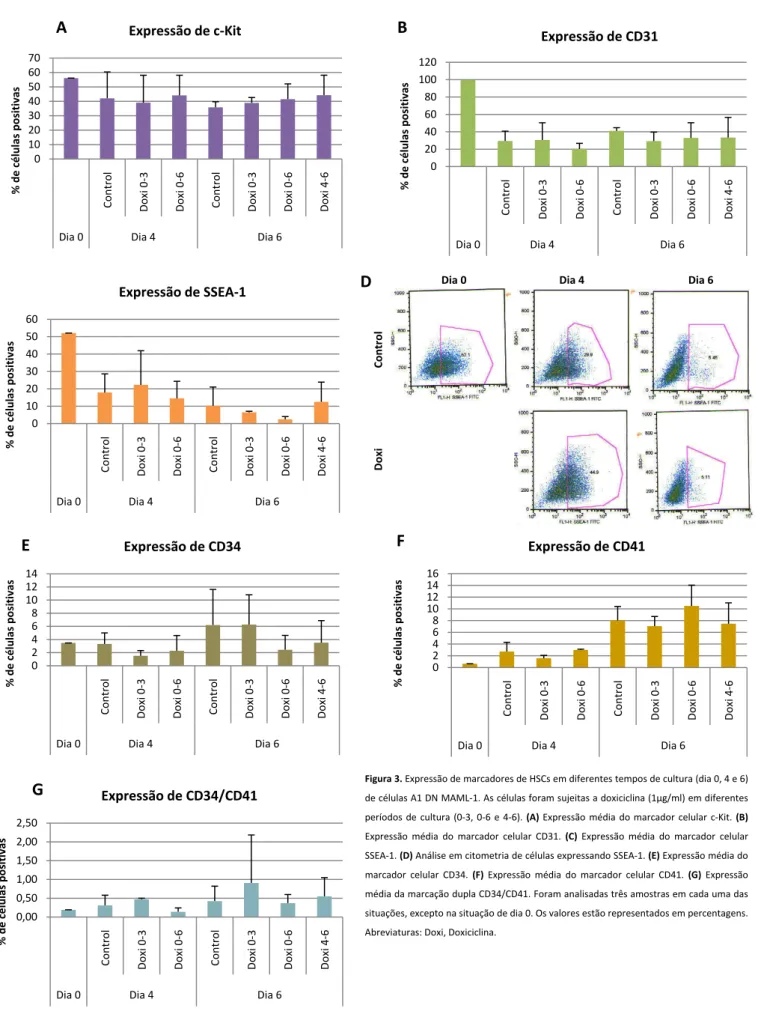
A caracterização fenotípica do aparecimento de células precursoras hematopoiéticas durante a diferenciação de EBs foi avaliada pela expressão simples de cinco marcadores transmembranares, c-Kit, SSEA-1, CD31, CD34 e CD41 e pela expressão dupla do conjunto CD34/CD41.
Emergência de progenitores hematopoiéticos – HSCs
O c-Kit é um receptor tirosina cinase com cinco domínios extracelulares e um domínio catalítico intracelular, expresso em diferentes progenitores incluindo os progenitores hematopoiéticos, HSCs (Linnekin, 1999), cujo ligando é o SCF (stem cell factor) que desencadeia a dimerização do receptor e promove o crescimento celular. Observámos que EBs A1 DN MAML-1, têm uma maior expressão deste marcador de pluripotencia a nível do dia 0, havendo uma diminuição nos dias subsequentes para todas as condições estudadas (Figura
% d e cé lu la s pos it iv as Dia 4 Doxi
A
B
Figura 2. Expressão de marcadores de precursores vasculares e sanguíneos e células endoteliais em diferentes tempos de cultura (dia 0, 4 e 6) de células A1 DN MAML-1. As células foram sujeitas a doxiciclina (1µg/ml) em diferentes períodos de cultura (0-3, 0-6 e 4-6). (A) Expressão média do marcador celular Flk-1. (B) Análise em citometria de células expressando Flk-1. (C) Expressão média do marcador celular CD31. (D) Análise em citometria de células expressando CD31. Foram analisadas três amostras em cada uma das situações, excepto na situação de dia 0. Os valores estão representados em percentagens. Abreviaturas: Doxi, Doxiciclina.
C
D
Dia 0 Dia 4 Dia 6
Co nt ro l Co nt ro l D ox i D ox i
Dia 0 Dia 4 Dia 6
% d e cé lu la s pos it iv as
0 2 4 6 8 10 12 14 16 Con tr ol D ox i 0 -3 D ox i 0 -6 Con tr ol D ox i 0 -3 D ox i 0 -6 D ox i 4 -6
Dia 0 Dia 4 Dia 6
Expressão de CD41
Dia 6 Dia 4D
0 10 20 30 40 50 60 70 Con tr ol D ox i 0 -3 D ox i 0 -6 Con tr ol D ox i 0 -3 D ox i 0 -6 D ox i 4 -6Dia 0 Dia 4 Dia 6
Expressão de c-Kit
0 20 40 60 80 100 120 Con tr ol D ox i 0 -3 D ox i 0 -6 Con tr ol D ox i 0 -3 D ox i 0 -6 D ox i 4 -6Dia 0 Dia 4 Dia 6
Expressão de CD31
A
B
0,00 0,50 1,00 1,50 2,00 2,50 Con tr ol D ox i 0 -3 D ox i 0 -6 Con tr ol D ox i 0 -3 D ox i 0 -6 D ox i 4 -6Dia 0 Dia 4 Dia 6
Expressão de CD34/CD41
0 10 20 30 40 50 60 Con tr ol D ox i 0 -3 D ox i 0 -6 Con tr ol D ox i 0 -3 D ox i 0 -6 D ox i 4 -6Dia 0 Dia 4 Dia 6
Expressão de SSEA-1
Dia 0Co nt ro l D ox i 0 2 4 6 8 10 12 14 Con tr ol D ox i 0 -3 D ox i 0 -6 Con tr ol D ox i 0 -3 D ox i 0 -6 D ox i 4 -6
Dia 0 Dia 4 Dia 6
Expressão de CD34
E
F
G
Dia 4 Co nt ro l Dia 6 Dia 4 Dia 0Figura 3. Expressão de marcadores de HSCs em diferentes tempos de cultura (dia 0, 4 e 6) de células A1 DN MAML-1. As células foram sujeitas a doxiciclina (1µg/ml) em diferentes períodos de cultura (0-3, 0-6 e 4-6). (A) Expressão média do marcador celular c-Kit. (B) Expressão média do marcador celular CD31. (C) Expressão média do marcador celular SSEA-1. (D) Análise em citometria de células expressando SSEA-1. (E) Expressão média do marcador celular CD34. (F) Expressão média do marcador celular CD41. (G) Expressão média da marcação dupla CD34/CD41. Foram analisadas três amostras em cada uma das situações, excepto na situação de dia 0. Os valores estão representados em percentagens. Abreviaturas: Doxi, Doxiciclina.
% d e cé lu la s pos it iv as % d e cé lu la s pos it iv as % d e cé lu la s pos it iv as % d e cé lu la s pos it iv as % d e cé lu la s pos it iv as % d e cé lu la s pos it iv as Dia 6 % d e cé lu la s pos it iv as
E
D
D D
A
3A). O mesmo acontece para o marcador SSEA-1 (Figura 3B) que marca ESCs e células embrionárias germinativas e cuja expressão diminui com a diferenciação celular (Kudo & Narimatsu, 1995). Verificámos igualmente que a expressão de CD31 é muito elevada a nível do dia 0 de cultura, havendo uma diminuição considerável ao longo do tempo (Figura 3C).
O CD34 é uma glicoproteína transmembranar que funciona como factor de adesão célula-a-célula, apesar de ainda se conhecer pouco sobre a sua função exacta. Esta molécula é expressa em HSCs tardias (dia 6), mas é também específica de células endoteliais, em tempos de maturação que não são avaliados no sistema de diferenciação utilizado (Fina et al, 1990). A figura 3D mostra o aumento da expressão de CD34 a partir do dia 6 de EBs A1 DN MAML-1. Um outro marcador analisado foi o CD41. O CD41 é um complexo membranar receptor constituído por integrinas. O CD41 está associado aos estádios precoces da hematopoiese, sendo expresso na membrana das HSCs (Mitjavila-Garcia et al, 2002). A figura 3E mostra um aumento da expressão de CD41 a partir do dia 4 de diferenciação de EBs. A co-expressão de CD34 e CD41 indica a presença de progenitores hematopoiéticos neste sistema in vitro de diferenciação de EBs. Observámos que a maior percentagem de células CD34+/CD41+ surge após o dia 4. Curiosamente, aquando da inibição do sistema Notch nos diferentes tempos experimentais indicados, observámos que existe um aumento de progenitores hematopoiéticos quando Notch está inactivo entre o dia 0 e o dia 3, período que corresponde, neste sistema in vitro, à emergência de progenitores hematopoiéticos e endoteliais.
Discussão/Conclusão
O modelo in vitro de EBs (Doetschman et al, 1985; Keller, 1995) mostrou ser um modelo eficaz na diferenciação de ESCs, permitindo a comunicação célula-a-célula essencial no estudo realizado. As células derivadas de EBs A1 DN MAML-1 diferenciadas na presença da doxiciclina, permitiram analisar a dinâmica de emergência de populações hematopoiéticas e endoteliais, nos primeiros dias da hematopoiese embrionária primitiva, aquando da inibição da via de sinalização Notch. A doxiciclina funcionou como activador da forma DN MAML-1, levando à formação de MAML-1 inactivo. A ausência de MAML-1 activo traduz-se na incapacidade de formação do complexo activador de transcrição a nível do núcleo (ICN + CSL), e por isso a sinalização Notch é impedida (Maillard et al, 2004).
Pela cultura in vitro de EBs ao longo de 6 dias, e em condições controlo, foi possível verificar a dinâmica existente no aparecimento de precursores bipotente, hemangioblasto, (Figura 2) assim como de progenitores hematopoiéticos e de células endoteliais (Figura 3). Pela expressão de Flk-1 e de CD31, em cultura, percebe-se que ocorreu um aumento de precursores vasculares e sanguíneos ao dia 4 e aparecimento de células endoteliais ao dia 6 de cultura. A emergência de células endoteliais neste tempo experimental é afectada pela via de sinalização Notch uma vez que, aquando da inibição da via pela adição de doxiciclina, existe uma ligeira diminuição da percentagem de células CD31+ (Figura 3). Desta forma verifica-se que a inibição da via de sinalização Notch leva a um aumento do número de precursores bipotentes e diminuição do número de células diferenciadas, visto que a inactividade da via impede a diferenciação celular. O turn-off do sistema de sinalização Notch interfere também com a quantidade de células estaminais emergentes em cultura. A avaliação da expressão de c-Kit e SSEA-1, em células expostas a doxiciclina, permite perceber que a inibição da via Notch leva ao aumento do número de ESCs em cultura (Figura 3), devido ao facto de não haver “estímulo” suficiente para a diferenciação celular. Da mesma forma, quando há inibição da via Notch até ao dia 3, a quantidade de progenitores hematopoiéticos (CD34+/CD41+) ao dia 4 e ao dia 6 aumenta quando comparamos com a situação controlo. Contrariamente quando há inibição da via Notch durante todo o tempo de diferenciação a quantidade de progenitores diminui. Podemos concluir que a via de sinalização Notch actua de maneira antagónica nas duas fases de diferenciação de EBs. Numa primeira fase inibe a formação de precursores bipotentes e posteriormente promove a expansão de progenitores hematopoiéticos
.
Estudos Futuros
Em estudos futuros será interessante estudar a eventual existência de alterações a nível do índice de proliferação celular nos EBs aquando da inibição da sinalização Notch. A análise pode ser feita pela incorporação de bromodeoxiuridina (BrdU) em EBs, em dias sequenciais, e posterior análise quantitativa e qualitativa, por citometria de fluxo, da expressão do marcador juntamente com a coloração com o iodeto de propídio.
Bibliografia
ALBELDA, S.M., MULLER, W.A., BUCK, C.A., NEWMAN, P.J. (1991). Molecular and cellular properties of PECAM-1 (endoCAM/CD31): a novel vascular cell-cell adhesion molecule. Journal of Cell Biology 114: 1059-1068.
DOETSCHMAN, T.C., EISTETTER, H., KATZ, M., SCHMIDT, W., KEMLER, R. (1985). The in vitro development of blastocystderived embryonic stem cell lines: Formation of visceral yolk sac, blood islands and myocardium. J. Embryol. Exp. Morphol. 87: 27–45.
FEHON, R.G., KOOH, P.J., REBAY, I., REGAN, C.L., XU, T., MUSKAVITCH, M.A., ARTAVANIS-TSAKONAS, S. (1990). Molecular interactions between the protein products of the neurogenic loci Notch and Delta, two EGF-homologous genes in Drosophila. Cell 61: 523-534.
FINA, L., MOLGAARD, H.V., ROBERTSON, D., BRADLEY, N.J., MONAGHAN, P., DELIA, D., SUTHERLAND, D.R., BAKER, M.A., GREAVES, M.F. (1990). Expression of the CD34 gene in vascular endothelial cells. Blood 75: 2417-26.
GORDON, W.R., ARNETT, K.L, BLACKLOW, S.C. (2008). The molecular logic of Notch signaling – a structural and biochemical perspective. Journal of Cell Science 121: 3109-3119.
ALCOBIA, I., LARANJEIRO, R., GOMES, A.C., SAAVEDRA, P., ZILHÃO, R., CIDADÃO, A., PARREIRA, L. (2009). A stage-specific biphasic role for Notch-signaling in ES-cell-derived hematopoiesis. em preparação
JARRIAULT, S., BROU, C., LOGEAT, F., SCHROETER, E.H., KOPAN, R., ISAREL, A. (1995). Signalling downstream of activated mammalian Notch. Nature 377: 355-358.
KABRUN, N., BUHRING, H. J., CHOL, K., ULRICH, A., RISAU, W., KELLER, G. (1997). Flk-1 expression defines a population of early embryonic hematopoietic precursors.
Development 124: 2039-2048.
KELLER, G. (1995). In vitro differentiation of embryonic stem cells. Curr. Opin. Cell Biol. 7: 862–869.
KUDO, T., NARIMATSU, H. (1995) The beta 1,4-galactosyltransferase gene is post-transcriptionally regulated during differentiation of mouse F9 teratocarcinoma cells.
Glycobiology 5: 397-403.
LINNEKIN, D. (1999). Early signaling pathways activated by c-Kit in hematopoietic cells. Int. J. Biochem. Cell Biol. 31: 1053-1074.
MAILLARD, I., WENG, A.P., CARPENTER, A.C., RODRIGUEZ, C.G., SAI, H., XU, L., ALLMAN, D., ASTER, J.C., PEAR, W.S. (2004). Mastermind critically regulates Notch-mediated lymphoid cell fate decisions. Blood 104: 1696-702.
MITJAVILA-GARCIA, M.T., CAILLERET, M., GODIN, I., NOGUEIRA, M.M., COHEN-SOLAL, K., SCHIAVON, V., LECLUSE, Y., LE PESTEUR, F., LAGRUE, A.H., VAINCHENKER, W. (2002). Expression of CD41 on hematopoietic progenitors derives from embryonic hematopoietic cells. Development 129: 2003-2013.
MURRAY, P.D.F. (1932). The development of in vitro of the blood of the early chick embryo. Proc. Roy. Soc. London 11: 497–521.
NEVES, H., WEERKAMP, F., GOMES, A.C., NABER, B.A.E., GAMEIRO, P., BECKER, J.D., LÚCIO, P., CLODE, N., VAN DONGEN, J.J.M., STAAL, F.J.T., PARREIRA, L. (2006). Effects of
Delta1 and Jagged1 on early human hematopoiesis: correlation with expression of Notch signaling-related genes in CD34+ cells. Stem Cells 24: 1328 – 1337.
SABIN, F.R. (1920). Studies on the origin of blood vessels and of red corpuscles as seen in the living blastoderm of the chick during the second day of incubation. Contrib.
Embryol. 9: 213– 262.
SMITH, A.G., HEATH, J.K., DONALDSON, D.D., WONG, G.G., MOREAU, J., STAHL, M., ROGERS, D. (1988). Inhibition of pluripotential embryonic stem cell differentiation by purified polypeptides. Nature 336: 688–690.
STEWART, C.L., KASPAR, P., BRUNET, L.J., BHATT, H., GADI, I., KONTGEN, F., ABBONDANZO, S.J. (1992). Blastocyst implantation depends on maternal expression of leukaemia inhibitory factor. Nature 359: 76–79.
STOCKINGER, H., GADD, S.J., EHER, R., MAJDIC, O., SCHREIBER, W., KASINRERK, W., STRASS, B., SCHNABL, E., KNAPP, W. (1990). Molecular characterization and functional analysis of the leukocyte surface protein CD31. Journal of Immunology 145: 3889-3897.
WILLIAMS, R.L., HILTON, D.J., PEASE, S., WILLSON, T.A., STEWART, C.L., GEARING, D.P., WAGNER, E.F., METCALF, D. NICOLA, N.A. GOUGH, N.M. (1988). Myeloid leukemia inhibitory factor maintains the developmental potential of embryonic stem cells. Nature 336: 684–687.
Considerações finais
A segunda parte do projecto inicialmente delineado não foi realizada devido a contratempos experimentais. No entanto, o principal objectivo do projecto foi cumprido. Até à data de apresentação pública do projecto realizarei ainda os dois conjuntos experimentais que faltam a nível do dia 0, de forma a solidificar os resultados obtidos até agora. O suporte de apresentação do projecto na sessão pública será preferencialmente Power Point.