REVISTA
BRASILEIRA
DE
ANESTESIOLOGIA
PublicaciónOficialdelaSociedadeBrasileiradeAnestesiologiawww.sba.com.br
ARTÍCULO
CIENTÍFICO
Efectos
de
la
dexmedetomidina
en
conjunto
con
el
precondicionamiento
isquémico
remoto
en
la
lesión
de
isquemia-reperfusión
renal
en
ratones
Emine
Bagcik
a,
Sevda
Ozkardesler
b,
Nilay
Boztas
b,∗,
Bekir
Ugur
Ergur
c,
Mert
Akan
b,
Mehmet
Guneli
dy
Sule
Ozbilgin
baDepartamentodeAnestesiologíayReanimación,GordesStateHospital,Manisa,Turquía
bDepartamentodeAnestesiologíayReanimación,MedicalFacultyof9EylulUniversity, ˙Izmir,Turquía cDepartamentodeHistologíayEmbriología,MedicalFacultyof9EylulUniversity, ˙Izmir,Turquía dLaboratoriodeCienciaAnimal,MedicalFacultyof9EylulUniversity, ˙Izmir,Turquía
Recibidoel4dejuliode2013;aceptadoel2deenerode2014 DisponibleenInternetel16deseptiembrede2014
PALABRASCLAVE Ri˜nón;
Lesiónde
isquemia-reperfusión; Dexmedetomidina; Caspasa-3;
Precondicionamiento isquémico;
Apoptosis
Resumen
Introducciónyobjetivos: Elobjetivodeesteestudiofueevaluarlosefectosdel precondicio-namiento isquémico remoto mediante breve isquemia del miembro posterior unilateral en combinaciónconla dexmedetomidina enla lesiónde isquemia-reperfusiónrenal pormedio dehistopatologíaeinmunoreactividaddelacaspasa-3activaenratones.
Métodos: 28ratonesmachosalbinosWistarfuerondivididosen4grupos.GrupoI(Sham[cirugía control],n=7):serealizólaparotomíaydiseccióndelpedículorenalen65mindeanestesiay losratonesfueronobservadosbajoanestesiadurante130min.GrupoII(isquemia-reperfusión, n=7): en el sexagésimoquinto minuto de anestesia,los pedículos renales bilaterales fue-ron pinzados; después de 60min de isquemia, se realizaron 24h de reperfusión. Grupo III (isquemia-reperfusión+dexmedetomidina,n=7):alquintominutodereperfusión,la dexme-detomidina(100g/kgintraperitoneal)fueadministradaenelgrupoconisquemia-reperfusión;
la reperfusión duró 24h. Grupo IV (isquemia-reperfusión+precondicionamiento isquémico remoto+dexmedetomidina,n=7):despuésdelalaparotomía,seaplicaron3ciclosde precon-dicionamientoisquémico(10mindeisquemiay10mindereperfusión)enelmiembroposterior izquierdoydespuésde5minenelgrupoiii.
Resultados: Laspuntuaciones delesiónhistopatológicaeinmunoreactividaddela caspasa-3 activafueronsignificativamentemenoresenelgrupoShamencomparaciónconlosotros gru-pos.Laspuntuacionesdelesiónhistopatológicadelosgruposiiiyivfueronsignificativamente menoresquelasdelgrupoii(p=0,03yp=0,05).Lainmunorreactividaddelacaspasa-3fue signi-ficativamentemenorenelgrupoivqueenelgrupoii(p=0,01)ynohubodiferenciasignificativa entrelosgruposiiyiii(p=0,06).
∗Autorparacorrespondencia.
Correoelectrónico:nilayboztas@hotmail.com(N.Boztas).
2255-4963/$–seefrontmatter©2014SociedadeBrasileiradeAnestesiologia.PublicadoporElsevierEditoraLtda.Todoslosderechosreservados.
Conclusiones:Elcondicionamientofarmacológicocondexmedetomidinayprecondicionamiento isquémicoremotoencombinacióncondexmedetomidinadisminuyendemodosignificativola lesióndeisquemia-reperfusiónrenalhistomorfológicamente.Elusocombinadodelos2métodos previenelaapoptosisvíacaspasa-3activa.
©2014SociedadeBrasileiradeAnestesiologia.PublicadoporElsevierEditoraLtda.Todoslos derechosreservados.
KEYWORDS Kidney;
Ischemia-reperfusion injury;
Dexmedetomidine; Caspase-3; Ischemic preconditioning; Apoptosis
Effectsofdexmedetomidineinconjunctionwithremoteischemicpreconditioningon renalischemia-reperfusioninjuryinrats
Abstract
Backgroundandobjectives: The aim of this study was to evaluate the effects of remote ischemic preconditioningbybriefischemiaofunilateralhindlimbwhencombined with dex-medetomidine on renal ischemia-reperfusion injury by histopathology andactive caspase-3 immunoreactivityinrats.
Methods:28Wistaralbinomaleratsweredividedinto4groups.GroupI(Sham,n=7): lapa-rotomy and renal pedicledissectionwere performed at65th minuteof anesthesiaandthe ratswereobservedunderanesthesiafor130min.GroupII(ischemia-reperfusion,n=7):at65th minuteofanesthesiabilateralrenalpedicleswereclamped.After60minischemia24hof reper-fusionwasperformed.GroupIII(ischemia-reperfusion+dexmedetomidine,n=7):atthefifth minute ofreperfusion (100g/kgintra-peritoneal)dexmedetomidine was administeredwith
ischemia-reperfusion group;reperfusionlasted24h.GroupIV(ischemia-reperfusion+remote ischemicpreconditioning+dexmedetomidine,n=7):afterlaparotomy,threecyclesofischemic preconditioning(10minischemiaand10minreperfusion)wereappliedtothelefthindlimband after5minwithgroupiii.
Results:Histopathologicalinjury scores andactivecaspase-3 immunoreactivitywere signifi-cantlylowerintheShamgroupcomparedtotheothergroups.Histopathologicalinjuryscores ingroupsiiiandivweresignificantlylowerthangroupii(P=.03andP=.05).Activecaspase-3 immunoreactivitywassignificantlylowerinthegroupivthangroupii(P=.01)andtherewasno significantdifferencebetweengroupiiandgroupiii(P=.06).
Conclusions: Pharmacologic conditioning with dexmedetomidine and remote ischemic
preconditioningwhencombinedwithdexmedetomidinesignificantlydecreasesrenal ischemia-reperfusioninjuryhistomorphologically.Combineduseoftwomethodspreventsapoptosisvia activecaspase-3.
© 2014SociedadeBrasileirade Anestesiologia.Publishedby ElsevierEditoraLtda.Allrights reserved.
Introducción
La lesión renal aguda isquémica es un síndrome clí-nico con altas tasas de mortalidad y morbilidad. Debido a la gran demanda de energía y a la compleja red microvascular renal, el ri˜nón es altamente sensible a la lesión deisquemia-reperfusión (IR)1-4. Los mecanismos de
lalesióndeIRrenalsonmultifactoriales,incluyendo hipo-xia,da˜nos alosradicaleslibresyrespuestas inflamatorias sistémicas5.Lareperfusiónisquémicadeltejidorenalinduce
condicionescelularescomplejasylamuertedelascélulas renalesdebidoalaapoptosis6.
Laapoptosisesunaformademuertecelularprogramada genéticamente.Dosvíasprincipalesdesempe˜nanunpapel enlaapoptosisepitelial.Laprimera,conocidacomolavía extrínseca o de receptor de muerte, está estimulada por moléculas de la familiaTNF-␣ conectada al ligandoCD95
(ligandoFas=CD95)atravésdesignosextracelulares.Esavía seconectaalasegundavía,lavíaintrínsecaomitocondrial, a través de la activación de la caspasa-3, que incluye el citocromocylafamiliadeproteínasBcl-2,yensuconjunto aumentanlaapoptosis7.
Laapoptosisdecélulastubularesrenaleseselresultado deunalesiónrenalyunimportantecontribuyentedela fisio-patologíadelaIR.Tantolainflamacióncomola apoptosis coexisten enla lesión deIR renal. Durante la hipoxia, la actividaddelacaspasaaumentacomoresultadodela acu-mulaciónintracelulardeCa2+.Lacaspasasehaceactivaen
lostejidosisquémicosyesunindicadordemuertecelular8.
Estasalteraciones,quepuedenobservarseencélulas tubu-lares,puedencausarlapérdidadelosbordesencepillode lascélulastubularesproximalesyescaparsedesdela mem-branabasaldelascélulashacialaluztubular,conlaeventual obstruccióndeltúbulo9,10.
Entre los métodos usados para reducir los efectos de lalesión deIR,el precondicionamiento isquémico remoto (PCIR)yel condicionamientofarmacológicoson losquese usan más a menudo11. En la revisión de la literatura en
lenguainglesa no encontramos ningún estudio de modelo deIRexperimentalqueinvestigase losefectos delusodel condicionamiento farmacológico con la dexmedetomidina administradaencombinaciónconPCIR.
I R Grupo I
Grupo II
Grupo III
Grupo IV
I D R
D R
1565º min 125
125
125 130 130 65
0 0
0
010203040 506065 I R I R I R I
65
1565º min
1565º min
1565º min
Figura1 Representaciónesquemáticadelprotocolo
experi-mental.
D,dexmedetomidina;I,isquemia;R,reperfusión.
administradoencombinaciónconladexmedetomidinaenla extremidad inferior y evaluar la inmunorreactividad de lacaspasa-3activaenmodelodeIRrenalenratones.
Materiales
y
métodos
Entotal se utilizaron 28 ratones adultos machos, albinos Wistar,conunpesode250-300g.Alcomienzodela investi-gaciónlosratonessemantuvieronentemperaturaambiente (21-22◦C)yconunahumedadrelativadel40-60%enunciclo
declaro/oscuro(12/12h)yalimentadosconunadieta están-dardepiensoyaguaadlibitum.Despuésdelaaprobación porparte delComitédeÉtica enExperimentaciónAnimal delainstitución,elestudiofuerealizadoenelLaboratorio MultidisciplinariodeExperimentaciónAnimal.Laanestesia sesuministróconcetamina(50mg/kg)yclorhidratode xila-zina(10mg/kg)yadministradaporvíaintraperitoneal(IP). Despuésde laanestesia, losanimales fueron divididos en 4grupos.
• GrupoI(Sham,n=7).Despuésdelalaparotomía,los pedí-culosrenalesderechoeizquierdofueronexpuestosenel minuto65delaanestesia,ylosratonessemantuvieron bajoanestesiadurante130minsinningunaotra interven-ción.
• GrupoII(IR,n=7).Despuésde60mindeisquemia,el pin-zamientofueretiradoylareperfusióndelosri˜nonesse permitiópor24h.
• Grupo III (IR+ dexmedetomidina, n=7). Después de 60min de isquemia, el pinzamiento fue retirado y se administraron100g/kgdedexmedetomidina(Precedex
100g/2ml,AbbottLaboratories,IL, EE.UU.)porvíaIP,
ylareperfusióndelosri˜nonessepermitiópor24h.
• Grupo IV(IR+PCIR+dexmedetomidina,n=7).Enseguida alalaparotomía,despuésde5mindePCIRy60min pos-teriores deisquemiarenal, elpinzamiento fue retirado yseadministraron100g/kgdedexmedetomidina
(Pre-cedex100g/2ml,AbbottLaboratories).Finalmente,se
realizaron24hdereperfusión(fig.1).
Quedóestipuladoqueseexpondríanlospedículosrenales enel grupoiyseiniciaríalaisquemiaenelminuto65de
laanestesia enlosgruposii yiiipara sincronizartodoslos
gruposparaeltiempodeprecondicionamientodelgrupoiv
yestandarizareliniciodelosprocedimientos.Lasmuestras detejidoseobtuvierondespuésde24hdereperfusión.
Para proteger los ratones de la hipotermia, la mesa deoperación fuecalentada conuncalentadordelámpara duranteel estudioylatemperaturacorporalsemidiócon una sondarectalyse mantuvoa 3.737,5◦C. Una solución
salinaporvíasubcutáneaacadahora,unadosificaciónde 3ml/kg,fueadministrada paraprevenirladeshidratación. Durante eltiempo de esperael abdomen secerrócon un tapón degasa estéril húmeday conunapinza quirúrgica. En todos los grupos, el ri˜nón izquierdo fue retirado bajo anestesiaparaanálisishistomorfológico,ylosratonesfueron sacrificadosporsangríadepuncióncardíacaaltérminodel estudio.Los ri˜nonesfueron colocadosenformol taponado al 10% y mojados enparafina, cortadosen láminas de 4-5mycoloreadosconhematoxilinayeosinaparaelestudio
histológicoconelusodeunmicroscopiodeluz.
Modelodeisquemia-reperfusiónrenal
Lospedículosrenalesbilateralesfueronexpuestosdespués delalaparotomía.Laisquemiarenaltotaldelospedículos renalesbilateralessemantuvoconpinzamiento microvascu-laratraumático.Laoclusiónadecuadafueconfirmadaporla faltadepulsaciónenlospedículosrenalesyporlapalidez de losri˜nones. Despuésdelperíodo isquémico, las pinzas microvascularesfueronretiradasyseiniciólareperfusión.
Modelodeprecondicionamientoisquémicoremoto
Para el efecto del torniquete del PCIR se emplearon un métodoquemostrósereficazporcintilografíadeperfusión yunmedidordeláser12,13. Paraesafinalidad, elmiembro
posteriorizquierdodelratónfueamarradoconunatira elás-tica(1cmdeanchoy30cmdelargo)enlaingle,aplicando presiónalrededor.Serealizaron3ciclosde10minde isque-mia,seguidospor 10mindereperfusión(65minentotal). Lainterrupción delflujosanguíneoseconfirmóconel uso de un medidor de la corriente del láser (láser Flo BPM2, Vasamedic,EE.UU.).
Evaluaciónhistomorfológicadetejidorenal
Las seccionesdetejidorenaldespuésdelIRfueron calcu-ladas por microscopia de luz por dos histólogos «ciegos»
para las designaciones de los grupos de animales, que investigaron las alteraciones estructurales de los túbulos proximales (atrofia tubular, pérdida del borde tubular en cepillo,vacuolización,dilatacióntubular,formaciónde cál-culo), la infiltración de células mononucleares(CMN), las alteraciones intersticialesestructurales, la morfologíadel corpúsculorenalylascélulasennecrosisyapoptosis.
Laclasificacióndelasimágenestransversalessehizopor medio de puntuaciones semicuantitativas en cuanto a lesiones tubulointersticiales de la siguiente forma: 0=ninguna lesión; 1=0-25%; 2=26-45%; 3=46-75%, y 4=76-100%14.
Métodosdeinmunohistoquímica
fueronmojadosenparafinayseccionadosencortesde3m
de espesor con un micrótomo y recolectados en láminas revestidasconpoli-L-lisina.
Las muestras fueron almacenadas en un horno a 60◦C durante 12h. Enseguida, un anticuerpo
monoclo-nal anticaspasa-3 específico para ratones (RB-10287-R7 LabVision) se usó para calcular la inmunorreactividad anticaspasa-3.
La actividad de laperoxidasa endógena fuebloqueada usando una solución de peróxido de hidrógeno al 3% en alcohol.Lasseccionesdelisinafuerontratadasconel anti-cuerpo anticaspasa-3a 4◦Cdurante la nochey enseguida
incubadasconunanticuerposecundariobiotiniladodurante 30min. Despuésde la aplicación del kit VectorElite ABC (VectorLaboratoriesInc.,Burlingame,EE.UU.),elcomplejo biotina-avidina-peroxidasa para el anticuerpo fue visuali-zadousandoel0,02%desoluciónde3,3’-diaminobenzidina. DespuésdelacontracoloraciónconhematoxilinadeMayer, seprocedióalanálisisdelaimagen.
Latasadecoloraciónpositivasecalculóusandoun indi-cadordepuntuaciónsemicuantitativo(1-4)paraladensidad yladistribución.
Criteriosdeexclusión
Los ratonesque necesitaronreanimación fueron excluidos delestudio.
Análisisestadístico
Paralosanálisisestadísticosseusóel programaSPSS (ver-sión15,0;SPSS,Chicago,IL,EE.UU.).Elanálisisdevarianza de Kruskal-Wallis se hizo para analizar los datos. El test
U de Mann-Whitney fue usado para las comparaciones pareadas de losgrupos. Todoslos datosse expresaron en media±desviaciónestándar.Losvaloresdep<0,05fueron consideradoscomoindicadoresdesignificaciónestadística.
Resultados
Entotal,28ratones fueron incluidosenel grupode estu-dio. Un ratón del grupo iv murió durante el período de
reperfusiónyquedóexcluidodelestudio.Laspuntuaciones
Sham
Infiltración de células mononucleares
1,8
1,6
1,4
1,2
0,8
0,6
0,4
0,2
0 1
IR IR+Dex IR+RIPC+Dex
Figura2 Puntuacionesdeinfiltracióndecélulas
mononuclea-resdetectadaporexamenhistomorfológicorenal. *ComparacióndelgrupoIRconelgrupoSham(p=0,01).
/
=Comparación de los grupos IR+Dex y IR+PCIR+Dex con el
grupoiv(p<0,05).
histomorfológicaseinmunohistoquímicasdelaslesionesde losgruposdeestudioaparecenenlastablas1y2.
Puntuacioneshistomorfológicasdelaslesiones renales
InfiltracióndeCMN.Laspuntuacioneshistomorfológicasde laslesionesdelgrupoShamfueronsignificativamente meno-resquelosdelgrupoiv (p=0,01).Laspuntuacionesdelas
lesionesdelgrupoIRfueronsignificativamentemayoresque lasdelosgruposIR+Dex eIR+PCIR+Dex(p=0,04yp=0,04, respectivamente;fig.2).
Alteracionesestructuralesdelostúbulosproximales.Las puntuaciones histomorfológicas de las lesiones del grupo
Shamfueronsignificativamentemenoresquelasdelos gru-posIR,IR+DexeIR+PCIR+Dex(p<0,01,p=0,02yp=0,02, respectivamente). El grupo IR obtuvo puntuaciones sig-nificativamente más elevadas que los grupos IR+Dex e IR+PCIR+Dex(p=0,05yp=0,05,respectivamente), mien-tras que no se registró diferencia significativa entre los gruposIR+DexeIR+PCIR+Dex(p=1,00;fig.3).
Alteracionesglomerulares. Las puntuaciones histomor-fológicasdelaslesionesdelShamfueronsignificativamente menores que las del grupo iv (p=0,04). El grupo IR
Tabla1 Resultadoshistomorfológicosdelaslesionesdelosgrupos
CMN AETP AG ETLI
GrupoI(n=7)
Sham
0,14±0,38 0,0±0,0 0,0±0,0 0,28±0,48
GrupoII(n=6) IR
1,0±0,63 1,67±0,82 0,50±0,55 3,83±2,22
GrupoIII(n=7) IR+Dex
0,28±0,49 0,71±0,75 0,0±0,0 1,42±1,27
GrupoIV(n=7) IR+PCIR+Dex
0,28±0,49 0,71±0,75 0,0±0,0 1,42±1,61
pa 0,04b 0,00b 0,01b 0,008b
AETP,alteracionesestructuralesdelostúbulosproximales;AG,alteracionesglomerulares;CMN,infiltracióndecélulasmononucleares;
ETLI,puntuacióntotaldelaslesioneshistológicas.
Datosexpresadoscomomedia±DE.
a TestdeKruskal-Wallis.
Sham
Alteración tubular
3
2,5
1,5
0,5
0 1 2
IR IR+Dex IR+RIPC+Dex
Figura3 Puntuacionesdealteracióndelesióntubular
detec-tadaporelexamenhistomorfológicorenal.
*ComparacióndelosgruposIR,IR+DexyIR+PCIR+Dexconel grupoSham(p<0,01).
/
=Comparación del grupo IR con los grupos IR+Dex y
IR+PCIR+Dex(p=0,05).
obtuvo puntuacionessignificativamente más elevadas que los grupos IR+Dex e IR+PCIR+Dex (p=0,04 y p=0,04, respectivamente), mientras que no se registró diferen-ciasignificativa entre los grupos IR+Dex e IR+PCIR+Dex (p=1,00;fig.4).
Puntuaciónhistopatológicatotaldelaslesiones.La pun-tuación histomorfológica total de las lesiones del grupo
Sham fue significativamente menor que la del grupo iv
(p=0,003). La comparación del grupo IR con los grupos IR+Dex e IR+PCIR+Dex mostró puntuaciones significati-vamente más elevadas que las del grupo IR (p=0,03 y p=0,05,respectivamente),mientrasquenoseregistró dife-renciasignificativaentrelosgruposIR+DexeIR+PCIR+Dex (p=0,79;fig.5).
Puntuacióninmunohistoquímicadelaslesiones.Las pun-tuacionesdelacoloracióninmunohistoquímicadelgrupoIR fueron significativamente más elevadas que las del grupo
Sham(p=0,001).Nohubodiferenciaestadísticamente sig-nificativaentrelosgruposIReIR+Dex(p=0,06).
En la comparación de las puntuaciones de las lesio-nes entre los grupos IR+PCIR+Dex e IR, las del grupo IR+PCIR+Dexfueronsignificativamentemenores(p=0,01). Las puntuaciones de las lesiones de los grupos IR+Dex e IR+PCIR+Dexnofuerondiferentes(p=0,47;fig.6).
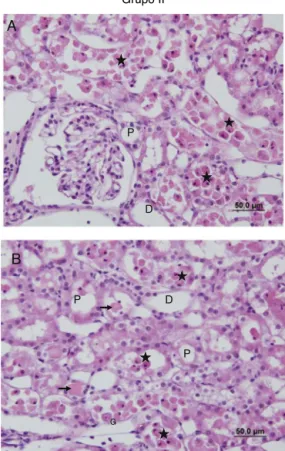
Ningunainfiltracióncelularopérdidadebordeencepillo seobservóenlasseccionesdelgrupoSham(fig. 7A,B).Sin
Sham
Alteración glomerular
1,2
1
0,8
0,6
0,2
0 0,4
IR IR+Dex IR+RIPC+Dex
Figura 4 Puntuaciones de alteración de lesión glomerular
detectadaporhistomorfologíarenal.
*ComparacióndelgrupoIRconogrupoSham(p<0,01). /
=Comparación del grupo IR con os grupos IR+Dex e
IR+PCIR+Dex(p<0,05).
Tabla2 Resultadosinmunohistoquímicosdelaslesionesde losgrupos
GrupoI(n=7) Sham
0,85±0,37
GrupoII(n=6) IR
2,50±0,54
GrupoIII(n=7) IR+Dex
1,71±0,75
GrupoIV(n=7) IR+PCIR+Dex
1,42±0,53
Datosexpresadoscomomedia±DE.
embargo,enelgrupoivobservamosunainfiltración peritu-bular deCMN, másprominente enel áreacortical, yuna pérdidadebordeencepillodelascélulasdeltúbulo proxi-mal,atrofiatubular,dilatacióntubularyvacuolización.En algunosdelostúbulosseobservólaacumulaciónde mate-rialproteico, juntoconlaformacióndecastasydesechos celularesenlaluzdelostúbulos(fig.8A,B).
EnelgrupoIR+Dexhubounapérdidadelbordeencepillo delascélulastubulares,atrofiatubular,dilatacióntubular, vacuolizaciónyacumulacióndematerialproteicoydesechos celularesenlaluzdelostúbulos,aunqueenmenorcantidad queenelgrupoIR(fig.9A,B).
Comparado con el grupo IR, el grupo IR+PCIR+Dex presentóatrofiatubular,dilatación tubular,vacuolización,
Sham
Puntuaciones histopatológicos totales
de las lesiones
7
6
5
4
3
2
1
0
IR IR+Dex IR+RIPC+Dex
Figura 5 Puntuación histopatológico total de las lesiones
detectadasporhistomorfologíarenal.
*ComparacióndelgrupoIRconogrupoSham(p<0,01). /
=Comparación del grupo IR con los grupos IR+Dex y
IR+PCIR+Dex(p<0,05).
Sham
Alteración glomerular
3,5
3
2,5
2
1
0 1,5
0,5
IR IR+Dex IR+RIPC+Dex
Figura6 Puntuacióndelainmunohistoquímicarenal.
*ComparacióndelgrupoIRconelgrupoSham(p<0,01). /
=Comparación del grupo IR con los grupos IR+Dex y
B
D G P
P
Grupo I
P G
G P
A
Figura7 Secciones(AyB)delgrupoSham.
D,túbulodistal,bordeencepillo;G,glomerular;P,túbulo pro-ximal.
acumulacióndematerialproteico ydesechoscelulares en laluzde lostúbulos,como tambiénpérdida delbordeen cepillodelascélulastubulares,aunqueenmenorcantidad. Sinembargo,encomparaciónconelgrupoIR+Dex,las alte-racionestubularesfueronmenosacentuadas(fig.10A,B).
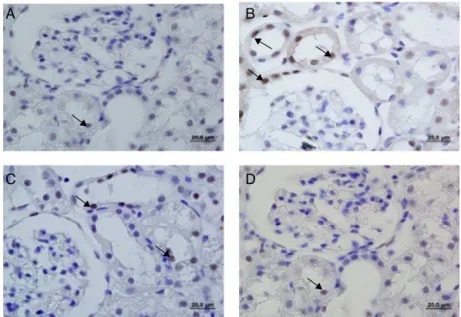
La intensidadde la coloración inmunohistoquímica fue mayor en las células positivas para caspasa-3 activa en el grupo IR en comparación con el grupo Sham, mien-trasque fuemenor enlascélulas delosgrupos IR+Dexe IR+PCIR+DexcomparadosconelgrupoIR.Laintensidadde lacoloracióndelascélulaspositivasparacaspasa-3activa delgrupoIR+PCIR+Dex fuemenor encomparaciónconel grupoIR+Dex(fig.11).
Discusión
Lainsuficienciarenalagudaquesedacomoresultadodela isquemiapuedeestarsiendocausadaporlahipotensión,por lahipovolemiayporlahipoperfusiónsecundariaala deshi-dratación,comotambiénlalesióndeIRencirugíasmayores, como las cardiotorácicas,vasculares y trasplantes15-18. La
lesióndeIResunadelascausasmáscomunesde insuficien-ciarenalagudaenelperioperatorio18.
MétodoscomoelPCIRyelcondicionamiento farmacoló-gicocondexmedetomidina,quesonusadosparapreveniro tratarlesionesdeIRrenal,hanmostradoefectospositivos enlalesióndeIRenmuchosestudiosanteriores11.
Enunainvestigaciónenlaliteraturanoencontramos nin-gúnestudioquecalculaselosefectosdelacombinaciónde
A
D P
B
D
G
P P
Grupo II
Figura8 Secciones(AyB)delgrupoIR.
D,túbulodistal;( )acumulacióndematerialproteicoenlos túbulos;(⋆)vertidoparadentrodelaluzdecélulasepiteliales
tubulares;L,glomerular;P,túbuloproximal.
esos 2 métodos en lesión de IR. Este estudio experimen-tal, usandoun modelo de ratón de IRrenal, comparó los efectosdelusodedexmedetomidinapura oPCIRen com-binaciónconladexmedetomidinacontralaapoptosisrenal, evaluandopormediodelainmunoreactividaddela caspasa-3ypuntuacioneshistopatológicosdelaslesiones.
Deacuerdo con nuestros resultados, el uso de la dex-medetomidina pura o en combinación con PCIR redujo significativamente lainfiltración de CMN, las alteraciones glomerulotubularesylapuntuacióntotaldelesionesdeIR. Enambosgrupos,todaslaspuntuaciones,conexcepciónde lasalteracionestubulares(p=0,05),fueronparecidasalas puntuacionesdelgrupoSham. Hubounareducción signifi-cativadelainmunoreactividaddelacaspasa-3enelgrupo dexmedetomidinaencombinaciónconPCIR,loquesugiere que la apoptosis, la principal vía de lesión IR, puede ser reducidaoprevenidaconelusodeesacombinación.
Variosperíodosdeisquemiayreperfusiónfueronusados enmodelosdelesión deIR renalenmuchos estudios19-22.
El períodoisquémico críticodepende del órgano, yde la isquemiacon duración superior a 5min para el cerebro y a 15-20min para el hígado y el ri˜nón, que puede causar muerteneuronale infarto23.Williamsetal.20 investigaron
Grupo III
A
G P
P
D
B
Figura9 Secciones(AyB)delgrupoIR+Dex.
D,túbulodistal;( )acumulacióndematerialproteicoqueserá reducidoencomparaciónconlosotrosgrupos;G,glomerular; P,túbuloproximal.
Losefectosprotectoresdelosórganosdela dexmedeto-midinacontralalesióndeIRfuerondemostradosenvarios tejidos,comoelcerebro, elcorazónylosri˜nones24-27.Los
efectos de la dexmedetomidina en la lesión de IR renal
Grupo IV
A
B
D G
P
P
G
D
D
P P
D G
Figura10 Secciones(AyB)delgrupoIR+PCIR+Dex.
D, túbulodistal;( )acumulacióndematerialproteicoque seráreducidoencomparaciónconlosotrosgrupos;G, glome-rular;P,túbuloproximal.
en ratones fueron investigados por Koco˘glu et al.19. Esos
investigadoresrelataronunadisminuciónsignificativaenlas puntuaciones histopatológicos delesión, detectadasen el minuto45despuésdelaadministraciónIPde100g/kgde
dexmedetomidina al inicio de la reperfusión. En nuestro estudio, con la misma dosis de dexmedetomidina admi-nistrada al inicio de la reperfusión se obtuvo un efecto
A B
C D
Figura11 Imágenesseccionalescoloradasdelacaspasa-3enlainmunohistoquímicadelosgruposexperimentalesSham(A),IR
renoprotectorevidenciadoporreduccionessignificativasde las puntuaciones histológicas de las lesiones. Ese efecto renoprotectorsehallónosoloduranteelperíodoinicial des-puésdelalesióndereperfusión,sinoquepermanecióhasta lavigésimacuartahora,quefueconsideradaelpicodela lesióndeIR20.
Aunqueelmecanismosubyacentealefectoprotectorde ladexmedetomidinaenIRrenalnoseaclaro,seconsidera queladexmedetomidinaaumentaelflujosanguíneorenal y la filtración glomerular, reduciendo así la liberación de noradrenalina28.
Villela etal.29 relataronque laadministración de
dex-medetomidinaabajasdosisenperrosanestesiadosredujo laosmolaridadurinariayelnivelplasmáticodevasopresina ycausóladiuresisdeagualibre.Enpacientesquenotenían enfermedad renalpero que fueron sometidos a la cirugía torácica,al administrarunainfusión dedexmedetomidina Frumentoetal.30relataronunamejoríadelafunciónrenal,
inclusivedelflujourinarioydelafiltraciónglomerularenel períodopostoperatorio.
Uno de losmecanismosmás probablesde laacción de ladexmedetomidina esprotegerel ri˜nónal inhibirla res-puesta al estrés quirúrgico y prevenir la vasoconstricción mediadaporelsistemaadrenérgico31-34.Esemecanismode
accióntambiénpuede aumentarla vasodilatación arterial renalatravésdeefectos vascularesdirectos19.Existeuna
comunicacióndequePKCdesempe˜naunpapelimportante enelprecondicionamientoisquémicoyabreloscanalesde K+dependientesdeATPmitocondrialysarcolemáticoal
esti-mular las vías de transducción intracelular, induciendo a lasíntesis deproteínas celulares protectoras. Enun estu-diodelas vías alternativasde transduccióndesignos, los agonistasdelreceptoralfa-2Bhandemostradoestimularla actividad dePKC y laproducción de trifosfatodeinositol en células de túbulos colectores renales distales, lo que sugierequelosagonistasalfa-2imitanlaproteccióncelular mímicaporPCI35,36.Guetal.18investigaronelmecanismode
acción de la dexmedetomidina in vitro con el cultivo decélulashumanasestabilizadasdeltúbuloproximalrenal, privadasdeoxígenoyglucosa.Losinvestigadoresrelataron tantounaumentosignificativodelaexpresióndefosfo-Akt enuncultivodecélulastubularesdespuésdeltratamiento con dexmedetomidina, dependiente dela dosis, como un efectodeladrenorreceptoralfa-2.Lavíafosfo-Aktgarantiza laviabilidadcelularal inhibirlas vías deapoptosis intrín-secas controladaspor caspasa a travésde la fosforilación delaBcl-2 pro-apoptótica,loquedesencadena lamuerte celularyel aumentode las expresionesdeBcl-2 yBcl-XL antiapoptóticas.
El efecto neuroprotector de la dexmedetomidina fue relatado como siendo el resultado de un aumento de las expresionesdeBcl-2yMdm-2antiapoptóticas;eseaumento hasidoasociadoaunareduccióndelosnivelesdecaspasa-3 yBax37 proapoptóticas.LavíaAktesesencialparala
recu-peracióndeIRrenal.Enesteestudio,comounindicadorde apoptosis,secalculólainmunoreactividaddelacaspasa-3. Laactivacióndelacaspasa-3eselpasofinaldela apopto-sis,queescomúnalas2principalesvíasdeapoptosisyun indicadordefinitivodemuertecelular.Laadministraciónde dexmedetomidinamostródisminuirlainmunoreactividadde lacaspasa-3activa,peronodemodosignificativo(p=0,06) encomparaciónconlalesióndeIR.
Esa diferencia estadísticamente no significativa puede serexplicadaporelpeque˜nonúmerodesujetosdelestudio. El precondicionamiento isquémico es un métodoaplicado mecánicao farmacológicamente antes dela isquemiadel órganoobjeto parareducir el nivel posterior de la lesión de IR. El objetivo del precondicionamiento isquémico es aplicarla isquemiay lareperfusión deórganos objetoen cortos intervalos de tiempo, para garantizar que el(los) órgano(s) objeto(s) pueda(n) tolerar bien la isquemia. La grandemandadeenergíaylaintensaredmicrovascularde losri˜nonesloshacenvulnerablesa lalesióndeIR,quees consideradaunadelasprincipalescausasdelesiónrenalen laestenosisdearteriarenalycirugíamicrovascularrenal.La lesióndeIRrenaleslaprincipalcausademorbimortalidad cardiovascularyestáasociadacon elatraso delafunción delinjertopostrasplanteyconlaaparicióndelesiónrenal encirugíacardíacayaórticaytambiénconlalesiónrenal poschoque1-4,38,39.
Estudiostantoexperimentalescomoclínicosenla litera-turamuestranqueelPCIdeórganodistantepuedeproteger elri˜nón40,41.Similarmenteanuestroestudio,Weveretal.40
investigaron el efectodel precondicionamiento isquémico derecho(PCID) enla extremidadposterior enlalesiónde IRrenal. Encontraste, esosautores compararonelefecto delaadministraciónde PCID,continuamenteo periódica-mente,ytambiénenunao2extremidades.Aunquehayan realizado3ciclosdePCID,losinvestigadoresusaron perío-dos I/R de 4/4min e investigaron los eventuales efectos enel minuto25 deisquemia. Losautores relataronquela expresióndelamolécula-1,indicandolesiónrenalytubular renal,disminuyósignificativamenteenelgrupocon3ciclos deI/R.Además,esaprotecciónnoseasocióalaadenosina, unodeloselementos-claveenlalesióndeIR.Elmecanismo subyacentedelPCIDysusvíasdetransduccióntodavíano hansidocompletamenteelucidados.Ambasvíasdeorigen neuraly transmisoresbioquímicos pueden desempe˜narun papel enel mecanismo delPCID42. Esos mecanismos
pue-denvariar,dependiendodelórganoobjetoydelprotocolo deprecondicionamientoaplicado.Enlosmétodosde isque-miamiocárdica que usaronPCIDrenal, laexpresión dela proteínaNF-B seguida por la aberturade los canalesde
K+/ATPfueconsideradaimportante43.
Aunque la lesión de IR renal sea un problema clínico comúne importante,las estrategiasparareducirlalesión deIRsoninsuficientesyserequierennuevostratamientos. Enlaliteraturanoexisteninformessobrelaprotección far-macológicaymecánicaenlalesióndeIRrenalenratones.
Así,2métodosdiferentesfueronusadosenlaslesiones deIRrenalenratones:ladexmedetomidina,ampliamente relatadacomo eficaz, y el PCID, que demostró ser eficaz en algunos estudios11, fueron combinados y comparados.
víassimilares.Esos2métodosdeprotecciónpueden aumen-tarelefectounodelotro.
En nuestro estudio, usamos xilazina, un agente anes-tésicocon actividad alfa-2-agonista, y lacetamina42, que
sugirierontenerefectosnegativossobrelalesióndeIR.Las puntuacioneshistopatológicasylainmunoreactividaddela caspasa-3activa fueron normalesenel grupo Sham, indi-candoque la cetamina no tuvo un efecto negativo sobre nuestrosresultados.
Nosotros no mostramos el efecto aislado del PCID en laapoptosis, que desempe˜na unpapel fundamental enel mecanismodelalesióndeIR,loqueconstituyeuna limita-cióndelpresenteestudio.Otrosfactoreslimitantesfueron lanoevaluación delestrés oxidativo ydelos mediadores inflamatorios,quetambiénsonlosresponsablesdelalesión IRydelavíaneurogénica.
Conflicto
de
intereses
Losautoresdeclaranquenoexistenconflictosdeintereses.
Bibliografía
1.OjoAO,Wolfe RA,Held PJ,etal. Delayed graftfunction:risk fac-tors and implications for renal allograft survival. Transplantation. 1997;63:968---74.
2.PericoN,CattaneoD,SayeghMH,etal.Delayedgraftfunctioninkidney transplantation.Lancet.2004;364:1814---27.
3.OjoAO,HeldPJ,PortFK,etal.Chronicrenalfailureaftertransplantation ofanonrenalorgan.NEnglJMed.2003;349:931---40.
4.NigwekarSU,KandulaP,HixJK,etal.Off-pumpcoronaryarterybypass surgery andacutekidneyinjury:a meta-analysis ofrandomizedand observationalstudies.AmJKidneyDis.2009;54:413---23.
5.CollardCD,GelmanS.Pathophysiology,clinicalmanifestations,and pre-ventionofischemia-reperfusioninjury.Anesthesiology.2001;94:1133---8.
6.Tsutsui H, Sugiura T, Hayashi K, et al. Moxonidine prevents ischemia/reperfusion-induced renal injury in rats. Eur J Pharmacol. 2009;603:73---8.
7.YazıcıP,AlizadehsharghS,AkdoganG.Apoptosis:regulatory molecu-les,relationshipswithdiseasesandapoptosisdetectionmethods.Turkiye KlinikleriJMedSci.2009;29:1677---86.
8.FaubelS,EdelsteinCL.Caspasesasdrugtargetsinischemicorganinjury. ImmuneEndocrMetabolDisord.2005;5:269---87.
9.NoiriE,GailitJ,ShethD,etal.CyclicRGDpeptidesameliorateischemic acuterenalfailureinrats.KidneyInt.1994;46:1050---8.
10.FriedewaldJJ,RabbH.Inflammatorycellsinischemicacuterenal fai-lure.KidneyInt.2004;66:486---91.
11.TapuriaN,KumarY,HabibMM,etal.Remoteischemicpreconditioning: anovelprotectivemethodfromischemiareperfusioninjury----areview. JSurgRes.2008;150:304---30.
12.KanoriaS,JalanR,DaviesNA,etal.Remoteischaemicpreconditioning ofthehindlimbreducesexperimentalliverwarmischaemia-reperfusion injury.BrJSurg.2006;93:762---8.
13.DuruS,KocaU,OztekinS,etal.AntithrombinIIIpretreatmentreduces neutrophilrecruitmentintolungandskeletalmuscletissuesintherat modelofbilaterallowerlimbischaemiaandreperfusion:apilotstudy. ActaAnaesthesiolScand.2005;49:1142---8.
14.Feng L,Xiong Y, ChengF, etal. Effect of ligustrazine on ischemia-reperfusioninjuryinmurinekidney.TransplantProc.2004;36:1949---51.
15.ThadhaniR,PascualM,BonventreJV.Acuterenalfailure.NEnglJMed. 1996;334:1448---60.
16.BrezisM,RosenS,SilvaP,etal.Renalischemia:anewperspective. KidneyInt.1984;26:375---83.
17.CaronA,DesrosiersRR,BeliveauR.Kidneyischemiareperfusion regula-tesexpressionanddistributionoftubulinsubunits,beta-actinandrho GTPasesinproximaltubules.ArchBiochemBiophys.2004;431:31---46.
18.Gu J, Pamela S, Hailin Z, et al. Dexmedetomidine provides reno-protection against ischemia-reperfusion injury in mice. Crit Care. 2011;15:R153.
19.Koco˘gluH,OzturkH,OzturkH,etal.Effectof dexmedetomidineon ischemia-reperfusioninjuryinratkidney:ahistopathologicstudy.Ren Fail.2009;31:70---4.
20.WilliamsP,LopezH,BrittD,etal.Characterizationofrenal ischemia-reperfusioninjuryinrats.JPharmacolToxicolMethods.1997;37:1---7.
21.FujiiT,TakaokaM,MuraokaT,etal.Preventiveeffectofl-carnosineon ischemia/reperfusion-inducedacuterenalfailureinrats.EurJ Pharma-col.2003;474:261---7.
22.Hussein Ael-A, Shkeir AA, Sarhan ME, et al. Effects of combi-ned erythropoietin and epidermal growth factor on renal ischae-mia/reperfusioninjury: arandomizedexperimental controlledstudy. BJUInt.2011;107:323---8.
23.JaeschkeH,FarhoodA.Kupffercellactivationafterno-flowischemia versushemorrhagicshock.FreeRadicBiolMed.2002;33:210---9.
24.SandersRD,MazeM.Alpha2-adrenoceptoragonists.CurrOpinInvestig Drugs.2007;8:25---33.
25.BillingsFT,ChenSW,KimM,etal.Alpha2-adrenergicagonistsprotect againstradiocantrast-inducednephropathyinmice.AmJPhysiolRenal Physiol.2008;295:741---8.
26.MaD,HossainM,RajakumaraswamyN,etal.Dexmedetomidineproduces itsneuroprotectiveeffectviathealpha2A-adrenoceptorsubtype.EurJ Pharmacol.2004;502:87---97.
27.KuhmonenJ,PokornyJ,MiettinenR,etal.Neuroprotectiveeffectsof dexmedetomidineinthegerbilhippocampusaftertransientglobal ische-mia.Anesthesiology.1997;87:371---7.
28.TaodaM,AdachiYU,UchihashiY,etal.Effectofdexmedetomidineon thereleaseof[3H]-noradrenalinefromratkidneycortexslices: charac-terizationofalpha2-adrenoceptor.NeurochemInt.2001;38:317---22.
29.VillelaNR,NascimentoPVN,CarvalhoLR.Effectsofdexmedetomidine onrenalsystemandonvasopressinplasmalevels.Experimentalstudyin dogs.RevBrasAnestesiol.2005;55:429---40.
30.FrumentoRJ,LogginidouHG,WahlanderS,etal.Dexmedetomidine infu-sionisassociatedwithenhancedrenalfunctionafterthoracicsurgery.J ClinAnesth.2006;18:422---6.
31.KulkaPJ,TrybaM,ZenzM.Preoperativealpha2-adrenergicreceptor ago-nistspreventthedeteriorationofrenalfunctionaftercardiacsurgery: resultsofarandomized,controlledtrial.CritCareMed.1996;24:947---52.
32.Helbo-Hansen S, Fletcher R, Lundberg D, et al. Clonidine and the sympatico-adrenalresponsetocoronary arteryby-passsurgery.Acta AnaesthesiolScand.1986;30:235---42.
33.KulkaPJ,TrybaM,ZenzM.Dose-responseeffectsofintravenous cloni-dineonstressresponseduringinductionofanesthesiaincoronaryartery bypassgraftpatients.AnesthAnalg.1995;80:263---8.
34.Flacke JW, Bloor BC, Flacke WE, et al. Reduced narcotic requi-rement by clonidine with improved hemodynamic and adrenergic stabilityinpatientsundergoingcoronarybypasssurgery.Anesthesiology. 1987;67:11---9.
35.GesekFA.Alpha2-adrenergicreceptorsactivatephospholipaseCinrenal epithelialcells.MolPharmacol.1996;50:407---14.
36.O’RourkeB.EvidenceformitochondrialK+channelsandtheirrolein cardioprotection.CircRes.2004;94:420---32.
37.EngelhardK,WernerC,EberspacherE,etal.Theeffectofthealpha 2-agonistdexmedetomidine and theN-methyl-d-aspartate antagonist S(+)-ketamineontheexpressionofapoptosis-regulatingproteinsafter incompletecerebralischemiaand reperfusioninrats.AnesthAnalg. 2003;96:524---31.
38.Safian RD, Textor SC. Renal-artery stenosis. N Engl J Med. 2001;344:431---42.
39.SchrierRW, WangW.Acute renalfailure andsepsis. NEnglJ Med. 2004;351:159---69.
40.WeverKE, Menting TP,Rovers M, etal. Ischemicpreconditioning in theanimalkidney,asystematicreviewandmeta-analysis.PLoSONE. 2012;7:e32296.
41.VenugopalV,LaingCM,LudmanA,etal.Effectofremoteischemic pre-conditioningonacutekidneyinjuryinnondiabeticpatientsundergoing coronaryarterybypassgraftsurgery:asecondaryanalysisof2small randomizedtrials.AmJKidneyDis.2010;56:1043---9.
42.CurtisFG,ViannaPT,VieroRM.DexmedetomidineandS(+)-ketamine inischemiaand reperfusion injury intheratkidney. ActaCir Bras. 2011;26:202---6.