UNIVERSIDADE DE SÃO PAULO
FACULDADE DE CIÊNCIAS FARMACÊUTICAS
Programa de Pós-Graduação em Farmácia
Área de Análises Clínicas
Mecanismos celulares e moleculares de ação dos glicocorticóides
endógenos sobre a mobilização de neutrófilos
Danielle Maia de Holanda Cavalcanti
Tese para obtenção do grau de DOUTOR
Orientadora:
Profa. Dra. Sandra Helena Poliselli Farsky
Danielle Maia de Holanda Cavalcanti
Mecanismos celulares e moleculares de ação dos glicocorticóides
endógenos sobre a mobilização de neutrófilos
Comissão Julgadora da
Tese para obtenção do grau de Doutor
Profa. Dra. Sandra Helena Poliselli Farsky orientadora/presidente
____________________________ 1o. examinador
____________________________ 2o. examinador
____________________________ 3o. examinador
____________________________ 4o. examinador
!
" #
"
$
"
$
# %
"
!&
"
#
"
$
!&
" "
DEDICATÓRIA
(
! ###
)
*
+
",' -
*
.
/ $
"
0
$1
$ 2
$
# %
"
"
"
3 )
3
)
$
+
4
"
"
###
)
5
!
* !
$
"
6 "
# 5
"
!
2
"
7
"
"
# 8
$
7
9
#
3
)
:7
* !
$
6
AGRADECIMENTOS ESPECIAIS
)
)
!
$
6
"
"
# %
# %
$
$
3
;
<
$
"
! =
)
*
*
>
!
?
)
" 0
333
)
)
!
@
#
AB $
0
#
7
!
C
"
3 @
!
!
$
7"
# (
$
6
$
#
7
"
#
AGRADECIMENTOS
)
"
"
# )
$
3
) @
# ( # *
@
D
E " B >
;
+
7
!
2
$
# F
0
$
"
#
)
( # @
"
G
( #>
@ A
* A
( #H
( # 5
+
( # ,
8
( #4
*
( # )
*
"
( #
4 A
( #
> A
$
2
!
#
) F "
@
5 0
0
!
7
! #
)
)
5
"
#
)
4
)
(
(
7
!
"
!
$
#
)
7
(
) 7
5 2
= +
( " E
>
I
:
#
)
$
J
$
$
= 5
E
*
@
) 2
E 7
5
( L
>
(
)
>
)
+
5
)
:
D
@
:
G
@
5
#
*
$
6
3
)
!
@
: 6
@
2
"
+
"
#
)
$
4
(
:
-
@
A 5
*
)
E
>
5
+
>
@
+
)
6
6
$
#
)
*
G B
0
7
2
! #
) *7
>
2
"
" "
#
)
$
-
@
(
!
>
( (
4
K
)
5 2
5
+
:
#
) )@
@
5)@
$
RESUMO
CAVALCANTI, D. Mecanismos celulares e moleculares de ação dos glicocorticóides endógenos sobre a mobilização de neutrófilos. 2010. 167f. Tese (Doutorado)- Faculdade de Ciências Farmacêuticas- Universidade de São Paulo, São Paulo
Temos mostrado que os glicocorticóides endógenos (GE) modulam o rolling e
a aderência de neutrófilos in vivo, mediando a expressão de moléculas de adesão
no leucócito e no endotélio. Adicionalmente, os GE controlam a maturação neutrofílica na medula e a sua mobilização para o sangue periférico. O presente trabalho visou investigar os mecanismos moleculares e celulares envolvidos na modulação exercida pelos GE neste processo.
Utilizando ratos Wistar submetidos à adrenalectomia bilateral, tratados com RU 38486 ou controles (falso-operados, tratados com veículo ou não manipulados), foi demonstrado que: 1) os GE controlam, negativamente, a expressão de L-selectina em neutrófilos circulantes e ICAM-1, VCAM-1, PECAM-1, VAP-1 na célula endotelial e, positivamente, a expressão de L-selectina em granulócitos da medula óssea via seu receptor citosólico (GCR); 2) o mecanismo envolvido no controle dos GE sobre a expressão de L-selectina é independente de ação sobre sua expressão gênica ou da atividade de NFκB, mas dependente da expressão de anexina-A1,
como verificado em camundongos knockouts (KO) para esta proteína 3) o controle
da expressão de moléculas de adesão endotelial é dependente de ações sobre a expressão gênica, via translocação nuclear do NFκB; 4) a neutrofilia detectada em
animais adrenalectomizados (ADR) é mediada pelo GCR, e dependente de anexina-A1; 5) a neutrofilia parece ser dependente da ação da anexina-A1 sobre a secreção de SDF-1 na medula óssea e expressão de CXCR-4 em neutrófilos circulantes e da medula; 6) concentrações circulantes elevadas de GE induzidas pela administração de ACTH confirmaram o controle dos GE, via anexina A-1, sobre o tráfego de neutrófilos da medula óssea para o sangue, mas sugerem um controle diferencial dos GE e anexina A-1 sobre a expressão de L-selectina em células da medula e do sangue circulante.
Estes dados mostram mecanismos inéditos do controle dos GE sobre o tráfego de neutrófilos, que diferem em cada microambiente e tipo celular envolvido neste complexo fenômeno.
ABSTRACT
CAVALCANTI, D. Cellular and molecular mechanisms of action of endogenous glucocorticoids on the neutrophil mobilization. 167f. Tese (Doutorado)- Faculdade de Ciências Farmacêuticas- Universidade de São Paulo, São Paulo
We have shown that endogenous glucocorticoids (GE) modulate the rolling and adhesion of neutrophils in vivo, mediating the expression of adhesion molecules
on leukocytes and the endothelium. Additionally, the GE control neutrophil maturation in bone marrow and mobilization to peripheral blood. This work aimed to investigate the molecular and cellular mechanisms involved in the modulation exerted by GE in this process.
Using male Wistar rats, submitted to bilateral adrenalectomy, treatment with RU 38 486 or controls (sham operated, vehicle or non manipulated), it was shown that: 1) GE control, negatively, L-selectin expression on circulating neutrophils and ICAM-1, VCAM-1, PECAM-1, VAP-1 on endothelial cell and, positively, L-selectin expression on bone marrow granulocytes via their cytosolic receptor (GCR); 2) the mechanism involved in the control of GE on the L-selectin expression is independent of its action on gene expression or NFκB activity, but dependent on the expression of
anexina-A1, as observed in mice knockouts for this protein; 3) the control of
endothelial adhesion molecules is dependent on gene expression, via NFκB
translocation; 4) the neutrophilia detected in adrenalectomized animals (ADR) is mediated by GCR, and dependent on anexina-A1; 5) the neutrophilia seems to be dependent on the action of annexin A-1 on SDF-1 secretion in bone marrow and expression of CXCR-4 in peripheral blood and bone marrow; 6) high circulating concentrations of GE induced by administration of ACTH confirmed the control of GE, via the annexin-1, on the traffic of neutrophils from the bone marrow to the blood, but suggest a differential control of GE and annexin A-1 on the L-selectin expression in the bone marrow and circulating blood.
These data indicate unpublished mechanisms of control of GE on the traffic of neutrophils, which differ in each microenvironment and cell type involved in this complex phenomenon.
LISTA DE ABREVIATURAS
ACTH Adrenocorticotropic hormone
ADR Adrenalectomizados
ANOVA Análise de variância ANXA-1 Anexina A-1
AP-1 Activator protein 1
ATP Adhenosine triphosphate BSA Bovine serum albumine CAMs Cell adhesion molecules
cDNA Complementary DNA
COBEA Colégio Brasileiro de Experimentação Animal CRH Corticotrophin-releasing hormone
DAB Dietilaminobenzidina
DMEM Dulbecco's Modified Eagle Medium DNA Deoxyribonucleic acid
DTT Dithiothreitol
EDTA Ethylenediamine tetraacetic acid EGF Epidermal growth factor
FITC Fluorescein isothiocyanate fMLP formil-Metil-Leucil-Fenilalanina
FO Falso operados
FPR2 Formyl peptide receptor 2
GAPDH Glyceraldehyde 3-phosphate dehydrogenase GCR Glucocorticoid cytosolic receptor
GCs Glicocorticóides
G-CSF Granulocyte-colony stimulating factor GDP Guanosine diphosphate
GE Glicocorticóides endógenos
GM-CSF Granulocyte-macrophage colony stimulating factor GREs Glucocorticoid-responsive elements
HRP Horseradish peroxidase hsp heat-shock proteins IκB Inhibitor of NFκB
ICAM-1 Intercellular adhesion molecule- 1
IgG Imunoglobulina G
IL Interleucina
INF-γ Interferon-gamma
i.p Intraperitoneal
IRF-3 Interferon regulatory factor-3 JAMs Junctional adhesion molecules KCl Cloreto de potássio
KH2PO4 di-Hidrogenofosfato de Potássio Monobásico
KO Knockout
LAD Leukocyte Adhesion Deficiency LFA-1 Lymphocyte function associated -1 LPS Lipopolissacarídeo
Mac-1 Macrophage antigen -1
MAO Monoamino-oxidase
MAPK Mitogen-activated protein kinase
MFI Mediana da Intensidade de fluorescência MgCl2 Cloreto de magnésio
MIP-2 Macrophage inflammatory protein-2
M-MLV-RT Moloney Murine Leukemia Virus Reverse Transcriptase MMP-9 Matrix metallopeptidase-9
mRNA Messenger ribonucleic acid Na2HPO4 Fosfato dissódico
NaCl Cloreto de sódio NaH2PO4 Fosfato de sódio
NFκB Nuclear factor-kappa B
NM Não manipulados cirurgicamente PBS Phosphate buffered saline
PE Phicoeritrina
PI Iodeto de propídeo
PMA Phorbol myristate acetate PSGL-1 P-selectin glycoprotein ligand-1
RT-PCR Reverse transcription-polymerase chain reaction SDF-1 Stromal derived factor-1 alpha
sLeX Sialil Lewis (tetrassacarídeo)
SSAO Semicarbazide-sensitive amine oxidase TACE TNF-alpha converting enzyme
TBE Tris/Borate/EDTA buffer TCR T-cell receptor
TNF- Tumor necrosis factor-alpha VAP-1 Vascular adhesion protein-1 VCAM-1 Vascular cell adhesion molecule-1 VLA-4 Very late antigen-4
ÍNDICE DE FIGURAS
Figura 1. Representação esquemática dos mecanismos genômicos de
ação dos glicocorticóides (GCs). 25
Figura 2. Representação esquemática dos mecanismos de ação não
genômicos dos glicocorticóides (GCs). 26 Figura 3. Representação esquemática da cascata do recrutamento
leucocitário. 33
Figura 4. Representação esquemática de mobilização da anexina A-1
em células ativadas e seu mecanismo de ação. 43 Figura 5. Expressão de 2 integrina na membrana de células da medula
óssea. 62
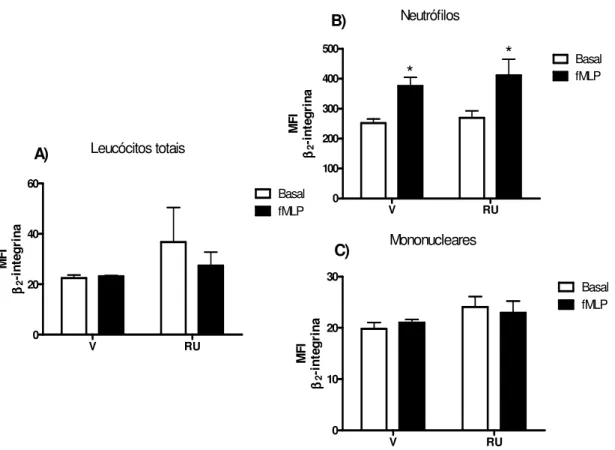
Figura 6. Expressão de 2 integrina nos leucócitos do compartimento
periférico. 63
Figura 7. Expressão de L-selectina na membrana de células da medula
óssea. 64
Figura 8. Expressão de L-selectina em leucócitos do compartimento
periférico. 65
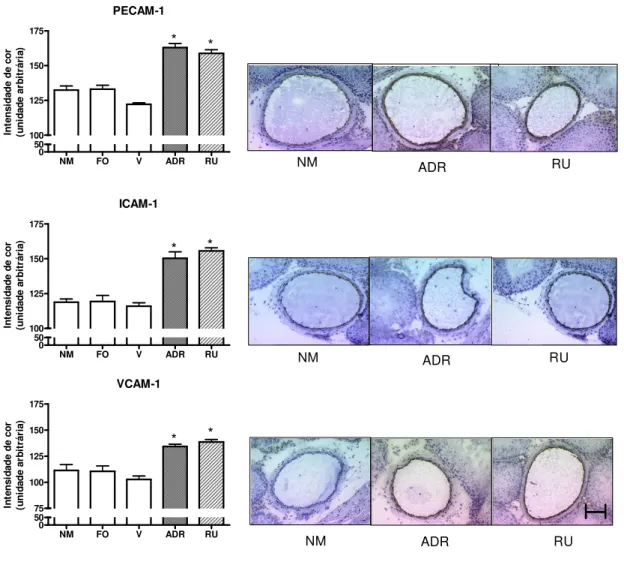
Figura 9. Expressão de PECAM-1, ICAM-1 e VCAM-1 na membrana da
célula endotelial. 67
Figura 10. Expressão de E-selectina e P-selectina na membrana da
célula endotelial. 68
Figura 11. Expressão da VAP-1 nos sinusóides hepáticos em condições
basais. 69
Figura 12. Expressão da VAP-1 nos vasos do músculo cremaster em
condições basais. 70
Figura 13. Atividade da VAP-1 no fígado e no músculo cremaster 71 Figura 14. RNAm de L-selectina em granulócitos da medula óssea e em
neutrófilos circulantes. 73
Figura 15. Translocação nuclear de NFκB em neutrófilos periféricos. 73
Figura 16. Expressão de L-selectina na membrana de granulócitos da
maturação da medula óssea. 76 Figura 18. Expressão de anexina A-1 nos neutrófilos do sangue
periférico. 77
Figura 19. Expressão gênica de moléculas de adesão endotelial. 79 Figura 20. Translocação nuclear de NFκB em células endoteliais. 80
Figura 21. Etapas de maturação de granulócitos na medula óssea. 82 Figura 22. Número total e diferencial de leucócitos do compartimento
periférico. 83
Figura 23. Número de granulócitos nos compartimentos medular e
periférico. 84
Figura 24. Percentual de neutrófilos circulantes em apoptose e necrose. 85 Figura 25. Quantificação de SDF-1α na medula óssea. 87
Figura 26. Expressão de CXCR4 na membrana de granulócitos da
medula óssea. 87
Figura 27. Expressão de CXCR4 na membrana de neutrófilos do sangue. 88 Figura 28. Concentração plasmática de corticosterona. 89 Figura 29. Número de granulócitos na medula óssea e no sangue
circulante. 91
Figura 30. Expressão de L-selectina na membrana de granulócitos da
medula óssea e do sangue circulante. 93 Figura 31. Número de granulócitos nos compartimentos medular e
periférico. 95
Figura 32. Expressão de L-selectina na membrana de granulócitos da
ÍNDICE DE TABELA
SUMÁRIO
1. INTRODUÇÃO... 20
1.1 Glicocorticóides... 20
1.1.1 Mecanismo clássico de ação molecular dos GCs... 21
1.1.2 Mecanismos de ação não genômicos dos GCs... 23
1.2 Recrutamento leucocitário... 26
1.2.1 Diferenciação e mobilização de granulócitos na medula óssea... 26
1.2.2 Interação leucócito-endotélio... 30
1.3 Controle dos glicocorticóides endógenos (GE) sobre a migração celular... 40
1.4 Anexina A-1... 42
2. OBJETIVOS... 46
3. MATERIAIS E MÉTODOS... 48
3.1 Delineamento experimental... 48
3.2 Animais... 49
3.3 Procedimentos cirúrgicos... 49
3.4 Tratamentos farmacológicos... 49
3.4.1 RU 38486... 49
3.4.2 ACTH... 50
3.5 Agente indutor de resposta inflamatória... 50
3.6 Hematopoiese... 50
3.6.1 Determinação do número de leucócitos circulantes... 50
3.6.2 Determinação do número de leucócitos na medula óssea... 51
3.7 Imunohistoquímica... 51
3.8 Atividade enzimática da VAP-1... 52
3.9 Cultura primária de células endoteliais... 53
3.10 RT-PCR... 54
3.11 Translocação de NFκB... 55
3.11.1 Obtenção do extrato nuclear... 55
3.11.2 Ensaio de eletromobilidade em gel... 56
3.12 Imunohistoquímica LR GOLD... 56
3.14 Ensaio imunoenzimático ELISA... 58 3.15 Análise estatística... 59 4. RESULTADOS... 61
4.1 Mecanismos moleculares dos glicocorticóides endógenos (GE) na expressão de moléculas de adesão... 61
4.1.1 Participação do receptor citosólico na expressão de L-selectina e β2integrina na membrana de leucócitos... 61
4.1.2 Participação do receptor citosólico na expressão de moléculas de adesão endoteliais... 66
4.1.3 Expressão gênica e translocação nuclear de L-selectina em granulócitos da medula e do sangue circulante... 72
4.1.4 Participação da anexina A-1 nos mecanismos de ação dos GE... 74
4.1.5 Expressão gênica de PECAM-1, ICAM-1 e VCAM-1 e translocação nuclear de NFκB na célula endotelial... 78
4.2 Mecanismos envolvidos na mobilização de neutrófilos para o sangue periférico... 81
4.2.1 Participação do receptor citosólico na ação dos GE sobre a produção/maturação de leucócitos na medula óssea e sobre o número de leucócitos circulantes... 81
4.2.2 Participação da anexina A-1 na ação dos GE sobre a produção/maturação de leucócitos na medula óssea e sobre o número de leucócitos circulantes... 81
4.2.3 Papel dos GE sobre apoptose e necrose de neutrófilos periféricos... 85
4.2.4 Participação do eixo SDF-1 /CXCR4 no controle da mobilização de neutrófilos da medula para o sangue e sobre o número de neutrófilos circulantes... 86
4.3 Efeito do ACTH ou dos níveis elevados de glicocorticóides endógenos sobre o recrutamento de neutrófilos da medula para o sangue e sobre a expressão de L-selectina... 89
4.3.2 Efeito do ACTH ou dos níveis elevados de GE sobre o
número de granulócitos na medula e no sangue circulante... 90
4.3.3 Efeito do ACTH ou dos níveis elevados de GE sobre a expressão de L-selectina na membrana de granulócitos da medula e neutrófilos do sangue circulante... 92
4.3.4 Efeitos do tratamento com ACTH sobre o número de granulócitos da medula óssea e neutrófilos da circulação em animais deficientes de anexina A-1... 94
4.3.5 Efeitos do tratamento com ACTH sobre a expressão de L-selectina em granulócitos da medula óssea e neutrófilos da circulação em animais deficientes de anexina A-1... 95
5. DISCUSSÃO... 98
6. CONCLUSÃO... 111
7. REFERÊNCIAS BIBLIOGRÁFICAS... 113
ANEXO A- Certificado do Comitê de Ética Experimental... 131
ANEXO B- Informações para os Membros de Bancas Julgadoras de Mestrado/Doutorado... 132 Histórico do Aluno
20 ___________________________________________________________________________
1. INTRODUÇÃO
1.1 Glicocorticóides
Os glicocorticóides (GCs) têm sido amplamente prescritos nos tratamentos de doenças de origens inflamatórias como artrite reumatóide, asma e polimialgia reumática (WALSH et al., 1996; BUTTGEREIT et al., 2004; THIELE et al., 2005).
São clinicamente relevantes pelos seus efeitos imunossupressores, antiinflamatórios e antialérgicos sobre células do sistema imune, tecidos e órgãos (BUTTGEREIT et al., 2005). No entanto, o tratamento com altas doses de GCs ou por um longo
período de tempo, causa reações adversas como os efeitos indesejáveis sobre o metabolismo (diabetes), tecido ósseo (osteoporose), músculos (miopatias), olhos e pele (SCHACKE et al., 2002; 2004; ADCOCK & LANE, 2003; WIKSTROM, 2003).
O uso terapêutico dos GCs provém de estudos que mostraram a importância dos GCs secretados pelas glândulas adrenais na homeostasia. Destes trabalhos surgiu o conceito de ativação do eixo hipotálamo-hipófise-adrenal na vigência de estresse de diferentes origens. No que confere à resposta inflamatória, é conhecido que mediadores inflamatórios secretados localmente no processo, entre os quais interleucinas (IL-1, IL-2, IL-6), interferon-γ (INF-γ) e tumor necrosis factor-α (TNFα),
alcançam a circulação sanguínea e estimulam centros específicos no hipotálamo e na hipófise que induzem, respectivamente, a secreção de corticotrophin-releasing hormone (CRH) e adrenocorticotropic hormone (ACTH) (BUMILLER et al.,1999;
SAFIEH-GARABEDIAN et al., 2002a,b). As células do córtex adrenal estimuladas
pelo ACTH secretam GCs, que entre outros efeitos, atuarão como moduladores endógenos do processo (LEME & SCHAPOVAL, 1975; TILDERS et al., 1994;
HADDAD et al., 2002). Ainda, alguns mediadores podem estimular diretamente as
células adrenais provocando a secreção hormonal (HADDAD et al., 2002).
21 ___________________________________________________________________________
Neste contexto, tem sido mostrado pelo nosso grupo que os hormônios secretados pela glândula modulam o tráfico de neutrófilos em condições fisiológicas e de inflamação. A compreensão destes mecanismos contribui para o entendimento das bases fisiopatológicas de diferentes processos que envolvem a capacidade de neutrófilos se locomoverem entre os diferentes compartimentos do organismo.
1.1.1 Mecanismo clássico de ação molecular dos GCs
A maioria dos efeitos antiinflamatórios dos GCs é desencadeada pela ação genômica, que leva a uma regulação positiva ou negativa da síntese de proteínas participativas do processo. O mecanismo molecular de ação inicia-se com a interação dos esteróides com o receptor intracelular localizado no citoplasma de inúmeras células. O receptor de GCs (GCR-glucocorticoid cytosolic receptor), um membro da família dos receptores de hormônios esteróides, no seu estado inativo é um complexo de multi proteínas, contendo diversas proteínas do tipo heat-shock (Hsp), como Hsp 90, Hsp70, Hsp56 e Hsp40. Existe também uma interação com
imunofilinas, proteínas chaperonas (como p23 e Src) e diversas quinases (MAPK-- Mitogen-activated protein kinase) sinalizando o sistema (STAHN, 2007). O GCR consiste de três domínios diferentes com várias funções: um domínio N-terminal contendo funções de transativação, um domínio ligado ao DNA e um domínio carboxi-terminal responsável pela ligação ao hormônio (LU & CIDLOWSKI, 2004). Em 1985, dois cDNAs originários do mesmo gene foram clonados para o receptor de GCs, e estes geram os receptores α e β (HOLLENBERG et al.,1985). O receptor α
difere do β somente na porção carboxi terminal. Devido a esta diferença, o receptor β é incapaz de ligar-se aos hormônios. Desta forma, têm se atribuído que o receptor α, isoforma predominante do receptor, é o responsável pelas ações genômicas dos
GCs, e que a expressão exacerbada do receptor β está associada à resistência
hormonal detectada em pacientes e em algumas espécies animais (LEUNG & BLOOM, 2003; PUJOULS et al., 2003).
22 ___________________________________________________________________________
translocado para o núcleo, onde se liga a seqüências específicas do DNA, denominadas GREs (glucocorticoid-responsive elements) (ALMAWI & MELEMEDJIAN, 2002). A ligação do hormônio-receptor aos GREs positivos resulta na indução de síntese de proteínas anti-inflamatórias (ex. IL-10, anexina A-1 e IκB),
mas também proteínas regulatórias importantes para o metabolismo (ex. enzimas envolvidas na gliconeogênese). Este processo, o qual é mediado pelos GREs positivos, é denominado de “transativação” e é um dos responsáveis pelos numerosos efeitos dos GCs (Figura 1, mecanismo I) (SCHÄCKE et al., 2002). A
transcrição de genes pode ser inibida por GCs pela interação direta dentre GCR e GREs negativo (SAKAI et al., 1988). Nesse contexto, tem sido mostrado que os GCs
inibem a transcrição de genes inflamatórios, incluindo interleucina IL-1 e IL-2 (BEATO, 1989; STAHN, 2007) (Figura 1, mecanismo II). No entanto, o exato papel dos GREs negativos na mediação dos efeitos dos GCs não está bem esclarecido. Adicionalmente, outro mecanismo molecular denominado “transrepressão” vem sendo amplamente descrito na literatura. Monômeros do complexo GC/GCR interagem direta ou indiretamente com fatores de transcrição, como AP-1 (activator protein 1), NF-κB (nuclear factor-κB) ou IRF-3 (interferon regulatory factor 3), que
estão envolvidos na regulação da expressão de genes pró-inflamatórios (Figura 1, mecanismo III). A regulação negativa do complexo GC/GCR resulta na redução de atividade transcripcional destes genes (NISSEN & YAMAMOTO, 2000; DE BOSSCHER et al., 2003; SONG et al., 2005). Neste contexto, os GCs inibem a
translocação nuclear e a função de fatores de transcrição suprimindo a síntese de mediadores inflamatórios, incluindo citocinas (IL-1, IL-2, TNF-α, INF-γ) e
prostaglandinas. Alguns mecanismos são sugeridos para esta transrepressão: 1) prevenção da ligação do fator de transcrição a seqüências específicas de DNA através da interação direta proteína-proteína; 2) indução da síntese de IκB, um
inibidor de NF-κB, causado pela interação entre GRE e o complexo GC/GCR; 3)
23 ___________________________________________________________________________
1.1.2 Mecanismos de ação não genômicos dos GCs
Alguns dos efeitos dos GCs são observados após um curto período de tempo e não podem ser explicados pelos mecanismos genômicos. Existe um período de latência entre a ligação do agonista e os efeitos dos GCs no mecanismo genômico, porque dependem da translocação do receptor ativado para o núcleo da célula, seguido da regulação da expressão gênica e síntese de proteínas reguladoras específicas. Por outro lado, os GCs também induzem efeitos rápidos, que ocorrem dentro de minutos após sua aplicação, conhecidos como não genômicos (LÖSEL & WEHLING, 2003). Existem evidências clínicas que comprovam a existência deste rápido efeito dos GCs. Alguns processos, como reações anafiláticas que podem ser rapidamente revertidos por altas doses de GCs, e injeções intra-articulares de GCs, em casos de doenças reumáticas, são exemplos desta ação rápida. Têm sido propostos três mecanismos de ação não genômicos: 1) interações não específicas dos GCs com membranas celulares; 2) efeitos não genômicos mediados pelo receptor citoplasmático (GCR) e 3) interações específicas com o receptor de membrana (mGCR) (LÖWENBERG et al., 2008; BOLDIZSAR et al., 2009).
O primeiro mecanismo proposto mostra que altas concentrações de GCs intercalam nas membranas, plasmática e mitocondrial, promovendo mudanças em suas propriedades físico-químicas ou atividades das proteínas associadas à membrana. Isto resulta em redução de cálcio e sódio através de membranas plasmáticas de células imunes, contribuindo para rápida imunossupressão e subseqüente redução do processo inflamatório (BUTTGEREIT & SCHEFFOLD, 2002). Estes efeitos são causados por ações diretas nas membranas, como redução na produção de ATP (adenosine triphosphate) (SONG et al., 2005) (Figura 2,
mecanismo I).
O segundo mecanismo (Figura 2, mecanismo II) não genômico proposto é a interação dos GCs com receptores de membranas (LÖWENBERG et al., 2008). A
existência do receptor foi mostrada primeiramente em membranas neuronais de anfíbios e em células de linfoma (GAMETCHU et al., 1999). Um estudo mais recente
24 ___________________________________________________________________________
Lupus Eritematoso apresentaram aumento significativo no número de células positivas para mGCR (SPIES et al., 2006). Estes resultados, em conjunto,
demonstram que o receptor de membrana (mGCR) exerce um papel importante na patogênese de doenças inflamatórias crônicas. Estudos recentes têm mostrado um papel regulador dos receptores de membrana de GCs sobre a sinalização induzida pela ação de agonistas aos receptores de células T (TCR), (LÖWENBERG et al.,
2005; 2006). Estas observações não só revelaram a existência de receptores de membrana de GCs em células T, mas também o papel funcional desses receptores. Lck e Fyn quinases foram identificadas como alvos das atividades não genômicas. Estas são membros da família das tirosinas quinases Scr, expressas em células T, que estão envolvidas na transdução de sinais mediada por TCR (T Cell Receptor) (ALLISON & HAVRAN, 1991; PALÁCIOS & WEISS, 2004). A perfeita associação destas quinases ao receptor TCR é essencial para a sinalização de células T (KANAZAWA et al.,1996). Estimulações in vitro usando glicocorticóide sintético
revelaram a inibição da sinalização através do TCR, visualizada pela supressão da fosforilação de moléculas da cascata das MAPKs (Mitogen-activated protein kinases) (LÖWENBERG et al., 2005). As atividades enzimáticas de Lck e Fyn foram inibidas
em indivíduos saudáveis tratados com prednisolona (LÖWENBERG et al., 2005).
O terceiro mecanismo sugerido para explicar os efeitos não genômicos dos GCs envolve o complexo GC/cGCR citoplasmático (Figura 2, mecanismo III). Como mencionado anteriormente, o receptor não ligado ao hormônio encontra-se no citoplasma como um complexo de multiproteínas (“heat-schoks” e quinases). Após a ligação do GC ao receptor, moléculas sinalizadoras se dissociam do complexo e são liberadas no citoplasma, tal como Scr, sendo consideradas responsáveis pelos rápidos efeitos dos GCs (CROXTALL et al., 2000; STAHN et al.,2007).
Do exposto acima, fica evidente que os mecanismos moleculares das ações antiinflamatórias dos glicocorticóides ainda não estão bem estabelecidos. Tem sido recentemente corroborado as observações que os mecanismos dos GCs, dependem, de alguma maneira, das concentrações dos hormônios na célula alvo.
25 ___________________________________________________________________________
Mecanismos genômicos
Mecanismos Genômicos
Figura 1- Representação esquemática dos mecanismos genômicos de ação dos glicocorticóides (GCs). O complexo ativado receptor/glicocorticóide transloca para dentro do núcleo, onde induz ou inibe a transcrição gênica. (I) Indução da síntese de proteínas anti-inflamatórias pela ligação do complexo aos GREs (glucocorticoid elements responsive) positivos; (II) inibição da transcrição de genes inflamatórios via os GREs negativos; (III) transrepressão através da interação direta ou indireta com fatores de transcrição; (IV) competição pelos co-ativadores entre o complexo GC/cGCR e fatores de transcrição (Figura adaptada de Buttgereit et al.,
26 ___________________________________________________________________________
Mecanismos não genômicos
Figura 2- Representação esquemática dos mecanismos de ação não genômicos dos glicocorticóides (GCs). (I) Interação direta em membranas celulares; (II) Interação com receptor de membrana (mGCR); (III) mecanismo mediado pela liberação das moléculas sinalizadoras após a ativação do receptor citosólico (cGCR). (Figura adaptada de Buttgereit et al., 2004 e revisada por Stahn et al., 2007)
1.2 Recrutamento leucocitário
1.2.1 Diferenciação e mobilização de granulócitos na medula óssea
27 ___________________________________________________________________________
rapidamente eliminados no tempo de meia vida de 6 a 8hs. Em condições de estresse, como infecção, neutrófilos periféricos podem aumentar significativamente. Esta resposta é mediada pelo aumento na granulopoiese e da liberação de neutrófilos na circulação (STARCKX et al., 2002; LINK, 2005).
A diferenciação granulocítica de células progenitoras hematopoiéticas é regulada por uma expressão coordenada de um número de fatores de transcrição mielóides, incluindo PU.1 e C/EBP (ROSMARIN et al., 2005). A manutenção da
produção de neutrófilos é dependente de um balanço entre a diferenciação e proliferação. Alguns sinais extracelulares são necessários para uma normal granulopoiese, dentre eles as citocinas têm papéis fundamentais neste processo. A principal citocina reguladora da granulopoiese é G-CSF (granulocyte-colony stimulating factor), amplamente usada na clínica para prevenir a neutropenia, estimula a granulopoiese em diferentes estágios de diferenciação (CHRISTOPHER & LINK, 2007). Além desta citocina, IL-3, GM-CSF (granulocyte-macrophage colony stimulating factor) e IL-6 também apresentam papel na estimulação da granulopoiese (METCALF et al., 1986, 1987; PODJA & TSUBOI, 1990).
A liberação de neutrófilos da medula óssea para a circulação contribui para a manutenção da homeostasia e é um processo amplamente regulado. Na medula, a hematopoiese é restrita ao espaço extravascular e as células brancas migram pela barreira vascular, composta de células endoteliais, membrana basal e células adventícias, que separa o compartimento hematopoiético da circulação (YODER & WILLIAMS, 1995). Um grupo de mediadores químicos induz a liberação das células para a circulação, dentre eles citocinas, quimiocinas, leucotrienos, produtos de bactérias entres outros, que diferem em condições fisiológicas e patológicas (STARCKX et al., 2002). Além desses, moléculas de adesão, como integrinas e
28 ___________________________________________________________________________
medula (CHRISTOPHER & LINK, 2007). Corroborando estes dados, camundongos deficientes de 2 integrina apresentaram neutrofilia (FORLOW et al., 2001) e
camundongos deficientes de L-selectina apresentaram retenção e liberação normais de células da medula óssea (ROBINSON et al., 1999).
Outro sistema recentemente investigado na retenção de células na medula óssea é o eixo SDF-1 /CXCR4. Stromal derived factor-1 alpha (SDF-1 ) é uma quimiocina produzida por células estromais da medula óssea (AIUTI et al., 1997). O
principal receptor para essa quimiocina é o CXCR4, um receptor acoplado a proteína G e amplamente expresso em células hematopoiéticas, incluindo neutrófilos (BLEUL
et al., 1996; OBERLIM et al., 1996; NAGASE et al., 2002). Há fortes evidências que
a sinalização SDF-1 /CXCR4 regula o tráfego de neutrófilos da medula: a primeira é que a quimiocina SDF-1 é produzida constitutivamente pelas células estromais (AIUTI et al., 1997); a segunda é que a depleção do gene CXCR4 em células
hematopoiéticas promoveu liberação aumentada de neutrófilos da medula (MA et al.,1999); por último, o tratamento com o antagonista seletivo do receptor AMD3100
promoveu a rápida liberação das células do compartimento medular (LILES et al.,
2003). Ainda, o tratamento de camundongos com G-CSF reduziu os níveis de SDF-1 e aumentou a mobilização de neutrófilos da medula óssea para o sangue (SEMERAD et al., 2002). Estes dados, em conjunto, sugerem que SDF-1 endógena
é o fator de retenção de neutrófilos na medula óssea. Martin e colaboradores (2003) mostraram que neutrófilos maduros na medula óssea possuem baixos níveis de CXCR4 expressos na membrana, porém detectáveis. Interessantemente, essas células apresentam altos níveis intracelulares do receptor, sugerindo que este é expresso na superfície celular é rapidamente internalizado pela ação do próprio SDF-1 e de outros mediadores quimiotáxicos (FURZE & RANKIN, 2008).
Após a migração de neutrófilos para os sítios de infecção é necessário remover estas células para promover a resolução da inflamação. Nesta situação, tem sido bem caracterizado o clearance de neutrófilos pela fagocitose das células
29 ___________________________________________________________________________
sangüínea, ou seja, na fase final de circulação apresentam redução progressiva na expressão receptores qumiotáxicos, como o CXCR2, e aumento na expressão de CXCR4 (MARTIN et al., 2003; NAGASE et al., 2002), com maior habilidade de
responder ao SDF-1 na presente na medula (FURZE & RANKIN, 2008). Tendo em vista que a medula óssea possui altos níveis endógenos de SDF-1 , Furze e Rankin (2008) propuseram a participação do eixo SDF-1 /CXCR4 no clearance de
neutrófilos, pela demonstração que neutrófilos que expressavam altos níveis de CXCR4 retornavam para a medula óssea. Confirmando que os neutrófilos podem retornar à medula óssea, estas células marcadas com material radioativo foram injetadas intravenosamente e altas concentrações de radioatividade na medula, baço e pulmão foram detectadas (THAKUR et al., 1977; SAVERYMUTTU et al.,
1985; SURATT et al., 2001). Neste contexto, foi proposto um modelo no qual
macrófagos residentes no estroma da medula óssea são as células responsáveis pela remoção de neutrófilos que ao voltarem à medula óssea tornam-se apoptóticos (FURZE & RANKIN, 2008).
Outro grupo de pesquisadores vem demonstrando um modelo de regulação da produção e liberação de neutrófilos da medula óssea, com a participação das citocinas G-CSF, IL-17 e IL-23. Uma série de experimentos realizados por Stark e colaboradores (2005) mostrou que a ingestão de neutrófilos apoptóticos por macrófagos teciduais iniciam uma cascata de secreção de citocinas que regula a produção e liberação de neutrófilos. Especificamente, após a ingestão, os macrófagos secretam IL-23 que suprime a expressão de IL-17 por subtipos de linfócitos T teciduais. Esta redução de IL-17 resulta na diminuição sistêmica de G-CSF, que conseqüentemente, reduz a produção e liberação de neutrófilos da medula óssea.
Tem sido proposta a participação de proteases hematopoiéticas na mobilização de neutrófilos da medula óssea. Estas enzimas proteolíticas degradam matriz extracelular, clivando moléculas de adesão e influenciando a sinalização célula-célula, por degradar receptores e ligantes. A mobilização de neutrófilos induzida por IL-8 está associada ao aumento nos níveis de metaloproteinase de matriz (MMP-9) na medula óssea. Similarmente, as concentrações de MMP-9, elastase e catepsina G aumentam na medula durante o tratamento com G-CSF (LEVESQUE et al., 2002). Adicionalmente, alguns experimentos in vitro mostraram
30 ___________________________________________________________________________
quimiocinas, incluindo VCAM-1 e SDF-1 , exercendo papel importante na regulação do tráfego de neutrófilos da medula óssea (LEVESQUE et al., 2001; 2003;
HEISSING et al., 2002; PETIT et al., 2002). No entanto, estas observações são
contestadas em animais knockouts para MMP-9 (BURDON et al., 2008)
É importante salientar que os mecanismos que controlam a mobilização de neutrófilos para o sangue em condições homeostáticas e de inflamação são complexos, não totalmente esclarecidos e dependentes de inúmeros mediadores químicos e receptores intracelulares e de membrana. Nos últimos anos, progressos significativos na compreensão destes mecanismos têm sido apresentados e têm mostrado a importância de mediadores secretados não só no compartimento medular, mas sim a participação marcante de células secretoras de citocinas nos compartimentos circulatórios e tecidual.
1.2.2 Interação leucócito-endotélio
Desde o primeiro relato feito por Dutrochet em 1824 que os leucócitos aderiam à parede vascular e migravam para o tecido, as interações entre leucócitos e endotélio têm atraído interesse de muitos pesquisadores. Observa-se uma pequena interação fisiológica entre neutrófilos e a parede dos vasos, com cerca de um décimo do pool de neutrófilos atravessando o endotélio em direção ao ambiente
extravascular (HARLAN, 1985). Estas interações fisiológicas de leucócitos circulantes e endotélio são alteradas durante reações inflamatórias agudas ou crônicas. Nestas condições, alterações reológicas e hemodinâmicas, caracterizadas por vasodilatação, exsudação de proteínas plasmáticas, com conseqüente redução da velocidade do fluxo sanguíneo, induzidas pela ação de mediadores químicos liberados por macrófagos residentes e mastócitos na fase inicial do processo (citocinas, quimiocinas, aminas vasoativas e eicosanóides), provocam a marginação das células brancas ao endotélio, predominantemente de vênulas pós-capilares próximas à área lesada. Em contato direto com o endotélio, os leucócitos inicialmente deslizam sobre a parede vascular (comportamento rolling). Com o
progredir da reação, as células brancas aderem firmemente ao endotélio (aderência), para a subsequente migração por entre as junções interendoteliais (transmigração) e migração no tecido extravascular (HARLAN, 1985; HARLAN et al.,
31 ___________________________________________________________________________
conjunto, de interação leucócito-endotélio, são as etapas iniciais e fundamentais para o recrutamento das células brancas em direção ao tecido lesado.
Embora as primeiras observações sobre a migração celular tenham sido feitas há mais de 180 anos, os mecanismos celulares e moleculares responsáveis pela interação leucócito-endotélio só passaram a ser mais bem elucidados a partir da década de 80, com a identificação das moléculas de adesão (GALLATIN et al.,1983;
ALBELDA et al., 1994; CARLOS & HARLAN, 1994;DOERSCHUK, 1999). Tem sido
proposto que ativação e/ou expressão de moléculas de adesão em cascata medeiam o rolling, a aderência e, subseqüentemente, a diapedese e migração de
leucócitos no tecido extravascular (Figura 3).
A captura dos leucócitos a parede vascular não depende apenas dos receptores expressos nas membranas celulares, mas também de alterações reológicos da corrente sanguínea. O processo conhecido como marginação, orienta o fluxo de leucócitos sobre parede vascular. Primeiramente, ocorre vasoconstricção transitória e, então, vasodilatação provocada pela liberação de histamina pelos mastócitos, quando estimulados pelo agente lesivo. O aumento de permeabilidade leva ao edema. Com isso, aumenta a concentração de células vermelhas dentro do vaso, o que promove o aumento da viscosidade sanguínea. Como consequência, há lentificação da circulação (estase) e, depois, marginação leucocitária. As hemácias têm fluxo axial e os leucócitos, fluxo mais marginal. Com a estase, os leucócitos tendem ainda mais a fazer marginação leucocitária (GRANGER & KUBES, 1994).
Está bem estabelecido, para maioria dos leitos microcirculatórios, que o comportamento rolling é mediado pela expressão/ativação de moléculas
pertencentes à famílid das selectinas. O comportamento rolling, está muito bem
32 ___________________________________________________________________________
tetrassacarídeo sialil Lewis (sLeX) (FOXALL et al., 1992). Outro ligante das
selectinas é a P-selectin glycoprotein ligand-1 (PSGL-1), uma mucina inicialmente definida específica para P-selectina, também funciona como ligante para a E-selectina e L- E-selectina (McEVER et al., 1997). Outros ligantes específicos para cada
selectina estão sumarizados na Tabela 1 (Adaptada de VON ANDRIAN et al., 1995;
___________________________________________________________________________________________________________
___________________________________________________________________________________________________________
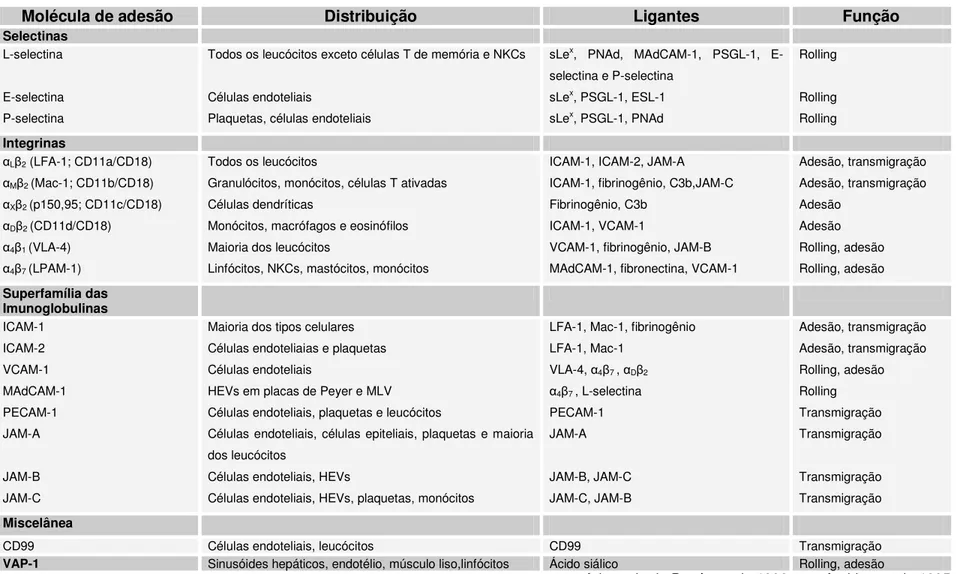
Tabela 1.Resumo das moléculas de adesão e seus ligantes envolvidos na interação leucócito-endotélio
Molécula de adesão Distribuição Ligantes Função
Selectinas
L-selectina
E-selectina P-selectina
Todos os leucócitos exceto células T de memória e NKCs
Células endoteliais
Plaquetas, células endoteliais
sLex, PNAd, MAdCAM-1, PSGL-1, E-selectina e P-E-selectina
sLex, PSGL-1, ESL-1 sLex, PSGL-1, PNAd
Rolling
Rolling Rolling
Integrinas
L 2 (LFA-1; CD11a/CD18) M 2 (Mac-1; CD11b/CD18) X 2 (p150,95; CD11c/CD18) D 2 (CD11d/CD18) 4 1 (VLA-4) 4 7 (LPAM-1)
Todos os leucócitos
Granulócitos, monócitos, células T ativadas Células dendríticas
Monócitos, macrófagos e eosinófilos Maioria dos leucócitos
Linfócitos, NKCs, mastócitos, monócitos
ICAM-1, ICAM-2, JAM-A ICAM-1, fibrinogênio, C3b,JAM-C Fibrinogênio, C3b
ICAM-1, VCAM-1
VCAM-1, fibrinogênio, JAM-B MAdCAM-1, fibronectina, VCAM-1
Adesão, transmigração Adesão, transmigração Adesão Adesão Rolling, adesão Rolling, adesão Superfamília das Imunoglobulinas ICAM-1 ICAM-2 VCAM-1 MAdCAM-1 PECAM-1 JAM-A JAM-B JAM-C
Maioria dos tipos celulares Células endoteliaias e plaquetas Células endoteliais
HEVs em placas de Peyer e MLV Células endoteliais, plaquetas e leucócitos
Células endoteliais, células epiteliais, plaquetas e maioria dos leucócitos
Células endoteliais, HEVs
Células endoteliais, HEVs, plaquetas, monócitos
LFA-1, Mac-1, fibrinogênio LFA-1, Mac-1
VLA-4, 4 7 , D 2 4 7 , L-selectina PECAM-1 JAM-A JAM-B, JAM-C JAM-C, JAM-B Adesão, transmigração Adesão, transmigração Rolling, adesão Rolling Transmigração Transmigração Transmigração Transmigração Miscelânea
CD99 Células endoteliais, leucócitos CD99 Transmigração
VAP-1 Sinusóides hepáticos, endotélio, músculo liso,linfócitos Ácido siálico Rolling, adesão
35 ___________________________________________________________________________
Os ligantes das selectinas pertencem ao grupo de glicoproteínas intimamente ligadas à glicosilação pós-translacionais. As enzimas envolvidas nessa glicosilação incluem as glicosiltransferases, fucosiltransferases e sulfotransferases, as quais têm como função transferir nucleotídeos ligados a açúcares, como GDP-fucose e UDP-galactose, para receptores glicoconjugados (SPERANDIO, 2006). Uma doença rara em humanos, conhecida como LAD II (Leukocyte Adhesion Deficiency), enfatiza a importância dessas modificações pós-translacional sobre a síntese dos ligantes para selectinas. Estes indivíduos apresentam transporte de guanosine diphosphate (GDP)-fucose ineficaz, resultando numa hipofucozilação de glicoproteínas, entre as quais os ligantes para as selectinas. Os pacientes exibem persistente leucocitose, defeito em rolling de leucócitos e, conseqüentemente, infecções bacterianas
recorrentes (HELMUS et al., 2006).
A L-selectina foi identificada em camundongos, pelo seu envolvimento na recirculação de linfócitos em endotélio de vênulas dos linfonodos (GALLATIN et al.,1983). Ela está presente exclusivamente e constitutivamente na maioria dos
leucócitos, com exceção de uma porção de células T de memória e natural killers, e
é a principal molécula responsável pela interação inicial destas células com o endotélio (GRIFFIN et al., 1990; TEDDER et al.,1990; LUND-JOHANSEN et al.,1993). Na circulação de humanos saudáveis, cerca de 50% dos linfócitos, 40 a
80% dos monócitos, 95% dos polimorfonucleares e a maioria das células B expressam a L-selectina na sua membrana (BRUEHL et al., 1996; RAINER, 2002).
Sua expressão é baixa no pool mitótico de células na medula, mas aumenta
gradativamente no decorrer do processo de maturação (TEDDER et al., 1990;
LUND-JOHANSEN & TERSTAPPEN, 1993; VAN EEDEN et al., 1997). Em
granulócitos, a expressão de L-selectina no processo de maturação pode promover interações celulares que compartimentalizam estas células no tecido hematopoiético (DIMITROFF et al., 2001). No entanto, como salientado anteriormente, sua
expressão parece não estar envolvida com migração dos neutrófilos da medula para o sangue (ROBINSON et al., 1999). A regulação da expressão de L-selectina varia
36 ___________________________________________________________________________
(JUTILA et al., 1989; KISHIMOTO et al., 1989; JUNG & DAILEY, 1990, SMALLEY &
LEY, 2005). As proteases envolvidas e a importância desta clivagem em leucócitos ainda não estão completamente estabelecidas. Existe evidência que a TNF-alpha converting enzyme (TACE), também conhecida como ADAM-17, participa da clivagem da L-selectina em timócitos após estimulação com phorbol myristate acetate (PMA) (PESCHON et al., 1998). Alguns estudos indicam que o
comportamento rolling induz a clivagem da molécula, e desta forma o leucócito pode
retornar à circulação. No entanto, se um estímulo químico adequado está presente para a ativação das β integrinas, responsáveis pela aderência, a clivagem de
L-selectina passa a ser fundamental para a transmigração (HAFEZI-MOGHADAM et al., 2001; RAINER, 2002; SMALLEY AND LEY, 2005).
A P-selectina é encontrada em plaquetas e estocada nos corpos de Weibel Palade na célula endotelial (McEVER et al., 1989). Quando a célula endotelial é
ativada por fatores vasoativos, como histamina e trombina, a P-selectina é rapidamente mobilizada para a membrana externa da célula, permitindo a sua interação com leucócitos circulantes (GENG et al., 1990). A expressão na superfície
celular é transiente e a molécula sofre reinternalização por endocitose para posterior expressão (SUBRAMANIAM et al., 1993; SMITH, 2008). Adicionalmente, a
P-selectina pode ser regulada transcripcionalmente e sua expressão induzida por lipopolissacarídeo (LPS) ou citocinas como TNF-α e IL-1 (PAN et al., 1998; SMITH,
2008). Esta molécula também funciona como transdutora de sinais importantes para o rolling de leucócitos (APLIN et al., 1998).
A E-selectina é expressa unicamente após ativação celular, com exceção de microvasos da pele e medula óssea que possuem pequenas concentrações constitutivas desta molécula. Sua expressão na superfície celular depende de síntese protéica e é induzida na célula endotelial por citocinas como IL-1 ou TNF-α,
sendo sua expressão máxima após 4hs de ativação, com redução de expressão a níveis basais após 24hs (BEVILACQUA et al., 1989; SMITH, 2008). Animais
duplamente deficientes para P- e E-selectina apresentaram severas alterações no
rolling de leucócitos com perda completa da interação leucócito-endotélio quando a
microcirculação foi estimulada com TNF-α (BULLARD et al., 1996).
37 ___________________________________________________________________________
endotelial permite que o leucócito detecte substâncias quimioatrativas, como leucotrieno B4, a fração 5a do sistema complemento ou quimiocinas. As quimiocinas interagem com seus receptores expressos em leucócitos e acarretam a ativação das integrinas.
As integrinas são heterodímeros compostos de uma subunidade α e uma
subunidade β. Cada subunidade tem um domínio extracelular amplo, um domínio
único transmembrana e um citoplasmático curto contendo entre 20 e 70 resíduos. Em vertebrados são 18 subunidades α e 8 subunidades β. A associação dessas
subunidades dá origem a 24 integrinas que foram agrupadas em subfamílias (LUO et al., 2007; SMITH, 2008). Estas proteínas receberam essa denominação por Hynes
(1987) devido à habilidade de formar uma ligação entre a matriz extracelular e o citoesqueleto. A atividade das integrinas é regulada por um processo denominado
inside-out signaling. Estímulos como as citocinas, quimiocinas e antígenos ativam
vias que atuam sobre as porções citoplasmáticas das integrinas, alterando suas afinidades por ligantes ou influenciando sua disposição sobre a superfície celular, portanto, alterando sua atividade. Adicionalmente, a interação com seus ligantes enviam sinais dos domínios extracelulares para vias citoplasmáticas, processo chamado out-side signaling. Essa dinâmica das integrinas e mudanças
conformacionais são necessárias para migração celular ocorrer de maneira eficiente (LUO et al., 2007; KINASHI, 2007). É bem estabelecido que a fosforilação da cadeia
β é necessária para ativação destas moléculas (GAHMBERG et al., 1997).
As moléculas da subfamília β2 ou complexo CD18, composta de 4 moléculas-
CD11a/CD18 ou LFA-1 (lymphocyte function associated 1), CD11b/CD18 ou Mac-1
(macrophage antigen 1), CD11c/CD18 e CD11d/CD18, são as mais relevantes no
recrutamento leucocitário e medeiam a aderência do leucócito ao endotélio e sua subseqüente diapedese (SMITH, 2008). Estudos in vivo, utilizando animais
deficientes para CD18, demonstraram diminuição no percentual de células aderentes em vênulas pós-capilares inflamadas (SCHARFFETTER-KOCHANEK et al., 1998;
FORLOW et al., 2000). A importância do complexo CD18 em humanos é bem
demonstrada exemplificada em pacientes que possuem uma deficiência genética de
β2 integrina, denominada deficiência de adesão leucocitária (LAD-I). Estes indivíduos
38 ___________________________________________________________________________
moléculas que compõem as demais subfamílias das integrinas, são receptores importantes para a hematopoese. Neste contexto, tem sido demonstrado que além do papel de aderência ao microambiente hematopoiético (LICHTERFELD et al.,
2000; LUNDAHL et al., 2002; CARION et al., 2002), as integrinas funcionam como
sinalizadoras intracelulares para a maturação leucocitária (TAKEDA et al., 2003; SHI et al., 2004).
A ativação dos leucócitos coincide com a diminuição da velocidade do rolling
e a transição para firme aderência. Este processo é estabelecido pela interação das integrinas com seus ligantes, moléculas pertencentes à superfamília das Imunoglobulinas, denominadas conhecidas como moléculas de adesão celular, intercelular (I)CAM-1, vascular (V)CAM-1, plaqueta-endotelial (PE)CAM-1 e moléculas de adesão juncional (GONZÁLEZ-AMARO & SÁNCHEZ-MADRID, 1999; HUMPHRIES et al., 2006). Estas proteínas possuem um domínio extracelular
constituído por várias unidades repetidas homólogas a domínios de imunoglobulina G, uma região transmembrana e uma pequena cauda citoplasmática. São expressas em diferentes tipos celulares e as expressões de ICAM-1 e VCAM-1 no endotélio quiescente são baixas, mas na presença de estímulos inflamatórios suas concentrações na membrana endotelial são extremamente aumentadas (HUO & LEY, 2001). Diferentemente, as expressões constitutivas de ICAM-2 e PECAM-1 são significativas (HUO & LEY, 2001).
A transmigração é um processo no qual o leucócito atravessa a camada de células endoteliais, por vias transcelular ou paracelular, sendo que a paracelular parece ser a mais comum em processos inflamatórios (PETRI & BIXEL, 2006). Durante a transmigração paracelular, os leucócitos atravessam as junções endoteliais, as quais são ricas em proteínas de adesão transmembrana. A primeira proteína amplamente encontrada nestas junções, que interagem por ligações homofílicas e exercem função no processo de diapedese, foi a PECAM-1 (NEWMAN, 1997). A evidência da participação da PECAM-1 na transmigração de leucócitos foi demonstrada in vitro, utilizando anticorpos anti-PECAM-1, onde a
transmigração de neutrófilos e monócitos foi reduzida (MULLER et al., 1993).
Corroborando este efeito, animais knockouts para PECAM-1 apresentaram prejuízo
na transmigração neutrofílica (SCHENKEL et al., 2006). Outras proteínas, que
39 ___________________________________________________________________________
laterais célula-célula e denominadas junctional adhesion molecules (JAMs), vascular endhotelial (VE)-Caderina e CD99 (DEJANA, 2004).
Recentemente, outra molécula de adesão denominada vascular adhesion protein-1(VAP-1) foi caracterizada como uma molécula envolvida na mobilização
leucocitária. Trata-se de uma monoamino-oxidase sensível a semicarbazida que catalisa a deaminação oxidativa de aminas primárias, formando o aldeído correspondente e liberando peróxido de hidrogênio e amônia. A VAP-1 está presente em vesículas citosólicas de células endoteliais e é translocada para a membrana celular após estímulo inflamatório. Esta molécula também é encontrada em células dendríticas, pericitos, células do músculo liso, adipócitos e linfócitos (SALMI & JALKANEN, 2001). O papel da VAP-1 no recrutamento leucocitário foi demonstrado pelo emprego de anticorpos monoclonais e animais geneticamente deficientes de VAP-1. In vivo, o tratamento de camundongos murinos com anticorpos anti-VAP-1
aumentou a velocidade do rolling e reduziu a aderência e a transmigração de
granulócitos para o foco inflamatório (TOHKA et al., 2001). Em sistema de fluxo in vitro foi demonstrado que o bloqueio da VAP-1 prejudica os fenômenos de rolling e
aderência de leucócitos em células endoteliais que expressavam a molécula (LALOR
et al., 2002). Na inflamação hepática, a VAP-1 parece ser a principal molécula que
medeia o recrutamento de linfócitos T CD4+ em vênulas pós-sinusóides e em sinusóides hepáticos de camundongos (BONDER et al., 2005). A participação
enzimática da VAP-1 nos eventos de interação leucócito-endotélio também já foi explorada. Koskinen e colaboradores (2004) verificaram que a atividade enzimática da VAP-1 é um pré-requisito para a atividade adesiva de granulócitos ao endotélio, já que endotélio transfectado com VAP-1 enzimaticamente inativa inutilizada, mas estruturalmente íntegra apresentaram atividade adesiva menor. Adicionalmente, foi sugerido que a sinalização intracelular dependente da VAP-1 pode promover um estado de ativação diferenciado do endotélio vascular para uma resposta inflamatória amplificada. Estes autores demonstraram que a transcrição e translocação de P- e E-selectinas, bem como o rolling de linfócitos em células
endoteliais foram dependentes da atividade enzimática da VAP-1 (JALKANEN et al.,
40 ___________________________________________________________________________
1.3 Controle dos glicocorticóides endógenos (GE) sobre a migração celular
A investigação do papel dos GCs nas diferentes etapas da mobilização local de leucócitos vem de longa data, e tem determinado resultados conflitantes até os dias atuais, principalmente quanto à origem endógena ou exógena e a dose de hormônio empregada. Diferentes modelos experimentais têm demonstrado que os GE ou exógenos modulam a migração de leucócitos para o foco da lesão, no entanto o mecanismo de ação não está totalmente esclarecido (FLOWER et al.,
1986; MORAES et al., 1987; PEERS et al., 1988; ABE et al., 1995; CASTAGLIUOLO et al., 2001).
Nosso grupo tem investigado o papel dos GE no processo de migração celular. Farsky e colaboradores (1995) demonstraram in vivo, em animais
adrenalectomizados (ADR) ou tratados com metopirona (inibidor da síntese de GCs que mantém a atividade de mineralocorticóides), o papel dos GE como moduladores fisiológicos da interação leucócito-endotélio. Nestes animais, o número de leucócitos em comportamento rolling, em condições normais, foi muito maior que o detectado
em animais controles falso-operados (FO) ou não manipulados cirurgicamente (NM). A indução de resposta inflamatória exacerbou a interação celular, com consequente aumento no número de células brancas aderidas à parede de vênulas pós-capilares e no interstício adjacente. Adicionalmente, verificou-se a participação do receptor citosólico nestes eventos, uma vez que animais não manipulados tratados com RU 38 486, antagonista do receptor de glicocorticóide, apresentaram os mesmos perfis de interação leucócito-endotélio encontrados nos animais ADR e tratados com metopirona.
41 ___________________________________________________________________________
após a cirurgia coincide com diminuição na expressão de L-selectina (FASSBENDER et al., 1999; SEEKAMP et al., 2001). Nesta mesma linha de
evidências, observou-se que a estimulação elétrica de áreas específicas do hipotálamo em gatos, que induz aumento de corticóides e noradrenalina circulantes, causou granulocitose e linfocitopenia. A análise da expressão de moléculas de adesão nestes leucócitos circulantes mostrou incremento na expressão de L-selectina em granulócitos e diminuição em linfócitos CD4 e CD8, efeito que parece não ser dependente de clivagem protéica (KANAME et al., 2002). No entanto,
trabalho prévio utilizando o mesmo modelo animal, onde a lesão hipotalâmica acarretou somente aumento na concentração de GCs circulantes, observou-se granulocitose com diminuição da expressão de L-selectina (MORI et al., 2000).Uma
série de estudos em bovinos recém-nascidos ou em fêmeas após o parto corroborou os dados citados acima (LEE et al., 1998; PREISLER et al., 2000; WEBER et al.,
2001).
Quanto à expressão de integrinas, os dados apresentados na literatura indicam que os GE não interferem com a expressão destas moléculas em leucócitos circulantes. Após estresse cirúrgico, a expressão de integrinas foi discretamente aumentada na vigência de altas concentrações de GCs (FASSBENDER et al., 1999).
Corroborando este efeito, TORSTEINSDÓTTIR et al. (1999) demonstraram que o
incremento na secreção de GE não altera a expressão de integrinas em leucócitos circulantes de humanos.
Tanto para os GE como para os GCs exógenos, os resultados são conflitantes quanto à ação direta sobre a síntese e/ou expressão de molécula de adesão ou indireta, através da inibição da secreção de mediadores que reconhecidamente ativam a expressão/ativação destas estruturas nas membranas celulares (BARNES & ADDOCK, 1993; DAVENPECK et al., 1998; PIPITONE et al.,
42 ___________________________________________________________________________
1.4 Anexina A-1
A anexina A-1, também conhecida como liporcotina-1, foi descrita por Flower & Blackwell (1979) e identificada como uma proteína de 37kDa induzida por GCs, envolvida na inibição da síntese de eicosanóides e de fosfolipase A2 (FLOWER, 1988). É encontrada em diferentes tecidos e tipos celulares, incluindo mamíferos, aves, roedores, peixes, insetos (MOSS & MORGAN, 2004). Em condições basais, anexina A-1 é encontrada no citoplasma de neutrófilos, macrófagos e monócitos de humanos e de murinos (MORAND et al., 1995; PERRETTI, et al., 2000; MULLA, et al., 2005). Apresenta atividade na regulação da adesão dos neutrófilos (PERRETTI,
1997;OLIANI et al., 2001;GIL et al., 2006) e dos monócitos (SOLITO et al., 2000) às
células endoteliais ativadas. Diferentes estudos utilizando modelos experimentais de inflamação têm mostrado que anexina A-1 ou peptídeos bioativos, compreendidos pela sua região N-terminal, promovem inibição no tráfego de neutrófilos do sangue para os tecidos inflamados (LIM et al., 1998; PERRETTI & FLOWER, 2004; LIM &
PERVAIZ, 2007). Um possível mecanismo na regulação da migração celular é a interferência da anexina-A1 com moléculas de adesão que medeiam à interação leucócito-endotélio. Experimentos utilizando microscopia confocal verificaram co-localização da anexina A-1 com a α4β1 integrina na superfície de monócitos (SOLITO
et al., 2000). Além disso, De Coupade e colaboradores (2003) propuseram que a
anexina-A1 externalizada na superfície celular pelos GCs facilita a clivagem da L-selectina por uma interação dependente de cálcio. Além disso, foi demonstrado que o tratamento com anexina A-1 induziu diminuição da expressão de L-selectina na membrana de neutrófilos atuando na clivagem desta molécula (STRAUSBAUGH & ROSEN, 2001).
Perretti & D’Acquisto (2009) propuseram um mecanismo esquemático da mobilização da anexina A-1 em células ativadas e seu potencial mecanismo de ação (Figura 4). Após ativação celular, a anexina A-1 intracelular é mobilizada para a membrana plasmática. Dependendo do tipo celular, esta é então externalizada e/ou secretada por um dos seguintes mecanismos: ativação do mecanismo transportador ABC (WEIN et al., 2004); fosforilação do seu resíduo de serina na porção
amino-terminal (SOLITO et al., 2006); ou fusão de grânulos contendo anexina A-1 com a
43 ___________________________________________________________________________
da região N-terminal e ligação ao seu receptor ALXR (também conhecido como FPR2). A anexina A-1 pode ativar a sinalização por mecanismos autócrinos, parácrinos ou justácrinos. Esta última é o mais plausível mecanismo em condições inflamatórias. A via anexina A-1/ALXR pode ser regulada pelos glicocorticóides, os quais induzem a expressão do gene que codifica esta proteína. Foi demonstrado que a administração de GCs exógenos em pacientes saudáveis acarretou aumento da expressão de anexina A-1 em monócitos e neutrófilos circulantes (GOULDING et al., 1990). Além disso, leucócitos obtidos de pacientes com Síndrome de Cushing,
que possuem altos níveis de GE, apresentaram aumento na expressão de anexina A-1 enquanto leucócitos obtidos de pacientes com Síndrome de Addison, que oposicionalemnte possuem baixos níveis de GE apresentaram baixa expressão de anexina A-1 (MULLA et al., 2005). Porém, os mecanismos pelos quais os GCs
regulam a expressão de anexina A-1 ainda não são totalmente conhecidos.
44 ___________________________________________________________________________
46 ___________________________________________________________________________
2. OBJETIVOS
Os objetivos deste trabalho de tese de doutorado foram baseados em resultados prévios que mostraram um controle endógeno dos glicocorticóides sobre a produção e maturação de neutrófilos e suas interações adesivas com o endotélio microvascular do compartimento medular e circulante. Um dos possíveis alvos desse controle foi atribuído à regulação exercida sobre a expressão de L-selectina na membrana de neutrófilos (CAVALCANTI et al., 2006).