UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA
DEPARTAMENTO DE FISIOLOGIA E FARMACOLOGIA PROGRAMA DE PÓS‐GRADUAÇÃO EM FARMACOLOGIA
INEZ LIBERATO EVANGELISTA
CARACTERIZAÇÃO DAS ATIVIDADES CARDIORENAL E
NEURAL DE
Bothrops marajoensis
E SUAS FRAÇÕES
INEZ LIBERATO EVANGELISTA
CARACTERIZAÇÃO DAS ATIVIDADES CARDIORENAL E
NEURAL DE
Bothrops marajoensis
E SUAS FRAÇÕES
Tese de Doutorado submetida à Coordenação do Programa de Pós-Graduação em Farmacologia do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal Ceará, como requisito para obtenção do título de Doutor em Farmacologia.
Orientadora: Profa. Dra. Helena Serra Azul Monteiro
INEZ LIBERATO EVANGELISTA
CARACTERIZAÇÃO DAS ATIVIDADES CARDIORENAL E
NEURAL DE
Bothrops marajoensis
E SUAS FRAÇÕES
Tese de Doutorado submetida à Coordenação do Programa de Pós-Graduação em Farmacologia do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal Ceará, como requisito para obtenção do título de Doutor em Farmacologia.
Aprovada em: 17 de Abril de 2009
BANCA EXAMINADORA
__________________________________________________ Profa. Dra. Helena Serra Azul Monteiro
____________________________________________________ Prof. Dr. Nilberto Robson Falcão do Nascimento
Universidade Estadual do Ceará -UECE
________________________________________________________ Profa. Dra. Arlândia Cristina Lima Nobre
Universidade de Fortaleza - UNIFOR
_________________________________________________ Prof. Dr. Alexandre Havt Bindá
Tudo que tenho de bom recebi de Deus.
AGRADECIMENTOS
Á Deus, por mais uma vitória concedida.
À Profa. Dra. Helena Serra Azul, pelo exemplo de orientação tranqüila, sempre segura e prudente.
Ao colega Prof. Dr. Nilberto Robson Falcão do Nascimento, pela paciência, pelo convívio, e imenso enriquecimento com seus ensinamentos.
Profa. Dra Arlândia Cristina Lima Nobre por ter aceitado prontamente o convite para participação da banca.
Profa. Dra. Gisela Costa Camarão por mais uma vez contribuir com enriquecimento do trabalho desenvolvido.
Prof. Dra. Maria Alice Costa Martins pela atenção, paciência e exemplo profissional.
A prima Janaina Serra Azul Evangelista por sua alegria e espontaneidade contagiante. Por todas as ajudas e convivência durante este doutorado.
Profa. Dra. Claudia Santos pela tranqüilidade e ajuda desenvolvida nos experimentos realizados na Universidade Estadual do Ceará.
Ao Prof. Dr Marcus Hikari Toyama, da Universidade Estadual Paulista Júlio de Mesquita Filho ((UNESP) por gentilmente ter cedido o veneno e suas frações para realização deste trabalho.
Aos bolsistas e alunos de iniciação científica da Universidade estadual do Ceará e Universidade Federal do Ceará.
LISTA DE ABREVIATURAS E/OU SÍMBOLOS
µg
MicrogramaµM
MicromolarµL
MicrolitroAch Acetilcolina Atrop Atropina
ATP Adenosina Trifosfato
Bmj Bothrops marajoensis
bpm Batimentos por minuto
Cch Carbacol
C90 Controle aos 90 min
C30 Controle aos 30 min
e.v Endovenosa
G Grama
mmHg Milímetros de mercúrio
mM Milimolar MS Milisegundos N Normal nM Nanomolar
◦C Graus Celsius
PAF Fator de agregação plaquetária
PLA2 Fosfolipase A2
PP Pressão de perfusão
RPM Revoluções por minuto
S.c Subcutâneo
TXA2 Tromboxano A2
LISTA DE FIGURAS E TABELAS
FIGURAS
Figura 1: Diferenças entre as caudas dos animais da família Viperidae 24
Figura 2: Evolução do aparelho venenoso em serpentes. 25
Figura 3: Imagem da espécie Bothrops marajoensis em seu habitat natural. 31
Figura 4: Distribuição dos acidentes ofídicos segundo o gênero da serpente
envolvida. Ceará, Brasil, 2001 a 2007. 32 Figura 5: Figura esquemática sistema perfusão cardíaca em ratos. 50
Figura 6: Desenho esquemático do sistema de perfusão de leito vascular
mesentério. 52
Figura 7: Representação gráfica do sistema de perfusão de rim isolado com
recirculação. 54
Figura 8: Pressão arterial média em ratos com veneno bruto de Bothrops
marajoensis 60
Figura 9: Freqüência cardíaca em ratos com veneno de B. marajoensis. 60
Figura 10: Avaliação da freqüência respiratória em ratos com veneno bruto de
Bothrops marajoensis. 61
Figura 11: Variação da pressão arterial média em ratos atropinizados, 1µg/kg de atropina após administração do veneno bruto de Bothrops marajoensis (BMJ) utilizado na dose 100μ g/mL
61
Figura 12: Avaliação da freqüência cardíaca em ratos atropinizados, 1µg/kg de atropina após administração do veneno bruto de Bothrops marajoensis utilizado na dose 100μ g/mL.
Figura 13: Avaliação da freqüência respiratória em ratos atropinizados, 1µg/kg de atropina após administração do veneno bruto de Bothrops marajoensis
utilizado na dose 100μ g/mL.
62
Figura 14: Avaliação da pressão arterial média em ratos após administração da
fosfolipase tipo1 do veneno bruto de Bothrops marajoensis. 63
Figura 15: Avaliação da freqüência cardíaca em ratos após administração da
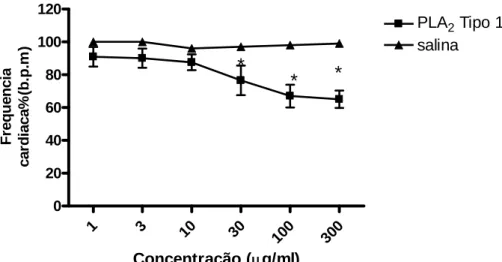
fosfolipase tipo1 do veneno bruto de Bothrops marajoensis. 63
Figura 16: Avaliação freqüência respiratória em ratos após administração da
fosfolipase tipo1 do veneno bruto de Bothrops marajoensis. 64
Figura 17: Avaliação pressão arterial média em ratos após administração da
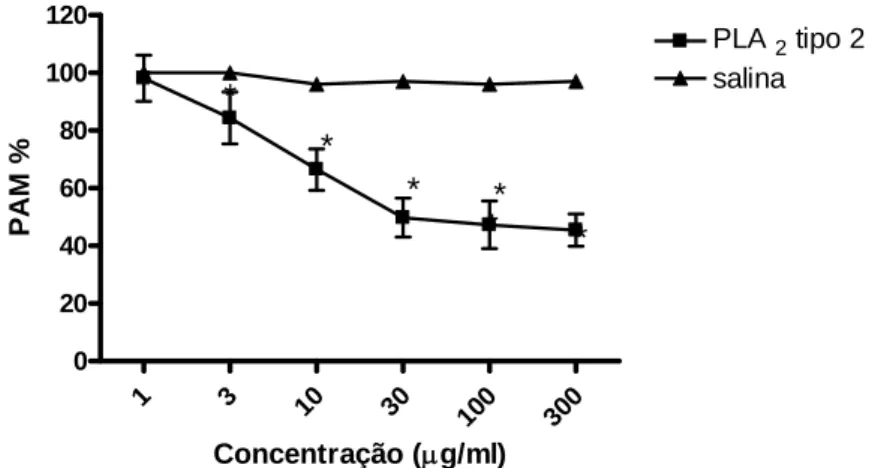
fosfolipase tipo2 do veneno bruto de Bothrops marajoensis. 64
Figura 18: Avaliação freqüência cardíaca em ratos após administração da
fosfolipase tipo2 do veneno bruto de Bothrops marajoensis. 65
Figura 19: Avaliação freqüência respiratória em ratos após administração da
fosfolipase tipo2 do veneno bruto de Bothrops marajoensis. 65
Figura 20: Avaliação da pressão arterial média em ratos após administração da
lectina do veneno bruto de Bothrops marajoensis. 66
Figura 21: Avaliação da freqüência cardíaca em ratos após administração da
lectina do veneno bruto de Bothrops marajoensis. 66
Figura 22: Avaliação da freqüência respiratória em ratos após administração da
lectina extraída do veneno bruto de Bothrops marajoensis. 67
Figura 23: Força de contração miocárdio, após administração do veneno bruto de
Bothrops marajoensis Bmj, na perfusão de coração isolado de ratos 68
Figura 24: Pressão de perfusão após administração do veneno bruto de Bothrops
marajoensis, na perfusão de coração isolado de ratos 68 Figura 25: Fluxo de perfusão coronariano após administração do veneno bruto de
Bothrops marajoensis na perfusão de coração isolado de ratos 69 Figura 26: Amplitude contração. Registro perfusão átrio isolado, antes (controle)
e depois da administração de Bmj. 69 Figura 27: Figura 27 a: Registro do eletrocardiograma em ratos antes da administração das drogas. (controle). 70 Figura 27b:Registro do eletrocardiograma em ratos após a administração Veneno
brutode Bothrops marajoensis dose 100µg/kg. 71 Figura 28: Efeito do Veneno bruto de Bothrops marajoensis em leito vascular
mesentério pré- contraído com fenilefrina- 72 Figura 29: Efeito do Veneno brutode Bothrops marajoensis dose 300μg/mL em
leito vascular mesentério pré –contraído com fenilefrina. 73 Figura 30: Pressão de perfusão em rim isolado de ratos. Efeito do Veneno bruto
de Bothrops marajoensis. 74
Figura 31: Resistência vascular renal em rim isolado de ratos. Efeito do Veneno
brutode Bothrops marajoensis. 75
Figura 32: Fluxo urinário em rim isolado de ratos. Efeito do Veneno bruto de
Bothrops marajoensis. 75
Figura 33: Ritmo de filtração glomerular. Efeito do Veneno bruto de Bothrops
marajoensis nas doses 100µg/kg 76
Figura 34: Decréscimo percentual transporte total de sódio em rim isolado de
ratos 76
Figura 35: Decréscimo percentual transporte total de cloreto.
77
Figura 36: Percentual transporte total de potássio em rim isolado de ratos.
Figura 37: Efeito da fosfolipase tipo 1 do Veneno brutode Bothrops marajoensis
canal deferente. 78
Figura 38: Efeito da fosfolipase tipo 1 do Veneno brutode Bothrops marajoensis
no canal deferente 78
Figura 39: Efeito da fosfolipase tipo 1 do Veneno brutode Bothrops marajoensis
no canal deferente 79
Figura 40: Transporte de sódio. Efeito da fosfolipase tipo 1 do Veneno bruto de
Bothrops marajoensis na perfusão renal de ratos 79 Figura 41: Transporte de cloretos. Efeito da fosfolipase tipo 1 do Veneno brutode
Bothrops marajoensis na perfusão renal de ratos. 80 Figura 42:Transporte de potássio. Efeito da fosfolipase tipo 1 do Veneno brutode
Bothrops marajoensis na perfusão renal de ratos 80 Figura 43: Força de contração. Efeito do veneno bruto de Bmj doses em nervo
frênico de rato estimulado por campo elétrico. 81 Figura 44: Força de contração. Efeito do veneno bruto de Bmj doses crescente em
canal Deferente de camundongos estimulado por campo 82 Figura 45: Força de contração com ioimbina. Veneno bruto de Bothrops
marajoensis (Bmj) 83
Figura 46: Efeito naloxone Veneno bruto de Bothrops marajoensis nas doses
100µg/kg em leito vascular mesentério de camundongos 83 Figura 47: Inibição da contração neurogênica estimulada por campo elétrico (ECE) pelo BMJ comparado com nenhuma queda significante pela contração com NA, ATP ou Cch (em Krebs normal ou enriquecido com guanetidina, fentolamina).
84
Figura 48: Efeito da fosfolipase tipo 1 do veneno bruto de BMJ doses crescente
em canal deferente de camundongos estimulado por campo elétrico 85
Figura 49: Efeito da fosfolipase tipo 2 do veneno bruto de BMJ em canal deferente de camundongos estimulado por campo elétrico. 85 Figura 50: Efeito PLA2 tipo 1 e tipo 2 do veneno bruto de BMJ em canal
deferente de camundongos estimulado por campo elétrico. 86 Figura 51: Efeito da lectina do veneno BMJem canal deferente de camundongos
TABELAS
Tabela 1: Classificação das serpentes viventes (adaptado de MCDOWELL, 1987). 22
Tabela 2: Dados brutos das ondas, complexos, intervalos de segmentos do eletrocardiograma após a injeção endovenosa com o veneno bruto de Bothrops marajoensis na dose de 100µ/kg.
RESUMO
CARACTERIZAÇÃO DAS ATIVIDADES CARDIORENAL E NEURAL DE Bothrops marajoensis E SUAS FRAÇÕES
Avaliou-se a atividade de Bothrops marajoensis (Bmj) e suas frações no sistema cardiorrenal. A resposta pressora do veneno bruto demonstrou uma diminuição da pressão arterial média e da freqüência cardíaca, sem alterações significativas na freqüência respiratória. Em ratos atropinizados demonstrou a permanência dos efeitos. Na perfusão de coração isolado de ratos observou-se uma diminuição na força de contração miocárdica acompanhada de um aumento da pressão de perfusão, sem alterações no fluxo coronariano. A análise eletrocardiográfica em ratos após injeção de Bmj provocou um bloqueio átrio ventricular gradual até um bloqueio completo indicando arritmia e dificuldade de condução atrial. Em leito vascular mesentério pré-contraído com fenilefrina não houve alterações significativas. No sistema de perfusão renal em ratos apresentou decréscimo significativo na pressão de perfusão, resistência vascular, fluxo urinário, ritmo de filtração e transportes de sódio e de cloreto. Fosfolipase miotóxica (tipo 1) demonstrou alterações somente no transporte de íons. A atividade de Bmj em doses crescentes em nervo Frênico Diafragma de ratomostrou um bloqueio na força de contração dose dependente, com efeito significante nas maiores doses. Em canal deferente de camundongos induziu a uma inibição dose dependente da contração estimulada por campo elétrico. Este feito não foi revertido pela Ioimbina nem por naloxone. Em outro estudo a adição do veneno bruto de Bmj inibiu a contração neurogênica,quando comparado com nenhuma queda significante pela contração com Cch, NA ou ATP (em Krebs normal ou enriquecido com guanetidina e fentolamina. A ausência de efeito do veneno bruto de Bothrops marajoensis sobre a contração induzida pelos principais agonistas purinérgicos demonstra provável atividade a nível pré-sináptico. Frações de fosfolipases miotóxicas (tipo 1 e tipo 2) demonstraram uma inibição da contração dose dependente.
ABSTRACT
CHARACTERIZATION OF TOTAL VENOM AND ITS FRACTION FROM THE
Bothrops marajoensis IN CARDIORENAL AND NEURAL ACTIVITIES
In this article we evaluated the activity of Bothrops marajoensis (Bmj) and its fractions in the cardio-renal system. The results of the total venom in blood pressure experiments showed a decrease in the mean arterial pressure and heart rate without significant changes in respiratory rate. The same experiments performed in rats atropinized showed the permanence of falling blood pressure and heart rate. After administration of Bmj used in infusion of isolated rats heart of there was a decrease in myocardial force of contraction accompanied by an increase in perfusion pressure, without changes in coronary flow. The electrocardiographic analysis after injection of Bmj in rats causes a progressive atrioventricular block until a complete blockage and difficulty in atrial conduction. The assessment in the mesenteric vascular bed Bmj did not produce significant changes. The system renal perfusion in rats caused significant decrease in perfusion pressure, renal vascular resistance, urinary flow, filtration rate, transport of sodium and chloride. The phospholipase (PLA2) type 1 showed only an alteration in the transport of electrolytes. The Bmj fractions neurotoxicity in rat phrenic nerve diaphragm increasing showed a blockage dose-dependent in the strength of contraction. In mice vas deferens we observed an induced of a dose-dependent inhibition of contraction stimulated by electric field. This fact was not reversed by yohimbine or by naloxone. In another study the addition of the total venom of Bmj inhibited the neurogenic contraction, compared with no significant decrease in contraction by Cch, NA or ATP (in normal Krebs solution or with enriched with guanethidine and phentolamine). The fractions, PLA2 (type 1 and type 2) showed a dose-dependent inhibition of contraction.
SUMÁRIO
LISTA DE ABREVIATURAS E /OU SÍMBOLOS LISTA DE FIGURAS E TABELAS
RESUMO ABSTRACT
1. INTRODUÇÃO 21
1.1 Origem e diversidade das serpentes 21
1.2 O veneno das serpentes 24
1.3 Bothrops marajoensis 27
1.4 Características gerais e epidemiológicas dos acidentes Botrópicos 28
1.5 Componentes do veneno do gênero Bothrops 31
1.5.1 As fosfolipases A2 dos venenos de Bothrops 32
1.5.2 As lectinas dos venenos de Bothrops 34
1.7 O veneno do gênero Bothrops e suas atividades nos sistemas fisiológicos
35
1.7.3 Toxicidade cardiovascular associada ao veneno de Bothrops 35 1.7.4 Nefrotoxicidade associada ao veneno de Bothrops 37 1.7.5 Neurotoxicidade associada ao venenode Bothrops 38
2. JUSTIFICATIVA 41
3. OBJETIVOS 43
3.1 Objetivos gerais 44
4. MATERIAL E MÉTODOS 45
4.1 Animais experimentais 46
4.2 Procedimentos com veneno de Bothrops marajoensis 46
4.3 Avaliação da toxicidade cardiovascular 46
4.3.1 Pressão arterial 46
4.3.2 Coração isolado de ratos 47
4.3.3 Átrio isolado 58
4.3.4 Avaliação eletrocardiográfica 59
4.3.5 Perfusão em leito vascular mesentérico 59
4.4 Nefrotoxicidade 50
4.4.1 Perfusão renal 50
4.4.1.1 Avaliação bioquímica dos perfusatos e urinas 52 4.4.1.2 cálculo dos parâmetros funcionais 52
4.5 Avaliação da neurotoxicidade 53
4.5.1 Nervo frênico de diafragma de ratos 53
4.5.2 Canal deferente de camundongos 54
4.6 análises estatísticas 54
4.7 Aspectos éticos 55
5. RESULTADOS 56
5.1 Avaliação da toxicidade cardiovascular 57
5.1.1 Pressão arterial de ratos 57
5.1.2 Coração isolado de ratos 65
5.1.3 Átrio isolado 67
5.1.4 Avaliação eletrocardiografia 68
5.1.5 Perfusão em leito vascular mesentério 70
5.2 Nefrotoxicidade 71
5.2.1 Perfusão renal 71
5.3 Avaliação da neurotoxicidade 79
5.3.1 Nervo frênico diafragma de ratos 79
5.3.2 Canal deferente de camundongos 79
6. DISCUSSÃO 86
6.1 Avaliação da toxicidade cardiovascular 87
6.2 Avaliação da nefrotoxicidade 90
6.3 Avaliação da neurotoxicidade 92
6.3.1 Frênico de diafragma de ratos 92
6.3.2 Canal Deferente de camundongos 94
7. CONCLUSÃO 96
8. REFERÊNCIAS BIBLIOGRÁFICAS 97
1 INTRODUÇÃO
1.1 Origem e diversidade das serpentes
As serpentes, ou ofídios, compõem a subordem Serpentes,que, atualmente com cerca de 3.000 espécies formam a ordem Squamata,o mais numeroso grupo dos répteis viventes. Estão inclusos na classe Reptilia, subclasse Lepdosauria, com cerca de 410 espécies venenosas Devido a estudos revisivos, descrições de novas espécies e invalidação de outras, os números apresentam uma variação constante, reflexo da complexidade de formas e ausência de conhecimento profundo das relações filogenéticas nestes animais (BARRAVIERA, 1993; MELGAREJO, 2003).
Apesar da escassez de registros fósseis, a origem desse grupo provavelmente remonta ao período Cretáceo (há cerca de 135 milhões de anos). Umas poucas vértebras danificadas são, possivelmente, o fóssil de serpente mais antigo, datado de cerca de 100 milhões de anos. Considerando-se que os primeiros repteis surgiram a 315 milhões de anos, a origem das serpentes é então relativamente recente (RAGE, 1987; RAGE; WERNER, 1999).
Bastante consensual é o fato de que as serpentes surgiram de algum grupo de lagartos de vida subterrânea que, por adaptação, tiveram corpo extremamente alongado, redução das patas e olhos semi-atrofiados (MELGAREJO, 2003).
Sempre houve controvérsias para se estabelecer uma classificação apropriada para serpentes. Nas últimas décadas surgiram várias propostas (ASSAKURA et al., 1992; DUARTE et al., 2000). Conforme McDowwell, 1987 podemos citar as serpentes viventes em 2 infraordens, 6 superfamílias e 19 famílias (quadro 1). A infraordem Scolecophidia inclui as cobras cegas e Alethiniphidia as demais serpentes. (RAGE; WERNER, 1999; MELGAREJO, 2003).
Quadro 1 - Classificação das serpentes Viventes
Infraordem Superfamília Familia
Scolecophidia Typhlopoide Anomalepididae (*)
Typhlopidae (*)
Leptotyphlopidae(*)
Alethinophidia Acrochordoidea Nigeropheidae
Palaeopheidae
Anomalopheidae
Acrochordidae
Anilioidea Loxocemidae
Xenopeltidae
Aniliidae (*)
Uropeltidae
Tropidopheoidea Tropidopheidae(*)
Bolyerioidea Bolyeriidae
Booidea Pythonidae
Boidae (*)
Colubroidea Atractaspididae
Elapidae (*)
Colubridae (*)
Viperidae (*)
(*) Famílias representadas no Brasil
Fonte: adaptado de McDowell (1987) e Cardoso et al.. (2003)
inoculá-las, ocasionando intoxicações sérias no homem e animais domésticos. (BRASIL, 2001; MELGAREJO, 2003).
A família Elapidae encontra-se amplamente distribuída pelo mundo, com cerca de 250 espécies. Muito bem conhecidas da Ásia, África e em particular na Austrália, onde todas as serpentes peçonhentas são dessa família. Possuem espécies famosas como as Najas asiáticas e as temidas Mambas do continente Africano. Nas Américas, a família é representada pelas chamadas popularmente “Cobras corais”. Na fauna brasileira são reconhecidas cerca de 20 espécies, a maioria ao gênero Micrurus (CAMPBELL; LAMAR, 1989; ROZE, 1996; JORGE DA SILVA, 1997).
A família Viperidae com mais de 200 espécies representa o mais importante grupo de serpentes para saúde pública, pois são responsáveis pela maioria dos acidentes ofídicos registrados não só no Brasil, mas em outros países americanos. Esta família possui 34 gêneros assim representados: Crotalus, Lachesis, Bothrops, Bothriopsis e Bothrocophias. Apenas os três primeiros adquirem importância epidemiológica. Em nosso país existem 5 gêneros que somam aproximadamente 30 espécies, no qual 20 espécies pertencem ao gênero Bothrops 19 ao gênero Micrurus, uma ao gênero Crotalus e uma ao gênero Lachesis. Os gêneros
Bothriopsis e Bothrocophias são classificados como uma revisão do gênero Bothrops
encontrando-se em áreas restritas da America do Sul e Bacia Amazônica, com um número limitado de espécies, sem registros de acidentes por estas serpentes. (CAMPBELL; LAMAR, 1989; FEITOSA; MONTEIRO, 1997; BRASIL, 2001).
1.2O veneno das serpentes
A peçonha consiste em uma complexa mistura de proteínas, peptídeos, lipídios, polissacarídeos e substâncias químicas inorgânicas. Diferenças intra-específicas na composição do veneno são decorrentes de variações geográficas, sexuais, ontogenéticas e sazonais (BRASIL, 2001; MOURA-DA-SILVA et al., 1990 a, 1990b; FURTADO et al.,
1991a, 1991b; CHIPPAUX et al., 1991; ABREU, 2004).
miotoxicidade, ações coagulantes, hemostáticas, hemorrágicas, nefrotóxicas e hepatóxicas (BON, 1997; QUEIROZ et al., 2008) .
Os componentes não protéicos dos venenos podem ser orgânicos ou inorgânicos. Os constituintes inorgânicos conhecidos são cálcio, cobre ferro, potássio, magnésio, manganês, sódio, fósforo, cobalto e zinco (PONCE-SOTO et al., 2006). Porém, nem todos são encontrados em todos os venenos e a quantidade também varia para cada espécie. O papel biológico de cada um desses constituintes inorgânicos não está claro. Alguns estudos sugerem que o cálcio, magnésio e manganês são importantes para a estabilização de certas proteínas, enquanto que outros, em particular o zinco, cobre, ferro e cobalto possivelmente atuam nos mecanismos catalíticos de certos componentes enzimáticos como metaloproteases (BJARNASON; FOX, 1994; AIRD, 2002).
Entre os componentes orgânicos não protéicos encontramos aminoácidos livres e pequenos peptídeos, carboidratos, lipídios, principalmente fosfolipídios e aminas biogênicas (VARANDA; GIANNINI, 1994; QUEIROZ et al., 2008).
Algumas enzimas são encontradas em todas as espécies, como a fosfolipase A2 (BON,
2000). A atividade fosfolipásica é amplamente encontrada nos venenos botrópicos. As serpentes Bothrops jararaca, Bothrops jararacussu e Bothrops atrox apresentam alta atividade fosfolipásica (VIDAL; STOPPANI, 1971; VIDAL et al., 1972; MURAKAMI, 2008). Além da ação hemolítica, enzimas com atividade de fosfolipase A2 apresentam ações
neurotóxicas pré-sinápticas e miotóxicas. (RODRIGUES-SIMIONI et al. , 2004; DURIGON
et al., 2005).
A atividade proteolítica tem sido relacionada a enzimas identificadas como serinas ou metaloproteases. Elas são responsáveis por intensas reações locais, como edema hemorrágico e necrose, ação hemorrágica, promovida pelas hemorraginas ou fatores hemorrágicos, ação coagulante e formação de bradicinina (JURGILAS, 2000).
gerando, assim, um quadro de incoagulabilidade sanguínea por consumo de fibrinogênio (RUSSEL, 1983; FONSECA, 2006).
Neurotoxinas são as toxinas mais amplamente estudadas sendo os constituintes mais tóxicos dos venenos ofídicos. São divididas, de acordo com o sítio de atuação, em pós-sinápticas e pré-pós-sinápticas. As neurotoxinas pós-pós-sinápticas mimetizam a ação do curare. Elas se ligam aos receptores colinérgicos sem provocar despolarização, inibindo a transmissão neuromuscular. Ocorrem nas serpentes da família Elapidae e Viperidae (VITAL BRAZIL, 1980; ZAMUNÉR et al., 2004). As toxinas pré-sinápticas agem possivelmente inibindo o influxo de cálcio, evitando assim a liberação de acetilcolina. Têm letalidade maior que as toxinas pós-sinápticas são estruturalmente relacionadas à fosfolipase A2 e podem agir como
toxinas mionecróticas. Foram encontradas também em serpentes da família Crotalidae como, por exemplo, a crotoxina, isolada da serpente Sul Americana Crotalus durissus terrificus
(HAWGOOD; SANTANA DE SÁ, 1979; BEGHINI et al., 2008). Em estudos comparativos entre as espécies de Bothrops, B. insulares e B. neuwiedi e a espécie Crotalus durissus cascavella demosntraram uma ação pré-sináptica dos venenos botrópicos com graus variados de bloqueio neuromuscular (DA CRUZ-HÖFLING, 2004).
As cardiotoxinas, assim como o fator lítico direto e as cobraminas são todas denominações usadas para toxinas de membrana que causam a despolarização persistente das membranas celulares, excitáveis ou não, acarretando distúrbios celulares como hemólise e citotoxicidade. Foram isoladas de venenos elapídicos, e são responsabilizadas, em associação com fosfolipases, pelas lesões locais como edema e necrose, nos acidentes com “Najas” (REID, 1964; VITAL BRASIL, 1982).
Apesar da complexa mistura de peptídeos ativos e proteínas presentes nos venenos ofídicos Kini e Evans (1992), destacaram a importância de três grupos de proteínas: as proteases, as desintegrinas e as proteínas relacionadas com as lectinas tipo C (CLPs).
As desintegrinas possuem massa molecular variada e são proteínas enzimáticas que inibem a interação entre o fibrinogênio e o complexo glicoprotéico IIb-IIIa da coagulação sanguínea. Apresenta uma seqüência de aminoácidos R-G-D característica, a qual é responsável por sua atividade (MUSIAL et al., 1990).
As proteínas relacionadas com as lectinas tipo C constituem um grupo de proteínas estruturalmente homólogas, mas com funções diversas. Algumas delas exibem atividades lectínicas, outras induzem efeitos anticoagulantes ou efeitos na aglutinação e agregação plaquetária (KINI, 1996).
Estudo dos venenos de serpentes tem propiciado a elucidação de diversos mecanismos farmacológicos, destacando-se a neurotrasnmisão na junção neuromuscular (BORJA et al.,
2002; ZAMUNER et al., 2000), a estrutura e a função dos receptores nicotínicos, (ARAÚJO, 2005) a casacata da coagulação (PINHO, 2001); alterações no sistema cardiorenal ( FERREIRA, 1965; FONTELES et al., 1983; MONTEIRO et al.; 2007).
1.4 Bothrops marajoensis
Bothrops marajoensis, como o nome indica, foi encontrada primeiro na ilha de Marajó, no Pará, e posteriormente em alguns locais litorâneos isolados do Maranhão. Considerada uma espécie do grupo atrox, sua classificação precisa ser revista para uma nova avaliação de seu status. (CAMPBELL; LAMAR, 1989). Estudo com a finalidade de definir variações de parentescos entre espécies do gênero, revelou que a espécie Bothrops atrox
possui variações fenotípicas entre as diversas serpentes do grupo, cuja principal causa está na necessidade de adaptação a ambientes diferentes, refletindo na filogenia das serpentes. Porém, para as populações das serpentes atualmente classificadas como Bothrops marajoensis existe pouca distinção entre esta espécie e Bothrops atrox. (WOLFGANG et al., 1996).
Figura 3 - Imagem da espécie Bothrops marajoensis (seta) em seu habitat natural Fonte: Wolfgang Wuster (2005). Local: Salvaterra, Pará, Ilha de Marajó.
1.5 Características gerais e epidemiológicas dos acidentes Botrópicos
Os acidentes por serpentes peçonhentas representam sérios problemas para a saúde pública, principalmente nos países tropicais, onde a freqüência com que ocorrem é particularmente alta, assim como a mortalidade por eles causada (PINHO; PEREIRA, 2001).
A mortalidade dos acidentados varia nas diferentes regiões do mundo. Na Ásia, principalmente na Índia, Paquistão e Birmânia, ocorre em torno de 25.000 a 35.000 óbitos por ano, sendo uma das serpentes mais importantes a Vipera russelli. Na África ocorrem de 400 a 1.000 mortes por ano e as serpentes que causam maior número de acidentes são espécies do gênero cobra (WOLFGANG et al., 1996).
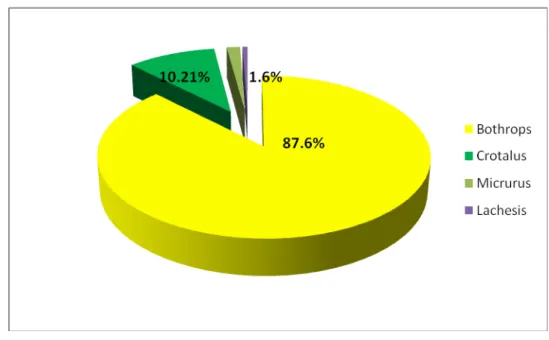
No Ceará existem poucos trabalhos sobre ofidismo. Recente pesquisa realizada sobre os acidentes ofídicos em nosso Estado mostrou que o maior número de casos em humanos era devido às serpentes do gênero Bothrops (ROCHA, 2008) (figura 4).
No período de 2001 a 2007 foram notificados no Ceará, 3877 casos de acidentes por serpentes peçonhentas. Foram mais acometidas as pessoas do sexo masculino (74.2%) e com faixa etária de 21 a 50 anos confirmando a consideração de que este tipo de acidente esta relacionado à atividade agrícola (ROCHA, 2008).
Figura 4 - Distribuição dos acidentes ofídicos segundo o gênero da serpente envolvida. Ceará, Brasil, 2001 a 2007
Fonte: Rocha (2008)
As alterações clínicas decorrentes dos acidentes por serpentes do gênero Bothrops
ocorrem tanto no local da picada como sistêmica. A picada constitui-se em uma inoculação subcutânea ou intramuscular. A distância interposta aos sinais da picada nem sempre se correlaciona com as dimensões da serpente e com a quantidade de veneno inoculada (BRASIL, 2001; FRANÇA, 2003).
Abscesso, celulite e erisipela podem ser observadas na região da picada e resultam em condições propícias ao crescimento de microrganismos, provocados em função da ação inflamatória aguda local somada a contaminação por bactérias da flora bucal das serpentes. Bacilos gram-negativos, agentes anaeróbios (Clostridium sp) e cocos gram-positivos, encontrados na boca das serpentes, têm sido descritos como agentes causadores de infecção (JORGE et al., 1994).
A necrose geralmente se limita ao tecido subcutâneo, mas pode comprometer estruturas mais profundas como tendões, músculos e ossos. O período de instalação é variável, na maioria dos casos, a partir do segundo dia após o acidente. A intensidade e a extensão da necrose estão fortemente relacionadas ao uso de torniquetes e outras intervenções bastante difundidas, porém extremamente prejudicial. A demora ente o acidente e o tratamento soroterápico também podem agravar o caso (FERREIRA et al., 1992; MORENO
et al., 2005).
A síndrome compartimental é uma complicação rara, porém quando ocorre necessita de intervenção rápida. É definida como aumento da pressão dentro de um compartimento fechado, por onde transcorrem músculos, nervos e vasos, comprometendo a circulação sangüínea regional, resultando em anormalidades da função neuromuscular. Os venenos botrópicos propiciam o desenvolvimento da síndrome compartimental por provável processo inflamatório e hemorrágico na região da picada. Localiza-se mais freqüente nos dedos, lateral da perna e regiões dorsal e ventral do antebraço (FRANÇA et al., 2003).
O envenenamento sistêmico humano por serpentes do gênero Bothrops, freqüentemente resulta em incoagulabilidade sanguínea (SANO-MARTINS et al., 1994). Este efeito deve-se, entre outros fatores, à ação de serinoproteases que clivam os fibrinopeptídeos A e B do fibrinogênio promovendo uma depleção dos níveis de fibrinogênio sanguíneo, e não ativa o fator XIII da cascata de coagulação, responsável por promover ligações cruzadas entre os monômeros de fibrina. (MARKLAND, 1998).
Diversas alterações renais já foram descritas como decorrência do envenenamento ofídico. Entre elas podemos citar glomerulonefrite glomerulite e nefrite intersticial (SANT; PUNDARE, 1972), arterite e necrose tubular (SITPRIJA; BOONPUCKNAVIG, 1979), necrose cortical e insuficiência renal (RAAB; KAISER, 1966; HAVT et al., 2005). Entre os demais o mais relatado tem sido a insuficiência renal (BARBOSA, 2006) Ainda foram descritas a ocorrência de hematúria, mioglobinúria, hemoglobinúria e proteinúria (SITPRIJA; BOONPUCKNAVIG, 1979).
Amaral et al. (1985) estudando as alterações renais provocadas em acidentes humanos com as serpentes Bothrops jararaca e Bothrops jararacussu descreveram a ocorrência de necrose cortical sem, contudo, desvendar sua patogênese. Os autores sugeriram então, que a necrose cortical deveria ser causada por coagulação intravascular, ação direta de enzimas proteolíticas no endotélio vascular ou por espasmos nos vasos provocados por substâncias vasoativas.
Sintomatologia neurológica raramente é atribuída aos acidentes causados por serpentes do gênero bothrópico. São poucos os casos clínicos no qual é diagnosticada a presença de alterações nervosas (BOCHENER; STRUCHINER, 2003; MISE, 2007).
1.6 Componentes do veneno do gênero Bothrops
As peçonhas das serpentes do gênero Bothrops podem ser caracterizadas por três atividades fisiopatológicas complexas: Ação proteolítica, mais bem definida como inflamatória aguda, ação coagulante e ação hemorrágica. Diferentes toxinas podem atuar sinergicamente para induzir um efeito, da mesma forma um único tipo de toxina pode ter várias atividades (ROSENFELD, 1971; FRANÇA et al., 2003)
A capacidade de ativar fatores de coagulação sangüínea está relacionada a substâncias capazes de ativar fibrinogênio, protombina e fator X ocasionando o consumo de fibrinogênio e a formação de fibrina, induzindo a incoagulabilidade sangüínea. A trombocitopenia pode ocorrer nas primeiras horas e eventualmente persistir por dias. Existe uma variação na intensidade da atividade coagulante em diferentes espécies e subespécies deste gênero (NAHAS et al., 1979; Da ROCHA; FURTADO, 2005).
A atividade hemorrágica pode ser atribuída as hemorraginas, metaloproteínas que contém zinco. Estão presentes na família Viperidae por provável gene ancestral comum. As hemorraginas possuem capacidade de romper a integridade do endotélio vascular. Degradam vários componentes da matriz extracelular, como colágeno tipo 4, fibronectina e laminina. São potentes inibidoras da agregação plaquetária. Seu possível mecanismo de ação está relacionado à degradação da lâmina basal do endotélio, na microvasculatura, com ruptura completa das células. São descritos fatores hemorrágicos no veneno de Bothrops jararaca, B. neuwiedi e B. moojeni. (ASSAKURA et al., 1986;LOMONTE et al., 1994; KAMIGUTI et al., 1994).
São encontradas também nas peçonhas botrópicas, metaloproteases com função fibrinogenolítica, que geram incoagulabilidade sanguínea assim como as serinoproteases anteriormente citadas. Estas clivam preferencialmente a cadeia A-a do fibrinogênio, seguida da clivagem da cadeia B-b e raramente a cadeia g é hidrolisada (MARKLAND, 1998).
1.6.1 As fosfolipases A2 dos venenos de Bothrops
As fosfolipases A2 constituem uma superfamília de enzimas definidas por catalisar a
hidrólise do éster ligado à posição central (Sn-2) de glicerofosfolipídeo de membranas celulares liberando precursores de mediadores químicos relacionados ao processo inflamatório. (BONFIN et al., 2008).
eicosanóides (prostaglandinas, tromboxano, leucotrienos e lipoxinas) como também da lisogliceril-fosforilcolina, precursor do fator de agregação plaquetária (BONFIN et al., 2008).
Nas peçonhas de serpentes as fosfolipases exercem atividades como: miotoxicidade, indução da agregação plaquetária, efeitos hemolíticos indiretos, edematogenicidade e efeitos anticoagulantes (KINI; EVANS, 1992).
No veneno botrópico podem ser encontrados diversos tipos de fosfolipases com atividades variadas: neurotoxidade, miotoxidade, cardiotoxidade, citotoxidade, proinflamatória, coagulante e agregante de plaqueta. Muitas são dependentes de cálcio para atuar Na classificação geral das enzimas fosfolipases das serpentes as miotoxinas foram as primeiras a serem identificadas (SAI-NGAM, 2008).
As miotoxinas fosfolipasicas foram classificadas quanto à presença ou ausência de atividade neurotóxica. Há uma homologia estrutural constante em cada grupo. As que não apresentam atividade neurotóxica possuem uma clara distinção das que contém o acido aspártico na posição 49 “Asp49” e as com resíduo de lisina na mesma posição “Lys49”. As “Asp 49” são as clássicas fosfolipases que catalisam a hidrólise do éster ligado a posição Sn2
do glicerofosfolipídeo. A Lys49 é dita como uma variante, também denominada PLA2 (PLA2 símile), por serem estruturalmente semelhantes, mas destituída de atividade enzimática, contendo lisina na posição do ácido aspártico. Uma variante serina ocupando a posição 49 Ser49 também é destituída de atividade enzimática (LOMONTE; ÂNGULO; CALDERÓN, 2003). As características destas duas formas, inativas, impedem a liberação do ácido graxo produzido após a liberação do fosfolipídeo, interrompendo o ciclo catalítico. Contudo, o efeito mionecrótico ocorre por uma via catalítica independente de atividade enzimática. In vivo esta ação é acompanhada por edema, hiperalgesia, liberação de citocinas proinflamatórias como a interleucina 6 , além de atividade letal quando injetada por via endovenosa ou intraperitoneal em camundongos (LOMONTE; ÂNGULO;CALDERÓN, 2003).
composição do veneno seja maior, tendo uma participação central na produção da lesão e destruição tissular causando a mionecrose (MOURA - DA-SILVA et al., 1991; LOMONTE; ÂNGULO; CALDERON, 2003; TRENTO, 2001).
As fosfolipases com ação neurotóxica estão presentes na família dos elapídeos, responsável pelo efeito letal destas serpentes, agindo na junção neuromuscular, em doses muito baixas, com atividade pré-sináptica, podendo gerar lesões na musculatura esquelética em doses também inferiores (1 a 2 μg) No veneno crotálico a crotoxina, principal componente tóxico do veneno, também é classificada como uma fosfolipase neurotóxica (PAHARI et al., 2007).
Nos venenos de algumas serpentes do gênero botrópico têm sido isoladas e caracterizadas as ações neurotóxicas de fosfolipases: Bothrops neuwiedi, (ZAMUNER, 1996)
Bothrops insulares (GOGO, 1998).
1.6.2 As lectinas dos venenos de Bothrops
As lectinas são definidas como proteínas com afinidade específica para moléculas de carboidratos, reconhecidas pela sua capacidade de aglutinar células (ÂNGULO; LOMONTE, 2008).
As lectinas de origem animal foram classificadas, inicialmente, quanto a necessidade de cálcio para atuar (lectinas cálcio dependente). Atualmente são reconhecidas as dependentes do radical sulfidril (lectinas tipo S) sendo a maioria específica para radical β-galactosídeos (DRICKAMER, 1993). Lectinas tipo C, que perderam a capacidade de se ligar a carboidratos são encontradas somente nos venenos das serpentes. São denominadas proteínas símiles e são metaloproteases com sua cadeia leve homóloga às lectinas específicas para galactose. Possuem ação contra fatores da coagulação, inibição da agregação plaquetária, e da trombina (JEBALI et al., 2009).
No gênero bothrops foram isoladas lectinas de varias espécies: B. jararaca
al., 2005); B. jararacussu (KASSAB et al., 2004). B insulares (GUIMARÃES et al. , 2004),
B pirajai ( HAVT et al, 2005).
1.7 O veneno do gênero Bothrops e suas atividades nos sistemas fisiológicos
1.7.1 Toxicidade cardiovascular associada ao veneno Botrópico
As alterações cardiovasculares são descritas no veneno de diversas espécies do gênero botrópico. O veneno dos viperideos, principalmente do gênero Bothrops, apresentam em sua composição toxinas que deprimem a atividade cardíaca (RICARDO, 2008; SIFUENTES et al., 2008).
A bradicinina foi detectada no plasma de animais após a adição de veneno da serpente
Bothrops jararaca. Esta descoberta fez parte de um estudo continuado, iniciado por Rocha e Silva, em 1939, sobre choque circulatório, enzimas proteolíticas e sua relação com a toxinologia das picadas por serpentes peçonhentas. A descoberta da bradicinina possibilitou que, Sérgio Henrique Ferreira, um dos colaboradores de Rocha e Silva na Faculdade de Medicina de Ribeirão Preto, descobrisse um "fator potencializador da bradicinina" no veneno botrópico, que aumentava intensamente a duração e a potência de seus efeitos vasodilatadores, com conseqüente redução da pressão arterial (ROCHA e SILVA et al., 1949; FERREIRA,1965; FERREIRA, 1992).
Diversos estudos descrevem as ações pressóricas do veneno do gênero Bothrops
(FERREIRA , 1965; BRAGA, 2006; SILVA, 2008). As frações obtidas do veneno bruto das serpentes do gênero também demonstram ação no sistema cardiovascular.
Comparando-se a atividade funcional entre fosfolipases A2 isoladas do veneno de
Bothrops jararacussu observou-se que somente um tipo apresentava atividade hipotensora (MARCUSSI et al., 2003).
de atividade hipotensora (PANUNTO et al., 2006). Da mesma forma o veneno bruto de
Bothrops insulares no mesmo tipo de preparação mostrou uma redução da pressão arterial sistêmica sem alterações significantes na freqüência cardíaca e respiratória (BRAGA et al.,
2006).
A avaliação das alterações eletrocardiográficas em ofidismo é pouco explorada. Múltiplos fatores influentes podem estar estabelecidos no paciente antes do acidente com a peçonha (cardiopatia prévia, distúrbios hidroeletrolíticos, drogas, entre outras), interferindo nas análises eletrocardiográficas. Uma análise do comprometimento cardíaco em acidentes botrópicos humano mostrou alterações eletrocardiográficas sugestivas de comprometimento miocárdico. As principais descritas foram: alteração difusa da repolarização ventricular, isquemia subepicárdica e bloqueio de condução (HERDOÍZA, et al., 1983).
1.6.4 Nefrotoxicidade associada ao veneno Botrópico
A insuficiência renal aguda tem sido relatada como a causa mais freqüente de mortes causadas por serpentes do gênero Bothrops. Diversas pesquisas descrevem a ação nefrotóxica induzida pelo veneno das serpentes do gênero. Estes efeitos renais podem estar associados a ações de miotoxinas, lectinas e fosfolipases, dentre outros constituintes do veneno bruto das espécies (BARBOSA et al., 2006; HAVT et al., 2005; BRAGA et al., 2006).
Estudos isolados sobre os venenos de Bothrops jararacuçu e Bothrops moojeni ambas nas doses de (3, 10 e 30 μg / mL) usando a preparação de perfusão em rim isolado de ratos, mostraram alterações semelhantes: uma diminuição na pressão de perfusão e na resistência vascular renal com aumento na taxa de filtração de glomerular e o fluxo urinário. O transporte tubular (sódio e potássio) também foi diminuído (HAVT, 2001; BARBOSA, 2002).
A análise de dois tipos de miotoxinas de Bothrops moojeni (Miotoxina I -Bmtx-I e Miotoxina II-BmtxII) demonstrou que a primeira possuía ação semelhante ao veneno bruto no sistema de perfusão renal, porém Miotoxina II não apresentava nenhum efeito fisiológico renal, com exceção de uma diminuição no transporte de potássio. Esta inabilidade aparente de Bmtx-II em induzir o efeito renal poderia ser explicada pela ausência da lisina C-terminal. Avaliando o efeito da Bmtx-I em vasos da microcirculação através da perfusão em leito vascular mesentérico, não demonstrou efeitos significativos, sugerindo que as alterações de pressão de perfusão e resistência renal não aconteciam por efeitos diretos na vasculatura renal (BARBOSA, 2006).
Alterações renais induzidas pelo veneno bruto de Bothrops pirajai e uma lectina (lectina tipo-C) no ensaio de perfusão renal em ratos mostrou que ambos geravam reduções na pressão de perfusão, resistência vascular renal, fluxo urinário, taxa de filtração de glomerular e transporte de sódio, potássio, observando que os principais efeitos renais eram devidos a ação da lectina (HAVT et al., 2005).
Boer et al. (2002) verificaram a presença de uma atividade proteolítica do veneno de
1.7.2 Neurotoxicidade associada ao veneno Botrópico
As serpentes do gênero Bothrops apresentam toxicidade menor se comparada a outros gêneros peçonhentos, como o crotálico, porém seu veneno é capaz de deixar seqüelas locais visíveis, geralmente não neutralizadas de modo eficiente pelos antivenenos, ainda que seja administrado logo após o acidente (BEGHINI et al., 2005).
A ação neurotóxica pré-sináptica é bem estabelecida para os gêneros de serpentes
Crotalus e Micrurus (BUSH; SIEDENBURG, 1999). Historicamente considerou-se que venenos botrópicos só possuíam ação pós-sináptica e efeitos miotóxicos. Porém, alguns estudos também sugerem uma ação pré-sináptica para estes venenos. Bothrops neuwiedi está relacionada entre as espécies do gênero com atividade neurotóxica mais bem relatada. (ZAMUNER et al., 1996; BORJA et al., 2002; RODRIGUES-SIMIONI et al., 2004).
Atividades neurotóxica e miotóxica de venenos de Bothrops neuwiedi, provenientes de regiões diferentes do Brasil mostraram um bloqueio neuromuscular irreversível; 15 dos 16 lotes de veneno estudado não aboliram respostas a acetilcolina (110µM) a baixas concentrações (10-20 µg / ml.), mas bloquearam respostas a KCI (13.4mM). Nas concentrações de 5-20 µg / ml, o veneno mais ativo bloqueou a contração sem respostas significantes para acetilcolina e KCI, sugerindo uma ação pré-sináptica. Porém nem todas as subespécies de B. Bothrops neuwiedi apresentaram atividade neurotóxica significante em preparações de músculo isolado (BORJA et al., 2002).
Um estudo comparativo dos efeitos do veneno bruto de três subespécies de Bothrops neuwiedi: B.n.goyazensis, B.n.paranaensis e B.n.diporus sobre a junção neuromuscular de ave (músculo biventer cervicis) e de mamífero (nervo frênico-diafragma de camundongo), demonstrou atividade maior em preparações de mamífero. Na concentração de 50 μg a 37ºC, na preparação de ave, o veneno de B.n.goyazensis exibiu maior atividade. No entanto, a 22ºC, o veneno de B.n.diporus exibiu maior atividade, demonstrando que esses venenos atuam de maneira diferenciada sobre a junção neuromuscular. (ABREU, 2004)
se que o efeito neurotóxico induzido pelo veneno de B. n. pauloensis está relacionado à presença de PLA2s miotóxicas. (RODRIGUES-SIMIONI et al., 2004; DURIGON et al., 2005).
Rodrigues-Simioni et al. (2004), avaliando as ações pré-sinápticas de venenos de
Bothrops (B. insularis e B. neuwiedi) demonstraram que venenos botrópicos podem conter componentes que agem presinapticamente, com semelhanças com o complexo crotoxina,
Ação do veneno de Bothrops lanceolatus (espécie encontrada na Ilha da Martinica, América Central) foi avaliada na junção neuromuscular e no músculo esquelético de camundongos, a uma dose pré-estabelecida de 20 µg/ml na qual induziu aumento inicial das contrações musculares e o aparecimento de contrações espontâneas (efeitos pré-sinápticos) seguido por bloqueio neuromuscular de 70 % em 182,6 ± 15,7 min. A Neostigmina e a 4- aminopiridina antagonizaram o bloqueio produzido pelo veneno, nessa preparação, sendo que com a Neostigmina o antagonismo foi parcial (64,4% ± 9,2). Utilizando-se a estimulação elétrica direta, o veneno na dose estudada não alterou a amplitude da resposta contrátil, confirmando que sua ação provavelmente se dá na junção neuromuscular e não nas fibras musculares da preparação. Nas preparações de diafragma cronicamente desnervado de camundongos, a contratura induzida pela adição de acetilcolina foi inibida pelo veneno, sugerindo uma ação nos receptores colinérgicos nicotínicos pós-sinápticos. Embora esse veneno tenha apresentado tanto efeitos pré como pós-sinápticos, nos experimentos "in vitro", com a dose estudada, os efeitos pós-sinápticos são mais evidentes (ARAÚJO, 2008).
O peptídeo potencializador de bradicinina BPPs isolado do veneno da serpente
2. JUSTIFICATIVA
O veneno extraído das glândulas das serpentes tem propiciado a descoberta de diversos mecanismos farmacológicos, além de apresentar uma diversidade de substâncias com potenciais a serem desvendados. Devido à alta especialização e características peculiares de cada grupo, têm sido alvo para descoberta de substância ativas para medicina,
O gênero Bothrops possui algumas das espécies mais importantes do ponto de vista médico, tanto pela porcentagem predominante dos acidentes ofídicos registrados quanto pelo seu potencial farmacológico.
Apesar de compor um dos gêneros mais importantes e bastante estudados na família dos viperídeos, Bothrops marajoensis é uma espécie ainda pouco conhecida. São escassos os estudos com relação a sua biologia e a toxinologia do seu veneno e frações. (WOLFGANG et al., 1996).
Santos et al. (2004), demonstraram atividade nucleotídica do veneno bruto de
Bothrops marajoensis sobre DNA de esperma de salmão. Recentemente, TORRES, et al., 2008 descreveram sua capacidade em inibir o crescimento de bactérias, especialmente da bactéria gram-positiva S. aureus, mas não apresentou qualquer inibição sobre as cepas de E. coli, C. albicans e P. aeruginosa. Galbiatti (2006) isolou deste veneno uma fosfolipase A2
com atividades miotóxica e neurotóxica, porém não quantificaram essa ação.
3.OBJETIVOS
3.1 Objetivo geral
O objetivo geral do nosso trabalho foi avaliar a toxicidade cardio-renal e neural, do veneno da serpente Bothrops marajoensis e de suas frações.
3.2 Objetivos específicos
Avaliar a toxicidade cardiovascular induzida pelo veneno de Bothrops marajoensis
através de alterações eletrocardiográficas e na pressão arterial de ratos, submetidos à administração do veneno e suas frações.
Analisar o efeito do veneno no sistema de perfusão de coração isolado e de átrio isolado.
Avaliar a ação do venenoem vasos de resistência através da perfusão em leito vascular mesentérico.
Avaliar a nefrotoxicidade induzida pelo veneno bruto de Bothrops marajoensis e suas frações (PLA 2 e lectina) no sistema de perfusão renal de rato.
Avaliar a neurotoxicidadeinduzida pelo veneno bruto de Bothrops marajoensis e suas frações na junção neuromuscular esquelética através de preparação do nervo frênico-diafragma de camundongo.
Analisar os efeitos na neurotransmissão autonômica in vitro das alterações induzidas pelo veneno e suas frações (PLA 2 e lectina)
4 MATERIAL E MÉTODOS
4.1 Animais experimentais
Ratos Wistar machos pesando entre 250 e 300g ou camundongos 30 a 35 g oriundos do biotério da Unidade de Pesquisas Clínicas da Universidade Federal do Ceará. Os animais foram mantidos em jejum por 12 horas antes do experimento com água “ad libitum”. Foram seguidos todos os protocolos éticos de pesquisa com animais.
4.2 Procedimentos com o veneno de Bothrops marajoensis
O veneno de Bothrops marajoensis e suas frações foram gentilmente cedidos pelo professor Marcus Hikari Toyama, da Universidade Estadual Paulista Júlio de Mesquita Filho (Campus do Litoral Paulista, São Vicente) (UNESP), para realização dos ensaios biológicos.
Inicialmente o veneno foi liofilizado.As purificações das frações do veneno de foram realizadas utilizando uma combinação de filtração em gel Shephadex e cromatografia de fase reversa (HPLC) com reagentes da Sigma Aldrich Chemical, Waters, Applied Biosystem, Pierce and Bio Rad, conforme descrito por Toyama et al. (1995).
4.3 Avaliação da toxicidade Cardiovascular
4.3.1 Pressão Arterial
jugular externa com o propósito de injetar as substâncias testes e os padrões. Os registros das experiências foram realizados com transdutores P23 Statham (Gould, Oxnard, CA, EUA) acoplados a um polígrafo Narco BioSystems (4-DMB, Houston, TX, EUA). Antes do início das experiências procedeu-se à calibração do instrumento utilizado como padrão um manômetro de mercúrio numa escala de 50 a 250 mmHg.
A pressão arterial média foi calculada segundo a equação: PAM: PD + (PS – PD)/3 Onde PAM – Pressão arterial média; PD – pressão diastólica; PS – Pressão sistólica. O veneno bruto de Bothrops marajoensis foi testado nas doses de 0.3, 1, 3,10,30 , 100 e 300 μ g/kg, e observada sua resposta pressora. Em outro grupo, para avaliar se efeitos hipotensores obtidos eram oriundos de reflexo do tipo Bezöld-Jarisch por ação do veneno em quimioceptores ventriculares, realizou-se o mesmo procedimento, em animais atropinizados (1µg/kg de atropina). O procedimento foi realizado até que um bloqueio positivo fosse obtido, ou seja, 80% ou mais de diminuição da resposta ao agonista. O veneno de Bothrops marajoensis foi utilizado na dose de 100μ g/kg, e observada sua resposta pressora.
Também se avaliou no mesmo sistema a ação de duas fosfolipases, miotoxinas básicas, e uma lectina isoladas do veneno bruto de Bothrops marajoensis.
4.3.2 Perfusão de Coração Isolado (LANGENDORFF, 1898)
Ratos machos, Wistar, pesando entre 250 e 350 g após submetidos a anestesia com pentobarbital sódico(50mg/kg), foram decapitados 20 minutos após heparinização (500UI/kg). O tórax foi aberto e o coração banhado com solução perfusora. A aorta foi canulada acima da válvula aórtica e assim iniciada a perfusão retrógrada com a solução de Krebs-Henseleit tamponada com bicarbonato. O pH da solução foi ajustado para 7,4 e equilibrado com 95% O2 – 5% CO2 a uma temperatura de 37° C. A concentração final de sais no tampão foi de (g/l): NaCl 6.7, NaHCO3 2.1, KCl 0.37, KH2PO4 0.17, MgSO4 H2O 0.144,
CaCl2 H2O0.154, e glicose 0.65.
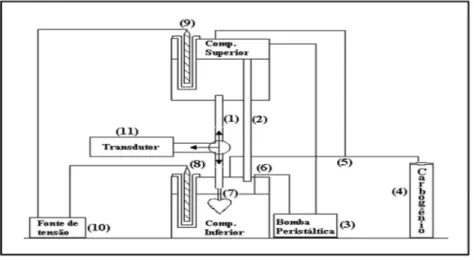
e ritmo cardíaco foram acompanhados através do registro contínuo das contrações espontâneas. O coração foi perfundido por meio de uma bomba peristáltica (Watson-Marlow) e o fluxo de perfusão mantido em 12 ml/min (figura 5). O veneno bruto de Bothrops marajoensis foi utilizado nas doses de 0.3, 1, 3,10 e 30μ g/ml.
Figura 5 - Figura esquemática do sistema de perfusão cardíaca em ratos
Nota: Ao centro compartimentos interligados por mangueira de perfusão (1); (2) mangueira lateral; (3) mangueira peristáltica, (4) cilindro de carbogênio; (5) mangueira para condução do carbogênio; (6) mangueira para circulação da solução; (7) cânula para aorta; (8) e (9) resistência; (10) fonte de tensão; (11) transdutor de pressão
Fonte: Colugnati et al. (2005)
4.3.3 Átrio isolado (VAN ROSSUM, 1963)
O tecido foi obtido de ratos machos, Wistar, pesando entre 300 e 350 g após submetidos a anestesia com pentobarbital sódico (50mg/kg), os átrios direitos foram incisados, montados verticalmente em banhos com capacidade de 5 ml e superfundidos com solução de Krebs-Henseleit (pH 7.4) mantido a uma temperatura de 37° C e aerado com carbogênio. A concentração final de sais no tampão foi de (g/l): NaCl 6.7, NaHCO3 2.1, KCl
0.37, KH2PO4 0.17, MgSO4 H2O 0.144, CaCl2 H2O 0.154, e glicose 0.65. As peças isoladas
15 min, antes da execução do experimento. O veneno bruto de Bothrops marajoensis foi utilizado nas doses de 0.3, 1, 3,10 e 30 μ g/ml.
4.3.4 Atividade eletrocardiográfica
Ratos Wistar, machos, pesando de 250-300 g foram submetidos a jejum de 24 horas , anestesiados com pentobarbital sódico (50 mg/kg) e submetidos à avaliação eletrocardiográfica.
Os animais foram mantidos em decúbito dorsal e canulada veia jugular para injeção do veneno. Eletrodos bipolares foram implantados subcutaneamente (derivação II), acoplados a um aparelho eletrocardiográfico (EKA-8 Burdick) de registro de pena. O registro foi realizado antes, após a administração de salina e após administração do veneno 100µg/ kg.
A análise do registro foi feita pela observação da duração dos intervalos dos segmentos, Q-T e P-R e análise qualitativa.
4.3.5 Perfusão em leito vascular mesentérico
O mesentério foi perfundido em sistema aberto (figura 6 ) com solução de Krebs contendo: 114.0mM de NaCl; 4.96mM de KCl; 1.24mM de KH2PO4; 0.5mM ode
MgSO4.7H2O; 24.99mM de NaHCO3; 2.10mM de CaCl2.2H2O; e 3.60mM de glicose. A
vasodilatação foi expressa com percentual de queda em relação ao incremento pressórico induzido por fenilefrina (considerado como 100%).
Figura 6 - Desenho esquemático do sistema de perfusão de leito vascular mesentérico Fonte: Braga (2006)
4.4 Avaliação da nefrotoxicidade
4.4.1 Perfusão renal
Ratos Wistar machos, pesando entre 250-350g foram anestesiados com pentobarbital sódico (50 mg/Kg) e preparados para nefrectomia. Injetou-se 3ml de manitol a 20 % na veia femural, com intuito de melhorar o acesso cirúrgico ao ureter. Após anti-sepsia do abdômen, realizou-se a incisão com base na linha Alba, o ureter foi isolado e canulado com tubo de polietileno (PE50), a artéria renal foi canulada e a mesentérica superior ocluída em seu lado
direito e pinçado no seu lado esquerdo. Com pequeno corte em seu tecido introduzimos a cânula por 3 a 5 mm e fixou-se a cânula à artéria. Logo a seguir, o órgão foi isolado com pinças e seccionado, promovendo a retirada do rim e ureter.
Os rins foram perfundidos com a solução de Krebs-Henseleit modificada, contendo albumina bovina 6g%: NaCl 138g, KCl 7g, NaH2PO4 . H2O 3,2g, MgSO4. 7 H2O 5,8g e
NaHCO3 = 4,2g, CaCl2 . 2 H2O = 0,74g, glicose = 2g, e penicilina G potássica cristalina =
0,05g. Em seguida, o volume foi completado para 2000mL com água bidestilada. Foi retirado 300mL desta solução, na qual foi adicionada albumina bovina (6g%). Em seguida, solução com albumina foi dialisada, com objetivo de retirar substâncias contaminantes. Nos demais grupos foram utilizados os mesmos procedimentos do grupo controle até os 30 minutos de perfusão, após este período foi adicionado em 100 ml da solução, contendo o veneno ou suas as frações liofilizadas (diluídos em 1 ml de solução salina 0,9%) e adicionadas ao sistema, ficando com a dosagem final de 0.03,0.3 e 3µg/ml.
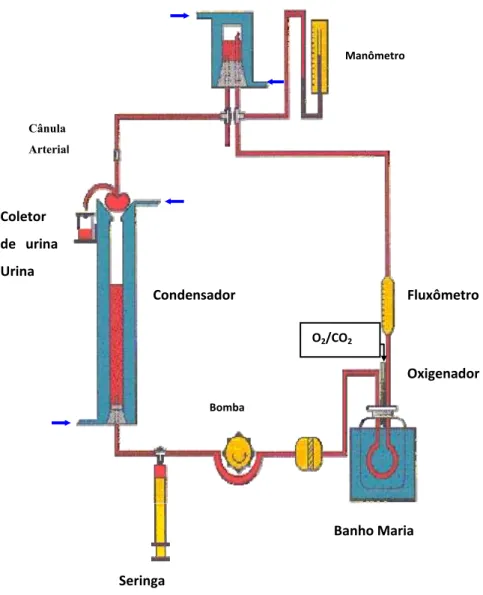
Figura 7 - Representação gráfica do sistema de perfusão de rim isolado com recirculação
Fluxômetro
Seringa
Oxigenador
Manômetro
Cânula Arterial
Coletor
de urina
Urina
Condensador
O2/CO2
Bomba
Os experimentos foram iniciados após a adaptação do órgão ao sistema de perfusão num tempo de aproximadamente 20 minutos. O tempo total de perfusão do órgão foi de 120 minutos. Durante esse período, foram observados as medidas do fluxo e pressão de perfusão.
4.4.1.1 Avaliação bioquímica de perfusatos e urinas
Foram realizados testes bioquímicos de dosagem de sódio e potássio, pelo método de fotometria de chama (Flame photometer - modelo 443IL). As dosagens de cloro foram realizadas seguindo o método descrito pelo kit do fabricante Labtest. A inulina foi dosada a partir do mesmo material, através de hidrólise direta. Finalmente foi medida a osmolaridade das amostras com um osmômetro (vapor Pressur osmometer - modelo 5100c ESCOR). Todas as análises bioquímicas foram realizadas na Unidade de Pesquisas Clínicas da Universidade Federal do Ceará.
4.4.1.2 Cálculo dos parâmetros funcionais renais
Foram utilizadas as seguintes fórmulas para determinação dos parâmetros funcionais renais :
1. FU (mL.g-1. min-1) = Fluxo urinário FU = (Peso do volume urinário / Peso do rim esquerdo) x 10 (admitiu-se que a urina possui a mesma densidade da água)
2. PP (mmHg) = Pressão de perfusão. Leitura em manômetro
3. RFG (mL.g-1.min-1) = Ritmo de filtração glomerular RFG = (DOU in / DOP in x FU) onde DOU in = densidade ótica da inulina na urina e DOP in = densidade ótica da inulina no perfusato
4. FPR (mL.g-1.min-1) = Fluxo de perfusão renal (registrado a cada 10 min/peso do rim/intervalo de tempo)
5. RVR (mmHg/mL.g-¹.min-1) = Resistência vascular renal RVR = PP (mmHg) / FPR 6. FNa+= (μEq.g-1. min-1) = Sódio filtrado FNa+ = RFG x PNa+ (PNa+= Concentração de sódio no perfusato)
8. TNa+= (μEq.g-1. min-1) = Sódio transportado TNa+ = FNa+ - ENa+ 9. %TNa+ = Percentual de sódio transportado%TNa+ = TNa+ x 100 / FNa+
10.Cosm (mL.g-1.min-1) = Clearance osmótico [Uosm / Posm] x FU (onde Uosm = Osmolaridade urinária e Posm = Osmolaridade do perfusato)
11. FK+ (μEq.g-1. min-1) = Potássio filtrado FK+ = RFG x PK+ (PK+ = concentração de potássio no perfusato)
12. EK+ (μEq.g-1. min-1) = Potássio excretado EK+ = FU x UK+ (UK+ = Concentração de potássio na urina)
13. TK+ (μEq.g-1. min-1) = Potássio transportado TK+ = FK+ x EK+
14. %TK+ (μEq.g-1. min-1) = Percentual de potássio transportado %TK+ = TK+ x 100 / FK+
15. TCl – (μEq.g-1. min-1) = Cloro transportado TCl – = FCl – x ECl –
16. % TCl – (μEq.g-1. min-1) = Percentual de cloro transportado % TCl – = TCl – x 100 / F TCl –
4.5 Avaliação da neurotoxicidade
4.5.1 NervoFrênico de Diafragma de ratos (BULBRING, 1946)
Ratos machos, Wistar, pesando entre 250 e 350 g depois de submetidos à anestesia com pentobarbital sódico (50mg/kg) ,foram intubados para ventilação mecânica e submetidos a cirurgia para excisão do hemidiafragma e nervo frênico (Bülbring, 1946). Após incisão da linha Alba a cavidade torácica, nervo frênico foi isolado com auxílio de uma pinça de vidro, da inserção no diafragma até a base do coração. O hemidiafragma esquerdo e o nervo frênico foram isolados e montados em banhos para registro isométrico. Após estabilização em solução de Krebs-Henseleit (pH da solução ajustado para 7,4 e equilibrado com 95% O2 – 5% CO2 a uma temperatura de 37° C) e concentração final de sais no tampão de (mmol/l):
NaCl 113.8, NaHCO3 22.0, KCl 4.7, KH2PO4 1.2, MgSO 7 H2O 1.1, CaCl2 2 H2O 2.5, e
4.5.2Canal deferente de camundongos
Camundongos swiss albinos, machos, pesando de 30-35 g foram sacrificados por deslocamento cervical. Realizou-se incisão abdominal média com dissecação de ambos os canais deferentes a partir da cauda do epidídimo até a próstata. Um segmento de aproximadamente 1 cm de comprimento, livre de tecido adiposo, foi retirado de cada porção prostática. Ambos os fragmentos foram montados verticalmente em banhos isométricos sob tensão de 0.25g em cuba orgânica de 5 ml de volume contento solução de Krebs-Henseleit livre de Mg2+, com pH 7.4, com seguinte composição: NaCl 118 mM, KCL 4.75 mM, CaCl2
54Mm, KH2POH4 0,93mM, NaHCO3 24mM, Glicose 11mM, EDTA 0,027mM. e ácido
ascórbico 0,1 mM. O meio foi mantido a 37 °C e aerado com 95% O2 e 5% CO2. Os tecidos
foram submetidos por campo elétrico transmural 20V, 0,4Hz e 0,5ms.
O veneno bruto de Bothrops marajoensis e suas frações PLA2 (tipo 1 e tipo 2) e lectina
foram testados de forma isolada, nas doses de (10ng a 30µg/ ml) adicionados de forma crescente. As fosfolipases também foram analisadas associadas para avaliar um possível efeito sinérgico. Em outro ensaio Ioimbina (10µM) foi adicionada ao banho na resposta máxima do efeito causado pelo veneno. Num terceiro experimento avaliou-se a possibilidade de efeito pós-sináptico através da contração obtida por noradrenalina (NA; 10µM), ATP (30 µM) ou carbacol (Cch; 10 μM) em Krebs normal e enriquecido com guanetidina 10µM e fentolamina 100µM.
4.6 Análises estatísticas
4.7 Aspectos éticos
5 RESULTADOS
5.1 Avaliação da toxicidade Cardiovascular
5.1.1 Pressão Arterial
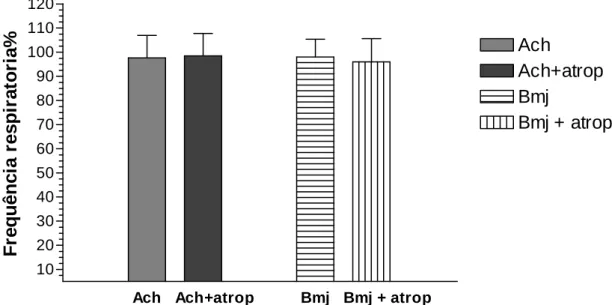
A resposta pressora do veneno bruto de Bothrops marajoensis utilizando as doses de 1, 3, 10, 30, 100 μg/kg, demonstrou uma diminuição da pressão arterial média (100 μg/kg, 31,6 ±5,3 mmHg) e da freqüência cardíaca (100 μg/kg, 66,9 ± 5,4 bpm), sem alterações significativas na freqüência respiratória (figuras 8, 9 e 10 respectivamente). Os mesmos experimentos realizados em ratos atropinizados (1µg/kg de atropina) demonstraram a permanência da queda pressórica (figura11) e da freqüência cardíaca (figura12). A variação da pressão arterial média com veneno foi de -73,9 ± 15,6 mmHg; dose de 100 μg/kg e em ratos atropinizados -72,9± 11,7 mmHg, na mesma dose. A freqüência cardíaca registrada na maior dose do veneno bruto (100 μg/kg) foi de 66,9 ±15 bpm e 67,7±17 bpm nos animais atropinizados. Não houve alteração na freqüência respiratória nos ratos atropinizados (97,9 ± 9,6 mim veneno bruto, com atropina 98.3% ±7.4 mim) (figura13).
As respostas pressóricas obtidas com a administração de duas fosfolipases (PLA2 tipo
1 e tipo 2) isoladas do veneno bruto de Bothrops marajoensis demonstraram que ambas reduziram a pressão arterial média (figuras 14 e 17) e a freqüência cardíaca (figuras 15 e 18), sem alterações significativas na freqüência respiratória (figuras 16 e 19). Porém a fosfolipase tipo1 demonstrou uma ação depressora mais intensa tanto na freqüência cardíaca (100 μg/kg, 65 ± 5 b.p.m) como na pressão arterial média (100 μg/kg ,30,3 ± 3,4 mmHg) quando compara a fosfolipase tipo 2 (300 μg/kg ,45,4 ± 5,4 mmHg; 76,8 ±5,4 b.p.m). A adição das duas fosfolipases no mesmo ensaio não demonstrou ação sinérgica ou aditiva.
A administração de uma lectina extraída do veneno bruto de Bothrops marajoensis