Universidade de Trás-os-Montes e Alto Douro
Avaliação do efeito analgésico da buprenorfina adicionada à
bupivacaína em bloqueios dos nervos ciático e femoral no período
peri-operatório
Dissertação de Mestrado em Medicina Veterinária
Filipa Orquídea Rodrigues Pereira
Orientador: Professor Doutor Luís Miguel Joaquim Marques Antunes
Co-Orientador: Dr. Pedro Olivério Monteiro Sanches Pinto
Universidade de Trás-os-Montes e Alto Douro
Avaliação do efeito analgésico da buprenorfina adicionada à
bupivacaína em bloqueios dos nervos ciático e femoral no período
peri-operatório
Dissertação de Mestrado em Medicina Veterinária
Filipa Orquídea Rodrigues Pereira
Orientador: Professor Doutor Luís Miguel Joaquim Marques Antunes
Co-Orientador: Dr. Pedro Olivério Monteiro Sanches Pinto
Composição do Júri:
___________________________________________ ___________________________________________ ___________________________________________
vi
“Divinum est opus sedare dolorem”
(Divino é o trabalho de aliviar a dor)
viii
Esta tese de mestrado foi redigida segundo o novo acordo ortográfico
Todas as doutrinas apresentadas são da exclusiva responsabilidade do autor
x
RESUMO
Este estudo teve como principal objetivo investigar o efeito analgésico adicional da buprenorfina, associada à bupivacaína, em bloqueios dos nervos ciático e femoral, efetuados por neuroestimulação, em cirurgias no membro pélvico de cães.
A amostra do estudo foi constituída por 6 animais, ASA I, aleatoriamente distribuídos em dois grupos: grupo controlo (BPN – Bloqueio de Nervo Periférico) e o grupo de estudo (BNP-CB – Bloqueio de Nervo Periférico com Buprenorfina). Todos os animais foram pré-medicados com meloxicam (0,2mg/kg SC), sedados com morfina (0,2mg/kg IM) e acepromazina (0,025mg/kg IM). A indução realizou-se com propofol (2-4 mg/kg IV) e a manutenção da anestesia efetuou-se com isoflurano. No grupo controlo, BNP, os bloqueios dos nervos periféricos foram apenas efectuados com bupivacaína (1mg/Kg); no grupo de estudo, BNP-CB, foi adicionada à bupivacaína (1mg/Kg) buprenorfina (0,01mg/kg).
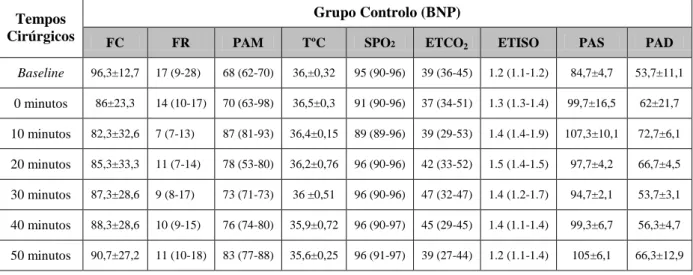
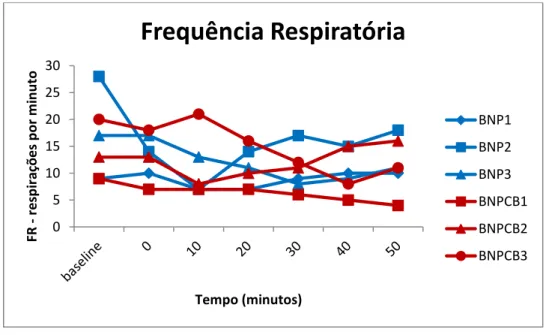
No intra-operatório foram registados, a cada 10 minutos, a frequência cardíaca (FC), frequência respiratória (FR), temperatura corporal em graus Celcius (TºC), saturação periférica de hemoglobina (SpO2), pressão arterial sistólica (PAS), diastólica (PAD) e média (PAM) e os valores no final da expiração de CO2 (ETCO2) e de isoflurano(ETISO).
A avaliação da dor animal foi efetuada utilizando a escala composta de dor de Glasgow (forma abreviada) e registada no pré-operatório, no momento imediatamente antes da pré-medicação e no pós-operatório, às 0, 2, 4, 6, 8, 12 e 24 horas após extubação.
Os dados que apresentaram normalidade e homogeneidade de variâncias foram comparados entre grupos usando o teste paramétrico t-student, os que não cumpriam os pressupostos foram submetidos a um teste não paramétrico, o teste Wilcoxon-Mann-Witney.
Os resultados observados neste trabalho são insuficientes para sugerir que a adição de buprenorfina, na dose total de 0,01mg/kg, à bupivacaína, em bloqueios dos nervos ciático e femoral, tenha efeitos benéficos e com relevância clínica no peri-operatório. O número reduzido de animais estudados e a variação inter-individual justificam estes resultados. Em conclusão, são necessários mais estudos, com uma maior amostra, para se determinar os potenciais efeitos clínicos da adição deste opióide aos anestésicos locais em bloqueios de nervos periféricos em cães.
Palavras-chave: Buprenorfina, analgesia, bupivacaína, bloqueio do nervo ciático e femoral, dor
xii
ABSTRACT
This study was aimed to investigate the additional analgesic effect of buprenorphine when added to bupivacaine for sciatic and femoral nerve block, performed by neurostimulation, in orthopedic surgery to the pelvic limb of dogs.
The study sample was comprised of 6 dogs, ASA I, randomly divided into two groups, control group (BNP – Peripheral nerve block) and study group (BNP-CB – Peripheral nerve block with buprenorphine).
All animals were premedicated with meloxicam (0.2 mg / kg SC) sedated with morphine (0.2 mg / kg IM) and acepromazine (0.025 mg / kg IM). The induction was performed with propofol (2-4 mg / kg IV) and maintenance of anesthesia was made with isoflurane. In the control group, BNP, the peripheral nerve blocks were performed only with bupivacaine (1mg/kg); in the study group, BNP-CB, they were made adding buprenorphine (0,01mg/kg) to bupivacaine (1mg/kg).
During the intraoperative period, values of heart rate (HR), respiratory rate (RR), body temperature – degrees Celsius (TºC), saturation of peripheral oxygen (SpO2), systolic, diastolic and mean arterial pressures (SAP, DAP, MAP) and end expiratory values of CO2 (ETCO2) and isoflurane (ETISO) were recorded every 10 minutes.
Animal post-operative pain was assessed using a composite scale of pain from Glasgow (short form), and recorded preoperatively, at the time immediately before premedication and postoperatively at 0, 2, 4, 6, 8, 12 and 24 hours after extubation. Results were compared between groups.
The data showing normality and homogeneity of variance were analyzed using parametric t-student test; those who did not meet the assumptions were subjected to a nonparametric test, the Wilcoxon-Mann-Whitney.
Based on the obtained results, this study was insufficient to suggest a clinical perioperative benefit in the addition of buprenorphine (0.01 mg / kg) to bupivacaine, in femoral and sciatic nerves blocks. The small number of animals studied and inter-individual variation justify these results. Further studies in dogs, using a larger sample, are needed to determine the effects of this opioid addiction to local anesthetics in peripheral nerve blocks.
xiv
ÍNDICE
PREÂMBULO ... 1
I. INTRODUÇÃO ... 3
1. Revisão bibliográfica ... 3 1.1. Definição de dor ... 3 1.2. Fisiopatologia da dor ... 4 1.2.1. Sensibilização periférica ... 6 1.2.2. Sensibilização central ... 6 1.3. Classificação da Dor ... 71.3.1. Dor fisiológica (primeira dor) ... 7
1.3.2. Dor patológica (segunda dor) ... 8
1.3.3. Dor visceral ... 8 1.3.4. Dor somática ... 8 1.3.5. Dor neuropática... 9 1.4 Avaliação da dor ... 9 1.4.1. A dor e o stress ... 9 1.4.2. Indicadores fisiológicos ... 10 1.4.3. Indicadores comportamentais ... 10 1.4.4. Escalas de dor ... 10
1.4.4.1. Tipos de escala de dor ... 10
1.4.4.1.1. Escalas de dor subjetivas e semi-objetivas ... 10
1.4.4.1.1.1. Sistema de Gradação Preditiva (PSS) ... 10
1.4.4.1.1.2. Escala Visual Analógica (VAS) ... 11
1.4.4.1.1.3. Escala Descritiva Simples (SDS) ... 11
1.4.4.1.1.4. Escala de Pontuação Numérica (NRS) ... 11
xv
1.4.4.1.2.1. Escala de dor da Universidade de Melbourne (UMPS) ... 11
1.4.4.1.3. Escalas de Resposta Comportamental ... 12
1.4.4.1.3.1. Escala Composta de Dor de Glasgow (GCMPS) ... 12
1.4.4.1.3.2. Escala Composta de Dor de Glasgow – Forma Abreviada (GCMPS-SF) ... 12
1.4.4.1.3.3. Escala de Dor da Universidade de Colorado ... 12
1.5. Terapêutica analgésica ... 13
1.5.1. Opióides ... 14
1.5.1.1. Morfina ... 15
1.5.1.2. Buprenorfina ... 16
1.5.2. Anti- inflamatórios não esteroides (AINE’S) ... 17
1.5.3. α2- Agonistas ... 17
1.5.4. Antagonistas do recetor N-metil-D-aspartato (NMDA)... 18
1.5.5. Anestésicos locais ... 18
1.4.5.1. Bupivacaína ... 19
1.6. Anestesia regional ... 19
1.6.1.Bloqueio dos nervos periféricos ... 20
1.6.1.2. Uso de adjuvantes opióides ... 20
II. MATERIAL E MÉTODOS ... 23
2.1. Animais ... 23
2.2. Procedimento Anestésico ... 23
2.2.1. Bloqueio do nervo femoral ... 24
2.2.2. Bloqueio do nervo ciático ... 24
2.2.3. Fluidoterapia e manutenção anestésica ... 25
2.2.4. Diferença entre grupos ... 25
2.2.5. Plano anestésico ... 26
2.2.6. Avaliação analgésica ... 26
xvi
2.2.8. Outras considerações ... 27
2.3. Tratamento estatístico ... 28
III. RESULTADOS ... 31
3.1. Grupos ... 31
3.2. Dados referentes ao período intra-operatório ... 32
3.3. Resgastes analgésicos no intraoperatório ... 40
3.4. Avaliação da dor pela GCMPS-SF ... 40
3.5. Resgastes analgésicos no pós-operatório ... 41
IV. DISCUSSÃO E CONCLUSÃO ... 43
xviii
ÍNDICE DE FIGURAS, GRÁFICOS E TABELAS
Figura 1 – Representação esquemática dos processos fisiológicos para o reconhecimento da dor ... 4 Figura 2 – Diferenciação entre os estímulos periféricos de alta e de baixa intensidade realizada pelos diferentes tipos de nociceptores. ... 5 Figura 3 – Hiperexcitabilidade do sistema nervoso, envolvendo mudanças tanto a nível periférico como central, em que estímulos de baixa intensidade passam a induzir dor - Dor patológica. ... 7 Figura 4 – Representação esquemática do delineamento experimental . ... 28
Gráfico 1 – Frequência cardíaca (FC), registada no período intraoperatório do estudo, para cada animal. ... 34 Gráfico 2 – Frequência cardíaca (FC) média e desvios-padrões no período intraoperatório do estudo, para cada grupo. ... 34 Gráfico 3 – Frequência respiratória (FR) registada no período intraoperatório do estudo, para cada animal. ... 35 Gráfico 4 – Mediana da frequência respiratória (FR) e intervalos de confiança de 95% registados no período intraoperatório do estudo, para cada grupo. ... 35 Gráfico 5 – Pressão Arterial Média (PAM), registada no período intraoperatório do estudo, para cada animal. ... 36 Gráfico 6 – Mediana da Pressão Arterial Média (PAM) e intervalos de confiança de 95% registados no período intraoperatório do estudo, para cada grupo. ... 36 Gráfico 7 – Temperatura corporal (TºC) registada no período intraoperatório do estudo, para cada animal. ... 37 Gráfico 8 – Temperatura corporal (TºC) média e desvios-padrões registados no período intraoperatório do estudo, para cada grupo. ... 37 Gráfico 9 – Saturação periférica de hemoglobina (SPO2) registada no período intraoperatório do estudo, para cada animal. ... 38 Gráfico 10 – Mediana da Saturação periférica de hemoglobina (SPO2) e intervalos de confiança de 95% registados no período intraoperatório do estudo, para cada grupo. ... 38
xix
Gráfico 11 – Valor de CO2 no final da expiração (ETCO2) registado ao longo do período intraoperatório do estudo, para cada animal. ... 39 Gráfico 12 – Mediana do Valor de CO2 no final da expiração (ETCO2) e intervalos de confiança de 95% registados no período intraoperatório do estudo, para cada grupo. ... 39 Gráfico 13 – Valor de isoflurano no final da expiração (ETISO) registado no período intraoperatório do estudo, para cada animal. ... 40 Gráfico 14 – Comparação entre as medianas (intervalos de confiança de 95%) da pontuação da escala composta de dor de Glasgow – forma abreviada (GCMPS-SF) entre o grupo sujeito a bloqueio dos nervos periféricos sem buprenorfina (BNP) e o grupo sujeito a bloqueio dos nervos periféricos com buprenorfina (BNP-CB) ... 41
Tabela 1 – Classificação dos receptores opióides e as suas principais funções. ... 14 Tabela 2 – Identificação de cada animal incluído no Grupo controlo, sujeito a bloqueio do nervo periférico sem buprenorfina (BNP). ... 31 Tabela 3 – Identificação de cada animal incluído no Grupo sujeito a bloqueio dos nervos periféricos com buprenorfina (BNP-CB). ... 32 Tabela 4 – Registo individual dos dados do intraoperatório do grupo controlo, grupo sujeito a bloqueio dos nervos periféricos sem buprenorfina (BNP) ... 33 Tabela 5 – Registo individual dos dados no período intraoperatório do grupo em estudo, grupo sujeito a bloqueio dos nervos periférico com buprenorfina (BNP-CB). ... 33
xx
AGRADECIMENTOS
Antes de mais gostaria de agradecer a todos os professores que me acompanharam na minha formação académica e me possibilitaram chegar até aqui.
Gostaria de agradecer ao Professor Doutor Luís Antunes, que me orientou nesta tese, dando-me todo o apoio para que esta se realizasse. Agradeço ainda a paciência e o tempo para a revisão cuidada desta dissertação.
Ao meu co-orientador de estágio, Dr. Pedro Olivério que me ofereceu a oportunidade de realizar este tema de trabalho, assim como pelos seus ensinamentos, disponibilidade e amizade ao longo do estágio, o meu muito obrigada.
Gostaria de agradecer ao Professor Doutor Bruno Colaço pela disponibilidade que demonstrou e pela orientação na parte estatística deste trabalho.
A toda a equipa do Hospital Veterinário do Baixo Vouga por me terem acolhido de uma forma extraordinária e por terem tornado o meu estágio inesquecível. Obrigada Dr. Artur Alves, Dra Sónia Miranda, Dr. José Miguel Campos, Dr. Hugo Vilhena, Dr. Pedro Moreira, Dra Inês Fonseca, Dr. João Neves, Dra Mariana, Dra Raquel, Daniela, Luciana, Nuno, Cátia, Lyubov, Graça, Daniel e Liliana foram todos excepcionais.
Um obrigada aos meus companheiros de estágio, Vanessa, Inês, Júlia, Luiza, Bruno Lopes, Mariana, André, Filipa, Nési e Bruno Silva por todos os momentos de companheirismo que passamos e por me terem sempre ajudado na componente prática com os animais.
Obrigada a todos os meus amigos, em especial à Ana, à Cláudia, à Ermelinda e ao Luís porque não há palavras para descrever a vossa amizade.
Um obrigada especial ao Ricardo por estar sempre presente e por me dar força para ser cada vez melhor.
Por fim, quero agradecer à minha família, principalmente às minhas irmãs e aos meus pais pelo amor e apoio incondicional, tornando possível a realização desta tese. Em especial à minha mãe pela sua compreensão, encorajamento, paciência e amizade que sempre demonstrou durante toda a minha vida.
A todos os que não mencionei, mas que direta ou indiretamente me ajudaram na concretização deste trabalho, o meu muito obrigada.
xxii
L
ISTA DE SIGLAS E ABREVIATURAS
AAHA – The American Animal Hospital Association AINE – Anti-inflamatório não esteroide
AINES – Anti-inflamatórios não esteroides
ASA I – Estado de paciente classificado como American Society of Anesthesiology I – animal saudável
BNP – Bloqueio de nervo periférico – Grupo Controlo
BNP-CB – Bloqueio de nervo periférico com buprenorfina – Grupo de estudo CO2 – Dióxido de Carbono
COX – Ciclooxigenase
ETISO – End-tidal de isoflurano (valor expirado de isoflurano) FC – Frequência Cardíaca
FR – Frequência Respiratória
GABA – Gamma-Amino-Butyric Acid
GCMPS – Glasgow Composite Measurement Pain Scale (Escala Composta de Dor de Glasgow)
GCMPS-SF –Glasgow Composite Measurement Pain Scale – Short Form (Escala Composta de Dor de Glasgow- Forma Abreviada)
HVBV – Hospital Veterinário do Baixo Vouga
IASP – International Association for the Study of Pain (Associação internacional para o estudo da dor)
IM – Via Intramuscular IV – Via Intravenosa
MAC - Concentração alveolar mínima NC – Nervo Ciático
NF – Nervo Femoral
NMDA – N-metil D- Aspartato
NRS – Numeric Rating Scale (Escala de Pontuação numérica) PAM – Pressão arterial média
PD – Pressão diastólica PS – Pressão sistólica
xxiii
PSS – Preemptive Scoring System (Sistema de Gradação Preditiva) SDS – Simple Descritive Scale (Escala Descritiva Simples)
SNC – Sistema Nervoso Central SNP – Sistema Nervoso Periférico SPO2 – Saturação parcial de oxigénio
UMPS – University of Melbourne Pain Scale (Escala de Dor da Universidade de Melbourne) VAS – Visual Analog Scale (Escala Visual Análoga)
1
PREÂMBULO
O presente trabalho de dissertação de mestrado integrado em Medicina Veterinária foi elaborado com base no estágio curricular ministrado pela Universidade de Trás os Montes e Alto Douro. O estágio desenvolveu-se no Hospital Veterinário do Baixo Vouga, ao longo de seis meses, entre o dia 1 de Setembro de 2012 e o dia 28 de Fevereiro de 2013, na área de Clínica de Animais de Companhia.
Semanalmente realizou rotações entre os serviços de consultas, internamento, imagiologia, cirurgia e anestesia. Acompanhou e auxiliou os médicos veterinários em consulta de medicina preventiva, medicina geral e de subespecialidades. As atividades desenvolvidas no internamento incluíram a realização de exames físicos diários, monitorização dos animais internados, cateterizações, administração de fármacos, colheita de sangue e outras amostras biológicas para análise, transfusões sanguíneas e, ainda, realização de exames complementares de diagnóstico (hemograma, bioquímicas, urianálise, raio-x, eletrocardiograma, ecografia e endoscopia). Relativamente à cirurgia, ajudou nas preparações pré-cirúrgicas assim como nas diversas cirurgias.
Quanto à anestesia, em todo o peri-operatório do doente: auxiliou nos diferentes protocolos anestésicos para diferentes patologias, na monotorização anestésica intra-operatória (electrocardiograma, pressão arterial, temperatura, oximetria de pulso e capnografia) e no recobro pós-cirúrgico, sempre com supervisão de um clínico responsável.
Contatou diariamente com um vasto número de casos clínicos o que permitiu a consolidação de conhecimentos académicos, fomentando o raciocínio de diagnóstico e o desenvolvimento de competências práticas.
Assistiu e participou em várias ações de formação relativas a diversas áreas da Medicina Veterinária. Essas ações de formação foram realizadas tanto pelos Médicos Veterinários como pelos próprios estagiários.
Teve oportunidade de apresentar um poster clínico no IX Congresso do Hospital Veterinário Montenegro, intitulado “Bloqueio paravertebral do plexo braquial com neuroestimulação para amputação de membro torácico num gato“. (Anexo H).
O contacto com profissionais excepcionais, num hospital com condições e equipamentos muitas vezes inacessíveis a grande parte dos hospitais ou clínicas veterinárias, tornou este estágio muito gratificante.
3
I. INTRODUÇÃO
1. Revisão bibliográfica
Reconhecer quando um animal está com dor e como trata-la de forma adequada são dois dos principais desafios com que os Médicos Veterinários são constantemente defrontados (Dugdale, 2010).
O protocolo analgésico peri-operatório tem um impacto sobre o bem-estar do doente e o seu efeito estende-se muitas vezes para além do período anestésico imediato (Hellyer, P. W.
et al., 2007; Muir, William W III, 2009).
Antes de apresentar o estudo experimental que suporta esta tese de mestrado, torna-se importante realizar uma breve revisão bibliográfica sobre a patofisiologia da dor, a avaliação da dor animal e os analgésicos mais utilizados.
1.1. Definição de dor
A dor é atualmente descrita, pela Associação Internacional para o Estudo da Dor, como uma “experiência sensorial e emocional desagradável associada a uma lesão tecidular real ou potencial”(IASP, 2011). Embora esta definição diga respeito ao Homem é também utilizada como referência para a dor animal. Desde 2001, há uma nota explicativa para esta definição, que afirma que a incapacidade de comunicar não nega a possibilidade de um indivíduo estar a sentir dor e precisar de tratamento adequado para o seu alívio (Dugdale, 2010). Em 2003, a dor foi considerada pela American Animal Hospital Association (AAHA), o quarto sinal vital, junto com a temperatura, pulso e frequência respiratória (Hellyer, P. W. et
al., 2007).
A dor surge a partir da ativação de um conjunto distinto de recetores e vias neuronais, por estímulos nocivos potencialmente prejudiciais para os tecidos. Ocorre em diferentes graus de severidade e resulta em lesão, doença ou stress emocional. Manifesta-se por mudanças biológicas, comportamentais ou ambas. É uma experiência subjetiva acompanhada por sentimentos de medo, ansiedade e pânico (Hellyer, P. W. et al., 2007).
4 1.2. Fisiopatologia da dor
Para os anestesistas é essencial uma compreensão dos processos fisiológicos que conduzem à perceção da dor e às respostas dos animais a esse processo, sendo a base para que uma boa abordagem analgésica seja possível.
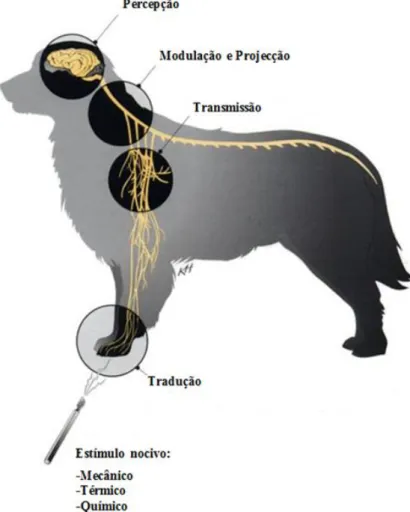
O componente fisiológico da dor é denominado de nocicepção. Embora definido como a resposta neuronal a um estímulo nocivo externo, similar em todos os mamíferos, existem variações individuais em cada espécie (Lemke, 2004). A nocicepção compreende processos de transdução, transmissão, modulação, projeção e percepção (Muir, William W III, 2009).
Figura 1 – Representação esquemática dos processos fisiológicos para o reconhecimento da dor (adaptado de
Tranquilli 2004)
Transdução – tradução de estímulos sensoriais (químicos, mecânicos e térmicos) em estímulos elétricos por parte de nociceptores específicos.
5
Transmissão – condução dos potenciais de ação até ao corno dorsal da medula espinhal, através de diferentes tipos de fibras aferentes (Figura 2) (Lemke e Creighton, 2010; Muir, William W III, 2009).
Modulação – ao atingirem a medula espinhal, os impulsos nervosos podem ser amplificados ou suprimidos (Muir, William W III, 2009).
Projeção – a informação modulada é posteriormente transportada para o cérebro através de axónios que se projetam do corno dorsal da medula até ao cérebro (Muir, William W III, 2009).
Perceção – integração, processamento e reconhecimento de toda a informação sensorial. Estes processos ocorrem em diferentes áreas do cérebro, que comunicam entre si através de interneurónios, cujo objetivo é produzirem uma resposta integrada e coordenada (Muir, William W III, 2009).
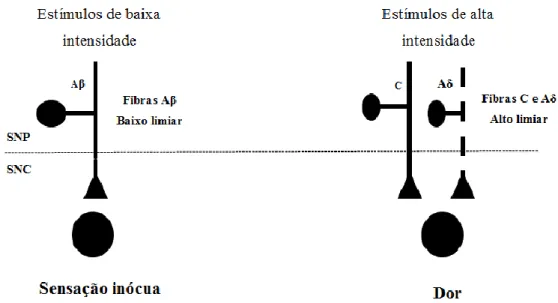
Figura 2 – Diferenciação entre os estímulos periféricos de alta e de baixa intensidade realizada pelos diferentes
tipos de nociceptores, adaptado de (Woolf e Chong, 1993); Fibras Aβ – mielinizadas, conduzem estímulos de natureza mecânica (táctil, pressão); Fibras Aδ – espessas e levemente mielinizadas, conduzem estímulos de natureza mecânica e térmica e estão associadas à transmissão da “primeira dor”; Fibras C – finas e não mielinizadas, conduzem estímulos polimodais e estão associadas à transmissão da “segunda dor” (Lamont, L. A. e Tranquilli, 2000); SNP – Sistema Nervoso Periférico; SNC – Sistema Nervoso Central.
A informação nociceptiva ocorre entre neurônios através de mediadores químicos (neurotransmissores), que são produzidos, armazenados e libertados pelas terminações dos nervos aferentes e pelos neurônios do corno dorsal (Hellyer, P. W. et al., 2007; Lemke, 2004).
6 1.2.1. Sensibilização periférica
A sensibilização periférica ocorre como consequência direta da lesão tecidual ou da inflamação. A lesão tecidular leva à libertação de mediadores inflamatórios ao nível das células lesadas, do plasma, das plaquetas, dos mastócitos e dos macrófagos. Alguns destes mediadores inflamatórios ativam diretamente os neurónios nociceptores ou sensibilizam-nos, levando à libertação da substância P e outros neuropéptidos. A sua libertação conduz à desgranulação dos mastócitos, à vasodilatação e ao edema, o que vai intensificar a ativação e sensibilização dos nociceptores, estabelecendo-se assim um ciclo vicioso. Terminações nervosas simpáticas também contribuem para a ativação e sensibilização destes terminais nervosos, através da libertação de noradrenalina e prostaglandinas. (Lemke e Creighton, 2010). Todos estes compostos de uma forma sinérgica formam uma “sopa sensibilizadora”, que, juntamente com o ciclo vicioso gerado, condicionam uma diminuição do limiar de excitabilidade das fibras Aδ e C e ativam nociceptores silenciosos, amplificando a resposta à dor. Ocorre desta forma a hiperalgesia primária (sensibilidade aumentada a um estimulo doloroso no local da lesão) (Lemke e Creighton, 2010; Muir, William W III, 2009).
1.2.2. Sensibilização central
A sensibilização central ocorre como consequência indireta da lesão tecidular ou da inflamação e depende do grau de sensibilização periférica. A constante ativação dos receptores no corno dorsal da medula leva a uma progressiva despolarização celular e à ativação de diferentes tipos de recetores. Quando o processo inflamatório continua por alguns dias, ocorre a ativação de genes reguladores de proteínas, novos tipos de receptores são expressos o que leva a uma maior reatividade dos neurónios de projeção a qualquer estimulação nociceptiva. Ocorre assim o fenómeno denominado por “wind-up”, contribuindo também para o desenvolvimento da sensibilização central a longo prazo (Lemke e Creighton, 2010).
A sensibilização dos neurónios do corno dorsal da medula pode durar horas, sendo responsável pela hiperalgesia secundária (maior sensibilidade em áreas vizinhas não submetidas a lesão) e alodínia (resposta a estímulos normalmente não dolorosos) devido á diminuição do limiar de excitabilidade e angariação de novos recetores sensitivos, nomeadamente fibras tipo Aβ, que até então respondiam apenas a sensações inócuas (Lamont, L. A. e Tranquilli, 2000).
7
Pode concluir-se assim que a dor (aguda ou crónica) pode provocar uma série de mudanças, como um resultado direto de modificações a nível do sistema nervoso periférico (através da diminuição do limiar de excitabilidade dos nociceptores) e central (devido ao aumento da resposta dos neurónios espinais à informação nociceptiva) resultando numa hipersensibilidade aos estímulos nocivos (Muir, William W III, 2009) (Figura 3). São estas as vias nociceptivas responsáveis pelo desenvolvimento da dor patológica (Lemke, 2004).
Figura 3 – Hiperexcitabilidade do sistema nervoso, envolvendo mudanças tanto a nível periférico como central,
em que estímulos de baixa intensidade passam a induzir dor - Dor patológica (adaptado de Woolf and Chong 1993); SNP – Sistema Nervoso Periférico; SNC – Sistema Nervoso Central.
1.3. Classificação da Dor
Existem várias abordagens para a classificação da dor. Segundo (Coutinho, 2012), o fenómeno da dor é vulgarmente classificado em: dor fisiológica, patológica, visceral, somática ou neuropática;
1.3.1. Dor fisiológica (primeira dor)
A dor fisiológica é frequentemente referida como dor nociceptiva, porque depende da ativação de receptores periféricos de alto limiar de ação (nociceptores) por excesso de pressão, calor, frio ou produtos químicos. A dor fisiológica é o tipo de dor que o animal sente quando é pisado, picado ou quando entra em contato com uma entidade potencialmente prejudicial (Muir, William W III, 2009), sendo extremamente localizada e geralmente
8
transitória. Tem uma função biológica, na medida em que alerta o corpo de perigo potencial ou dano tecidual, levando a mudanças de comportamento para autoproteção (Hellyer, P. W. et
al., 2007; Lorenz et al., 2011; Muir, William W III, 2009) incitando o reflexo de fuga e o
comportamento de “luta ou fuga” (Lorenz et al., 2011). A intensidade da dor é altamente correlacionada com a resposta reflexa de retirada (Muir, William W III, 2009).
1.3.2. Dor patológica (segunda dor)
A dor patológica deve ser classificada numa perspetiva temporal em dor aguda e dor crónica (Lamont, L. A. e Tranquilli, 2000).
A dor aguda, na maioria dos casos, tem origem na inflamação ou trauma de tecidos moles. Através da hipersensibilização da área afetada, ou dos tecidos próximos, a dor aguda provoca no indivíduo um afastamento a estímulos externos (Lamont, L. A. e Tranquilli, 2000) levando ao descanso ou ao desuso e facilitando a recuperação tecidular (Muir, William W III, 2009).
A dor crónica, definida como tendo uma duração superior de 3 a 6 meses, pode manifestar-se de forma espontânea ou ser provocada por vários estímulos externos. A dor crónica é normalmente exagerada em duração e/ou amplitude (Lamont, L. A. e Tranquilli, 2000). Este tipo de dor não exerce nenhuma função biológica vantajosa, sendo debilitante, prejudicial e comprometedora da qualidade de vida do animal (Hellyer, P. W. et al., 2007; Lorenz et al., 2011; Muir, William W III, 2009)
1.3.3. Dor visceral
A dor visceral é uma dor difusa, ambígua e de difícil localização (Lemke e Creighton, 2010; Michael J Hudspith, 2006). Os estímulos aferentes detetados pelos nociceptores viscerais são transmitidos por fibras Aδ e C através do sistema nervoso autónomo (via simpática e parassimpática). Por esta razão, a maioria dos estímulos considerados dolorosos, não são percebidos como dor, mas inflamação generalizada. Contudo situações de isquemia ou dilatação provocam uma dor severa associada à componente simpática (taquipneia, taquicardia) (Muir, William W III, 2009).
1.3.4. Dor somática
A dor somática pode ser dividida em profunda e superficial. A dor somática profunda advém da estimulação de nociceptores presentes em ligamentos, tendões, ossos, vasos
9
sanguíneos, fáscia e músculos; caracteriza-se por ser difusa e com uma localização pouco definida. A dor somática superficial advém da ativação de nociceptores presentes na pele ou outro tecido superficial e caracteriza-se pela sua localização exata e lancinante (Lorenz et al., 2011).
1.3.5. Dor neuropática
A dor neuropática resulta da doença e disfunção do sistema nervoso, tanto periférico como central, e apresenta uma anormal transmissão de informação nociceptiva, que se desenvolveu como resultado da lesão (Lorenz et al., 2011).
Este tipo de dor é descrita como tendo a perceção maior que o estímulo nocivo aparente (Lorenz et al., 2011). Pode incluir dor espontânea, parestesia, distesia, alodinia e hiperpatia (Lerche, 2009).
1.4 Avaliação da dor
Nos humanos, o Gold standard para avaliação da dor é a comunicação verbal com o doente, infelizmente isso não é possível entre veterinários e animais (Mathews, 2000).
Assim, relativamente à avaliação da dor, todos os métodos são categóricos, subjetivos e sujeitos a erros de sobrevalorização ou subvalorização do grau de dor (Mich e Hellyer, 2009).
1.4.1. A dor e o stress
O stress é a resposta biológica criada quando a homeostase do animal é ameaçada ou interrompida. A dor, aguda ou crónica, é capaz de produzir stress e quando severa, pode ser responsável por profundas mudanças comportamentais. Mesmo sem um estímulo verdadeiramente doloroso, os factores de um ambiente hospitalar (meio ambiente, ruído, contenção) podem levar a um estado de ansiedade ou medo que sensibiliza e amplifica a resposta ao stress a um estímulo doloroso (Muir, William W. III 2009b).
A resposta fisiológica ao stress pode ocorrer a vários níveis, nomeadamente a nível neuroendócrino, metabólico, morfológico, imunológico e hematológico (Muir, William W. III 2009b).
10 1.4.2. Indicadores fisiológicos
Os parâmetros fisiológicos são úteis na avaliação da resposta a um estímulo nocivo quando o animal se encontra anestesiado ou em períodos conscientes transitórios. Quanto maior o período consciente que um animal experimenta um estímulo doloroso, menor é a utilidade dos parâmetros fisiológicos na avaliação do grau de dor (Mich e Hellyer, 2009).
1.4.3. Indicadores comportamentais
Relativamente aos comportamentos exibidos num animal com dor, é importante salientar, que estes vão depender de muitos fatores, incluindo a espécie, idade, raça, sexo, personalidade, severidade e duração da dor (Muir, William W. III e Gaynor, 2009).
Apesar de existirem certos comportamentos e posturas corporais que se associam mais à dor, nenhum é patognomónico da mesma. O animal por si só tem um comportamento diferente em casa quando comparado a um ambiente estranho (Muir, William W. III e Gaynor, 2009). Aliás, como um mecanismo inato de proteção, alguns animais expressam comportamentos mínimos demostrativos de dor, de modo a evitar que um potencial predador o reconheça como uma presa fácil (Dugdale, 2010; Muir, William W. III e Gaynor, 2009; Shaffran, 2008).
No cão, os parâmetros comportamentais mais indicativos de dor no cão estão referidos no Anexo A.
As escalas de dor desenvolvidas, apesar de também elas subjetivas vieram auxiliar os profissionais de saúde (Mich e Hellyer, 2009).
1.4.4. Escalas de dor
Principalmente concebidas para a avaliação da dor aguda pós-operatória e traumática em cães, auxiliam na orientação do tratamento analgésico e fornecem informações de diagnóstico/prognóstico da resolução da lesão tecidual. Garantem uma avaliação da dor mais constante, evitando que esta passe mais facilmente despercebida ou sub-tratada.
Independentemente da escala utilizada para avaliar a dor, é fundamental reconhecer as limitações de cada uma e a finalidade para a qual foi desenvolvida (Mich e Hellyer, 2009).
1.4.4.1. Tipos de escala de dor
1.4.4.1.1. Escalas de dor subjetivas e semi-objetivas 1.4.4.1.1.1. Sistema de Gradação Preditiva (PSS)
11
Esta escala consiste em prever o grau de dor a que o animal é submetido consoante o tipo de procedimento cirúrgico ou pela quantidade de tecido lesado (sem dor, ligeira/mínima, moderada ou grave). Esta é uma escala simples, útil para o planeamento da analgesia pós-operatória, no entanto não determina a resposta à analgesia estabelecida (Mich e Hellyer, 2009).
1.4.4.1.1.2. Escala Visual Analógica (VAS)
Esta escala é um sistema semi-objetivo utilizado para quantificar a intensidade da dor. Consiste em uma linha reta horizontal, com 100mm de comprimento, em que o zero corresponde á ausência de dor e o 100 ao máximo de dor possível (Mathews, 2000). Em Medicina Veterinária o observador desenha uma linha vertical no local em que acha mais próximo da dor experimentada pelo animal. Com o uso desta escala pode haver uma variabilidade inter-observador com a possibilidade de uma sobrevalorização ou subvalorização da dor (Mich e Hellyer, 2009).
1.4.4.1.1.3. Escala Descritiva Simples (SDS)
A escala descritiva simples é uma escala semi-objetiva, consiste em 4 ou 5 categorias com descrições da intensidade da dor, a cada descrição é atribuído um número que corresponde ao nível de dor. De fácil utilização, é um método pouco sensível devido ao seu reduzido número de categorias, sendo influenciada pelo observador (Mich e Hellyer, 2009).
1.4.4.1.1.4. Escala de Pontuação Numérica (NRS)
A escala de pontuação numérica consiste em várias categorias de definições descritivas de dor às quais são atribuídas pontuações. No período pós-operatório, a NRS pode demonstrar-se insensível para detectar diferenças entre animais que receberam analgesia dos que não receberam. Apenas são reconhecidos comportamentos de dor mais intensos, típicos de dor pós- cirúrgica, não sendo sensível a alterações comportamentais resultantes da ação residual da anestesia ou a dor diferente origem (Mich e Hellyer, 2009).
1.4.4.1.2. Escalas de Resposta Comportamental e Fisiológica 1.4.4.1.2.1. Escala de dor da Universidade de Melbourne (UMPS)
A escala de dor da Universidade de Melbourne é uma escala desenhada especificamente para a avaliação pós-cirúrgica em cães. Possui uma maior precisão
12
relativamente a VAS, SDS e à NRS. A avaliação de vários fatores aumenta a sua especificidade e a avaliação das mudanças comportamentais ou de atitude contribuí para essa sensibilidade. Como desvantagens, a UMPS pode não ser suficientemente sensível para detetar pequenas mudanças de comportamento. Exige que o observador conheça o estado mental normal do animal antes da cirurgia, sendo a sua validação ainda limitada (Mich e Hellyer, 2009).
1.4.4.1.3. Escalas de Resposta Comportamental
1.4.4.1.3.1. Escala Composta de Dor de Glasgow (GCMPS)
A escala composta de dor de Glasgow é uma escala com 47 descrições agrupadas em 7 categorias. Os termos utilizados para a descrição da dor foram reduzidos a palavras específicas e expressões. Está validada por métodos estatísticos e foi testada quanto à sua validade, sensibilidade e fiabilidade (Morton et al., 2005). A variabilidade por parte do observador está mais limitada, uma vez que estes só verificam a presença ou ausência de determinado comportamento. Embora de utilização simples, uma vez que os dados fisiológicos não estão incluídos, carece de um sistema de pontuação que permite determinar a evolução do paciente ao longo do tempo (Mich e Hellyer, 2009).
1.4.4.1.3.2. Escala Composta de Dor de Glasgow – Forma Abreviada (GCMPS-SF)
A escala composta de dor de Glasgow na sua forma abreviada resulta de uma modificação da GCMPS, tornando mais fácil a sua aplicação num ambiente clínico. Tem como principal vantagem a inclusão de um sistema de pontuação (Mich e Hellyer, 2009). É constituída por 6 categorias, sendo a pontuação máxima de dor 24 (ou 20 se a mobilidade é impossível de avaliar) (Reid et al., 2007). A intervenção analgésica está recomendada quando a pontuação total de dor atinge os 6 em 24 (ou 5 em 20) (Dugdale, 2010; Reid et al., 2007). Esta escala torna-se uma ferramenta auxiliar na tomada de decisões relacionadas com cães com dor aguda (Mich e Hellyer, 2009) daí ser a escolhida para este trabalho científico.
1.4.4.1.3.3. Escala de Dor da Universidade de Colorado
A escala de dor da Universidade de Colorado é de fácil empregabilidade, com a possibilidade de utilização em cães e gatos. A interpretação subjetiva por parte do observador é mais reduzida, contudo ainda não existem estudos clínicos que permitam a sua validação. Além disso, a sua utilização está muito limitada à dor aguda (Mich e Hellyer, 2009).
13 1.5. Terapêutica analgésica
A compreensão das condições subjacentes que podem resultar em dor prepara melhor o médico veterinário para antecipar e potencialmente intervir ou modular o desenvolvimento da dor, evitando situações potencialmente piores para o animal (Hellyer, P. et al., 2007). Atualmente, não deve ser tolerável que um procedimento cirúrgico seja o agente etiológico de dor persistente num animal (Dyson, 2008). Contudo, uma verdadeira analgesia (ausência da sensação de dor) nem sempre é conseguida, por isso os métodos utilizados resultam muitas vezes numa hipoalgesia (redução da sensação de dor para um nível mais tolerável) (Dugdale, 2010)
Os avanços no campo da anestesia veterinária provaram que uma abordagem multimodal, com a utilização de fármacos de várias categorias para atingir o resultado de anestesia e analgesia desejado, é preferido á utilização de um único fármaco utilizado isoladamente. A abordagem multimodal permite o uso de doses reduzidas de cada fármaco, diminuindo a probabilidade dos efeitos secundários dependentes da dose (Chohan, 2010). Por outro lado, a atuação de diferentes classes farmacológicas em diferentes locais e recetores impede a transmissão do estímulo injurioso a diferentes níveis das vias da dor (Lamont, L. A., 2008; Shaffran, 2008).
Não podemos deixar de salientar a existência de uma forte correlação entre a dor aguda pós-operatória grave e o desenvolvimento de dor crónica (Macintyre e Walker, 2010). Assim uma abordagem agressiva e multimodal para a gestão da dor aguda, impedindo que as vias de dor crónica se estabeleçam, deve ser uma preocupação para o médico veterinário (Chohan, 2010).
Um outro conceito fundamental é o de analgesia preventiva, definida como um tratamento anti-nociceptivo baseado na administração de analgésicos antes do início do estímulo nocivo prevenindo a sensibilização periférica e central. Esta foi a razão do lema do Ano Mundial Contra a Dor Aguda em 2011 "Antecipar, avaliar, aliviar”. (Dugdale, 2010; Gurney, 2012).
O efeito de analgesia preventiva é demonstrado quando a dor pós-operatória e / ou uso de analgésicos no pós-operatório são reduzidos para além da duração esperada da ação do fármaco usado (Katz et al., 2011).
Existem cinco principais classes de fármacos analgésicos que vão bloquear ou modular a entrada nociceptiva num ou mais locais de ação (Lemke e Creighton, 2010).
14 1.5.1. Opióides
Os opióides são definidos como substâncias químicas, naturais ou sintéticas, que se ligam a um receptor opiáceo e que podem ser antagonizados pela naloxona (Vallejo et al., 2011).Os opióides são fármacos mais utilizados para o tratamento da dor moderada a grave (Gurney, 2012) e formam a base de uma anestesia multimodal peri-operatória. Produzem analgesia sem perda de propriocepção nem consciência, constituindo o modo mais eficaz de controlo da dor aguda pós-cirúrgica (Wagner, 2009).
O uso de opióides na pré-medicação pode fornecer, entre outros benefícios, a redução da concentração alveolar mínima (MAC) e a prevenção de “wind-up” (reatividade dos neurónios de projeção a qualquer estimulação nociceptiva) (Dyson, 2008).
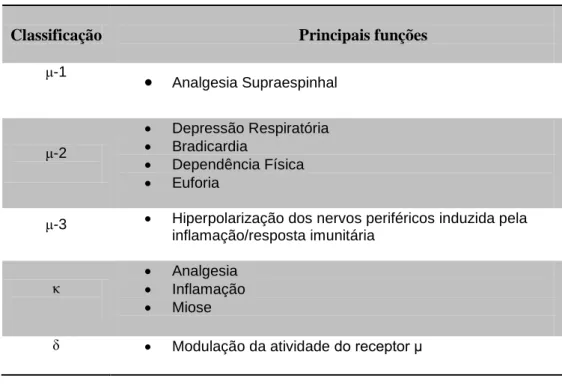
Existem três tipos de receptores opiáceos bem identificados, mais conhecidos pelas suas designações gregas: μ (Mu ou MOP), κ (Kappa ou KOP) e δ (Delta ou DOP) (Hellyer et
al., 2011). Estes encontram-se distribuídos pelo cérebro, medula espinhal (corno dorsal), nervos sensoriais periféricos e autónomos (Vallejo et al., 2011) e por células neuroendócrinas (hipófise e glândulas adrenais), ectodérmicas e do sistema imunológico (Stein et al., 2009) (Tabela 1).
Tabela 1 – Classificação dos receptores opióides e as suas principais funções (adaptado de Wagner 2009).
Classificação Principais funções
μ-1 Analgesia Supraespinhal μ-2 Depressão Respiratória Bradicardia Dependência Física Euforia
μ-3 Hiperpolarização dos nervos periféricos induzida pela inflamação/resposta imunitária
κ
Analgesia
Inflamação
Miose
15
Os opióides podem ser classificados de acordo com sua interação com os receptores opióides em: agonistas, agonistas parciais, antagonistas e agonistas-antagonistas (Vallejo et
al., 2011).
Os agonistas totais são aqueles em que a sua ligação resulta de uma ativação máxima do receptor e o aumento da dose produz um aumento do efeito analgésico não existindo um efeito platô (Lamont, L. e Mathews, 2007; Wagner, 2009), são exemplos: a morfina e o fentanil.
Os antagonistas ligam-se a um ou mais receptores mas não induzem qualquer efeito. Atuando competitivamente para se ligarem aos receptores, revertem o efeito do agonista (Wagner, 2009). A naloxona é um dos antagonistas mais utilizados (Hellyer et al., 2011).
Os agonistas-antagonistas produzem uma ação antagonista ao nível dos receptores μ. O seu efeito analgésico é causado pelo agonismo que exerce ao nível dos receptores κ. Não produzem um efeito analgésico tão potente nem tão abrangente em relação a todos os tipos de dor, como os agonistas totais (Lamont, L. e Mathews, 2007), é exemplo o butorfanol.
Os agonistas parciais ligam-se a determinado receptor mas exercem apenas uma ativação parcial do mesmo, possuindo um efeito clínico mais limitado (Lamont, L. e Mathews, 2007).
1.5.1.1. Morfina
A morfina é o principal alcaloide derivado do ópio. É o protótipo do agonista opióide para o qual todos os outros são comparados (Wagner 2009). Liga-se fortemente ao receptor opióide μ, mas também tem efeitos agonísticos nos receptores k e δ (Hellyer, Robertson et al. 2011, Vallejo, Barkin et al. 2011). O seu efeito analgésico começa cerca de 15 a 30 minutos após a sua administração e tem a duração máxima de 4 horas (Wagner 2009, Vallejo, Barkin et al. 2011). A sua utilização está preconizada no controlo da dor intensa a moderada associada a processos traumáticos e patologias crónicas, bem como no período perioperatório (Hellyer, Robertson et al. 2011). Quando administrada no período intraoperatório, assim como o fentanil e a hidromorfina, pode reduzir o consumo de isoflurano em cerca de 30% a 50% (Lemke and Creighton 2010). É frequentemente administrada, para controlo da dor, em intervalos de dosagem fixa através da via intramuscular, subcutânea ou endovenosa (Hellyer, Robertson et al. 2011). A administração endovenosa pode causar a libertação de histamina ou sequestro esplénico de sangue (no cão) quando administrados em bolus rápidos, contribuindo para a hipotensão (Muir 2009a, Lorenz, Coates et al. 2011) daí a importância de uma
16
administração lenta e em doses reduzidas (Wagner 2009). Pode ainda causar depressão respiratória, bradicardia, euforia, variações na termorregulação, náuseas, vómitos, diminuição da motilidade intestinal e aumento da hormona antidiurética (Muir 2009a, Vallejo, Barkin et al. 2011).
1.5.1.2. Buprenorfina
A buprenorfina é um opióide semi-sintético derivado da tebaína, com uma alta lipossolubididade (Hellyer et al., 2011), 25 a 50 vezes mais potente que a morfina (Dobkin, 1977; Downing et al., 1977; Kay, 1978). Embora agonista-antagonista, é diferente dos outros opióides, sendo agonista parcial dos receptores μ e antagonista dos receptores κ (Wagner, 2009).
A buprenorfina possui um início de ação considerado lento (5 a 15 minutos) e o pico de ação só acontece uma hora após a sua administração (Andaluz et al., 2009; Hellyer et al., 2011; Wagner, 2009). Em cães e gatos, a dose clínica de buprenorfina varia entre 0,01-0,02 mg/kg (Wagner, 2009). Apesar de uma suposta vantagem da buprenorfina ser a sua longa duração de analgesia (até 12 horas), muitas vezes o seu efeito clínico em animais parece diminuir para menos de 6 horas (Andaluz et al., 2009; Gurney, 2012; Wagner, 2009). A longa ação é atribuída a uma elevada afinidade para os receptores μ e uma dissociação lenta (Papich, 2000) sendo difícil intensificar o efeito analgésico com a administração de outro opióide ou antagonizar o seu efeito com a administração de um antagonista (Lamont, L. e Mathews, 2007).
Em cães e gatos, a buprenorfina é usada mais frequentemente no período pós-operatório para controlar a dor de intensidade leve a moderada. Tal como acontece com os outros opióides desta categoria, a buprenorfina não é adequada para a gestão da dor grave, como no caso de procedimentos ortopédicos invasivos (Hellyer et al., 2011), uma vez que a qualidade da analgesia não é a mesma como quando é obtida com agonistas puros (Chohan, 2010). A buprenorfina possui um excelente perfil de segurança, caraterizado por um com efeito plateau para depressão respiratória, ausência de efeito imunossupressor, baixo potencial de interação farmacocinética e ausência de acumulação em caso de insuficiência renal (Clohan,2010).
17 1.5.2. Anti- inflamatórios não esteroides (AINE’S)
Os anti-inflamatórios não esteroides (AINES) são os analgésicos mais utilizados em Medicina Veterinária, tendo sido considerados eficazes no alívio da dor aguda e crónica na maioria das espécies (Lascelles et al., 2007). Os AINES atuam sinergicamente com os opióides no controlo da dor (Lemke e Creighton, 2010; Muir, William W. III, 2009a).
Para além da analgesia, são ainda conhecidos pelos seus efeitos anti-inflamatórios e antipiréticos (Muir, William W. III, 2009a).
Os AINES atuam inibindo as ciclooxigenases (COX), impedindo a oxidação do ácido araquidónico em outros ecosanóides,nomeadamente em prostaglandina E2, F2α e D2 (PGE2, PGF2, PGD2), tromboxanos A2 e B2 e prostaciclina, mediadores químicos do processo inflamatório (Kawabata, 2011). Existem duas principais COX identificadas, a COX-1 e a COX-2. Uma terceira, a COX-3, foi identificada principalmente no córtex cerebral canino e em quantidades mínimas perifericamente (Warner e Mitchell, 2002). A COX-1 é responsável pela produção basal de prostaglandinas fundamentais para a homeostasia em vários tecidos e sistemas. A COX-2 é sintetizada pelos macrófagos e células inflamatórias após estimulação pelas citoquinas e outros mediadores, podendo aumentar até vinte vezes o seu valor normal e consequentemente aumentar o nível de prostanoides (Papich, 2008).
O uso clínico de AINES está mais relacionado com potenciais problemas gastrointestinais, como a ulceração gástrica. Os efeitos secundários renais e hepáticos têm sido relatados com menor frequência, enquanto a inibição da coagulação, letargia e polidipsia são raramente relatadas em estudos clínicos (KuKanich et al., 2012).
Atualmente, o desenvolvimento de AINES centra-se sobretudo na inibição da COX-2 com o intuito de não interferir com a COX-1, preservando a maioria das funções fisiológicas normais (Papich, 2008), estando associados a menos efeitos adversos gastrointestinais, embora não haja estudos que confirmem uma associação a menor efeitos renais ou hepáticos (KuKanich et al., 2012). O Meloxican é exemplo de um inibidor preferencial da Cox-2 comummente utilizado na medicina Veterinária (Ramsey, 2011).
1.5.3. α2- Agonistas
Os α2-agonistas ativam os receptores α2 no cérebro e na medula espinhal, diminuindo a libertação de neurotransmissores envolvidos na transmissão da informação nociceptiva (Lamont, Leigh, 2009). Estes fármacos têm tido um crescente interesse devido á sua capacidade de produzir sedação, analgesia, relaxamento muscular e ação ansiolítica
18
(Paddleford e Harvey, 1999) . São um dos mais potentes sedativos existentes, podem ser usados desde a pré-medicação até à recuperação anestésica (Lemke e Creighton, 2010). Devido á sua ação analgésica, podem ser tão eficazes como os opióides em algumas situações (Paddleford e Harvey, 1999), e frequentemente são administrados juntos com estes no pré-operatório (Lemke e Creighton, 2010). Quando administrados sistemicamente, o curto período de ação limita o uso como analgésicos (Paddleford e Harvey, 1999), pelo que atualmente têm sido usados em infusão contínua. A medetomidina e a dexmedetomidina são exemplos de dois potentes analgésicos α2-agonistas. São contraindicados em doentes cardiovasculares (por provocarem bradicardia e bradiarritmias) (Lamont, Leigh, 2009).
1.5.4. Antagonistas do recetor N-metil-D-aspartato (NMDA)
O glutamato, é um agonista endógeno dos receptores N-metil-D-aspartato (NMDA) supra-espinhais e espinhais. Quando ativos, estes receptores promovem a excitação dos neurónios de projeção, contribuindo para o desenvolvimento da sensibilização central. Assim, o bloqueio destes receptores ao nível do corno dorsal contribuem para que a sensibilização central não se complete (Lemke e Creighton, 2010).
Atualmente, na Medicina Veterinária existem dois agentes relevantes: a ketamina e a amantadina (Hellyer et al., 2011).
1.5.5. Anestésicos locais
Os anestésicos locais bloqueiam a ação dos canais de sódio na membrana celular neuronal, evitando a despolarização celular e impedindo a neurotransmissão do potencial de ação (Mama, 2009; Muir, William W. III, 2009a).
As fibras nervosas possuem sensibilidades diferentes aos anestésicos locais, sendo as de pequeno diâmetro (C, Aδ) mais sensíveis que as de grande diâmetro (Aβ), do mesmo modo, as fibras mielizadas são bloqueadas mais rapidamente que as não mielizadas do mesmo diâmetro. O bloqueio das fibras nervosas ocorre gradualmente, iniciando-se com a perda de sensibilidade (analgesia) e diferentes graus na perda da função motora (Mama, 2009; Muir, William W. III, 2009a).
Os anestésicos locais possuem um grupo aromático insaturado (lipofílico) associado a um grupo amina (hidrofílico). Esses dois grupos são ligados por uma cadeia intermediária que determina a classificação do anestésico local como amida (lidocaína, mepivacaína, bupivacaína e rupivacaína) ou éster (procaína, tetracaína e benzocaína) (Mama, 2009).
19
Na sua maioria os anestésicos locais, potenciam os efeitos dos agentes hipnóticos (por exemplo, o propofol) e dos anestésicos inalatórios (por exemplo, isoflurano), resultando numa diminuição da quantidade de anestésico exigido (Muir, William W. III, 2009a).
A taxa de absorção sistémica dos anestésicos locais está inversamente relacionada com a duração do efeito no local de ação. A sua absorção vai depender das suas propriedades físico-químicas e farmacológicas, concentração, local de administração e do uso simultâneo de vasoconstritores ou outros adjuvantes (Mama, 2009).
Quando administrados com técnica e dose adequadas, os anestésicos locais são relativamente livres de efeitos secundários (Lemke e Creighton, 2010; Mama, 2009; Skarda e Tranquilli, 2011).
1.4.5.1. Bupivacaína
A bupivacaína é um anestésico local comummente usado nos bloqueios regionais, com um tempo de acção quatro vezes superior á lidocaína (Lemke e Creighton, 2010; Mama, 2009). O seu início de ação é considerado lento (20 minutos) e tem um tempo de ação longo, de 4 a 6 horas (Lemke and Creighton 2010). A toxicidade da bupivacaína expressa-se principalmente no sistema cardiovascular, podendo produzir arritmias cardíacas graves incluindo fibrilhação ventricular (Mama, 2009).
Na prática clínica, os anestésicos locais são mais frequentemente administrados em locais específicos de modo a produzir analgesia e anestesia regional.
1.6. Anestesia regional
A anestesia regional engloba as seguintes categorias: anestesia tópica; infiltração local; bloqueio dos nervos periféricos; administração intra-articular; bloqueio endovenoso; bloqueio epidural e bloqueio vertebral (Mama, 2009).
Os benefícios da anestesia loco-regional estão bem resumidos por Campoy. Este afirma que a anestesia local previne a transmissão do impulso nociceptivo, minimizando a sensibilização central, o que reduz a necessidade analgésica no pós-operatório (Campoy, L. et
al., 2008).
O médico veterinário deve sempre considerar a inclusão de um bloqueio neural, periférico ou central, nos seus protocolos de gestão da dor perioperatória (Lemke e Creighton, 2010).
20 1.6.1.Bloqueio dos nervos periféricos
Técnicas de anestesia regional como os bloqueios dos nervos periféricos têm sido comummente usados em protocolos de anestesia multimodal, dada a sua eficácia, taxa de sucesso, ampla margem de segurança e efeito analgésico prolongado durante todo o período peri-operatório. (Campoy, L. et al., 2012a; Caniglia et al., 2012; Vettorato et al., 2012). Os bloqueios dos nervos periféricos têm sido descritos em cães como uma técnica de analgesia regional alternativa em ambos os membros, pélvico e torácico (Campoy, L, 2006; Campoy, L.
et al., 2008; Campoy, L. et al., 2012a; Campoy, L. et al., 2012b; Caniglia et al., 2012; Mahler
e Adogwa, 2008; Vettorato et al., 2012; Wenger, 2004; Wenger et al., 2005).
1.6.1.2. Uso de adjuvantes opióides
Uma das estratégias utilizadas para aumentar a duração dos bloqueios anestésicos dos nervos periféricos é baseada na utilização de adjuvantes, que quando usados em combinação com os anestésicos locais podem prolongar a sua duração de ação. (Yilmaz-Rastoder et al., 2012). A descoberta de múltiplos receptores opiáceos nas fibras nervosas aferentes primárias tem despoletado um crescente interesse no uso dos opióides como adjuvantes para os anestésicos locais. No entanto, a eficácia e o mecanismo de ação dos opióides aplicados perifericamente para a dor peri-operatória contínua controverso (Brummett e Williams, 2011; Grant et al., 2001).
No Homem, segundo alguns estudos, foi estabelecido que os opióides aplicados aos nervos periféricos produzem analgesia eficaz (Arendt-Nielsen et al., 1991; Sanchez et al., 1984; Viel et al., 1989) e quando associados aos anestésicos locais, a analgesia seria mais perlongada (Bazin et al., 1997; Modi et al., 2009). Uma revisão qualitativa realizada em ensaios clínicos randomizados no período entre 1966 -1996 forneceu evidências clinicamente relevantes, de um efeito analgésico dos opióides administrados perifericamente na dor aguda (Picard et al., 1997).
O mecanismo associado ao aumento da eficácia e duração da analgesia com opioides administrados perifericamente parece estar relacionado com a sua lipossolubilidade. As propriedades físico-químicas dos opióides são assim importantes na sua capacidade de penetrar a mielina axonal e a membrana do nervo (Behr et al., 2012; Stein et al., 2009). De facto, os compostos muito solúveis em lípidos, tal como a buprenorfina, têm sido considerados analgésicos mais eficazes a nível periférico (Viel et al., 1989) e vários estudos têm sido efectuados com a buprenorfina para determinar a sua eficácia perineural, daí ser a
21
escolhida para este trabalho científico. No Homem, um estudo onde o objetivo foi avaliar se a adição epineural de buprenorfina à levobupivacaína prolongava a analgesia pós-operatória em bloqueios do plexo braquial concluiu que a analgesia da buprenorfina epineural era mais eficaz quando comparada com a buprenorfina administrada intramuscular, sugerindo que a buprenorfina atuava localmente no sistema nervoso periférico (Behr et al., 2012).
Outros estudos também em bloqueios do plexo braquial no Homem, demonstraram eficácia analgésica na adição de buprenorfina à mepivacaína, tetracaína e epinefrina (Candido
et al., 2001; Candido et al., 2002). Recentemente, o mesmo grupo de investigadores
comparou o efeito analgésico da buprenorfina no pós-operatório adicionado à bupivacaína em bloqueios do nervo ciático, embora com resultados menos impressionantes do que os iniciais. Apesar de ambos os grupos de buprenorfina (perineural e intramuscular) terem tido pontuações mais baixas na escala de dor nas primeiras 48 horas quando comparados com o grupo da bupivacaína isolada, quer esta diferença, quer a diferença no consumo de opioides, não foi estatisticamente significativa (Candido et al., 2010). Os resultados sugeriram que fatores como as características dos anestésicos locais, a técnica do bloqueio e a anatomia do nervo podem ser relevantes para a eficácia dos opióides adjuvantes.
Até ao momento, segundo a pesquisa efetuada, desconhecem-se estudos em cães que comparem bloqueios de nervos periféricos com ou sem opióides. Assim, este estudo teve como principais objetivos:
Investigar o efeito analgésico adicional da buprenorfina associada à bupivacaína em bloqueios dos nervos ciático e femoral em cirurgias ortopédicas ao membro pélvico de cães, e
Observar se, nas condições clínicas utilizadas, ocorrerão alterações nos parâmetros a avaliar no intra-operatório, nomeadamente na frequência cardíaca (FC), frequência respiratória (FR), temperatura corporal em graus Celcius (TºC), saturação periférica de hemoglobina (SpO2), pressão arterial sistólica (PAS), diastólica (PAD) e média (PAM), valores no final da expiração de CO2 (ETCO2) e de isoflurano (ETISO) e na dor pós-operatória, nos animais do grupo submetido a bloqueio dos nervos periféricos com buprenorfina, relativamente ao grupo controlo.
23
II. MATERIAL E MÉTODOS
2.1. Animais
O presente estudo foi realizado durante um período de 6 meses (Setembro de 2012 a Fevereiro de 2013), no hospital veterinário do Baixo Vouga e nele foram incluídos animais pertencentes à espécie Canis lúpus familiaris, sem raça definida, de ambos os sexos, ASA I (Sociedade Americana de Anestesiologia I), com indicação cirúrgica para cirurgia ortopédica ao joelho (Técnica extracapsular para reparação de ruptura do ligamento cruzado craneal e luxação medial da rótula) e não sujeitos a ação medicamentosa analgésica nas 24 horas antecedentes à avaliação da dor pré-cirúrgica.
Os animais foram distribuídos aleatoriamente por 2 grupos:
1. grupo controlo (BPN – Bloqueio de Nervo Periférico): sujeito a bloqueio do NF (nervo femoral) e NC (nervo Ciático) com bupivacaína sem uso de buprenorfina; 2. grupo de estudo (BNP-CB – Bloqueio de Nervo Periférico com Buprenorfina): sujeito
a bloqueio do NF e NC, usando a buprenorfina associada à bupivacaína.
Todos os proprietários foram esclarecidos sobre o estudo e assinaram um termo de consentimento para a recolha e publicação dos dados (Anexo B).
2.2. Procedimento Anestésico
Antes da cirurgia todos os animais foram submetidos a um jejum alimentar de 12 horas e hídrico de 4 horas.
A estratégia analgésica utilizada nos animais incluídos em ambos os grupos foi preventiva e multimodal.
Com base no exame físico pré-anestésico, avaliação hematológica e bioquímica, os animais deste estudo foram considerados sistemicamente saudáveis, bem hidratados e portanto classificados como ASA I, de acordo coma Sociedade Americana de Anestesiologistas.
Os animais do grupo BNP foram pré-medicados com um AINE, meloxicam (0,2mg/kg SC; Metacam 5® Boehringer Ingelheim Vetmedic, USA), uma hora antes da sedação; sedados com morfina (0,2mg/kg IM; Morfina® 1% B Braun, Queluz de Baixo, Portugal) e acepromazina (0,025mg/kg IM Calmivet®, Vétoquinol, Barcarena, Portugal). Após a sedação, os animais foram preparados de forma asséptica de rotina, sendo cateterizados
24
(Introcan®; B.Braun, Queluz de Baixo, Portugal) na veia cefálica contrária ao membro pélvico lesionado. Vinte minutos depois da sedação, a indução realizou-se com propofol (2-4 mg/kg IV; Propofol lipuro® 1% B.Braun, Queluz de Baixo, Portugal), até perda de consciência para entubação endotraqueal (tubos endotraquiais de murphy, com diâmetro adequado ao porte do animal).
Após a indução os animais foram sujeitos a bloqueio do nervo ciático e femoral. Os bloqueios foram realizados segundo a técnica publicada por Campoy (Campoy, L, 2006), com uso de um neuroestimulador (Stimuplex HNS11;B.Braun Melsungen GmbH, Alemanha) para auxílio na localização dos nervos.
2.2.1. Bloqueio do nervo femoral
Os animais foram posicionados em decúbito lateral com o membro a ser bloqueado em posição superior, abduzido 90ºC e estendido caudalmente. Após a tricotomia e preparação asséptica da pele que recobre o triângulo femoral (delimitado caudalmente pelo músculo pectineus, cranialmente pelo músculo sartório e proximalmente pelo músculo iliopsoas), a localização aproximada do NF foi estimada usando a pulsação da artéria femoral como ponto de referência (o nervo femoral está localizado cranialmente á artéria femoral).
Resumidamente, após a colocação do eléctrodo positivo sobre a pele da região caudal do joelho, foi iniciado o estímulo eléctrico de 1 mA. A agulha de estimulação (StimuplexD, 25G, 50mm; B.Braun Melsungen GmbH, Alemanha) foi avançando através da pele num ângulo de 20 a 30ºC, sempre cranial à artéria femoral e caudomedial ao músculo sartório. Quando se verificou contração do músculo quadríceps femoral com o movimento da rótula (“dançar da rótula”) a estimulação foi reduzida a 0,4 mA (em reduções de 0,2mA de cada vez enquanto se avançava a agulha) e a agulha avançada ligeiramente mantendo a contração muscular. De seguida para evitar injeção intraneural a intensidade da corrente era diminuída e a agulha recuada até perda da contração a 0,2 mA. Administrou-se bupivacaína (0,1ml/Kg bupivacaína 0,5% ® B.Braun, Queluz de Baixo, Portugal) após confirmação de ausência de refluxo sanguíneo e de ausência de resistência detectável à injeção.
2.2.2. Bloqueio do nervo ciático
O nervo ciático é formado por duas ramificações: medialmente o nervo tíbial e lateralmente o nervo perineal comum (Campoy, L, 2006; Mahler e Adogwa, 2008). O nervo