Clínica Universitária de Medicina I
Neoplasia Oculta: revisão da literatura
e análise de pequena série de quatro
casos clínicos
Bruno Miguel Ferreira Pedrosa
Clínica Universitária de Medicina I
Neoplasia Oculta: revisão da literatura
e análise de pequena série de quatro
casos clínicos
Bruno Miguel Ferreira Pedrosa
Orientado por:
Professora Doutora Sara Croca
TÍTULO
Neoplasia Oculta: revisão da literatura e análise de pequena série de
quatro casos clínicos
RESUMO
Introdução: Neoplasia oculta ou neoplasia de localização primária não identificada engloba um grupo heterogéneo de situações clínicas definidas pela presença de metástases de crescimento agressivo sem tumor primário definido após uma investigação completa e exaustiva, ou pela presença de manifestações sistémicas relacionadas com a presença de síndromes paraneoplásicos, constituindo 3 a 5% de todos os diagnósticos de neoplasia. A neoplasia oculta é a terceira/quarta causa de morte por neoplasia, apresentando na maioria dos casos (80 a 85%) prognóstico desfavorável, com sobrevida média de 6 a 10 meses. A terapêutica da neoplasia oculta deve ser ponderada a nível individual, de acordo com as bases clinico-patológicas e subgrupo de prognóstico em que o doente se insere.
Casos Clínicos: Neste trabalho apresentam-se quatro casos clínicos de doentes internados no serviço de Medicina 1C do Hospital de Santa Maria que constituem exemplos ilustrativos de neoplasia oculta, nomeadamente na gravidade da forma de apresentação, progressão rápida e dificuldade de estabelecer diagnóstico histológico. Conclusão: Nos casos apresentados evidenciou-se o rápido carácter evolutivo de mau prognóstico da neoplasia oculta, culminando invariavelmente em morte. Apesar de nos casos em questão se considerar o diagnóstico de neoplasia oculta pela apresentação de metástases sem tumor primário definido, os exames que seriam necessários para a obtenção de diagnóstico final não foram realizados por rápida evolução da doença, tendo a abordagem diagnóstica sido limitada, principalmente no que diz respeito à obtenção de biópsia. Para além disso, permaneceu a dúvida quanto ao regime terapêutico adequado bem como quanto à aplicabilidade das guidelines atuais.
Palavras-chave: Neoplasia oculta, Síndrome paraneoplásico O trabalho final exprime a opinião do autor e não da FML.
ABSTRACT
Introduction: Occult neoplasia or cancer of unknown primary is a diverse group of cancers that is defined by the presence of metastasis of aggressive growth without an identifiable primary tumor after a complete and exhaustive evaluation, or by the presence of systemic manifestations related to paraneoplastic syndromes, which accounts for 3 to 5% of all cancer cases. Occult neoplasia is the third/forth cause of death by neoplasia, and has a poor prognosis, with a life expectancy of 6 to 10 months, in the majority of cases (80 to 85%). Treatment must be settled individually, according to clinical and pathological findings and the prognostic subgroup in which the patient is in.
Case Report: Here are described four clinical cases of patients admitted to Hospital de Santa Maria Internal Medicine IC care which are illustrative examples of occult neoplasia, in its aggressive presentation, rapid progression and difficulty in establishing histological diagnosis.
Conclusion: In the cases presented, the aggressive evolution and poor prognosis of occult neoplasia are evident, since all the patients died. Even though the diagnosis of occult neoplasia was considered because of the presence of metastasis without an identifiable primary tumor, the necessary investigation to reach the final diagnosis was not completed due to the aggressive progression of the disease and the diagnostic approach was limited, especially when a biopsy was needed. In addition, the doubt remained as to the adequate therapeutic regimen to apply as well as the applicability of the current guidelines.
ÍNDICE
INTRODUÇÃO ... 7
Definição ... 7
Epidemiologia... 8
Fisiopatologia ... 9
-Associada à presença de lesões secundárias ... 9
-Associada a síndromes paraneoplásicos ... 11
Fatores de risco ... 16
Classificação ... 17
Diagnóstico ... 18
Prognóstico ... 21
Terapêutica ... 22
CASOS CLÍNICOS – APRESENTAÇÃO CLÍNICA e EVOLUÇÃO ... 24
Caso 1 ... 24 Caso 2 ... 29 Caso 3 ... 34 Caso 4 ... 38 DISCUSSÃO ... 44 Caso 1 ... 44 Caso 2 ... 46 Caso 3 ... 48 Caso 4 ... 50 Discussão global ... 52 CONCLUSÃO ... 55 AGRADECIMENTOS ... 56 BIBLIOGRAFIA ... 57 ABREVIATURAS ... 63 QUADROS E FIGURAS ... 65
INTRODUÇÃO Definição
O conceito de neoplasia oculta (NO) ou neoplasia de localização primária não identificada engloba um grupo heterogéneo de situações clínicas definidas pela presença de metástases de crescimento agressivo, sem tumor primário definido após uma investigação completa e exaustiva [1, 2], ou pela presença de manifestações sistémicas relacionadas com a presença de síndromes paraneoplásicos (SP) [3].
Na maioria dos casos de doença neoplásica metastizada, a origem da lesão primária torna-se rapidamente evidente após marcha diagnóstica adequada (vide torna-secção Diagnóstico onde se define marcha diagnóstica adequada). No entanto, em cerca de um terço dos casos, apesar da convicção de etiologia neoplásica para lesões assumidas como metastáticas, a localização/etiologia do tumor primário não é clara [4].
Perante o diagnóstico presuntivo de NO, podem ser encontradas duas situações distintas: 1) neoplasias em que o local de origem pode ser previsto, pelo menos, pelo seu perfil imunohistoquimico (IHQ);
2) neoplasias que se mantêm ocultas mesmo após uma avaliação IHQ completa. Embora a separação nestes dois grupos com base no perfil IHQ possa ser de certa forma artificial, esta poderá ser relevante para estabelecer uma estratégia terapêutica nomeadamente numa abordagem inicial [5].
Atualmente, a biologia específica da NO não é completamente conhecida. No entanto, dados atuais sugerem que a disseminação metastática pode ocorrer na ausência de um tumor primário identificável em virtude do crescimento agressivo das células neoplásicas metastáticas [6].
Epidemiologia
A NO constitui 3 a 5% de todos os diagnósticos de neoplasia [6], com uma incidência anual de 7 a 12 casos por 100.000 habitantes nos Estados Unidos da América [7]. Contudo, estes números poderão ser mais elevados na medida em que existem casos de NO que serão diagnosticados como neoplasias específicas de órgão por razões clínicas pragmáticas, mesmo sendo o seu diagnóstico incerto [5].
Alguns autores consideram que a frequência de diagnóstico de NO está em relação direta com o tipo de abordagem diagnóstica e a investigação complementar realizada [2]. Ainda assim, parece existir um subgrupo de doentes que, apesar de uma avaliação complementar exaustiva, permanecem sem local de origem do tumor primário definido. De realçar ainda que, segundo dados estatísticos, o número de casos tem vindo a diminuir ao longo dos anos, provavelmente em relação com uma maior sensibilidade dos métodos de diagnóstico complementares, nomeadamente imagiológicos (tomografia computorizada (TC), ressonância magnética (RM) crânio-encefálica e tomografia por emissão de positrões (PET)) e a avaliação histológica complementada por técnicas IHQ [2].
A NO acomete predominantemente os homens, sendo a idade média, na altura do diagnóstico, de 60 anos [7]. À apresentação, mais de metade dos doentes com NO apresentam múltiplos locais de envolvimento metastático, tendo os restantes apenas um local acometido (mais frequentemente o fígado, osso, pulmão ou nódulos linfáticos) [8].
Fisiopatologia
-Associada à presença de lesões secundárias
A história natural e a fisiopatologia de NO não estão bem estabelecidas, principalmente pela existência de uma origem primária não identificada, seja de uma perspetiva de órgão, seja de uma perspetiva de linhagem celular identificável, sobretudo quando os exames anátomo-patológicos são compatíveis com células indiferenciadas.
Considerando que cada vez mais os planos terapêuticos no contexto das doenças oncológicas são adaptados ao tipo de neoplasia, a presença do diagnóstico de NO compromete a possibilidade de iniciar tratamento dirigido. Por outro lado, por definição, a existência de NO implica a presença de disseminação neoplásica importante, sendo que a eficácia de qualquer terapêutica instituída será comprometida pelo perfil de agressividade acentuado deste síndrome, característica essa compatível com variantes neoplásicas com mecanismos de evasão ao controlo do sistema imunitário [9].
As lesões neoformativas podem surgir em qualquer tecido do corpo. Na grande maioria dos casos, o primeiro passo da patogénese de qualquer neoplasia é o crescimento de uma lesão primária [5]. Com a acumulação de mutações de uma linhagem celular atípica habitualmente com um índice proliferativo elevado, aumenta a probabilidade de surgir um clone metastático que possua as propriedades biológicas que possibilitam a disseminação a partir da lesão primária, seja por contiguidade, via linfática ou via hematogénea e, eventualmente, o crescimento em órgãos à distância [5].
De um ponto de vista anatómico, a metástase pode partir do local primário através de uma cavidade (por exemplo, dos pulmões para a cavidade pleural ou do cólon para o peritoneu), por invasão linfática ou por invasão sanguínea. As células neoplásicas podem até migrar através do endotélio, da membrana basal ou ao longo dos neurónios [10]. Acredita-se que a transição epitélio-mesenquima é o processo primário na cascata metastática, permitindo à célula perder irreversivelmente as ligações célula-célula e adquirir características mesenquimatosas [11]. Outro processo que pode destruir as características celulares reconhecidas pelas técnicas de IHQ usadas na identificação de tecidos pode ser o immunoediting, que corresponde à capacidade de a célula neoplásica alterar as suas características de forma a evitar o reconhecimento pelo sistema imunitário [12]. Sendo que a capacidade do sistema imunitário de erradicar clones depende das características imunogénicas dos mesmos, os clones editados serão pouco imunogénicos ou mesmo imunossupressores (“stealth clones”), permitindo a adoção de características
de rápida expansão como as que se vêm em muitos casos de NO [13]. Com a maior compreensão da ligação entre o sistema imune e a carcinogénese, tem também surgido a hipótese de que a NO em certos órgãos pode ser, na verdade, uma versão imunologicamente editada de uma lesão primária neoformativa do mesmo órgão. Em geral, as células metastáticas mantêm as características histológicas do tecido de origem, no entanto, não exibem morfologia/propriedades referentes ao tecido/órgão de origem podendo ainda não estar relacionadas com nenhum local primário suspeito, identificando-se assim o tumor como neoplasia primária de origem desconhecida ou NO [2, 5].
No entanto, existem exceções a este processo fisiopatológico genérico, podendo ocorrer: 1) Neoplasias síncronas (que podem apresentar histologia diferente ou semelhante
em relação ao tumor primário) ou neoplasias metácronas (que apresentam histologia semelhante ao tumor primário), identificadas num intervalo inferior ou superior a 6 meses, respetivamente, em órgãos diferentes [14].
2) Lesões múltiplas, isto é, podem existir múltiplas massas que correspondem a nódulos satélite da lesão primária, compartilhando a mesma histologia; estas podem ainda corresponder a metástases que se desenvolveram como consequência da neoplasia primária. [2]
Até à data, estudos genéticos não revelaram variantes da linha germinal (germline variants) que possam predispor para este tipo de neoplasia [15]. No entanto, estudos demonstram que a NO não tem uma incidência aleatória, existindo uma relação familiar que é corroborada pelo facto de que os diagnósticos de NO foram identificados com maior frequência em doentes cujos familiares tenham tido diagnóstico de NO ou de neoplasias pulmonar, hepática, renal ou outras [2, 16]. Para além disso, a mortalidade destes doentes, na sua maioria, foi secundária às metástases de órgão que, curiosamente, correspondiam aos locais de neoplasias primárias conhecidas dos respetivos familiares [13].
Na NO, a atipia primária pode permanecer diminuta e escapar à deteção clínica, ou pode mesmo desaparecer após a disseminação metastática, ou pode ainda ficar contida ou ser eliminada pelo sistema imunitário. Assim, coloca-se em hipótese que a NO pode ser um desenvolvimento maligno que resulta de um aumento da metastização ou de um aumento da sobrevivência em relação ao tumor primário. No entanto, a hipótese de um perfil genético ou fenotípico único das lesões metastáticas permanece por demonstrar [17].
-Associada a síndromes paraneoplásicos
Os SP afetam cerca de 8% dos doentes com neoplasia [18] e definem-se como alterações que podem acompanhar as neoplasias e que são causadas por reatividade cruzada imunológica entre os tecidos malignos e normais ou por secreção neoplásica de hormonas, péptidos ou citocinas [18], não se encontrando diretamente relacionadas com os efeitos quer da massa tumoral, quer da invasão tecidual pela neoplasia [19]. As células neoplásicas, provenientes com mais frequência de lesões neoformativas carcinóides ou de origem neuroendócrina, podem ser produtoras de diferentes agentes que podem estimular respostas hormonais, hematológicas, dermatológicas ou neurológicas que desencadeiam esses síndromes [19].
Os SP podem envolver diversos sistemas orgânicos, sendo o sistema endócrino (o mais comum), hematológico, neurológico, dermatológico e reumatológico os mais frequentemente afetados [18].
Os síndromes endócrinos resultam da produção, por parte da neoplasia, de hormonas ou péptidos que originam alterações metabólicas (ou seja, produção ectópica de hormonas por um tecido atípico [18, 19]). Assim, e para além de não existir uma correlação direta entre o desenvolvimento de síndromes endócrinos e o estadio ou prognóstico da neoplasia [20], tais síndromes frequentemente melhoram após o tratamento da neoplasia subjacente [18]. A hipercalcémia paraneoplásica é o síndrome endócrino mais comum [19], ocorrendo em cerca de 20% dos doentes com neoplasia [19] e em até 10 % de todos os doentes com neoplasia em estadio avançado, e normalmente está associado a um prognóstico desfavorável [21]. Em 80% dos casos é causada por produção ectópica de “parathyroid hormone (PTH)-related protein (PTHrP)” e ocorre mais frequentemente no contexto de neoplasias pavimento-celulares [22]. (Quadro 1)
Síndrome
Endócrino Hormona Responsável Neoplasias Típicas
Hipercalcémia
PTHrP Células pavimentosas (cabeça e pescoço, pulmão, pele); Mama, Genitourinário; Gastrointestinal 1,25-dihidroxivitamina
D Linfomas
PTH (raro) Pulmão; Ovário
PGE2 Renal; Pulmão
SIADH Vasopressina Pulmão (células pavimentosas e pequenas células);
Gastrointestinal, Genitourinário; Ovário
Síndrome de
Cushing
ACTH
Pulmão (pequenas células, brônquicos, adenocarcinoma, pavimentosos); Timo, Pâncreas; Carcinoma medular de Tiróide
CRH Pâncreas; Pulmão; Próstata
GIP, LH/ hCG, outros receptores acoplados a proteina G (raro)
Hiperplasia Supra-renal macronodular
Hipoglicémia IGF-II
Mesenquimatosas; Sarcomas; Supra-renal; Hepático; Gastrointestinal; Renal; Próstata
Insulina (raro) Cérvix (carcinoma de pequenas células) Feminização
Masculina hCG
Testículos (embrionário, seminomas); Germinomas; Coriocarcinoma; Pulmão; Hepático; Pâncreas Diarreia ou
hipermotilidade intestinal
Calcitonina Pulmão; Cólon; Mama; Carcinoma medular da Tiróide
VI P Pâncreas; Fecromocitoma; Esófago
Osteomalácia
oncogénica Fosfatonina (FGF23)
Hemangiopericitomas; Osteoblastomas; Fibromas; Sarcomas; Neoplasias de células gigantes; Próstata; Pulmão
Acromegália GHRH Pâncreas; Brônquicos
GH Pulmão; Pâncreas
Hipertiroidismo TSH Mola hidatidiforme; Neoplasias embrionárias
Hipertensão Renina Neoplasias justaglomerulares; Rim; Pulmão; Pâncreas; Ovário
PTHrP - Parathyroid hormone–related protein; PTH - Parathyroid hormone; PGE2 - Prostaglandin E2 ; ACTH -
Adrenocorticotropic hormone; CRH - Corticotropin-releasing hormone; GIP - Gastric Inhibitory Peptide; LH - Luteinizing Hormone; hCG - human Chorionic Gonadotropin; IGF-Insulin-like growth factor type II; VIP - Vasoactive Intestinal Peptide; FGF23 - Fibroblast Growth Factor 23; GHRH - Growth hormone–releasing hormone; GH - Growth hormone
Quadro 1: Síndromes Paraneoplásicos Endócrinos mais frequentes e neoplasias associadas.
(Adaptado de Jameson, JL., Longo, DL. 121. Paraneoplastic syndromes: Endocrinologic/Hematologic. In Kasper D. L., Fauci A. S.,
Hauser S. L., Longo D. L., Jameson J. L. Harrison’s Principles of Internal Medicine. McGraw-Hill 2016, 19th edition, pp 608-613.)
Os síndromes hematológicos em doentes com neoplasias sólidas não estão tão bem caracterizados quanto os síndromes endócrinos uma vez que a(s) hormona(s) ectópica(s) ou citocinas responsáveis não foram ainda identificadas na maioria dessas neoplasias [19]. Estes síndromes raramente são sintomáticos, estando muitas vezes associados a doença em estadio avançado, beneficiando do tratamento da neoplasia subjacente [18,
19]. Estes síndromes manifestam-se mais frequentemente como eritrocitose, granulocitose, trombocitose, eosinofilia e tromboflebite (Quadro 2).
Síndrome Hematológico
Proteína
Responsável Neoplasias Típicas
Eritrocitose EPO Renal; Hepatocarcinoma; Hemangioblastomas
cerebelares
Granulocitose G-CSF;
GM-CSF; IL-6
Pulmão; Gastrointestinal; Ovário; Genitourinário; Doença de Hodgkin
Trombocitose IL-6 Pulmão; Gastrointestinal; Mama; Ovário; Linfoma
Eosinofilia IL-5 Linfoma; Leucemia; Pulmão
Tromboflebite Desconhecido Pulmão; Pâncreas; Gastrointestinal; Mama; Genitourinário; Ovário; Próstata; Linfoma
EPO – Eritropoetina; G-CSF - Granulocyte Colony-Stimulating Factor; GM-CSF - Granulocyte-Macrophage Colony-Stimulating Factor; IL - Interleukin.
Quadro 2: Síndromes Paraneoplásicos Hematológicos mais frequentes e neoplasias
associadas. (Adaptado de Jameson, JL., Longo, DL. 121. Paraneoplastic syndromes: Endocrinologic/Hematologic. In Kasper D. L., Fauci A. S., Hauser S. L., Longo D. L., Jameson J. L. Harrison’s Principles of Internal Medicine. McGraw-Hill 2016, 19th edition, pp 608-613.)
Os síndromes neurológicos em contexto paraneoplásico podem acometer qualquer porção do sistema nervoso [23], sendo que os sintomas neurológicos precedem o diagnóstico de neoplasia em 60% dos doentes [23]. Estes síndromes são raros (ocorrendo em menos de 1% dos casos de neoplasia [18]) e resultam da reatividade imunológica cruzada entre células neoplásicas e componentes do sistema nervoso [24], ou seja, são mediados por respostas imunes desencadeadas por proteínas neurológicas (antígenos onconeurais) expressas por certas neoplasias. Devido à sua semelhança antigénica, os anticorpos onconeurais e os linfócitos T específicos do antígeno onconeural também se ligam a componentes do sistema nervoso [25].
Uma vez que as células neoplásicas não são os agentes causais diretos destes síndromes, o tratamento bem sucedido da neoplasia não resulta, necessariamente, em melhoria neurológica, para além de que o dano neurológico pode, em alguns casos, ser permanente [18].
No Quadro 3 estão representados alguns dos síndromes neurológicos paraneoplásicos mais comuns.
Síndrome
Neurológico Anticorpo Associado Neoplasias Típicas
Encefalite Límbica (EL)
anti-Hu (mais comum em neoplasia do pulmão de pequenas células); anti-Ma2 (mais comum em neoplasia testicular); anti-CRMP5 (anti-CV2); anti-amphiphysin
Neoplasia do pulmão de pequenas células; Neoplasia testicular de células germinativas; Mama; Timoma; Teratoma; Doença de Hodgkin
Degeneração Cerebelar Paraneoplásica anti-Yo; anti-Hu; anti-CRMP5 (anti-CV2); anti-Ma; anti-Tr; anti-Ri; anti-VGCC; anti-mGluR
Neoplasia do pulmão de pequenas células; Ginecológica; Doença de Hodgkin; Mama
Síndrome de
Lambert-Eaton anti-VGCC
Neoplasia do pulmão de pequenas células; Próstata; Linfomas; Adenocarcinomas Miastenia gravis anti-AchR Timoma
Neuropatia autonómica anti-Hu anti-CRMP5 (anti-CV2) anti-nAchR anti-amphiphysin
Neoplasia do pulmão de pequenas células; Timoma Neuropatia Sensorial Subaguda (periférica) anti-Hu anti-CRMP5 (anti-CV2) anti-amphiphysin
Pulmão, mais frequentemente neoplasia do pulmão de pequenas células; Mama; Ovário; Sarcoma; Doença de Hodgkin
anti-Hu; anti-Ma; anti-Yo; anti-Ri – Neuronal Nuclear Antibody; anti-CRMP5 - collapsin response mediator protein 5 anibodie; anti-Tr – reversible Neuronal Nuclear Antibody; anti-VGCC - Anti-voltage-gated calcium channel antibodies; Anti-mGluR - Anti-Metabotropic Glutamate Receptor 5 antibody; anti-AchR - acetylcholine receptor antibodie
Quadro 3: Síndromes Paraneoplásicos Neurológicos mais frequentes e neoplasias associadas. (Adaptado de Pelosof, LC., Gerber, DE. (2010) Paraneoplastic Syndromes: An Approach to Diagnosis and Treatment. Mayo Clin Proc. 85(9): 838–854).
Os síndromes dermatológicos são um grupo heterogéneo de manifestações clínicas, sendo o segundo SP mais comum [26], apesar de muitas vezes ser difícil de determinar a correlação entre uma determinada alteração dermatológica e uma neoplasia ou mesmo definir a frequência dessa associação na população em geral [27]. O desenvolvimento desses síndromes, bem como dos síndromes reumatológicos, frequentemente precede o diagnóstico de neoplasia ou precede, ainda, a recorrência de uma neoplasia previamente tratada [28].
No Quadro 4 estão representados os síndromes dermatológicos e reumatológicos paraneoplásicos mais comuns.
Síndrome Dermatológico/
Reumatológico Neoplasias Típicas
Acantose Nigrigans Adenocarcinoma Gástrico; Ginecológico
Dermatomiosite Ovário; Mama; Próstata; Pulmão; Colorretal; Linfoma Não
Hodgkin; Nasofaríngeo
Eritrodermia
Leucemia linfocítica crónica; Linfoma cutâneo de células T; Gastro-intestinal (colorretal, gástrico; esofágico; vesícula biliar); Linfoma/Leucemia células T; Neoplasias
Mieloproliferativas
Osteoartopatia hipertrófica Neoplasias intratorácicas; Metástases pulmonares e ósseas;
Carcinoma nasofaríngeo; Rabdomiossarcoma
Vasculite leucocitoclástica Leucemia/Linfoma; Síndromes mielodisplásicos; Cólon;
Urológico; Mieloma múltiplo; Rabdomiossarcoma
Pênfigo paraneoplásico
Linfoma Não Hodgkin; Leucemia linfocítica cónica;
Timoma; Doença de Castleman; Sarcoma folicular de células dendríticas
Polimialgia reumática Leucemia/Linfoma; Síndromes mielodisplásicos; Cólon;
Pulmão; Renal; Próstata; Mama
Síndrome de Sweet
Leucemia; Linfoma Não Hodgkin; Síndromes
Mielodisplásicos; Genitourinário; Mama; Gastrointestinal; Mieloma Múltiplo; Ginecológico; Testicular; Melanoma Quadro 4: Síndromes Paraneoplásicos Dermatológicos e Reumatológicos mais frequentes e neoplasias associadas. (Adaptado de Pelosof, LC., Gerber, DE. (2010) Paraneoplastic Syndromes: An Approach to Diagnosis and Treatment. Mayo Clin Proc. 85(9): 838–854.)
Os sinais, sintomas e alterações metabólicas associadas aos SP são muitas vezes ignorados no contexto de doença neoplásica e do seu tratamento. Contudo, manifestações clínicas atípicas num doente com neoplasia devem elevar a hipótese de um SP concomitante.
Fatores de risco
O tabagismo é, até à data, o único fator de risco conhecido para NO, sendo que o seu efeito é muito menor que na neoplasia do pulmão [29]. No entanto, vários estudos não revelaram associação de risco com qualquer fator conhecido [7].
Classificação [5, 6]
A grande maioria dos casos de NO é representada por carcinomas, sendo os adenocarcinomas os mais frequentemente diagnosticados.
Anatomopatologicamente, estas neoplasias podem ser classificadas como: 1) Adenocarcinomas bem e moderadamente diferenciados;
2) Carcinomas pavimentosos;
3) Carcinomas com diferenciação neuro-endócrina;
4) Carcinomas pouco diferenciados (incluindo adenocarcinomas pouco diferenciados);
5) Tumores indiferenciados.
Assim, os testes IHQ serão os únicos que nos poderão sugerir o local de origem do tumor primário e excluir neoplasias potencialmente quimiossensíveis/curáveis, como, por exemplo, linfomas.
Diagnóstico
A marcha diagnóstica recomendada para identificação do local primário inclui: anamnese e exame objetivo exaustivos, exames imagiológicos e exame histopatológico detalhado com IHQ específica [6]. Uma história familiar completa é essencial nestes casos [17]. Os critérios de diagnóstico da NO incluem: uma biópsia que comprove malignidade para a qual a origem anatómica é desconhecida após uma história clínica completa, exame objetivo completo e detalhado, testes de função hepática e renal, análises sanguíneas, radiografia do tórax, TC abdomino-pélvica, mamografia nas mulheres e antigénio especifico prostático (PSA) nos homens [17].
A nível IHQ, a marcha diagnóstica inicia com a determinação da linhagem celular (epitelial, melanocítica, linfoide, mesenquimatosa, germinativa), com o auxílio de marcadores apropriados [5].
Caso o diagnóstico patológico seja de carcinoma ou adenocarcinoma, de forma a ser possível excluir neoplasias hormono-sensíveis que possam ser sujeitas a tratamento específico, é aconselhável pesquisar: PSA, alfa-fetoproteina (AFP), hCG e cromogranina humana A (CgA) nos homens; recetores de estrogénio e progesterona (nas mulheres com nódulos axilares metastáticos); a marcação para as citoqueratinas (CK) 7 (normalmente presente nas neoplasias do aparelho gastro intestinal superior, colangiocarcinoma, neoplasias do pâncreas, pulmão, ovário, endométrio e mamário) e 20 (presente nas neoplasias epiteliais do trato gastro-intestinal inferior, utotelio e células de Merkel) providencia indicações para um possível local primário (Quadro 5); a marcação para CgA e sinaptofisina é necessária para identificar uma diferenciação neurendócrina (Quadro 6) [6].
Marcador primário Possível local primário Marcadores adicionais
CK 7+/CK 20+ Neoplasia do urotelio, ovário e pâncreas; Colangiocarcinoma
Urotelina e WT-1
CK 7+/CK 20 - Carcinoma pulmão, mama,
tiroide, endometrial, cervical e pancreático; Colangiocarcinoma
TTF-1, ER, PR, GCDFP-15
CK 7-/CK 20+ Carcinoma colorretal e das
células de Merkel
CEA e CDX-2 CK 7-/CK 20- Carcinoma hepatocelular, renal,
próstata e células pavimentoso
Hep Par-1 e PSA
CK - cytokeratin; CEA - carcinoembryonic antigen; TTF1 - thyroid transcription factor 1; ER - estrogen receptor; PgR - progesterone receptor; GCDFP-15 - gross cystic disease fluid protein-15; WT-1 - Wilms tumour gene 1; PSA - prostate specific antigen.
Quadro 5: Investigação imunohistoquímica básica nos casos de neoplasia oculta. (Adaptado de: K. Fizazi1, F. A. Greco, N. Pavlidis, G. Daugaard, K. Oien & G. Pentheroudakis, on behalf of the ESMO Guidelines Committee (2015). Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v133–v138)
Citoqueratinas PSA PgR ER, CDX2+, CK20+, CK7- TTF1, Napsina A, CK7+ Tiroglobulina, Calcitonia NSE, Cromogranina, Sinaptofisina AFP, OCT4, hCG, PLAP
LCA HMB45 S100, Vimentina, Desmina
Carcinoma Indiferenciado + - ± - - - ± Neoplasia da Próstata + + - - - - Neoplasia da Mama + - ± - - - ± Neoplasia Colorrectal + - - + - - - - Adenocarcinoma do Pulmão + - - - + - - - - Neoplasia da Tiroide + - - - ± + ± - - - - Tumor Neuroendócrino + - - - ± ± + - - - - Tumor da linha germinal + - - - + - - ± Linfoma - - - + - - Melanoma - - - + ± Sarcoma - - - ± +
O quadro demonstra padrões de marcação gerais mas exceções existem, especialmente para S100 e vimentina. Neoplasias neuroendócrinas e da tiroide são frequentemente positivas para CK7 e TTF1 mas não NapsinaA
PSA - prostate specific antigen; ER - estrogen receptor; PgR - progesterone receptor; CK - cytokeratin; TTF1 - thyroid transrcription factor 1; NSE - neuron-specific enolase; AFP - alpha fetoprotein; hCG - human chorionic gonadotropin; PLAP - placental alkaline phosphatase; LCA - leukocyte common antigen.
Quadro 6: Investigação imunohistoquímica nos casos de neoplasia oculta. (Adaptado de K.
Fizazi, F. A. Greco, N. Pavlidis, G. Daugaard, K. Oien & G. Pentheroudakis, on behalf of the ESMO Guidelines Committee (2015). Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v133–v138)
Atualmente, a IHQ consegue prever o local do tumor primário em cerca de 35 a 40% das neoplasias metastizadas [5]. No entanto, e tendo em conta o Quadro 5, a IHQ não tem especificidade ou sensibilidade para algumas neoplasias primárias, nomeadamente neoplasias do trato gastro-intestinal superior (gastro-esofágico) ou biliopancreáticas. Por isso, na grande maioria dos casos, o perfil IHQ pode apenas sugerir um conjunto de possíveis diagnósticos diferenciais e não indicar um diagnóstico único e conclusivo [5].
De destacar que o PSA e a tiroglobulina são os marcadores disponíveis mais específicos, embora as neoplasias da próstata e da tiroide muito raramente se apresentem sob a forma de NO [17].
A nível imagiológico, várias são as considerações a ter em conta (Quadro 7) como: a realização de exames endoscópicos deve ser guiada não só pelos sinais e sintomas mas também pelos achados laboratoriais; a realização de 2-deoxy-2-[18F]fluoro-D-glucose-positron emission tomography (FDG–PET)/TC de corpo pode contribuir para esclarecer o diagnóstico nos casos de adenopatias cervicais de NO ou nos casos de NO com metástase única.
Procedimentos aconselhados Tipo de doente
História clínica e exame objetivo Todos
Análises sanguíneas e bioquímicas gerais Todos
TC tóraco-abdomino-pélvica Todos
Mamografia Doentes sexo feminino
Investigação se NO diagnosticada:
-RM mamária Doentes sexo feminino com adenocarcinoma axilar
-AFP e hCG séricos Doentes com doença metastática na linha média
-PSA sérico Doentes do sexo masculino com metástases ósseas
adenocaricinomatosas
-CT/PET cabeça e pescoço (opcional) Carcinoma pavimentoso cervical
-Endoscopia Orientado por sinais/sintomas/achados laboratoriais
-Octreoscan e cromogranina Doentes com NO neuroendócrina
-Investigação de patologia secundária Orientado por sinais/sintomas/achados laboratoriais Quadro 7: Guidelines de diagnóstico e estadiamento em neoplasia oculta. (Adaptado de K.
Fizazi1, F. A. Greco, N. Pavlidis, G. Daugaard, K. Oien & G. Pentheroudakis, on behalf of the ESMO Guidelines Committee (2015). Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v133–v138)
Prognóstico
A NO é a terceira/quarta causa de morte por neoplasia [30, 31]. Apesar do aumento da sensibilidade diagnóstica na NO, a sobrevida tem-se mantido inalterada, sugerindo tratar-se de uma doença que, como entidade clínica, tratar-se tem mantido uniforme [32]. Na globalidade dos casos (80 a 85%), o prognóstico é desfavorável (sobrevida média de 6 a 10 meses), apresentado modesta sensibilidade à quimioterapia e sobrevida de cerca de 50% a 1 ano e de 10% a 5 anos, desde a data de diagnóstico [33]. Uma pequena percentagem dos doentes (15 a 20%) pertence ao subgrupo de melhor prognóstico, com neoplasias mais diferenciadas e quimiossensíveis, apresentando taxas de sobrevida mais elevadas [5].
Os fatores de prognóstico incluem performance status, localização e número de metástases, resposta à quimioterapia e níveis séricos de lactato desidrogenase (LDH) [17], podendo dividir-se os doentes em dois subgrupos e em categorias de risco específicas de acordo com os órgãos envolvidos (estadio da doença) e histologia, de forma a otimizar o tratamento [34]:
1) doentes com bom performance status (0 a 1) e LDH dentro de valores normais, com sobrevida média de vida de 1 ano;
2) doentes com LDH elevada e/ou mau performance status, com sobrevida média de cerca de 4 meses. [6]
Para além disso, podem considerar-se fatores preditores de mau prognóstico os diagnósticos de: adenocarcinoma com metastização hepática; ascite maligna não papilar; metástases cerebrais múltiplas; metástases pulmonares/pleurais múltiplas; doença óssea sistémica.
Por outro lado, fatores preditores de bom prognóstico estão relacionados com: carcinoma pouco diferenciado com distribuição mediana; adenocarcinoma papilar da cavidade peritoneal (na mulher); adenocarcinoma que envolva apenas nódulos linfáticos axilares (na mulher); carcinoma pavimentoso com envolvimento de gânglios linfáticos cervicais; adenopatia maligna isolada; carcinoma neuroendócrino pouco diferenciado; tumor único, pequeno e com potencial ressecabilidade [35].
De realçar que os doentes que ficam livres de doença terão maior risco de neoplasia subsequentemente [36].
Terapêutica [6]
A terapêutica da NO deve ser ponderada a nível individual, de acordo com as bases clinico-patológicas e subgrupo de prognóstico em que o doente se insere, recomendando-se fortemente o acompanhamento do doente em centros especializados.
Uma vez que a maioria dos casos de NO se apresenta em estadio avançado, a terapêutica sistémica é a abordagem mais comum. Atualmente, não está definido qual o melhor esquema terapêutico, sendo que a maior parte dos regimes em prática utilizam agentes antineoplásicos contendo platina [5].
Os doentes que pertencem ao subgrupo de bom prognostico, devem ser tratados de forma semelhante àqueles com equivalente tumor primário metastizado conhecido (Quadro 8). Estes doentes conseguem atingir controlo de doença em 30 a 60% dos casos, semelhante aos equivalentes de origem conhecida.
Subtipo de NO Tratamento proposto Provável neoplasia equivalente de origem
conhecida
Carcinoma neuroendócrino pouco diferenciado
Quimioterapia combinada platina + etoposido Carcinoma neuroendócrino pouco diferenciado Carcinoma neuroendócrino bem
diferenciado
Análogos da somatostatina, streptozocina, 5-FU, sutinib, everolimus
Carcinoma neuroendócrino bem diferenciado
Adenocarcinomatose papilar peritoneal tipo seroso em mulheres
Cirurgia de remoção otimizada seguida de quimioterapia baseada em platina-taxano
Neoplasia do ovário
Nódulo metastático axilar isolado em mulher
Dissecção nodal axilar, mastectomia ou radioterapia mamária e quimiohormonoterapia adjuvante
Cancro da mama (encontrado em 50 a 70% quando é realizada RM)
Carcinoma pavimentoso que envolva nódulos linfáticos cervicais não supraclaviculares
Dissecção e/ou radioterapia bilateral do pescoço e eixo cabeça-pescoço; combinação de quimioterapia e platina ou quimioradioterapia para estadios avançados
Carcinoma pavimentoso da cabeça e pescoço
NO com perfil molecular ou IHQ (CK20+, CDX2+, CK7-) colorretal
Tratamento sistémico utilizado para neoplasia colorretal
Neoplasia colorretal metastizada
NO de metástase única Ressecção e/ou RT com ou sem terapêutica sistémica
Metástase única Homem com metástase óssea OU
com IHQ/PSA+
Terapia de supressão de androgénio com ou sem radioterapia
Neoplasia da próstata
5-FU - 5-fluorouracil; RM – ressonância magnética; IHQ - imunohistoquímica; PSA - prostate-specific antigen; RT - Radioterapia; CK - citoqueratina
Quadro 8: Terapêutica comummente utilizada em doentes com neoplasia oculta de bom prognostico. (Adaptado de K. Fizazi1, F. A. Greco, N. Pavlidis, G. Daugaard, K. Oien & G. Pentheroudakis, on behalf
of the ESMO Guidelines Committee (2015). Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v133–v138)
Em relação aos doentes com mau prognóstico (Quadro 9), muitos são os estudos realizados no sentido de perceber qual a melhor combinação de fármacos, com o mínimo de efeitos adversos, de forma a atingir o melhor controlo da doença. O consenso geral reside no objetivo único e realista de atingir um prolongamento da sobrevida e paliação sintomática com preservação da qualidade de vida, consequentemente, devem ser escolhidos regimes de quimioterapia de baixa toxicidade e doente-específicos.
Quimioterapia Cisplatina + Gemcitabina Cisplatina + Etoposido Paclitaxel + Carboplatina Docetaxel + Carboplatina Irinotecan + Oxaliplatina
Capecitabina oral + Oxaliplatina Gemcitabina/Irinotecan
Quadro 9: Agentes quimioterápicos de baixa toxicidade comummente utilizados em doentes com neoplasia oculta de mau prognostico. (Adaptado de K. Fizazi1, F. A. Greco, N. Pavlidis,
G. Daugaard, K. Oien & G. Pentheroudakis, on behalf of the ESMO Guidelines Committee (2015). Cancers of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v133–v138)
Se em determinado doente a avaliação do padrão metastático, resultados de testes clínicos e laboratoriais, exames imagiológicos, avaliações patológicas e expressão génica forem relativamente inespecíficos/ambíguos, um tratamento específico localizado (por exemplo, radioterapia) pode ser considerado, embora não exista evidência prospetiva de que tal seja mais benéfico do que a quimioterapia empírica.
A resposta à terapêutica deve ser avaliada após dois ou três ciclos de quimioterapia através de testes ajustados a cada doente e situação clínica, sendo que a avaliação da qualidade de vida é particularmente importante nos doentes com NO de mau prognóstico, onde a toxicidade excessiva do tratamento pode invalidar o mesmo.
CASOS CLÍNICOS – APRESENTAÇÃO CLÍNICA e EVOLUÇÃO
Em seguida, apresentam-se quatro casos clínicos de doentes internados no serviço de Medicina 1C do Hospital de Santa Maria que constituem exemplos ilustrativos de NO, nomeadamente na gravidade da forma de apresentação, progressão rápida e dificuldade de estabelecer diagnóstico histológico.
Caso 1
Mulher, de 87 anos de idade, sem antecedentes pessoais ou familiares relevantes. Doente referenciada e seguida em consulta de Doenças Autoimunes no Hospital de Santa Maria desde Fevereiro de 2015 por quadro cutâneo sugestivo de Dermatomiosite com 7 meses de evolução, apresentado rash eritematoso maculo papular, pruriginoso na face, ao longo da linha de implantação capilar, região cervical posterior, membro superior esquerdo, dorso de ambas as mãos e hiperémia periungueal sugestiva de vasculite peri-ungueal. Negava úlceras orais, artrite/artralgias, xerostomia/xeroftalmia, mialgias/ fraqueza muscular ou sintomas sugestivos de fenómeno de Raynaud. Realizou biópsia cutânea cujo resultado foi compatível com o diagnóstico de Dermatomiosite, sem aparente envolvimento muscular avaliado clínica, laboratorial e eletromiograficamente. Do estudo imunológico alargado destacava-se apenas anticorpo anti-nuclear (ANA) positivo em título baixo (1/160), sem outras alterações, nomeadamente com perfil ENA (extraible nuclear antigens) negativo, anti-dsDNA (anti-double stranded DNA) negativo e ausência de consumo de complemento. Iniciou corticoterapia em dose baixa (prednisolona) com resolução do rash cutâneo. Atendendo à idade de início de sintomas, paucidade de alterações imunológicas e ausência de envolvimento muscular, admitiu-se Dermatomiosite Amiopática de provável etiologia paraneoplásica.
Após clínica favorável durante o primeiro ano de seguimento, sem recidiva de manifestações cutâneas e investigação complementar sem identificação de neoplasia, verificou-se instalação insidiosa de quadro consumptivo caracterizado por perda ponderal estimada de 15 kg, anorexia, astenia, fraqueza muscular generalizada e adinamia, sem outra sintomatologia de órgão. Admitida a hipótese de exacerbação de Dermatomiosite, foi aumentada a dose de prednisolona e associada azatioprina, sem qualquer benefício clínico e verificando-se evidência laboratorial de quadro inflamatório sistémico major, caracterizado por elevação de ferritina (2925ng/mL), hiperfibrinogenémia e elevação da
proteína C reativa (PCR) (17 mg/dL) e velocidade de sedimentação (VS) (120mm/h), com procalcitonina negativa.
Foi discutida com a família a hipótese de internamento, optando-se por seguir a doente em ambulatório. Durante esse período repetiu-se estudo complementar exaustivo para identificação de eventual progressão de quadro oncológico de base, incluindo:
• Radiografia do tórax que não demonstrou alterações de relevo;
• TC tóraco-abdómino-pélvica que não revelou lesões neoformativas ou adenopatias;
• Endoscopia digestiva alta e colonoscopia que não revelaram alterações; • Videoendoscopia por cápsula que não demonstrou alterações;
• Ecografia ginecológica que revelou pólipo endometrial, tendo sido excluída a hipótese de neoplasia após biópsia e exame anátomo-patológico;
• Mamografia e ecografia mamária sem alterações de relevo; • Biópsia muscular sem alterações de relevo;
• Mielograma sem alterações;
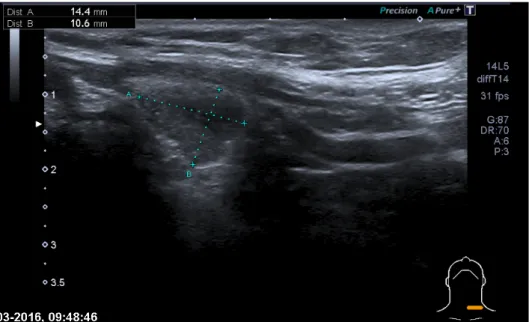
• Ecografia tiroideia que demonstrou nódulo tiroideu cujo exame anatomo-patológico foi inconclusivo verificando-se persistência de estado eutiroideu (Figura 1);
• Imunofixação urinária com elevação cadeias K e protéina de Bence Jones negativa; imunofixação sérica com pico oligoclonal em K e L.
Por persistência e agravamento do quadro supracitado, optou-se por internamento eletivo para estabilização clínica e investigação de provável NO.
À data da entrada no internamento (Junho de 2016), destacava-se ao exame objetivo edema bilateral dos membros inferiores até ao joelho Godet +++, sem sinais de trombose venosa profunda; sem adenopatias palpáveis, massas ou organomegálias à inspeção abdominal; auscultação cardiopulmonar sem sopros e sem evidências de estase; sem ingurgitamento jugular ou reflexo hepáto-jugular.
Laboratorialmente, salientava-se anemia microcítica hipocrómica (hemoglobina (Hb) 8,1g/dL) com estudo etiológico compatível com etiologia de doença crónica, leucocitose 15.910x109/L com neutrofilia, VS 120 mm/h, PCR 19,5mg/dL com procalcitonina negativa (0,31 ng/mL), prolongamento espontâneo do international normalized ratio (INR) (1,72), elevação da β2-microglobulina (4,4 ng/mL) com LDH elevada (321 U/L), elevação dos parâmetros de citocolestase hepática e hipoalbuminémia (1,6mg/dL). Da investigação complementar realizada em internamento destacava-se:
• Radiografia do tórax sem alterações de relevo;
• Hemoculturas e uroculturas que se revelaram negativas;
• Ecocardiograma transesofágico que excluiu endocardite infeciosa;
• Rectossigmoidoscopia devido as queixas de tenesmo e dor anal que não evidenciou alterações.
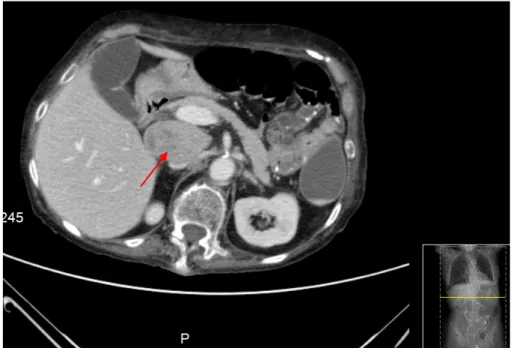
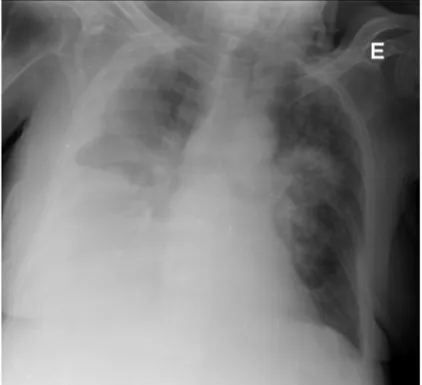
• TC tóraco-abdómino-pélvica (Figura 2) que relatava: ligeiro derrame pleural bilateral, mais volumoso à esquerda; nódulo com cerca de 1 cm na vertente inferior do lobo esquerdo da tiroide, sem adenopatias patológicas; no território do tronco celíaco, em localização anterior à veia cava inferior (VCI) e posterior ao confluente espleno-portal observada massa com cerca de 67 mm x 55mm x 35 mm, independente do fígado, do pâncreas e do estômago que parecia de origem adenopática; duas adenopatias retroperitoneais, pré-vasculares, com menor eixo justa-centimétrico.
Figura 2: TC tóraco-abdomino-pélvica que demonstra “No território do tronco celíaco, em
localização anterior à VCI e posterior ao confluente espleno-portal observamos massa com cerca de 67 mm x 55 mm x 35 mm, independente do fígado, do pâncreas e do estômago que nos
parece de origem adenopática.”
As imagens da TC foram discutidas com a equipa de Imagiologia que considerou que a massa descrita não seria passível de ser abordada por biópsia aspirativa ecoguiada atendendo à sua localização. No entanto, uma vez que não foi possível caracterizar a origem (hepática vs. adenopática) desta massa por este método de imagem, foi sugerida a realização de RM abdominal e eventualmente biópsia laparoscópica após estabilização clínica.
Perante os dados imagiológicos, considerou-se como diagnóstico mais provável a presença de neoplasia de etiologia não esclarecida a condicionar quadro consumptivo major e Dermatomiosite Amiopática paraneoplásica.
A doente teve alta para seguimento em consulta de Medicina Interna 16 dias depois do início do internamento de forma a realizar os restantes exames complementares em ambulatório, nomeadamente RM abdominal e punção aspirativa ecoguiada de nódulo tiroideu. Ficou ainda referenciada à consulta de Imuno-hemoterapia no Hospital de Santa Maria para monitorização de anemia crónica e realização de suporte transfusional quando adequado.
No entanto, a doente recorreu ao serviço de urgência (SU) do Hospital de Santa Maria cerca de 10 dias (26 de Julho) depois por quadro de dor abdominal, recusa alimentar, prostração, urina turva com cheiro fétido e oligúria, tendo realizado, nesse contexto,
urocultura em ambulatório com isolamento de Escherichia coli e Enterobacter cloacae. Negava febre, vómitos, dispneia ou alterações gastrointestinais, referindo, no entanto, agravamento do quadro consumptivo. Foi iniciada antibioterapia de acordo com antibiograma, assumindo-se urossépsis de etiologia nosocomial.
Durante o internamento, apesar de antibioterapia dirigida, a doente manteve agravamento franco do estado geral, com prostração marcada, recusa alimentar e progressiva diminuição da diurese. Não se verificaram picos febris, mantendo, contudo, elevação dos parâmetros de fase aguda.
Clinicamente, por haver evidência de desconforto, com fácies de dor, foi otimizada a terapêutica opióide, com controlo da sintomatologia. Dado o estado funcional da doente, sem possibilidade de realização de investigação adicional ou quimioterapia dirigida a NO, foi decidido em conjunto com a família manter apenas medidas de conforto, pelo que não foi realizada RM abdominal ou biópsia ecoguiada de nódulo tiroideu previamente programadas.
Foi verificado e certificado o óbito 14 dias depois do inicio do internamento. A família recusou realização de autópsia para esclarecimento histológico de neoplasia, impossibilitando o estabelecimento de diagnóstico etiológico formal.
Caso 2
Mulher, 72 anos, com antecedentes de: regurgitação mitral ligeira; incontinência urinária; status pós-apendicectomia; queratose actínica no dorso do nariz; sem outros antecedentes pessoais ou familiares relevantes. Internada no serviço de Medicina 1C a 7 de Dezembro de 2016.
A doente referia retorragias ocasionais no ano que antecedeu o internamento, sem outra sintomatologia associada, nomeadamente tenesmo ou falsa vontade de defecar, estando aparentemente estável até 5 meses antes do internamento, quando iniciou quadro de anorexia e astenia, com perda ponderal de cerca de 10 kg. Negava febre, sudorese noturna ou sintomatologia respiratória, gastrintestinal ou génito-urinária. Nas 2 semanas que antecederam o internamento, descrevia agravamento do estado geral, retorragias de sangue vivo frequentes, cansaço e dispneia, disfagia predominantemente para sólidos, e toracalgia direita de tipo pleurítico pelo que recorreu ao SU do Hospital de Santa Maria. À observação no SU, destacava-se: auscultação pulmonar com murmúrio vesicular presente em ambos os hemicampos mas diminuído no hemicampo direito; hepatomegalia discreta homogénea e dor à palpação da fossa ilíaca esquerda, sem reação peritoneal. Laboratorialmente destacava-se: Hb 12g/dL, leucocitose (17.00x109/L) com neutrofilia (93,9%), trombocitopenia (100.000/mm3), ureia 93mg/dL, creatinina 1,3mg/dL
(0,44mg/dl na semana antecedente), sódio 134 mg/dL; potássio 5,4mg/dL, ALT 21 U/L, AST 35 U/L, bilirrubina total 1,16 mg/dL, LDH 439 U/L, fósforo 4,8 mg/dL, PCR 23,4 mg/dL, hipoalbuminémia (2,9mg/dL). Gasimetria arterial em ar ambiente evidenciava acidose metabólica por hiperlactacidémia compensada e insuficiência respiratória parcial (pH 7,487; pCO2 29,2mmHg; 63,3mmHg; HCO3- 23,5mmol/L; Lactato 84mg/dL). Da investigação complementar realizada destacava-se:
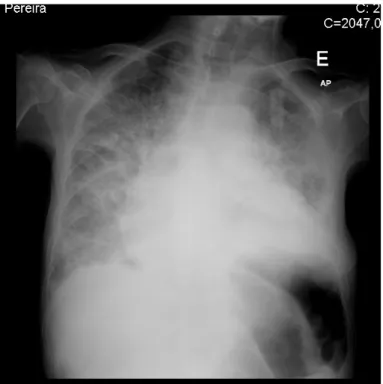
• Radiografia de tórax (Figura 3) que revelou derrame pleural direito e reforço intersticial bilateral;
• Ecografia abdominal que relatava derrame pleural direito; moderada quantidade de líquido intraperitoneal observado em todos os quadrantes abdominais; vesícula biliar em repleção, com conteúdo endoluminal em topografia de declive que se interpretaram como litíase e lamas biliares; presença de imagem interpretada como conteúdo ecogéneo em topografia dependente na bexiga; endométrio com 11/12 mm de espessura, a esclarecer por estudos dirigidos.
Figura 3: Radiografia do tórax que demonstra derrame pleural direito e reforço intersticial bilateral.
Admitindo-se síndrome consumptivo em estudo e eventual pneumonia adquirida na comunidade, foi iniciada antibioterapia empírica com ceftriaxone e azitromicina após exames culturais e antigenúrias para Pneumococcus e Legionella. Após isolamento de Escherichia coli produtora de b-lactamase em hemocultura e urocultura, admitiu-se quadro de sépsis com ponto de partida urinário, tendo sido alterada antibioterapia para meropenem de acordo com teste de sensibilidade aos antibióticos.
Durante os primeiros dias de internamento, a doente apresentou-se apirética e estável hemodinamicamente. Do estudo laboratorial complementar destacava-se anemia normocítica normocrómica (10g/dL) com estudo de fatores hematopoiéticos compatível com etiologia de doença crónica e défice de folato. Constatada persistência de hiperlactacidémia, hiperuricémia, consumo de fibrinogénio e trombocitopénia, na ausência de alteração de tempos de coagulação e sem elevação de LDH, creatina quinase ou alterações do ionograma sérico que suportassem o diagnóstico de coagulação intravascular disseminada (CID)/ púrpura trombocitopénica trombótica (PTT) nem de síndrome de lise tumoral.
A doente realizou paracentese diagnóstica sem complicações aparentes, constatando-se saída de líquido sero-hemático turvo cujo exame citoquímico foi compatível com exsudado, exame bacteriológico negativo e exame anátomo-patológico negativo para
células neoplásicas.
Para alívio sintomático da dispneia e tendo em conta a hipoxémia persistente, foi realizada toracocentese diagnóstica e terapêutica com saída de 1500cc de líquido sero-hemático, com exame citoquímico do líquido sem consumo de glicose e adenosina deaminase (ADA) não aumentado e estudo microbiológico negativo (micológico, micobacteriológico e bacteriológico em aero e anaerobiose).
Por queixas de disfagia, a doente foi observada pela equipa de Otorrinolaringologia que não documentou nenhuma alteração de relevo.
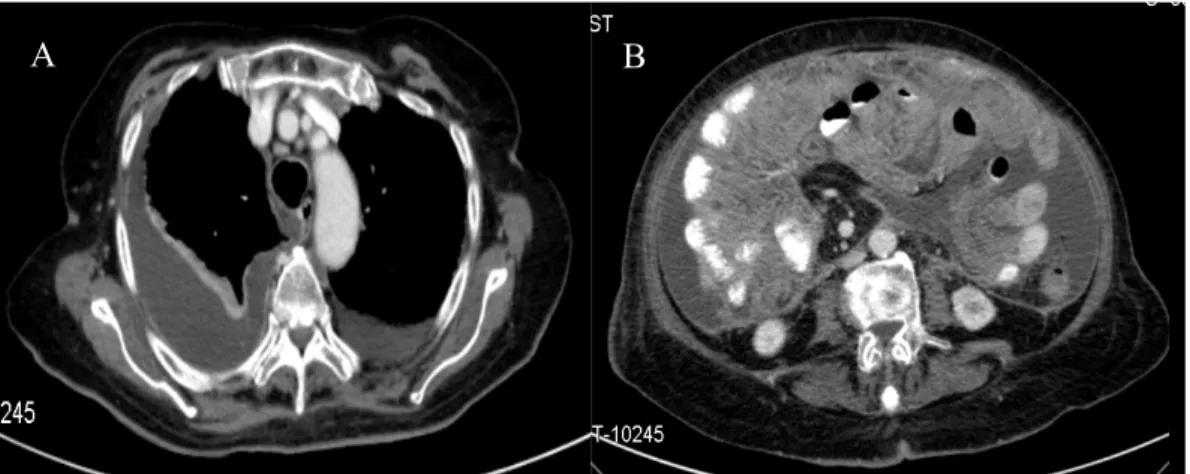
Realizou TC tóraco-abdómino-pélvica (Figura 4) que evidenciou: derrame pleural bilateral mais acentuado à direita, condicionando atelectasia do pulmão adjacente; trombose de ramos segmentares da artéria pulmonar esquerda; aumento da espessura do grande epíploon e da parede de todo o cólon bem como da parede de algumas ansas do delgado que pareciam encarceradas, associando-se a ascite moderada (carcinomatose vs. infeção tuberculosa); sem evidências de adenopatias ou outras alterações de relevo.
Figura 4: TC tóraco-abdomino-pélvica: A) derrame pleural bilateral mais acentuado à direita, condicionando atelectasia do pulmão adjacente; B) aumento da espessura do grande epíploon e
da parede de todo o cólon bem como da parede de algumas ansas do delgado que parecem encarceradas, associando-se a ascite moderada.
O quadro clinico foi discutido com a equipa de Cirurgia Geral atendendo a referência a possível encarceramento de ansas intestinais e hiperlactacidémia mantida, tendo sido considerado que, perante doente com estabilidade hemodinâmica, tolerância de via oral, trânsito intestinal mantido e ausência de clínica de abdómen agudo, a atitude expectante seria a atitude a tomar até realização de colonoscopia (que não foi realizada em tempo útil pela impossibilidade de ser fornecido apoio pela Anestesia).
Foi, ainda, realizada ecografia ginecológica que não evidenciou alterações de relevo. Apesar de evidência de tromboembolismo pulmonar na TC, e atendendo à suspeita de presença de coagulopatia de consumo (com contagem de plaquetas mínima de 64.000/mm3 e consumo de fibrinogénio, com valor mínimo de 161 mg/dL;), optou-se por não iniciar hipocoagulação.
Durante o internamento, a doente apresentou como intercorrência infeção a Influenza A de transmissão nosocomial, confirmada por zaragatoa nasofaríngea tendo realizado terapêutica antiviral dirigida com Oseltamivir.
Ao 13º dia de internamento, verificou-se deterioração clinica marcada com agravamento da hipoxémia e polipneia, com necessidade de oxigenoterapia suplementar em alto debito (FiO2 de 100%), apesar de apirexia e estabilidade hemodinâmica mantidas. Foi repetida
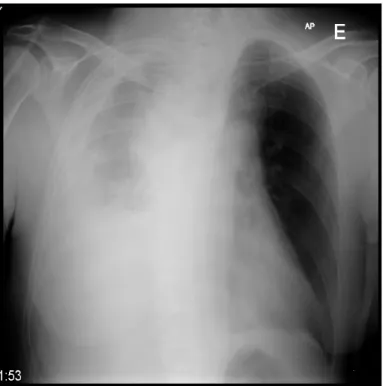
radiografia de tórax (Figura 5) que evidenciou: recidiva de derrame pleural à direita e espessamento pleural a condicionar desvio do parênquima pulmonar; lesão nodular de limites mal definidos a nível para-hilar à esquerda.
Figura 5: Radiografia do tórax com: derrame pleural à direita e espessamento pleural a condicionar desvio do parênquima pulmonar; lesão nodular de limites mal definidos a nível para-hilar à
esquerda.
Foi realizada nova toracocentese tendo sido drenados 1000cc de liquido sero-hemático compatível com exsudado, com exame micobacteriológico e bacteriológico negativo,
(incluindo Ziehl-Neelsen negativo), persistindo evolução clínica desfavorável.
Por deterioração ventilatória marcada [insuficiência respiratória global com retenção discreta de CO2 interpretada como tendo etiologia multifatorial (tromboembolismo
pulmonar; infeção por influenza; envolvimento pleural/pulmonar)] e perante ausência de diagnóstico formal, a doente foi discutida com o Serviço de Medicina Intensiva que após avaliação da doente na enfermaria, considerou não haver indicação para escalar suporte de órgão que justificasse transferência para este serviço, considerando-se como suporte ventilatório máximo instituição de ventilação não invasiva, que a doente recusou apesar de falência ventilatória refratária a terapêutica médica otimizada rapidamente progressiva.
Foi discutida a situação clínica com a família que compreendeu a gravidade da situação clínica e paucidade de opções terapêuticas, pelo que se decidiu não instituir manobras de reanimação e privilegiar medidas de conforto.
Foi verificado e certificado o óbito 17 dias depois do inicio do internamento. A família recusou realização de autópsia para esclarecimento histológico de neoplasia, impossibilitando o estabelecimento de diagnóstico etiológico formal.
Caso 3
Mulher, 55 anos de idade, com antecedentes pessoais conhecidos de tabagismo (90 unidades maço-ano (UMA)), status pós-histerectomia e ooforectomia bilateral (desconhece-se contexto clínico que levou a esta intervenção). Sem outros antecedentes pessoais ou familiares relevantes.
Doente saudável até 1 ano antes do internamento, altura em que iniciou queixas de anorexia não seletiva e perda ponderal quantificada em 10 kg. No mês que antecedeu o internamento referia astenia, dispneia para esforços moderados, aumento do volume abdominal e toracalgia à esquerda de características pleuríticas de intensidade crescente. Referia ainda tosse crónica produtiva, não purulenta, sem aumento recente da quantidade ou alteração das características da expetoração. Realizou ecografia abdominal em ambulatório no mês anterior ao internamento que não revelava alterações.
Negava febre, hemoptises, angor, ortopneia ou dispneia paroxística noturna, sintomatologia urinária ou gastrointestinal ou outra de relevo. Por persistência da sintomatologia supra-descrita, recorreu ao SU do Hospital de Santa Maria no dia do internamento.
À observação no SU destacava-se auscultação pulmonar com murmúrio vesicular diminuído em ambas as bases, com discretos fervores crepitantes no hemitórax esquerdo; dor à palpação da grelha costal esquerda; abdómen distendido com dor à palpação superficial e profunda, sem defesa; sem outras alterações de relevo ao exame objetivo. Laboratorialmente, destacava-se anemia normocítica normocrómica (10g/dL), leucocitose (12.18x109/L) com neutrofilia (79,7%), PCR 9,30 mg/dL, LDH 203 U/L, trombocitose, hiponatrémia hiposmolar de 131 mmol/L, discreto padrão colestático sem hiperbilirrubinémia. Radiografia do tórax com hipotransparência da base esquerda (sobreponível a radiografias anteriores) e presença de múltiplas lesões grosseiramente nodulares dispersas ao nível do hemitórax direito, esboçando condensação a nível para-cardíaco homolateralmente de novo. (Figura 6)
Figura 6: Radiografia do Tórax com hipotransparência da base esquerda (sobreponível a radiografias anteriores) e da base direita (de novo).
A doente ficou internada no serviço de Medicina Interna do Hospital de Santa Maria com os diagnósticos de pneumonia adquirida na comunidade e quadro consumptivo de etiologia a esclarecer.
Foi instituída antibioterapia empírica com amoxicilina e ácido clavulânico que cumpriu durante 7 dias, sem isolamentos nos exames bacteriológicos de sangue e de expetoração (Ziehl-Neelsen negativo) e com serologias para Vírus da Imunodeficiência Humana (VIH) negativas.
Verificou-se persistência de elevação de parâmetros de fase aguda e procalcitonina negativa e, clinicamente, toracalgia pleurítica mantida e astenia marcada a condicionar incapacidade para a marcha e dependência gradual de terceiros.
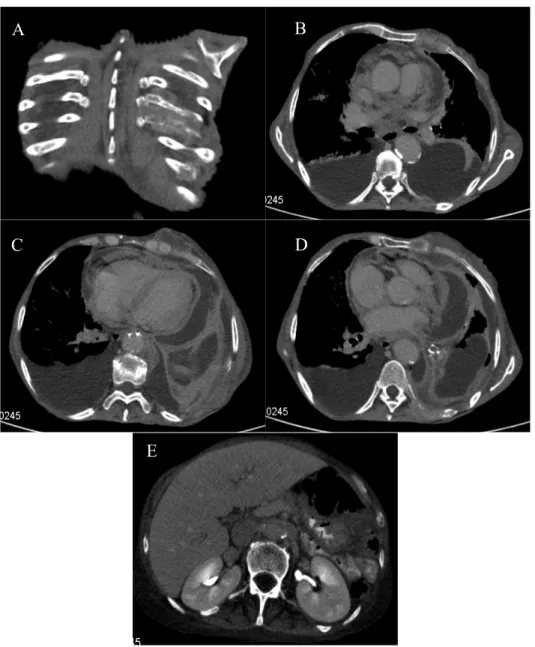
Para esclarecimento do quadro consumptivo, realizou TC tóraco-abdómino-pélvica (Figura 7) com contraste que foi compatível com NO com metastização óssea, pleural, pericárdica, da parede torácica e do espaço subdiafragmático esquerdo, descrevendo-se “lesões líticas com componente de partes moles do 7º ao 10º arco costal posterior esquerdo, que se estendia à parede torácica póstero-lateral na transição dorso lombar dando origem a massa com 5x2cm que captava contraste de forma heterogénea por provável necrose; lesão lítica do corpo do esterno lateralizada à esquerda igualmente com componente de partes moles com a mesma modalidade de captação de contraste; moderado derrame pleural esquerdo metastático; moderado derrame pericárdico com
alguma loculação e importante espessamento nodular, sólido, irregular que igualmente se interpretou como metastático; invasão da veia lobar pulmonar inferior esquerda com obliteração do lúmen por lesão com 2,5 cm. No parênquima pulmonar arejado existiam lesões de enfisema e nos lobos médio e inferior direito, espessamento septal por provável edema; derrame pleural direito de volume moderado, livre; hepatomegalia homogénea; no espaço subdiafragmático esquerdo existia nódulo sólido com 2,8 cm adjacente ao ângulo esplénico do cólon; pequena a moderada ascite com localização subdiafragmática e cavidade pélvica; adenopatia com 1 cm lombo-aórtica inferior à veia renal esquerda; sem outras alterações de relevo descritas.
Figura 7: TC tóraco-abdomino-pélvica: A) lesões líticas com componente de partes moles do 7º ao 10º arco costal posterior esquerdo; B/C/D) lesão lítica do corpo do esterno lateralizada à esquerda, derrame pleural bilateral; moderado derrame pericárdico com alguma loculação e importante espessamento nodular, sólido; E) adenopatia com 1 cm lombo-aórtica inferior à veia
renal esquerda
A B
C D
O caso foi discutido com a equipa de Imagiologia de Intervenção tendo sido realizada biópsia ecoguiada de massa da parede torácica à esquerda. Foi igualmente discutido com a equipa de Pneumologia de intervenção no sentido de orientar toracocentese diagnóstica e terapêutica do derrame pleural à esquerda tendo, no entanto, sido protelada após realização de ecografia torácica pela especialidade que revelou massa junto à pleura, de grandes dimensões, com pequena quantidade de líquido, sem margem para a realização do procedimento com segurança.
Por dor irruptiva não controlada apesar de terapêutica analgésica otimizada em doente com neoplasia extensamente metastizada em estudo, sem status funcional que permitisse iniciar quimioterapia empírica paliativa, privilegiou-se promoção de conforto, tendo sido instituída terapêutica opióide em perfusão contínua, verificando-se o óbito 24h depois ao 15º dia de internamento.
O resultado anátomo-patológico da biópsia ecoguiada da massa da parede torácica ficou disponível 23 dias após o óbito, revelando neoplasia maligna epitelial pouco diferenciada de alto grau, cuja marcação IHQ (EMA (Epithelial membrane antigen) + focal; CK8/18 + focal; CD10 + ; Vimentina + ; CK7 - ; TTF 1 - ; BerEP4 - ; S100 - ; Desmina - ; CD 34 - ; LCA - ; Calretinina - ; CK5/6 - ; WT 1 -) foi compatível com carcinoma pouco diferenciado de alto grau, sendo colocada como primeira hipótese origem renal, embora não pudessem ser excluísse outras localizações.
A família recusou realização de autópsia para esclarecimento da origem neoplásica, impossibilitando o estabelecimento de diagnóstico etiológico formal.
Caso 4
Mulher, 56 anos de idade, com antecedentes pessoais trombose venosa profunda popliteia esquerda 12 anos antes, sem suspeita de trombofilia associada, sem recorrência de episódios trombóticos; esclerose múltipla primária progressiva com 10anos de evolução com compromisso motor acentuado. Sem outros antecedentes pessoais ou familiares relevantes.
Doente aparentemente estável até cerca de 3 meses antes do internamento, quando iniciou disfonia, tendo realizado em ambulatório TC cérvico-facial que descrevia assimetria das cordas vocais (com maior espessura à direita), hemiparesia da hemilaringe direita por eventual compromisso do nervo vago/nervo recorrente homolateral e atrofia ligeira da corda vocal/ligamento vocal à esquerda e ecografia cervical que relatava múltiplas adenopatias dispersas nas cadeias cervicais, hilares e mediastínicas, presença de derrame pleural bilateral, aspetos sugestivos de doença linfoproliferativa com significativo compromisso cervical e suspeita de envolvimento mediastínico. Iniciou nessa altura seguimento na Fundação Champalimaud, sendo descrita desde então instalação gradual de anorexia não seletiva, perda ponderal não quantificada e incapacidade gradual para marcha autónoma. Após avaliação pelo Neurologista assistente, admitiu-se exacerbação de Esclerose Múltipla, tendo sido instituída terapêutica imunossupressora com metilprednisolona em alta dose (3 pulsos de 1g/dia) em regime de internamento, não sendo descritas outras intercorrências. Cerca de um mês após este internamento, verificou-se aparecimento de sinais inflamatórios do membro superior esquerdo onde fora colocado acesso venoso, associados a tumefação axilar direita com sinais inflamatórios francos (rubor e eritema), motivo pelo qual recorreu ao SU do Hospital de Santa Maria, tendo sido diagnosticada celulite e instituída antibioterapia empírica com amoxicilina e acido clavulânico.
Negava febre, sudação noturna, prurido, dispneia, precordialgia ou sintomatologia genito-urinária ou gastrointestinal.
No mês que antecedeu o internamento, foram realizados diversos métodos complementares de diagnóstico na Fundação Champalimaud, destacando-se:
• Ecografia tiroideia: múltiplas adenopatias dispersas pelas cadeias cervicais bilateralmente, cadeias jugulares internas, cadeias espinhais acessórias e cadeias do compartimento central em maior número e com maiores dimensões a direita (a adenopatia de maiores dimensões encontrava-se em topografia póstero-inferior ao lobo direito da tiroide e media 57x41 mm);
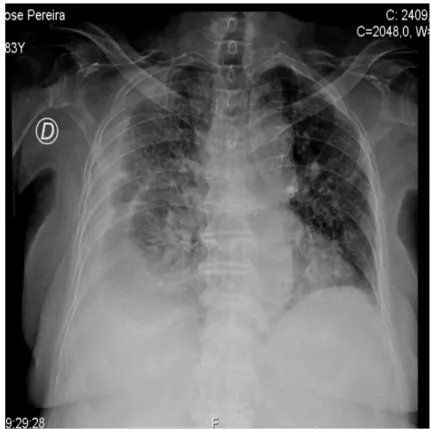
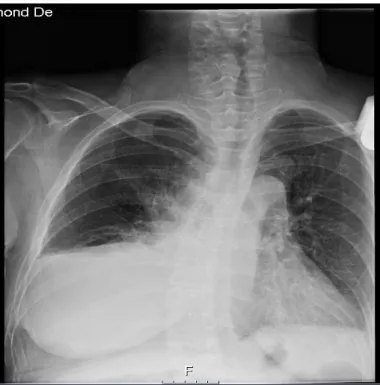
• Radiografia do tórax que demonstrava alargamento mediastínico, condicionado pela presença de lesões ocupando espaço na região hilar direita e região mediastínica superior, hipotransparência em toalha ocupando todo o campo pulmonar direito, obliterando os seios pleurais e apagamento da hemicúpula diafragmática homolateral, aspetos esses em relação com derrame pleural. Por agravamento das queixas de disfonia, disfagia com engasgamento frequente, tosse com expetoração mucosa que não conseguia mobilizar, condicionando incapacidade de manter via oral adequada, recorreu ao SU do Hospital de Santa Maria no dia 27 de Agosto de 2016.
À observação no SU destacava-se: adenopatias inframandibulares e cervicais bilaterais palpáveis com cerca de 1cm, móveis e indolores; tumefação axilar direita com cerca de 3 cm, com sinais inflamatórios (rubor e calor, com supuração); auscultação pulmonar com murmúrio vesicular mantido, mas abolido nos dois terços inferiores do hemitórax direito, sem ruídos adventícios; membros inferiores com discreto edema bimaleolar godet +, sem sinais de trombose venosa profunda; sem sinais meníngeos. A nível analítico a doente apresentava: Hb 9,7 g/dL; sem leucocitose; linfopénia de 14%; sem trombocitopénia ou alterações da coagulação; função renal sem alterações; ionograma com hiponatrémia discreta de 134 mmol/L; LDH aumentada (647 U/L); PCR de 8,82 mg/dL (valor prévio de 7,49 mg/dL 15 dias antes); sem outras alterações de relevo. Exame sumário de urina: urobilinogenúria de 4,0 mg/dL; bilirrubinúria de 1 mg/dL; cetonúria de 5 mg/dL; proteinúria de 25 mg/dL; leucocitúria 100 células/uL; sem eritrocitúria; nitritos positivos. Radiografia de tórax (Figura 8) apresentava derrame pleural bilateral de maior extensão à direita e alargamento do mediastino.