Universidade de Trás-os-Montes e Alto Douro
Serodiagnóstico da infeção por Toxoplasma gondii em carnívoros
domésticos- estudo comparativo entre o teste de aglutinação
modificado e o teste de hemaglutinação indireta
Dissertação de Mestrado Integrado em Medicina Veterinária
SUSANA FILIPA LIMA FERNANDES
Orientadora:
Professora Doutora Ana Patrícia Antunes Lopes (DVM, PhD)
Universidade de Trás-os-Montes e Alto Douro
Serodiagnóstico da infeção por Toxoplasma gondii em carnívoros
domésticos- estudo comparativo entre o teste de aglutinação
modificado e teste de hemaglutinação indireta
Dissertação de Mestrado Integrado em Medicina Veterinária
SUSANA FILIPA LIMA FERNANDES
Orientadora:
Professora Doutora Ana Patrícia Antunes Lopes (DVM, PhD)
Composição do júri:
Presidente: Doutor Carlos Alberto e Silva Venâncio (Universidade de Trás-os-Montes e Alto Douro)
Vogais: Luís Miguel Martins Lucas Cardoso (Universidade de Trás-os-Montes e Alto Douro)
Ana Patrícia Antunes Lopes (Universidade de Trás-os-Montes e Alto Douro)
iii
D
ECLARAÇÃONome: Susana Filipa Lima Fernandes
Endereço eletrónico: susana93_17@hotmail.com
Designação do mestrado: Mestrado Integrado em Medicina Veterinária
Título: “Serodiagnóstico da infeção por Toxoplasma gondii em carnívoros domésticos- estudo comparativo entre o teste de aglutinação modificado e o teste de hemaglutinação indireta”
Orientadora: Professora Doutora Ana Patrícia Antunes Lopes Ano de conclusão: 2017
Declaro que esta dissertação de mestrado, apresentada à Universidade de Trás-os-Montes e Alto Douro (UTAD) como requisito para a obtenção do grau de Mestre em Medicina Veterinária, é resultado do meu trabalho e pesquisa pessoal, assim como das indicações da minha orientadora, a Professora Doutora Ana Patrícia Antunes Lopes. O seu conteúdo é original, e não foi apresentado em nenhuma outra instituição. Declaro ainda que todas as fontes consultadas foram devidamente identificadas no texto e nas referências.
Vila Real, dezembro de 2017 Susana Filipa Lima Fernandes
v
A
GRADECIMENTOSÀ minha orientadora, a Professora Doutora Ana Patrícia Antunes Lopes pela paciência, disponibilidade, dedicação, incentivo e palavras amigas. Obrigada pelos esclarecimentos de dúvidas, pela revisão crítica deste trabalho e pela bibliografia facultada.
Ao Professor Doutor Luís Lucas Cardoso, pelo importante contributo na realização deste trabalho. Agradeço ainda, a dedicação, a disponibilidade e os esclarecimentos de dúvidas.
À equipa do Laboratório INNO, em especial à Doutora Paula Brilhante Simões por ter proporcionado o estágio e a recolha de amostras. A todos, o meu sincero obrigado pela paciência, pelos conhecimentos transmitidos e, acima de tudo pela amizade.
À equipa do Hospital Veterinário de Braga, pela paciência, pela confiança depositada e pela partilha de conhecimentos.
vii
R
ESUMOToxoplasma gondii, o agente etiológico da toxoplasmose, é um protozoário parasita intracelular obrigatório com distribuição mundial. Os felídeos, domésticos e selvagens, são fundamentais na epidemiologia da infeção uma vez que, como hospedeiros definitivos, são os únicos capazes de excretar milhões de oocistos não esporulados com as fezes, contaminado assim o meio ambiente. A infeção por T. gondii é uma importante causa de aborto e morte neonatal em vários hospedeiros, como o homem e o ovino.
Este estudo teve como objetivo comparar os resultados obtidos pelo teste de aglutinação modificado (“modified agglutination test”-MAT) (“cut off” de 20) com os obtidos pelo teste de hemaglutinação indireta (“indirect hemagglutination test”-IHAT) (“cut off” de 80) na pesquisa de anticorpos para T. gondii em 88 soros de carnívoros domésticos de Portugal, nomeadamente de 79 gatos (Felis catus) e nove cães (Canis lupus familiaris).
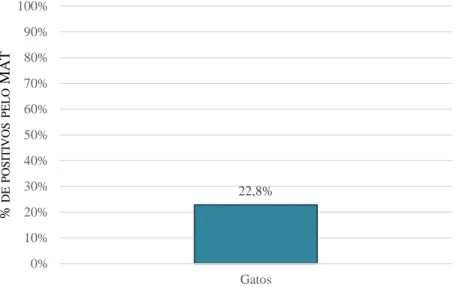
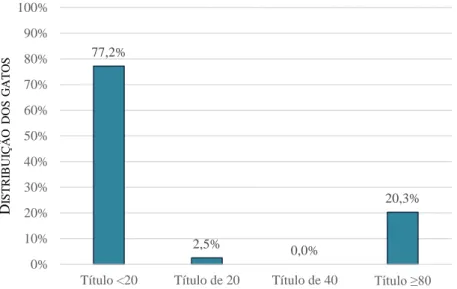
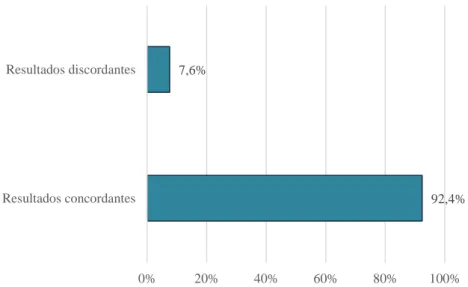
A seropositividade em gatos obtida pelo MAT (22,8%) foi superior à obtida pelo IHAT (15,2%). Nenhum dos soros de cães foi positivo pelo IHAT, porém 44,4% foram seropositivos pelo MAT. O grau de concordância entre os dois testes serológicos foi avaliado através do coeficiente kappa de Cohen (“Cohen’s coefficient kappa”-k). Deste modo, obteve-se uma concordância substancial (k=0,76) em soros de gatos, e uma fraca (k=0) em soros de cães. Utilizando o MAT como teste de referência, a sensibilidade relativa no IHAT foi de 66,7% e 0,0% em soros de gatos e cães, respetivamente; e a especificidade relativa foi de 100,0% em ambas as espécies.
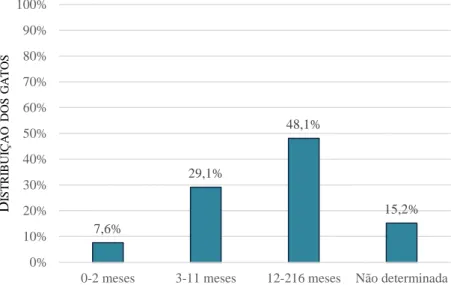
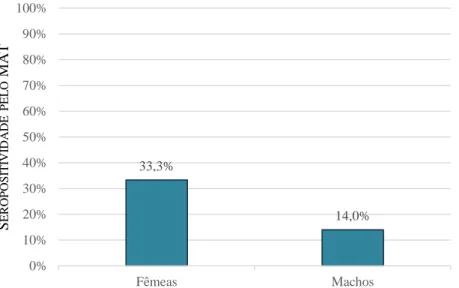
Em gatos e cães, não foi observada uma associação estatisticamente significativa entre a infeção e o grupo etário. Porém, em soros de gatos a comparação aos pares evidenciou diferenças significativas entre o grupo dos 0-2 e o dos 3-11 meses, e entre o dos 0-2 e o dos 12-216 meses.
Embora este trabalho possa ser considerado como um estudo preliminar, devido ao número reduzido de animais amostrados, os dados obtidos sugerem que o IHAT pode ser utilizado em associação com o MAT no diagnóstico da infeção por T. gondii em carnívoros domésticos. Adicionalmente, a baixa sensibilidade obtida no IHAT limita a sua utilização em estudos epidemiológicos em gatos e cães domésticos.
ix
A
BSTRACTToxoplasma gondii, the etiological agent of toxoplasmosis, is an obligate intracellular parasite with a worldwide distribution. Domestic and wild felids play a crucial role in the epidemiology of infection since, as definitive hosts, they are the only ones capable of shedding millions of nonsporulated oocysts with feces, thus contaminated the environment. T. gondii infection can cause abortion and neonatal death in several hosts, such as man and sheep.
The aim of this study was to compare the results obtained by the modified agglutination test (MAT) (cut off of 20) with those obtained by the indirect hemagglutination test (IHAT) (cut off of 80), in the detection of T. gondii antibodies in 88 domestic carnivores sera from Portugal, namely 79 cats (Felis catus) and nine dogs (Canis lupus familiaris).
The seropositivity in cats obtained by the MAT (22.8%) was higher than that obtained by the IHAT (15.2%). None of the dog’s sera were positive by the IHAT, but 44.4% were seropositive by the MAT. The degree of agreement between the two serological tests was evaluated using Cohen's coefficient kappa (k). In this way, a substantial agreement (k=0.76) was obtained in cat’s sera, and a slight (k=0) in dog’s sera. Using the MAT as the reference test, the relative sensitivity in the IHAT was 66.7% and 0.0% in sera from cats and dogs, respectively; and the relative specificity was 100.0% in both species.
In both cats and dogs, no significant statistical association was found between infection and age groups. However, in cat’s sera, the pairwise comparison showed significant differences between the 0-2 and 3-11 months groups, and between 0-2 and 12-216 months.
Although this work may be considered as a preliminary study, due to the small number of animals sampled, the data obtained suggest that the IHAT can be used in association with the MAT in the diagnosis of T. gondii infection in domestic carnivores. Additionally, the low sensitivity obtained with the IHAT limits its use in epidemiological studies in domestic cats and dogs.
xi
Í
NDICE GERAL AGRADECIMENTOS ... v RESUMO ... vii ABSTRACT ... ix ÍNDICE GERAL ... xi ÍNDICE DE FIGURAS ... xvÍNDICE DE GRÁFICOS ... xvii
ÍNDICE DE TABELAS ... xix
LISTA DE ABREVIATURAS ... xxi
Capítulo 1 – Revisão da literatura científica ... 1
1. Introdução ... 1
2. Toxoplasma gondii ... 2
2.1. Taxonomia ... 2
2.2. Morfologia das formas parasitárias ... 2
2.2.1. Taquizoíto ... 3
2.2.2. Bradizoíto ... 3
2.2.3. Oocisto ... 4
2.3. Caracterização de genótipos e variabilidade ... 5
3. Transmissão ... 6
3.1. Transmissão por oocistos... 6
3.2. Transmissão por quistos tecidulares ... 7
3.3. Transmissão por taquizoítos ... 8
4. Ciclo de vida ... 9
4.1. Fase extraintestinal ... 9
xii
5. Respostas imunitárias ... 12
6. Invasão e patogenia ... 14
7. Infeção por Toxoplasma gondii em animais ... 15
7.1. Carnívoros domésticos ... 16
7.2. Herbívoros e omnívoros domésticos ... 17
7.3. Animais exóticos e selvagens ... 20
8. Infeção por Toxoplasma gondii no homem ... 21
9. Diagnóstico ... 22
9.1. Deteção do agente ... 23
9.1.1. Citologia e imuno-histoquímica ... 23
9.1.2. Bioensaio ... 23
9.1.3. Exame coprológico ... 24
9.1.4. Reação em cadeia da polimerase ... 25
9.2. Métodos serológicos ... 25
9.2.1. Teste de lise ... 25
9.2.2. Teste de imunofluorescência indireta ... 26
9.2.3. Ensaio imunoenzimático... 26
9.2.4. Testes de aglutinação ... 27
9.2.5. Comparação de diferentes testes serológicos na deteção de anticorpos para Toxoplasma gondii ... 28
10. Tratamento ... 31
11. Prevenção e controlo ... 32
Capítulo 2 – Componente experimental ... 37
1. Introdução ... 37
2. Objetivos ... 38
xiii
2.2. Objetivos específicos ... 38
3. Material e Métodos ... 39
3.1. Local de estudo ... 39
3.2. Animais e amostras ... 40
3.3. Teste de hemaglutinação indireta ... 41
3.3.1. Material e reagentes ... 42
3.3.2. Metodologia laboratorial ... 42
3.3.3. Leitura e interpretação dos resultados ... 44
3.4. Teste de aglutinação modificado ... 45
3.4.1. Material e reagentes ... 46
3.4.2. Metodologia laboratorial ... 47
3.4.3. Leitura e interpretação de resultados ... 49
3.5. Análise estatística ... 50
4. Resultados ... 53
4.1. Gato doméstico (Felis catus) ... 53
4.1.1 Distribuição dos animais ... 53
4.1.2. Teste de hemaglutinação indireta ... 54
4.1.3. Teste de aglutinação modificado ... 56
4.1.4. Avaliação do desempenho do teste de hemaglutinação indireta ... 59
4.2. Cão doméstico (Canis lupus familiaris) ... 62
4.2.1. Distribuição dos animais ... 62
4.2.2. Teste de hemaglutinação indireta ... 63
4.2.3. Teste de aglutinação modificado ... 64
4.2.4. Avaliação do desempenho do teste de hemaglutinação indireta ... 67
5. Discussão ... 71
6. Conclusões ... 79
xiv
ANEXO I-Seroprevalência da infeção por Toxoplasma gondii em Portugal ... 102
ANEXO II- Seroprevalência da infeção por Toxoplasma gondii em carnívoros
domésticos ... 106
ANEXO III- Seroprevalência da infeção por Toxoplasma gondii em animais domésticos
utilizando diferentes testes serológicos ... 107
ANEXO IV- Ficha de requisição do Laboratório INNO ... 110
xv
Í
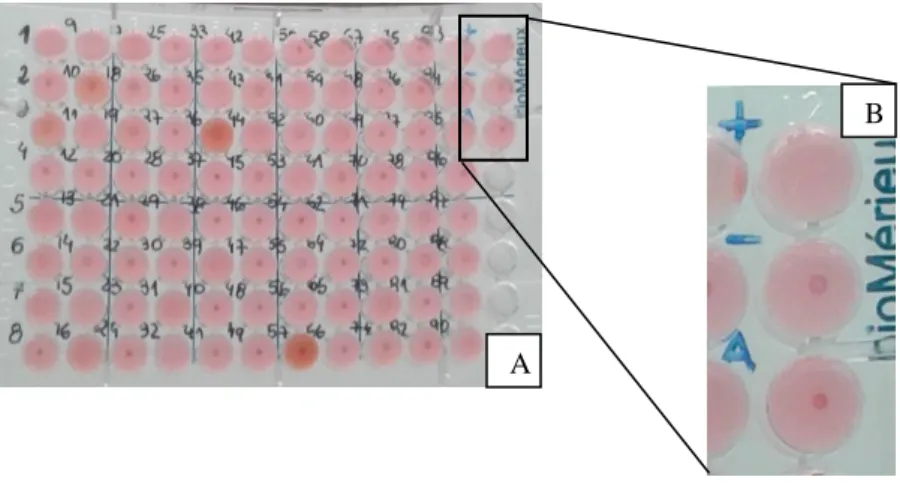
NDICE DE FIGURASFigura 1- Estádios de Toxoplasma gondii. ... 2 Figura 2- Fontes de infeção por Toxoplasma gondii. ... 9 Figura 3- Ciclo de vida de Toxoplasma gondii. ... 12 Figura 4- Instalações do laboratório INNO. (A) Laboratório de análises clínicas e citologia. (B) Laboratório de histopatologia... 39 Figura 5- Tubos para colheita de soro. (A) Tubos de colheita de soro em suporte de plástico. (B) Tubo de colheita de soro com um ativador da coagulação e um gel que após centrifugação permite uma separação completa e irreversível entre o soro e o coágulo. ... 41 Figura 6- Teste comercial Toxo-Hai Fumouze® (Fumouze Diagnostics, Levallois- Perret, França). ... 41 Figura 7- Reagentes do teste comercial Toxo-Hai Fumouze®. Da esquerda para a direita: solução diluente, R1, R2, R3, controlo positivo e controlo negativo. ... 42 Figura 8- Placa de microtitulação (Toxo-Hai Fumouze®) após 2 horas de incubação. . 44 Figura 9- Leitura e interpretação dos resultados (Toxo-Hai Fumouze®). (A) Resultado
negativo: sedimentação dos glóbulos vermelhos em botão bem definido e nítido no fundo da cúpula. (B) Resultado positivo: o padrão de aglutinação forma um véu castanho que cobre totalmente o fundo da cúpula. ... 44 Figura 10- Resultados das cúpulas controlo (Toxo-Hai Fumouze®). ... 45 Figura 11- Teste comercial Toxo-Screen DA® (BioMérieux, Lyon, França). ... 46 Figura 12- Reagentes do teste comercial Toxo-Screen DA®. Da esquerda para a direita: 2-ME já reconstituído, R1, R2, R3, R4, R5, R6 e solução de PBS já reconstituída. ... 46 Figura 13- Material necessário não fornecido pelo teste Toxo-Screen DA®. (A) Micropipeta simples com ponta descartável. (B) Micropipeta multicanal com 8 pontas descartáveis. (C) Micropipeta de repetição com ponta descartável. (D) Agitador de placas. (E) Soros dos animais a testar. ... 47 Figura 14- Pipetagem de 2,5 µL de amostra de soro com uma micropipeta simples. ... 48 Figura 15- Resultado negativo (Toxo-Screen DA®): sedimentação de taquizoítos em botão bem definido e nítido no fundo da cúpula. ... 49 Figura 16- Resultado negativo (Toxo-Screen DA®): sedimentação dos taquizoítos em anel com diâmetro inferior a 50% do diâmetro total do fundo da cúpula. ... 49
xvi Figura 17- Resultado positivo (Toxo-Screen DA®): aglutinação dos taquizoítos em véu
cobrindo todo o fundo da cúpula. ... 49 Figura 18- Resultado positivo (Toxo-Screen DA®): aglutinação dos taquizoítos em anel
com diâmetro superior a 50% do diâmetro total do fundo da cúpula. ... 49 Figura 19- (A) Placa de microtitulação (Toxo-Screen DA®) após 18 horas de incubação. (B) Resultados das cúpulas controlo. ... 50
xvii
Í
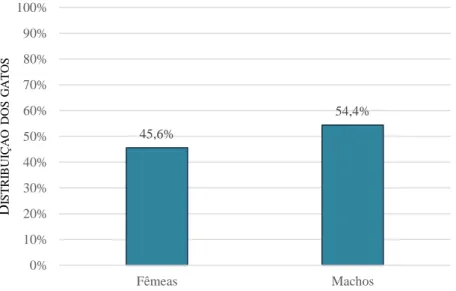
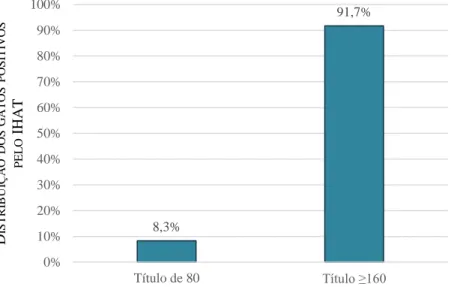
NDICE DE GRÁFICOSGráfico 1- Distribuição do número total de animais incluídos no estudo (n=88) de acordo com a espécie. ... 53 Gráfico 2- Distribuição do número total de gatos incluídos no estudo (n=79) de acordo com o género. ... 53 Gráfico 3- Distribuição do número total de gatos incluídos no estudo (n=79) de acordo com o grupo etário. ... 54 Gráfico 4- Seropositividade obtida pelo IHAT no número total de gatos incluídos no estudo (n=79). ... 54 Gráfico 5- Distribuição dos gatos seropositivos pelo IHAT (n=12) de acordo com o título de anticorpos. ... 55 Gráfico 6- Distribuição do número total de gatos incluídos no estudo (n=79) de acordo com o título de anticorpos obtidos pelo IHAT. ... 55 Gráfico 7- Seropositividade obtida pelo MAT no número total de gatos incluídos no estudo (n=79). ... 56 Gráfico 8- Distribuição dos gatos seropositivos pelo MAT (n=18) de acordo com o título de anticorpos. ... 56 Gráfico 9- Distribuição do número total de gatos incluídos no estudo (n=79) de acordo com o título de anticorpos obtido pelo MAT. ... 57 Gráfico 10- Seropositividade obtida pelo MAT no número total de gatos incluídos no estudo (n=79) de acordo com o género (p=0,076). ... 58 Gráfico 11- Seropositividade obtida pelo MAT de acordo com o grupo etário. ... 58 Gráfico 12- Distribuição dos resultados discordantes e concordantes entre o IHAT e o MAT no número total de gatos incluídos no estudo (n=79). ... 59 Gráfico 13- Distribuição dos resultados concordantes positivos e negativos entre o IHAT e o MAT no número total de gatos incluídos no estudo (n=79). ... 60 Gráfico 14- Distribuição dos resultados positivos pelo MAT e IHAT, ou a pelo menos um dos testes serológicos (IHAT ou MAT) no número total de gatos incluídos no estudo (n=79). ... 60 Gráfico 15- Distribuição dos resultados falsos negativos e falsos positivos pelo IHAT, usando o MAT como teste de referência, no número total de gatos incluídos no estudo (n=79). ... 61
xviii Gráfico 16- Distribuição do número total de cães incluídos no estudo (n=9) de acordo com o género. ... 62 Gráfico 17- Distribuição do número total de cães incluídos no estudo (n=9) de acordo com o grupo etário. ... 63 Gráfico 18- Distribuição do número total de cães incluídos no estudo (n=9) de acordo com o título de anticorpos obtido pelo IHAT. ... 63 Gráfico 19- Seropositividade obtida pelo MAT no número total de cães incluídos no estudo (n=9). ... 64 Gráfico 20- Distribuição dos cães seropositivos pelo MAT (n=4) de acordo com o título de anticorpos. ... 64 Gráfico 21- Distribuição do número total de cães incluídos no estudo (n=9) de acordo com o título de anticorpos obtido pelo MAT. ... 65 Gráfico 22- Seropositividade obtida pelo MAT no número total de cães (n=9) incluídos no estudo de acordo com o género (p=1,0). ... 66 Gráfico 23- Seropositividade obtida pelo MAT de acordo com o grupo etário (p=1,0). ... 66 Gráfico 24- Distribuição dos resultados discordantes e concordantes entre o IHAT e o MAT no número total de cães incluídos no estudo (n=9). ... 67 Gráfico 25- Distribuição dos resultados concordantes positivos e negativos entre o IHAT e o MAT no número total de cães incluídos no estudo (n=9). ... 68 Gráfico 26- Distribuição dos resultados positivos pelo MAT e IHAT, ou a pelo menos um dos testes serológicos (IHAT ou MAT) no número total de cães incluídos no estudo (n=9). ... 68 Gráfico 27- Distribuição dos resultados falsos negativos e falsos positivos pelo IHAT, usando o MAT como teste de referência, no número total de cães incluídos no estudo (n=9). ... 69
xix
Í
NDICE DE TABELASTabela 1- Seroprevalência da infeção por Toxoplasma gondii em cães e gatos utilizando diferentes testes serológicos. ... 30 Tabela 2- Alguns protocolos terapêuticos utilizados no tratamento da toxoplasmose em cães e gatos. ... 32 Tabela 3- Comparação dos títulos de anticorpos obtidos pelo IHAT e pelo MAT no número total de gatos incluídos no estudo (n=79). ... 57 Tabela 4- Seropositividade obtida pelo MAT nas variáveis género e grupo etário no número total de gatos amostrados (n=79). ... 59 Tabela 5- Distribuição do número total de gatos incluídos no estudo (n=79) de acordo com os resultados obtidos pelo IHAT e pelo MAT. ... 61 Tabela 6- Comparação dos títulos de anticorpos obtidos pelo IHAT e pelo MAT no número total de cães incluídos no estudo (n=9). ... 65 Tabela 7- Seropositividade obtida pelo MAT nas variáveis género e grupo etário no total dos cães amostrados (n=9). ... 67 Tabela 8- Distribuição do número total de cães incluídos no estudo (n=9) de acordo com os resultados obtidos pelo IHAT e pelo MAT. ... 69 Tabela 9- Percentagem de resultados falsos positivos e falsos negativos, sensibilidade relativa, especificidade relativa, valor preditivo positivo e valor preditivo negativo no IHAT, usando o MAT como teste de referência, na pesquisa de anticorpos para Toxoplasma gondii no número total de gatos (n=79) e cães (n=9) incluídos no estudo. 70 Tabela 10- Seroprevalência da infeção por Toxoplasma gondii no homem e em animais domésticos de Portugal. ... 102 Tabela 11- Seroprevalência da infeção por Toxoplasma gondii em mamíferos silváticos de Portugal. ... 103 Tabela 12- Seroprevalência da infeção por Toxoplasma gondii em aves silváticas de Portugal. ... 104 Tabela 13- Seroprevalência da infeção por Toxoplasma gondii em aves e mamíferos de cativeiro de Portugal. ... 105 Tabela 14- Alguns valores da seroprevalência da infeção por Toxoplasma gondii em gatos e cães a nível mundial ... 106
xx Tabela 15- Seroprevalência da infeção por Toxoplasma gondii em animais domésticos utilizando diferentes testes serológicos. ... 107
xxi
L
ISTA DE ABREVIATURASµL microlitro
µm micrómetro
2-ME 2-beta-mercaptoetanol ADN ácido desoxirribonucleico
BID “bis in die” (de doze em doze horas)
CD “cluster of differentiation” (aglomerado de diferenciação) CDV “canine distemper virus” (vírus da esgana canina)
DT “dye test” (teste de lise)
ELISA “enzyme-linked immunoabsorbent assay” (ensaio imunoenzimático) EUA Estados Unidos da América
GRA “dense granule antigen” (antigénio de grânulo denso) HE hematoxilina e eosina
IC intervalo de confiança
IFAT “indirect fluorescente antibody test” (teste de imunofluorescência indireta) IFN-γ interferão gama
Ig imunoglobulina
IHAT “indirect hemagglutination test” (teste de hemaglutinação indireta) IHC “immunohistochemical” (imuno-histoquímica)
IL interleucina
IM via de administração intra-muscular
k “Cohen’s coefficient kappa” (coeficiente kappa de Cohen)
kg quilograma
KGy quilogray
LAT “latex agglutination test” (teste de aglutinação em látex) LCR líquido cefalorraquidiano
MAT “modified agglutination test” (teste de aglutinação modificado)
mg miligrama
mL mililitro
MPa mega pascal
xxii NO “nitric oxid” (óxido nítrico)
NK “natural killer cells” (células exterminadoras naturais) OD “optical density” (densidade ótica)
OMS Organização Mundial de Saúde
p valor de probabilidade
pi pós-infeção
PAS “periodic acid Schiff” (ácido periódico de Schiff)
PBS “phosphate buffered solution” (solução tampão de fosfato) PCR “polimerase chain reaction” (reação em cadeia da polimerase) PO “per os” (via de administração oral)
R reagente
Rpm rotações por minuto
SAG “surface antigen” (antigénio de superfície) SID “semel in die” (de 24 em 24 horas) SIDA síndrome da imunodeficiência adquirida SNC sistema nervoso central
TGF-β “transforming growth factor beta” (fator beta de transformação do crescimento)
Th T “helper” (T auxiliar)
TID “ter in die” (de oito em oito horas)
TNF-α “tumor necrosis factor alpha” (fator alfa de necrose tumoral) UI Unidades Internacionais
1
Capítulo 1 –
R
EVISÃO DA LITERATURA CIENTÍFICA1.
I
NTRODUÇÃOToxoplasma gondii, agente etiológico da toxoplasmose, possui uma distribuição mundial sendo um dos parasitas mais investigados devido à sua importância médica, veterinária e de saúde pública (Dubey, 2008). Este protozoário foi descrito pela primeira vez num roedor do norte de África, Ctenodactylus gundi, por Nicolle e Manceaux (1908) e, quase simultaneamente, num coelho (Oryctolagus cuniculus) no Brasil por Splendore (1908). Um ano mais tarde, Nicolle e Manceaux (1909) designaram este parasita de Toxoplasma gondii devido à sua morfologia (do latim “toxon”: arco e “plasma”: forma), e ao nome do seu hospedeiro original (Dubey, 2008). T. gondii é capaz de infetar qualquer animal homeotérmico (Dubey, 2010b).
A verdadeira importância da infeção humana só foi reconhecida após os primeiros casos de toxoplasmose congénita (Robert-Gangneux e Dardé, 2012). Adicionalmente, na década de 80, T. gondii surge como a maior causa de morte em pacientes com síndrome da imunodeficiência adquirida (SIDA) (Innes, 2010).
Em medicina veterinária, a infeção por T. gondii foi indicada como uma das principais causas de aborto em ovinos da Nova Zelândia, Austrália, Estados Unidos da América (EUA), Reino Unido e Noruega, originando elevadas perdas económicas (Dubey, 2009b; Innes, 2010). Mais recentemente, foi indicado como causa de morte em lontras-marinhas (Enhydra lutris) (Miller et al., 2004).
O contacto e a interação entre os carnívoros domésticos e o homem pode aumentar o risco de transmissão de T. gondii (Zhu et al., 2012). O gato doméstico e outros felídeos são essenciais na transmissão da infeção, uma vez que são os únicos capazes de excretar oocistos não esporulados no meio ambiente (Dubey, 2010b). O cão doméstico pode transmitir a infeção ao homem, particularmente a crianças, após rebolar ou ingerir fezes de gato contendo oocistos esporulados (Lindsay et al., 1997).
As limitações e as exigências dos métodos diretos de diagnóstico realçam a importância da utilização de provas serológicas específicas em rastreios e no diagnóstico da infeção por T. gondii (Dubey, 2010b). Embora estejam disponíveis vários testes serológicos para a pesquisa de anticorpos específicos, pouca informação existe sobre o seu desempenho e comparação em animais naturalmente infetados por T. gondii (Mainar-Jaime e Barberán, 2007).
2
2.
T
OXOPLASMA GONDII2.1. TAXONOMIA
Toxoplasma gondii é um protozoário parasita intracelular obrigatório que, segundo Levine et al. (1980), pertence ao reino Protista (Haeckel, 1866); sub-reino Protozoa (Goldfuss, 1918 emend. Von Siebold, 1845); filo Apicomplexa (Levine, 1970); classe Sporozoea (Leukart, 1879); subclasse Coccidia (Leukart, 1879); ordem Eucoccidia (Léger e Duboscq, 1910); subordem Eimeriina (Léger, 1911); família Sarcocystidae (Poche, 1913); subfamília Toxoplasmatinae (Biocca, 1956) e género Toxoplasma (Nicolle e Manceaux, 1909).
2.2. MORFOL OGI A DAS FORM AS PARASIT ÁRIAS
T. gondii possui três estádios infetantes: o taquizoíto, o bradizoíto e o esporozoíto (Figura 1). O taquizoíto é responsável pela disseminação durante a fase aguda da doença; o bradizoíto no interior dos quistos tecidulares corresponde à fase crónica; e o esporozoíto no interior do oocisto esporulado representa o estádio ambiental (Smith, 1995; Robert-Gangneux e Dardé, 2012).
A B
C
D
E
F Figura 1- Estádios de Toxoplasma gondii. (A) Taquizoíto no interior de uma célula num exsudado peritoneal de murganho (Microscópia electrónica). (B) Bradizoíto no interior de um quisto tecidular isolado do cérebro de murganho (Micróscopia electrónica). (C) Quisto tecidular presente no cérebro de murganho. Note-se a presença de bradizoítos PAS-positivos (ponta de setas) no interior de quisto com parede PAS-negativa (seta). (D) Quisto tecidular, isolado do cérebro de murganho, repleto de bradizoítos protegidos por uma parede (seta). (E) Oocisto não esporulado. Observe-se o esporonte no interior. (F) Oocisto esporulado contendo 2 esporocistos cada com 4 esporozoítos (ponta de seta). Realça-se a presença de uma parede fina (seta). Am, grânulo de amilopectina; Ce, centríolos; Co, conoide; Dg, grânulo denso; Ga, apicoplasto; Go, complexo de Golgi; Im, complexo interno da membrana; Mi, mitocôndria; Mn, micronema; No, nucléolo; Nu, núcleo; Pv, vacúolo parasitóforo; Pm, plasmalema; Rh, roptria (Adaptado de Dubey et al., 1998; Dubey, 2010b).
3 2.2.1. Taquizoíto
O termo “taquizoíto” foi proposto por Frenkel (1973) para descrever a forma parasitária que se multiplica rapidamente em qualquer célula do hospedeiro intermediário e na lâmina própria do hospedeiro definitivo (Dubey et al., 1998; Dubey, 2010b). A designação provém do grego “takhýs” que significa “rápido”. Possui forma em meia-lua com aproximadamente 2 por 6 µm, onde a porção anterior é afilada e a posterior arredondada (Dubey, 2010b). O taquizoíto multiplica-se por endodiogenia, método de reprodução assexuada onde uma célula mãe origina duas células filhas, no interior da célula hospedeira (Dubey, 2010b). A locomoção advém de um complexo sistema dependente de actina-miosina (Kim e Weiss, 2004).
Regra geral, os taquizoítos são destruídos durante a digestão pelo suco gástrico. No entanto, alguns estudos in vitro demonstraram que estes podem sobreviver até duas horas numa solução de pepsina (Dubey, 1998a). São sensíveis à pasteurização e a concentrações de sal (Tenter et al., 2000).
2.2.2. Bradizoíto
O termo “bradizoíto”, do grego “bradýs” que significa lento, foi proposto por Frenkel (1973) para descrever a forma parasitária que se multiplica lentamente no interior de quistos tecidulares.
Os quistos tecidulares crescem e permanecem intracelulares à medida que os bradizoítos se multiplicam por endodiogenia. Estes variam no tamanho, pois quistos jovens podem ter apenas 5 µm de diâmetro e dois bradizoítos no interior enquanto os mais velhos podem ter centenas. A morfologia também é variável. Assim, geralmente no tecido nervoso os quistos são esféricos e não atingem os 70 µm de diâmetro, pelo contrário no músculo são vulgarmente alongados e podem atingir 100 µm de comprimento (Dubey et al., 1998). Tal como os taquizoítos possuem forma crescente e aproximadamente 7 por 1,5 µm de tamanho. A parede do quisto é elástica, fina (inferior a 0,5 µm de espessura) e ainda ligeiramente positiva ao ácido periódico de Schiff (“periodic acid Schiff”-PAS) (Dubey et al., 1998). Alguns bradizoítos podem degenerar especialmente os dos quistos mais velhos (Dubey et al., 1998).
Morfologicamente o bradizoíto é mais estreito que o taquizoíto (Dubey, 2010b). Embora estruturalmente semelhantes, o taquizoíto e o bradizoíto diferem em alguns aspetos, nomeadamente na posição do núcleo que está central no taquizoíto e mais próximo da extremidade posterior no bradizoíto. Além disso, o bradizoíto possui maior
4 número de micronemas e de grânulos de amilopectina, estes últimos justificam a sua forte reação positiva ao reagente PAS (Dubey, 2010b). Diferem ainda nos antigénios que expressem na sua superfície (Lyons et al., 2002).
Os bradizoítos são mais resistentes que os taquizoítos a enzimas como a tripsina e pepsina presentes no suco gástrico (Tenter et al., 2000). Os quistos tecidulares podem persistir até três semanas em carcaças ou carne picada em refrigeração (1 a 4ªC). Podem ainda sobreviver durante mais de uma semana entre -1 e -8ºC (Tenter et al., 2000). No entanto, são inativados quando a temperatura interna atinge e se mantém nos 67ºC durante 3,5 minutos ou -12ºC durante 24 horas (Dubey et al., 1990; Jones et al., 2009); e com 0,5 KGy de radiação gama (Dubey, 1996). Em condições laboratoriais, os quistos são inviabilizados em soluções de 6% de cloreto de sódio (NaCl), a temperaturas de 4 a 20ºC, contudo podem sobreviver por várias semanas a concentrações mais baixas (Tenter et al., 2000).
2.2.3. Oocisto
Os oocistos não esporulados são subesféricos a esféricos com 10 por 12 µm, e estão preenchidos pelo esporonte (Dubey et al., 1998). A esporulação do oocisto ocorre no meio ambiente podendo demorar entre 1 a 5 dias dependendo das condições ambientais de temperatura, humidade e arejamento (Dubey et al., 1998).
Os oocistos esporulados são subesféricos a ovais com 11 por 13 µm. Cada um contém dois esporocistos (6 por 8 µm), com quatro esporozoítos cada (2 por 6-8 µm) (Dubey, 2010b).
Embora semelhantes estruturalmente, o taquizoíto, o bradizoíto e o esporozoíto, diferem na quantidade de organelos. Assim, o taquizoíto possui menor número de micronemas e o bradizoíto o maior. Já o bradizoíto possuí menor quantidade de grânulos densos. Os grânulos de amilopectina são numerosos em bradizoítos e esporozoítos. A quantidade de roptrias é semelhante entre os três (Dubey et al., 1998). O núcleo do esporozoíto é subterminal (Dubey et al., 1998).
Os oocistos não esporulados podem manter-se viáveis durante vários meses em refrigeração (4ºC) (Lindsay et al., 2002), embora sejam destruídos a 37ºC durante 24 horas ou a 50ºC por 10 minutos (Dubey et al., 1970b).
Os oocistos esporulados são bastante resistente às condições ambientais podendo sobreviver até 18 meses no solo (Tenter et al., 2000) e até 54 meses em refrigeração (4ºC) (Dubey, 1998b). Podem persistir viáveis por pelo menos 24 meses no mar
5 (Lindsay e Dubey, 2009). São, ainda, resistentes aos desinfetantes e detergentes laboratoriais comuns, embora sejam inativados pelo tratamento com hidróxido de amónia a 5% durante 30 minutos (Dubey et al., 1970a). Os oocistos esporulados podem ser destruídos a 60ºC durante um minuto (Dubey, 1998b); ou com 0,25 KGy de radiação gama (Dubey et al., 1996).
2.3. CARACTE RI ZAÇÃO DE GE NÓT IPOS E VARIABILI DADE
O conhecimento filogenético de T. gondii é de extrema importância porque as variações genéticas entre as suas estirpes determinam as diferenças na virulência, patogenia e gravidade da doença em murganhos, e em seres humanos (Boothroyd e Grigg, 2002). Os primeiros estudos de genotipificação molecular realizados em humanos e animais domésticos da Europa e América do Norte sugeriram que a estrutura populacional de T. gondii consistia em três linhagens clonais predominantes, designadas de tipo I, II e III, com reduzida variabilidade entre si. Estas diferiam, na virulência e no padrão de ocorrência epidemiológica (Howe e Sibley, 1995). Assim, as estripes do tipo I eram altamente virulentas em murganhos e as do tipo II e III eram pouco ou nada virulentas (Sibley et al., 2009). No entanto, sabe-se atualmente, que estripes do tipo III podem ser virulentas para os murganhos (Dubey et al., 2002; dos Santos et al., 2005).
Estudos em outros continentes revelaram uma estrutura populacional muito mais complexa e uma maior diversidade genética do que inicialmente foi reconhecido, nomeadamente, em animais e seres humanos do Brasil (Dubey et al., 2002; dos Santos et al., 2005; Khan et al., 2006; Dubey e Su, 2009). Adicionalmente, estirpes com genótipos atípicos, isto é, não pertencentes às três linhagens clonais inicialmente descritas; foram isoladas principalmente na vida selvagem em locais com reduzida domesticação o que sugere uma maior presença de trocas genéticas neste meio (Azenberg et al., 2004; Wendte et al., 2011). Também em lontras-marinhas, na Califórnia, foi isolado um novo genótipo designado de tipo X (Miller et al., 2004).
A distribuição dos genótipos de T. gondii varia com a região (Vilares et al., 2017). O tipo II é o mais prevalente na Europa e América do Norte e mais frequentemente associado a casos clínicos de toxoplasmose humana, tanto congénita como em pacientes com SIDA (Howe e Sibley, 1995; Halonen e Weiss, 2013). Em Portugal, os tipos II e III são os mais prevalentes em animais (Dubey et al., 2006; Sousa et al., 2006; Waap et al., 2008; Vilares et al., 2014; Lopes et al., 2015); sendo o tipo I raro (Waap et al., 2008; Vilares et al., 2014; Verma et al., 2015); e o tipo II seguido do
6 tipo I em humanos (Vilares et al., 2017). Contudo, em Portugal há evidências da presença de estirpes recombinantes ou atípicas (Vilares et al., 2014; 2017).
Alguns relatos suportam a hipótese de uma maior virulência de algumas estirpes atípicas em humanos, especialmente aparente em pacientes imunocompetentes (Dardé, 2008).
3.
T
RANSMISSÃOA infeção por T. gondii pode ser transmitida entre o hospedeiro definitivo e o intermediário, entre hospedeiros definitivos, ou ainda entre hospedeiros intermediários (Tenter et al., 2000).
A transmissão pode ocorrer por via horizontal ou vertical (Figura 2) (Tenter et al., 2000). Na primeira, a infeção pode ocorrer: (1) pela ingestão de quistos tecidulares em carne ou vísceras cruas ou mal cozinhadas; (2) pela ingestão de oocistos esporulados na água, alimentos, solo (via feco-oral) ou pelo contato direto com fezes de gato; (3) por transfusões sanguíneas, transplantes de órgãos ou através de leite cru (Hill e Dubey, 2002; Dubey e Jones, 2008; Robert-Gangneux e Dardé, 2012). A transmissão vertical, da mãe para o filho, ocorre por via transplacentária ou galactófora (Dubey, 2010b).
3.1. TRANSMISSÃO POR OOCIS T OS
Os oocistos não esporulados, excretados no ambiente por felídeos podem contaminar a água, o solo ou alimentos, como frutas e vegetais (Dubey, 2010b). A via feco-oral é a via de transmissão mais eficiente no hospedeiro intermediário (Dubey, 2006).
Se a elevada resistência dos oocistos esporulados permite a contaminação do ambiente por longos períodos de tempo, o transporte por hospedeiros mecânicos, pela chuva ou pelo vento, possibilita a sua disseminação pelo ambiente. Assim, invertebrados como moscas, minhocas ou baratas, podem transportar os oocistos para longe do local inicial de contaminação (Dubey, 1991; Hill e Dubey, 2002). Também os cães possuem um papel importante na disseminação de oocistos pelo ambiente. Ao rebolarem em fezes de gato podem ficar com os oocistos esporulados no seu pelo e consequentemente transmiti-los ao homem, em particular a crianças. Adicionalmente, podem excretar oocistos viáveis nas fezes após coprofagia, embora não sejam
7 hospedeiros definitivos (Lindsay et al., 1997). Pelo contrário, a transmissão devido ao contato direto com o gato é considerada mínima (Dubey, 1987).
O contato de mulheres grávidas com o solo foi indicado como um fator de risco num estudo realizado na Europa (Cook et al., 2000). Em um estudo realizado no estado de São Paulo no Brasil, T. gondii foi isolado em 22,6% dos 31 parques infantis escolares testados (dos Santos et al., 2010), o que demonstra a importância do contato com o solo na potencial infeção em crianças. Já o consumo de água contaminada com oocistos esporulados foi a causa de um surto de toxoplasmose humana no Canadá (Bowie et al., 1997). Foi sugerido que oocistos excretados por gatos domésticos e pumas da região contaminaram o reservatório de água municipal (Aramini et al., 1998).
Segundo Miller et al. (2002) o escoamento de água doce contaminada com oocistos para o mar é um fator de risco para a infeção em lontras-marinhas. Desconhece-se como ocorre a transmissão nos animais marinhos, contudo é mais provável que esta ocorra pela ingestão de oocistos esporulados diretamente da água do mar ou pela ingestão de hospedeiros que por sua vez ingeriram oocistos (Dubey, 2004). No ambiente marinho, os moluscos podem atuar como hospedeiros mecânicos devido à sua capacidade de filtrar e concentrar oocistos (Dubey e Jones, 2008).
3.2. TRANSMISSÃO POR QUIST OS TE CIDULA RES
A infeção por T. gondii pode ser adquirida pela ingestão de quistos tecidulares em carne ou vísceras cruas ou mal cozinhadas (Hill e Dubey, 2002). Esta é a via de transmissão mais eficiente no gato (carnivorismo) (Dubey, 2006).
Em animais de pecuária, os quistos de T. gondii são mais frequentemente isolados em carne de porco, ovelha e cabra; e menos frequentes em carne de frango, coelho ou cavalo; e são raramente encontrados em carne de bovino (Tenter et al., 2000; Dubey, 2010b). O risco associado com o tipo de carne varia entre países de acordo com os hábitos locais e com a prevalência da infeção nos animais de produção (Robert- Gangneux e Dardé, 2012). De acordo com Cook et al. (2000) a ingestão de carne mal cozinhada ou produtos curados foi responsável por 30 a 63% das infeções em mulheres grávidas na Europa. Os animais silváticos infetados, como lebres e javalis, também possuem quistos nos seus tecidos e por isso são fonte de infeção para o homem e outros animais, especialmente quando as vísceras são deixadas no campo pelos caçadores à disposição de felídeos e outros carnívoros (Dubey, 1991; Tenter et al., 2000).
8 A transmissão por transplante de órgãos pode ocorrer devido à presença de bradizoítos ou taquizoítos, embora os quistos sejam a via mais provável (Dubey, 2010b). Assim, a transmissão pode ocorrer quando um dador seropositivo doa um órgão ou medula óssea para um recetor seronegativo; ou quando ocorre reativação de uma infeção latente no recetor seropositivo (Montoya e Liesenfeld, 2004). Em ambos os casos, a instituição de uma terapia imunossupressora no recetor aumenta a probabilidade de infeção (Dubey, 2010b).
3.3. TRANSMISSÃO POR TAQUI ZOÍT OS
Como já mencionado no ponto 2.2.1., os taquizoítos são mais suscetíveis às condições ambientais o que os torna pouco importantes do ponto de vista epidemiológico na transmissão horizontal (Robert-Gangneux e Dardé, 2012). No entanto, a presença de taquizoítos no leite cru de hospedeiros intermediários, como ovelha, cabra ou vaca, pode ser fonte de infeção para o homem e outros animais. Embora esta via de transmissão seja pouco provável, foi descrito um caso de toxoplasmose em crianças devido à ingestão de leite não pasteurizado de cabra (Tenter et al., 2000).
Os taquizoítos também podem ser transmitidos pelo sangue, nomeadamente durante uma transfusão sanguínea ou num acidente de laboratório, como uma picada de uma agulha. A transmissão por transfusão sanguínea só é possível se o dador adquiriu a infeção recentemente e a parasitemia estiver presente no momento da transfusão (Tenter et al., 2000; Dubey, 2010b; Robert-Gangneux e Dardé, 2012).
Para além do sangue e do leite, os taquizoítos podem ser encontrados em secreções corporais, como saliva, expetoração, sémen, urina ou lágrima. Contudo não há evidências que a transmissão horizontal no homem possa ocorrer por estas vias (Tenter et al., 2000).
A importância desta forma parasitária deve-se principalmente à sua possibilidade de transmissão por via transplacentária especialmente quando a primoinfeção ocorre durante a gestação ou pouco tempo antes da conceção (Montoya e Liesenfeld, 2004). Os taquizoítos podem também ser transmitidos da mãe para o filho pelo leite (via galactófora) (Dubey, 2010b).
9
4.
C
ICLO DE VIDAO ciclo de vida de T. gondii é heteroxeno facultativo e possui duas fases distintas a entero-epitelial e a extraintestinal (Dubey et al., 1970b). A primeira ocorre exclusivamente no hospedeiro definitivo membros da família Felidae, e a segunda, em qualquer animal homeotérmico incluindo os próprios felídeos (Figura 3) (Dubey, 2010b).
4.1. FASE E XTRAINTE STINAL
A fase extraintestinal inicia-se após a ingestão de oocistos esporulados ou de quistos pelo hospedeiro intermediário. As enzimas proteolíticas do estômago e intestino delgado do hospedeiro são responsáveis pela dissolução da parede do quisto e consequente libertação dos bradizoítos. Já a libertação dos esporozoítos ocorre após rotura da parede dos oocistos no intestino delgado (Dubey, 1991, 2010b). Os bradizoítos e os esporozoítos invadem os enterócitos, multiplicam-se no seu interior e
10 se em taquizoítos (Robert-Gangneux e Dardé, 2012). Por sua vez, os taquizoítos multiplicam-se rapidamente por endodiogenia (Dubey, 2010b). A multiplicação termina com a rotura da célula hospedeira e libertação dos taquizoítos (ciclo lítico), que podem parasitar outras células e/ou disseminar-se pelo sangue (parasitemia) e linfa para outros órgãos dando origem à fase aguda da infeção. Durante esta fase, estes podem atingir a placenta e consequentemente o feto (Dubey, 1987). No hospedeiro imunocompetente o desenvolvimento de uma resposta imunitária protetora origina a formação de quistos tecidulares. Estes caracterizam a fase crónica da infeção e podem permanecer durante toda a vida do hospedeiro (Dubey, 1991). Localizam-se especialmente no sistema nervoso central (SNC), músculos, esquelético e cardíaco, e globo ocular e menos em vísceras como pulmão, fígado e rim (Dubey, 2004).
4.2. FASE E NTERO-EPITELIAL
A fase entero-epitelial ocorre no hospedeiro definitivo e culmina com a libertação de oocistos não esporulados no meio ambiente (Dubey, 2010b).
Apenas o estádio de bradizoíto inicia este ciclo e por isso é necessário a ingestão de quistos tecidulares presentes no hospedeiro intermediário pelo felídeo. No seu trato digestivo, os bradizoítos são libertados após digestão da parede do quisto por enzimas proteolíticas do estômago e intestino delgado (Dubey, 2010b). Alguns destes bradizoítos penetram na lâmina própria do intestino e multiplicam-se como taquizoítos, outros invadem os enterócitos e iniciam a esquizogonia. (Dubey, 2004). A esquizogonia é um processo de multiplicação assexuada onde o núcleo divide-se duas ou mais vezes sem divisão citoplasmática. Dela resulta a formação de cinco tipos assexuais, morfologicamente distintos, designados de A, B, C, D e E (Jones e Dudey, 2010). Os merozoítos libertados dos esquizontes do tipo D e E iniciam a gametogonia (fase sexual) e formam os gâmetas femininos (macrogâmetas) e masculinos (microgâmetas) (Jones e Dudey, 2010). Os microgâmetas usam os seus dois flagelos para deslizar, penetrar e fertilizar os macrogâmetas maduros. Após fertilização desenvolve-se uma parede à volta do zigoto para formar o oocisto (Dubey, 2010b). Com a rotura das células epiteliais os oocistos não esporulados são libertados no lúmen intestinal e daí são expulsos com as fezes no ambiente (Dubey, 2004; Tenter et al., 2000). O início da esporulação ocorre 24 a 48 horas após a excreção e pode durar 1 a 5 dias dependendo das condições ambientais de temperatura, humidade e arejamento (Dubey et al., 1970a; Dubey, 1991).
11 T. gondii pode persistir nos tecidos intestinais e extraintestinais durante meses e possivelmente durante toda a vida do gato (Dubey, 2004).
Os felídeos podem excretar oocistos após ingerirem qualquer um dos três estádios infetantes, ou seja, taquizoítos, bradizoítos ou esporozoítos (Jones e Dubey, 2010). Contudo o período pré-patente, definido como o tempo necessário para ocorrer a excreção de oocistos após a infeção inicial, e a frequência de excreção variam com o estádio do parasita ingerido (Dubey, 2010b). Assim, quando a infeção ocorre por ingestão de bradizoítos o período pré-patente é de 3 a 10 dias e o patente (corresponde ao período de excreção de oocistos) até 20 dias. No caso de ingestão de oocistos esporulados, o período pré-patente é de mais de 18 dias e o patente até 10 dias. Por fim, quando ocorre a ingestão de taquizoítos o período pré-patente é de mais de 13 dias e o patente até 7 dias (Dubey, 1998a; Tenter et al., 2000). O período pré-patente é mais longo no caso da transmissão pelos oocistos porque é necessário ocorrer primeiro a conversão de esporozoítos em taquizoítos e destes em bradizoítos. Só após a rotura da parede do quisto é que os bradizoítos são libertados e podem migrar até ao intestino onde darão início ao ciclo entero-epitelial. Como referido, a frequência de excreção também varia com o estádio infetante ingerido. Assim, a maioria dos gatos excreta oocistos após a ingestão de bradizoítos, contudo menos de 50% o faz após ingestão de oocistos esporulados ou taquizoítos (Dubey, 2010b).
Estima-se que apenas 1% dos gatos de uma população esteja a eliminar oocistos num dado momento (Hill e Dubey, 2002). Contudo isso não é um fator limitante, pois um só gato pode excretar mais de 100 milhões de oocistos não esporulados (Robert- Gangneux e Dardé, 2012). Além disso, a associação de oocistos altamente resistentes no ambiente ao seu transporte por hospedeiros mecânicos explica a sua vasta disseminação no meio ambiente (Dubey, 1991).
Geralmente os gatos apenas excretam oocistos na primoinfeção. No entanto, a imunidade protetora não se mantém por toda a vida, e por isso o gato pode voltar a excretar oocistos (Tenter et al., 2000). Experimentalmente, esta pode ser induzida após imunossupressão com corticosteróides em doses elevadas (Dubey e Frenkel, 1974). Regra geral, o número de oocistos excretados é menor que o observado na infeção primária (Dubey, 2010b).
12
5.
R
ESPOSTAS IMUNITÁRIASNo hospedeiro imunocompetente a infeção por T. gondii é controlada pelo sistema imunitário, com o desenvolvimento de uma resposta tanto celular como humoral (Bhopale, 2003). Na verdade, esta não é suficiente para eliminar o parasita, contudo permite a formação de um estado de equilíbrio entre ambos que se poderá manter estável por toda a vida do hospedeiro (Denkers et al., 2004).
Os enterócitos representam a primeira linha de defesa, pois uma vez infetados com taquizoítos libertam mediadores inflamatórios responsáveis por recrutar neutrófilos, células dendríticas, macrófagos, monócitos e células T (Miller et al., 2009).
Os neutrófilos são dos primeiros a chegar ao local. Para além da sua atividade fagocítica libertam citoquinas inflamatórias como a interleucina (IL) 12 responsável não só por recrutar outras células inflamatórias, como células dendríticas imaturas, macrófagos e células T, mas também por matar diretamente o parasita (Miller et al., 2009; Halonen e Weiss, 2013).
As células dendríticas são fundamentais para a resistência do hospedeiro pois são as principais produtoras de IL-12. Os neutrófilos e o fator alfa de necrose tumoral
13 (“tumor necrosis factor alpha”-TNF-α) são essenciais para a sua maturação (Miller et al., 2009).
As principais funções dos macrófagos incluem a produção de IL-12, fagocitose e controlo da disseminação do agente na fase inicial (Miller et al., 2009). Para além destas funções juntamente com as células dendríticas atuam como células apresentadoras de antigénios (Robert-Gangneux e Dardé, 2012).
A IL-12, produzida pelos neutrófilos, macrófagos e células dendríticas, é fundamental para a ativação de células exterminadoras naturais (“natural killer cells”-NK) e células T CD4+ e CD8+ que consequentemente produzem interferão gama (INF-γ) (Halonen e Weiss, 2013). Por sua vez, o INF-γ promove a ativação dos macrófagos por um mecanismo de “feedback” positivo. Os macrófagos ativados fagocitam e destroem o parasita pela libertação de enzimas lisossomais, radicais livres de oxigénio e óxido nítrico (“nitric oxid”-NO) (Miller et al., 2009).
O INF-γ é fundamental para a resistência do hospedeiro durante a fase aguda e crónica da infeção (Halonen e Weiss, 2013). Este é responsável por controlar a libertação de NO e radicais livres de oxigénio pelas células inflamatórias. Ao inibir enzimas da mitocôndria e do núcleo, o NO pode matar diretamente os taquizoítos. Para além destas funções, o INF-γ também interfere com o metabolismo do protozoário levando à privação de ferro, um importante cofator, e de triptofano, um aminoácido essencial. A depleção de ferro e triptofano leva a diminuição da multiplicação dos taquizoítos nos enterócitos (Miller et al., 2009).
Para além da produção de INF-γ, os linfócitos CD8+ possuem propriedades citotóxicas e são fundamentais no controlo da infeção juntamente com os linfócitos CD4+ (Bhopale, 2003).
A imunidade adquirida é iniciada pelas células apresentadoras de antigénios, como as células dendríticas, que migram desde o local da infeção até aos linfonodos regionais onde interagem com os linfócitos T promovendo a sua ativação e diferenciação em linfócitos T auxiliares (T “helper”-Th) 1 (Denkers et al., 2004).
Citoquinas anti-inflamatórias, como a IL-10, IL-27 e fator beta de transformação do crescimento (“transforming growth factor beta”-TGF-β), são fundamentais no controlo dos danos provocados pela inflamação nos tecidos do hospedeiro (Miller et al., 2009).
Com o objetivo de criar um ambiente propício ao seu desenvolvimento, o protozoário desenvolveu mecanismos para escapar à resposta imunitária do hospedeiro.
14 A maioria destes tem como objetivo final inibir a libertação de IL-12, TNF-α e/ou INF-γ (Miller et al., 2009).
Embora a resposta celular seja a mais importante, a resposta humoral também desempenha um papel importante, ocorrendo a produção de imunoglobulinas (Ig) M, IgG, IgA e IgE específicas (Gross et al., 1996; Bhopale, 2003). A IgM e a IgA surgem na primeira semana pós-infeção (pi) e atingem um pico ao final de um mês, após o qual diminuem para níveis indetetáveis em várias semanas ou anos. A IgE atinge um pico às três semanas pi, após o qual diminui rapidamente. Por fim, a IgG surge na segunda semana pi, atingindo um patamar dois a três meses depois; de seguida diminui de forma constante mantendo um título residual durante toda a vida do hospedeiro (Montoya e Lisenfeld, 2004; Dard et al., 2016). As Ig provocam a lise das formas parasitárias extracelulares após ativação pelo complemento (Schreiber e Feldman, 1980; Dubey, 2004); e facilitam a fagocitose ao promoverem a opsonização do protozoário (Hiszczynska-Sawicka et al., 2014). A IgA interfere, ainda, com a adesão do parasita aos enterócitos participando por isso, na imunidade intestinal (Mack e McLeod, 1992).
6.
I
NVASÃO E PATOGENIADe forma a garantir a perpetuação do ciclo de vida, e sendo T. gondii um protozoário intracelular obrigatório, este deve ser capaz de invadir a célula hospedeira e criar um ambiente propício à sua multiplicação (Kim e Weiss, 2008). A invasão ativa na célula alvo advém de um sistema complexo dependente de actina-miosina e da segregação de proteínas de três organelos apicais, nomeadamente micronemas, roptrias e grânulos densos (Robert-Gangneux e Dardé, 2012).
A invasão inicia-se com o reconhecimento e adesão na célula hospedeira através da segregação de proteínas pelos micronemas (Kim e Weiss, 2004). Segue-se, a exocitose do conteúdo das roptrias e consequente entrada e formação de um vacúolo parasitóforo (Kim e Weiss, 2004). Já no seu interior, o taquizoíto segrega proteínas dos grânulos densos que são responsáveis por permitir a difusão de pequenas moléculas entre a membrana do vacúolo parasitóforo e o citoplasma (Clough e Frickel, 2017). Adicionalmente, proteínas do parasita interagem e recrutam organelos, como a mitocôndria e o retículo endoplasmático, da célula hospedeira (Kim e Weiss, 2004). Desta forma, T. gondii multiplica-se no interior do vacúolo parasitóforo, protegido do sistema imunitário, mas com acesso a nutrientes da célula hospedeira (Clough e Frickel,
15 2017). Além disso, a modelação dos mecanismos de apoptose e a formação de um vacúolo parasitóforo não fusogénico garantem a sobrevivência do protozoário (Kim e Weiss, 2008). T. gondii pode invadir vários tipos de células, porém é no interior de macrófagos e células detríticas que consegue facilmente disseminar-se pelo organismo (Miller et al., 2009).
A patogenia de T. gondii é determinada por vários fatores, incluindo a suscetibilidade da espécie hospedeira, o estatuto imunitário do hospedeiro, a virulência da estripe e o estádio do parasita envolvido na infeção (Dubey, 2004; Innes et al., 2009). Por exemplo, primatas do Velho Mundo, ratos, bovinos e cavalos são resistentes à infeção ao contrário de primatas do Novo Mundo e marsupiais que são mais suscetíveis (Dubey, 2010b). A patogenia advém da multiplicação intracelular de taquizoítos e consequente necrose dos tecidos, uma vez que o parasita não produz toxinas. À necrose segue-se uma resposta inflamatória (Davidson, 2000). Embora o dano tecidular durante a fase aguda possa ser fatal, o mais comum é a recuperação com a formação de uma imunidade protetora (Dubey, 2010b). Assim sendo, agentes imunomodeladores como o NO, o INF-γ e o TNF-α são responsáveis pela conversão de taquizoítos em bradizoítos (Smith, 1995; Lyons et al., 2002). Surge, então a infeção crónica com o aparecimento de quistos tecidulares especialmente no músculo e no SNC (Dubey, 2010b). Por outro lado, na ausência de uma resposta imunitária efetiva, pode ocorrer a conversão de bradizoítos em taquizoítos e consequente reativação da doença (Lyons et al., 2002).
7.
I
NFEÇÃO PORT
OXOPLASMA GONDII EM ANIMAISA infeção por T. gondii em animais é influenciada pelos hábitos alimentares e suscetibilidade da espécie hospedeira, assim como pelas condições climáticas da região. Assim, as regiões mais secas e quentes estão, geralmente, associadas a menores valores de prevalência, uma vez que as condições ambientais são pouco favoráveis para a sobrevivência dos oocistos; contrariamente às regiões húmidas (Robert-Gangneux, 2014). Os valores de seroprevalência da infeção por T. gondii em humanos e animais domésticos e silváticos de Portugal encontram-se sumariados nas Tabelas 10, 11, 12 e 13 do Anexo I.
Geralmente a infeção por T. gondii, tanto no hospedeiro definitivo como no intermediário, ocorre sem o aparecimento de sinais clínicos (Dubey, 1987). Não se conhece qual a razão por que alguns animais desenvolvem toxoplasmose e outros não. É
16 pressuposto que a doença resulta de uma falha da imunidade local ou sistémica, uma vez que a imunossupressão está relacionada com uma infeção primária grave e com a reativação da infeção latente (Davidson, 2000).
7.1. CARNÍVOROS DOMÉSTICOS
A prevalência da infeção por T. gondii no gato doméstico (Felis catus) varia com a idade, tipo de alimentação, com o estilo de vida e com a localização geográfica (Tenter et al., 2000; Dubey, 2010b). É pressuposto que um gato seropositivo já excretou oocistos e por isso a seroprevalência nestes animais é um bom indicador da contaminação ambiental por oocistos (Jones e Dubey, 2010). Geralmente, esta é maior em gatos de áreas rurais ou vadios comparativamente aos de áreas urbanas ou suburbanas (Tenter et al., 2000). A seroprevalência aumenta, ainda, com a idade sugerindo uma infeção pós-natal (Dubey, 2010b). Segundo Elmore et al. (2010) a prevalência estimada em gatos domésticos a nível mundial varia entre 30 e 40%. Em Portugal, Lopes et al. (2008) encontraram uma seroprevalência de 35,8% em 204 gatos domésticos do nordeste e na região de Lisboa este valor foi de 20,5% em 215 animais (Esteves et al., 2014). Estes resultados não podem ser comparados uma vez que o limiar de positividade (“cut-off”) definido para o teste de aglutinação modificado (“modified agglutination test”-MAT) foi diferente (20 versus 40) entre os dois estudos. Já em gatos vadios, prevalências entre 24,2 e 44,2% têm sido observadas em Lisboa (Duarte et al., 2010; Waap et al., 2012); e de 39,2% no sul de Portugal (Waap et al., 2016). Em Espanha e na China, outros autores também referem prevalências superiores em gatos vadios comparativamente aos domésticos (Gauss et al., 2003; Miró et al., 2004; Liu et al., 2014). Na Tabela 14 do Anexo II encontram-se alguns valores da seroprevalência da infeção por T. gondii em gatos a nível mundial.
No gato doméstico adulto a infeção por T. gondii é vulgarmente assintomática (Fayer, 1981). No entanto, gatos de qualquer idade, raça ou gênero podem morrer de toxoplasmose (Dubey, 2010b). Os sinais clínicos mais comuns incluem, febre, dispneia, taquipneia, icterícia e desconforto abdominal. Lesões oculares como “flare” do humor aquoso, hifema, anisocoria, midríase, uveíte, corioretinite, atrofia ou hemorragias na retina, são frequentes. Sinais neurológicos como, incoordenação, estupor e cegueira parcial ou total, também podem estar presentes embora não sejam os sinais clínicos mais comuns (Bowman et al., 2002; Dubey, 2010b). Em gatinhos infetados por via transplacentária ou galactófora a infeção é grave e geralmente fatal devido a doença
17 pulmonar ou hepática (Lappin, 2010). As lesões macroscópicas são especialmente encontradas no pulmão e consistem em edema difuso, congestão e presença de áreas multifocais descoradas e firmes. Efusões pericárdicas e abdominais também podem estar presentes. O órgão abdominal mais frequentemente afetado é o fígado com uma hepatite difusa necrosante. Áreas de necrose podem também estar presentes nos linfonodos mesentéricos e pâncreas (Bowman et al., 2002).
Embora os felídeos sejam os únicos capazes de excretar oocistos no ambiente, os cães (Canis lupus familiaris) são considerados sentinelas da infeção por T. gondii devido ao seu contato próximo com humanos (Rodrigues et al., 2016). No cão doméstico a prevalência da infeção varia com a idade, tipo de alimentação e com o estilo de vida (Dubey, 2010b; Lopes et al., 2011a). Geralmente, a prevalência é maior em cães com acesso ao exterior e naqueles onde a dieta incluí carne ou vísceras cruas (Lopes et al., 2011a; Cano-Terriza et al., 2016). E tal como no gato aumenta com a idade (Dubey, 2010b). No nordeste de Portugal, foi observada uma seroprevalência de 38,0% em 673 cães domésticos (Lopes et al., 2011a). Na Tabela 14 do Anexo II encontram-se alguns valores da seroprevalência da infeção por T. gondii em cães a nível mundial.
No cão os sinais clínicos incluem sinais neuromusculares, respiratórios e gastrointestinais (Dubey, 1987). Ao contrário do gato, a toxoplasmose ocular é rara no cão. Geralmente quando presente está associada à infeção generalizada (Davidson, 2000). A infeção por T. gondii é comummente fatal quando associada ao vírus da esgana canina (“canine distemper virus”-CDV) (Dubey, 1987). A infeção tende a ser mais grave no cachorro, porém pouca informação está disponível sobre a transmissão transplacentária no cão (Dubey et al., 2009). As principais lesões ocorrem no pulmão, fígado, cérebro e linfonodos mesentéricos sobre a forma de focos necróticos. Menos frequentemente podem ser observadas áreas de necrose no pâncreas, rim e baço; assim como, úlceras no estômago e intestino delgado; e atrofia do cerebelo (Dubey, 1987).
7.2. HE RBÍVOROS E OMNÍVORO S DOMÉSTICOS
Entre os animais de interesse pecuário, os quistos tecidulares são mais frequentemente encontrados em suínos (Sus scrofa), ovinos (Ovis aries) e caprinos (Capra hircus) (Tenter et al., 2000). A prevalência nestes animais depende do sistema de produção utilizado e consequentemente das condições de higiene e maneio aplicadas,
18 como a restrição do acesso de felídeos e tipo de alimentação fornecida aos animais (Robert-Gangneux, 2014).
Em suínos de Portugal, a prevalência estimada no norte foi de 15,6% em 333 animais (Sousa et al., 2006); e de 9,8% em 254 suínos abatidos para consumo humano (Lopes et al., 2013a). Já no centro e sul do país, foi encontrado um valor de 7,1% (Esteves et al., 2014). No norte do país, a diminuição do valor da prevalência, de 15,6% para 9,8%, foi significativa (p=0,040) (Lopes et al., 2013a). Em outros países europeus, como a Inglaterra, o valor de prevalência obtido, pelo MAT num “cut-off” de 25, foi de 3,6% em 2071 suínos abatidos para consumo humano (Limon et al., 2017); já em Espanha, o valor de foi de 24,5% em 1200 suínos testados para a pesquisa de anticorpos para T. gondii pelo teste de imunofluorescência indireta (“indirect fluorescent antibody test”-IFAT), num “cut-off” de 20 (Herrero et al., 2016); e na Itália foi de 16,1% em 960 suínos, pelo IFAT num “cut-off” de 16 (Veronesi et al., 2011).
Embora a toxoplasmose seja rara no suíno, quando presente manifesta-se na forma de anorexia, febre, dispneia, fraqueza dos membros, diarreia e nados-mortos (Dubey, 2009a; Dubey e Jones, 2008). A mortalidade é mais elevada nos animais jovens (Dubey e Lindsay, 2006). Pneumonia, miocardite, encefalite e necrose placentária são as principais lesões descritas em suínos infetados (Dubey e Lindsay, 2006).
Em algumas regiões do mundo, a prevalência em pequenos ruminantes pode atingir os 96% em ovinos e os 91% em caprinos (Dubey, 2010b). Esta aumenta com a idade e é, geralmente, menor naqueles animais criados em sistemas intensivos (Tenter et al., 2000). No norte de Portugal foram detetados anticorpos para T. gondii em 17,1% de 1467 ovinos (Sousa et al., 2009); em 33,6% de 119 ovinos e em 18,5% de 184 caprinos (Lopes et al., 2013a). A seroprevalência em geral aumentou significativamente (p<0,001) em ovinos do norte do país (Lopes et al., 2013a).
Em pequenos ruminantes, a infeção por T. gondii provoca elevadas perdas económicas devido à morte embrionária, morte fetal, mumificação, aborto e morte neonatal (Dubey e Lindsay, 2006). Na ovelha adulta a infeção é geralmente subclínica, no entanto com a parasitemia pode surgir um episódio de febre (Buxton, 1990; Dubey, 2009b). A infeção no início da gestação é fatal para o feto devido à multiplicação do parasita, facilitada pela ausência de uma resposta imunitária. Porém, o feto pode sobreviver quando a infeção ocorre mais tarde na gestação (Buxton, 1990). As principais lesões placentárias incluem, inflamação focal e necrose dos cotilédones que alternam com áreas intercotiledonares normais. As lesões características são placas ou