Universidade de Trás-os-Montes e Alto Douro
EFEITO DA PRESSÃO NEGATIVA
NO CONGELAMENTO DE SÉMEN OVINO
Dissertação de Mestrado em Medicina Veterinária
Moisés Leitão Gonçalves
Orientador:
Professora Doutora Rita Maria Payan Martins Pinto Carreira Universidade de Trás-os-Montes e Alto Douro
Coorientador:
Professor Doutor Alceu Mezzalira
Universidade do Estado de Santa Catarina
Universidade de Trás-os-Montes e Alto Douro
EFEITO DA PRESSÃO NEGATIVA
NO CONGELAMENTO DE SÉMEN OVINO
Dissertação de Mestrado em Medicina Veterinária
Moisés Leitão Gonçalves
Orientador:
Professora Doutora Rita Maria Payan Martins Pinto Carreira Universidade de Trás-os-Montes e Alto Douro
Coorientador:
Professor Doutor Alceu Mezzalira
Universidade do Estado de Santa Catarina
Composição do Júri:
Professor Doutor Nuno Francisco Fonte Santa Alegria Professora Doutora Ana Celeste Carvalho Bessa
iv
Declaro que esta dissertação de mestrado é resultado do meu trabalho pessoal e da tutoria dos Profs. Drs. Rita Maria Payan Martins Pinto Carreira e Alceu Mezzalira. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
Vila Real, 30 de Outubro de 2013.
v
Aos meus Pais.
vii AGRADECIMENTOS
Quero aproveitar os seguintes parágrafos para reconhecer e agradecer a todos aqueles que de certa forma contribuíram para que este longo percurso académico chegasse a bom termo e que culminasse neste trabalho.
Começo por agradecer à Prof. Dra. Rita Payan, como orientadora da tese, que sempre colocou à minha disposição toda a sua ajuda bem como o seu aconselhamento, conhecimento e experiência, mais-valias fundamentais para a conclusão deste trabalho.
Agradeço também ao meu coorientador, o Prof. Dr. Alceu Mezzalira, Diretor do Laboratório de Reprodução Animal da Universidade do Estado de Santa Catarina, pela sua disponibilidade em me receber e orientar ao longo do meu estágio, tornando possível a realização da pesquisa desenvolvida neste trabalho.
Não posso deixar de agradecer a todo grupo de trabalho do Laboratório de Reprodução Animal da Universidade do Estado de Santa Catarina, principalmente à Renata Casali por ter partilhado toda a sua experiencia e conhecimento na área de estudo e pela paciência demonstrada ao longo do trabalho. Aos Profs. Drs. Fabricio Mozzaquatro e Maicon Pinto, aos colegas Larissa Silva, Caroline Arcego, Ana Karolina, Aimê Friso, Cláudio Brogni, Alysson Macedo, Norton e Lucas por toda a ajuda, partilha de conhecimento, simpatia e hospitalidade. Aos funcionários da empresa EPAGRI pela disponibilidade na cedência dos animais utilizados no estudo.
Agradeço também ao Prof. Dr. Fabiano Salbego, por ter aceitado o meu estágio no Hospital Veterinário da Universidade do Estado de Santa Catarina, pela sua ajuda e partilha de experiencia. A todo o grupo do mesmo Hospital, em especial às internas Bruna e Carina, e aos Drs. Ademar, Fabíola, Doughlas e Bruna Regalin, Aury, Ronise.
Um agradecimento especial às pessoas que tornaram mais fácil a minha adaptação no Brasil, que pela sua hospitalidade, camaradagem e simpatia fizeram com que me sentisse em casa; por tudo isto um grande abraço ao Naor Fialho, Reinaldo Martins, Cessar Dezini, João Mattielo, Miguel Angelo, Eduardo Macagnan e Marciel França.
viii
Quero agradecer ao Dr. Reinaldo Branquinho e a toda a equipa do Hospital Veterinário Limiavet, por me terem recebido nos meus primeiros meses de contacto com a realidade quotidiana de Médico Veterinário. Obrigado pelos ensinamentos, pela paciência e pelos momentos de convívio na vossa família.
A todos os amigos que tive a sorte de conhecer ao longo dos 6 anos em Vila Real, deixo aqui o meu agradecimento por todos os momentos que partilhamos e que dificilmente irei esquecer. O meu obrigado ao Marco Guimarães, Nuno Machado, Sara Levy, Sandra Fagundes, Sofia Soares, Luís Vidinha, Miguel Oliveira, Ângela Eleutério, Alfredo Teixeira, Hélder Valente, Élsio Afonso, João Cancelinha, Rui Pedro Freitas, Leandro Rocha, Paulo Afonso, Carlos Costa, Jorge Lopes, Alexandre Anjos, Daniela Cardoso, Daniel Gomes da Costa, Sara Alves, Sara Melo, Filipa Silva, Inês Coelho, Joana Silva, Joana Sousa, Ana Júlia, Cláudia Morgado, Pedro Barbosa, Marcos Silva, Hélio Oliveira, Ricardo Silva, Pedro Falcão, Patrick Smith, Pedro Fonseca.
A todos os amigos que já conhecia antes de enveredar no ensino superior e que perdurarão, o meu obrigado ao Rafael Rodrigues, Soraia Dantas, Catherine Besteiro, Margarida Fernandes, Tiago Rodrigues, Barbara Araújo, Alberto Rego, Sara Alves, João Meleiro, Nuno Carvalho, Daniel Gonçalves, Tiago Enes, Daniel Castro, Alexandra Táboas, Joana Abreu.
Quero deixar um beijo e um agradecimento bastante especial à Lúcia Pinto, por todo o apoio incondicional que sempre me dedicou e por fazer com que muitas coisas na minha vida tenham sentido. Sei que sempre estarás para me alegrar e motivar nos momentos mais difíceis bem como nos momentos mais felizes. A ti o meu eterno obrigado.
Por último, mas não menos importante, a minha família. Começo pelos meus pais, por todo o amor que me dedicam, pela educação que me transmitiram e por todos os esforços assim como, todos os sacrifícios que fizeram para que esta importante jornada da minha vida fosse concluída, a eles o meu obrigado. Ao meu irmão e irmã agradeço toda a amizade e companheirismo que sempre nos acompanhou. Aos meus avós, paternos e maternos, bem como ao meu tio João e aos meus padrinhos agradeço-lhes todo o amor e educação que sempre me transmitiram.
ix RESUMO
As técnicas de criopreservação de sémen de ovino, apesar da toda a evolução sofrida, ainda se acompanha de uma redução da viabilidade dos espermatozoides à descongelação, conferindo pouca fertilidade ao sémen utilizado em IA. Sabe-se que o sémen congelado de touro e de porco quando submetido a elevada pressão hidrostática positiva na congelação apresenta melhorias consideráveis nos parâmetros motilidade, viabilidade e fertilidade à descongelação, o que orientou os objetivos do presente trabalho. Contudo o equipamento requerido neste processo tem um elevado custo. No trabalho agora apresentado recorreu-se a um equipamento de baixo custo e de fácil utilização para induzir um stresse por pressão negativa com resultados semelhantes ao produzido por pressão positiva, com o objectivo de avaliar as alterações induzidas pela pressão criada nos parâmetros de qualidade do sémen ovino. Para isso, foram recolhidos ejaculados de dois carneiros, que foram utilizados para constituir cinco pools a partir dos quais se trabalhou. Cada um dos pools foi dividido em quatro grupos, a saber: controlo (Ctr), grupos tratados com pressão negativa de 200 mBar (P-200), de 500 mBar (P-500) e de 800 mBar (P-800). Após a descongelação todas as amostras foram analisadas quanto à motilidade progressiva (às 0h, 1h, 2h e 3h após descongelação), à integridade de membrana e do acrossoma e pela taxa de clivagem após fecundação in vitro heteróloga com oócitos bovinos. Os resultados demonstraram que após a descongelação os três grupos submetidos a pressão negativa apresentam motilidade progressiva (0h) inferior à do grupo controlo (p<0,05); porém nas avaliações subsequentes (às 1h, 2 h e 3h) não se observaram diferenças entre os quatro grupos (p>0,05). Relativamente à integridade de membrana o grupo controlo e o grupo P-500 obtiveram resultados semelhantes mas superiores aos obtidos com os tratamentos 200 e P-500 (p<0,05). Na avaliação da taxa de clivagem não houve diferenças entre os grupos controlo, P-200 e P-500, sendo superiores aos do grupo P-800 (p<0,05). Este trabalho permitiu concluir que tratamentos com a pressão -800 mBar são prejudiciais para o sémen de ovino; contudo, pressões negativas de 500 e 200 mBar não comprometem a viabilidade do sémen por comparação com as amostras controlo, se bem que também não apresentem a melhoria pretendida. No entanto, a avaliação do efeito da pressão negativa sobre a fertilidade do sémen ovino precisa de ser testada in vivo, através da taxa de gestação após a inseminação artificial com sémen congelado tratado com pressão negativa.
xi ABSTRACT
Despite the improvement of cryopreservation techniques of ram’s semen in the past few years, there still is a reduction of spermatozoa’s viability after thawing, providing a low fertility IA semen. Bull and boar frozen semen, when submitted to positive high-hydrostatic pressure during freezing presents considerable improvements in motility, viability and fertility after thawing, which guided the goals of the present study, although the equipment needed in this process is expensive. Our project used an equipment low cost and easy handling to induce stress by negative pressure with similar results to positive pressure, with the purpose to evaluate the changes on ram’s semen quality parameters induced by the pressure created. Semen was pooled from ejaculates of two rams. Each pool was aliquot in 4 groups: control (Ctr), groups treated with 200 mBar (p-200), 500 mBar (p-500) and 800 (P-800) negative pressure. After thawing every sample was analyzed for progressive motility (at 0h, 1 h, 2h and 3h after thawing), membrane and acrosome integrity and the cleavage rate after heterologous in vitro fertilization with bovine oocytes. The results showed that after thawing the three groups submitted to negative pressure exhibited progressive motility (0h) lower than control group (p<0,05); although in the following evaluations (at 1h, 2h and 3h) difference were not observe among the four groups (p>0,05). Concerning the membrane integrity, the control group and the P-500 group obtained similar results, and both were superior than for P-200 and P-500 treatments (p<0,05). In the evaluation of cleavage rates there were no differences between the control group, the P-200 group, and P-500 group; however these results were superior when compared with the results from P-800 treatment (p<0,05). We conclude that P-800 mBar treatments are harmful to the ram’s semen; however 500 and 200 mBar do not compromise the viability of the semen by comparison with control samples, even though they don’t show pretended improvements. Negative pressure effect on ram’s semen fertility has to be tested in vivo, through conception rate after artificial insemination with frozen semen treated with negative pressure.
xiii Índice Geral CAPÍTULO 1 ... 21 1.1 CARACTERÍSTICAS DO SÉMEN... 23 1.1.1 Plasma seminal ... 24 1.1.2 Espermatozoide ... 24
1.1.3 Particularidades da fisiologia do espermatozoide no processo de criopreservação ... 26
1.2 FATORES CRIOBIOLÓGICOS DETERMINANTES DA FUNÇÃO DO ESPERMATOZOIDE ... 30
1.2.1 Mecanismos de lesão criogénica ... 30
1.3. TÉCNICAS PARA MELHORAMENTO DA CONGELAÇÃO DE SÉMEN ... 37
1.3.1. Adição de proteínas conservadas do plasma seminal de ovino ... 37
1.3.2. Tratamento com pressão hidrostática elevada prévio à congelação ... 38
1.3.3. Fontes de gema de ovo do diluidor na criopreservação de sémen ovino ... 40
CAPÍTULO 2 ... 42
2.1 MATERIAIS E MÉTODOS... 43
2.1.1 Desenho experimental ... 43
2.1.2 Animais e recolha de sémen ... 44
2.1.3 Processamento de sémen ... 45
2.1.4 Refrigeração e congelação ... 49
2.1.5 Descongelação das amostras ... 50
2.1.6 Avaliação do sémen descongelado ... 50
2.1.7 Avaliação do sémen descongelado após seleção em gradiente de Percoll® ... 53
2.1.8 Análise estatística ... 55
2.2 RESULTADOS ... 56
2.2.1 Avaliação do sémen fresco de cada sessão de congelação ... 56
2.2.2 Avaliação após descongelação ... 57
2.3.DISCUSSÃO ... 60
2.4.CONSIDERAÇÕES FINAIS ... 65
xv ÍNDICE DE FIGURAS
Figura 1 – Representação da interação entre a taxa de congelação, “efeito solução”, formação de gelo e a sobrevivência do espermatozoide ... 35
Figura 2- Equipamento utilizado no tratamento de pressão negativa ... 48
Figura 3 - Equipamento TK 3000 compact® utilizado no congelamento de sémen ... 49
Figura 4 Fotografia em microscopia de contraste de fase (1) e fluorescência (2) do mesmo campo de leitura (ampliação de 400x). ... 52
Figura 5 Fotografia em microscópio de fluorescência (Ampliação de 800x). ... 52
xvii ÍNDICE DE TABELAS
Tabela 1 - Constituintes do Diluidor ... 47
Tabela 2 - Avaliação do sémen fresco (MotM - motilidade massal; MotP - motilidade progressiva). ... 56
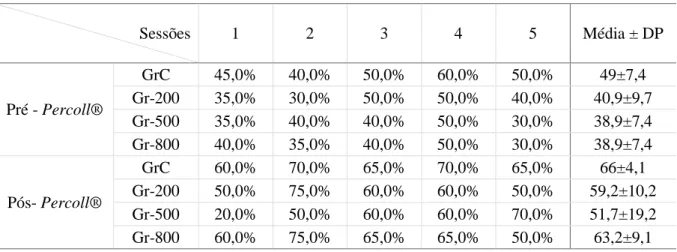
Tabela 3 – Motilidade progressiva avaliada no momento após a descongelação antes e depois da seleção de espermatozoides em gradiente de Percoll® ... 57
Tabela 4 – Motilidade Progressiva avaliada uma, duas e três horas após a descongelação do sémen ... 58
Tabela 5 – Integridade da membrana, avaliada antes e depois da seleção de espermatozoides em gradiente de Percoll® ... 58
Tabela 6 – Integridade do acrossoma, avaliada antes e depois da seleção de espermatozoides em gradiente de Percoll® ... 59
xix LISTA DE ABREVIATURAS E SIGLAS
% - Percentagem
ADN - Ácido Desoxirribonucleico ADP - Adenosina Difosfato
AMPc - Adenosina Monofosfato cíclico ATP - Adenosina Trifosfato
BSA - Albumina de soro bovino
CASA - Análise seminal assistida por computador COCs - Complexos Cumulus-Oócitos
ERK - Cinases reguladas por sinais extracelulares FITC - Isoticianato de fluoresceína
FIV - Fecundação in vitro GPx - Glutationa peroxidase H2O2 - Peróxido de hidrogénio HSP - Proteínas de choque térmico IA - Inseminação artificial
MAP - Cinase ativada por mitógeno Min – Minuto
Ml – Mililitro Mm – Milímetro MPa - Mega Pascal
Mr - Massa molecular relativa NO - Óxido nítrico
O2- - Anião superóxido ºC:- Graus centigrados
PA - Aglutinina de amendoim PBS - Phosphate Buffered Saline
PHGPx - Fosfolípido hidroperóxido da glutationa peroxidase ROS - Espécies Reativas de Oxigénio
rpm - Rotações por minuto
RSVP - Seminal Vesicle Protein Precursor SOD - Superóxido Dismutase
xx UV – Ultra Violeta
VA- Vagina artificial μL - microlitros
21
CAPÍTULO 1
22
Durante séculos a ciência foi surpreendida pelo comportamento dos espermatozoides quando submetidos a temperaturas baixas. A descoberta dos agentes crioprotetores, nomeadamente o glicerol fomentaram o interesse na investigação da criopreservação de sémen de mamíferos (Salamon e Maxwell, 2000). Estes avanços na tecnologia da criopreservação possibilitaram o congelamento de sémen e permitiram a expansão de programas de melhoramento animal devido à sua enorme aplicação na inseminação artificial e na fecundação in vitro. A criopreservação de sémen possibilita que os locais de recolha de sémen e inseminação se localizem em áreas geográficas diferentes facilitando a distribuição do material genético, além de possibilitar também o armazenamento a longo prazo e deste modo a inseminação com sémen de um macho já morto; por outro lado reduz o risco de transmissão de doenças e permite a inseminação de um grande número de fêmeas num curto período de tempo (Ollero et al. 1998, Bailey et al. 2008). A criopreservação de sémen também contribuiu para a redução dos custos associados à manutenção de linhagens de animais de pesquisa e permitiu que as tecnologias de reprodução assistida se tornassem uma realidade no tratamento da infertilidade (Benson et al. 2012).
Os primeiros registos de congelamento de sémen de carneiro são de Bernstein e Petropavlovsky em 1937, utilizando como crioprotetor uma solução de glicerol 1 M a 9,2%, tendo congelado a -21 °C sémen de vários mamíferos (coelho, cobaia, carneiro, touro, porco, cavalo) e aves (frango e pato) (Salamon e Maxwell, 2000).
Ao longo dos anos têm sido elaboradas técnicas empíricas e testados novos protocolos de criopreservação de sémen com o objetivo de alargar a metodologia para várias espécies e melhorar a eficiência do processo. Apesar das melhorias introduzidas nas técnicas de criopreservação ao longo das últimas décadas, a viabilidade e a fertilidade pós-descongelação do sémen são reduzidas como consequência das lesões celulares resultantes de todo o processo de criopreservação (Medeiros et al. 2002). Durante a criopreservação as células espermáticas são expostas a grandes variações de temperatura, que vão desde a temperatura no momento da recolha do sémen até -196ºC; estas alterações de temperatura promovem modificações na função e estrutura celular devido ao “choque térmico”, exercido sobretudo no acrossoma, membrana plasmática e nas mitocôndrias (Ollero et al. 1998). Este fenómeno, “choque térmico”, surge nos espermatozoides de algumas espécies de mamíferos e é resultado do arrefecimento rápido provocado por uma taxa de arrefecimento elevada, causando danos irreversíveis num grande número de células (Watson, 1981). As lesões associadas ao choque
23
térmico podem ser diferentes consoante a espécie, quer no que respeita à estrutura mais atingida quer no grau de lesão infligida.
Salamon e Maxwell (2000), classificam os danos criogénicos no sémen de ovino em ultraestruturais (físicos) e bioquímicos ou funcionais. Os danos ultra estruturais são geralmente mais acentuados nos espermatozoide de ovino do que nos de bovino e ocorrem na membrana plasmática, no acrossoma, na bainha mitocondrial e no axonema. Relativamente ao espermatozoide de ovino após congelamento, a motilidade encontra-se melhor preservada que a integridade morfológica, sendo as membranas plasmáticas e acrossómicas mais sensíveis que o núcleo e peça intermédia. Após os procedimentos de congelação e descongelação do sémen de ovino, constatou-se que existem alterações na arquitetura da mitocôndria embora o mesmo não seja verificado na cauda ou no axonema (Salamon e Maxwell, 2000).
Todos estes danos ultra estruturais são acompanhados por alterações bioquímicas ou perda de conteúdo vital. Algumas das perdas ou alterações incluem: a libertação de transaminase glutâmico oxalacética, perdas de lipoproteínas e aminoácidos, diminuição da atividade da fosfatase, diminuição das proteínas de ligação fraca ao colesterol (loosely bound cholesterol protein), aumento do conteúdo em sódio e diminuição de potássio, inativação da hialuronidase e acrosina, redução da síntese de ATP e ADP, e diminuição da atividade proteolítica do acrossoma. Devido a este conjunto de lesões provocadas no espermatozoide, a taxa de espermatozoides de ovino com motilidade após descongelação é de 40% a 60%, embora só 20% a 30% permaneçam biologicamente funcionais, já que o espermatozoide pode ter motilidade e ao mesmo tempo apresentar danos ultra estruturais que limitam a sua capacidade de fecundação. A motilidade e estrutura do espermatozoide são pois afetadas de diferente modo, não se sabendo ainda se essas alterações ocorrem simultaneamente ou em fases diferentes da congelação e descongelação (Salamon e Maxwell, 1995; Salamon e Maxwell, 2000).
1.1 Características do Sémen
O sémen é o fluído emitido durante a ejaculação e proporciona o veículo aos gametas masculinos (espermatozoides). É depositado na vagina da fêmea durante a cópula, ou pode ser recolhido de um macho por meios artificiais para estudos, congelamento ou para inseminação artificial. O sémen é composto por duas frações principais, nomeadamente o plasma seminal e
24
o espermatozoide. A composição e as características do sémen varia entre espécies diferentes (Evans e Maxwell, 1987).
1.1.1 Plasma seminal
O plasma seminal é uma mistura de fluídos segregados maioritariamente pelas glândulas vesiculares, com um menor contributo dos testículos, epidídimo, ductos deferentes e das restantes glândulas sexuais anexas. As três funções básicas do plasma seminal são: 1) servir de veículo para o espermatozoide, transportando-o ao longo do trato reprodutor masculino durante a ejaculação; 2) servir como um meio de ativação para os espermatozoides não móveis; 3) fornecer um meio tampão, rico em nutrientes que favorece a sobrevivência do espermatozoide após a deposição no trato feminino. O plasma seminal do ovino é um fluido isotónico com pH neutro, constituído maioritariamente por água (cerca de 75%). Os seus principais constituintes orgânicos são: frutose (maior fonte energética do espermatozoide), sorbitol, inositol, ácido cítrico, glicerilfosforilcolina, fosfolípidos, prostaglandinas e proteínas. Da fração inorgânica fazem parte os iões sódio, potássio e cloreto. As prostaglandinas estão presentes no plasma seminal de várias espécies e a sua concentração é mais elevada no sémen de pequenos ruminantes que nas outras espécies, não sendo clara a razão deste facto. Uma vez que as prostaglandinas induzem fortes contrações na musculatura uterina, tem sido sugerido que tais contrações ajudem no transporte e progressão do espermatozoide ao longo do trato feminino (Evans e Maxwell, 1987).
1.1.2 Espermatozoide
1.1.2.1 Morfologia
O espermatozoide dos mamíferos é constituído por 3 porções: cabeça, pescoço e cauda. O seu comprimento é específico da espécie e varia entre os animais de interesse pecuário e os animais de companhia, entre 50 µm (porco e javali), 60 µm (carneiro e bode) e 90 µm (touro) (Pesch e Bergmann, 2006). A membrana plasmática rodeia totalmente o espermatozoide e a sua organização segue o modelo de mosaico fluído aplicado às membranas biológicas proposto por Singer e Nicholson; com proteínas integrantes dispersas na superfície e entre a dupla camada de fosfolípidos polarizados (Parks e Graham, 1992). Relativamente à composição dos
25
fosfolípidos, é específica da espécie (aproximadamente 70% de fosfolípidos, 25% de lípidos neutros e 5% glicolípidos (Meyers 2005).
Cabeça
A cabeça do espermatozoide é constituída pelo acrossoma e o núcleo, rodeados pela membrana plasmática. O acrossoma forma-se a partir do complexo de Golgi e contém enzimas eletrolíticas tais como a acrosina, hialuronidase além de muitas outras hidrólases e esterases. Estas enzimas são fundamentais para a lise da zona pelúcida e penetração da corona radiata do oócito. Serão libertadas durante a reação do acrossoma quando a membrana externa do acrossoma se funde com a membrana plasmática do espermatozoide (Pesch e Bergmann, 2006)
O acrossoma forma uma estrutura que reveste os primeiros dois terços da cabeça do espermatozoide; existe uma grande variação da sua forma, que é espécie-específica. O acrossoma é constituído por uma membrana interna e externa que se encontram fundidas na porção distal do mesmo e rodeada por conteúdo electrodenso amorfo. Entre o acrossoma e o núcleo existe um pequeno espaço denominado subacrossomal, rico em conteúdo amorfo de baixa densidade que confere adesão entre ambos (Pesch e Bergmann, 2006).
O núcleo contém cromatina condensada com a informação genética. A forma do núcleo é específica para espécie e geralmente é achatado dorso-ventralmente, de contorno oval, ensiforme ou falciforme. A membrana nuclear que reveste o núcleo e a membrana interna do acrossoma formam o envelope nuclear. Na extremidade caudal do núcleo existe a fossa de implantação, que serve de âncora para a cabeça do capítulo da peça intermédia. Esta fossa de implantação é espécie-específica e está rodeada por duas camadas opostas do envelope nuclear, com pontes cruzadas entre elas e reforçadas por uma camada de material denso, a placa basal (Pesch e Bergmann, 2006).
Colo
O colo é um segmento curto que une o flagelo à cabeça do espermatozoide. Tem aproximadamente 1 µm e está fixo anteriormente na placa basal através do capítulo e posteriormente nas fibras densas externas do flagelo. É composto pelas colunas segmentares e
26
uma estrutura fibrosa densa, o capítulo, que tem um comprimento e forma variável. Próximo dele encontra-se o centríolo proximal (o centríolo distal está ausente no espermatozoide maduro, uma vez que opera como corpo basal do flagelo no início da espermiogénese). As colunas segmentares estão na origem das nove fibras densas externas que conferem rigidez e resistência ao flagelo. Entre estas colunas encontram-se pequenas projeções das mitocôndrias cuja função é o fornecimento de energia (Pesch e Bergmann, 2006).
Peça intermédia, peça principal e peça terminal
A cauda é a estrutura maior do espermatozoide e é constituída pela peça intermédia, peça principal e peça terminal. A peça intermédia tem cerca de 5 µm de comprimento e é constituída pela bainha mitocondrial que envolve o axonema e as nove fibras densas; é a este nível que se produz a energia essencial à motilidade e demais funções do espermatozoide. As nove fibras densas rodeiam o axonema, que é composto por nove pares de microtúbulos circundando um par central, resultando numa disposição 9 + 9 + 2. Na peça principal, que é o segmento mais longo, a bainha mitocondrial é substituída por uma camada de tecido fibroso, que funciona de suporte e é mediador nas vias da sinalização proteica, podendo estar envolvido na regulação da maturação de espermatozoides, motilidade e capacitação. Na peça terminal a estrutura de nove fibras densas, nove microtúbulos e o par central sofrem uma alteração estrutural convertendo-se em dezoito microtúbulos independentes (Pesch e Bergmann, 2006).
1.1.3 Particularidades da fisiologia do espermatozoide no processo de criopreservação
Na maior parte das espécies, a congelação predispõe à capacitação do espermatozoide que rapidamente evolui para a reação do acrossoma após descongelação (Medeiros et al. 2002). A compreensão do processo de capacitação é de especial importância para perceber a possível origem dos efeitos prejudiciais da criopreservação na função do espermatozoide; portanto, parece-nos oportuno fazer uma revisão da fisiologia do espermatozoide e do processo de capacitação.
Determinadas características específicas dos espermatozoides conferem a particularidade de serem uma "célula terminal" e por isso mesmo mais suscetível a lesões. O espermatozoide é uma célula haploide, quase desprovido de citoplasma e outras organelas celulares, exceto o núcleo, o acrossoma, as mitocôndrias que se localizam na peça intermédia, e os constituintes
27
do flagelo (Eddy et al. 1994, citado por Medeiros et al. 2002). No núcleo, os cromossomas estão altamente condensados, impedindo assim qualquer atividade de transcrição de forma a serem produzidas proteínas. O acrossoma, uma bolsa de conteúdo enzimático, permite que o espermatozoide interaja e penetre o oócito no momento da fecundação. As mitocôndrias fornecem o ATP, que é usado principalmente na motilidade. O espermatozoide tem uma quantidade residual de retículo endoplasmático e complexo de Golgi, pelo que o espermatozoide depende da absorção de moléculas do meio envolvente de forma a manter as membranas celulares funcionais e para que o processo de capacitação espermática possa ocorrer (Amann et al. 1993).
Nos mamíferos, o ejaculado permanece durante algum tempo no trato reprodutor feminino, que tem uma duração espécie-específica, onde ocorre a maturação final do espermatozoide que torna possível a fecundação do oócito. Esta exigência de tempo é modulada pelo estado hormonal da fêmea, e procura prevenir o envelhecimento dos gametas (Medeiros et al. 2002). A progressão no meio extra-testicular, primeiro no trato reprodutor masculino e posteriormente, no trato reprodutivo feminino, induz no espermatozoide uma sucessão de alterações bioquímicas necessárias para desenvolver a capacidade de fecundação (Chang, 1951). Estas alterações que conduzem à maturação do espermatozoide estão definidos como dois processos, a capacitação espermática e a reação acrossómica (Austin, 1952).
1.1.3.1 Capacitação espermática
A capacitação não pode ser detetada a nível estrutural; no entanto, a nível molecular foram caracterizados alguns processos (Visconti et al. 1998; Medeiros et al. 2002). A capacitação espermática é um conjunto de reações bioquímicas num determinado período de tempo, o desenvolvimento das quais depende das condições intrínsecas do espermatozoide e da interação do espermatozoide no aparelho genital feminino. Os mecanismos de capacitação espermática devem-se a modificações na membrana plasmática e na concentração intracelulares de vários iões. Estas modificações compreendem: 1) a remoção ou inativação dos fatores de descapacitação na superfície do espermatozoide, que têm origem epididimária e/ou seminal (Medeiros et al. 2002); 2) alterações na localização, estrutura molecular e mobilidade lateral das proteínas integrantes da membrana (Medeiros et al. 2002); 3) adsorção de proteínas do trato genital feminino para o espermatozoide (Yanagimachi, 1994, citado por Medeiros et al. 2002); 4) alterações na composição lipídica da membrana, em especial no rácio colesterol/fosfolípido
28
(propôs-se que uma diminuição no teor de colesterol da membrana plasmática do espermatozoide durante a capacitação leva ao aumento da fluidez da membrana, com consequente aumento da permeabilidade da membrana e da capacidade de fusão, facilitando assim a fusão da membrana plasmática com a membrana acrossómica externa (Cross, 1998)); 5) desregulação iónica indicada pelo aumento de cálcio e sódio internos e pH (Fraser, 1995); 6) produção de espécies reativas de oxigénio (ROS), aumento no cAMP e a fosforilação da tirosina (Aitken, 1995; de Lamirande et al. 1997; Visconti et al. 1998; Parrish et al. 1999; Topper et al. 1999).
O processo de capacitação espermática inicia-se com o aumento intracelular de cálcio, bicarbonato de sódio e peróxido de hidrogénio, que conjuntamente ativam a adenilato-ciclase para a produção de AMP cíclico (cAMP); a proteína cinase A é ativada pela produção de cAMP e inicia a fosforilação de proteínas (Meyers, 2005). A capacitação espermática do rato, do homem e do touro foi correlacionada com o aumento da fosforilação da tirosina, em substratos proteicos designados por Mr 40.000 – 120.000 (Visconti et al., 1998) e estes autores sugerem que a fosforilação da tirosina medeia uma variedade de funções celulares, tais como: 1) regulação do crescimento; 2) controlo do ciclo celular; 3) integridade do citoesqueleto; 4) regulação da corrente iônica; 5) regulação dos recetores e 6) elemento essencial após a capacitação (Meyers, 2005). In vitro, o aumento da fosforilação da tirosina depende da presença no meio de BSA (albumina de soro bovino), cálcio e bicarbonato de sódio; as concentrações destes compostos necessários na fosforilação de tirosina são semelhantes às necessárias para a capacitação. Após a capacitação espermática o espermatozoide adquire a competência para se ligar à zona pelúcida do oócito interagindo com um recetor específico (Meyers, 2005).
1.1.3.2 Reação acrossómica
A reação acrossómica é um evento estrutural e bioquímico bem definido. Ocorre antes da fecundação, uma vez que o espermatozoide necessita de segregar as enzimas do acrossoma para penetrar na zona pelúcida. A reação acrossómica é acionada pelo contacto com a zona pelúcida e trata-se da fusão de múltiplos pontos entre a membrana plasmática e a membrana exterior do acrossoma, seguido pela vesiculação da membrana e saída do conteúdo enzimático acrossomal (Medeiros et al. 2002; Gadella, 2008).
29 1.1.3.3 Espécies Reativas de Oxigénio
Estão disponíveis alguns estudos sobre o envolvimento das espécies reativas de oxigénio (ROS) na capacitação espermática. Espécies reativas de oxigénio, especificamente o anião superóxido (O2-), o peróxido de hidrogénio (H2O2) e óxido nítrico (NO) desempenham um papel importante na cascata de reações que conduzem à capacitação (Aitken, 1995). A produção de O2- está relacionado com o desenvolvimento da hiperativação e capacitação no espermatozoide humano (de Lamirande e Gagnon, 1993; Zhang e Zheng, 1996). A adição de níveis baixos de H2O2 desencadeiam a capacitação espermática no sémen de hamster, também o O2- foi associado à capacitação espermática do sémen de bovino ao passo que o H2O2 parece estar envolvido na reação de acrossoma (O'Flaherty et al. 1999). A peroxidação lipídica favorece a ligação do espermatozoide à zona pelúcida (Aitken et al. 1989). Durante a capacitação, as mudanças iónicas intracelulares levam à produção de ROS, necessária à ocorrência da fosforilação da tirosina-quinase (Aitken et al. 1998; Leclerc et al. 1998). Apesar do seu papel fisiológico na capacitação e reação acrossómica, as espécies reativas de oxigénio são prejudiciais para a sobrevivência dos espermatozoide. Estas moléculas são formadas a partir da redução incompleta do oxigénio molecular e são tóxicos para as células, devido à sua instabilidade. Os espermatozoides são particularmente suscetíveis à lesão oxidativa devido aos muitos fosfolípidos polinsaturados na membrana plasmática, à incapacidade de realizar a síntese de novo de componentes da membrana e da fraca capacidade do seu sistema antioxidante.
Os espermatozoides, assim como o plasma seminal, possuem enzimas que retêm ou sequestram os radicais livres, como a superóxido dismutase (SOD), a catalase ou a peroxidase (GPx e PHGPx), além de outros agentes redutores, como a glutationa, o ácido ascórbico, taurina, e hipotaurina. Estes sistemas antioxidantes são específicos para cada espécie tanto no que respeita ao tipo como na sua distribuição intracelular ou nos fluídos, do trato masculino e feminino (Aitken e Vernet, 1998; Lapointe et al. 1998; Lapointe et al. 2000; Medeiros et al. 2002).
30
1.2 Fatores criobiológicos determinantes da função do espermatozoide
1.2.1 Mecanismos de lesão criogénica
No protocolo de criopreservação existem diferentes oportunidades para ocorrerem lesões nos espermatozoides; a causa primária de lesão criogénica é a rutura da membrana plasmática, devido a diferentes tipos de stresse: térmicos, mecânicos, químicos e osmóticos (Parks e Graham, 1992). A qualidade do sémen congelado depende maioritariamente da capacidade das células suportarem o processo de criopreservação sem prejuízo das suas funções mais importantes, entre as quais a viabilidade e motilidade. As várias formas de lesão e os seus mecanismos intrínsecos serão descritos a seguir.
1.2.1.1 Variações de temperatura
Contrariamente à crença popular, o maior desafio da sobrevivência das células ao longo do processo de criopreservação não é a sua capacidade de suportar o armazenamento a baixa temperatura (-196ºC), mas sim a agressividade dos intervalos de temperatura entre -15ºC e -60°C que as células tem necessariamente de atravessar duas vezes: durante a congelação e posteriormente na descongelação (Mazur, 1963). Sabe-se que o arrefecimento demasiado rápido do sémen de ungulados, entre 30ºC e 0ºC conduz ao “choque térmico”, um stresse letal para alguns espermatozoides. De forma a reduzir este fenómeno, o arrefecimento neste intervalo crítico de temperaturas tem de ser feito com extrema cautela. Mesmo recorrendo a um arrefecimento lento as variações de temperatura induzem stresse nas membranas, devido à transição de fase dos lípidos e mudança do estado funcional das membranas (fase líquida e fase gel podem coexistir). O “choque térmico” induzido na membrana plasmática pode ocorrer a temperaturas inferiores a 0Cº uma vez que a transição de fase lipídica pode não estar completa a essa temperatura (Watson, 2000). No entanto, a transição de fase é feita maioritariamente entre os 15ºC e 5 Cº (Drobnis,1993 citado por Watson, 2000) e é neste intervalo que ocorrem as principais lesões causadas pelas mudanças de temperatura.
A hipótese das lesões produzidas na membrana plasmática serem resultado da transição de fase na dupla camada lipídica está bem fundamentada. Trabalhos usando a análise estrutural por fratura de congelação da membrana plasmática do espermatozoide antes, durante e após o congelamento prestaram evidências claras da ocorrência de separação de fases, que são apenas
31
parcialmente revertidos após o aquecimento/descongelação (de Leeuw, 1990 citado por Watson, 2000). Outros componentes da membrana plasmática podem também ser afetados pelo stresse da variação de temperatura, nomeadamente as proteínas integrantes da membrana que são aglomeradas em clusters devido à separação das fases lipídicas, promovendo alterações na sua função; estas modificações são especialmente importantes em proteínas estruturalmente modificadas em virtude da sua função na membrana, como no caso das proteínas constituintes dos canais iónicos (Watson, 2000). Sabe-se que a permeabilidade de membrana aumenta após o arrefecimento, pode ser devido a um aumento da permeabilidade geral da membrana ou a alterações promovidas especificamente nos canais iónicos. Desta forma a regulação do cálcio é afetada durante o arrefecimento conduzindo a sérias consequências em termos de função celular; casos extremos desta alteração podem ser incompatíveis com a viabilidade celular. A absorção de cálcio durante a refrigeração induz uma capacitação espermática acelerada e a fusão de alguns pontos entre as membranas plasmática e acrossómica externa assemelhando-se aos processos que ocorrem durante a reação do acrossoma (Watson, 2000).
Os elementos do citoesqueleto são igualmente sensíveis às variações de temperatura. Na refrigeração de outras células ocorre uma prematura despolimerização dos filamentos de actina (Hall, 1993 citado por Watson, 2000). Segundo os princípios postulados por Spungin (1995) citado por Watson (2000), a despolimerização da F-actina do citoesqueleto do espermatozoide, é um passo necessário para a aproximação da membrana plasmática à membrana externa do acrossoma promovendo a reação do acrossoma; assim sendo, essa despolimerização prematura pode contribuir para uma fusão desordenada das membranas após criopreservação.
1.2.1.2 Choque osmótico
As lesões celulares decorrentes do processo de criopreservação, sejam morfológicas ou funcionais, surgem principalmente devido ao choque osmótico; estas lesões resultam da hiperosmolaridade do diluidor, da mudança da concentração relativa do soluto durante o processo de congelação/descongelação e da diferença nas permeabilidades relativas da água e de solutos permeáveis e impermeáveis (Sieme et al. 2008).
Um dos constituintes do diluidor é o crioprotetor que provoca um stresse osmótico transitório na membrana plasmática do espermatozoide, em função da permeabilidade relativa do crioprotetor; modificando o comportamento das células durante a criopreservação; afetando a
32
taxa de transporte de água, o processo de nucleação e o crescimento dos cristais de gelo (Gao e Critser, 2000). O agente crioprotetor de eleição para a criopreservação de sémen é o glicerol (ocasionalmente o dimetilsulfoxido) ao qual está associado um stresse osmótico letal para concentrações superiores a 1 M (Watson, 2000).
A adição de glicerol reduz a capacidade elétrica da membrana, sugerindo a ocorrência de rearranjos em grande escala na estrutura da membrana (Rudenko et al., 1984, citado por Parks e Graham, 1992); induz a formação de junções de hiato na membrana (Kachar et al., 1985 citado por Parks e Graham, 1992) e provoca a interdigitação dos dois folhetos da dupla camada, conduzindo a alterações na fluidez de membrana através do aumento da ordem das cadeias interiores de cadeias acil de ácidos gordos (Boggs et al., 1985 citado por Parks e Graham, 1992); o glicerol também modifica a polimerização e despolimerização de microtúbulos, que podem afetar indiretamente a membrana plasmática. As alterações na estrutura do citoesqueleto podem interferir com a interação das proteínas associadas aos microtúbulos e o citoesqueleto (Keates et al. 1980 citado por Parks e Graham, 1992) e alterar a transdução do sinal de membrana ou interferir com a capacitância dos domínios membranares (Parks e Graham, 1992).
Alterações osmóticas no meio provocam uma redução da capacidade celular para preservar os processos de sinalização, o que constitui uma importante consequência da criopreservação (Meyers, 2005). Durante a capacitação espermática o efluxo de colesterol é necessário para aumentar a fluidez da membrana e para estimular a fosforilação da tirosina, processos fundamentais para a fertilização; a importância deste efluxo sugere que o colesterol e a sinalização são mecanismos importantes a ter em conta nos danos osmóticos da criopreservação; o efluxo de colesterol, bem como o aumento do cálcio intracelular observados durante a capacitação espermática, ocorrem também na criopreservação (Holt, 2000, Watson, 2000 citados por Meyers 2005). A capacitação espermática induzida pela criopreservação é consequência do aumento de cálcio intracelular devido a lesão membranar, ao passo que a importância do colesterol neste tipo de lesão não é bem conhecido (Meyers 2005).
As cinases ativadas por mitógeno (MAP) são elementos importantes na transdução do sinal da superfície celular para o núcleo, desempenhando um papel fundamental na proliferação e diferenciação celular, e são ativadas em resposta ao stresse celular (Raingeaud et al., 1995, Volonte et al., 2001 citados por Meyers, 2005); Várias cinases pertencentes à família MAP estão já identificadas, como por exemplo as cinases reguladas por sinais extracelulares (ERK40
33
e a MAP p38) (Rouse et al., 1994 citado por Meyers); o choque osmótico ativa a via da MAP p38 em células somáticas de mamíferos e as ERK são ativadas principalmente pela estimulação de fatores de crescimento; no entanto Meyers (2005) não encontrou provas em sémen de equino, de que a via da MAP p38 possa ter um papel importante na resposta ao stresse osmótico.
No congelamento, as células sofrem desidratação induzida pelas soluções hiperosmóticas não congeladas, com consequente perda de volume celular (até metade do volume quando em condições isotónicas) (Parks e Graham 1992); por outro lado, na descongelação ocorre um reequilíbrio e a água entra na célula (estímulo hipotónico) conduzindo a um aumento do volume celular (até ao dobro do volume quando em condições isotónicas); (Parks e Graham 1992). O limite para estas variações de volume do espermatozoide é em parte determinado pela sua capacidade em suportar estas variações. Quando estes níveis são ultrapassados (a diferença máxima entre estes níveis é conhecida como a capacidade máxima de mobilização celular ou maximal cell volume excursion), ocorre lesão celular. Desta forma a taxa de congelamento mais equilibrada para um determinado tipo de célula deve promover uma mobilização de volume tolerável, ou seja, uma variação de volume que não produza perda de integridade da membrana plasmática nem interfira com a função celular (por exemplo a motilidade do espermatozoide) (Sieme et al. 2008). A incapacidade das células recuperarem o seu volume após a descongelação resulta em disfunção e morte celular; os danos provocados durante a criopreservação devido à sensibilidade das células em meios hiperosmóticos são designados como "efeito solução” (Sieme et al. 2008).
As lesões induzidas pela solução hiperosmótica agravam-se quando o congelamento é efetuado a uma taxa de congelação baixa, uma vez que o período de desidratação é mais longo e a exposição das células à solução hiperosmótica não congelada é mais prolongada, provocando assim um elevado grau de desidratação, com consequente redução de volume e rutura celular (Mazur, 1972 citado por Sieme et al. 2008). Lovelock (1957) citado por Gao e Critser (2000) propuseram que o aumento da concentração de solutos e desidratação celular produzem efeitos deletérios sobre os complexos lípido-proteína da membrana plasmática, enfraquecendo-os e provocando as perdas de lípidos e fosfolípidos. Com estas perdas, a célula torna-se permeável aos eletrólitos aumentando de volume e podendo sofrer lise. Karow e Webb (1965), citados por Gao e Critser (2000), explicam as lesões em tecidos congelados a uma taxa lenta, como consequência da extração de água ligada a estruturas celulares para incorporação nos cristais
34
de gelo formados; desnudando as proteínas dispostas em rede ligadas a moléculas de água, que são estruturas essenciais para a integridade da célula.
1.2.1.3 Formação e dissolução dos cristais de gelo
O stresse induzido pela formação de cristais de gelo está associado principalmente com a variação da pressão osmótica na fração não congelada. Quando uma solução é arrefecida abaixo do ponto de congelação, ocorre a nucleação dos cristais de gelo; os solutos são dissolvidos no que resta da fração líquida da água, aumentando a pressão osmótica da solução. Assim, a quantidade de água que cristaliza, bem como a pressão osmótica da solução remanescente dependem da temperatura (quanto mais reduzida for a temperatura, mais gelo se forma e menor volume terá a fração não congelada, gerando uma maior pressão osmótica da solução remanescente). Sabe-se que, para obter ótimas taxas de sobrevivência celular a duração da exposição das células a condições hiperosmóticas deve ser o mais breve possível, portanto, a taxa de arrefecimento deve ser o mais rápida possível para evitar os danos provocados pelo “efeito solução”; os melhores índices de sobrevivência dos espermatozoides foram conseguidas empiricamente através da congelação a taxas de congelação elevadas (15º - 60ºC/min) (Mazur 1984 citado por Watson 2000). No entanto a baixa permeabilidade da membrana espermática representa um fator crítico do congelamento rápido, pelo que a taxa deve ser suficientemente lenta para permitir que a água intracelular saia por osmose, prevenindo a formação de gelo intracelular que provoca por si só lesão mecânica através de danos na estrutura celular (Muldrew e McGann, 1990, 1994 citados por Sieme et al. 2008).
A Figura 1 ilustra a interação do “efeito solução” e da formação de gelo intracelular em função da taxa de congelação, que resulta numa curva de sobrevivência celular em forma de “U” invertido.
35 1.2.1.4 Processo de descongelação
Uma célula que sobreviva à congelação a temperaturas abaixo de zero é posteriormente desafiada no processo de aquecimento e descongelação; este processo pode provocar efeitos negativos sobre a sobrevivência celular semelhantes aos descritos para o arrefecimento (Mazur 1984, citado por Gao e Critser 2000). A extensão destas lesões depende da quantidade de gelo intracelular formado e da desidratação celular, fruto da taxa de arrefecimento utilizada. No primeiro caso, recorrendo a uma descongelação rápida pode-se recuperar, com o mínimo de lesão, um grande número de células; uma vez que se evita o processo de recristalização, isto é, a evolução dos cristais de gelo intracelulares pequenos em cristais de maior dimensão. Mesmo quando as células são arrefecidas a uma taxa mais lenta, evitando o congelamento intracelular, é difícil prever a taxa de descongelação ideal, já que a resposta à taxa de descongelação é dependente das condições da congelação e do tipo de células em causa. Gao e Critser 2000, referindo-se ao trabalho de Mahadevan (1980) em que foram testadas várias metodologias e taxas de aquecimento de sémen humano, apontam o facto de a descongelação mais lenta, efetuada ao ar a 20ºC e 35°C, ser a que apresenta melhores índices de motilidade e coloração supravital. No entanto, aqueles autores referem também que quando a taxa de congelação é rápida o efeito da taxa de descongelação é residual, provavelmente porque os espermatozoides tornaram-se inviáveis devido à formação de gelo intracelular durante o processo de congelação rápida.
Figura 1 – Representação da interação entre a taxa de congelação, “efeito solução”, formação de gelo e a sobrevivência do espermatozoide; Adaptado de Benson et al. (2012)
36
1.2.1.5 Lesão oxidativa provocada por espécies reativas de oxigénio (ROS)
A redução da motilidade e da fertilidade seminal, ocorrida em processos de preservação do sémen e na inseminação artificial, tem sido em parte, atribuída a lesão oxidativa resultante da formação excessiva ou inapropriada de ROS (Roca, 2005 citado por Kadirvel et al. 2009). As consequências de lesões oxidativos são várias: 1) lesão na membrana; 2) inibição da respiração; 3) perda de enzimas intracelulares; 4) alteração das proteínas do axonema e 5) lesão na membrana mitocondrial (Aitken et al., 1998 citado por. Kadirvel et al. 2009).
Estudos demonstram que a peroxidação lipídica da membrana provocada pelas ROS é uma das causas da deficiente função espermática do sémen conservado a 4ºC (Vishwanath et al., 2000, citado por. Kadirvel et al. 2009) e congelado (Chatterjee et al., 2001 citado por Kadirvel et al. 2009), uma vez que a perda da integridade da membrana espermática derivada da peroxidação lipidica aumenta a sua permeabilidade, e consequentemente perde a capacidade de regulação da concentração de iões intracelulares com funções importantes na movimentação dos espermatozoides. No entanto Armstrong et al (1999), citado por Kavirdel et al., (2009), atribuiem a diminuição e perda da motilidade espermática à diminução do potencial da membrana da mitocôndria provocado pela depleção de ATP que por sua vez se deve às ROS. Os resultados do estudo de Kavirdel et al. (2009) com sémen de bufalo reforçam a ideia de que as espécies reativas de oxigênio podem afetar negativamente a motilidade dos espermatozoides através das alterações na função mitocondrial.
Os efeitos prejudiciais das ROS também são confirmados no ADN do espermatozoide, pelas consequências graves no desenvolvimento após a fecundação (Kadirvel et al. 2009); existem evidências que atestam o aumento do stresse oxidativo como gerador da fragmentação do ADN do espermatozoide, ao contrário da ativação pelas caspases (reguladores da apoptose) (Thomson et al., 2009, citado por Said et al. 2010). A modificação da fluidez da membrana mitocondrial durante a criopreservação leva a um aumento do seu potencial ocorrendo libertação de ROS que produzem quebras simples e duplas na cadeia de ADN do espermatozoide.
A fragmentação do ADN acentua-se na descongelação atingindo-se uma taxa máxima de fragmentação durante as primeiras 4 horas após a descongelação (Said et al. 2010), que é independente da taxa de congelação aplicada e da utilização de crioprotetores (Isachenko et al.,
37
2004, citado por Said et al., 2010); no entanto, quando se aumenta a quantidade de crioprotetor a taxa de apoptose também aumenta (Wundrich et al., 2006 citado por Said et al., 2010).
Tem-se verificado em espermatozoides humanos que a produção de ROS aumenta durante o arrefecimento a 4ºC (Wang et al., 1997, citado por Said et al., 2010), o que se pode dever ao facto da atividade metabólica a esta temperatura não ser completamente estável ao contrário da congelação a -196ºC, que induz um estado de latência onde as atividades metabólicas são praticamente inexistentes (Kadirvel et al. 2009); além disto, demonstrou-se que o processo de criopreservação diminui a atividade antioxidante nos espermatozoides potenciando os danos induzidos pelas ROS (Lasso et al, 1994, citado por Said et al., 2010).
1.2.1.6 Armazenamento
Geralmente, as amostras de sémen congeladas são armazenadas a temperaturas de -196°C, em azoto líquido, e as reações metabólicas não ocorrem em tempos geologicamente relevantes (Mazur, 1984 citado por Gao e Critser 2000), o que alonga muito no tempo a preservação das amostras.
1.3. Técnicas para melhoramento da congelação de sémen
Ao longo do tempo têm sido estudadas diferentes técnicas que visam melhorar a eficiência da congelação, procurando a identificação de moléculas ou metodologias que sejam menos agressivas para o espermatozoide durante a congelação.
1.3.1. Adição de proteínas conservadas do plasma seminal de ovino
Se for adicionado plasma seminal ao sémen de carneiro na descongelação, a resistência do espermatozoide ao choque pelo frio e aos efeitos nocivos da criopreservação aumenta, assim como melhora a motilidade, a viabilidade, a integridade do acrossoma e a atividade mitocondrial. Este efeito benéfico está associado à presença das proteínas do plasma seminal, em particular as que têm origem nas glândulas vesiculares, como a RSVP 14 e 20 (Seminal Vesicle Protein Precursor). Existem mais proteínas além destas duas. Através do fracionamento das proteínas do plasma seminal de ovino em cromatografia de exclusão, foram encontradas três frações de proteínas capazes de reparar os efeitos do choque pelo frio. No entanto, a fração com melhor resultado na proteção do espermatozoide foi a que contém as proteínas RSVP14 e
38
RSVP20 (Barrios et al. 2000). Estas proteínas ligam-se a toda a superfície do espermatozoide, em especial na região do acrossoma, e participam na estabilização da membrana espermática e no processo de capacitação espermática. As proteínas RSVP 14 e RSVP 20 tem ainda capacidade anti-oxidante, pelo que adicionalmente protegem os espermatozoide contra o stresse oxidativo e a capacitação prematura associada à acumulação de ROS (Bernardini et al. 2011).
Bernardini et al. (2011) desenvolveram um método para identificar as proteínas do plasma seminal de ovino que aderem especificamente à membrana espermática, utilizando proteínas imobilizadas a partir da membrana espermática. Estas proteinas foram designadas de proteinas de interação do plasma seminal e são tão eficazes na proteção da motilidade e ultra estrutura do espermatozoide como todo o conteúdo do plasma seminal. Para provar a ação protetora das proteínas de interação do plasma seminal, no estudo de Bernardini et al. (2011), a adição de uma fração de proteínas de interação do plasma seminal a amostras de sémen ovino congelada na descongelação produziu uma melhoria na motilidade progressiva do espermatozoide e também na reparação das lesões na membrana plasmática e da mitocôndria, que foram equivalentes aos obtidos pela adição de plasma seminal completo.
1.3.2. Tratamento com pressão hidrostática elevada prévio à congelação
Pribenszky et al, citados por Huang et al. 2009, relata que a aplicação de um stresse sub-letal no sémen de suíno fresco, prévio ao processo de congelação, através de pressão hidrostática elevada, aumenta a motilidade (total e progressiva) após a descongelação do sémen. O stresse sub-letal resulta da aplicação de 20 a 40 MPa de pressão durante 90 a 120 minutos. No estudo de Kuo et al. (2007), citado por Huang et al. (2009), foram inseminadas porcas com sémen submetido às condições anteriores, obtendo-se taxas de prenhez de 75% e uma média de leitões nascidos por parto de 11,43; o grupo controlo deste estudo (sémen utilizado nas inseminações não submetido a pressão hidrostática), apresentou 87% de taxas de prenhez mas apenas 7,5 de média de leitões nascidos por parto. Também se verificaram melhorias, mediante a aplicação do tratamento com pressão hidrostática elevada prévio à congelação/vitrificação, na sobrevivência de blastocistos de rato após a descongelação (Pribenszky et al., citado por Huang et al., 2009); embriões de bovino produzidos in vitro (Pribenszky et al., citados por Huang et al., 2009); oócitos suínos (Du, 2008, Pribenszky et al., 2008 citados por Huang et al., 2009) e sémen de touro (Pribenszky et al., citado por Huang et al., 2009).
39
Admite-se que as melhorias produzidas pelo stresse sejam resultado de variações no perfil proteico das células a nível das proteínas (como as proteínas de choque térmico ou HSP) que são ativadas em situação de stresse, como é o caso das chaperonas (Huang et al. 2009). Existem diferentes estudos de tratamentos com stresse celular que suportam esta teoria, nomeadamente: 1) bactérias (Welch 1993 e Wemekamp-Kamphuis 2002, citados por Huang et al., 2009); 2) células HeLa (Wang et al., 2005 citado por Huang et al., 2009); 3) condrócitos (Kaarniranta, 1998 citado por Huang et al., 2009).
No trabalho de Hörmann (2006) citado por Huang et al., (2009), descreveu a resposta ao stresse produzido pela pressão hidrostática elevada em Lactobacillus sanfranciscensis e verificou que são afetadas dezasseis proteínas. Além disso, Kaarniranta, (1998) citado por Huang et al. (2009), mostrou que a indução das proteínas de stresse produzida pela pressão hidrostática elevada, ocorre após transcrição em condrócitos mas sem indução de transcrição De igual forma, acredita-se que o aumento da sobrevivência, após a descongelação, do sémen e de oócitos (tratados previamente à congelação com pressão hidrostática elevada) advenha de efeitos posteriores à transcrição.
Para clarificar o modo como a pressão hidrostática elevada afeta o proteoma do espermatozoide, Huang et al. (2009) utilizando sémen de suíno, verificaram as alterações produzidas antes e depois do congelamento. Analisaram três pressões diferentes: 200bar, 300bar e 400bar, aplicadas durante 90 minutos e os resultados demonstraram melhorias significativas em termos de motilidade após a descongelação nos grupos submetidos a pressão hidrostática; o grupo controlo (não submetido a pressão hidrostática) obteve uma taxa de motilidade após a descongelação de 46%, um valor inferior aos 52%, 56% e 56% dos grupos de 200bar, 300bar e 400bar respetivamente. Através de eletroforese em gel bidimensional quantificaram-se as variações de volume dos níveis proteicos de 125 bandas no gel bidimensional, provenientes de diferentes amostras de sémen: 1) sem tratamento de pressão hidrostática elevada à temperatura ambiente; 2) com tratamento de pressão hidrostática elevada de 300bar a 5°C e após o congelação/descongelação; e 3) do grupo controlo a 5 °C e após a congelação/descongelação. Verificou-se que em 7 das 125 bandas, ocorreram variações significativas nos níveis proteicos, sendo que 3 delas correspondem a proteínas específicas da resposta à pressão hidrostática elevada e as restantes 4 bandas representam as proteínas relacionadas com a congelação e descongelação. Após identificação proteica verificou-se que as 3 proteínas específicas da reação à pressão hidrostática são: a proteína 1 do complexo ubiquinol-citocromo C reductase,
40
Perilipin e o precursor AWN da proteína fixadora do carbohidrato; estas proteínas específicas surgem em maior quantidade nas amostras do grupo submetido a pressão hidrostática recolhidas a 5 °C assim como nas amostras após a descongelação. Os autores concluem que o mecanismo protetor atribuído à pressão hidrostática elevada deve-se a variações nos níveis destas proteínas específicas, no entanto a sua função exata e fisiologia na crio-proteção necessitam de um estudo mais aprofundado (Huang et al. 2009).
1.3.3. Fontes de gema de ovo do diluidor na criopreservação de sémen ovino
O sucesso da criopreservação depende, de uma maneira geral, da utilização do diluidor correto, do crioprotetor e do processo de congelação e descongelação (Fiser 1991, citado por Ali et al. 2013). No que ao crioprotetor diz respeito, a sua função é importante já que confere resistência a variações marcadas e bruscas de temperatura protegendo assim o espermatozoide do choque térmico e impede a formação e dissolução dos cristais de gelo; a gema de ovo é frequentemente utilizada como crioprotetor em diluidores de sémen de mamíferos; acredita-se que as propriedades crioprotetoras da gema de ovo resultem do seu conteúdo em fosfolípidos, colesterol e lipoproteínas de baixa densidade (Ali et al. 2013).
A ação benéfica da gema de ovo varia em função da sua fonte, em particular porque a espécie de origem condiciona a quantidade de colesterol, ácidos gordos e de constituintes em menor expressão como os aminoácidos livres e hidratos de carbono (Ali et al. 2013). Nos trabalhos realizados por Ali et al. (2013) em que foram testados os efeitos de gema de ovo de diferentes espécies (avestruz, perdiz, peru, pato, galinha e tartaruga) na fertilidade do sémen de carneiro, verificou-se que a taxa de clivagem obtida in vitro e a taxa de blastocistos eram superiores para a gema de ovo de perdiz e de pato, comparativamente com as outras espécies, seguidas pela gema de avestruz e pato, sendo os que apresentam piores resultados as gemas de ovo de galinha e tartaruga, contudo, com a passagem do tempo, estes efeitos reduzem-se e mesmo invertem-se, embora seja mais difícil distinguir dos eventuais efeitos associados às condições de produção in vitro de embriões.
Os resultados obtidos sugerem que, a substituição da gema do ovo de galinha pela gema de ovo de perdiz, como crioprotetor no diluidor de sémen de ovino, aumenta a taxa de fecundação in vitro de oócitos e melhora o desenvolvimento inicial dos embriões. As razões apontadas para
41
esta conclusão têm por base a existência de diferenças significativas na quantidade de colesterol e lípidos totais das gemas dos ovos utilizadas, uma vez que, as gemas de ovo da avestruz, pato e peru são as mais ricas em lípidos totais (Sinanoglou et al. 2011 citado por Al et al. 2013) e a gema de ovo de avestruz a mais rica em colesterol em comparação com a gema de ovo de perdiz, pato e galinha (Kazmierska et al., 2005, Krawczyk, 2009, citados por Ali et al. 2013).
Assim, os diluidores de sémen preparados através de gemas de ovo com elevadas quantidades de colesterol aumenta a sobrevivência dos espermatozoides à criopreservação, a taxa de fecundação e o desenvolvimento embrionário. Purdy e Graham (2004), citado por Ali et al. (2013), relata que adicionando colesterol ao sémen antes da congelação aumenta a taxa de sobrevivência à criopreservação e o número de espermatozoides móveis.
42
CAPÍTULO 2
43
A indução de uma situação de stresse prévio à congelação, nomeadamente a associada à aplicação de uma pressão hidrostática positiva sub-letal, tem sido referida como benéfica na congelação do sémen de touro e varrasco, por aumentar a motilidade, a viabilidade (Huang et al. 2009) e os parâmetros gerais de fertilidade do sémen, e também de oócitos de ovino produzidos in vitro (Bogliolo et al. 2011).
Durante o meu estágio tive a oportunidade de acompanhar as experiências coordenadas pelo Professor Alceu Mezzalira, e que incluíam a testagem dos efeitos de um pré-tratamento com pressão negativa na qualidade espermática à descongelação de sémen de carneiro.
A componente prática deste trabalho foi realizado no Laboratório de Reprodução Animal do Centro de Ciências Agroveterinárias, da Universidade do Estado de Santa Catarina (Brasil), entre 1 de fevereiro e 30 de abril de 2013, supervisionados pelo Professor Alceu Mezzalira (como já referido) e faziam parte de um protocolo de pesquisa colaborativa com a Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina (EPAGRI), na cidade de Lages, estado de Santa Catarina no Brasil.
Objetivos
Para além dos objetivos gerais subjacentes ao estágio em ambiente de trabalho do Mestrado Integrado em Medicina Veterinária, este trabalho pretendeu ainda avaliar o efeito de um stresse controlado, induzido por pressão negativa antes do congelamento, sobre amostras de sémen de ovino, com recurso a um equipamento de baixo custo e de fácil manipulação. Utilizando 3 níveis de pressão distintos comparou-se o efeito do tratamento de pressão negativa em vários parâmetros de qualidade seminal após a descongelação, como sejam a motilidade, a integridade do acrossoma ou da membrana citoplasmática e a taxa de fertilização in vitro.
2.1 Materiais e Métodos
2.1.1 Desenho experimental
Para testar os efeitos do tratamento com pressão negativa, recolheu-se em cada sessão o ejaculado de dois carneiros de fertilidade comprovada. Estes ejaculados foram utilizados para constituir um pool de sémen fresco a partir do qual se realizou a experiência, e que foi dividido
44
em quatro amostras distintas. Uma das amostras constituiu o grupo controlo (GrC) e não foi submetido a qualquer tratamento pré-congelação. As outras 3 amostras foram submetidas a um tratamento de pressão negativa antes da congelação; as pressões instauradas foram distintas (-200 mBar, -500 mBar e -800 mBar) e constituíram os 3 grupos que se identificam em seguida: Gr-200, Gr-500 e Gr-800, respetivamente. Depois deste passo, as amostras foram submetidas a um protocolo de rotina para congelação de sémen ovino sendo as condições iguais para os quatros grupos. As amostras foram mantidas congeladas por 4 a 7 dias, após o que foram descongeladas e a fertilidade potencial do sémen testada. Foram analisados os seguintes parâmetros:
1. Motilidade progressiva avaliada por microscopia ótica (foi avaliada a diferentes tempos pós-descongelação: momento da descongelação (tempo 0) e novamente às 1, 2, 3 horas, respetivamente tempos 1, 2 e 3), e ainda após seleção em gradiente de Percoll®; 2. Integridade do acrossoma, através de microscopia de fluorescência, com recurso à
coloração de aglutinina (PA) conjugada com isoticianato de fluoresceína (FITC); foi realizado à descongelação e após seleção em gradiente de Percoll®;
3. Integridade da membrana, através do teste hiposmótico, realizado à descongelação e após seleção em gradiente de Percoll®;
4. Taxa de fertilização in vitro, avaliada às 48h após FIV heteróloga com oócitos bovinos;
Este procedimento foi replicado por cinco vezes ao longo de cinco semanas, sendo os machos dadores de sémen sempre os mesmos.
2.1.2 Animais e recolha de sémen
Neste estudo foram utilizados como dadores de sémen dois carneiros adultos da raça Frisia Milchschaf e Lacaune, ambos com vinte e um meses de idade. Os animais encontravam-se estabulados na Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina, na cidade de Lages, estado de Santa Catarina no Brasil. (Latitude: 27º 48' 58" S; Longitude: 50º 19' 34" O).