Universidade de Trás-os-Montes e Alto Douro
Desenvolvimento de uma câmara anestésica com
monitorização integrada da frequência respiratória
Dissertação de Mestrado Integrado em Medicina Veterinária
Ana Margarida Batista Pereira
Prof. Doutor Luís Miguel Joaquim Marques Antunes Prof. Doutor Joaquim Gabriel Magalhães Mendes
Universidade de Trás-os-Montes e Alto Douro
Desenvolvimento de uma câmara anestésica com
monitorização integrada da frequência respiratória
Dissertação de Mestrado Integrado em Medicina Veterinária
Ana Margarida Batista Pereira Prof. Doutor Luís Miguel Joaquim Marques Antunes Prof. Doutor Joaquim Gabriel Magalhães Mendes
Composição do Júri:
_____________________________________________________________ _____________________________________________________________ _____________________________________________________________
iii
Resumo
Os anestésicos conduzem a alterações na ventilação em função da concentração de anestésico administrada. Existem técnicas e equipamentos que permitem monitorizar os efeitos da anestesia. Não obstante, o desenvolvimento de novos dispositivos de monitorização anestésica é uma necessidade. Nesse contexto, os sensores piezoelétricos têm vindo a desempenhar um importante papel dada a sua capacidade de gerar um potencial elétrico quando sobre eles é aplicada uma força mecânica. Devido à sua elevada sensibilidade podem ser utilizados para a medição de parâmetros fisiológicos como a frequência respiratória e cardíaca.
O objetivo deste trabalho foi o desenvolvimento de um dispositivo piloto para monitorização da frequência respiratória. Este consiste numa câmara anestésica equipada com um sensor piezoelétrico, colocado num dos apoios da mesma, destinado à deteção da vibração produzida pelos movimentos respiratórios de um murganho anestesiado no seu interior. A par da aquisição do sinal elétrico gerado pelo sensor piezoelétrico, foi também capturado, simultaneamente, um vídeo dos animais anestesiados.
Para validação da câmara anestésica como dispositivo de monitorização anestésica, foram realizados dois estudos independentes. No primeiro, os animais foram anestesiados com concentração semelhante de isoflurano (1.5%). No segundo foram utilizadas três concentrações diferentes de isoflurano (1%, 1.5%, 2%). Em ambos os estudos, a frequência respiratória obtida pelo sensor piezoelétrico foi comparada com a obtida por análise de vídeo.
Os resultados obtidos revelaram haver relação entre as medições efetuadas entre ambos os métodos, quando utilizados em anestesias mais profundas. Em anestesias mais superficiais revelaram, no entanto, falta de correlação que se pode dever a subestimação por parte do vídeo ou sobrestimação por parte do sensor piezoelétrico. Não obstante, ambos os métodos detetaram a mesma depressão respiratória em função da concentração de anestésico usada.
Palavras-chave: câmara anestésica, isoflurano, anestesia, monitorização, frequência
v
Abstract
Depending on the dose, anesthetics may lead to respiratory depression. There are currently several equipment and techniques available to monitor the effects of anesthesia in the respiratory system. Nevertheless, the development of new devices for anesthesia monitoring is a permanent need for research. In this context, the piezoelectric sensors have been playing an important role. Piezoelectric materials generate electrical charge when a mechanically strain is applied. Due to their high sensitivity they can be used for measuring physiological parameters such as respiratory and heart rate.
The aim of this study was to develop a device for monitoring respiratory rate based on piezoelectric sensors. The device consists on an anesthetic chamber equipped with a piezoelectric sensor placed on one of its the footholds. The sensor detects the vibration produced by the respiratory movements of an anesthetized mouse placed inside the anesthetic chamber.
In addition to the acquisition of the electrical signal generated by the piezoelectric sensor, a video image of the anesthetized mouse was simultaneously, recorded. Concerning the validation of the anesthetic chamber as an anesthetic monitoring device, two independent studies were performed. In the first the animals were anesthetized with the same isoflurane concentration (1.5%). As for the second study, three different concentrations of isoflurane (1%, 1.5%, 2%) were administered. In both studies the respiratory rate obtained from the piezoelectric sensor was compared with the obtained by the video analysis.
The results revealed a relationship between the measurements performed by the two methods when moderate to deep anesthesia is present. In more superficial anesthesia there is a discrepancy between the piezoelectric and video measurements. This lack of agreement can be due to an error associated with video or piezoelectric sensor methods. However, both methods presented a similar respiratory depression reading related with the isoflurane concentration administered.
Key-words: anesthetic chamber, isoflurane, anesthesia, respiratory rate, monitoring,
vii
Agradecimentos
Aos meus orientador, Professor Doutor Luís Antunes e coorientador, Professor Doutor Joaquim Gabriel por todo o apoio científico, mas principalmente pela oportunidade e meios proporcionados para realização deste trabalho.
À doutora Ana Maria Valentim pela disponibilidade e ajuda na escrita e realização dos testes em animais.
À equipa do Lab. 003, do Departamento de Engenharia Mecânica da FEUP por todo o conhecimento e boa disposição.
Ao projeto "IntelLab II - Inteligência em Laboratórios”, FCOMP-01-0202-FEDER-033877 - Fundo Europeu de Desenvolvimento Regional (FEDER) através do COMPETE - Programa Operacional Fatores de Competitividade (POFC), no qual o este trabalho se encontra inserido.
Aos professores que me ensinaram com paixão, foram eles peça fundamental na motivação para a aprendizagem.
Aos meus colegas de curso por toda a interajuda, ‘copos’, e boas memórias académicas.
Às minhas queridas amigas de ‘Trájosmontes’ pela equipa que formámos, amizade, incentivo e diversão.
À minha grande família pelos valores e incutidos e apoio incondicional. Ao meu Niki por ter ficado comigo para assistir à conclusão de mais uma etapa da minha vida.
Aos meus amigos de sempre, com quem passei algumas das horas mais memoráveis da minha vida.
Aos meus incansáveis pais por todo o empenho em tornar os meus sonhos em realidade. Obrigada Mãe. Obrigada Pai.
ix
Índice
Índice de Figuras ... xi
Índice de tabelas ... xiii
Abreviaturas ... xv
Descrição do estágio curricular ... 1
Introdução ... 3
Capítulo 1 - Enquadramento teórico ... 5
1.1 Anestesia ... 5
1.1.1 Anestesia geral ... 6
1.1.1.1 Anestesia injetável ... 8
1.1.1.2 Anestesia inalatória ... 9
1.1.1.2.1 Anestesia inalatória em murganhos ... 10
1.2 Monitorização anestésica ... 11
1.2.1 Monitorização da função respiratória ... 13
1.2.1.1 Métodos invasivos ... 14
1.2.1.2 Métodos não invasivos ... 15
1.2.1.3 Novas soluções de monitorização da frequência respiratória ... 17
Capítulo 2 - Materiais e Métodos ... 19
2.1 Animais ... 19
2.2 Anestesia ... 20
2.3 Equipamento ... 22
2.3.1 Construção da câmara anestésica ... 22
2.3.2.1 Escolha, colocação e conexão dos sensores ... 23
2.3.2.2. Programação dos sensores ... 26
2.3.2.1.1 Desenvolvimento do software de aquisição do sinal ... 27
2.3.2.1.2 Desenvolvimento de software de processamento dos dados ... 28
2.3.4 Aquecimento da câmara anestésica ... 31
2.3.5 Montagem do setup completo... 32
2.4 Mensuração da frequência respiratória ... 34
2.5 Análise estatística ... 35
Capítulo3 – Resultados ... 37
x 3.2 Resultado do estudo 2 ... 40 Capítulo 4 – Discussão ... 47 Referências ... 53 Anexos ... 61 Sumário de publicações ... 63
xi
Índice de Figuras
Figura 1 – Protocolo anestésico de validação esquematizado ... 21 Figura 2 - Imagem obtida em SolidWorks® do projeto da câmara anestésica. Imagem
real. ... 22
Figura 3 - Sensores piezoelétricos utilizados e respetivas medidas. ... 23 Figura 4 – Imagem conseguida em SolidWorks® referente ao posicionamento e
dimensão dos sensores piezoelétricos. Imagem real. ... 24
Figura 5 – Imagem obtida em SolidWorks® com o pormenor da colocação e dimensão
dos sensores. Imagem real. ... 25
Figura 6 - Sensor piezoelétrico (Kingstate KRS -100) e imagem real da sua colocação
no apoio da câmara anestésica. ... 25
Figura 7 - Dispositivo de aquisição de dado DAQ NI USB-6251, conectado a um
sensor piezoelétrico. ... 26
Figura 8 – Instrumento visual (VI) para aquisição de dados. ... 28 Figura 9 – Representação gráfica do sinal elétrico obtido com e sem aplicação de filtro.
... 29
Figura 10 –Instrumento visual para análise dos dados. ... 30
Figura 11 – Medição da frequência respiratória a partir do sinal de vídeo - representação gráfica da variação da área preta (silhueta torácica do animal)
relativamente à área branca (fundo) em cinco segundos. ... 31
Figura 12 - Imagem obtida em SolidWorks® da versão final da câmara anestésica.
Imagem real. ... 32
Figura 13 – Sensor e controlador de temperatura utilizados no istema de aquecimento.
... 32
xii Figura 15 - Filtro absorvente para anestésico nos gases exalados. ... 33 Figura 16 – Monitor de anestesia (Capnomac ultima) para medição da concentração de
anestésico no interior da câmara. ... 34
Figura 17 – Setup completo: computador, dispositivo de aquisição de dados, DAQ,
webcam, controlador de temperatura, monitor de anestesia câmara anestésica
(vaporizador e extrator não incluídos na imagem) ... 34
Figura 18 – Representação dos sinais elétricos pré-processamento, registados pelos três
sensores piezoelétrico com os momentos da anestesia assinalados (estudo1). ... 38
Figura 19 – Representação gráfica dos sinais sobrepostos obtidos por análises de vídeo
(preto) e do sensor piezoelétrico (vermelho) num intervalo de cinco segundos (estudo 1).. ... 38
Figura 20 – Linha de regressão resultante dos valores de respiração por minuto (RPM)
dos sinais elétrico e de vídeo.(estudo 1)... 39
Figura 21 – Representação gráfica da respiração por minuto (RPM) de quinze segundos
do sinal de elétrico captado pelo sensor piezoelétrico após processamento (imagens da esquerda) e do sinal de vídeo (imagens da direita) para diferentes concentrações de isoflurano: 1%; 1.5%; 2% (estudo 2). ... 41
Figura 22 – Linhas de regressão dos valores da respiração por minuto (RPM) dos sinais
elétrico e de vídeo e, para as concentrações: 1%; 1.5%; 2% (estudo 2). ... 44
Figura 23 – Diagrama de caixas da frequência respiratória por minuto (RPM) dos
murganhos anestesiados com diferentes concentrações de isoflurano obtida pelos dois métodos: sensor piezoelétrico e análise de vídeo (estudo 2). ... 45
xiii
Índice de tabelas
Tabela 1 – Estádios de anestesia ... 7 Tabela 2 – Vantagens e desvantagens da anestesia injetável ... 8 Tabela 3 – Parâmetros anestésicos a monitorizar em roedores de laboratório ... 12 Tabela 4 – Peso e ordem dos tratamentos administrados aos dez animais que
participaram nos testes (estudo 2) ... 21
Tabela 5 – Movimentos respiratórios por minuto (RPM) (estudo 1) ... 39 Tabela 6 – Estatística descritivas das medições de frequência respiratória por minuto
(RPM); Q1: quartil 25%; Q3: quartil 75%; I-I: intervalo interquartil (estudo 2) ... 42
Tabela 7 – Correlação de Spearman realizada entre os métodos sensor piezoelétrico e
vídeo, para cada concentração administrada (estudo 2). ... 42
Tabela 8 – Valor de p resultante do teste Friedman para as concentrações administradas
xv
Abreviaturas
% Percentagem bpm Beats por minuto
CAM Concentração alveolar mínima
CAMLoor Concentração alveolar mínima – Loss of righting reflex CO₂ Dióxido de carbono
DAQ Dispositivo de aquisição de dados ECG Eletrocardiografia
EEG Eletroencefalograma ED50 Dose média efetiva
EtCO₂ Valor numérico de dióxido de carbono no volume corrente FC Frequência cardíaca
g Grama
HCO₃ Bicarbonato Hz Hertz
I-I Intervalo interquartil IM Intramuscular IO Intraóssea IP Intraperitoneal IV Intravenosa kΩ Quiloohm L Litro
L/min Litros por minuto mm Milímetro
mmHg Milímetros de mercúrio O₂ Oxigénio
ºC Graus centígrados PAlv Pressão parcial alveolar Pa Pressão parcial arterial
PaCO₂ Pressão parcial de dióxido de carbono PaO₂ Pressão parcial de oxigénio
Psnc Pressão parcial no sistema nervoso central PVDF Fluoreto de polivilideno
Pi Pressão inspirada Q1 Quartil 1 - 25% Q3 Quartil 3 - 75% ROI Region of interest RPM Respirações por minuto SC Subcutânea
SNC Sistema nervoso central
SpO₂ Saturação de oxigénio no sangue VI Instrumento visual
1
Descrição do estágio curricular
A presente dissertação surge como produto do estágio de dez meses realizado no decurso do sexto ano do Mestrado Integrado em Medicina Veterinária. O mesmo foi composto por três partes, duas delas dedicadas à clínica de pequenos animais e uma referente à investigação, na qual foi realizada a componente experimental da presente dissertação.
Desde Agosto de 2013, por um período de quatro meses integrei a equipa de estagiários do Hospital Veterinário Montenegro (HVM). O HVM é um hospital de referência no Porto, em clínica de pequenos animais, recebendo frequentemente doentes referenciados de outras clínicas e hospitais para consultas e procedimentos em especialidades como oftalmologia, cardiologia, cirurgia e imagiologia (nomeadamente tomografia computorizada). Consultas e cirurgia de animais exóticos têm também lugar no HVM, levadas a cabo por médicos externos, com marcação prévia. Enquanto estagiária, trabalhei em turnos diários de 8h, urgências noturnas e urgências ao fim de semana e feriados, durante os quais permaneci no hospital 12h e 24h respectivamente. Sumariamente apresento as actividades práticas desenvolvidas, durante este período:
Cirurgia: preparação pré-cirúrgica do doente, assistência ao cirurgião e cuidados pós-cirúrgicos; monitorização anestésica e pós-anestésica.
Consultas: observação e assistência ao médico veterinário em consultas de rotina, especialidade, urgência e animais exóticos.
Internamento: monitorização dos doentes, administração de medicações Exames complementares de diagnóstico (ecografias, ecocardiografias e
eletrocardiografia): observação e assistência ao médico veterinário. Laboratório: realização de análises sanguíneas (hemograma, bioquímicas,
esfregaços), urianálise e observação microscópica de exames dermatológicos e parasitológicos.
Entre Dezembro de 2013 e Março de 2014, fiz investigação no âmbito da componente experimental da minha dissertação na área de desenvolvimento de dispositivos de monitorização anestésica para murganhos de laboratório. Durante este período de três meses, estive no laboratório L003 do departamento de engenharia mecânica da Faculdade de Engenharia do Porto (FEUP) e fiz visitas ocasionais ao Instituto de Biologia Molecular e Celular (IBMC). No primeiro, conjuntamente com
2
outros investigadores tive oportunidade de expandir os meus conhecimentos para além da medicina veterinária propriamente dita, no sentido de desenvolver o dispositivo que será descrito nesta dissertação. Tomei contacto com software de programação como é o caso do LabVIEW®, montagem de circuitos e colagem de materiais. As visitas ao IBMC foram realizadas essencialmente no contexto dos testes realizados em murganhos para desenvolvimento do dispositivo de monitorização anestésica. No entanto, estas tiveram também uma componente pedagógica no sentido em que, assisti à apresentação e discussão de alguns projetos de investigação propostos ou em decurso. A aprendizagem de condutas de higiene, maneio e metodologia de práticas de investigação com murganhos em geral foi outra das componentes deste estágio.
De Março de 2014, por um período de três meses, realizei um estágio ao abrigo do programa ERASMUS na Polónia (Varsóvia) no hospital veterinário Małych Zwierzą, situado campus da Warsaw University of Life Sciences (WULS – SGGW), como parte integrante dos recursos da faculdade de medicina veterinária de Varsóvia. O hospital iniciou atividade em 2002 e desde essa altura, presta cuidados a várias espécies. No que diz respeito à clínica de pequenos animais, conta com profissionais que dão resposta às mais variadas especialidades como imagiologia, oftalmologia, cardiologia, oncologia, neurologia, reprodução, cirurgia entre outras. Durante os três meses de estágio, desenvolvi as minhas atividades essencialmente na área de anestesiologia, cirurgia e medicina interna. As dificuldades de comunicação sentidas inicialmente foram facilmente ultrapassadas graças à simpatia dos alunos polacos prontamente dispostos a traduzir a história e anamnese dos doentes na consulta, e aos médicos fluentes em inglês, habituados a lecionar as turmas de estudantes de língua inglesa. As minhas atividades no hospital eram realizadas durante a semana desde as 8h às 2h da tarde, nesse período acompanhei preferencialmente as cirurgias (preparação pré-cirúrgica, assistente do cirurgião e monitorização anestésica). Na ausência de atividades no bloco operatório, o meu tempo era dividido entre as consultas de medicina interna e as rotações de especialidade das turmas lecionadas em inglês, dos alunos do quinto ano.
3
Introdução
O presente trabalho pretende oferecer uma contribuição para os estudos realizados no âmbito do desenvolvimento de dispositivos de monitorização anestésica. Técnicas e equipamentos comummente utilizados em anestesiologia humana são, frequentemente, adaptados para uso em anestesiologia veterinária. Contudo a medicina veterinária ocupa-se de uma variedade de espécies que se distinguem pelas suas: dimensões, comportamento, e variabilidade de parâmetros fisiológicos. Estas características tornam o desenvolvimento de dispositivos de monitorização anestésica numa necessidade e vasto campo de investigação com diversas oportunidades para o refinamento dos procedimentos. Assim procura-se automatizar processos com soluções mais económicas, prática e menos invasivas.
O objetivo principal deste trabalho consistiu no desenvolvimento de um meio de monitorização da frequência respiratória que possuísse as seguintes características: não invasivo, não implicasse a contenção e a aplicação de sensores diretamente no animal, que permitisse o registo para posterior análise das medições efetuadas, e possibilitasse ainda, a sua aplicação em espécies de maior porte. Assim, foi testada a hipótese de medir a frequência respiratória através da vibração provocada pelos movimentos respiratórios, com recurso a sensores piezoelétricos incorporados numa câmara anestésica dimensionada para murganhos. A validação da frequência respiratória obtida com recurso à caixa sensorizada foi conseguida através de técnicas de análise de imagem de vídeos referentes aos animais estudados durante os testes. Os testes em animais consistiram na realização de protocolos anestésicos com diferentes concentrações de isoflurano e consequente cálculo da frequência respiratória.
O desenvolvimento da câmara anestésica sensorizada e software de aquisição e análise de dados, foi realizado em cooperação com Instituto de Biologia Molecular e Celular (IBMC) e a Faculdade de Engenharia do Porto (FEUP). No primeiro tiveram lugar os testes realizados em animais, no segundo foi realizado o desenvolvimento do dispositivo propriamente dito.
No primeiro capítulo é feito um enquadramento teórico, em que serão abordados aspetos relativos ao conceito de anestesia, monitorização anestésica, com maior ênfase na monitorização da frequência respiratória; conceito e aplicação de sensores piezoelétricos no contexto da monitorização em roedores de laboratório. Seguidamente
4
serão apresentados os materiais e métodos, com descrição detalhada do desenvolvimento da câmara anestésica e dos testes realizados em animais. A apresentação dos resultados dos testes realizados é seguida de uma breve discussão.
Quer a descrição dos materiais e métodos, quer a apresentação de resultados estão divididos em dois estudos, os quais foram realizados separadamente utilizando, no entanto, a câmara anestésica.
No estudo 1 colocou-se a hipótese da existência de correlação entre as medições de frequência respiratória dadas pelo sensor piezoelétrico e pelo vídeo através da técnica de análise de imagem.
No estudo 2, avaliou-se a influência da profundidade anestésica na relação entre as medições.
5
Capítulo 1 - Enquadramento teórico
1.1 Anestesia
A anestesia é definida atualmente como um processo reversível de depressão do Sistema Nervoso Central (SNC), conseguido mediante a administração de fármacos.
O termo anestesia foi proposto por Oliver Wendel Holmes em 1846, baseado na sua origem grega, cujo significado literal é: na - ausência e aisthēsis – sensação. Em 16 de Outubro de 1846, Morton demonstrou publicamente que era possível provocar anestesia utilizando éter, sendo por isso considerado o pai da anestesia (Steffey, 2013). Um ano depois, o éter havia já sido administrado a vários animais domésticos e, a revista de The
Veterinarian publicou um artigo descrevendo a sua utilização em seis cães e dois gatos
(ACVA, 2002). A par desse acontecimento, a anestesia foi adotada pelo Royal
Veterinary College (Steffey, 2013). Mais tarde em 1915, Hobday publicou o primeiro
livro escrito em inglês dedicado à anestesia veterinária sob o título de Anaesthesia and
narcosis of animals and birds (Hobday, 1915).
A anestesia veterinária pretende satisfazer dois amplos pré-requisitos: o maneio de animais por parte dos humanos e a restrição de sofrimento desnecessário. O primeiro objetivo permite uma eficiente proteção contra agressões ou acidentes, decorrentes da prática clínica em animais ineficazmente contidos, e o segundo permite a correta realização de procedimentos médico-cirúrgicos bem como o controlo da dor (Hall, 2001).
Consoante o tipo de procedimento pode optar-se pela realização de uma anestesia geral ou local.
A anestesia local resulta de um bloqueio temporário dos nervos sensoriais, por vezes acompanhado por um bloqueio concorrente dos nervos motores, na qual o animal permanece consciente. A interrupção da transmissão neural nos nervos sensoriais ou tratos nervosos pode ser feito por infiltração local, bloqueio nervoso regional, injeção epidural ou no espaço subaracnóide com redução da dor ou nocicepção (Skarda, 2007). A anestesia geral implica por sua vez, a perda de consciência.
6
1.1.1 Anestesia geral
A anestesia geral pode ser definida como um estado de inconsciência produzido por um processo controlado e reversível de intoxicação do SNC em que, o doente não sente ou responde a estímulos nocivos ou de outro tipo (Jones, 1999).
Em função da concentração em que são administrados, os anestésicos têm diferentes efeitos. Em baixas concentrações podem causar amnésia, analgesia, hipnose, e hiperreflexia (Wood, 2003). Em concentrações superiores satisfazem, geralmente, os critérios da tríade: inconsciência, analgesia e relaxamento muscular. A inconsciência resulta na ausência de perceção ou memória (amnésia) de quaisquer eventos de caris sensorial e motor. O relaxamento muscular é conseguido pela supressão dos reflexos somáticos (reflexos propriocetivos como por exemplo, o reflexo postural). No entanto, a par da supressão destes dá-se também a dos reflexos autonómicos (como fenómenos hemodinâmicos, respiratórios e termorreguladores) a qual é, frequentemente, alvo de vigilância apertada por parte do anestesiologista (Dugdale, 2010). A analgesia que se refere à diminuição ou ausência da perceção de dor. Apesar da presença de dor ter vantagens claras de sobrevivência na limitação da extensão das lesões, acarreta, também graves consequências como: stress, aumento do catabolismo com cicatrização retardada, anorexia, entre outras (Pearson, 1999).
Em anestesia podem considerar-se cinco importantes passos:
avaliação pré-anestésica que pressupõe a procura de condições patológicas, estabilização e administração de analgesia, se houver necessidade;
pré-medicação em que são administrados fármacos ansiolíticos ou sedativos e início da analgesia (caso não tenha sido previamente iniciada no passo anteriormente descrito);
indução da anestesia, que consiste na transição de um estado em que o animal está consciente para a inconsciência ou estado de anestesia propriamente dita;
manutenção da anestesia;
recuperação, fase em que o animal acorda, cuidados pós-anestésicos e analgesia devem ser providenciados (Hall, 2001).
A anestesia pode ser conseguida com a administração de um só fármaco, no entanto como raramente um anestésico tem igual ação sobre todos os critérios da tríade da
7 anestesia geral, o resultado é uma profunda depressão do SNC e reflexos homeostáticos (Seymour, 2007). Em alternativa, pode utilizar-se uma anestesia balanceada que consiste no uso de diferentes fármacos com propriedades distintas, administrados em concentrações menores, diminuindo assim o risco anestésico (Tonner, 2005).
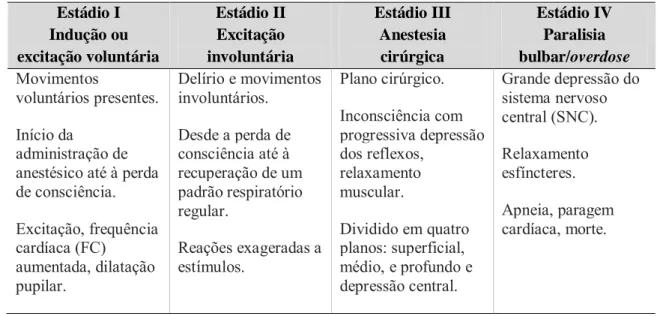
É possível distinguir, quatro estádios de anestesia, em função dos sinais neuromusculares exibidos, os quais se encontram sumariados na Tabela 1.
Tabela 1 – Estádios de anestesia em função de diversas variáveis clínicas. Estádio I Indução ou excitação voluntária Estádio II Excitação involuntária Estádio III Anestesia cirúrgica Estádio IV Paralisia bulbar/overdose Movimentos voluntários presentes. Início da administração de anestésico até à perda de consciência. Excitação, frequência cardíaca (FC) aumentada, dilatação pupilar. Delírio e movimentos involuntários. Desde a perda de consciência até à recuperação de um padrão respiratório regular. Reações exageradas a estímulos. Plano cirúrgico. Inconsciência com progressiva depressão dos reflexos, relaxamento muscular. Dividido em quatro planos: superficial, médio, e profundo e depressão central. Grande depressão do sistema nervoso central (SNC). Relaxamento esfíncteres. Apneia, paragem cardíaca, morte. Adaptado de Muir, 2007.
Não obstante, da distinção dos estádios de anestesia anteriormente apresentada, a distinção entre os mesmos pode nem sempre ser clara. A resposta individual do animal, presença de doença concomitante bem como, administração prévia de medicação ou tipo de anestésicos fornecidos, são fatores que contribuem para impor variabilidade nesta classificação (Muir, 2007).
Relativamente à administração dos anestésicos gerais, esta pode ser feita por inalação ou injeção. A administração combinada de anestésicos injetáveis e inalatórios é frequentemente utilizada.
8
1.1.1.1 Anestesia injetável
Os anestésicos injetáveis são administrados pela via subcutânea (SC), intravenosa (IV), intramuscular (IM), intraperitoneal (IP) ou intraóssea (IO). A escolha da via está frequentemente relacionada com as características da substância ativa e dos seus adjuvantes. Em roedores de laboratório, a via IP é a mais comummente utilizada, por permitir a administração de maiores volumes. A administração é feita, geralmente no quadrante abdominal inferior esquerdo. No entanto erros como administração intravisceral, subcutânea e no tecido adiposo podem ocorrer (Flecknell, 2007).
A segurança na administração dos anestésicos injetáveis depende do cumprimento das normas relativamente às doses recomendadas em função do peso e quadro clínico. As doses devem no entanto, ser seguidas com sentido crítico quando se está perante um animal jovem, idoso ou doente, evitando assim overdose (Seymour, 2007).
Os fármacos injetáveis podem ser utilizados na indução ou manutenção (bolus intermitentes ou infusão contínua). A recuperação da anestesia injetável depende do perfil cinético do fármaco administrado e da forma como este interage com o organismo. A tabela 2 resume as vantagens e desvantagens da anestesia injetável.
Tabela 2 - Vantagens e desvantagens da anestesia injetável.
Vantagens Desvantagens
Requer pouco equipamento (seringas, agulhas, cateteres intravenosos...).
Após administração, não é possível retirar o fármaco do organismo.
Fácil administração. Quando usado apenas um único agente anestésico produz geralmente profunda depressão cardiovascular e respiratória.
Não apresenta risco para os trabalhadores, uma vez que não polui o ambiente.
Mal tolerada em animais com hipovolemia e hipotoxemia. Se existir doença renal ou hepática concorrente as doses devem ser reduzidas. Conhecida com precisão a dose
administrada.
9
1.1.1.2 Anestesia inalatória
A anestesia inalatória consiste na administração por via respiratória de uma mistura de gases ricos em oxigénio (O₂), que veicula os vapores de agentes anestésicos voláteis. A sua popularidade surge, em parte, devido às suas características farmacocinéticas que possibilitam um ajuste previsível das concentrações necessárias para obtenção rápida da profundidade anestésica desejada. As desvantagens da anestesia inalatória relacionam-se com os elevados custos bem como de necessidade de sistema de exaustão (Hellebrekers, 2001).
A administração dos agentes anestésicos inalatórios pode ser feita com recurso a máscaras faciais, entubação endotraqueal ou câmaras anestésicas (Faunt, 2008). Cada anestésico tem uma gama única de pressões de vapor, as quais estão dependentes da temperatura, sendo por esse motivo necessário a utilização de um vaporizador específico e calibrado para administração dos mesmos (Hall, 2001).
O índice de potência anestésica para anestésicos inalatórios é dado pela concentração alveolar mínima (CAM). O conceito foi introduzido em 1963 por Merkel e Edger (Eger, 1965) e é usado como medida standard para comparação de potência entre diferentes anestésicos (Quasha, 1980). O CAM é definido como a concentração mínima alveolar de um anestésico à pressão de 1 atmosfera capaz de produzir imobilidade em 50% dos indivíduos expostos a um estímulo doloroso. Assim, de acordo com a definição anterior, o CAM é a dose média efetiva (ED₅₀) (Sonner, 2007).
Durante a anestesia geral a pressão inspirada (Pi) de anestésico chega aos alvéolos e difunde-se através do epitélio alveolar para os capilares que suprimem os mesmos. Através da ventilação dá-se a difusão do anestésico para os alvéolos no entanto, esta é acompanhada de absorção para a corrente sanguínea. Assim, o tempo necessário para que exista um equilíbrio entre Pi e PAlv (pressão parcial alveolar) é superior. A equação em que, PAlv é a pressão parcial alveolar, Pa é a pressão parcial arterial no e Psnc é a pressão parcial no SNC (Stoelting, 2006), traduz a segunda parte do equilíbrio anestésico. O aumento da PAlv é rapidamente acompanhado por aumento da Pa e da Psnc, devido à elevada vascularização pulmonar e do SNC, respetivamente. A Pi é de longe o fator mais importante na determinação na velocidade em que (Harper, 2004).
10
A perda de anestésico por absorção pelos componentes do circuito ao longo do sistema de administração (vaporizador) é também um fator que condiciona a velocidade de indução e eliminação (Preckel, 2005).
A recuperação da anestesia é representada pela taxa de diminuição do Psnc que se reflete na Pa (Yasuda, 1991). Quando se cessa a administração de anestésico, a eliminação do mesmo, ocorre através da ventilação pulmonar. Como a Pa diminui, o anestésico passa novamente dos tecidos para os alvéolos (McKay, 2011), sendo eliminado através da ventilação.
A vantagem do uso da anestesia inalatória relativamente à anestesia injetável relaciona-se com por um lado, com a metabolização mínima que os agentes inalatórios sofrem no organismo por outro, com o menor risco de morte em caso de sobredosagem (Jones, 1999). Em caso de overdose, o animal deve ser imediatamente ventilado com oxigénio, aumentando assim a eliminação do anestésico (Harvey, 1999).
1.1.1.2.1 Anestesia inalatória em murganhos
Os anestésicos injetáveis e inalatórios são comumente utilizados em roedores (Tremoleda, 2012). A principal vantagem decorrente do uso de agentes inalatórios em investigação, é a possibilidade de medir a concentração anestésica fornecida, continuamente, assegurando assim, que todos os animais alcançam profundidades anestésicas semelhantes. Vários animais podem assim ser estudados sob as mesmas condições de anestesia. Relativamente à anestesia injetável, salienta-se ainda, a vantagem de estar associado a menor erros na administração.
Por razões de custo e simplicidade, a indução anestésica é frequentemente feita com recurso a campânulas de vidro ou câmaras anestésicas (Wixson, 1997). No primeiro caso, gaze ou algodão embebido em anestésico na forma líquida (por exemplo éter ou metoxiflurano) é colocado no fundo da campânula (o contato do mesmo com o animal deve ser evitado). A volatilização do líquido presente no algodão em ambiente fechado, induz a anestesia do animal que, é confirmada pela perda do reflexo postural (Otto, 2012). A desvantagem do uso de campânulas de vidro consiste na falta de controlo da quantidade de anestésico fornecido. Não sendo uma boa prática este procedimento está em desuso. No segundo caso e, quando se tratam de anestésicos com elevadas pressões,
11
a câmara anestésica deve ser conectada a um sistema de vaporização convenientemente calibrado, com uma pressão inspirada conhecida (Vogler, 1997). O oxigénio é o gás mais vulgarmente utilizado como meio de transporte dos agentes anestésicos inalatórios. Este é fornecido pressurizado e armazenado em cilindros que, estão equipados com regulador de pressão e medidor de fluxo fornecendo caudais adequados (na ordem de 0,5 a 5 L/min) através de um vaporizador integrado. A capacidade pulmonar do animal e, em menor escala, a eficiência do circuito de anestesia usado irá determinar a taxa de fluxo de gás necessário (Tremoleda, 2012). A câmara de indução deve possuir dois orifícios, um para entrada da mistura de gases, e outro para exaustão dos mesmos (Otto, 2012). Após a indução da anestesia, o murganho pode ser retirado da câmara anestésica para ser sujeito a procedimentos muito curtos (<30 seg); se for desejada uma anestesia mais longa, a manutenção pode ser feita com recurso a uma máscara ou ainda, com recurso a entubação orotraqueal (utilizando um cateter IV) para períodos de manutenção mais longos (Otto, 2012).
1.2 Monitorização anestésica
A monitorização da anestesia tem como função a coleta de dados que refletem as condições fisiológicas do doente. Permite ao responsável pela anestesia reagir perante qualquer reação adversa durante o procedimento antes que, esta resulte num dano irreversível. A vigilância ‘manual’ é reforçada pelo uso de equipamento de monitorização que fornece dados objetivos e complementares às observações, por vezes subjetivas do anestesista (Silva, 2011).
A monitorização anestésica pode ser classificada em função do momento em que tem lugar. Assim podemos ter a monitorização pré-anestésica, anestésica e pós-anestésica.
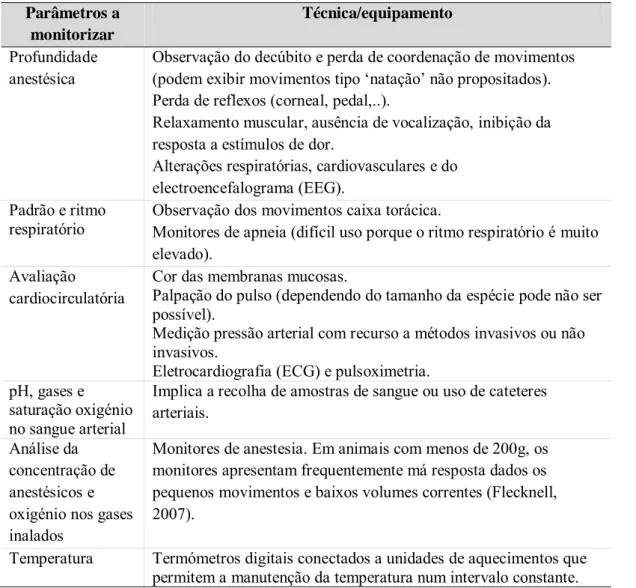
A monitorização pré-anestésica tem como função a identificação e determinação da magnitude de anormalidades que possam prejudicar a resposta do animal à anestesia. A monitorização anestésica, é responsável pelo controlo e manutenção das variáveis fisiológicas durante o período de anestesia. A monitorização pós-anestésica tem por sua vez, o propósito de garantir a total recuperação anestésica bem como, fornecer a analgesia adequada (Haskins, 2007). Nesta introdução vai ser dado destaque à monitorização anestésica propriamente dita, particularmente em roedores, a qual se encontra sumariada na Tabela 3.
12
Em termos gerais, os parâmetros anestésicos fundamentais relacionam-se com a função respiratória, cardiocirculatória, temperatura e profundidade anestésica, função renal e relaxamento muscular (Dugdale, 2010). Nesse âmbito podemos considerar três níveis de monitorização anestésica: nível I compreende uma monitorização básica e indispensável; nível II poderá ser opcionalmente realizada como rotina, estando indicada em alguns doentes que acusem a necessidade de uma monitorização mais completa; por último o nível III, que deve ser realizada em doentes com patologias específicas e risco anestésico elevado (Hall, 2001).
Tabela 3 - Parâmetros anestésicos a monitorizar em roedores de laboratório.
Parâmetros a monitorizar
Técnica/equipamento
Profundidade
anestésica Observação do decúbito e perda de coordenação de movimentos (podem exibir movimentos tipo ‘natação’ não propositados). Perda de reflexos (corneal, pedal,..).
Relaxamento muscular, ausência de vocalização, inibição da resposta a estímulos de dor.
Alterações respiratórias, cardiovasculares e do electroencefalograma (EEG).
Padrão e ritmo
respiratório Observação dos movimentos caixa torácica. Monitores de apneia (difícil uso porque o ritmo respiratório é muito elevado).
Avaliação
cardiocirculatória Cor das membranas mucosas. Palpação do pulso (dependendo do tamanho da espécie pode não ser possível).
Medição pressão arterial com recurso a métodos invasivos ou não invasivos.
Eletrocardiografia (ECG) e pulsoximetria. pH, gases e
saturação oxigénio no sangue arterial
Implica a recolha de amostras de sangue ou uso de cateteres arteriais.
Análise da concentração de anestésicos e oxigénio nos gases inalados
Monitores de anestesia. Em animais com menos de 200g, os monitores apresentam frequentemente má resposta dados os pequenos movimentos e baixos volumes correntes (Flecknell, 2007).
Temperatura Termómetros digitais conectados a unidades de aquecimentos que permitem a manutenção da temperatura num intervalo constante.
13
A monitorização de parâmetros anestésicos torna-se progressivamente mais difícil quanto menor for a espécie em questão. A informação obtida habitualmente por exemplo, por observação dos movimentos torácicos ou palpação do pulso podem não ser claras e por esse motivo, a criatividade é frequentemente necessária para adaptar as técnicas e equipamentos existentes ao tamanho e especificações anatómicas de cada animal.
1.2.1 Monitorização da função respiratória
A função respiratória é determinada por um controlo comportamental e metabólico. O controlo metabólico é efetuado por um feedback negativo, pelas vias aferentes dos quimiorrecetores que detetam o aumento da pressão parcial do dióxido de carbono (PaCO₂) e redução da pressão parcial do oxigénio (PaO₂) no sangue arterial (Gallego, 2001). A resposta à hipoxia é mediada pelos corpos carotídeos (quimiorrecetores periféricos) situados na bifurcação da aorta, que conduzem a informação aos centros medulares por forma a aumentar a ventilação (Nattie, 1999; Richardson, 2003), ou diminuir quando a PaCO₂ e PaO₂ se encontram dentro de valores normais.
O controlo comportamental da respiração consiste na capacidade de aumentar ou diminuir voluntariamente a frequência e amplitude dos movimentos respiratórios. A ausência de movimentos respiratórios, apneia, pode ser conseguida voluntariamente. No entanto, quando a PaCO₂ aumenta em consequência da apneia, o centro respiratório (controlo metabólico) sobrepõe-se à influencia cerebral voluntária (Seeley, 2003). A anestesia remove o controlo comportamental (pela produção de inconsciência) que influencia a ventilação (Dahan, 2003).
Dependendo da dose em que são administrados, os anestésicos têm diferentes locais de ação, provocando uma depressão no sistema cardiorrespiratório (Teppema, 2011). A depressão ventilatória causa elevação da PaCO₂. Esta relaciona-se com a dose de anestésico administrada, o qual causa uma diminuição da resposta ventilatória à PaCO₂ (Eger, 2005). Sabe-se por exemplo, que o isoflurano em concentrações subanestésicas provoca diminuição da ventilação face à hipoxia, por ter uma ação nos quimiorrecetores periféricos (van den Elsen, 1995).
14
Ainda que a monitorização da função respiratória pressuponha o acesso a vários parâmetros tais como, frequência, ritmo respiratório, volume corrente, espaço morto, pressões parciais de O₂ e CO₂ é sobre a monitorização da frequência respiratória que este trabalho se debruça.
Uma alteração na frequência respiratória é um indicador sensível da alteração do estado do doente. Bradipneia pode por exemplo, ser um sinal de anestesia profunda ou hipotermia. Taquipneia por sua vez, está relacionada com inúmeras condições, e a sua ocorrência não implica obrigatoriamente a existência de uma anestesia superficial (Haskins, 2007).
A frequência respiratória é assim, um dos indicadores da profundidade anestésica. Esta tende a aumentar durante o estádio I de anestesia, especialmente se não for administrada pré-medicação. No estádio II, a depressão respiratória aumenta e a o padrão respiratório torna-se irregular. No estádio III, a diminuição da ventilação pode estar relacionada com o relaxamento dos músculos intercostais e diafragmáticos. Posteriormente, o padrão respiratório tende a ser mais superficial, os movimentos torácicos diminuem e a respiração torna-se maioritariamente abdominal, com possibilidade de aumento da frequência respiratória. No estádio IV, perante uma
overdose, a respiração torna-se inteiramente abdominal, durante a inspiração a
contração do diafragma provoca colapso do tórax e, inversamente, durante a expiração o avanço anterior do diafragma provoca a expansão do tórax. Progressivamente os movimentos diafragmáticos tornam-se menos amplos, as trocas respiratórias diminuem até que cessam (Muir, 2007).
1.2.1.1 Métodos invasivos
Os métodos invasivos para monitorização da função respiratória em anestesia implicam a análise de gases no sangue (gasometria). É considerado o meio mais efetivo para avaliação da adequação da ventilação e oxigenação (Mason, 2007).
Consiste na recolha de sangue arterial/venoso ou cateterização arterial/venosa e permite a obtenção de níveis de O₂ e CO₂ (dióxido de carbono), HCO₃ (bicarbonato), pH e excesso de base presentes no sangue arterial e venoso. A PaO₂ é uma medida
15
inalação de misturas de gases pobres em oxigénio ou a ineficaz troca pulmonar de gases. A PaCO₂ é dada pelo balanço entre a produção e eliminação do mesmo, tendo em condições normais valores bastante constantes. A concentração de HCO₃, pH e excesso de base, informam relativamente ao equilíbrio ácido base (Craig, 1999).
Não obstante de ser o método ideal para monitorização da função respiratória e perfusão, a gasometria tem a desvantagem de ser invasivo, implicar elevado conhecimento técnico e equipamento caro, o que faz dos métodos não invasivos, uma boa alternativa para a monitorização de parâmetros anestésicos relacionados com a eficiência respiratória.
1.2.1.2 Métodos não invasivos
Os métodos de monitorização da função respiratória podem ser categorizados em função da sua resposta: ao movimento, volume; fluxo nasal e concentração de gases sanguíneos (Folke, 2003).
Os métodos observacionais surgem como a solução mais simples e económica, dando uma ideia da frequência, ritmo, volume respiratório bem como da coloração das membranas mucosas (Mason, 1997).
A frequência respiratória pode ser monitorizada através da observação dos movimentos respiratórios e contagem dos mesmos num minuto ou em frações de minuto com recurso a um cronómetro. Apesar das vantagens de custo-simplicidade, este é um método que exige um acompanhamento constante por parte do responsável pela anestesia. Krieger et all. avaliaram a rotina de avaliação da frequência respiratória numa unidade de cuidados intensivos de um hospital de medicina humana, comparando-o com os dados obtidos por um sistema protótipo que consiste num microprocessador que avalia por pletismografia de indutância e concluíram que, havia um erro de 20% nas medições feitas pela equipa. (Krieger, 1986).
A oximetria de pulso surge como alternativa não invasiva, tem a vantagem de proporcionar uma monitorização contínua da SpO₂ (saturação de oxigénio no sangue), dando por isso uma boa indicação da adequação da ventilação e trocas gasosas. A sua utilização não está dependente de elevados conhecimentos técnicos, sendo apenas necessário que o clínico interprete os valores indicados, implica a compra do
16
equipamento que pode ser específico ou adaptável a várias espécies. O funcionamento do pulsoxímetro baseia-se na absorção da luz de um determinado comprimento de onda pela desoxihemoglobina e oxihemoglobina (do Amaral, 1992). A luz emitida por uma fonte oposta à extremidade em que o dispositivo está colocado é absorvida em diferente grau pela desoxihemoglobina (940 nm) e oxihemoglobina (660 nm) do sangue que a perfunde e medida por um sensor que se encontra na face oposta (James, 1999). Considera-se que existem trocas gasosas eficientes quando os valores de SpO₂ são superiores a 95% e quando os valores se encontram abaixo de 90%, intervenção imediata é requerida. O local de colocação do sensor de pulsioxímetro é importante para evitar erros de leitura, devendo este ser colocado em locais despigmentados e sem pelo.
No que diz respeito aos roedores de laboratório, o uso de pulsoxímetro tem duas principais limitações. Por um lado o limite superior do monitor deve ser superior a 350 beats por minuto (bpm). Por outro lado, vários tipos de sensores e em diferentes posições devem ser testados por forma a conseguir a melhor leitura. A base da cauda e os membros posteriores são frequentemente os locais escolhidos (Flecknell, 2007).
A capnografia é outra técnica não invasiva que permite obter, com bastante precisão a PaCO₂. O princípio subjacente à técnica é o de que, a concentração de CO₂ nos capilares pulmonares vai estar em equilíbrio com a que se encontra nos alvéolos no fim da expiração. Assim, a medição é feita no volume corrente expirado com base na capacidade de absorção da luz infravermelha pelo CO₂. O equipamento consiste numa sonda compacta que deve ser conectada entre o tubo endotraqueal e sistema respiratório do animal e um analisador. Os capnógrafos geram um gráfico da concentração de CO₂ durante o ciclo respiratório do animal e apresentam o valor numérico do CO₂ no volume corrente (EtCO₂). Valores EtCO₂ entre 35 a 45 mmHg são considerados normais, valores superiores indicam hipoventilação, valores inferiores indicam hiperventilação (Flaherty, 2005). Através do gráfico gerado é possível também obter informação relativa à ocorrência de paragem cardíaca, apneia, problemas relacionados com o sistema de anestesia (falha no fluxo unidirecional das válvulas no caso de um sistema circular de respiração) condições patológicas pré-existentes (êmbolos pulmonares, doença obstrutiva crónica das vias aéreas) (Flaherty, 2012). A desvantagem deste equipamento é o custo que faz com que nem sempre esteja disponível na prática clínica. Relativamente ao uso da capnografia em roedores de laboratório, levantam-se duas questões. Em primeiro lugar, o volume de gás necessário para compor a amostra a ser analisada é frequentemente muito grande comparativamente ao volume corrente do
17
animal. Em segundo lugar, a presença da sonda provoca um aumento do espaço morto no circuito, bastante significativo em animais tão pequenos (Flecknell, 2007).
1.2.1.3 Novas soluções de monitorização da frequência respiratória
A deformação da cavidade torácica provocada pela sua expansão aquando da inspiração pode ser considerada um biosinal mecânico da respiração. Biosinais mecânicos são por definição correspondentes, a deformações no corpo ou vibrações locais da pele que podem revelar dados fisiológicos (Kaniusas, 2012). Esta característica mecânica da respiração pode ser convertida num sinal elétrico, e posteriormente mensurada.
A mensuração elétrica funciona em termos gerais da seguinte forma: um input mecânico de uma determinada ‘quantidade’ gera um sinal elétrico, que constitui um
output representativo da ‘quantidade’ que pretendemos mensurar. A atribuição de
indicação numérica para a ‘quantidade’ medida, é feito em duas etapas: em primeiro lugar, a ‘quantidade’ mecânica é convertida num sinal elétrico, posteriormente o mesmo é amplificado, medido e gravado (Gautschi, 2002).
Neste contexto, surgem os sensores piezoelétricos que graças às suas características e modo de funcionamento permitem a mensuração da frequência respiratória.
1.2.1.3.1 Sensores piezoelétricos
A palavra piezo deriva do grego “piezein” e significa, pressionar. Piezoeletricidade por composição das palavras significa, literalmente "eletricidade de pressão“. O efeito piezoelétrico foi descoberto em 1880 pelos irmãos Pierre e Jacques Curie. Estes descobriram que quando uma tensão mecânica é aplicada sobre determinados cristais cerâmicos, é produzida eletricidade cuja voltagem é diretamente proporcional à tensão aplicada. O material piezoelétrico mais comum é o quartzo, no entanto outros cristais cerâmicos podem também ser utilizados.
Os sensores piezoelétricos não necessitam de alimentação externa, produzem eles próprios um sinal analógico de tensão quando estimulados mecanicamente. Dadas as suas características de simplicidade, baixo custo, alta sensibilidade, e versatilidade, os
18
sensores piezoelétricos têm encontrado cada vez maior aplicação em dispositivos e técnicas de monitorização na área das ciências biomédicas (Webster, 2006).
19
Capítulo 2 - Materiais e Métodos
2.1 Animais
Para a realização do estudo 1 foram utilizados 3 murganhos BALB/c do género feminino, com 3 meses, aproximadamente 13g de peso e cor branca. Por forma a respeitar a regra dos 3R’s (Reduction, Refinement e Replacement) e tendo em conta o objetivo dos testes realizados, os animais envolvidos provieram de grupo controlo integrado num outro trabalho de investigação.
No estudo 2 foram utilizados 10 murganhos do género feminino, da estirpe C57BL/6 e de cor castanha. Os animais foram criados no biotério do IBMC (sendo descendentes F1 e F2 de animais proveniente do laboratório Charles River, Barcelona, Espanha).
O género e estirpe dos animais utilizados não teve qualquer propósito especifico. Os animais usados em ambos os estudos foram alojados em gaiolas (Makrolon tipo II, Tecniplast, Dias de Sousa, Alcochete, Portugal). As mesmas tinham cama de sabugo de milho (Probiológica, Lisboa, Portugal), um pedaço de papel e um tubo de cartão para fins de enriquecimento ambiental. Água e comida granulada para roedores (4RF25-GLP Mucedola, SRL, Settimo Milanese, Itália) foram fornecidos ad libitum. Os animais foram mantidos numa sala com temperatura (21ºC ± 1 º C) e humidade (55%) controladas. Foram efetuados ciclos de luz de 12h, nos quais as luzes eram desligadas às 16h.
Todo o cuidado foi tomado para minimizar o número de animais utilizados e o sofrimento indesejado. No final dos testes, todos os animais foram eutanasiados pela técnica de estiramento da coluna cervical.
Todos os procedimentos foram eticamente aprovados pela autoridade portuguesa competente pela proteção dos animais (Direção Geral de Veterinária, em Lisboa, Portugal).
20
2.2 Anestesia
Estudo 1
Os murganhos foram colocados individualmente na câmara anestésica e a anestesia foi induzida com uma mistura 5% de isoflurano (Isoflo, Esteve Farma Lda., Carnaxide, Portugal) e 100% de oxigénio, fornecidos a uma taxa de 1L/min, até perda do reflexo postular. Em seguida, foi reduzida a concentração de isoflurano para 1,5% em 100% de oxigénio, administrados a uma taxa de 1L/min. O controlo da concentração de anestésico fornecido foi efetuado no vaporizador. A anestesia foi interrompida alguns minutos depois, e por forma a acelerar a recuperação, foi administrado 100% oxigénio a uma taxa de 2L/min. Após recuperarem a consciência os animais foram retirados da câmara anestésica.
Estudo 2
Os murganhos foram colocados individualmente na câmara anestésica. A anestesia foi induzida com uma mistura 4% de isoflurano (Isoflo, Esteve Farma Lda., Carnaxide, Portugal) e 100% de oxigénio, fornecidos a uma taxa de 1L/min até perderam o reflexo postular.
Em seguida, de modo a observar a variação dos parâmetros fisiológicos, de acordo com a profundidade anestésica, três tratamentos com diferentes concentrações de isoflurano foram, aleatoriamente, administrados a cada um dos animais para manutenção da anestesia, designadamente: I) anestesia mantida com baixa concentração de isoflurano (1%); II) concentração intermédia (1,5%); e III) elevada concentração (2%). O esquema do protocolo anestésico encontra-se representado na Figura 1. O peso e a ordem pela qual os animais foram testados estão representados na Tabela 4.
21 Figura 1 – Protocolo anestésico de validação esquematizado
A concentração foi controlada com base na informação obtida por um monitor de anestesia (Capnomac ultima, Datex-Ohmeda, Helsinki, Finland).
Cada concentração foi administrada por um período de 15 minutos. O Instrumento Visual (VI) do software de aquisição do sinal foi programado para mostrar os dados continuamente por 13 minutos, e por fim, gravá-los continuamente por 2 minutos. Admite-se que 15 minutos é o tempo necessário para atingir que o equilíbrio entre a concentração de anestésico no gás alveolar, sangue arterial e cérebro (Quasha, 1980).
Após a administração dos três tratamentos, o fornecimento de isoflurano foi suspenso e oxigénio a 100% foi administrado a uma taxa de 2L/min de modo a acelerar a recuperação. Os animais foram retirados da câmara anestésica e observados até recuperarem a consciência. Os tempos de indução e recuperação foram medidos por um cronómetro e registados.
Tabela 4 - Peso e ordem dos tratamentos administrados aos 10 animais que participaram nos
testes.
Murganho Peso Ordem Tratamentos
#1 29 g I – II – III #2 27.3 g II – I – III #3 29 g II – III – I #4 26.6 g III – II – I #5 29.9 g I – III – II #6 27.5 g I – III – II #7 27.8 g I – III – II #8 28.6 g III – I – II #9 28.3 g I – II – III #10 30.3 g II – III – I
22
2.3 Equipamento
2.3.1 Construção da câmara anestésica
A câmara anestésica foi projetada com um formato trapezoidal, assente em três apoios cilíndricos coincidentes com cada um dos vértices por forma a garantir uma configuração mecanicamente estável. O material escolhido foi acrílico transparente, com 4 mm de espessura. As medidas da câmara estão referenciadas na Figura 2, e apresenta um volume total de 945000mm³. A reduzida dimensão da câmara possibilita um controle mais preciso sobre a quantidade de anestésico administrado. Permite também a obtenção das concentrações anestésicas desejadas num curto espaço de tempo, resultando, numa indução e recuperação da anestesia mais rápida e num menor consumo de anestésico. A câmara dispõe em duas faces opostas e paralelas de dois orifícios com 15 mm de diâmetro cada. Um para entrada da mistura de gases, e outro para exaustão dos mesmos.
23
2.3.2 Sensorização da câmara anestésica
2.3.2.1 Escolha, colocação e conexão dos sensores
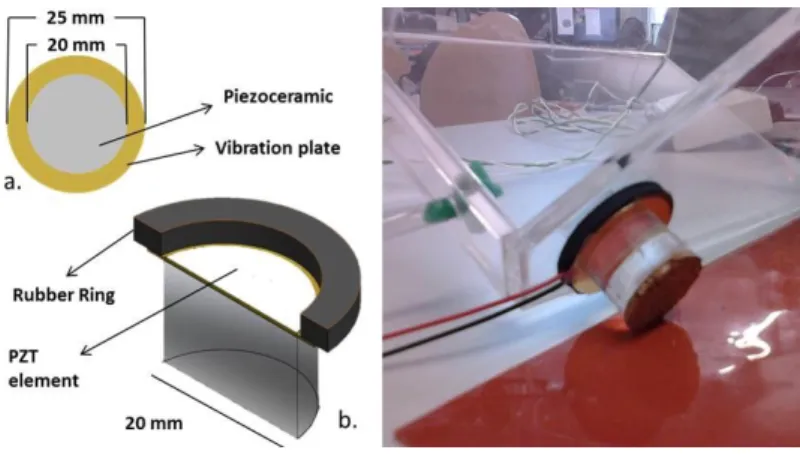
Os sensores piezoelétricos foram escolhidos tendo em conta a sua capacidade de gerar um potencial elétrico quando sujeitos a uma deformação mecânica a par da sua elevada sensibilidade. O sensor utilizado consiste num fino cristal de piezoelétrico circular, assente num pedaço de cobre circular com um diâmetro ligeiramente superior ao do cristal (conectado a dois fios de cobre), conforme ilustrado na Figura 3.
Figura 3 - Sensores piezoelétricos utilizados e respetivas medidas.
Em cada um dos apoios da câmara (em acrílico com 20 mm de diâmetro por 20 mm de altura) foi colocado um sensor piezoelétrico. O objetivo deste sensor é a deteção da vibração proveniente da base da câmara, originada pela expansão da caixa torácica do murganho aquando da respiração. O sensor é capaz de detetar vibrações causadas pelos movimentos respiratórios do murganho anestesiado, mas também outras vibrações existentes na sala de trabalho. Assim, nem todo o sinal elétrico gerado é relevante, sendo por isso considerado ruído. Para minimizar o ruído e otimizar o sinal captado, foram testados sensores de diferentes dimensões colocados em diferentes posições relativas.
Numa primeira abordagem foram utilizados sensores de iguais dimensões, colocados entre um anel de borracha, onde assentava a base da caixa, e o apoio da câmara,
24
conforme ilustrado na Figura 4. A ideia desta configuração é potenciar a deformação mecânica aplicada no cristal piezoelétrico, criando deste modo um efeito mola. No anel foi também criada uma reentrância para evitar contacto entre este e os fios.
Figura 4 – Imagem conseguida em SolidWorks® referente ao posicionamento e dimensão dos
sensores piezoelétricos. Imagem real.
Numa segunda fase, o sensor piezoelétrico posicionado no vértice frontal (coincidente com o orifício de entrada dos gases anestésicos) foi substituído por outro de maiores dimensões. Os anéis de borracha foram retirados por aparentarem ter algum efeito amortecedor das vibrações. Em substituição foi colocado um elemento rígido de metal entre a base da câmara, diretamente assente no cristal piezoelétrico, conforme ilustrado na Figura 5.
25
Figura 5 – Imagem obtida em SolidWorks® com o pormenor da colocação e dimensão dos
sensores. Imagem real.
O resultado dos testes realizados com a configuração anteriormente descrita revelou que o sensor de maiores dimensões possibilitava a obtenção de um sinal de melhor qualidade. Tendo ainda em conta as reduzidas dimensões da câmara anestésica, optou-se pela utilização de apenas um optou-sensor, o qual mostrou optou-ser suficiente para obtenção de sinal. O apoio correspondente ao vértice frontal foi colocado diretamente sobre o cristal piezoelétrico do sensor piezoelétrico de maiores dimensões. A Figura 6 ilustra o sensor piezoelétrico escolhido e o pormenor da sua colocação.
Figura 6 - Sensor piezoelétrico (Kingstate KRS -100) e imagem real da sua colocação no apoio
da câmara anestésica.
Para a aquisição do sinal, os sensores piezoelétricos foram conectados a um dispositivo de aquisição de dados (DAQ) NI USB-6251, 16-bit, Multifunction I/O
26
(National Instruments, Austin, TX, Estados Unidos) ilustrado na Figura 7. O DAQ atua
como interface entre o computador e os sinal elétrico que se pretende adquirir, digitaliza-o (converte o sinal analógico de entrada) para que este possa ser interpretado pelo computador. Possui circuitos eletrónicos de condicionamento de sinais, conversor analógico digital e barramento do computador.
Com o propósito de melhorar a qualidade do sinal, foi ligada uma resistência de 330 kΩ em paralelo em cada entrada analógica do DAQ. A ligação da resistência foi efetuada por forma a controlar a impedância interna do DAQ, bem como o desvio do sinal e a sua subida.
Figura 7 - Dispositivo de aquisição de dado DAQ NI USB-6251, conectado a um sensor
piezoelétrico (o qual não está visível na imagem).
2.3.2.2. Programação dos sensores
O DAQ conectado ao computador por uma entrada USB, foi utilizado conjuntamente com o software comercial LabVIEW® 2013 (National Instruments, Austin, TX, Estados Unidos), o qual permite a aquisição e processamento do sinal. Este software permite o controlar a operação do DAQ permitindo o processamento, visualização e armazenamento de dados de medição.
O LabVIEW® consiste numa linguagem de programação gráfica que pode ser utilizado para realização de medições e automação de procedimentos. Os programas gerados pelo LabVIEW® são Instrumentos Visuais (VI’s) compostos por um painel
27
frontal contendo uma interface, bem como pelo diagrama de blocos, no qual consta o código gráfico do programa (Travis, 2006).
2.3.2.1.1 Desenvolvimento do software de aquisição do sinal
A fim de comparar os dados obtidos pelo sensor piezoelétrico, foi criado um VI que permite a aquisição de sinal elétrico e imagem simultaneamente. Para aquisição do vídeo foi utilizado um módulo do LabVIEW®, NI-DAQmx e Vision Acquisition modules (National Instruments Austin, TX, Estados Unidos), o qual permite também a realização do processamento de imagem. O vídeo foi captado com recurso a uma
webcam (Canyon, CNR - WCAM43, 0.3 Mega pixel, resolução 640x480).
A Figura 8 corresponde a um print screen do VI criado para aquisição de sinal. Este permite a representação gráfica do sinal elétrico obtido pelos sensores piezoelétricos e a imagem captada pela webcam simultaneamente, bem como a gravação dos dados para posterior análise.
As taxas de amostragem utilizadas para a aquisição do sinal elétrico e do vídeo foram 250 Hz e 8 Hz, respetivamente. A escolha destas taxas está relacionada com a capacidade de sincronização na aquisição e processamento de ambos. Não obstante disso, para aquisição do sinal elétrico devemos obedecer ao teorema da amostragem.
O teorema da amostragem afirma que, um sinal limitado em banda de tempo contínuo é inteiramente representado (amostrado), se, e somente se, a taxa de amostragem for duas vezes superior à largura de banda do sinal. (Mainardi, 2008). Caso contrário produz-se um fenómeno indesejável, denominado de aliasing, que se traduz numa sobreposição de espectro que inviabiliza a correta recuperação do sinal.
28 Figura 8 – Instrumento visual (VI) para aquisição de dados – software comercial LabVIEW®
2013 (National Instruments).
2.3.2.1.2 Desenvolvimento de software de processamento dos dados
Para o processamento e análise de dados foi criado outro VI que, a par do de aquisição, permite o tratamento simultâneo da imagem e sinal de vídeo obtidos. Na interface existe uma barra temporal que permite selecionar o intervalo de tempo pretendido.
Na representação gráfica do sinal elétrico os picos correspondem à tensão mecânica provocada pela vibração (resultante dos movimentos respiratórios), no qual estão incluídos dados que pretendemos obter, bem como o ruído que pretendemos excluir. Dado que os movimentos respiratórios se encontram numa gama de frequências expectável para cada espécie. No caso do murganho e devido à depressão respiratória, podemos esperar frequências respiratórias entre 0,4 – 2,6 Hz (Sato, 2006). Assim, foi aplicado um filtro digital Butterworth de passa-banda (Kehtarnavaz, 2011) de frequência mínima 1 Hz e máxima 5Hz por forma a eliminar o ruído, evidenciando os picos correspondentes, ao impacto dos movimentos respiratórios. A Figura 9 ilustra o sinal obtido em 5 segundos sem processamento e após a aplicação do filtro.
29 Figura 9 – Representação gráfica do sinal elétrico obtido: a. sem aplicação de filtro; b. filtrado -
filtro Butterworth, passa-banda 1-5 Hz.
2.3.3 Monitorização respiratória por análise de imagem
A observação dos movimentos respiratórios registados pelo vídeo é uma forma simples de medir a frequência respiratória do murganho anestesiado, sendo no entanto bastante trabalhosa. Por esse motivo, no VI criado para análise de dados foram utilizadas algumas ferramentas de processamento de imagem que permitem automatizar o processo de contagem e representação do número de respirações por minuto (RPM).
A Figura 10 representa a técnica de processamento de imagem utilizada. Em primeiro lugar, foi selecionada na imagem uma region of interest (ROI) que, no presente caso, corresponde à silhueta torácica do murganho. Em seguida a escala de cores da ROI foi alterada para cinzentos para que nela pudesse ser aplicado um
threshold na imagem.
30 Figura 10 – a. Imagem real do murganho anestesiado, o quadrado verde seleciona a “region of
interest” (ROI); b. ROI em escala de cinzento; c. threshold aplicado à ROI.
O threshold é um processo de segmentação de imagens que se baseia na diferença
dos níveis de cinza que compõe diferentes objetos de uma imagem. A partir de um limiar estabelecido de acordo com as características dos objetos que se quer isolar, a imagem pode ser segmentada em dois grupos: o grupo de pixels com níveis de cinza abaixo do limiar e o grupo de pixels com níveis de cinza acima do limiar. O resultado desta operação é a binarização da imagem. Em murganhos de cor clara é colocado um fundo de cor preta na face oposta da câmara (relativamente à posição da webcam) para proporcionar maior contraste com a silhueta torácica branca. No caso de o murganho possuir pelagem escura é colocado um fundo branco.
Por fim, após o processamento o programa calcula a variação da área preta em função da área branca (cujo aumento é consequência da expansão da caixa torácica) e representa-a graficamente. Desta forma faz-se corresponder, a cada pico, um movimento respiratório conforme demonstrado na Figura 11.