UNIVERSIDADE FEDERAL DE UBERLÂNDIA Instituto de Ciências Biomédicas
Programa de Pós-Graduação em Imunologia e Parasitologia Aplicadas
VINÍCIUS JOSÉ DE OLIVEIRA
Efeitos da natação sobre os parâmetros morfofuncionais e imunológicos em um modelo murino de inflamação pulmonar induzido pelo alérgeno
recombinante Blo t 5 do ácaro Blomia tropicalis
VINÍCIUS JOSÉ DE OLIVEIRA
Efeitos da natação sobre os parâmetros morfofuncionais e imunológicos em um modelo murino de inflamação pulmonar induzido pelo alérgeno
recombinante Blo t 5 do ácaro Blomia tropicalis
Dissertação apresentada ao Colegiado do Programa de Pós-Graduação em Imunologia e Parasitologia Aplicadas como parte de obtenção do título de mestre.
Prof. Dr. Ernesto Akio Taketomi Orientador
AGRADECIMENTOS
Em primeiro lugar e, antes de tudo, quero agradecer a Deus por ter me proporcionado esta oportunidade, pela força para conseguir chegar até aqui e por tudo que ele tem abençoado para mim durante minha caminhada acadêmica.
Agradeço aos meus pais, Adilso e Lucimar, por todo apoio e confiança em mim depositados, afinal esta conquista não é só minha, é nossa.
Agradeço a minha irmã, Bruna, por todo apoio, conselhos e por acreditar em mim muito mais do que eu mesmo.
Agradeço ao meu namorado, Cláudio Henrique, por ter me aturado durante os períodos finais dessa fase, por ouvir minhas reclamações e por acreditar em mim de uma maneira encantadora, você foi essencial para que eu chegasse até aqui.
Agradeço ao professor Ernesto Akio Taketomi por ter aceitado me orientar nessa jornada, por todo apoio e por todo conhecimento transmitido, sem isso eu não teria chegado até aqui.
Agradeço ao professor Jair Pereira da Cunha Júnior por todas as conversas, pelo apoio e pelo conhecimento transmitido.
Agradeço aos meus amigos e parceiros de laboratório, Isabella, Hellen, Karine, Alessandro, Laura, Alfredo e Greice, por todos os momentos de risadas, de discussões, de aprendizado, obrigado por tornar meus dias mais alegres e minha jornada mais calma e agradável.
Agradeço também ao professor Robinson Sabino e a Léia Sousa pela parceria firmada entre o LALIC e o departamento de Fisiologia, por colaborar com as análises que incrementaram meu projeto para que ele chegasse ao fim.
À Fundação de Amparo à Pesquisa do Estado de Minas Gerais pelo investimento em mim através da Bolsa de Estudos.
RESUMO
Modelos experimentais de inflamação pulmonar têm sido comumente utilizados para compreender a fisiopatologia das doenças pulmonares inflamatórias. Pela primeira vez, desenvolvemos um modelo experimental de inflamação pulmonar usando o alérgeno recombinante Blo t 5 (rBlo t 5) do ácaro Blomia tropicalis, para descrever os efeitos promovidos pela natação, de moderada intensidade, neste modelo. A sequência de Blo t 5 foi clonada no vetor pET28a e utilizou-se para transformação E. coli BL21, sendo purificada por cromatografia de afinidade em coluna de níquel. Em seguida, camundongos BALB/c foram sensibilizados duas vezes com 25 µg do alérgeno recombinante (i.p.) e 5 μg intranasais (i.n.) em intervalos de 7 dias, seguidos por quatro instilações i.n. diárias e submetidos à natação (TA) durante 4 semanas. Foram avaliados o volume corrente, frequência respiratória e volume-minuto, os níveis de anticorpos IgG específicos e as subclasses de IgG (IgG1 e IgG2a), citocinas e lactato plasmático. Encontramos um aumento no volume corrente (p <0,001) após exposição a altas concentrações de Metacolina e níveis aumentados de IgG anti-rBlo t 5 (p <0,0001) e suas subclasses no grupo rBLOT5, com uma diminuição desses parâmetros no grupo rBLOT5-TA. Houve diminuição nas células totais (p<0,0001) e nos níveis de citocinas pró-inflamatórias, como a IL-6 (p<0,01), IFN-γ (p<0,05) e TNF (p< 0,01), no grupo rBLOT5-TA. Podemos concluir que o exercício aeróbico, mesmo em intensidade moderada, é indicado para atenuação do processo inflamatório pulmonar em doenças pulmonares.
ABSTRACT
Experimental models for lung inflammation have been commonly used to understand the pathophysiology of the inflammatory lung diseases. For the first time, we developed an experimental model of lung inflammation using the recombinant Blo t 5 protein (rBlo t 5) from the mite Blomia tropicalis, in order to analysis the effects promoted by swimming (TA) at moderate intensity in this model. The Blo t 5 sequence was cloned in pET28a vector and used to transform BL21 E. coli strain, and it was purified in a nickel affinity chromatography. Then, BALB/c mice were sensitized two times with 25 µg recombinant protein (i.p.) and 5 µg (i.n.) at intervals of 7 days, followed by four daily intranasally instillations, and submitted to swimming for 4 weeks. The tidal volume, respiratory frequency, volume-minute, levels of specific IgG antibodies and IgG subclasses (IgG1 and IgG2a), cytokines and lactate from blood were evaluated. We found an increase in tidal volume (p<0,001) after exposure to high concentrations of methacholine and increased levels of total IgG anti-rBlo t 5 (p<0.0001) and their subclasses in rBLOT5 group, with a decrease in these parameters in rBLOT5-TA group. There was a decrease in total cells (p<0,0001) and in the proinflammatory cytokines levels, like IL-6 (p<0,01), IFN-γ (p<0,05) and TNF (p<0,01) in rBLOT5-TA group. We can conclude that aerobic exercise, even at moderate intensity, is indicated for attenuation of pulmonary inflammatory process in lung diseases.
LISTA DE FIGURAS
Figura 1 – Sistema respiratório humano...16
Figura 2 – Volumes e capacidades pulmonares padronizados...18
Figura 3 – Sequência gênica do alérgeno Blo t 5...34
Figura 4 - Design experimental...40
Figura 5 – Cargas suportadas pelos camundongos no Teste Progressivo de Carga (TPC)...48
Figura 6 – Função respiratória basal...51
Figura 7 - Análise do volume corrente durante o teste de broncoprovocação com Metacolina (TBM)...52
Figura 8 - Contagem de células no BALF...54
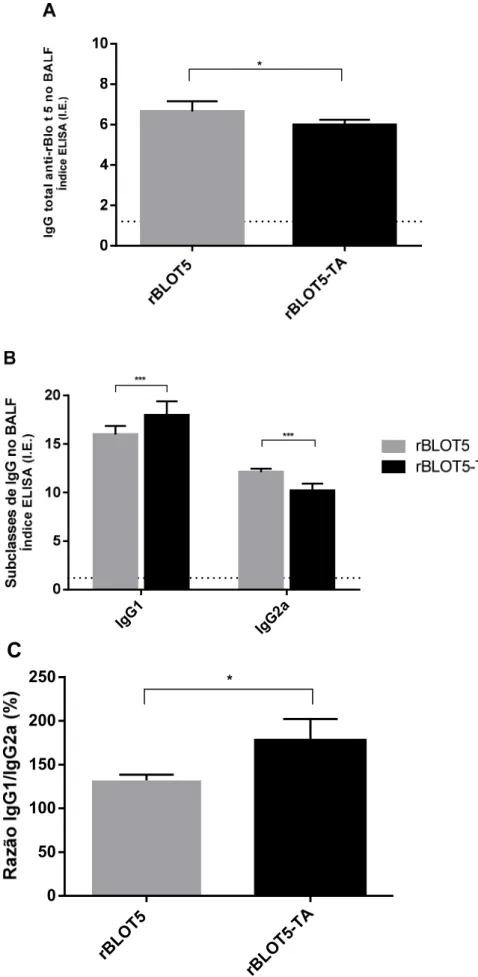
Figura 9 – Produção de anticorpos da classe IgG e subclasses IgG1 e IgG2a específicos a rBlo t 5 no BALF...56
LISTA DE TABELA
LISTA DE ABREVIATURAS E SIGLAS
ºC – Graus Celsius µg – Microgramas µL – Microlitros
ABTS – 2,2'-Azinobis [3-ethylbenzothiazoline-6-sulfonic acid]-diammonium salt ANOVA – Análise de Variância
BALF – Fluido de lavagem broncoalveolar CaCl2 – Cloreto de cálcio
CO2 – Dióxido de carbono
DAMPs – Padrões Moleculares Associados a Danos DO – Densidade óptica
DP – Desvio padrão
EDTA – Ácido etilenodiaminotetracético ELISA – Ensaio imunoenzimáticos
FcγRI – Receptores de alta afinidade para IgG FcεRI – Receptores de alta afinidade para IgE Fig. – Figura
g – Gramas
I.E. – Índice ELISA i.n. – Intranasal i.p. – Intraperitoneal IFN-γ – Interferon-gama IgA – Imunoglobulina A IgE – Imunoglobulina E IgG – Imunoglobulina G
IgG1– Imunoglobulina G, subclasse 1 IgG2a – Imunoglobulina G, subclasse 2a IL – Interleucina
IL-1ra – Receptor antagonista de IL-1 IL-2R – Receptor de interleucina 2
kg – Quilogramas
LB Broth – Caldo Luria Bertani Broth M – Molar
MFI – Intensidade Média de Fluorescência mg – Miligramas
mg/dL – Miligramas por decilitros
MHC II – Complexo principal de histocompatibilidade de classe II MiliQ – Água ultrapura
mL – Mililitros mm – Milimetros mM – Milimolar
mmol/L – Milimolar por litro NaCl – Cloreto de sódio
ng/mL – Nanogramas por mililitros NK – Natural killer
nm – Nanômetros NO – Óxido nítrico
PAMPs – Padrões Moleculares Associados a Patógenos PBS – Tampão fosfato-salino
PBS-T – PBS-Tween 20
PBS-TM – PBS-Tween 20 com Molico PCR – Reação em Cadeia da Polimerase
pET28a-rBlo t 5 – Vetor de expressão pET28a com o construto do rBlo t 5 PMSF – Phenylmethanesulfonyl fluoride
rBlo t 5 – Alérgeno recombinante de Blo t 5
rBLOT5 – Grupo experimental expostos à rBlo t 5 e não treinados rBLOT5-TA – Grupo experimental expostos à rBlo t 5 e treinados SDS-PAGE – Gel de poliacrilamida com dodecil sulfato de sódio SOCS3 – Suppressor of cytokine signaling 3
SR – Sistema respiratório
TA – Grupo experimental não expostos à rBlo t 5 e treinados TBM – Teste de Broncoprovocação com Metacolina
Th – T helper
Th1 – T helper tipo 1 Th2 – T helper tipo 2 Th17 – T helper tipo 17
SUMÁRIO
1 INTRODUÇÃO ... 16
1.1 Sistema respiratório ... 16
1.2 Ácaros da poeira domiciliar ... 23
1.3 Exercício físico e resposta imune ... 26
2 JUSTIFICATIVA ... 31
3 HIPÓTESES ... 32
4 OBJETIVOS ... 33
4.1 Objetivo geral ... 33
4.2 Objetivos específicos ... 33
5 MATERIAL E MÉTODOS ... 34
5.1 Produção do alérgeno recombinante Blo t 5 ... 34
5.2 Animais ... 39
5.3 Protocolo de exposição ao alérgeno rBlo t 5 ... 39
5.4 Protocolo de treinamento ... 40
5.5 Mensuração dos níveis de lactato sanguíneo ... 42
5.6 Análise da função respiratória ... 43
5.7 Coleta e processamento do lavado broncoalveolar ... 44
5.8 Detecção de anticorpos no BALF ... 44
5.9 Detecção de citocinas no BALF ... 46
5.10 Análise estatística ... 47
6 RESULTADOS ... 48
6.1 Influência da carga de treinamento no condicionamento físico dos camundongos ... 48
6.2 Influência da natação nos níveis de lactato plasmáticos ... 49
6.3 Influência da natação nas alterações da função pulmonar induzidas pela inflamação ... 49
6.4 Influência da natação sobre a hiperreatividade das vias aéreas ... 52
6.5 Influência da natação no infiltrado celular nos pulmões ... 53
6.6 Influência da natação sobre a produção de anticorpos específicos para rBlo t 5 ... 55
7 DISCUSSÃO ... 59
8 CONCLUSÃO ... 65
REFERÊNCIAS ... 66
ANEXO ... 76
1 INTRODUÇÃO
Para o entendimento dos dados descritos nesta dissertação se faz necessário o entendimento de alguns aspectos relacionados a composição e função do sistema respiratório, da fisiologia e da imunopatologia respiratória, em particular a pulmonar e da importância dos ácaros da poeira domiciliar quanto à sua capacidade de induzir doenças neste sistema, assim como a capacidade imunomodulatória promovida pelo exercício sobre o processo inflamatório.
1.1 SISTEMA RESPIRATÓRIO
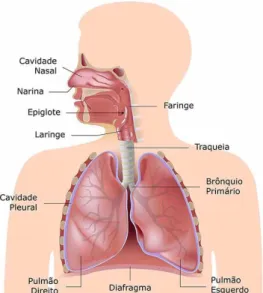
Classicamente, o sistema respiratório (SR) é dividido em vias aéreas superiores e vias aéreas inferiores. As vias aéreas superiores são formadas por órgãos que se situam externamente à caixa torácica como o nariz externo, a cavidade nasal, a faringe e a laringe. Já as vias aéreas inferiores são constituídas pelos órgãos localizados internamente a caixa torácica como a traqueia, os brônquios, os bronquíolos, os alvéolos pulmonares e os pulmões (LOWE e ANDERSON, 2015), como representado na Figura 1.
Figura 1 – Sistema respiratório humano. O sistema respiratório é constituído pelo nariz, cavidade nasal, faringe, laringe, traqueia, brônquios e pulmões. Disponível em:
Na espécie humana o SR é fundamental para sua sobrevivência, sendo responsável pelo mecanismo de troca gasosa (hematose) com o ar atmosférico, processo realizado nos alvéolos pulmonares, para garantir que a concentração de oxigênio seja mantida no sangue e a retirada do dióxido de carbono (CO2), dejeto do metabolismo celular, do sangue para o exterior. O oxigênio é o principal combustível no processo químico onde ocorre a queima da glicose oriunda dos alimentos, transformando-a em energia para as tarefas do dia-a-dia, e além da hematose, o SR auxilia na regulação da temperatura corporal, na manutenção do pH do sangue, além de estar envolvido na fala e no olfato (LEVITZKY, 2008; HSIA et al., 2013; PATWA e SHAH, 2015).
1.1.1FISIOLOGIA PULMONAR
A mecânica respiratória desde a incursão do ar até a hematose é dependente da interação entre órgãos e mecanismos específicos. Os pulmões não são capazes de se insuflar para entrada do ar, sendo dependentes das forças dos músculos da respiração que diferentemente da musculatura cardíaca não se contraem espontaneamente. Cada incursão respiratória é desencadeada no cérebro, nos grupos de neurônios localizados no bulbo, que envia uma mensagem eferente à musculatura inspiratória (diafragma e intercostais externos) para início da insuflação pulmonar, desde que a caixa torácica esteja intacta, sendo capaz de expandir-se para que o ar penetre no SR através do nariz ou da boca (SHARMA e GOODWIN, 2006; LEVITZKY, 2008; KLING, 2011).
A superfície alveolar possui uma composição especializada com o intuito de permitir a hematose. Ela é constituída principalmente por uma fina camada de células epiteliais escamosas, as células alveolares tipo I, entre as quais estão entremeadas as células alveolares cuboides tipo II mais volumosas, responsáveis pela produção de uma camada liquida que reveste os alvéolos e permitem as trocas gasosas. Além destas células, existem os macrófagos alveolares fagocíticos móveis, que patrulham a superfície alveolar e fagocitam as partículas inspiradas que não ficaram retidas nos cílios presentes em diversas partes do SR (OCHS et al., 2004; LEVITZKY, 2008).
Após a hematose, os músculos responsáveis pela expiração (abdominais e intercostais internos) são ativados via sistema nervoso central promovendo a expiração ativa, onde o ar flui para fora dos alvéolos até que a pressão alveolar entre em equilíbrio com a pressão atmosférica (LEVITZKY, 2008).
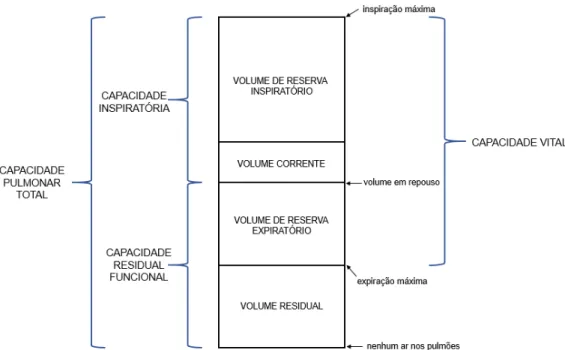
O volume de ar que entra e sai dos pulmões é dependente da mecânica respiratória, da musculatura envolvida no processo, do tamanho dos pulmões, do peso do indivíduo e de condições fisiológicas normais e patológicas. Existem quatro volumes pulmonares padronizados e quatro capacidades pulmonares padronizadas, que consistem em dois ou mais volumes padronizados em combinação (BARRETO, 2002; LEVITZKY, 2008), como mostra a Figura 2.
O volume corrente é o volume de ar que entra ou sai pelo nariz ou pela boca durante uma incursão respiratória, já o volume residual é o volume de gás deixado nos pulmões após uma expiração máxima forçada e o volume de reserva expiratório é o volume de gás que é expelido pelos pulmões durante uma expiração forçada máxima que começa no final de uma expiração corrente normal, enquanto que o volume de reserva inspiratório é o volume de gás que é inalado pelos pulmões durante uma inspiração forçada máxima que começa no final de uma inspiração corrente normal (BARRETO, 2002; LEVITZKY, 2008).
Em relação as capacidades pulmonares padronizadas, a capacidade residual funcional refere-se ao volume de gás que permanece nos pulmões no final de uma expiração corrente normal e a capacidade inspiratória é referente ao volume de ar que é inalado para dentro dos pulmões durante um esforço inspiratório máximo que começa no final de uma expiração corrente normal, já a capacidade pulmonar total é o volume de ar nos pulmões após um esforço inspiratório máximo, enquanto que a capacidade vital é o volume de ar expelido pelos pulmões durante uma expiração forçada máxima que começa após uma expiração forçada máxima (BARRETO, 2002; LEVITZKY, 2008).
Considerando que o comportamento mecânico do pulmão é baseado em suas propriedades elásticas e em seu volume, a mensuração dos volumes pulmonares oferece informações clinicamente importantes uma vez que muitos estados patológicos podem alterar volumes pulmonares específicos ou suas relações mútuas, sendo a técnica da espirometria a mais utilizada para a determinação destes volumes (BARRETO, 2002; DE CASTRO PEREIRA et al., 2007). A espirometria (do latim spirare = respirar + metrum = medida) é a medida do ar que entra e sai dos pulmões. Pode ser realizada durante respiração lenta ou durante manobras expiratórias forçadas, sendo um teste que permite o diagnóstico e a quantificação dos distúrbios ventilatórios (DE CASTRO PEREIRA et al., 1996; RUBIN, 2005; DE CASTRO PEREIRA et al., 2007).
Todos os dias, cerca de 10.000 litros de ar são inspirados e penetram as vias aéreas até chegar nos alvéolos pulmonares, porém nesse ar podem conter alguns antígenos como poeira e ácaros da poeira domiciliar, pólens, esporos fúngicos, cinzas, microrganismos como vírus e bactérias, substâncias químicas e gases tóxicos. Os antígenos inalados podem se depositar no trato respiratório como resultado da impactação ou sedimentação provenientes da passagem do ar pelas vias aéreas. Assim, a estrutura das vias aéreas e sua segmentação progressiva, a filtração do ar e o transporte mucociliar compõem os principais mecanismos de defesa mecânicos do SR. Enquanto que a interação entre os macrófagos residentes do tecido pulmonar e as células imunes efetoras compõem, predominantemente, os mecanismos imunológicos de defesa pulmonar (LEVITZKY, 2008; LOPES et al., 2010).
Dependendo da localização, do tamanho e da composição destas partículas podem haver diferentes estímulos para limpeza e eliminação destes antígenos, como por exemplo, materiais irritantes grandes ou o acúmulo de secreções nas vias aéreas altas são removidos rapidamente com reflexo de tosse ou espirro, uma vez que as partículas menores podem ser depositadas na superfície do trato respiratório desencadeando uma resposta mucociliar e das células de defesa do sistema imune (LEVITZKY, 2008; LOPES et al., 2010).
O mecanismo de defesa mecânico, inicia-se nas narinas que impedem, através dos cílios e do turbilhonamento do ar, a passagem dos antígenos inalados, seguidos do fechamento da glote. Quando essa atitude defensiva mais imediata do SR não é capaz de reter estas partículas, tornam-se importantes outros meios, incluindo o transporte mucociliar, já que todo o trato respiratório, desde as vias aéreas superiores até os bronquíolos terminais, é revestido por um epitélio ciliar coberto de muco. O material que se deposita no muco é deslocado continuamente para cima na direção da faringe, ao alcançá-la ele é deglutido, expectorado (tosse ou espirro) ou removido quando o indivíduo assoa o nariz (LEVITZKY, 2008; LOPES et al., 2010).
A defesa imunológica do SR é composta por diversos fatores e estímulos divididos entre a resposta imune inata e resposta imune adquirida (ou adaptativa). Os principais componentes da imunidade inata são as células fagocíticas (neutrófilos e macrófagos), as células natural killer (NK) e as células dentríticas (HALLSTRAND et
suas superfícies que associadas a produção de mucinas antimicrobianas e o movimento ciliar auxiliam na defesa do SR através da limpeza/eliminação (clearance) do ambiente pulmonar.
Apesar deste mecanismo inato ser bastante eficiente, alguns antígenos e também microrganismos conseguem ultrapassar ou mesmo resistir aos mecanismos de defesa natural, e a proteção do SR é, criticamente, dependente das respostas imunológicas adaptativas.
A resposta imune adaptativa é dividida em imunidade humoral e celular, no qual cada uma delas desempenha diferentes funções desde a proliferação e diferenciação celular culminando na produção de anticorpos ou em células imunes efetoras. Além disso, este perfil de resposta imunológica tem uma incrível capacidade para distinguir os diferentes patógenos e moléculas, incluindo até mesmo aqueles que apresentam grande semelhança sendo, por isso, sendo também chamada de imunidade específica (CURTIS, 2005; IWASAKI e MEDZHITOV, 2015).
A resposta imune celular é mediada pela ação dos células T associada a produção de citocinas, que são moléculas proteicas, glicosiladas ou não, que enviam diversos sinais estimulatórios, modulatórios ou mesmo inibitórios para as diferentes células do sistema imunológico (TURNER et al., 2014). Os células T auxiliares CD4+ (T helper - Th) ajudam os macrófagos a eliminar antígenos fagocitados e auxiliam as células B a produzirem anticorpos, sofrendo diferenciação de acordo com o microambiente pulmonar, dando origens a respostas Th1, Th2, T regulatórias (Treg), entre outras (LOPES et al., 2010).
A resposta Th1 está relacionada com a defesa contra microrganismos intracelulares e vírus, enquanto a resposta Th2 é mais efetiva contra os helmintos e bactérias extracelulares. Além disso, as células Treg produzem a interleucina-10 (IL-10) e/ou o Fator de transformação do crescimento beta (TGF-β) e estão envolvidas na modulação da resposta imune, impedindo ou diminuindo as consequências das reações de hipersensibilidade e das doenças autoimunes (MILLS e MCGUIRK, 2004). Outrossim, as células T também podem exercer sua função através da citotoxicidade mediada por células T CD8+ ou através da secreção de citocinas que vão ativar macrófagos para destruir os agentes intracelulares (LOPES et al., 2010).
O IFN-γ é responsável pela limitação da propagação de infecções virais e das parasitoses, aumenta a expressão dos genes do complexo principal de histocompatibilidade (MHC) classe I e II, e em monócitos e macrófagos estimula a produção de receptores de alta afinidade (FcγRI) para imunoglobulinas G (IgG), além de induzir a síntese de TNF por estas células. O TNF é a principal citocina com atividade biológica de citólise e citoestase em diferentes linhagens neoplásicas, tendo ação antitumoral bem definida (DINARELLO, 2007).
Já a IL-2 é o principal fator estimulador de células T, sendo um fator de crescimento e ativação para todas as subpopulações de linfócitos T, induzindo a expansão clonal de células T ativadas. A IL-6 é uma citocina pleiotrópica que influencia respostas imune antígeno-específicas e reações inflamatórias, sendo um dos maiores mediadores da fase aguda da inflamação. Em adição, a IL-12 possui importante função em estimular células NK, além de estar envolvida na expressão de fatores transcricionais relacionados com o desenvolvimento de células Th1 e concomitante inibição do desenvolvimento de fatores transcricionais relacionados com as células Th2 (DINARELLO, 2007; TURNER et al., 2014).
Em relação as citocinas de perfil Th2, a IL-4 tem como função determinar o perfil da resposta imune em Th2, induzindo a diferenciação e proliferação de células B, aumentando a expressão de MHC II nas células apresentadoras de antígenos, além de aumentar a expressão de receptores de alta afinidade para IgE (FcεRI) em mastócitos e basófilos. Já a IL-5 possui a função de estimular o crescimento e diferenciação de eosinófilos. Por fim, a IL-13 inibe a atividade quimiotática e fagocitária de monócitos/macrófagos; reduz expressão de citocinas pró-inflamatórias (IL-1, IL-6, IL-8, IL-10, IL-12), diminuindo a resposta inflamatória (DINARELLO, 2007; TURNER et al., 2014).
O muco que reveste as vias aéreas superiores contém grandes quantidades de anticorpos da classe IgA, conferindo proteção a infecções virais e, provavelmente, dificultando a aderência bacteriana à mucosa. Já nas vias aéreas inferiores, anticorpos das classes IgG e IgA apresentam-se em menores quantidades, fornecendo auxílio à opsonização não imunológica dos pneumócitos e consequentemente a fagocitose por macrófagos alveolares e neutrófilos (TWIGG, 2005).
Alguns antígenos presentes no ar são capazes de promover a sensibilização alergênica em indivíduos geneticamente predispostos, nestes casos, encontra-se grandes quantidades de IgE antígeno-específico promovendo a sensibilização de mastócitos que ao degranular, liberam aminas vasoativas causando os sintomas iniciais das crises alérgicas respiratórias como coriza, produção de muco e hiperreatividade das vias aéreas (GAUTRIN et al., 2000; PATELIS et al., 2014).
Com o intuito de entender melhor como funciona o processo inflamatório pulmonar, os modelos em animais experimentais tornaram-se uma ferramenta valiosa na pesquisa, pois descrevem a fisiopatologia do processo, mostrando a ação de vários mecanismos imunológicos envolvidos, como a produção de citocinas, quimiocinas, imunoglobulinas, receptores celulares, entre outros mediadores específicos dessas doenças, assim como os mecanismos envolvidos no tratamento destas patologias (BARRIOS, 2008; MOORE e HOGABOAM, 2008; BARON et al., 2012).
1.2 ÁCAROS DA POEIRA DOMICILIAR
Dentro do contexto de inflamação pulmonar induzida por antígenos presentes no ar inalado durante a respiração, deve ser dado especial atenção para os ácaros da poeira domiciliar, uma vez que as proteínas que compõe o corpo e as fezes dos ácaros são capazes de induzir uma resposta imune e, em indivíduos predispostos geneticamente, induzir doenças alérgicas. O Brasil, por ser um país tropical, fornece meios propícios para o crescimento e proliferação destas espécies, pois apresenta temperatura em torno de 28 a 30ºC e umidade relativa do ar média de 82% (BINOTTI
Os ácaros que vivem na poeira são microscópicos (0,1 a 0,6 mm de comprimento), de corpo ovoide, com 8 patas articuláveis e hábitos alimentares que consistem na alimentação de restos de pele humana e detritos orgânicos presentes no ambiente (BOQUETE et al., 2006; CLARKE et al., 2015; MASON et al., 2015). Entre as espécies de ácaros que habitam essencialmente a poeira estão as espécies Dermatophagoides pteronyssinus, Dermatophagoides farinae e Blomia tropicalis (GAO et al., 2007; TAN et al., 2012), sendo a espécie Blomia tropicalis a mais prevalente entre elas no Brasil (CARVALHO et al., 2013).
1.2.1 BLOMIA TROPICALIS E SEUS ALÉRGENOS
Os ácaros da espécie Blomia tropicalis foram descritos pela primeira vez em 1973, com tamanho entre 230 e 365 µm e forma globular, após um estudo morfofuncional realizado por Van Bronswijk e colaboradores. Neste estudo, eles definiram sua classificação taxonômica como reino Metazoa, filo Arthropoda, classe Arachnida, Subclasse Acari, ordem Astigmata, família Echimypodidae, gênero Blomia e espécie Blomia tropicalis (YAN CHUA et al., 2007).
Inicialmente esta espécie de ácaro foi classificada como ácaros de armazenagem, pois eram encontrados em fazendas, porém com o passar dos anos eles foram sendo encontrados dentro do ambiente doméstico, na poeira e alojados em locais como colchões, cortinas, bichos de pelúcia, carros, entre outros locais onde é possível a deposição de poeira (BOQUETE et al., 2006; CLARKE et al., 2015; MASON et al., 2015). Com isso, ela tem se tornado uma espécie de importância médica cuja relevância se baseia na sua capacidade de interagir com o sistema imune desencadeando respostas inflamatórias levando ao desenvolvimento, em casos de exposição contínua, de doenças alérgicas (THOMAS et al., 2007).
al., 2012; JULIA-SERDA et al., 2012; JEEVARATHNUM et al., 2015; PEFURA-YONE et al., 2015), demonstrando a relevância destes alérgenos, uma vez que antígenos derivados do ácaro Blomia tropicalis como a Blo t 5 também foi encontrada contaminando alimentos, como cereais (HUSSEIN e ELAWAMY, 2015).
De acordo com o Subcomitê de nomenclatura de alérgenos (WHO/IUIS Allergen Nomenclature Sub-committee), banco de dados aprovado pela Organização Mundial de Saúde e pela União Internacional de Sociedades de Imunologia, existem 14 alérgenos da espécie Blomia tropicalis cadastrados (WHO/IUIS). Entre eles existem alguns com funções bioquímicas bem definidas, como o Blo t 1 que apresenta função de cisteína protease, o Blo t 3 cuja função é de uma tripsina, o Blo t 19 que apresenta função homóloga a um peptídeo antimicrobiano, enquanto alguns deles, como o Blo t 5 e o Blo t 21, não apresentam ainda essas informações por falta de estudos que comprovem suas funções bioquímicas.
Contudo, o alérgeno Blo t 5 têm sido o mais estudado e bem caracterizado na literatura (KUO et al., 2003; YI et al., 2004; CHAN et al., 2008; NAIK et al., 2008), principalmente após o advento das técnicas de biologia molecular que auxiliaram na caracterização morfológica e na produção destes alérgenos em laboratórios de pesquisa, através da tecnologia de proteínas recombinantes. Estudos demonstraram que rBlo t 5 é reconhecido pela IgE de 12 a 98% dos pacientes com alergia ou asma em todo o mundo (SHEK et al., 2010; KIDON et al., 2011; ZAKZUK et al., 2013) e confere maior especificidade aos ensaios de sorodiagnóstico do que o extrato de ácaro inteiro, mostrando baixa reatividade cruzada com Dermatophagoides pteronyssinus e Ascaris lumbricoides (CARVALHO et al., 2013). No entanto, não existem na literatura estudos com modelos experimentais que induziram a inflamação pulmonar utilizando o rBlo t 5, para entender seus efeitos imunomoduladores in vivo.
1.3 EXERCÍCIO FÍSICO E RESPOSTA IMUNE
As respostas promovidas pelo exercício, tanto em processos inflamatórios pulmonares agudos como crônicos, afetam diversos componentes do sistema imune, levando em consideração a intensidade, duração e a frequência do exercício, onde o exercício de intensidade moderada, em especial, estimulam parâmetros relacionados à imunidade celular e humoral, levando ao controle dos processos inflamatórios agudos, promovidos por infecções, e crônicos, como em doenças inflamatórias crônicas (PRESTES et al., 2010; TERRA et al., 2012). Contudo, o exercício pode, paradoxalmente, tanto promover melhora como debilitar a resposta imune; dependendo do tipo de exercício e do nível de aptidão física de cada indivíduo (MINETTO et al., 2005; PRESTES et al., 2010).
O exercício físico influencia na resposta imune de diversas maneiras, sendo suas principais ações o recrutamento e atividade funcional das células da resposta imune inata assim como na resposta imune adaptativa, envolvendo citotoxicidade de células T CD8+ e produção de anticorpos pelas células B(BIGLEY e SIMPSON, 2015; PEAKE et al., 2015; CAMARGO HIZUME-KUNZLER et al., 2017). Porém, pouco se
sabe sobre a influência do exercício físico de moderada intensidade sobre os parâmetros imunes, especialmente no caso de que esta intensidade de exercício tem sido bastante praticada pela população em geral (SAXTON et al., 2003; PEAKE et al.,
2015).
Além disso, existe uma diferença na modulação da resposta imune em relação aos efeitos agudos e crônicos promovidos pelo exercício. As alterações da resposta imune, temporárias, causadas por uma sessão de exercício são conhecidas como resposta aguda ao exercício, uma vez que as modificações provocadas no sistema imunológico em função da prática regular do exercício são conhecidas como resposta crônica ao exercício, sendo este último o foco de análise proposto para o estudo desta dissertação (ROSA et al., 2002; DOS SANTOS et al., 2011; FREITAS et al., 2016).
Na resposta imune celular, o exercício físico atua em diferentes células envolvidas na resposta imune inata, como neutrófilos, macrófagos, células dendríticas, células NK, e na resposta imune adaptativa, que envolve principalmente células T (CD4+ e CD8+) e células B e seus produtos (TERRA et al., 2012).
Diversos elementos estão envolvidos no comportamento dos neutrófilos e na resposta imune ao exercício, como mediadores neuroendócrinos, liberação de esteroides, produção de citocinas e produção de radicais livres. A ativação da fibra muscular aumenta a liberação de cálcio (Ca2+), levando à síntese de citocinas
pró-inflamatórias, como o TNF e IL-1β, que regulam a expressão de selectinas pelas células endoteliais, atraindo neutrófilos para a região, além de promover a degranulação de neutrófilos (BUTTERFIELD et al., 2006; TERRA et al., 2012).
Quanto aos macrófagos, os exercícios aeróbicos prolongados e extenuantes diminuem a expressão de receptores TLRs em sua superfície comprometendo a apresentação de antígenos e modulando o perfil de resposta Th1 pró-inflamatória. Esse efeito anti-inflamatório impede o dano tecidual causado pelos mediadores inflamatórios e reduz o risco de doenças inflamatórias crônicas, pois aumentam sua capacidade microbicida e a produção de citocinas como IFN-γ, TNF e óxido nítrico (NO) (GLEESON et al., 2006; KIZAKI et al., 2008).
As células dendríticas possuem uma importante função na apresentação de antígenos para células T, promovendo sua ativação e expansão clonal. O treinamento de moderada intensidade, durante um período de 5 semanas, é capaz de induzir um aumento na expressão de moléculas MHC II em células dendríticas e produção de citocinas, principalmente a IL-12, sugerindo a capacidade da influência do exercício sobre a modulação da resposta no sistema imune inato (CHIANG et al., 2007).
Já as células NK, linfócitos com citotoxicidade natural para células infectadas por vírus e células tumorais, apresentam grande sensibilidade ao estresse promovido pelo exercício físico, uma vez que a adrenalina e as catecolaminas liberadas durante o treinamento contribuem para o recrutamento de células NK, a partir das paredes endoteliais para a circulação geral promovendo sua redistribuição do sangue periférico para os outros tecidos, sugerindo que a NK pode ser um potencial elo entre a atividade física regular e o estado de saúde geral (TIMMONS e CIESLAK, 2008; BIGLEY e SIMPSON, 2015).
exercício, provavelmente devido ao efeito persistente do cortisol liberado durante o treinamento associado à apoptose celular, uma vez que um percentual maior de apoptose de linfócitos em humanos tem sido descrito imediatamente após a realização de exercícios de alta intensidade (HSU et al., 2002; STEENSBERG et al., 2002; NAVALTA et al., 2007).
Alguns estudos demonstraram que o número absoluto de linfócitos T e de células T CD4+ e a expressão do receptor de IL-2 (IL-2R) em células T aumentou em indivíduos submetidos a exercícios de intensidade moderada (KOHUT e SENCHINA, 2004; SHIMIZU et al., 2008; TERRA et al., 2012). Outros estudos têm confirmado que o exercício físico de moderada intensidade é capaz de aumentar a citotoxicidade das células T CD8+, assim como interferir no switch (mudança) de classe de imunoglobulinas produzidas pelos linfócitos B (WOODS et al., 2003; WITARD et al., 2012).
1.3.2EXERCÍCIO FÍSICO E PRODUÇÃO DE CITOCINAS
Vários autores têm relatado um aumento nas concentrações séricas de citocinas anti-inflamatórias após diferentes tipos de exercício, como o exercício de alta intensidade (SUZUKI et al., 2003), exercício de resistência (HIROSE et al., 2004; NIEMAN et al., 2004), corridas do tipo downhill (MALM et al., 2004), ciclismo intenso (TOFT et al., 2002), corridas e ciclismo de resistência (NIEMAN et al., 2004), e em modelos experimentais murinos de natação (AVILA et al., 2015; BRUGGEMANN et al., 2015). As principais citocinas anti-inflamatórias são IL-10 e TGF-β, as quais podem, entre outras funções, inibir a produção de citocinas pró-inflamatórias como a IL-1, IL-2, IL-12, IL-18, IFN-γ e TNF (SUZUKI et al., 2002; TOFT et al., 2002; PETERSEN e PEDERSEN, 2005; SILVA e MACEDO, 2011).
IL-1 (IL-IL-1ra) e IL-IL-10, além do estímulo à liberação de receptores solúveis para TNF (MOLDOVEANU et al., 2001; PETERSEN e PEDERSEN, 2005).
Já a IL-10 possui como função o bloqueio na apresentação de antígenos pelos macrófagos, a inibição na produção de IL-1β, TNF e quimiocinas pelos macrófagos e linfócitos e, consequentemente, a finalização da resposta inflamatória. Ela é considerada a principal citocina anti-inflamatória secretada em mamíferos, sendo capaz de ser estimulada por diversos mecanismos celulares e pelo exercício físico, através do aumento na produção de Suppressor of cytokine signaling3 (SOCS3) que promove a ativação celular via forkhead box P3 (Foxp3) (PETERSEN e PEDERSEN, 2005; FLYNN et al., 2007).
Outra citocina anti-inflamatória secretada após o exercício físico é a TGF-β. Poucos estudos mensuraram sua produção e relação com atividade física, porém a citocina foi detectada em biopsias de músculo esquelético de atletas submetidos a exercícios de alta intensidade, cuja concentração estava elevada em intervalos de meses de treinamento (GUMUCIO, 2015; BOHM et al., 2016).
O aumento da produção de citocinas anti-inflamatórias durante o exercício possivelmente se dá para restringir reações pró-inflamatórias em resposta ao dano na musculatura esquelética causadas pelo exercício (TOFT et al., 2002), como também para manutenção e melhora do processo inflamatório promovido por diferentes agentes (SUZUKI et al., 2002; SILVA e MACEDO, 2011; PEAKE et al., 2015).
1.3.3EXERCÍCIO FÍSICO E RESPOSTA IMUNE HUMORAL
Durante um processo inflamatório existe o aumento da síntese de anticorpos que buscam inativar o agente causador, seja ele intra ou extracelular. Alguns estudos mostram o aumento dos anticorpos séricos após exercícios de alta intensidade, cuja explicação se baseia no fato de que o volume plasmático que se segue ao exercício é menor (POORTMANS, 1971).
imunoglobulinas, onde foi vista uma diminuição de até 50% dos valores basais em atletas de elite após esforço intenso, relacionando tal achado com maior incidência de infecções de vias aéreas superiores em atletas submetidos a grandes esforços (COSTA ROSA e VAISBERG, 2002).
2 JUSTIFICATIVA
3 HIPÓTESES
Em relação à inflamação pulmonar ocasionada pela exposição experimental em camundongos ao alérgeno recombinante Blo t 5 e o emprego de exercícios físicos, temos como hipóteses:
H0: O condicionamento físico aeróbico, promovido pela natação em moderada
intensidade, não produzirá nenhum efeito sobre a função pulmonar e resposta inflamatória das vias aéreas nos animais expostos ao alérgeno recombinante Blo t 5.
H1: O condicionamento físico aeróbico, promovido pela natação em moderada
4 OBJETIVOS
4.1 OBJETIVO GERAL
Avaliar os efeitos crônicos promovidos pela natação de moderada intensidade sobre parâmetros morfofuncionais e imunológicos em um modelo murino de inflamação pulmonar induzida pelo alérgeno recombinante Blo t 5.
4.2 OBJETIVOS ESPECÍFICOS
1) Avaliar o condicionamento físico dos camundongos submetidos ou não à natação; 2) Caracterizar a função pulmonar e a hiperreatividade das vias aéreas dos camundongos submetidos ou não à natação;
3) Realizar a contagem total e diferencial de células no lavado broncoalveolar (BALF) dos camundongos dos diferentes grupos;
5 MATERIAL E MÉTODOS
5.1 PRODUÇÃO DO ALÉRGENO RECOMBINANTE Blo t 5
A produção, expressão e purificação do alérgeno recombinante Blo t 5 (rBlo t 5) foi realizada seguindo os passos descritos por CARVALHO et al. (2013), conforme descrito a seguir.
5.1.1SELEÇÃO DA SEQUÊNCIA GÊNICA DO ALÉRGENO BLO T 5
A seleção da sequência gênica codificante do alérgeno Blo t 5, proveniente do ácaro da poeira domiciliar Blomia tropicalis, foi realizada utilizando os dados armazenados nos bancos de genes do Pubmed (https://www.ncbi.nlm.nih.gov/), cujo código de acesso é U59102. O gene do alérgeno em questão apresenta uma sequência de 537 pares de bases e codifica um produto proteico de 134 aminoácidos, como mostra a Figura 3, com destaque na cor vermelha a sequência codificante utilizada para produção do construto recombinante.
Figura 3 – Sequência gênica do alérgeno Blo t 5. A figura mostra a sequência gênica do alérgeno Blo t 5 do ácaro Blomia tropicalis (GenBank: U59102) composta por 537 pb, cujas sequências nas cores vermelhas destacam os 134 aminoácidos que codificam o gene utilizado na produção do construto recombinante.
5.1.2CONSTRUÇÃO DO VETOR DE EXPRESSÃO PET28A
produzidos pela empresa GenScript (New Jersey, E.U.A.) e adquiridos pelo Laboratório de Alergia e Imunologia Clínica da UFU.
Então, os primers foram submetidos à amplificação gênica através da Reação em Cadeia da Polimerase (PCR), as sequências sintéticas foram ligadas ao vetor pUC57 e sub-clonadas no vetor de expressão pET28a (Millipore, Massachusetts, U.S.A.), utilizando as enzimas de restrição BamHI/XhoI. Este processo foi realizado com o intuito de inserir nos construtos uma cauda de histidina, aminoácido com afinidade pela molécula de níquel, para auxiliar no processo de purificação do alérgeno recombinante.
5.1.3PRODUÇÃO DE CÉLULAS BACTERIANAS COMPETENTES
A produção de células bacterianas competentes para transformação e posteriormente expressão do alérgeno recombinante rBlo t 5 foi realizada com bactérias Escherichia coli. Para transformação, foi realizado um pré-inóculo de E. coli da cepa BL21 (Novagen, E.U.A.), previamente crescida por 18 horas, em meio de crescimento bacteriano Caldo Luria Bertani Broth (LB Broth) contendo 10 g/L de tryptone, 5 g/L de extrato de levedura e 5 g/L de cloreto de sódio (NaCl) (Sigma-Aldrich, E.U.A.), sendo incubadas overnight em estufa (37°C, 5% CO2).
Após incubação, 250 µL do pré-inóculo foram transferidos para 25 mL de meio LB Broth, mantidos em incubação sob agitação (180 rpm, 37°C) até atingirem a densidade óptica (DO) 0.3, mensurada no espectrofotômetro (BioTek, E.U.A.) sob comprimento de onda de 600 nm. Então, os tubos foram centrifugados (3000xg por 15 minutos), o sobrenadante foi descartado e o pellet formado foi ressuspenso em 5 mL de solução de cloreto de cálcio (CaCl2) a 50 mM sob suave agitação do tubo.
5.1.4REAÇÃO DE TRANSFORMAÇÃO DA E. COLI BL21 COM PET28A-RBLO T 5
Para transformação das bactérias competentes foi realizada a incubação de 20 µL da suspensão celular, cuja DO lida no espectrofotômetro fosse igual 0.6, com 20 ng do vetor de expressão pET28a-rBlo t 5, no gelo durante 5 minutos. Após esse período foi realizado o choque térmico nas suspensões, que consiste em manter as suspensões bacterianas durante 3 minutos em banho-maria à 42°C e subsequente banho de gelo por 10 minutos, para afastamento das células da membrana externa da bactéria com o intuito de internalizar o vetor de expressão.
Após o choque térmico, foram adicionadas as suspensões 250 µL de meio SOC (0,5% de extrato de levedura, 2% de tryptone, glicose a 20 mM, NaCl a 10 mM, cloreto de potássio a 2,5 mM, cloreto de magnésio a 10 mM e sulfato de magnésio a 10 mM) (Quiagen, E.U.A.) e a reação foi incubada durante 1 hora sob agitação orbital (180 rpm, 37°C).
Ao término do período de incubação, diferentes volumes da suspensão bacteriana (10 µL, 15 µL, 25 µL, 50 µL, 150 µL) foram distribuídos em placas de Petri contendo meio de crescimento bacteriano LB Ágar (10 g/L de peptone 140, 5 g/L de extrato de leveduras, 5 g/L de NaCl e 12 g/L de Ágar) e 10 µg/mL de Ampicilina (Sigma-Aldrich, E.U.A.), e incubadas em estufa (18 horas à 37°C). As colônias transformadas foram aquelas capazes de crescerem nesse meio seletivo, assim, elas foram coletadas e armazenadas à -20°C em meio LB Broth contendo 10 µg/mL de Ampicilina e glicerol (v/v).
5.1.5INDUÇÃO DA EXPRESSÃO DO ALÉRGENO RBLO T 5 EM E. COLI BL21
No dia seguinte, foi realizada a leitura da DO da suspensão pelo espectrofotômetro (DO = 0,4), o volume total do erlenmeyer foi transferido para outro erlenmeyer contendo 1 L de meio LB Broth e kanamicina, e esta nova suspensão foi mantida sob agitação (180 rpm, 37°C) por 18 horas, onde atingiu a DO de 0,6 indicada para o processo de indução.
Antes da indução, uma amostra de 10 mL foi coletada e armazenada à -20°C, servindo para futuras análises eletroforéticas como controle negativo do processo de indução. Então, foram adicionados à suspensão Isopropyl β -D-1-thiogalactopyranoside (IPTG) a 0,2 mM (Sigma-Aldrich, E.U.A.) e incubou-se por 5 horas sobre agitação (180 rpm, 37°C).
Passadas as 5 horas, uma amostra de 10 mL foi coletada e armazenada à -20°C, servindo para futuras análises eletroforéticas como controle positivo do processo de indução. Continuamente, a suspensão foi dividida em tubos falcon de 50 mL e centrifugadas (3000xg por 10 minutos), o sobrenadante foi descartado e o pellet contendo as bactérias armazenado à -80°C até o processo de purificação do alérgeno recombinante rBlo t 5.
5.1.6PURIFICAÇÃO DO ALÉRGENO RBLO T 5
Para purificação do alérgeno recombinante foi utilizada a técnica de cromatografia de afinidade com resina de Níquel-Agarose (Ni-NTA Agarose) (GE Healthcare, Little Chalfont, UK), uma vez que o alérgeno possui uma cauda de histidina que tem afinidade pelo Níquel.
A coluna de Níquel foi montada em um suporte, lavada com 25 mL de água ultrapura (MiliQ), então foi injetado nela 25 mL do tampão de equilíbrio (TrisHCl a 50 mM, NaCl a 500 mM, TritonX a 0,2%, Imidazol a 10mM e MiliQ) utilizado para reequilibrar os íons presentes na coluna. Após esta etapa foi realizada a preparação das bactérias para coleta do material contendo o rBlo t 5 que seria purificado pela coluna.
Sacarose a 200 mM, TritonX a 0,2%, Imidazol a 10mM) na razão de 3 mL de tampão para 1 g de pellet, até a solução ficar homogênea. Então acrescentou-se 15 mg de Lisozima (Sigma-Aldrich, E.U.A.), homogeneizou-se bem e incubou-se por 15 minutos no gelo. Após incubação foram realizados os ciclos de criólise, onde as amostras foram colocadas no nitrogênio líquido e depois em banho-maria à 37°C até descongelar, sendo cada etapa repetida 10 vezes.
Após a criólise, a solução foi incubada no gelo e submetida à sonicação (SONOPLUS Ultrasonic Homogenizers, Bandelin), compostos de 10 ciclos de 30 segundos à 50 W, para rompimento das células e dos corpos de inclusão, liberando o alérgeno recombinante. Então, a solução foi centrifugada à 10.000xg por 10 minutos e, em seguida, o sobrenadante foi coletado e o sedimento descartado.
O sobrenadante coletado foi filtrado em filtros para seringas de 0,22 µm (Millipore, Massachusetts, U.S.A.) e injetados na coluna após a passagem de todo o tampão de equilíbrio. Logo após a passagem do sobrenadante na coluna foi realizado novamente a passagem de 25 mL do tampão de equilíbrio.
Em seguida, foram injetados na coluna 25 mL do primeiro tampão de eluição (Tris-HCl a 50 mM e Imidazol a 75 mM), sendo todo o volume coletado para posterior quantificação proteica. Na sequência, foram injetados 25 mL do segundo tampão de eluição (Tris-HCl a 50 mM e Imidazol a 250 mM), cujas amostras eluídas foram coletadas para quantificação proteica. Após esse processo a coluna foi lavada novamente com 50 mL de MiliQ e então foram injetados 50 mL do tampão de regeneração (Tris-HCl a 500 mM, NaCl a 1 M e Imidazol a 500 mM). Para armazenamento da coluna foram injetados 15 mL de etanol a 25%.
5.2 ANIMAIS
Foram utilizados no estudo 24 camundongos estéreis, da linhagem BALB/c, fêmeas, com idade de 6 a 8 semanas, provenientes do Centro de Bioterismo e Experimentação Animal da UFU. Eles foram mantidos em um ambiente com temperatura e umidade controladas, alimentação ad-libitum, em ciclo de claro-escuro de 12 horas. Todos os experimentos propostos para este estudo foram aprovados Comitê de Ética na Utilização de Animais (CEUA) da UFU, sob protocolo CEUA 048/17 (Anexo 1).
Os camundongos foram divididos em 4 grupos: grupo Controle: não expostos à rBlo t 5 e não treinados; grupo TA: não expostos à rBlo t 5 e treinados; grupo rBLOT5: expostos à rBlo t 5 e não treinados; e grupo rBLOT5-TA: expostos à rBlo t 5 e treinados.
5.3 PROTOCOLO DE EXPOSIÇÃO AO ALÉRGENO rBlo t 5
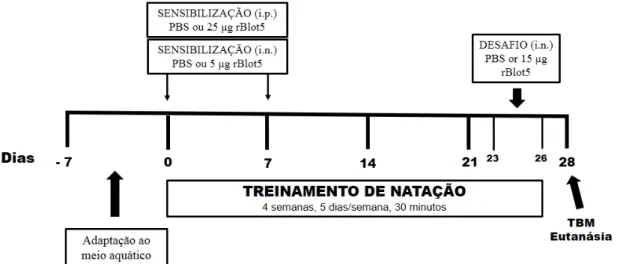
O protocolo de exposição dos camundongos à rBlo t 5 foi realizado em diferentes intervalos de tempo e através de diferentes vias de exposição, com base em protocolos já descritos (REDDY et al., 2012; ABBRING, SUZANNE et al., 2017; HASPESLAGH et al., 2017), sendo o design experimental ilustrado na Figura 4.
Nos dias 0 e 7, os camundongos dos grupos rBLOT5 e rBLOT5-TA foram sensibilizados, por via intraperitoneal (i.p.), com 100 µL de uma solução composta por 25 µg de rBlo t 5 associadas a 2 mg de hidróxido de alumínio adsorvidos em tampão fosfato-salino (PBS), enquanto que os animais dos demais grupos foram sensibilizados via i.p. com 100 µL de PBS.
aspiração e distribuição pulmonar adequadas sem oferecer riscos de afogamento aos animais (SOUTHAM et al., 2002). Os animais dos grupos Controle e TA receberam instilações nasais com 40 µL de PBS.
Posteriormente, entre os dias 23 e 26 foram realizados os desafios antigênicos. Para isso, os camundongos foram anestesiados, conforme descrito anteriormente, e realizadas instilações nasais de 15 µg de rBlo t 5 dissolvidas em 40 µL de PBS nos animais dos grupos rBLOT5 e rBLOT5-TA, enquanto que nos animais dos demais grupos foram realizadas instilações nasais com 40 µL de PBS.
Figura 4 - Design experimental. O protocolo de exposição ao rBlo t 5 e o protocolo de treinamento da natação estão ilustrados no esquema acima. A adaptação ao meio aquático foi iniciada no dia -7, o treinamento de natação ocorreu no dia 0 a 26 do experimento. As exposições antigênicas (i.p. e i.n.) ocorreram aos 0 e 7 dias concomitante ao protocolo de natação, bem como os desafios i.n aconteceram do 23º ao 26º dia. Após 48 horas da última instilação nasal, os animais foram submetidos ao TBM (Teste de Broncoprovocação com Metacolina) e depois foram eutanasiados.
5.4 PROTOCOLO DE TREINAMENTO
5.4.1ADAPTAÇÃO AO AMBIENTE AQUÁTICO
Para adaptação ao ambiente aquático, os camundongos dos grupos TA e rBLOT5-TA foram colocados no aquário dos dias -7 até o dia -5, em intervalos crescentes de tempo, que variaram de 10 minutos (dia -7) até 30 minutos (dia -5), com aumento progressivo da carga de treinamento presa a cauda, que variaram de 0 (dia -7), 2% (dia -6) até 10% (dia -5) do peso corporal total do animal.
5.4.2TESTE PROGRESSIVO DE CARGA
Para avaliação da capacidade funcional os camundongos foram submetidos ao Teste Progressivo de Carga (TPC) ao final de cada semana de treinamento. Os animais dos grupos TA e rBLOT5-TA foram colocados individualmente em uma raia do aquário, com uma sobrecarga de 2% do peso corporal preso à cauda e a cada três minutos foram acrescentados mais 2% do peso corporal, sem interrupção do exercício até o momento de exaustão (ALMEIDA et al., 2009; KIM et al., 2014; BRUGGEMANN et al., 2015).
A exaustão foi caracterizada pela imersão do animal de cinco a sete segundos sem que o mesmo retornasse à superfície quando então o camundongo foi retirado da raia, secado com o auxílio de uma toalha e colocado novamente na gaiola.
5.4.3NATAÇÃO COM INTENSIDADE MODERADA DE TREINAMENTO
Para definição da intensidade de treinamento foi realizado um teste piloto, de acordo com a metodologia do treinamento proposta abaixo e mensurados os níveis de lactato sérico conforme descrito no item 4.5. A literatura afirma que se a diferença de produção de lactato entre o 10º e 30º minuto após a sessão de treinamento for menor do que 1 mmol/L define tal intensidade do treinamento como moderada (AVILA
Após adaptação ao ambiente aquático e a realização do TPC, os camundongos dos grupos TA e rBLOT5-TA foram então submetidos a sessões de natação com intensidade moderada de treinamento, sendo utilizado o protocolo baseado em estudos prévios disponíveis na literatura cientifica (ALMEIDA et al., 2009; CECHELLA et al., 2014; KIM et al., 2014; BRUGGEMANN et al., 2015).
O treinamento, como mostra a figura 2, foi realizado durante 4 semanas, 5 dias por semana, com sessões de treinamento de 30 minutos, onde o camundongo treinava com uma carga acoplada à base da cauda equivalente a 50% da carga máxima no TPC. Os animais dos grupos Controle e rBLOT5 foram mantidos durante o mesmo intervalo de tempo e sem adição de carga em outro tanque com 2 cm de água na mesma temperatura que a da piscina dos animais treinados. Após o término da sessão de treinamento, os camundongos foram retirados do aquário e do tanque, secados com o auxílio de uma toalha e colocados novamente em suas respectivas gaiolas.
5.5 MENSURAÇÃO DOS NÍVEIS DE LACTATO SANGUÍNEO
A intensidade do treinamento da natação foi determinada através da mensuração dos níveis de lactato secretados após as sessões de treinamento (AVILA
et al., 2015; BRUGGEMANN et al., 2015). Para isso, foram coletados 20 µL de sangue de uma secção realizada na cauda dos camundongos ao 10° e 30° minutos após a última sessão semanal de treinamento dos animais dos grupos TA e rBLOT5-TA. Para comparação, os animais dos grupos Controle e rBLOT5 foram submetidos a uma sessão de treinamento nos mesmos dias e então amostras de sangue foram coletadas conforme descrito para os animais dos outros grupos.
Para o blank utilizou-se 10 µL de MiliQ e 1 mL do reagente de trabalho fornecido pelo Kit, para o Padrão utilizou-se 10 µL da solução Padrão e 1 mL do reagente de trabalho, e para as amostras utilizou-se 10 µL do plasma de cada amostra e 1 mL do reagente de trabalho. Então os microtubos foram colocados em banho-maria à 37°C durante 5 minutos e foi realizada a leitura das absorbâncias pelo espectrofotômetro no comprimento de onda de 550 nm.
As concentrações de lactato, em mg/dL, presentes nas amostras foram determinadas pelo cálculo realizado através da fórmula: Absorbância da amostra/Absorbância do padrão x 40. Para conversão dos valores em Unidades Internacionais (mmol/L), foi realizada a multiplicação dos valores em mg/dL por 0,111.
5.6 ANÁLISE DA FUNÇÃO RESPIRATÓRIA
A função respiratória dos camundongos foi avaliada através da técnica de espirometria, cujos parâmetros analisados foram o volume corrente, a frequência respiratória e o volume-minuto dos animais. Esses dados foram obtidos sob condições basais e também após o Teste de Broncoprovocação com Metacolina (TBM). Sendo este teste utilizado no diagnóstico e na quantificação da hiperreatividade brônquica.
No 28º dia, os camundongos foram anestesiados, conforme descrito no item 4.3, alocados no espirômetro, que possui uma câmara hermética conectada a um nebulizador e um sensor espirométrico (SpirometerFE141, ADInstruments, Sydney, Austrália), e os dados foram mensurados durante 5 minutos para obtenção dos dados basais.
5.7 COLETA E PROCESSAMENTO DO LAVADO BRONCOALVEOLAR
Após a análise da função pulmonar, os camundongos foram eutanasiados através da inoculação via i.p. de uma dose letal de Pentobarbital (Nembutal™, Ceva Santé Animale, Holanda, 600 mg/kg). Em seguida foi realizada uma incisão medial na região ventral do pescoço do animal para acesso cirúrgico da traqueia, foi inserida uma cânula (PE-250, Critchley, Austrália), com auxílio de um microscópio cirúrgico (DF Vasconcellos, modelo MC-M1232), para a manutenção pérvia das vias aéreas. Então para coleta do fluido de lavagem broncoalveolar (BALF) foram realizadas duas aspirações manuais suaves após inoculação de 700 μL de PBS-EDTA gelado a 0,05 mM (VERHEIJDEN et al., 2015; ABBRING, S. et al., 2017)
O BALF foi centrifugado (400xg, 6 min) e o sobrenadante foi colhido e congelado a -80ºC até análise posterior e o sedimento celular foi ressuspenso em 1 mL de PBS-EDTA a 0,05 mM para contagem das células. A contagem de células totais foi realizada na câmara de Neubauer (BOECO, Alemanha) utilizando a solução Azul de Tripano a 0,4% (Sigma-Aldrich, U.S.A.), enquanto que a contagem diferencial das células foi realizada em lâminas de microscopia após a coloração pelo método de May Grünwald-Giemsa (Bioclin/Quibasa, Brasil). Os tipos celulares observados ao microscópio óptico foram expressos em percentagem, após a contagem de 100 células (RODRIGUES et al., 2012).
5.8 DETECÇÃO DE ANTICORPOS NO BALF
Para detecção e quantificação de anticorpos das classes IgE, IgG e suas subclasses IgG1 e IgG2a no BALF foram realizados ensaios imunoenzimátios (ELISA), sendo o ELISA sanduiche para IgE total e o ELISA indireto para IgG e suas subclasses, conforme descrito por Miranda et al. (2011), com algumas modificações.
U.S.A.) foram sensibilizadas com 1 µL/poço do anticorpo anti-IgE de camundongo produzido em cabras diluído em tampão carbonato-bicabornato 0,05 M e pH 9,6 (100 µL/poço) e mantidas em temperatura ambiente por 1 hora. Então as placas foram lavadas com tampão de lavagem (Tris a 50 mM, Nacl a 0,14 mM, Tween 20 a 0,05%) e bloqueadas por 30 minutos em temperatura ambiente com 200 µL/poço de tampão de bloqueio (Tris a 50 mM, Nacl a 0,14 mM, soro albumina bovina a 1%).
Após o bloqueio as placas foram lavadas novamente e incubadas com 50 µL/poço das amostras de BALF puras e 50 µL/poço das amostras da curva de diluição seriada do padrão de IgE (250 ng/mL, 125 ng/mL, 62.5 ng/mL, 31.25 ng/mL, 15.62 ng/mL, 7.8 ng/mL, 3.9 ng/mL, 0 ng/mL) por 1 hora em temperatura ambiente. Após 1 hora, as placas foram lavadas e em seguida, adicionou-se o anticorpo de detecção conjugado com peroxidase diluído na solução de bloqueio em 1:75.000 e elas foram incubadas em temperatura ambiente por mais 1 hora. Na sequência as placas foram lavadas e a reação revelada com o substrato enzimático TMB, utilizando o ácido sulfúrico à 0.18 M como solução de parada. Então foi realizada a leitura da DO no espectrofotômetro sob cumprimento de onda de 450 nm e a quantificação de IgE foi realizada no software Microplate Manager® (BioRad Laboratories, E.U.A.) utilizando a curva de diluição seriada do padrão como valores de referência.
Para detecção de IgG específica ao alérgeno rBlo t 5 no BALF, as placas foram sensibilizadas com 3 µg/poço de rBlo t 5 diluído em tampão carbonato-bicabornato 0,06 M e pH 9,6 e mantidas overnight à 4ºC. No dia seguinte, elas foram lavadas com PBS-Tween 20 (PBS-T) e os sítios inespecíficos de ligação dos poços foram bloqueados com 150 µL/poço de PBS-T-Molico (PBS-TM) a 5% por 1 hora em temperatura ambiente. Então a placa foi lavada novamente com PBS-T e as amostras foram aplicadas em duplicatas (50 µL/poço) diluídas em PBS-TM, na diluição de 1:50, e incubadas por 1 hora à 37°C.
Para detecção das subclasses IgG1 e IgG2a específicas ao alérgeno rBlo t 5 no BALF, o ELISA realizado seguiu basicamente as mesmas etapas realizadas para detecção de IgG, no entanto, para a realização do bloqueio e como diluente das etapas subsequentes foi utilizado o PBS-TM à 1%, as amostras de soro foram diluídas 1:10 e ficaram incubadas por 2 horas, os anticorpos primários utilizados foram o anti-IgG1 de camundongo produzido em cabras e o anti-IgG2a de camundongo produzido em cabras, ambos na diluição de 1:250, e o anticorpo secundário utilizado foi o IgG de coelho anti-IgG de cabra conjugado com peroxidase, na diluição de 1:1000 (Sigma-Aldrich, E.U.A.) com incubação por 1 hora à 37ºC.
Os resultados foram expressos em Índice ELISA (I.E.), calculados de acordo com a seguinte fórmula:
onde DO significa média da densidade óptica da amostra testada (positivas e controles negativos), δ significa desvio-padrão das densidades ópticas das amostras do controle negativo. Os valores de I.E. maiores do que 1,2 foram considerados positivos para presença dos anticorpos.
Após a análise dos dados individuais, foi calculado a razão da produção de IgG1 por IgG2a (IgG1/IgG2a) para avaliar o perfil de polarização da resposta imune humoral dos camundongos submetidos ao treinamento da natação.
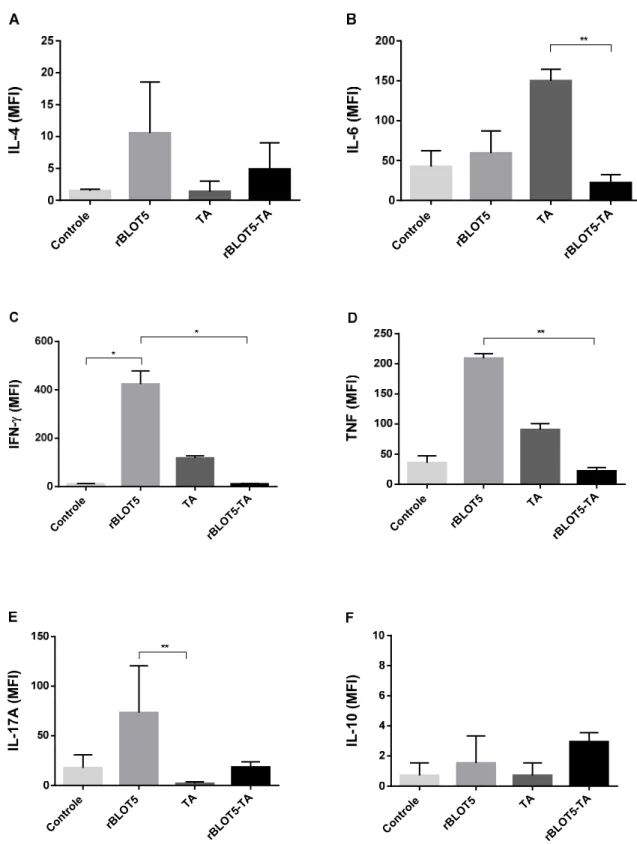
5.9 DETECÇÃO DE CITOCINAS NO BALF
A produção de citocinas de perfil Th1 (IL-6, IFN-γ e TNF), Th2 (IL-4 e IL-10) e Th17 (IL-17A) foram mensuradas no BALF através da técnica de Cytometric Bead
A seguir, foram adicionados nas amostras 50 µL do anticorpo de detecção conjugado com Ficoeritrina (PE) e os tubos incubados por 2 horas na ausência completa de luz. Após este período, adicionou-se 1mL do tampão de lavagem e as amostras foram centrifugadas (200 g por 5 minutos). Os sedimentos contendo as beads foram ressuspendidos em 300 μL do mesmo tampão de lavagem e as amostras foram submetidas à análise no citômetro de fluxo (BD FACSAria III™, BD Pharmingen, U.S.A.).
Os dados obtidos foram analisados pelo software FCAP Array versão 1.0.1 (BD Pharmingen, E.U.A.), levando em consideração os limites de detecção de cada citocina através da fluorescência emitida pela bead. Os dados analisados foram expressos em Intensidade Média de Fluorescência (MFI).
5.10 ANÁLISE ESTATÍSTICA
A análise estatística foi realizada utilizando o software GraphPad Prism 6 (San Diego, CA, EUA) onde a normalidade dos dados foi avaliada pelo teste de Kolmogorov-Smirnov. Os dados com distribuição paramétrica foram avaliados pelo teste de Análise de Variância (ANOVA), seguidos pelos testes de comparação múltipla para comparação entre grupos, sendo o pós-teste de Tukey para análise dos dados da função respiratória basal, do número total de células no BALF e da produção da imunoglobulina IgG; o pós-teste de Bonferroni para os dados do TBM, o pós-teste de Hom-Sidak para os dados referentes a proporção relativa de leucócitos no BALF, o pós-teste de Sidak para os dados referentes a produção das imunoglobulinas IgG1 e IgG2a.
6 RESULTADOS
6.1 INFLUÊNCIA DA CARGA DE TREINAMENTO NO CONDICIONAMENTO FÍSICO DOS CAMUNDONGOS
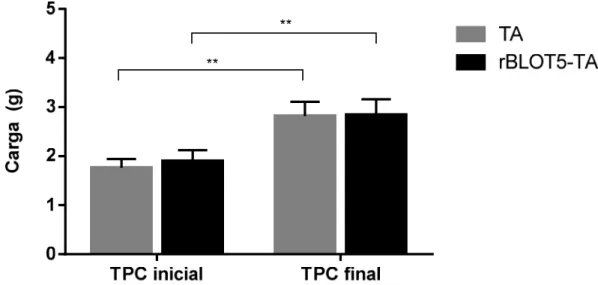
Para manutenção da carga de treinamento foram realizados semanalmente, no sexto dia de cada semana de treinamento, o Teste Progressivo de Carga (TPC) nos animais dos grupos TA e rBLOT5-TA. O treinamento através da natação promoveu uma melhora do condicionamento físico dos camundongos dos grupos TA e rBLOT5-TA, uma vez que houve um aumento significativo das cargas suportadas no TPC quando comparados os testes realizados na primeira e na última semana de treinamento, como mostra a Figura 5.
6.2 INFLUÊNCIA DA NATAÇÃO NOS NÍVEIS DE LACTATO PLASMÁTICOS
Os níveis de lactato plasmáticos foram mensurados no 10º e 30º minutos após a última sessão de treinamento da primeira e da quarta semana, com o intuito de se avaliar a intensidade de treinamento, sendo que o aumento inferior a 1 mmol/L entre os períodos analisados confere ao treinamento uma intensidade moderada.
A tabela 1 mostra os valores mensurados dos níveis de lactato plasmáticos nos períodos descritos. Os dados mostram uma pequena alteração, não significativa, dos níveis de lactato nos grupos TA e rBLOT5-TA na quarta semana em relação a primeira semana, onde o grupo que apresenta a inflamação pulmonar submetido a natação apresentou os maiores níveis de lactato. Os animais do grupo rBLOT5 apresentaram maiores níveis de produção de lactato após a sessão de treinamento em relação ao grupo Controle mesmo sem serem submetidos a sessões semanais de treinamento.
Tabela 1. Níveis de lactato plasmáticos. Os valores (média ± DP) da concentração de lactato no sangue são expressos em mmol/L medidos no quinto dia após a sessão de treino na primeira (1ª semana) e na última semana (4ª semana). ≠ Os animais dos grupos Controle e rBLOT5 foram submetidos ao protocolo de exercício apenas nos dias da coleta de sangue para análise das concentrações de lactato. § A coleta de sangue dos grupos TA e rBLOT5-TA foi realizada após o quinto dia da sessão de treino semanal.
Tempo Grupos
Controle≠ rBLOT5≠ TA§ rBLOT5-TA§
1ª semana 10° min 2,34 ± 0,43 3,12 ± 0,54 3,94 ± 1,03 4,06 ± 1,00 30ºmin 3,11 ± 0,89 4,10 ± 0,39 4,15 ± 0,99 5,58 ± 0,49 4ª semana 10º min 2,89 ± 0,66 3,77 ± 0,43 4,01 ± 1,10 4,97 ± 0,35 30ºmin 3,55 ± 0,71 4,13 ± 0,74 4,99 ± 0,76 5,23 ± 0,82
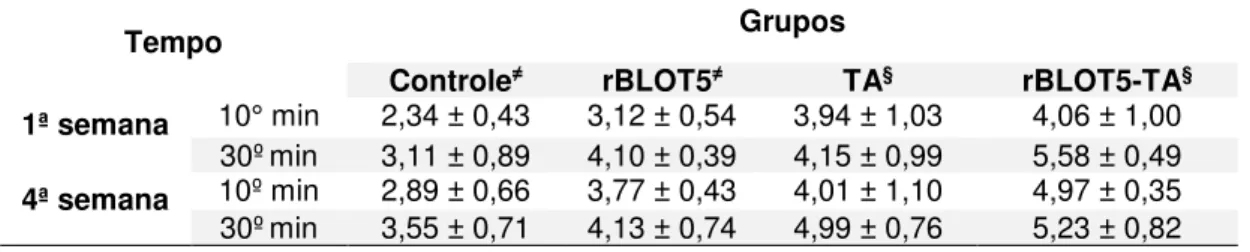
6.3 INFLUÊNCIA DA NATAÇÃO NAS ALTERAÇÕES DA FUNÇÃO PULMONAR INDUZIDAS PELA INFLAMAÇÃO
6B) e o volume-minuto, resultado da multiplicação dos dois primeiros parâmetros (Fig. 6C).
Figura 6 – Função respiratória basal. Função respiratória basal dos animais dos grupos experimentais mensurados através da espirometria no 28º dia. A Fig. 6A mostra os dados referentes ao volume corrente mobilizado pelos animais durante o ciclo respiratório, a Fig. 6B mostra os dados referentes a frequência respiratória dos animais, enquanto a Fig. 6C mostra o volume-minuto obtido pela multiplicação do volume corrente pela frequência respiratória. Os valores são expressos como média ± DP. As diferenças estatisticamente significantes foram determinadas pelo teste One-way ANOVA com teste de comparações múltiplas de Tukey. *p<0,05; **p<0,01; ***p<0,001; ****p<0,0001.
Contr ole
rBLO
T5 TA
rBLO T5-TA
Contr ole
rBLO
T5 TA
rBLO T5-TA
Contr ole
rBLO
T5 TA
6.4 INFLUÊNCIA DA NATAÇÃO SOBRE A HIPERREATIVIDADE DAS VIAS AÉREAS
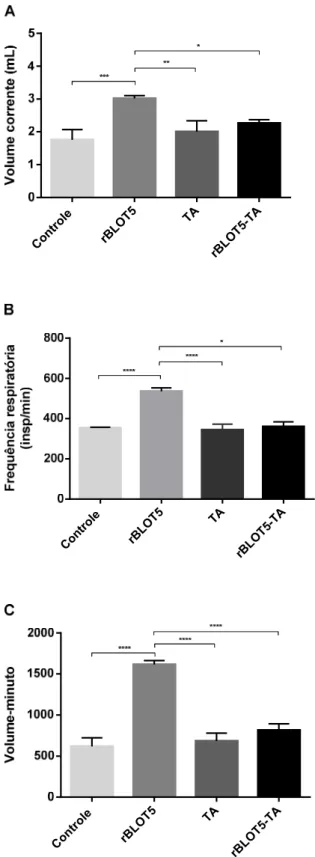
Para análise da hiperreatividade das vias aéreas dos camundongos foi realizado o Teste de Broncoprovocação com Metacolina (TBM), onde os animais foram nebulizados com doses crescentes de Metacolina (6.25, 12.5, 25 e 50 mg/mL) e então avaliado o volume corrente mobilizado por eles durante um período de 6 minutos pela técnica de espirometria.
A Figura 7 mostra que o parâmetro volume corrente não responde as pequenas concentrações de Metacolina em todos os grupos experimentais. Contudo, após a exposição a doses maiores do broncoconstritor, como 25 e 50 mg/mL, houve um aumento significativo do volume corrente no grupo rBLOT5, enquanto que no grupo rBLOT5-TA houve uma diminuição significativa deste parâmetro após a inalação de 50 mg/mL de Metacolina.
6.5 INFLUÊNCIA DA NATAÇÃO NO INFILTRADO CELULAR NOS PULMÕES
Para análise do infiltrado celular nas vias aéreas dos camundongos foi realizada a contagem total e contagem diferencial (porcentagem relativa de leucócitos) das células coletadas no BALF, com técnicas específicas para tais fins.
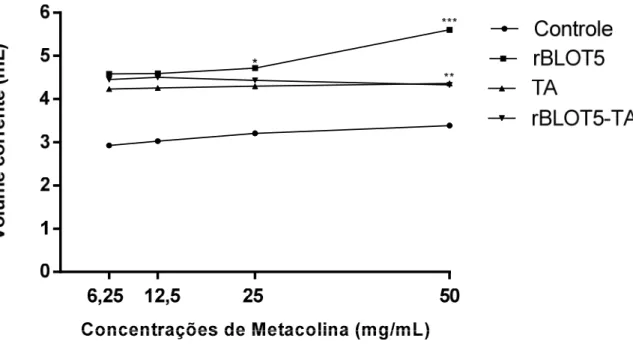
Em relação a contagem total de células (Fig. 8A), houve uma redução significativa do número de células no BALF dos animais do grupo rBLOT5-TA em relação ao grupo rBLOT5. Além disso, observou-se também que o BALF dos camundongos do grupo rBLOT5 apresentou uma quantidade de células significativamente maior quando comparado com os grupos Controle e TA.
Figura 8 - Contagem de células no BALF. Número total de células do BALF nos diferentes grupos de estudo está representado na Fig. 8A. Os valores estão expressos como média ± DP. As diferenças estatisticamente significantes foram determinadas pelo teste One-way ANOVA com teste de comparações múltiplas de Tukey. A contagem diferencial das células do BALF dos grupos rBLOT5 e rBLOT5-TA está ilustrada na Fig. 8B. Os valores são expressos como média ± DP da proporção relativa de leucócitos. A análise estatística foi realizada através do Two-way ANOVA com o teste de comparações múltiplas de Holm-Sidak. *p<0,05; **p<0,01; p<0,0001.