Avaliação do desempenho do programa de eliminação da hanseníase na atenção básica/PSF no Brasil : (2006 - 2007)
Texto
(2) UNIVERSIDADE DE BRASÍLIA – UnB FACULDADE DE CIENCIAS DA SAÚDE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE. AVALIAÇÃO DO DESEMPENHO DO PROGRAMA DE ELIMINAÇÃO DA HANSENÍASE NA ATENÇÃO BÁSICA/PSF NO BRASIL (2006 – 2007). Dissertação apresentada como requisito parcial para obtenção doTitulo de Mestre em Ciências da Saúde pelo Programa de Pós-Graduação em Ciências da Saúde da Universidade de Brasília.. Orientador: Dr. Edgar Merchan Hamann. BRASÍLIA, 2009. 2.
(3) ALEXSANDRO C. DIAS. AVALIAÇÃO DO DESEMPENHO DO PROGRAMA DE ELIMINAÇÃO DA HANSENÍASE NA ATENÇÃO BÁSICA/PSF NO BRASIL (2006 – 2007) .. Dissertação apresentada como requisito parcial para obtenção doTitulo de Mestre em Ciências da Saúde pelo Programa de Pós-Graduação em Ciências da Saúde da Universidade de Brasília. Aprovada em 16 de setembro de 2009. BANCA EXAMINADORA. Prof. Dr. Edgar Merchan Hamann Faculdade de Ciencias da Saúde - FCS/UnB. Prfª Drª Margarita Urdaneta Gutierrez Universidade de Brasilia - UnB. Prof. Dr. Pedro Luiz Tauil Faculdade de Medicina – FM/UnB. 3.
(4) FICHA CATALOGRAFICA. Dias, Alexsandro C. Avaliação do desempenho do Programa de Eliminação da hanseníase na Atenção Básica/PSF no Brasil (2006 – 2007). 112 p.: il.: 30cm. Dissertação de Mestrado, apresentada a Faculdade de Ciências da Saúde da Universidade de Brasília – UnB – Área de Concentração: Epidemiologia, Saúde e Educação. Orientador: Hamann, Edgar Merchan 1 – Hanseníase. 2 –Atenção Básica. 3 – Operacionalização.. 4.
(5) A todos e todas que com sua luz ajudaram a iluminar os meus caminhos.. 5.
(6) AGRADECIMENTOS. Agradeço ao Prof. Dr. Edgar Merchan Hamann pela oportunidade de desenvolver este trabalho no Programa de Pós-graduação em Ciências da Saúde e pelas valiosas contribuições na minha formação acadêmica ao longo desse período. Agradeço, também, por ter acolhido este projeto de pesquisa no Núcleo de Estudos em Saúde Pública da Universidade de Brasília- NESP/UnB, pois sem o qual a sua execução não seria possível. Aprendi muito nesses anos de convivência e sua presença constante em todas as etapas deste trabalho foi decisiva para esta conquista. Agradeço pelo apoio e incentivo aos pesquisadores e aos funcionários do NESP/UnB em especial a Profª. Dra. Maria Fátima de Sousa e a funcionária Expedita Machado de Sousa que com sua competência e dedicação contribuiu para a viabilização técnica desse estudo. Agradeço também a Profª. Msc. Vera Rejane Nascimento Gregório pelo carinho e dedicação e por ter me iniciado no campo da pesquisa e em especial no estudo da Hanseníase, ainda na Universidade de Pernambuco. Agradeço ao Programa Nacional de Eliminação da Hanseníase pela confiança e credibilidade em nós depositada, e igualmente agradeço aos colegas que participaram do processo de coleta de dados nas cinco regiões desse país, pois sem a dedicação dos mesmos não teríamos desenvolvido este trabalho. Agradeço, finalmente, a minha família e amigos pelos momentos furtados de nossa convivência para viabilizar o projeto de mestrado. Obrigado por todo apoio e dedicação.. 6.
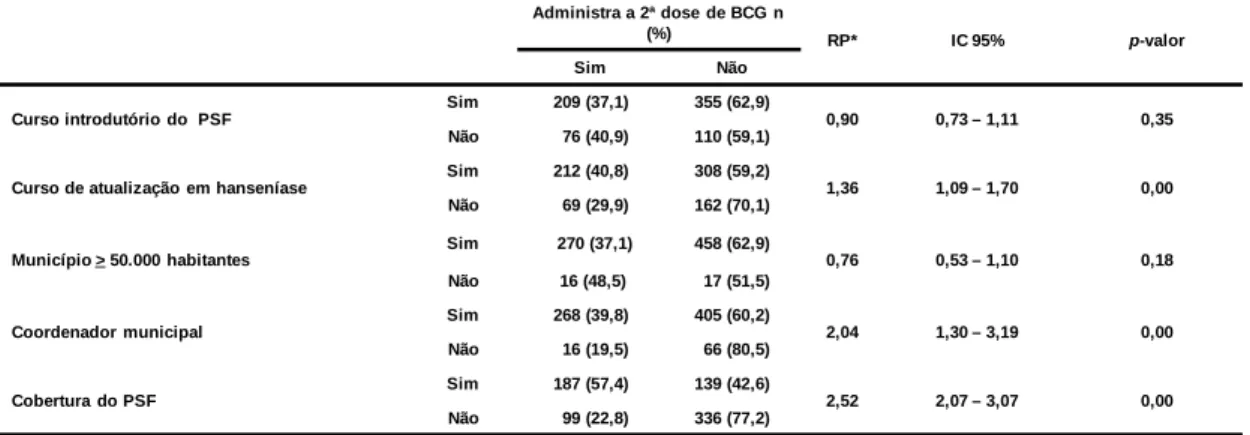
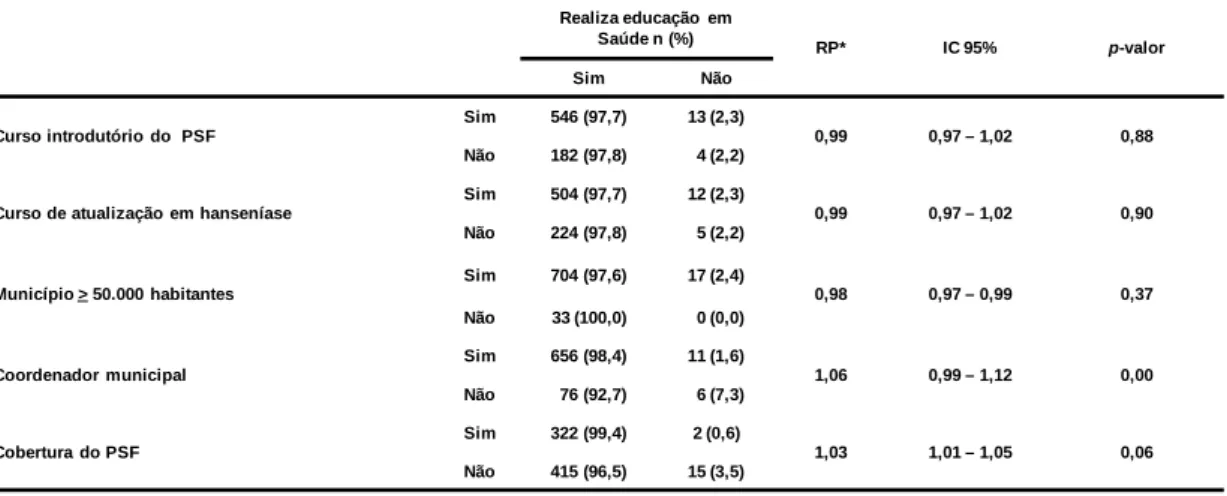
(7) RESUMO Introdução: A Hanseníase é uma doença dermatoneurologica, que tem como agente etiológico causador o Mycobacterium leprae. A estratégia de controle adotada pelos países membros da Organização Mundial da Saúde (OMS) definiu, em 1991, que a hanseníase deixaria de ser um problema de saúde pública naqueles países onde o coeficiente de prevalência fosse menor ou igual a 1 caso para cada 10 mil habitantes. Objetivo: Avaliar a situação operacional do programa de eliminação da hanseníase em municípios prioritários para esse agravo nas cinco regiões do Brasil, identificando as ações de controle realizadas pelos profissionais que atuam no Programa de Saúde da Família - PSF e fatores associados. Método: Trata-se de um estudo analítico do tipo transversal, realizado no período de setembro de 2006 a março de 2007. Foi selecionada de forma aleatória uma amostra com profissionais de saúde de 762 equipes do PSF dos municípios prioritários para o ano de 2005. Os dados foram coletados por meio da aplicação de um questionário semiestruturado utilizando a técnica de entrevista. As variáveis indicativas de desempenho do Programa Nacional de Eliminação da Hanseníase - PNEH foram designadas como dependentes e as restantes como preditoras ou independentes. A associação entre ambas foi aferida mediante o cálculo da razão de prevalência cuja significância foi testada pelo Chi-quadrado de Mantel-Haenszel. Resultados: Cerca de 70% das equipes visitadas informam realizar o diagnóstico da hanseníase. O controle e investigação dos comunicantes é realizado por 74,4% das equipes e a aplicação da segunda dose de BCG por apenas 37,5% delas. As equipes que realizam ações de educação em saúde têm 3 vezes mais probabilidade de realizarem controle de comunicantes. Aquelas que desenvolvem ações de controle de comunicantes tem 45 vezes mais probabilidade de aplicarem a segunda dose da BCG. A cobertura do PSF, a presença de coordenador municipal do Programa de Eliminação e a participação em cursos de hanseníase mostraram-se associados ao melhor desempenho do programa. Conclusão: Os dados indicam a necessidade de aprimorar o processo de descentralização e operacionalização do programa para que se possa continuar avançando para a eliminação da doença no Brasil. Palavras-chave: Hanseníase, atenção básica, operacionalização. 7.
(8) ABSTRACT Introduction: Leprosy is a infectious granulomatous disease caused by Mycobacterium leprae, Control strategy adopted by WHO member countries established, in 1991, that leprosy would not be a public health issue in countries where the prevalence rate is equal to / or less than one case per 10,000 inhabitants. Objective: To analize the operational situaltion of the National Leprosy Elimination Program (NLEP) in leprosy-high-priority municipalities, classified by the Ministry of Health, in the five Brazilain geographical regions. We identified control measures peformed by health professionals working at the primary health care level (“Family Health Program - FHP”) as well as predictors of these measures. Methods: We conducted a cross-sectional study aiming to evaluate variables related to NLEP. The study was carried out from september, 2006, to March, 2007 and the sample included 762 Health Professional Teams of FHP, randomly selected from leprosy-high-priority municipalities official list of 2005. Data collection was made by means of a structred questionnaire-guided interview. NLEP-performance features were designed as dependent variables and the remaining as predictors. Statistical association was ascertained by prevalence ratio calculation whose significance was tested by Mantel-Haenszel chi-square test. Results: About 30% of health Professional teams reported that they do not make clinical diagnosis of leprosy. Case-contact investigation is done by 74,4% of health teams and BCG second-dose administration is made only by 37,5%. Healtth teams which perform health education actions have a 3fold probability of case-contact investigation. Those health teams that carry out case-contact control have 45 times more probability of BCG-2nd dose administration. FHP coverage, the existence of a Leprosy Program municipal coordinator, leprosy-focused training participation, were all associated to a better program performance. Conclusion: Data indicate the necessity of a continuous reflection on the health care de-centralization process and NLEP effective control performance in order to attain the goal of eliminating leprosy in Brazil.. Key-words: Leprosy, primary health care, health services research.. 8.
(9) LISTA DE ABREVIATURAS. A.C.. Antes de Cristo. BAAR. Baciloscopia. BCG. Bacilo de Calmette e Guérin. CNDS. Coordenação Nacional de Dermatologia Sanitária. CNS. Conselho Nacional de Saúde. D.C.. Depois de Cristo. DNDS. Divisão Nacional de Dermatologia Sanitária. ENH. Eritema Nodoso Hansenico. ESF. Equipes de Saúde da Família. GM. Gabinete do Ministro. IEDS. Instituto Estadual de Dermatologia Sanitária. MB. Multibacilar. MS. Ministério da Saúde. OMS. Organização Mundial de Saúde. OPAS. Organização Pan-Americana de Saúde. PB. Paucibacilar. PEH. Programa de Eliminação da Hanseníase. PEN. Plano de Emergência Nacional. PNCH. Programa Nacional de Controle da Hanseníase. PNEH. Programa Nacional de Eliminação da Hanseníase. PQT. Poliquimioterapia. PSF. Programa de Saúde da Família. RIPSA. Rede Interagencial de Informações para a Saúde. ROM. Rifampicina, Ofloxacin e Minociclina. RR. Reação Reversa. SINAN. Sistema de Informação de Agravos de Notificação. SVS. Secretaria de Vigilância em Saúde. UBS. Unidade Básica de Saúde. USF. Unidades de Saúde da Família. 9.
(10) LISTA DE TABELAS. Tabela 1.. Tabela 2.. Tabela 3.. Tabela 4.. Tabela 5.. Tabela 6.. Tabela 7.. Tabela 8.. PAGINA. Distribuição geográfica, número de equipes de Saúde da Família e cobertura municipal do PSF. Municípios prioritários para o PEH, Brasil 2005................................ 52. Freqüências de atividades do PEH e outras características das 762 equipes participantes do estudo............................................................................. 54. Freqüência das atividades realizadas do PEH e outras características segundo regiões do Brasil....................... 55. Realização de diagnostico de hanseníase segundo características do programa e possíveis fatores associados. Municípios prioritários para o PEH. Brasil 2006............................................................... ................. 56. Proporção de realização de ações de controle de comunicantes segundo características operacionais do programa e participação em cursos técnicos e possíveis fatores determinantes. Municípios prioritários para o PEH, Brasil, 2006.................................................. 56. Proporção de realização de administração da 2º dose da BCG segundo características do programa e participação em cursos e possíveis fatores determinantes. Municípios prioritários do PEH, Brasil, 2006................................................................................. 57. Proporção de realização de atividades de educação em saúde segundo questões operacionais do programa. Municípios prioritários do PEH, Brasil, 2006................................................................................. 58. Proporcao de realização de atividades de educação em saúde sobre hanseníase, segundo questões operacionais do programa e possíveis fatores associados. Municípios prioritários do PEH, Brasil, 2006................................................................................. 59. 10.
(11) SUMARIO. I.. INTRODUÇÃO................................................................................... II.. REFERENCIAL TEÓRICO................................................................ 18. 12. 2.1 - Aspectos históricos da hanseníase........................................... 19 2.2 - A hanseníase............................................................................. 22. 2.3 – Diagnóstico e classificação da hanseníase.............................. 25. III.. 2.3 – O controle da hanseníase no Brasil.......................................... 28. OBJETIVOS....................................................................................... 43. 3.1 – Objetivo Geral........................................................................... 44 3.2 – Objetivos específicos................................................................ 44 IV.. METODO........................................................................................... 45 4.1 – Delineamento do estudo e variáveis......................................... 46. 4.2 - O campo de estudo.................................................................... 47. 4.3 - População e período do estudo................................................. 48. 4.4 - Coleta de dados......................................................................... 48. 4.5 - Plano de análise e tratamento dos dados.................................. 49. 4.6 - Aspectos éticos.......................................................................... 49. V.. RESULTADOS.................................................................................. 51. VI.. DISCUSSÃO...................................................................................... 61. VII.. CONCLUSÕES.................................................................................. 67. VIII.. RECOMENDAÇÕES......................................................................... 70. IX.. REFERÊNCIAS................................................................................. 74. X. APÊNDICES............................................................................................ 79. X. PROPOSTA DE ARTIGO........................................................................ 87. 11.
(12) I - INTRODUÇÃO. 12.
(13) Os países membros da Organização Mundial da Saúde (OMS) definiram, em 1991, que a eliminação da hanseníase era uma meta a ser alcançada até o ano 2000. Com a definição da meta de eliminação a OMS definiu ainda que a hanseníase deixaria de ser considerada um problema de saúde pública naqueles países onde o coeficiente de prevalência fosse menor ou igual a 1 caso para cada 10 mil habitantes (WHO, 2005). Apesar da meta proposta, a hanseníase ainda não foi eliminada em Angola, Brasil, República Africana Central, República Democrática do Congo, Índia, Madagascar, Moçambique, Nepal e na República Unida da Tanzânia (1). O indicador utilizado atualmente para monitorar a eliminação da hanseníase é a prevalência pontual (2). A Portaria GM/MS nº. 31, de 8 julho de 2005, estabeleceu que, para a construção do coeficiente de prevalência pontual, o numerador seja composto pelo total de pacientes em curso de tratamento, que representa o total de doentes no momento da análise. A prevalência pontual, usualmente, é medida no dia 31 de dezembro de cada ano. Até 2004, o indicador utilizado oficialmente no Brasil era o coeficiente de prevalência que era composto pelos casos em curso de tratamento e incluía também os casos em abandono de tratamento, o que impossibilitava qualquer comparação da prevalência no Brasil com outros países que já adotavam tal método. Até então, o Brasil era o país com maior magnitude da hanseníase do mundo (2). No início de 2005, a prevalência mundial da hanseníase era de 286.063 casos e o número de casos novos descobertos, durante o ano de 2004, foi 407.791. O número de casos descobertos, em todo o mundo, diminuiu para cerca de 107 mil casos, isto é, 21% durante o ano de 2004, quando comparado. 13.
(14) com o ano de 2003. Essa redução ocorreu principalmente pela diminuição de casos novos na Índia, onde houve diminuição, na detecção, de 29% em relação ao ano de 2003 (1). Em 1998, a Índia foi responsável por 79% dos casos de hanseníase detectados globalmente (3). O número de casos novos tem diminuído na região oriental do mediterrâneo, na Ásia e regiões do Pacífico Ocidental. Porém, não há igual tendência na África e nas Américas (3). A situação epidemiológica da hanseníase no Brasil foi considerada heterogênea devido à grande variação do coeficiente de prevalência nas várias regiões do país.. No período de 2001 a 2006 foram diagnosticados 288.407 casos novos no Brasil, destes, 54% (155.718) foram do sexo masculino. A mediana de idade foi de 39 anos com variação de 1 mês a 99 anos e 24.000 casos (0,8%) foram em menores de 15 anos. Em média, o número de casos novos a cada ano foi 47.400 casos, representando um coeficiente médio de detecção (CMD) geral considerado muito alto (2,7/10.000 habitantes). Da mesma forma, coeficiente médio anual de detecção em menores de 15 anos foi também muito alto (0,7/10.000 hab.), o que indica transmissão recente e ativa da doença. Os casos vêm sendo diagnosticados em todas as regiões do país, principalmente nas regiões norte, centro–oeste e nordeste.. Em cada região, o CMD variou de forma importante: 6,6/10.000 hab. na região Norte; 5,8/10.000 hab. no Centro-Oeste; 3,4/10.000 hab. no Nordeste e 1,3/10.000 hab. no Sudeste; e na região Sul, 0,7/10.000 hab. O mesmo se observa nos menores de 15 anos com CMD de 2,2/10.000 hab. na região Norte; 1,4/10.000 hab. no Centro-Oeste; e 1,1/10.000 hab. no Nordeste.. 14.
(15) Assim, mesmo com importantes avanços no diagnóstico precoce, o Brasil ainda apresenta importante contingente de pessoas com incapacidade físicas pela hanseníase a cada ano. A proporção media anual (PMA) de casos com avaliação do grau de incapacidade física (GIF) no diagnóstico foi de 88,9% (256.365/288.407).. A. PMA. de. casos. com. GIF. I. (um). foi. 17,8%. (45,869/256.365) e GIF II (dois) foi 5,8% (14.815/256.365).. Com relação à proporção de cura, indicador importante para o controle da hanseniase, no período de 2001 a 2006 a media encontrada foi 90%, (259.566/288.407) considerado como bom.. Os. principais. indicadores. de. monitoramento. de. eliminação. da. hanseníase apontaram para uma melhor situação, contudo, os coeficientes de detecção continuaram elevados no Brasil e América Latina. Com tudo, houve uma redução na prevalência registrada no Brasil resultante da atualização de registros dos pacientes e da unificação nas definições de um caso de hanseníase (1). Com isso, vem ocorrendo uma aproximação do coeficiente de prevalência com a meta de eliminação proposta pela OMS. Na década de 90, era comum a continuidade do paciente em registro ativo, mesmo após o término do tratamento e, em situações de abandono ou óbito, esses casos que não recebiam alta no sistema de informação e contribuíam para a manutenção do coeficiente de prevalência elevado. Por intermédio do Plano Nacional de Eliminação da Hanseníase, os estados e municípios promoveram a limpeza dos bancos de dados, dessa. 15.
(16) forma, permaneceram registrados apenas os casos de hanseníase que realmente estavam em curso de tratamento. Ao mesmo tempo em que os coeficientes de prevalência vêm diminuindo, os coeficientes de detecção, que indicam a endemicidade, continuam elevados em virtude da continuidade na transmissão da doença entre as populações ou ainda pela detecção tardia de casos. No estudo realizado, na Índia, no período de 1982 a 2002, observou-se que o coeficiente de prevalência da hanseníase apresentou forte declínio e o coeficiente de detecção continuou aumentando quase que constantemente, ultrapassando o coeficiente de prevalência desde 1999 (4). No Brasil, Martelli et al. (2002) verificaram a mesma tendência no período de 1983 a 2000, no qual ocorreu forte declínio do coeficiente de prevalência da doença, ao passo que os coeficientes de detecção continuaram elevados e sem alteração. Conforme o estudo de Meima et al. (2004) na América Latina, houve aumento consistente do coeficiente de detecção da hanseníase (5). Ao longo dos últimos anos, o Programa Nacional de Controle da Hanseníase desenvolveu estratégias de formação dos profissionais da rede de atenção, descentralização do diagnóstico e ampliação do acesso a poliquimioterapia, conforme recomendações da OMS. No esforço final para atingir a meta de eliminação até o ano de 2010, o Programa Nacional de Controle da Hanseníase do Ministério da Saúde propôs uma série de mudanças na execução de suas ações. Tendo em vista que, no Brasil, o coeficiente de prevalência continua acima do preconizado pela OMS, bem como considerando as diretrizes. 16.
(17) estabelecidas pela Norma Operacional de Assistência a Saúde – NOAS-SUS 01/ 02 que reforça as ações de eliminação da hanseníase como uma das sete estratégias mínimas da atenção básica que deve ser ofertada por todos os municípios, reforçando o papel da estratégia da Saúde da Família. Foi objetivo deste estudo realizar uma avaliação operacional do programa de hanseníase com ênfase na atenção básica / Equipe de Saúde da Família.. 17.
(18) II – REFERENCIAL TEORICO. 18.
(19) 2.1 - ASPECTOS HISTÓRICOS DA HANSENÍASE Desde a antigüidade, a hanseníase tem sido considerada uma doença contagiosa, mutilante e incurável. Esses aspectos levaram a uma intensa reação da comunidade, fazendo com que as pessoas acometidas pela doença fossem mais temidas do que a própria doença (6). Amplamente conhecida como “lepra”, a hanseníase encontra-se entre as mais antigas doenças mundiais, tendo como berço aparente a China e a Índia. As citações mais remotas são da época da dinastia Chou (600 A.C), com relatos sobre os discípulos de Confúcio, que haviam contraído a doença. Em um livro compilado (500 A.C), encontra-se o termo “li- feng” para designar paralisia grave e descrever um estado semelhante à atual forma virchoviana da doença (7). A hanseníase também era confundida inicialmente com diversas outras enfermidades da pele ou deformidades. Os gregos conheciam a doença, sendo chamada de elefantíase por Aratues e Galeno, por identificarem semelhança da pele do animal com a pele do doente. O termo lepra foi usado por Hipócrates, mas suas descrições indicam doença de pele com lesões escamosas. (os. eczemas. crônicos). sem. haver,. porém,. menção. às. manifestações neurológicas da hanseníase (8). A Bíblia é outra fonte de confusão quanto à existência da hanseníase entre os judeus na época do êxodo. O termo “tsaraath” (ou saraath), no hebraico significa uma condição anormal da pele dos indivíduos, das roupas ou das casas, que necessitavam de purificação. Aqueles que apresentassem o “tsaraath” deveriam ser isolados até que os sinais desta condição desaparecessem (9). 19.
(20) Segundo o Livro sagrado o “tsaraath”, na pele dos judeus seriam “manchas brancas e deprimidas em que os pêlos também se tornavam brancos”. Na tradução grega do texto hebraico, a palavra “tsaraath” foi traduzida como lepra e “lepros”, em grego, significam “algo que descama”. É interessante observar que essa mesma palavra designava a casca interna das árvores, que era usada para escrita, tanto é que sua forma latina vem a ser “líber”, que originou a palavra livro, como conhecemos hoje. A palavra lepra também foi usada pelos gregos para designar doenças escamosas do tipo da psoríase e a hanseníase mesmo, eles chamavam de elefantíase (9). O termo lepra também designava condição de miséria, pobreza, doenças que supurassem ou que representassem contágio ou repugnância aos olhos (10). Na Idade Média (583 DC), o Concílio da Igreja Católica realizado em Lyon, estabeleceu regras para a profilaxia da doença. Consistiam em isolar o doente da população sadia e incluíam um ofício religioso em intenção do doente semelhante ao ofício dos mortos, após o qual o “leproso” era excluído da comunidade, passando a residir em locais reservados para esse fim. Eram ainda obrigados a usar roupas características que os identificavam como doentes e fazer soar a sineta ou matraca para avisar os sadios da sua aproximação. Foi criada, no século XII, a primeira ordem religiosa dedicada a prestar cuidados aos doentes de hanseníase e também os primeiros leprosários na Europa. A alta magnitude da doença na Europa pode ser estimada pela existência de 19.000 leprosários no século XIII naquele continente (11).. 20.
(21) O declínio da endemia na Europa, a partir do século XVII, também foi observado após as desativações dos asilos, que prosseguiu ao longo do século XVIII e a primeira metade do século XIX. Admite-se que esse declínio teve como causa principal a melhoria das condições sócio-econômicas dos povos europeus ao longo das Idades Moderna e Contemporânea. Com as conquistas espanholas e portuguesas e as importações de escravos africanos, introduziase a doença no Mundo Novo. Durante este período de colonização, a América Latina tornou-se gradativamente uma nova área endêmica mundial, persistindo também focos endêmicos na Ásia e na África (11). Nas Américas, a hanseníase deve ter chegado com os colonizadores entre os séculos XVI e XVII. Nos Estados Unidos, foram os franceses que provavelmente trouxeram a hanseníase; na América do Sul, a doença teria sido trazida pelos colonos espanhóis e portugueses (9). De acordo com Maurano (1944), os portugueses teriam sido os responsáveis pelo primeiro foco de hanseníase,. que. teve. início. com. as. migrações. colonizadoras. que. desembarcaram pelos portos do Rio de Janeiro, Salvador e Recife, no fim do século XVI e início do XVII. Esse autor nega, junto com Juliano Moreira, o papel dos africanos na introdução da lepra no período pós-descoberta do Brasil, embora vários outros relatos deixem em dúvida essa posição (12). Considera-se que o papel desempenhado pelos escravos na introdução da hanseníase nas Américas, e em particular no Brasil, é discutível. Apesar de se admitir a dificuldade de negociação de escravos acometidos pela hanseníase ou qualquer outra doença, é válido supor que muitos deles procedentes de diversas regiões da África, poderiam ter entrado em nosso país com a hanseníase ainda em seu período de incubação ou na sua forma. 21.
(22) indeterminada de difícil diagnóstico para os médicos militares de então, incumbidos do exame dos navios negreiros (9). Segundo ANDRADE (1996), os primeiros casos notificados no Brasil foram no ano de 1600, na cidade do Rio de Janeiro. Em 1698 o então Governador e Capitão Geral do Rio de Janeiro, Artur de Sá e Meneses, solicitou ao Rei autorização para instalar um hospital para os “lázaros”, termo de origem hebraica usado para nomear os que estavam “atacados de lepra” ou “cobertos de chagas”, usado em referência ao personagem bíblico “Lázaro”, designação com a qual eram conhecidos os portadores da doença (13).. 2.2 - A HANSENÍASE A Hanseníase é uma doença dermatoneurologica, infectocontagiosa e de evolução longa, cujo agente etiologico é o Mycobacterium leprae, um bacilo alcool-ácido resistente, gram-positivo, metabolicamente pobre e obrigatoriamente intracelular, de reprodução muito lenta, pouco antigênico (9).. Há fortes evidências de que, no sistema nervoso periférico, o M leprae se instale no interior das células de Schwann que representariam um local onde poderiam sobreviver e proliferar livres das defesas imunes do organismo. Quando a proliferação bacilar é suficientemente grande para romper estas células hospedeiras, os bacilos podem chegar ao interstício, endo ou extraneural, (9). Esta situação protegida do M. leprae nas células de Schwann é importante não só para o entendimento do período de incubação prolongado, mas também porque o sistema nervoso vai representar, durante o. 22.
(23) desenvolvimento da doença, locus preferido do bacilo. A fase de parasitismo, restrito às células de Schwann, é muito prolongada, sendo medida em anos (9). Ainda não cultivado in vitro, o M. Leprae pode apresentar-se em forma de bastão ou ligeiramente encurvado, de 2 a 8mm de comprimento, podendo apresentar-se individualizados, mas, quando muito numerosos tem a tendência de dispor-se em paralelo formando feixes, que são denominados de globias. Descoberto na Noruega em 1873 por Armauer Hansen, o Mycobacterium foi a primeira bactéria a ser identificada como causadora de uma doença humana (14). Vários estudos têm demonstrado que, diante da infecção, a maioria dos indivíduos oferece resistência ao Mycobacterium leprae, não desenvolvendo a doença, situação esta que pode ser alterada, em função da relação entre o agente e o hospedeiro. Nos indivíduos que adoecem, a infecção evolui de maneiras diversas, de acordo com a resposta imunológica, especifica, do hospedeiro frente ao bacilo. De acordo com o Caderno de Atenção Básica n° 21 do Departamento de Atenção Básica (15) os principais sinais e sintomas da doença são:. • Manchas. esbranquiçadas. (hipocrômicas),. acastanhadas. ou. avermelhadas, com alterações de sensibilidade (a pessoa sente formigamentos, choques e câimbras que evoluem para dormência -se queima ou machuca sem perceber); • Pápulas, infiltrações, tubérculos e nódulos, normalmente sem sintomas ; • Diminuição ou queda de pêlos, localizada ou difusa, especialmente sobrancelhas;. 23.
(24) • Falta ou ausência de sudorese no local - pele seca.. Doença complexa com manifestações polimorfas de decurso crônico, a hanseníase, em alguns doentes, é interrompida por episódios reacionais, também conhecidas como reações hansênicas, que são manifestações agudas ocasionadas por alterações do sistema imunológico da pessoa atingida pela hanseníase. As reações hansênicas podem ocorrer antes, durante e após o tratamento com a poliquimioterapia (PQT), tanto nos casos paucibacilar (Pb) como nos multibacilar (Mb). Tais episódios são classificados, de acordo com a gravidade em: Reação tipo um ou Reação Reversa (RR) – que consiste no aparecimento de infiltrações e alterações da cor da pele, além de edema das lesões antigas, surgimento de novas lesões (manchas ou placas), bem como comprometimento dos nervos periféricos. Reação caracterizada. tipo pelo. dois. ou. Eritema. aparecimento. de. Nodoso nódulos. Hansênico subcutâneos. (ENH). –. dolorosos,. acompanhados ou não de febre; dores articulares e mal estar generealizado além de, em alguns casos, ocorrer o aparecimento de irite ou iridociclite. O ser humano é considerado a única fonte de infecção da hanseníase. A transmissão se dá por meio de um portador multibacilifero, sem tratamento, que elimina o bacilo para o meio exterior, pelas vias aéreas superiores, infectando outras pessoas suscetíveis. Estima-se que 90% da população tenha defesa natural contra o M. leprae e, sabe-se que a susceptibilidade ao M. leprae tem influência genética (16).. 24.
(25) Devido ao padrão de multiplicação do bacilo, observa-se ainda que a doença progride lentamente. Entre o contato com a pessoa doente e o aparecimento dos primeiros sinais pode levar em média 2 a 5 anos (17). A principal via de eliminação do bacilo pelo doente, e a mais provável via de entrada deste no organismo, é a via aérea superior (mucosa nasal e orofaringe), pelo contato íntimo e prolongado, muito freqüente na convivência domiciliar. Por isso, o domicílio é apontado como importante espaço de transmissão da doença. A hanseníase não é de transmissão hereditária ou congênita e também não há evidências de transmissão nas relações sexuais (17). A disseminação da hanseníase, em determinada comunidade, está relacionada à proporção de pessoas suscetíveis na população e sua oportunidade de contato com o bacilo. Os riscos de adoecimento são maiores em contatos familiares de doentes bacilíferos (11).. 2.3 – DIAGNOSTICO, CLASSIFICAÇÃO E TRATAMENTO DA HANSENÍASE. Para o diagnóstico da doença são necessários uma anamnese e exame físico cuidadoso. Na anamnese, deve ser explorada principalmente a sintomatologia neurológica, duração, localização e evolução dos sintomas e história epidemiológica. No exame dermatológico, devem ser investigados manchas, nódulos, infiltrações, placas, alopécia localizada, ulcerações e calosidades. A hanseníase é principalmente uma doença dos nervos periféricos e nas lesões ou áreas suspeitas deve ser feita a pesquisa das sensibilidades. 25.
(26) térmica, dolorosa e tátil. É recomendada a palpação dos troncos nervosos periféricos mais acometidos pela doença, quais sejam: ulnar ou cubital, radial, mediano, fibular e tibial posterior. Deve-se também verificar a integridade anatômica e motora das mãos, pés e face (18,19, 20). O diagnóstico da hanseníase é basicamente clínico. O profissional deve atentar para as queixas apresentadas, por meio do exame de toda a pele, das mucosas e dos olhos, da palpação dos nervos, da avaliação da sensibilidade tátil, térmica e dolorosa e da força muscular dos membros superiores e inferiores. A pessoa com suspeita de hanseníase deve ser examinada em um local que tenha privacidade e boa iluminação. Em alguns casos, é necessário solicitar exames complementares, tais como a baciloscopia, em unidades de referência para a confirmação diagnóstica (17). Nesse contexto, o Ministério da Saúde, na Portaria n° 1.073/GM de 26 de setembro de 2000, coloca a vigilância dos contatos como uma das medidas para detecção e diagnóstico precoce dos casos e que, para fins operacionais, deve-se considerar como contato intradomiciliar toda e qualquer pessoa que resida ou tenha residido nos últimos cinco anos com o doente. E, de acordo com orientações do MS, o comunicante deve ser submetido a exame dermatoneurológico e receber orientação quanto ao período de incubação, transmissão, sinais e sintomas da hanseníase, assim como receber duas doses da vacina BCG, com intervalo mínimo de seis meses entre a primeira e a segunda dose (21). Classificar uma doença é uma maneira de compreendê-la melhor e, com isso, procurar uma terapêutica que possa controlá-la, ou mesmo eliminá-la. Quanto mais fatos novos forem aparecendo, fruto de seu estudo, mais sua. 26.
(27) classificação se altera e se completa. Devido às diversas manifestações clínicas, diferenças nas respostas imunológicas, epidemiológicas e evoluções encontradas na hanseníase, houve a necessidade de uma classificação para a doença. RABELO, em nosso país, foi um dos primeiros a estabelecer o conceito das formas polares da hanseníase. A partir da hanseníase indeterminada (I) os pacientes, sem tratamento, poderiam evoluir para a forma polar tuberculóide (T), se tiverem boa resistência ou para a forma virchowviana (V), se não houver boa resistência do organismo ao M. leprae (22). No Congresso de Leprologia, realizado em Madri em 1953, foram mantidos os critérios propostos por RABELO, acrescentando-se um novo grupo de pacientes, a que se denominou de “dimorfos”. Esse grupo também evoluía a partir da forma indeterminada (I), porém apresentando aspectos clínicos que não eram característicos das formas polares T e V. Tratava-se então de pacientes interpolares. Na época, esse grupo de pacientes foi definido como clinicamente instáveis e com tendência a evoluir para a forma Virchoviana se não fossem tratados (22). RIDLEY. &. JOPLING. (1966),. propuseram. uma. modificação. da. classificação de Madri, introduzindo o conceito espectral da hanseníase, subdividindo os “dimorfos” em dimorfo-tuberculoide (DT), dimorfo-dimorfo (DD), e dimorfo-virchowiano (DV) (22). Segundo FRANÇA (1999), foram definidas duas formas clinicas polares, uma maligna que é o tipo virchowiano (lepromatoso), e uma benigna que é o tipo tuberculoide e dois grupos: dimorfo e indeterminado (23).. 27.
(28) Em 1982, a Organização Mundial de Saúde propôs uma classificação operacional para fins de tratamento, baseando-se nas manifestações clínicas e na baciloscopia, para ser utilizada nos programas de controle, individualizandose as formas: paucibacilar e multibacilar. Paucibacilar (Pb): pacientes que apresentam até cinco lesões de pele, sem acometimento de troncos nervosos, e /ou acometimento de apenas um tronco nervoso. A baciloscopia é negativa e corresponde às formas clinicas indeterminada e tuberculoide. Multibacilar (Mb): pacientes que apresentam mais de cinco lesões de pele e /ou acometimento de mais de um tronco nervoso, apresentam a baciloscopia positiva e corresponde às formas clinicas dimorfa e virchowiana. A forma virchowiana sempre apresenta baciloscopia positiva e a forma dimorfa pode apresenta baciloscopia positiva ou negativa (24).. 2.4 - O CONTROLE DA HANSENÍASE NO BRASIL O controle de uma doença inicia, via de regra, quando seu aparecimento torna-se um problema para o individuo e para a sociedade. Com a hanseníase não foi diferente. Nesse sentido são inúmeros os estudos e pesquisas a respeito do seu surgimento e controle no Brasil (12). No ano de 1741, surge o primeiro regulamento para combater a lepra no Brasil, redigido por dois médicos da corte. Segundo Souza Araújo (1946), a lepra foi considerada como doença contagiosa e, como medida de controle, estabeleceu-se o isolamento dos doentes em asilos especiais, segundo o sexo e as condições sociais. A segregação dos filhos era uma das recomendações. Nesses asilos os pacientes deveriam receber tratamento especial. Em relação. 28.
(29) ao diagnóstico, era apontada a possível confusão entre a sífilis e a lepra, com alerta rigoroso na seleção dos imigrantes africanos (25) A partir da instituição desse regulamento, tem inicio, por decisão das autoridades sanitárias, a construção de asilos para “lázaros”. No período colonial foram instalados hospitais no Rio de Janeiro, em 1741, na Bahia, em 1784, e em São Paulo, em 1799. Já durante o império, o primeiro hospital-asilo foi edificado em São Luiz do Maranhão, em 1833. Maurano (1944) relata que as solicitações de providências contra a lepra pelos governadores provinciais, que continuavam pedindo a abertura de mais hospitais, era a prova de que a doença não diminuíra, mesmo nas cidades que haviam fornecido esse tipo de assistência ao paciente. As principais recomendações do I Congresso Internacional de Lepra, realizado em 1897, em Berlim, foram o isolamento compulsório, a notificação obrigatória dos casos e vigilância dos contatos, recomendações essas também adotadas pelo Brasil, até meados do século XX. É desse período o início da participação de instituições civis e filantrópicas no controle da doença. Por tanto, por aproximadamente 200 anos o controle teve como base o regulamento de 1741 (12). Em 1912, após estudos realizados no interior de São Paulo, onde foi constatada que a luta contra a lepra dependia do isolamento dos pacientes, Emílio Ribas chama a atenção do governo para o aumento constante de casos. Propõe, então, que esse isolamento fosse feito em asilos-colônia, onde os doentes deveriam levar uma vida semelhante à das pessoas saudáveis. Ao lado das criações das colônias, havia a necessidade de decretos visando facilitar a profilaxia e a notificação compulsória de todos os casos de lepra (26).. 29.
(30) Em 1915, no Rio de Janeiro, a Sociedade Médica reúne uma comissão de profilaxia da lepra, integrada por vários delegados, dentre eles Adolfo Lutz. Infelizmente, os debates versaram sobre transmissão, ficando a discussão sobre a profilaxia prejudicada (27). No Rio de Janeiro, em 1916, Carlos Chagas, enquanto presidente do I Congresso Americano de Lepra, aprova as seguintes conclusões: recensear os leprosos de todos os estados; recolher diferentes legislações antilepróticas em vigor; abrir colônias para combater o contágio; instituir plano uniforme na luta, aplicado simultaneamente em todo território nacional; permitir, em certas condições, o isolamento domiciliar e fazer com que os doentes fossem tratados por especialistas. Na época, o Estado desempenhava uma ação saneadora pelo isolamento compulsório dos doentes nos então asilos-colônias. Esta medida tinha como suporte a idéia de que o confinamento de doentes com doenças transmissíveis traria necessariamente a erradicação da doença, o que levou à recomendação da institucionalização do cuidado aos doentes. As seguintes medidas foram implementadas por lei: •. Notificação compulsória e censo de leprosos.. •. Fundação de asilos-colônias, nos quais seriam confinados os leprosos pobres;. •. Isolamento domiciliar do doente com vigilância médica e aplicação dos recursos de higiene para o caso;. •. Vigilância dos comunicantes e suspeitos de lepra;. 30.
(31) •. Isolamento dos filhos recém-nascidos de pais leprosos em orfanatos específicos e isolamento dos filhos expostos ao risco em locais específicos para cuidar das crianças chamados de preventórios;. •. Proibição da importação de casos de lepra de outros países. •. Notificação de mudança de residência de leprosos e sua família. •. Proibição ao doente de lepra de exercer profissões ou atividades que pudessem ser perigosas à coletividade ou que o colocassem em contato direto com pessoas sadias;. •. Proibição aos doente de freqüentar igrejas, teatros e casas de divertimentos, lugares públicos ou viajar em veículos sem o prévio consentimento da autoridade sanitária competente (26, 28, 29) Em 1920, com a criação do Departamento Nacional de Saúde Pública. por Carlos Chagas, surge a primeira atividade sanitária para o controle da “lepra”, com a criação da “Inspetoria de Profilaxia da Lepra e Doenças Venéreas”.. As ações de controle de então priorizavam a construção de. leprosários em todos os estados endêmicos, o censo e o tratamento pelo óleo de hydonocarpus, ou óleo de Chaulmoogra, que foi largamente utilizado no tratamento da hanseníase, ao lado de outras terapias arsenicais e azul de metileno, mas que nunca tiveram eficácia terapêutica comprovada (29). As medidas utilizadas no controle da hanseníase só contribuíam para que os doentes negassem a doença até o surgimento das deformidades e, em última instância, as autoridades sanitárias acabavam por espalhar medo e discriminação em relação aos doentes (13). O fim da antiga Inspetoria de Profilaxia da Lepra e Doenças Venéreas ocorre em 1934, criando-se, então, a “Inspetoria dos Centros de Saúde”, com a. 31.
(32) função de fornecer assistência técnica aos profissionais dos dispensários. Esta instância permitiu a multiplicação dos dispensários (12). Em 1935, foi feito um plano de ação mais abrangente, elaborado com a intenção de dar assistência aos familiares dos doentes por meio da criação de ligas de caridade (6). Com o objetivo de melhorar a qualidade do diagnóstico, em 1937 foi criado, no Rio de Janeiro, o Centro de Elucidação Diagnóstica, voltada para situações nas quais os médicos dos Centros de Saúde tivessem dúvidas sobre o diagnóstico da lepra. Assim, a organização da rede de serviços de controle da lepra passa a ser integrada por diferentes serviços: hospitais colônias, Serviço de Visitação Domiciliar, Dispensários dos Centros de saúde e Centro de Elucidação Diagnóstica (27). O “Serviço Nacional de Lepra” foi criado em 1941, procedendo à coleta e à organização de dados que forneceram informações mais atualizadas da realidade da doença no país. Nesse primeiro momento, de acordo com o modelo de intervenção de Saúde Pública vigente, as ações eram voltadas para o âmbito bacteriológico, movidas pelo objetivo de proteger a sociedade do contágio (30). O isolamento dos doentes só contribuiu para provocar sérios problemas sociais e não demonstrava ser eficaz no controle da doença ou na diminuição no número de casos da endemia, além de ser bastante dispendioso para o Estado manter um doente em asilos-colônias. Com o advento da sulfona em 1943 e os novos conhecimentos científicos acerca de formas menos bacilíferas da doença, decidiu-se pelo tratamento ambulatorial, por meio de três atividades institucionais: leprosários,. 32.
(33) dispensários e preventórios. Os leprosários eram destinados a resguardar os casos de pacientes virchowvianos; os dispensários tinham de examinar os contatos, pessoas com suspeita de lepra e atender aos casos tuberculoides ou indeterminados; e nos preventórios eram criados e educados os filhos dos doentes (30, 13). Por orientação do Departamento Nacional de Saúde do Ministério da Educação e Saúde, a partir de 1946 foram realizados censos extensivos de hanseníase em todo o país por Ernani Agrícola, cujos resultados mostraram o aumento do número de casos novos, enquanto o agravamento da prevalência indicava que a expansão da endemia não fora de forma alguma detida, concluindo que o tripé (leprosário-dispensário-proventório) havia se tornado insuficiente. para. impedir. a. propagação. da. endemia.. Em. 1954. foi. regulamentada uma lei que desobrigava a internação compulsória (30,13). Surge, então, em 1956 uma radical modificação dos métodos profiláticos até então em uso e aparece a figura do leprólogo. O país foi estratificado em cinco áreas, subordinadas à “Campanha de Luta Contra a Lepra” compostas por grupos de trabalho como: leprólogos, médicos não especialistas e guardas sanitários. Buscava-se a cura da hanseníase por meio de um conjunto de medidas: • descentralização do atendimento com cobertura populacional; • a. estratificação. do. país,. segundo. critérios. epidemiológicos. e. operacionais; • a identificação e exclusão dos registros dos óbitos, dos ausentes e curados; • educação sanitária.. 33.
(34) Em 1960, a Revista Brasileira de Leprologia publica a síntese dos requisitos de uso prático na organização da Campanha de Controle da Lepra, dentre elas que a propaganda e a educação sanitária devem ser intensificadas de modo que os médicos e o público em geral possam se convencer de que não existem leprosos (a palavra não deveria ser mais usada), mas pessoas sofrendo de lepra, uma doença curável (12). Em 1962, o então Primeiro Ministro Tancredo Neves institui o decreto Nº 968 de 7/5/62, que apesar de não revogar a lei 610, liberava o doente e acabava com o isolamento. Esta década é marcada por importantes mudanças na atenção ao doente. Surge, com base na curabilidade da terapêutica com Dapsona, a não obrigatoriedade da internação compulsória do doente contagiante. Em 1969, em São Paulo, surge a proposta do Dr. Abrahão Rotberg, da substituição do termo lepra por hanseníase, nome proposto em homenagem ao cientista norueguês Dr. Gerard Amauer Hansen, descobridor do Mycobacterium leprae. Tal nomeclatura gradativamente passou a ser adotada pelo Ministério da Saúde e pela sociedade brasileira. Em 1995, o então Presidente da Republica, Fernando Henrique Cardoso, decreta a lei 9.010 de 29 de março de 1995 que proíbe a utilização da terminologia " Lepra " nos documento oficiais da administração centralizada e descentralizada da Uniao e dos demais entes federados (Lei 9.010/95). A propaganda e educação sanitária recebem maior ênfase para a diminuição do preconceito e descobrimento de casos. São elaboradas normas técnicas e a publicação do Guia de Controle da Hanseníase pela necessidade. 34.
(35) de padronização ao nível nacional das técnicas e procedimentos utilizados no controle da doença (13, 30, 32, 31). Desde o inicio das atividades de controle, todas as informações eram sistematicamente difundidas por intermédio de dois periódicos: a Revista Brasileira de Leprologia, fundada em 1933, e o Boletim da Divisão Nacional de Lepra, que circulou de 1943 a 1975. A primeira teve continuidade com publicação da Revista Hansenologia Internacionales que, até hoje, é a única publicação periódica no Brasil dedicada á Hanseníase. Por outro lado, o Boletim da Divisão Nacional de Lepra passou a ser editado sob o titulo Boletim da Divisão Nacional de Dermatologia Sanitária, deixando entretanto, de circular na década de 70. Além da alteração das denominações de Divisão Nacional de Lepra e Campanha Nacional contra a Lepra para Divisão Nacional de Dermatologia Sanitária (DNDS) e Campanha Nacional Contra Hanseniase, o Ministério da Saúde ampliou as atribuições legais do órgão que, além das atividades de prevenção da hanseníase, passa a ser responsável pela prevenção de outras dermatoses de interesse sanitário. Visando promover o sistema nacional de saúde, foram estabelecidas novas diretrizes de atuação conjunta no controle da hanseníase pelo Ministério da Saúde e da Previdência e Assistência Social, cujas ações seriam executadas pelos serviços básicos e especializados de saúde, das Secretarias de Saúde dos Estados, dos Municípios, do Distrito Federal, assim como de entidades privadas e de médicos particulares. A DNDS concentraria seus esforços na coordenação, supervisão e atenção cada vez maior de seus. 35.
(36) executantes, com recursos humanos, materiais, treinamento de pessoal profissional e auxiliar (30, 32). As mudanças mais importantes observadas na década de setenta são as relacionadas com as medidas de diminuição do estigma da doença. O termo hanseníase é adotado pela Nomenclatura de Dermatologia Brasileira e pelo Governo Federal em substituição definitiva a palavra lepra e seus derivados, conforme recomendação da Conferencia Nacional de Hanseníase, realizada em Brasília, em fevereiro de 1976. No decorrer de 1976, uma nova portaria da DNDS estabelece a Política de Controle da Hanseníase, que seria realizada mediante a execução das seguintes ações, no mesmo nível de prioridade: educação em saúde; aplicação da BCG; descoberta de doentes; tratamento dos doentes e prevenção e tratamento das incapacidades (12). A denominação Programa Integrado de Controle da Hanseníase data de 1978, quando também é divulgado um manual de prevenção e tratamento de incapacidades físicas, mediante técnicas simples, além de um guia de controle da hanseníase, com modificações importantes com relação às ações de profilaxia divulgadas anteriormente (12). Destaca-se na década de oitenta que as principais mudanças ocorrem em relação à terapêutica. Começam a surgir os primeiros casos de resistência às sulfonas em países africanos, modificando todo o panorama mundial em relação ao tratamento da doença. Propõe-se também a redução do tempo de tratamento e inclusão de novos medicamentos no controle da doença e a utilização de esquemas padronizados pela OMS. Surge a poliquimioterapia em 1986 no Brasil, com implantação gradual em todo território Nacional.. 36.
(37) Nessa época o programa conta com a ajuda de recursos não governamentais de países estrangeiros para a implantação do novo esquema e treinamento de pessoal. São criados os primeiros “Centros Nacionais de Referência”,. unidades. responsáveis. pelo. tratamento. de. doentes. e. principalmente nas capacitações dos técnicos envolvidos no programa e produção de novas pesquisas sobre hanseníase. No final da década, a preocupação estava voltada para a eliminação da endemia como problema de saúde pública, com a elaboração do Plano de Emergência Nacional (PEM), onde o país é dividido em regiões de acordo com a incidência e prevalência da doença e a distribuição dos recursos é feita de acordo com as áreas consideradas prioritárias, tendo-se como critérios, os coeficientes de morbidade (29). Em 1990, a Divisão Nacional de Dermatologia Sanitária (DNDS) passa à. Coordenação. Nacional. de. Dermatologia. Sanitária. (CNDS).. A. poliquimioterapia passa a ser o esquema oficial de tratamento em todo território Nacional. O Brasil, juntamente com outros estados membros da OMS em Assembléia Mundial, assumiram o compromisso de até o ano 2000 reduzirem a prevalência da doença para menos de 1 caso por 10.000 hab. No ano de 1997 surge a proposta da OMS de tratamento com dose única, o ROM (Rifampicina, Ofloxacin e Minociclina) para doentes paucibacilares com lesão de hanseníase única e poliquimioterapia padrão (PQT) para multibacilar durante 12 meses. Estes esquemas foram implantados em unidades-piloto, ainda como protocolo de pesquisa, não sendo considerado esquema oficial padrão de tratamento (29).. 37.
(38) Em 1991, a Organização Mundial de Saúde, animada com os resultados da redução do número de casos registrados, graças à implementação da PQT/OMS, propôs a eliminação da doença como problema de saúde pública do mundo, ou seja, que até o ano de 2000 todos os países endêmicos alcançassem a taxa de prevalência de menos de 1 doente a cada 10.000 habitantes. No Brasil a taxa de prevalência registrada para 1997 foi 5,5/10.000 habitantes (MS, 1999) e em 2000 uma prevalência de 4,57/10.000 habitantes, muito longe ainda da meta estimada que é de 1/10.000 habitantes (21). Ainda no ano de 2000, a estratégia de integração das atividades de diagnóstico e tratamento na atenção básica é sustentada por diversas iniciativas do governo federal e dos demais parceiros. Destaca-se a publicação da Norma Operacional da Assistência à Saúde NOAS-SUS 01/2001, que ampliou as responsabilidades dos municípios na Atenção Básica e estabeleceu a eliminação da hanseníase como uma das áreas de atuação estratégica mínima para habilitação na condição de Gestão Plena da Atenção Básica Ampliada - GPBA dos municípios. Em 2004, o Programa Nacional de Eliminação da Hanseníase (PNEH) estabeleceu um conjunto de ações para o redimensionamento da política de eliminação da doença enquanto problema de saúde pública e da atenção à hanseníase no Brasil. Dentre as ações estabelecidas, o Ministério da saúde utilizou um conjunto de critérios para definir uma lista de municípios prioritários para o Programa Nacional, sendo eles, municípios com mais de 50 casos em curso de tratamento no ano da avaliação, uma média de 10 casos novos MB e média de 2 casos novos em crianças nos últimos 5 anos. A partir dos critérios estabelecidos, chegou-se a um total de 206 municípios prioritários para o ano. 38.
(39) de 2005. Em 2006, após revisão, aplicando-se os mesmos critérios na base de dados de 2005, o número de municípios prioritários caiu para 109. Em 2004, o Ministério da Saúde alterou a forma de cálculo do coeficiente de detecção, passando-se a incluir como casos novos de hanseníase apenas aqueles presentes na base de dados do Sistema de Informação de Agravos de Notificação – SINAN no nível federal, até o dia 15 de janeiro do ano subseqüente, em lugar de 13 de março como feito anteriormente. Como o SINAN não e um sistema atualizado em tempo real, nem todos os casos diagnosticados no ano anterior são incluídos na sua base de dados ate janeiro. Esta situação alterou a estrutura da serie histórica, provocando uma queda artificial do numero de casos novos detectados. Também contribuíram para esta distorção, o calculo da prevalência por ponto, baseado apenas no numero de casos em tratamento, no mês de dezembro. O acúmulo ano a ano de casos diagnosticados e não informados à Organização Pan-Americana (OPAS) / Organização Mundial de Saúde (OMS), organismos responsáveis por intermediar a provisão de medicamentos junto ao laboratório Novarts, levou à doação de quantitativo inferior as necessidades do país, causando o desabastecimento das Unidades de Saúde e, consequentemente, a interrupção do tratamento de pacientes (33). Para solucionar o problema foram adotadas as recomendações da Nota Técnica n. 10/2007/PNCH/Devep/SVS. O documento afirma que o controle da hanseníase é baseado no diagnostico precoce de casos, seu tratamento e cura, visando eliminar fontes de infecção e evitar seqüelas. Outro fato importante trazido pela nota técnica n. 10/2007/PNCH/Devep/SVS foi a definição do principal indicador epidemiológico do controle da hanseníase, que. 39.
(40) passa a ser o coeficiente de detecção em menores de 15 anos, pois segundo o mesmo documento, expressa a forca da transmissão recente e a sua tendência. Também deveriam ser considerados: o coeficiente de detecção em todas as idades, que expressa o numero de casos novos pela população em geral, e a proporção de cura de casos diagnosticados, que e o mais importante indicador de resultado das atividades de controle. Nesse sentido, o Ministério da Saúde declara ainda, em 2007, que o indicador de prevalência passa a ser um indicador secundário e complementar, para atender a solicitações de avaliações especiais e externas e comparação com outros países. Também informa que a terminologia “eliminação”, implicitamente ligada a meta de “eliminação” lançada pela OMS, baseada nesse indicador, torna-se inadequada para nominar a área técnica de hanseníase, que volta a ser Programa Nacional de Controle da Hanseníase – PNCH. As mudanças propostas, além de aprovadas pelos gestores estaduais e municipais, foram também submetidas a diversos pesquisadores da área, dos quais receberam apoio. Segundo Penna & Penna (2007) a súbita redução do numero de casos, se não bem avaliada, poderia reduzir o comprometimento político nacional e internacional na busca de esforços para o alcance da eliminação da doença (34). Nesse contexto são lançados os eixos estruturantes ou componentes técnicos do PNCH, um conjunto de ações a serem adotadas por todos os gestores do SUS:. 40.
(41) • Componente 1 - Vigilância epidemiológica: dividido em dois subcomponentes, monitoramento do SINAN e análise das informações sobre a endemia. • Componente 2 - Gestão: dividido em três subcomponentes, planejamento, monitoramento, avaliação e descentralização das ações para a atenção básica. • Componente 3 - Atenção integral à saúde da pessoa atingida pela. hanseníase. e. seus. familiares:. divididos. nos. subcomponentes, diagnóstico, tratamento e vigilância dos contatos, prevenção de incapacidades e reabilitação e resgate social. • Componente 4 - Comunicação e educação: composto por ações de comunicação em saúde, mobilização social e política de educação permanente. •. Componente 5 - Pesquisa: com ações de fortalecimento dos centros de referência e implementação e financiamento de pesquisa.. Dentre as diretrizes estabelecidas, o PNCH define como fundamental intensificar a descentralização das ações de controle da hanseníase integradas com atenção básica e, para o acompanhamento desse processo, fica clara a necessidade de definição de consensos sobre o conceito e mecanismos confiáveis de aferição do número de unidades básicas com o Programa de Controle da Hanseníase – PCH implantado. Neste sentido, o PNCH define como consenso para avaliar a implantação do PCH nessas unidades a. 41.
(42) execução das seguintes atividades: diagnóstico, tratamento, vigilância de contatos, prevenção de incapacidades físicas e atividades de comunicação e educação.. 42.
(43) III – OBJETIVOS. 43.
(44) 3.1 - OBJETIVO GERAL •. Avaliar a situação operacional da endemia hansênica em municípios prioritários para esse agravo das cinco regiões do Brasil, identificando os fatores que facilitam e dificultam as ações de controle da hanseníase realizadas pelos profissionais que atuam no PSF.. 3.2 - OBJETIVOS ESPECIFICOS. •. Descrever as condições de diagnóstico da hanseníase observando a proporção de equipes que realizam qualquer forma de diagnóstico e diagnóstico por exame dermatoneurológico;. •. Determinar a proporção de equipes que realizam exames dos comunicantes e a proporção que administra segunda dose de BCG;. •. Determinar o percentual de equipes que realizaram atividades de educação em saúde sobre hanseníase.. •. Determinar o percentual de equipes que têm coordenação municipal do programa de hanseníase;. •. Determinar a proporção de equipes que participaram de cursos de atualização em hanseníase e de cursos introdutórios do PSF;. •. Identificar possíveis fatores associados ao desempenho das equipes de saúde da família para o diagnóstico da hanseníase, à aplicação da 2º dose da BCG, às ações de controle dos comunicantes bem como, à realização de ações de educação em saúde e educação em saúde sobre hanseníase.. 44.
(45) IV – METODO. 45.
(46) 4.1 – DELINEAMENTO DO ESTUDO E VARIÁVEIS Trata-se de um estudo que teve um componente epidemiológico (estudo analítico do tipo transversal), e um componente operacional (avaliação de alguns elementos de estrutura, processo e resultado de um programa dentro dos serviços de saúde). Foram utilizadas variáveis referentes a características do porte populacional, organização do PSF, do Programa Nacional de Eliminação da Hanseníase dentro da estrutura político-administrativa do município, infraestrutura da Unidade Básica de Saúde - UBS, processo de trabalho das equipes de saúde da família (ESF) e realização de capacitações. Dentre as principais variáveis utilizadas no estudo destacamos:. VARIAVEIS DE PROCESSO E ESTRUTURA: •. Participação em curso introdutório do PSF,. •. Participação em curso de atualização em hanseníase,. •. Presença de coordenador municipal do PEH,. •. Cobertura do PSF e porte do município.. • VARIAVEIS DE DESFECHO: •. Realização de diagnostico;. •. Aplicação da 2° dose da BCG;. •. Realização das ações de educação em saúde;. •. Realização das ações de educação em saúde;. 46.
(47) 4.2 – O CAMPO DE ESTUDO. As principais áreas de abrangência deste estudo foram um conjunto de municípios com maior prevalência da doença e que integraram o elenco dos 109 municípios prioritários para o Programa de Eliminação da Hanseníase do Ministério da Saúde no ano de 2005. Para fins de classificação dos municípios, foram considerados prioritários todos os municípios que apresentassem as seguintes características: •. Municípios com média igual ou superior a 50 casos em curso de tratamento em dezembro de 2005;. •. Municípios com média anual de casos novos igual ou superior a 10 casos nos últimos 5 anos. •. Municípios com média anual igual ou superior a 10 casos multibacilares nos últimos 5 anos. •. Municípios com média anual igual ou superior a 10 casos em menores de 15 anos nos últimos 5 anos. Após a seleção dos estados, os municípios foram selecionados por sorteio simples e agrupados em três estratos, de acordo com o porte populacional de cada um, sendo estes municípios de pequeno, médio e grande porte, com populações de até 50 mil habitantes, de 50 a 100 mil e acima de 100 mil habitantes, respectivamente. Para viabilizar a análise dos resultados utilizouse como cobertura ideal da ESF um valor superior a 50%.. 47.
Imagem




Outline
Documentos relacionados
Figure III. 37: Water vapor-liquid interfacial tension.. 38: Ethanol vapor-liquid interfacial tension. Interfacial tension was calculated using these coefficients in
Desde logo, a nossa compreensão e interpretação da importância funcional e ritual das lamentações públicas das carpideiras e dos carpideiros egípcios é sublinhada pelo
Para avaliação do estado imunológico da população em estudo, foram colhidas amostras de soro sanguíneo de 133 aves e submetidas a provas sorológicas como a Reação
O Programa de Educação do Estado do Rio de Janeiro, implementado em janeiro de 2011, trouxe mudanças relevantes para o contexto educacional do estado. No ranking do
Sendo assim, ao (re)pensar a prática do professor em uma sala de aceleração, dispõe-se sobre ações que envolvem o contexto gerencial e pedagógico do programa, bem como
Constata - se, portanto, que, tanto o PNBE, quanto o PNLL colocam o desenvolvimento da competência leitora e a formação de leitores em destaque, seja por meio do acesso
Além disso, serão abordados os estudos sobre os dois programas que surgiram no cenário educacional como políticas públicas educacionais curriculares, com propostas
[r]