DEPARTAMENTO DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
ANA KARINE PESSOA BASTOS SIQUEIRA
SÍNTESE DE DERIVADOS DE VITAMINA A UTILIZANDO
LIPASE DE Candida antarctica IMOBILIZADA (NOVOZYME 435)
Fortaleza - Ceará
DEPARTAMENTO DE ENGENHARIA QUIMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
ANA KARINE PESSOA BASTOS SIQUEIRA
SÍNTESE DE DERIVADOS DE VITAMINA A UTILIZANDO
LIPASE DE Candida antarctica IMOBILIZADA (NOVOZYME 435)
Dissertação submetida ao Programa de Pós-graduação em
Engenharia Química, da Universidade Federal do Ceará como
requisito parcial para a obtenção do Grau Mestre em
Engenharia Química
Orientadora: Profa. Dra. Luciana Rocha Barros Gonçalves
Ficha catalográfica elaborada pela Bibliotecária Ana Cristina Azevedo U. Melo CRB-3/572
S628s Siqueira, Ana Karine Pessoa Bastos
Síntese de derivados de vitamina A utilizando lipase de candida antartica imobilizada (Novozyme 435) / Ana Karine Pessoa Bastos Siqueira.
109f., il. color. enc.
Dissertação (Mestrado) - Universidade Federal do Ceará, Fortaleza, 2007. Área de Concentração: Processos Biotecnológicos
Orientadora: Profa. Dra. Luciana Rocha Barros Gonçalves
1.Palmito de retilina 2. Adipato de retinila 3. Síntese enzimática I. Gonçalves, Luciana Rocha Barros (orient.) II.Universidade Federal do Ceará
– Pós-Graduação em Engenharia Química III. Título CDD 660
Ao meu pai, Onofre
À minha mãe, Ana
Aos meus irmãos, Moises e Karol
Ao meu marido, Robson
Pela família que somos,
À Deus.
Aos meus pais Onofre Teófilo Botelho Bastos e Ana Lúcia Pessoa Bastos pela
minha educação, formação, por terem sido sempre presentes em minhas escolhas e
ainda pelos meus dois irmãos: Moises Bastos Neto e Ana Karolina Pessoa Bastos.
Ao meu marido, Robson da Silva Siqueira, simplesmente por existir em minha
vida.
Às Professoras Luciana Rocha Barros Gonçalves e Andrea Lopes de Oliveira
Ferreira pela oportunidade, paciência, orientações na realização desta pesquisa e pela
amizade.
Ao amigo Daniel Canabrava pela paciência e pelo tempo dedicado a esclarecer
minhas primeiras dúvidas de termodinâmica.
Aos meus estimados amigos do GPBIO por terem sempre feito do laboratório
um excelente ambiente de trabalho. Em especial à Renata Ferreira Oliveira, pela
disponibilidade e constante ajuda nos experimentos nos momentos em que mais
precisei.
Aos amigos da pós-graduação: Anayla, Bete, Valderez, Jame´s, Izabelly, Juliana
e Josy, pelas dicas, pelos momentos divertidos; pelo tempo para desabafos e
principalmente pela amizade.
À Profª Otília Pessoa do Laboratório de Análises Fitoquímicas de Plantas
Medicinais (LAFIPLAM), por ter me acolhido em seu laboratório e por ter cedido
tempo do seu bolsista José Gustavo Lima de Almeida, ao qual serei sempre grata, para
me auxiliar nos experimentos de cromatografia.
Ao Prof. Edilberto Rocha Silveira do Centro Nordestino de Aplicação e Uso de
RMN (CENAUREM-UFC), pelas orientações e por ter permitido a realização dos
O objetivo desta dissertação foi sintetizar derivados de vitamina A por rota enzimática, como alternativa à rota química, que é caracteristicamente mais agressiva ao meio ambiente. A síntese do palmitato de retinila resultaria em produto com melhor aceitação de mercado, já que é mais estável do que o éster que foi utilizado como substrato, acetato de retinila. Já a síntese de adipato de retinila, tinha como principal finalidade, disponibilizar um novo derivado de vitamina A. Para ambos, visava-se a aplicação nas indústrias farmacêutica, cosmética e alimentícia. Nesse contexto, utilizou-se lipase de Candida antarctica tipo B imobilizada (Novozyme 435 com 571,48 UI/g ± 55,47) e os substratos acetato de retinila, ácidos palmítico e adípico. Além destes, peneira molecular (PM) 3Ǻ também foi adicionada, já que as reações propostas liberam água para o meio reacional, desfavoredendo a síntese do éster desejado. Dois planejamentos foram realizados para se avaliar a síntese de palmitato de retinila, ambos em volume reacional total de 2 mL. No primeiro, três variáveis foram analisadas: proporção entre os substratos, solvente e temperatura. A quantidade de acetato de retinila foi mantida em 0,1 mmol e a do ácido palmítico variando entre 0,1 e 0,5 mmol. Levando em consideração o coeficiente de partição do ácido utilizado, foram testados tolueno e hexano. As temperaturas variaram entre 25 e 40°C, de acordo com o planejamento fatorial 23 blocado com ponto central. No segundo, estudou-se a influência da quantidade de lipase (25, 50 e 75 mg) e PM (20, 50, 80 mg) em tolueno e hexano, conforme planejamento fatorial 32. Ensaios em maior escala foram realizados não apenas para o palmitato, o qual foi submetido a teste de estabilidade térmica, mas também para o adipato, que por não ser comercializado precisou ser separado da reação e identificado por ressonância magnética nuclear. Com uma análise estatística dos resultados, pôde-se observar que os parâmetros que tiveram efeito significativo no primeiro planejamento, foram a temperatura e a interação desta com a razão molar entre os substratos. No segundo, tanto a enzima como a relação quadrática da PM foram significantes no rendimento de síntese com tolueno, e apenas a enzima, quando utilizado o hexano. A separação do palmitato de retinila foi realizada em coluna de sílica C18, tendo sido avaliada em calorimetria exploratória diferencial (do inglês, differencial screening calorimetry - DSC) e observado eventos térmicos por volta de 6,54ºC. Quanto ao adipato de retinila, nenhum procedimento de separação foi eficaz para a separação da mistura formada entre o mesmo e o adipato de diretinila.
The main objective of this work was to synthesize vitamin A derivatives through an enzymatic route, as an alternative to chemistry route, more aggressive to the environment. The conversion of retinyl acetate into retinyl palmitate would result in a product with better market acceptance, since it is more stable than the ester used as substrate. Retinyl adipate synthesis, on the other hand, was studied in order to prepare a new vitamin A derivative. Both Vitamin A derivatives synthesized in this work were aiming the industrial production of cosmetics and foods. In this context, immobilized Candida antarctica type B lipase (Novozyme 435 with 571,48 UI/g ± 55,47) was used to catalyze the conversion of the substrates retinyl acetate, palmitic and adipic acids. In addition to these, molecular sieves was also added since the proposed reactions release water to the reaction media, which is not favorable to the desired ester synthesis. The retinyl palmitate synthesis was investigated by two factorial experimental design, using a total reactional volume of 2 mL. In the first, three variables were analyzed: rate between substrates, type of solvent and temperature. Retinyl acetate was kept in 0,1 mmol and palmitic acid varied between 0,1 and 0,5 mmol. Considering the acid partition coefficient, toluene and hexane were tested as solvents. The temperatures varied between 25 and 40°C, following a 23 factorial experimental design blocked with central points. In the second design, the influence of lipase (25, 50 e 75 mg) and molecular sieves (20, 50, 80 mg) amounts were studied using toluene or hexane as solvent, in accordance with a 32 factorial design. Experiments in a larger scale were performed not only to the produce retinyl palmitate, which was submitted to termic stability tests, but also to retinyl adipate, which is not commercially available and thereof it was recovered from the reactional media and identified by nuclear magnetic resonance. The statistical analysis of the results allowed the observation of significant effects. In the first planning, temperature and their interaction with the molar rate between the substrates were the significant variables. In the second, enzyme and the molecular sieves quadratic relation were significant in the yield of synthesis with toluene, but only the enzyme was significant when hexane was utilized. The retinyl palmitate separation was performed in silica C18 column and the purified sample was analyzed by differential scanning calorimetric – DS with a thermal event around 6.54ºC. In the case of retinyl adipate, no separation procedure was effective since there is a mixture formed between retinyl and diretinyl adipates.
Figura 1.1 - Estrutura molecular da β-ionona ... 2 Figura 1.2 - Estrutura dos retinóides naturais. As setas preenchidas mostram as
conversões catalisadas por enzimas. As setas pontilhadas são, prováveis
conversões, embora não tenham sido confirmadas ... 3
Figura 2.1 - Estrutura molecular da vitamina A na forma de álcool (retinol) ... 8
Figura 2.2 - Reação de síntese do palmitato de retinila com a formação do retinol,
produto da reação inversa ... 13
Figura 3.1 - Fluxograma para preparo do experimento ... 30
Figura 3.2 - Esquema de preparação das amostras para posterior análise em HPLC .... 31
Figura 3.3 - Cromatograma correspondente à injeção de palmitato de retinila padrão . 33
Figura 3.4 - Cromatograma correspondente à injeção de acetato de retinila padrão ... 33 Figura 3.5 - Cromatografia em gel ou por exclusão de tamanhos. (1) Material sendo
adicionado à coluna de SEPHADEX. (2) Coleta das frações. (3)
Cromatografia em camada delgada ... 35
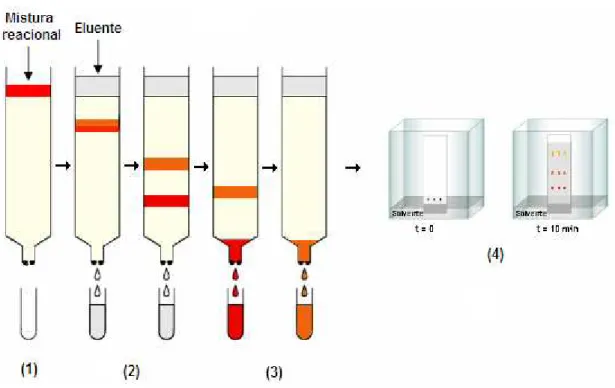
Figura 3.6 - Cromatografia em sílica gel 60 para separação dos componentes reacionais.
(1) Material adicionado à coluna de sílica. (2) Adição de eluente por ordem
crescente de polaridade. (3) Separação das substâncias de acordo com a
afinidade pelo eluente utilizado. (4) Cromatografia em camada delgada .. 37
Figura 3.7 - Cromatografia de separação fase reversa em coluna de sílica C18 para
separação dos componentes reacionais. (1) Cartucho preenchido com sílica
C18. (2) Adição do material, seco, a ser separado. (3) Eluição com metanol.
(4) Eluição com acetonitrila ou acetona ... 39
Figura 4.1 - Cromatograma de síntese de palmitato de retinila a partir de acetato de
retinila, utilizando hexano, razão molar entre os substratos de 1:1,
temperatura de 40ºC e 50 mg de ambos os componentes Novozyme 435 e
PM ... 42
Figura 4.2 - Análise quantitativa, em duplicata, dos componentes reacionais ao longo da
reação em hexano, razão molar entre os substratos de 1:1, temperatura de
40ºC e 50 mg de ambos os componentes: Novozyme 435 ePM. Formação
variáveis estudas para a produtividade de palmitato de retinila, conforme
planejamento experimental fatorial 23 blocado ... 46
Figura 4.4 - Diagrama de Pareto indicando o efeito dos valores estimados para as
variáveis estudas para a conversão de acetato a palmitato de retinila,
conforme planejamento experimental fatorial 23 blocado ... 47
Figura 4.5 - Valores previstos pelo modelo versus valores experimentais da conversão
de acetato em palmitato de retinila no planejamento experimental fatorial 23
blocado ... 48
Figura 4.6 - Influência da razão molar e da temperatura na conversão ... 50
Figura 4.7 - Valores previstos pelo modelo versus valores experimentais da
produtividade no planejamento 32 ... 52
Figura 4.8 - Diagrama de Pareto indicando o efeito dos valores estimados para as
variáveis estudas para a produtividade palmitato de retinila em hexano,
conforme planejamento 32 ... 53
Figura 4.9 - Efeito da quantidade de enzima e de peneira molecular na produtividade de
palmitato de retinila em hexano ... 55
Figura 4.10 - Valores previstos pelo modelo versus valores experimentais da conversão
no planejamento 32 ... 57
Figura 4.11 - Diagrama de Pareto indicando o efeito dos valores estimados para as
variáveis estudas para a conversão de acetato a palmitato de retinila em
hexano, conforme planejamento 32 ... 58
Figura 4.12 - Efeito da quantidade de enzima e de peneira molecular na conversão de
acetato a palmitato de retinila em hexano ... 59
Figura 4.13 - Cromatograma da síntese de palmitato de retinila a partir de acetato de
retinila após 3 horas de reação, utilizando 75 mg de Novozyme 435 e 80
mg de PM ... 61
Figura 4.14 - Cromatograma da síntese de palmitato de retinila a partir de acetato de
retinila após 3 horas de reação, utilizando 50 mg de Novozyme 435 e 50
mg de PM ... 62
Figura 4.15 - Valores previstos pelo modelo versus valores experimentais da
produtividade de acetato em palmitato de retinila no planejamento 32 ... 63
Figura 4.17 - Efeito da quantidade de enzima e de peneira molecular na produtividade
de palmitato de retinila em tolueno ... 66
Figura 4.18 - Valores previstos pelo modelo versus valores experimentais da conversão
de acetato em palmitato de retinila no planejamento 32 ... 68
Figura 4.19 - Diagrama de Pareto indicando o efeito dos valores estimados para a as
variáveis estudas para a conversão de acetato a palmitato de retinila em
tolueno, conforme planejamento 32 ... 69
Figura 4.20 - Efeito da quantidade de peneira molecular e de lipase na conversão de
acetato a palmitato de retinila em tolueno ... 70
Figura 4.21 - Reação de síntese unilateral do adipato de retinila com a formação do
retinol, como produto da reação inversa ... 72
Figura 4.22 - Cromatograma de síntese de adipato de retinila/diretinila a partir de
acetato de retinila, utilizando 20 mL de etanol, razão molar entre os
substratos de 1:2, temperatura de 40ºC e 500 mg de ambos os
componentes lipase e peneira molecular ... 73
Figura 4.23 - Termograma de DSC do palmitato de retinila sintetizado em atmosfera de
Tabela 2.1 - Absorbância máxima de luz de retinóides com as respectivas fórmula
molecular e massa molar ...18
Tabela 2.2 - Condições de análise do palmitato de retinila ... 19
Tabela 2.3 - Condições de análise do adipato de retinila ... 20
Tabela 3.1 - Níveis do planejamento experimental fatorial 23 blocado para a síntese de
palmitato de retinila em tolueno e hexano ... 24
Tabela 3.2 - Planejamento experimental fatorial 23 blocado ... 25
Tabela 3.3 - Níveis do planejamento experimental fatorial 32 para análise da influência
de enzima e peneira molecular na síntese de palmitato de retinila ... 26
Tabela 3.4 - Concentrações utilizadas para o preparo da curva de calibração ... 29
Tabela 3.5 - Eluentes por ordem crescente de polaridade utilizados para a separação do
adipato e palmitato de retinila do meio reacional e posterior identificação
por NMR ... 36
Tabela 4.1 - Resultados do planejamento experimental fatorial 23 blocado para a
produtividade e conversão de palmitato de retinila, com 3 horas de reação
... 44
Tabela 4.2 - Estimativas dos efeitos principais e suas interações na produtividade de
palmitato de retinila ... 45
Tabela 4.3 - Estimativas dos efeitos principais e suas interações na conversão de acetato
a palmitato de retinila ... 47
Tabela 4.4 - Análise da variância (ANOVA) para a síntese enzimática de palmitato de
retinila, resposta: Conversão ... 49
Tabela 4.5 - Resultados de produtividade e conversão obtidos com 3 horas de reação no
planejamento 32 utilizando hexano ... 51
Tabela 4.6 - Efeitos estimados para a produtividade de palmitato de retinila em hexano
... 51
Tabela 4.7 - Análise da variância (ANOVA) para a síntese enzimática de palmitato de
retinila em hexano, resposta: Produtividade ... 53
Tabela 4.8 - Efeitos estimados para a conversão de acetato a palmitato de retinila em
Tabela 4.10 - Resultados de produtividade e conversão obtidos com 3 horas de reação
no planejamento 32 utilizando tolueno ... 61
Tabela 4.11 - Efeitos estimados para produtividade de palmitato de retinila em tolueno
... 62
Tabela 4.12 - Análise da variância (ANOVA) para a síntese enzimática de palmitato de
retinila em tolueno, resposta: Produtividade ... 64
Tabela 4.13 - Efeitos estimados para a conversão de acetato a palmitato de retinila em
tolueno ... 67
Tabela 4.14 - Análise da variância (ANOVA) para a síntese enzimática de palmitato de
retinila em tolueno, resposta: Conversão ... 69
Tabela 4.15 - Cálculos realizados utilizando a teoria funcional da densidade na
aproximação da densidade local (DFT-RB3LYP) com o conjunto de base
3-21G para as moléculas de ácido adípico e adipato de retinila na fase
gasosa, usando o programa Gaussian 03, tendo sido a geometria
otimizada dos compostos, obtida por minimização da energia
... 71
Tabela 4.16 - Eluentes por ordem crescente de polaridade e respectivos frascos
Lista de Figuras ... i
Lista de Tabelas ... iv
1. Introdução ... 1
2. Revisão Bibliográfica 2.1. Ésteres de retinila ... 7
2.2. Por que não partir do retinol?... 7
2.3. Rota Enzimática – Utilização de lipase imobilizada (Novozyme 435) ... 8
2.4. Aplicações dos derivados de vitamina A ... 10
2.5. Efeito da temperatura ... 11
2.6. Efeito da proporção molar entre os substratos ... 12
2.7. Reação enzimática ... 12
2.8. Influência da quantidade de enzima ... 14
2.9. Influência da quantidade de peneira molecular (PM) ... 14
2.10. Influência dos solventes orgânicos ... 15
2.11. Análise dos ésteres de retinila ... 16
2.12. Identificação – Métodos de detecção ... 17
2.13. Separação e purificação dos componentes da reação ... 20
2.14. Estabilidade dos produtos obtidos ... 22
3. Materiais e Métodos 3.1. Materiais ... 23
3.2. Métodos 3.2.1. Estudo das condições operacionais de síntese do palmitato de retinila ... 24
3.2.2. Ensaio para separação do palmitato de retinila sintetizado ... 26
3.2.3. Síntese de adipato de retinila ... 27
3.2.4. Curvas de calibração ... 28
3.2.5. Preparo da reação ... 29
3.2.6. Preparo das amostras para análise em HPLC ... 30
3.2.7. Análise em HPLC ... 31
3.2.9. Mecanismos de separação ... 34
3.2.9.1. Exclusão por tamanho - Separação em coluna Sephadex ... 34
3.2.9.2. Separação em coluna de sílica gel 60 ... 36
3.2.9.3. Fase Reversa - Separação em Coluna de Sílica C18 ... 38
3.2.10. Avaliação da estabilidade térmica do palmitato de retinila ... 39
4. Resultados e Discussões 4.1. Síntese de palmitato de retinila ... 41
4.1.1. Influência da razão molar entre os substratos, temperatura e solvente na síntese de palmitato de retinila ... 41
4.1.1.1. Efeito da razão molar entre os substratos, temperatura e solvente na produtividade de palmitato de retinila ... 44
4.1.1.2. Efeito da razão molar entre os substratos, temperatura e solvente na conversão de acetato a palmitato de retinila ... 46
4.1.2. Influência da peneira molecular e da quantidade de lipase na síntese de palmitato de retinila em hexano ... 50
4.1.2.1. Efeito da quantidade de enzima e de peneira molecular na produtividade de palmitato de retinila em hexano ... 51
4.1.2.2. Efeito da quantidade de enzima e de peneira molecular na conversão de acetato a palmitato de retinila em hexano ... 55
4.1.3. Influência da quantidade de lipase e de peneira molecular na síntese de palmitato de retinila em tolueno ... 60
4.1.3.1. Efeito da quantidade de lipase e de peneira molecular na produtividade de palmitato de retinila em tolueno ... 62
4.1.3.2. Efeito da quantidade de peneira molecular e de lipase na conversão de acetato a palmitato de retinila em tolueno ... 66
4.3.2. Separação em coluna de sílica gel 60 ... 74
4.3.3. Separação em coluna de sílica C18 ... 75
4.4. Calorimetria exploratória experimental do palmitato de retinila ... 76
5. Conclusões 5.1. Influência da razão molar entre substratos, temperatura e solvente ... 78
5.2. Influência da quantidade de lipase e de peneira molecular em hexano ... 79
5.3 Influência da quantidade de lipase e de peneira molecular em tolueno ... 79
5.4. Separação do palmitato de retinila sintetizado ... 79
5.5. Síntese de adipato de retinila ... 79
6. Referências Bibliográficas ... 80
7. Anexos 7.1. Anexos A ... 86
7.2. Anexos B ... 88
1. INTRODUÇÃO
As vitaminas são nutrientes orgânicos essenciais e não-calóricos, necessários em
pequenas quantidades na dieta e que ajudam a conduzir o processo celular. Os primeiros
registros de vitaminas datam do início do século XX, tendo sido nomeadas e muitas
também abreviadas por letras e números, à medida que foram sendo descobertas. São
naturalmente divididas em duas classes: lipossolúveis e hidrossolúveis. Vitaminas
lipossolúveis podem ser armazenadas com outros lipídios no tecido adiposo, e, pelo fato
de serem armazenadas, algumas podem atingir concentrações tóxicas. As hidrossolúveis
são geralmente absorvidas diretamente pela corrente sangüínea, sendo o excesso
excretado na urina. Dessa forma, o risco de toxicidade imediata não é tão provável
quanto o é para as lipossolúveis, exceto em casos de doses extremamente altas (Sizer e
Whitney, 2003).
Assim como as vitaminas D, E e K, a vitamina A é lipossolúvel e uma vez
absorvida, é armazenada no fígado e no tecido adiposo até que o organismo sinta
necessidade de consumi-la.
Atualmente, alguns autores utilizam o termo “vitamina A” não unicamente para
se referir ao retinol (vitamina A na forma álcool). Assim, Blomhoff et al. (1990)
definiram-na não apenas como uma única molécula, mas sim, como um grupo de
moléculas (retinóides) que apresentam a mesma função biológica do retinol. Da mesma
forma, Keller e Fenske (1998) e Sorg et al. (2006) afirmaram que o termo “retinóides” inclui tanto os derivados naturais quanto os sintéticos da vitamina A, relacionados
estruturalmente, bem como o retinol, os ésteres de retinila e o ácido retinóico
(tretinoína). Almeida-Muradian e Penteado (2003) empregaram genericamente o termo
vitamina A para todos os derivados da β-ionona (exceto os carotenóides cujo termo é pró-vitamina A) que possuam atividade biológica do retinol all-trans ou estejam
CH3 C
H3
CH3
O CH3
Figura 1.1: Estrutura molecular da β-ionona.
Uma das fontes mais ricas de vitamina A é o óleo de fígado de peixes marinhos
e de mamíferos. Embora muitos vegetais e frutas apresentem seu precursor, o β -caroteno e não a vitamina A na forma ativa, os alimentos que fornecem vitamina A
pré-formada na forma ativa são os alimentos de origem animal (Sizer e Whitney, 2003;
Almeida-Muradian e Penteado, 2003).
No sangue e nos tecidos, os retinóides predominantes são o retinol e seus ésteres.
Na pele, somam mais do que 99% do total dos retinóides cutâneos (Sorg et al., 2006).
Os derivados de vitamina A (ésteres de retinila) e pró-vitamina A (carotenóides)
contidos nos alimentos, sofrem as ações dos sucos gástrico, pancreático e intestinal.
Antes de serem absorvidos, os ésteres de retinila são enzimaticamente convertidos a
retinol no interior do intestino, onde é re-esterificado, principalmente sob a forma de
palmitato de retinila, sendo incorporado aos quilomícrons, principais lipoproteínas do intestino, e excretado na linfa (Blomhoff et al., 1990 e Guilland e Lequeu, 1995).
O retinol, sintetizado no intestino tanto por hidrólise de ésteres de retinila quanto
por oxidação de vários carotenóides, pode ainda ser oxidado à retinaldeído, e então, a
ácido retinóico, que é uma forma ativa da vitamina A (Castenmiller, 1998). Depois de
absorvido, é transportado na circulação por proteínas específicas. Através de difusão
passiva, penetram nas células da pele, onde é metabolizado em, pelo menos, quatro
importantes produtos: ésteres de retinila, 14-hidroxi-4,14-retro-retinol,
3,4-didehidroretinol all-trans (e seus ésteres) e ácido retinóico all-trans (tRA). Desses
quatro metabólitos, os ésteres de retinila apresentam os maiores níveis e funcionam
como reserva de retinol. Sua hidrólise disponibiliza o retinol, o qual pode ser
Os quilomícrons são formados no intestino e transportam a gordura da alimentação, distribuindo-a pelo organismo para utilização e armazenamento.
metabolizado (Fischer e Voorhees, 1996) ou esterificado com ácidos graxos para formar
novamente os ésteres de retinila (Roos, et al., 1998).
A Figura 1.2 mostra várias formas de retinóides e ainda algumas possíveis
conversões que podem sofrer à medida que vão sendo sintetizados e absorvidos no
organismo.
Figura 1.2. Estrutura dos retinóides naturais. As setas preenchidas mostram as
conversões catalisadas por enzimas. As setas pontilhadas são, prováveis conversões,
embora não tenham sido confirmadas.
O OH
O OH
O O
R
Ácido Retinóico Retinaldeído Retinol
4-oxoretinaldeído
Ácido 4-oxoretinóico 4-oxoretinol
O
O
OH
O
O
OH O
A biodisponibilidade e a digestão da Vitamina A são afetadas pelo estado
nutricional do indivíduo e pela integridade da mucosa intestinal. Em condições normais,
90% da vitamina A é armazenada no fígado, podendo aparecer em pequenas
quantidades em outros tecidos. Deve-se ressaltar ainda que as proteínas, gorduras,
vitaminas e zinco são fatores nutricionais importantes para a biodisponibilidade da
vitamina A (Machlin, 1990).
Para atender a demanda das necessidades dos tecidos por retinóides, o retinol se
liga à proteína carregadora do retinol (do inglês, retinol-binding protein ou RBP) para
ser liberado na circulação sangüínea e ser transportado num estado complexado até os
tecidos. Os metabólitos da vitamina A são excretados na urina (DRI, 2001).
Os ésteres de vitamina A podem ser isolados diretamente dos óleos encontrados
em peixes marinhos e mamíferos, por destilação molecular à baixa pressão.
Alternativamente, a vitamina A pode ser extraída diretamente com clorofórmio ou
outros solventes combinados, como o hexano com etanol, seguido de uma purificação
cromatográfica (Almeida-Muradian e Penteado, 2003).
Uma carência nutricional preocupante em nível de saúde pública é a
hipovitaminose A (deficiência de vitamina A). Ela afeta as estruturas epiteliais de
diferentes órgãos, sendo nos olhos o mais evidente. Uma carência prolongada pode
causar alterações na pele, tornando-a áspera, seca e escamosa, decorrente do aumento de
queratinização. A deficiência de vitamina A representa a principal causa de cegueira
evitável no mundo, estando também associada a 23% das mortes por diarréias em
crianças, além de contribuir para esterilidade masculina e a baixa resistência às
infecções, devido ao seu papel na manutenção da integridade das membranas mucosas
(Germano, 2002). Calcula-se que a hipovitaminose A atinja cerca de 254 milhões de
crianças em todo o mundo. Quanto à magnitude do problema, as conseqüências
patológicas atingem níveis alarmantes no semi-árido nordestino.
Desde 1994 (Portaria nº 2.160, de 29 de Dezembro de 1994 - Programa de
Vitamina A) o Ministério da Saúde vem atuando em ações de intervenções visando a
eliminação da deficiência de vitamina A no Brasil. As estratégias de intervenções são
estabelecidas através da suplementação com megadoses de vitamina A às crianças de 6
educativas implementadas pelos Agentes Comunitários de Saúde e também através dos
meios de comunicação de massa, disponibilizando informações à população que visem a
seleção de alimentos ricos em retinol (vitamina A de origem animal) e carotenóides
(vitamina A de origem vegetal), na composição de sua alimentação diária. Atualmente,
o Programa vem sendo desenvolvido no Nordeste e no Vale do Jequitinhonha/MG,
regiões reconhecidas como "bolsões endêmicos" da deficiência de Vitamina A
(http://dtr2004.saude.gov.br/nutricao/vita.php).
É preconizado que a suplementação de megadoses de vitamina A seja feita com
intervalo de 4 a 6 meses. Assim, forma-se uma reserva corporal da vitamina que garante
o aporte orgânico, em situações em que o consumo, via alimentação, não é suficiente
para suprir as necessidades diárias da vitamina.
A vitamina A é um antioxidante e como tal, liga-se a radicais livres, ou seja,
defende os lipídeos do corpo. Os radicais livres freqüentemente rompem ácidos graxos
insaturados, prejudicando a habilidade da membrana em transportar substâncias para
dentro e para fora da célula. Os radicais livres também prejudicam as proteínas
celulares, alterando suas funções e o DNA, perturbando todas as células que herdaram
esse DNA danificado. Quando os radicais livres no corpo excedem as defesas contra
eles, ocorre o conhecido estresse oxidativo. Há uma ligação íntima entre esse estresse e
doenças como artrite, catarata, doenças renais, alguns tipos de câncer e doenças
cardiovasculares (Campbel, 2000). Portanto, outro apelo para o estudo da produção de
derivados de vitamina A é seu uso na indústria farmacêutica e alimentícia.
No segmento das indústrias não-alimentícias, os ésteres de retinila podem ser
usados nas seguintes categorias industriais: indústria farmacêutica (cremes faciais,
medicamentos para pele, creme hidratante, pomadas cicatrizantes e etc) e indústria
cosmética (produtos destinados à fabricação de maquiagem, cremes, sabonetes e
perfumes, óleo para cabelo, batons, pós faciais, etc).
Atualmente, vem sendo dirigido intenso esforço de pesquisa acadêmica e
industrial para a busca de rotas alternativas de produção dessas moléculas, de modo a
atender às crescentes restrições das legislações nacionais de controle ambiental. Para
isso, procura-se substituir a síntese química por reações enzimáticas, pois enzimas
“limpos”, baseados na catálise enzimática são caracteristicamente menos agressivos ao
ambiente. Nesse contexto, este trabalho tem como objetivo sintetizar ésteres de vitamina
A, palmitato e adipato de retinila, utilizando lipase imobilizada de Candida antarctica,
comercialmente conhecida como Novozyme 435.
Tal síntese será obtida por acidólise, que é um tipo de reação caracterizada pela
interação entre um éster e um ácido para a obtenção de um novo éster e um novo ácido.
Assim, enquanto a reação entre ácido palmítico e acetato de retinila foi proposta para a
síntese de palmitato de retinila, para a síntese do adipato de retinila, utilizou-se ácido
adípico e acetato de retinila como éster de partida.
Com a finalidade de se otimizar a síntese do palmitato de vitamina A, as variáveis
conversão e produtividade foram selecionadas e avaliadas em termos de temperatura,
solvente e razão molar entre os substratos. Um planejamento 23 blocado foi realizado,
fixando-se em 50 mg tanto a quantidade de peneira molecular como também a de lipase
imobilizada, para se avaliar a influência da temperatura, razão molar entre os substratos
e solvente. Da mesma forma, as quantidades de peneira molecular e de lipase também
foram variadas, de acordo com planejamento 32, para que fossem avaliadas suas
influências na obtenção do palmitato de retinila. Assim, pretendeu-se propor um
2. REVISÃO BIBLIOGRÁFICA
Nesse capítulo, serão discutidas algumas propriedades dos ésteres de retinila e
apresentadas algumas aplicações, bem como o desenvolvimento de pesquisas que
envolvem a sua síntese, levando em consideração efeitos como temperatura, solvente e
proporção entre substratos. Também serão apresentados alguns estudos realizados com
a finalidade de separar os ésteres obtidos.
2.1. Ésteres de retinila
Somente alguns compostos de retinóides puros estão disponíveis
comercialmente. Dentre eles, acetato de retinila e palmitato de retinila (Gundersen e
Blomhoff, 2001). Enquanto que o palmitato de retinila (C16) é conhecido como o mais
estável dos ésteres de vitamina A disponíveis, os derivados de vitamina A com cadeia
curta (como por exemplo, acetato de retinila) são conhecidos por perderem atividade
quando estocados (Idson, 1993).
2.2. Por que não partir do retinol?
Em 1988, o retinol já estava sendo incorporado a muitos produtos de cuidado
para a pele (Connor, 1988). Apesar disso, Rejasse et al. (2003) descreveram que, além
deste ter custo elevado, sua molécula é muito instável. Portanto, levando em
consideração as dificuldades que devem ser reduzidas no contexto experimental, a
utilização de retinol como substrato para a síntese de derivados de vitamina A, poderia
trazer prejuízo frente a sua instabilidade operacional. Outro fator também observado por
esses autores foi a formação de produtos secundários, o que pode acarretar em menor
A Figura 2.1 mostra a estrutura molecular da vitamina A na forma de álcool
(retinol) que, segundo Gundersen e Blomhoff (2001), além de ser termolábel, é também
fotossensível e facilmente atacada por agentes oxidantes. Isso se deve, principalmente,
ao canal polieno rico em elétrons, que consiste em várias ligações duplas
carbono-carbono conjugadas. Na molécula do retinol, cinco ligações duplas estão conjugadas,
embora aquela no anel não esteja em completa ressonância com a cadeia lateral devido
ao impedimento estérico.
Figura 2.1: Estrutura molecular da vitamina A na forma de álcool (retinol).
2.3. Rota Enzimática – Utilização de lipase imobilizada (Novozyme 435)
Em diversos países, os processos industriais de fabricação de ésteres de retinila
ocorrem por rota química (Bigger et al., 1997 e Corey et al., 1999). Entretanto, essa rota
apresenta algumas desvantagens, tal como, a produção de grandes quantidades de
resíduos químicos. Além disso, a instabilidade do retinol e dos ésteres de retinila,
resultam na formação de co-produtos. Nesse contexto, as enzimas vem desempenhando
importante papel no que diz respeito a substituição da rota química por uma “rota verde”. O uso de lipases como catalisadores de reações, por exemplo, tem recentemente
se mostrado um método bastante promissor, pois operam em condições amenas de
reação, além de possuírem alta eficiência catalítica e boa seletividade (Dordick, 1996).
Assim, as lipases (triacilglicerol hidrolases E.C. 3113) têm papel de destaque
notadamente dada a sua versatilidade (Palomo et al., 2002). São citadas por Paiva et al.
(2000) por apresentarem capacidade intrínseca de catalisar a quebra de ligações
carboxil-éster em tri, di e monoacilgliceróis (maior constituinte de animais e plantas). E
por Maugard et al. (2002) que afirmaram a capacidade da mesma em catalisar a
hidrólise de acilglicerídeos. Além disso, são regioespecíficas e atuam em uma larga
C. antarctica) aparece como alternativa interessante aos processos químicos
convencionais, pois as enzimas são altamente seletivas, o que resulta em produtos muito
mais puros. Visto a ampla aplicação dos derivados de vitamina A em produtos que
variam desde um simples suplemento alimentar até um medicamento de uso restrito,
torna-se importante o conhecimento de uma rota que leve a sua obtenção na forma mais
pura possível.
A reação de síntese poderá fornecer resultados ainda melhores, caso a utilização
da enzima na forma imobilizada seja adotada, pois fatores como estabilidade e atividade
enzimática são aprimorados. Além dessas vantagens, ainda há a reciclabilidade da
mesma (Sharma et al., 2001), uma propriedade obtida com o processo de imobilização,
que pode reduzir custos pelo fato de tornar a enzima útil por mais de um ciclo de
operação. Dessa forma, a Novozyme 435 é uma lipase do tipo CAL-B Candida
antarctica produzida por fermentação submersa de microorganismos aspergillus orizae
geneticamente modificada e imobilizada por adsorção sobre resina acrílica macroporosa
numa concentração de 3% massa/massa. Consiste de partículas com diâmetro na escala
de 0,3-0,9 nm, densidade aproximada de 430 Kg/m3, contendo 1-2% de água
massa/massa (Zimmermann, 2005).
Maugard et al. (2000) utilizaram a enzima imobilizada, Novozyme 435, para a
síntese de derivados de vitamina A em meio orgânico. Em 2002, os mesmos autores
utilizaram-na novamente para a síntese de adipato de retinila, obtendo mais de 70% de
rendimento ao final da reação. Da mesma forma, Rejasse et al. (2003) também a
utilizaram em meio orgânico para a obtenção de derivados da vitamina A.
Em 2006, Chunhua et al. testaram o efeito de cinco tipos de enzimas para a
síntese de palmitato de retinila, dentre elas, lipase de Mucor miehei (Lipozyme RM IM),
lipase Thermomyces lanuginosus (Lipozyme TL IM) e lipase de Cândida antarctica
(Novozyme 435). Dentre essas, somente a Novozyme 435 apresentou bons resultados
2.4. Aplicações dos derivados de vitamina A
Os retinóides têm importantes efeitos biológicos: regulação do crescimento e
diferenciação de células epiteliais, inibição do crescimento de tumores durante
carcinogênese experimental, diminuição do crescimento de células malignas,
diminuição do processo inflamatório, e ativador do sistema imunológico (Keller e
Fenske, 1998). Nesse contexto, representam grande potencial comercial, tanto na área
de cosméticos, como também na indústria farmacêutica.
No que se refere à indústria de cosméticos, merecem destaque os produtos que
combatem o fotoenvelhecimento. Já no âmbito da indústria farmacêutica, os retinóides
são amplamente abordados na literatura pelo seu uso na prevenção de câncer em muitos
locais-alvos do epitélio tanto de animais como de humanos (Sporn e Roberts, 1983 e
Hong e Sporn, 1997). Além disso, são utilizados no tratamento de doenças, tais como:
Leucemia mielogênita aguda (William, 2001);
Psoríase – doença de pele (Keller e Fenske, 1998);
Lupus cutâneo eritematoso – doença do sistema imune (Keller e Fenske, 1998);
Acne/Rosácea – processo inflamatório/infeccioso da pele (Keller, e Fenske, 1998 e Francis et al., 2006);
Melanoma (Francis et al. , 2006 e Niles, 2000);
Mesmo sendo úteis no melanoma, é provável que os retinóides não curem câncer
de pele, embora o tratamento envolvendo a sua utilização, previna a formação de novas
lesões, contanto que a terapia não seja descontinuada (Keller e Fenske, 1998). Além da
atuação dos retinóides em tratamento de algumas doenças, Sorg et al. (2006) afirmaram
que atuam como potentes filtros de luz UV, pela capacidade que possuem de absorver
fortemente esses raios. Duell et al. (1997) complementaram que o retinol absorve a luz
UV em comprimento de onda menor (325 nm) do que o retinaldeído (385 nm) e o ácido
retinóico, além de ser mais estável por ser um fraco precursor deste último. Quanto aos
ésteres de retinila, apresentam o mesmo espectro de absorção de UV que o retinol e
ainda possuem o melhor perfil de tolerância para uso tópico, visto que são os mais
A estabilidade do componente ativo numa formulação farmacêutica é de extrema
importância e deve ser considerada no processo de fabricação do produto, devendo este,
apresentar atividade biológica satisfatória, minimizando os riscos para o paciente e
assim, tornando o tratamento eficaz. Para tanto, segundo Sorg et al. (2006), a ordem de
tolerância dos retinóides para uso tópico é: ésteres de retinila > retinol = retinaldeído >>
ácido retinóico. Apesar deste último ser largamente utilizado tanto para várias doenças
de pele como também para melhorar o aspecto de envelhecimento da mesma, seu uso
tópico induz irritação, o que implica na descontinuidade da terapia por parte do
paciente.
2.5. Efeito da temperatura
A temperatura é um importante fator que pode afetar não apenas a atividade
enzimática, mas também a dissolução dos substratos. Com base nisto, Maugard e Legoy
(2000) utilizaram temperatura de 55°C para estudar a síntese de ésteres de retinila a
partir do retinol e obtiveram 75% de conversão com 5 horas de reação e máximo de
90% depois de 20 horas.
Já em 2002, Maugard et al. estudaram a síntese de derivados de vitamina A
hidrossolúeis, utilizando temperatura de 40°C, obtendo rendimento de 73% para a
síntese de adipato de retinila a partir da acidólise do palmitato de retinila e ácido
adípico. No ano seguinte (2003), Rejasse et al. estudaram a influência da temperatura
não apenas na síntese de ésteres de retinila por hidrólise reversa, ou seja, a partir do
retinol, mas também por acidólise, no caso, de adipato de retinila a partir do palmitato.
Dessa forma, observaram que a temperatura ótima de síntese era de 40°C para ambas as
reações.
Ao contrário do que foi verificado pelos dois últimos autores, Chunhua et al.
(2006) estudaram a síntese de palmitato de retinila e observaram que a temperatura
ótima era de 25°C, na qual 81,5% de acetato de vitamina A foram convertidos a
palmitato de retinila. Mostraram ainda que abaixo de 25°C, a atividade da enzima limita
acetato de retinila decresce, resultando no decréscimo de rendimento do produto
desejado.
Com base no estudo já realizado pelos autores acima citados, decidiu-se avaliar a
síntese de palmitato de retinila em ambas as temperaturas, ou seja, 25 e 40ºC.
2.6. Efeito da proporção molar entre os substratos
Maugard e Legoy (2000) e Maugard et al. (2000) utilizaram proporção 1:1 entre
os substratos retinol e determinados doadores de acila para a síntese enzimática de
derivados de vitamina A. Maugard et al. (2002) afirmaram que a quantidade de doador
de grupos acila deveria estar em excesso para garantir o equilíbrio em favor da reação
de síntese. Portanto, utilizaram proporção de 1:5 entre retinol e doador de acila,
respectivamente, para estudar sínteses de derivados de vitamina A.
Em 2003, Rejasse et al. testaram várias proporções e observaram que quando a
razão molar retinol/ácido adípico decrescia, o rendimento de síntese de adipato de
retinila aumentava, mas alcançou um máximo na razão crítica de 1:5 entre os substratos.
Da mesma forma, na reação de acidólise, observaram que a proporção 1:5 entre
palmitato de retinila e ácido adípico, respectivamente, fornecia conversão de 73% para
adipato de retinila, com apenas 9% de hidrólise e conseqüente formação de retinol.
Chunhua et al. (2006) testaram várias razões molares entre os substratos ácido
adípico e acetato de retinila, em hexano a 25 °C. A concentração de acetato foi fixada
em 1,2 mmol e do ácido variou entre 1,2 e 12 mmol. Com o aumento da razão molar
acetato/ácido, observou-se aumento do rendimento de palmitato, atingindo valor
máximo com razão de 1:3.
2.7. Reação enzimática
Enzimas são catalisadores e, portanto, apenas aumentam a velocidade na qual a
reação acontece, diminuindo sua energia de ativação. São proteínas com atividade
CH3 C H3 CH3 O O CH3 CH3
CH3 H3C (CH2)14
O
OH
+
Ác. palmítico
Acetato de retinila
CH3 C H3 CH3 O O
(CH2)14 CH3
CH3 CH3
+ C H3 O OH Ác. acético CH3 C H3 CH3 OH
CH3 CH3
Palmitato de retinila Retinol
alto peso molecular dessas proteínas permite que as mesmas atinjam conformações
espaciais tais que apenas seus substratos atingem o centro ativo.
Lipases (glicerol éster hidrolase) são enzimas obtidas de fontes animais, vegetais
e microbianas, cuja atuação é na interface orgânica-aquosa, catalisando a hidrólise de
ligações ésteres carboxílicas. A utilização de lipases não é restrita a reações de hidrólise,
ela também contempla transformações como esterificações e transesterificações (Freitas
et al., 2003). As lipases mais estudadas são as microbianas, produzidas
extracelularmente por fermentação de leveduras, fungos e bactérias. Entre essas
enzimas, a lipase de Candida antarctica é uma das mais atraentes comercialmente
disponíveis para reações de produção de derivados de vitamina A (Maugard et al.,
2000).
A Figura 2.2 exemplifica uma reação enzimática intitulada de acidólise, na qual
o produto é obtido a partir da adição de um ácido a um éster. No caso, ácido palmítico
foi adicionado a acetato de retinila com a finalidade de sintetizar palmitato de retinila.
Essa reação pode ser favorecida pela secagem prévia do solvente, a qual minimizaria a
presença de água no meio e consequentemente, desfavoreceria a formação do produto
intermediário, retinol. Além do palmitato, adipato de retinila também pode ser obtido
por acidólise, adicionando ácido adípico a acetato ou palmitato de retinila, como será
abordado posteriormente.
Figura 2.2: Reação de síntese do palmitato de retinila com a formação do retinol,
2.8. Influência da quantidade de enzima
Maugard e Legoy (2000) estudaram a síntese de derivados de retinila utilizando
100 mg de lipase imobilizada comercialmente (Novozyme 435), obtendo
metil-succinato de retinila com mais de 70% de rendimento em 50 h de reação. No mesmo
ano, Maugard et al. também utilizaram 100 mg de lipase com a finalidade de obter
L-lactato de retinila a partir do retinol. Ao final de 20 h de reação, alcançaram rendimento
máximo de 90%.
Em 2002, Maugard et al utilizaram 25 mg da mesma enzima para a síntese de
derivados hidrossolúveis do retinol, tais como adipato de retinila e metil-adipato de
retinila. No ano seguinte, Rejasse et al. (2003) também utilizaram 25 mg de lipase
(Novozyme 435) para a obtenção de derivados de vitamina A. Para tanto, avaliaram por
hidrólise reversa, ou seja, a partir do retinol, obtendo adipato de retinila e adipato de
diretinila ao mesmo tempo. Por acidólise, partindo do palmitato de retinila juntamente
com ácido adípico, obtiveram bom rendimento de adipato de retinila, acompanhado de
alta concentração do substrato ácido.
Chunhua et al. (2006) utilizaram 100 mg de cinco diferentes tipos de lipases e
obtiveram os maiores rendimentos quanto à síntese de palmitato de retinila, quando
utilizaram Novozyme 435 (75,2%) e lipase de Candida antarctica imobilizada por
adsorção pelo próprio grupo de pesquisa (77,5%). Com base nos bons resultados
apresentados pela lipase imobilizada pelo grupo, estudaram o efeito da sua quantidade
no rendimento de síntese. Dessa forma, compararam os resultados com 50 e 150 mg de
lipase. Assim, observaram que o rendimento de palmitato de retinila ao final de 12 h de
reação, era baixo quando utilizado 50 mg e na outra quantidade avaliada.
2.9. Influência da quantidade de peneira molecular (PM)
Além do solvente utilizado ser composto por água, mesmo que em pequenas
quantidades, a própria reação de acidólise, proposta para a síntese de éster de retinila,
também disponibiliza água para o meio, portanto, é essencial que seja avaliada a
quantidade ideal de PM a ser utilizada, para que o desempenho da lipase não seja
As lipases foram originalmente designadas pela natureza para catalisar a quebra
de ésteres via reação de hidrólise (com consumo concomitante de moléculas de água).
No entanto, assim como para muitas reações químicas, partindo do princípio da
quimioreversibilidade, a reação inversa (isto é, a síntese de ésteres) também ocorre em
nível molecular. Dessa forma, a conversão de equilíbrio depende da quantidade de água
presente na mistura reacional (Paiva et al., 2000).
Maugard e Legoy (2000) utilizaram 250 mg de PM 3Å para a obtenção de
derivados de vitamina A tais como succinato de retinila, L-lactato de retinila,
metil-adipato de retinila e oleato de retinila. No mesmo ano, Maugard et al. verificaram que
com a utilização de 50 g/L de PM 3Å, foi possível aumentar a conversão de retinol em
L-lactato de retinila de 60 para 75%, com 5 h de reação.
2.10. Influência dos solventes orgânicos
Os solventes orgânicos modificam a conformação nativa da enzima pelo
rompimento da ligação de hidrogênio e interações hidrofóbicas, conduzindo a mudança
de atividade e estabilidade (Cremonesi et al., 1974). Além disso, possuem vários efeitos
físico-químicos em enzimas, sendo a natureza e polaridade do meio orgânico, fatores
que afetam a atividade das lipases (Laane et al., 1987). Quanto aos ésteres de vitamina
A, são rapidamente inativados em solução aquosa durante exposição à luz (Allwood e
Plane, 1984 e Paquette e Kanaan, 1985). Além do tipo de solvente orgânico utilizado
afetar fortemente a atividade enzimática, bem como a seletividade no meio orgânico,
desempenha papel crucial na solubilização do agente acilante, contribuindo para o
rendimento de síntese. Nesse contexto, Maugard et al. (2000) estudaram a síntese de
ésteres de vitamina A por transesterificação catalisada por enzima, testando vários
solventes, tais como, hexano, álcool tert-amil, dioxano e ciclohexanona. Contudo, os
maiores rendimentos foram obtidos quando utilizados solventes apolares como hexano.
Em 2002, Maugard et al. estudaram o efeito existente entre várias enzimas em alguns
solventes e identificaram que a lipase de Candida antarctica, (Novozyme 435) foi o
catalisador mais eficaz para a obtenção de derivados de vitamina A através da acilação
do retinol. Da mesma forma, verificaram que a mesma mostrava boa atividade em
Rejasse et al. (2003) estudaram o efeito de solventes na síntese de adipato de
retinila por acidólise. Assim como para a hidrólise reversa, observaram que a
transferência de grupos acila entre ácido adípico e palmitato de retinila era melhor em
solventes com valores de log P* menores do que 1,5 (exceto acetonitrila – CH3CN). Os melhores rendimentos de síntese foram obtidos em dioxano e álcool tert-amil (73%). De
fato, palmitato de retinila é uma molécula muito hidrofóbica e muito pouco solúvel em
acetonitrila, solvente no qual somente 6% de adipato de retinila foram obtidos. Em
solventes hidrofóbicos, tais como hexano e tolueno, a solubilidade do ácido adípico foi
pequena e conseqüentemente, a síntese foi ineficiente (0%).
Chunhua et al., 2006 analisaram seis diferentes tipos de solventes para a
interesterificação de acetato de retinila catalisada por lipase. Ao final, verificaram que o
rendimento do palmitato de retinila dependia parcialmente da polaridade do solvente,
sendo os maiores valores obtidos quando utilizados solventes com baixa polaridade ou
apolares, como hexano e isooctano. Nessas condições obtiveram 79,5 e 78,5% de
palmitato de retinila, respectivamente, contra apenas 8,4% de conversão quando
utilizado solvente muito apolar, tal como álcool tert-amil.
2.11. Análise dos ésteres de retinila
Gundersen e Blomhoff (2001) determinaram cromatograficamente os retinóides
naturais presentes em amostras biológicas e afirmaram que o caminho clássico para a
extração dos mesmos é pela adição de um solvente imiscível em água depois da
precipitação protéica, seguida de agitação vigorosa por 5 a 10 minutos, centrifugação e
remoção da fase orgânica. Esse procedimento deveria ser repetido de uma a três vezes,
sendo o solvente removido por vácuo ou com aquecimento e uma cuidadosa purga com
gás inerte. O resíduo era, então, dissolvido na fase móvel ou em outro solvente tal como
metanol. Solventes comumente utilizados em extração são, por exemplo, hexano,
acetona, clorofórmio ou mistura desses.
*
Segundo Nöll (1996) HPLC é freqüentemente dividida em normal e
fase-reversa. Na primeira, a fase estacionária é polar, como por exemplo, sílica ou sílica
modificada com grupos polares tais como CN ou NH2 e o eluente é um líquido apolar,
como o hexano, com pequenas quantidades de solvente polar, como 2-propanol ou
clorofórmio. Na fase-reversa, a cromatografia é caracterizada pela presença de uma fase
estacionária hidrofóbica e um eluente polar. Nesse contexto, diferentes ésteres de
retinila são facilmente separados na maioria das colunas de fase reversa e são detectados
tanto por ultra-violeta (UV) como também por detecção fluorescente seletiva (DFS).
Furr et al. (1986) afirmaram que a separação de oleato e palmitato de retinila é,
algumas vezes, reportada como um problema, mas pode ser facilmente alcançada com
acetonitrila-clorofórmio (80:20, v:v) em menos de 10 minutos numa coluna C18.
2.12. Identificação - Métodos de detecção
Os retinóides possuem múltiplas ligações duplas carbono-carbono conjugadas e,
portanto, absorvem a luz ultravioleta na faixa de 300-400 nm. (Wyss, 1998). Nesse
contexto, Nöll e Becker (2000) afirmaram que a técnica de HPLC é uma ferramenta
para distinguir vários retinóides. Já segundo Gundersen e Blomhoff (2001) a
identificação de um retinóide analisado por técnicas cromatográficas não é tarefa
simples, pois novos retinóides surgem freqüentemente e o número de amostras
comerciais disponíveis é muito limitado. O ideal seria que a caracterização do material
incluísse espectro de massa de alta resolução, ressonância magnética nuclear (NMR –
Nuclear Magnetic Ressonance) e espectroscopia ultra-violeta (UV). Caso haja
disponibilidade de um padrão puro, combinando o tempo de retenção de uma substância
desconhecida no sistema cromatográfico com o padrão é possível se ter uma indicação
da sua identidade. A Tabela 2.1 apresenta os valores de comprimento de onda máximo
Tabela 2.1: Absorbância máxima de luz de retinóides com as respectivas fórmula
molecular e massa molar.
Retinóide Fórmula molecular Massa Molar (g.mol-1) λmáx (nm)
All-trans-retinol C20H30O 286,46 325
13-cis-retinol C20H30O 286,46 328
11-cis-retinol C20H30O 286,46 319
11,13-di-cis-retinol C20H30O 286,46 311
9,13-di-cis-retinol C20H30O 286,46 324
All-trans-acetato de
retinila C22H32O2 328,5 325
All-trans-palmitato
de retinila C36H60O2 524,9 325
All-trans-retinal C20H28O 284,44 383
Fonte: Gundersen e Blomhoff (2001).
Em caso de um padrão puro não estar disponível (adipato de retinila produzido
neste trabalho), a detecção do produto poderá ser feita através de uma espectroscopia de
massa. Sabendo que a única limitação desse método é a inabilidade de se distinguir os
isômeros cis e trans, problema não presente nesta dissertação, pois os ésteres aqui
formados são originados de uma reação enzimática, (Gundersen e Blomhoff, 2001), é
eficaz para a confirmação prévia da massa de uma determinada amostra. Em seguida, a
identificação pode ser feita através de NMR.
Em 2004, Scalzo et al. utilizaram cromatografia de fase reversa e normal para
acompanhar a concentração de palmitato de retinila. Na reversa, utilizou-se acetonitrila
como fase móvel em temperatura ambiente e fluxo volumétrico de 1 mL/min. Na
cromatografia de fase normal, utilizaram n-hexano/éter etílico (99:1, v/v) e apenas n
-hexano como fase móvel. Ambos em temperatura ambiente e com fluxo de 1 mL/min.
O comprimento de onda selecionado foi 325 nm para as análises em ambas as
Como pode ser observada na Tabela 2.2, em 2006, Chunhua et al. também
analisaram a concentração de palmitato de retinila por cromatografia de fase reversa,
mas em condições distintas das descritas anteriormente. A fase móvel selecionada para
tal análise foi 100% metanol em coluna de sílica C18 a temperatura de 25°C. O fluxo
foi mantido em 1 mL/min, mas o volume de injeção foi de apenas 20 μL e comprimento de onda de325 nm.
Tabela 2.2: Condições de análise do palmitato de retinila.
Condições Scalzo et al., 2004 Chunhua et al., 2006 Fase reversa Fase reversa
Fase móvel Acetonitrila hexano e
n-hexano/éter etílico 100% Metanol
Temperatura Ambiente Ambiente 25°C
Coluna LiChrosorb
TM
RP 8
(7 μm)
LiChrosorbTM–NH2
(10 μm) Ultrasep C18
Fluxo 1 mL.min-1 1 mL.min-1 1 mL.min-1
325 nm 325 nm 327 nm
Vinjeção 50 μL 50 μL 20 μL
Maugard et al. (2002) e Rejasse et al. (2003) acompanharam a síntese de adipato
de retinila, utilizando coluna Ultrasep C18, fase móvel composta de
acetonitrila/metanol/água/TFA [62/18/20/0,1 (v/v/v/v)] a 50°C e vazão volumétrica de 1
mL/min. Como pode ser observado na Tabela 2.3, utilizaram praticamente as mesmas
condições de análise, diferindo, respectivamente, apenas no comprimento de onda, 280
Tabela 2.3: Condições de análise do adipato de retinila.
Condições Maugard et al., 2002 Rejasse et al., 2003
Fase móvel Acetonitrila/Metanol/Água/TFA [62/18/20/0,1 (v/v/v/v)]
Temperatura 50°C
Coluna Ultrasep C18
Fluxo 1 mL.min-1
280 nm 330 nm
Vinjeção 25 μL 20 μL
2.13. Separação e purificação dos componentes da reação
A cromatografia liquida de alta eficiência (HPLC - High Performance of Liquid
Chromatography) de fase normal ou reversa é a técnica preferida para separação e
purificação de retinóides (Furr et al., 1994 e Wyss, 1995), devido às suas suaves
condições de operação serem compatíveis com o calor, luz e oxigênio, propriedades às
quais os retinóides são sensíveis (Breemen et al., 1998). Esse método tem se tornado
predominante para separação e quantificação de retinóides em amostras biológicas, mas
para desenvolver um procedimento que possa separar cada um deles na mesma corrida é
praticamente impossível. Por essa razão, as condições de separação cromatográfica são
modificadas para cada aplicação (Gundersen e Blomhoff, 2001).
A aplicação de técnicas de ionização química a pressão atmosférica (APCI
-Atmospheric Pressure Chemical Ionization) foram estudadas por Breemen et al. (1998)
para análises em cromatografia líquida acoplada a espectro de massa, de retinóides
extraídos de soro humano. Nesse contexto, as separações foram realizadas usando uma
coluna C30 fase-reversa 10 cm x 2 mm (YMC, Wilmington, NC, USA) com um sistema
de solvente consistindo num gradiente linear de 30-90% de metanol – éter metil-tert-butil – ácido acético (50:50:0,5, v/v/v) em 30 minutos ou 20-90% do mesmo solvente
em 25 minutos. No caso, o ácido acético funciona como um reagente pareador de íons
durante a cromatografia de fase-reversa e facilitam a formação de retinóides protonados.
Scalzo et al., 2004 afirmaram que a conformação cis corresponde à forma menos
estável do palmitato de retinila. No mesmo trabalho, afirmaram também que o isômero
13-cis sempre está presente na forma comercializada do palmitato de retinila, num total
de 5-10%. Dessa forma, a separação de tais componentes torna-se relevante, visto que
uma formulação cosmética, por exemplo, deve ter boa atividade para a obtenção de
respostas pelo usuário. Estudos já foram realizados em relação à separação de isômeros
do retinol (Nöll, 1996), sendo a pureza dos mesmos, determinada pela medição do
espectro de absorbância de várias amostras de 500 a 190 nm, comparando o tempo de
retenção com cromatogramas das amostras padrões. Em seguida, os principais picos
foram verificados através da espectroscopia de ressonância magnética nuclear (NMR – Nuclear Magnetic Ressonance) do 13C e 1H, ambos do material padrão e das frações
coletadas pelo experimento. Isômeros do retinol podem ser separados em n-hexano–
tBME (tert-Butil Metil Éter) se a razão entre os solventes variar de 70:30 a 96:4 (v/v),
respectivamente. Com 30% de tBME a corrida demora 9 minutos, utilizando fluxo
volumétrico de 2 mL/min e 56 bar de pressão.
Nöll e Becker (2000) aplicaram HPLC na separação de isômeros não-polares de
retinóides, e verificaram que os parâmetros críticos para esse procedimento são a
escolha da coluna apropriada e a mistura ideal de eluentes. No que se refere à proporção
entre os eluentes, alcançaram máxima separação de isômeros do retinol, utilizando n
-heptano–tBME (94:6, v/v), num total de 23 minutos a um fluxo volumétrico de 3 mL/min e na separação de isômeros do palmitato de retinila, utilizaram razão de eluente
n-heptano–tBME (99:1, v/v). Finalmente, concluíram que se a resolução do pico e a separação das linhas de base são pretendidas ou isômeros específicos devem ser
separados, a escolha da fase móvel e proporção entre eluentes devem ser diferentes da
situação na qual somente uma estimativa grosseira do conteúdo completo da vitamina A
2.14. Estabilidade dos produtos obtidos
Os retinóides são sensíveis à luz, oxigênio e calor. Tudo isso deve ser
considerado quando o assunto é a coleta de amostras e posterior estocagem (Wyss,
1995). Enquanto que o retinol pode permanecer estável por apenas cinco dias quando
estocado a temperatura ambiente e na ausência de luz (Ake et al., 1998), a temperatura
de – 80°C, nenhuma degradação significante do retinol e derivados de retinila extraídos de plasma humano, foi observada quando estocados por seis meses (Hartman et al.,
2001).
Em 1998, Ake et al. testaram a foto-decomposição do retinol, expondo uma
solução padrão do mesmo, em uma cubeta de vidro a uma distância de 10 cm de uma
lâmpada emitindo luz a 325 nm. No mesmo estudo, também investigaram a degradação
térmica colocando uma solução padrão contendo 10 mg/L de retinol em um forno
regulado a 45°C ± 2°C. Alíquotas foram retiradas em vários intervalos de tempo e
analisadas em HPLC. Ao final, verificaram que a análise dos dados, no que diz respeito
à estabilidade da solução, mostrou que a solução padrão de retinol pode ser mantida a
temperatura ambiente por, pelo menos, 24 h sem degradação apreciável. A solução
mantida no escuro a temperatura de 4°C não mostrou degradação notável por, pelo
menos, 7 dias. Já no estudo de seletividade, o pico correspondente ao retinol mostrou
decréscimo considerável após 3 h de irradiação a 350 nm, tendo restado muito pouco de
3. MATERIAIS E MÉTODOS
Este capítulo descreve a metodologia desenvolvida, juntamente com os materiais
utilizados, para a realização dos experimentos desta dissertação.
3.1. Materiais
Os materiais utilizados para a execução dos experimentos foram os
convencionais de um laboratório de síntese orgânica em pequena escala, basicamente,
constituído de reatores de vidro; balança semi-analítica digital da Bel Engineering,
Itália; banhos termostáticos com aquecimento e/ou resfriamento da Quimis; agitadores
mecânicos, marca Tecnal; purificador de água Milipore e cromatógrafo líquido de alta
eficiência - HPLC (do inglês, High Performance of Liquid Chromatography), bomba
modelo 1525 (Waters), detector UV/Vis modelo 2487 (Waters), injetor modelo 717
(Waters), equipado com uma coluna Symmetry C18 (150 x 4,6 mm, 5 m) de fase
reversa da Waters e infra-vermelho (IR).
Os substratos consistiram nos ésteres acetato e palmitato de retinila e retinol,
adquiridos da Sigma-Aldrich, Alemanha e ácidos adípico e palmítico, gentilmente
doados pela Rodhia, Brasil. O biocatalisador utilizado foi a lipase E.C. 3113 de Candida
antarctica tipo B, imobilizada em resina acrílica (Novozyme 435, lote LC200206).
Quanto aos solventes, foram eles: tolueno, grau analítico da Synth, São Paulo; acetona e
álcoois isopropílico, metílico e etílico, grau analítico da Synth e também grau HPLC da
Vetec, Rio de Janeiro; dioxano, grau analítico adquirido da Reagen-Quimibrás
Indústrias Químicas, Rio de Janeiro; hexano, grau analítico e acetonitrila, grau HPLC,