UNIVERSIDADE FEDERAL DE SÃO CARLOS
CENTRO DE CIÊNCIAS EXATAS E DE TECNOLOGIA
DEPARTAMENTO DE QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
“Síntese e Caracterização de Nanocompósitos Magnéticos e
sua Aplicação na Despoluição de Águas”
Henrique Aparecido de Jesus Loures Mourão*
Dissertação apresentada como parte dos requisitos para obtenção do título de MESTRE EM QUÍMICA, área de concentração: FÍSICO-QUÍMICA.
Orientador: Caue Ribeiro de Oliveira *bolsista FAPESP
Ficha catalográfica elaborada pelo DePT da Biblioteca Comunitária da UFSCar
M931sc
Mourão, Henrique Aparecido de Jesus Loures.
Síntese e caracterização de nanocompósitos magnéticos e sua aplicação na despoluição de águas / Henrique
Aparecido de Jesus Loures Mourão. -- São Carlos : UFSCar, 2009.
92 f.
Dissertação (Mestrado) -- Universidade Federal de São Carlos, 2009.
1. Fotocatálise. 2. Descontaminação de águas. 3.
Semicondutores. 4. Nanocompósitos magnéticos. 5. Dióxido de estanho e dióxido de titânio (Síntese). 6. Ferrita. I. Título.
Deparamento de Quhica
PROGRAMA DE P~s-GRADUAÇÃO EM QUÁ~ICA
Curso de Mestrado
Assinaíuras dos membros
da
banca examinadora que avaliaram e aprovaram a defesa de dissertação de mestrado do cc~ncilktato Henrique Aparecido deJesus
Loures Mourão, realizada em 05de
março de 2009:/
/
Dr.
Cauê Ribeiro de OliveiraL
R o f Dr. Emerson Rodngues de
-
-
Rof. Dr.
Dedico este trabalho à minha família,
em especial aos meus pais Geraldo e Maria de Fátima
Agradecimentos
Primeiramente, eu gostaria de agradecer a você que está lendo este trabalho e que certamente colaborou ou ainda vai colaborar, através de críticas, sugestões, ...;
A Deus, pela vida, saúde e paz;
Ao meu orientador Dr. Caue Ribeiro, pelo apoio, orientação, discussões e sugestões que possibilitaram a realização deste trabalho;
Ao Prof. Dr. Emerson pelos conselhos e ensinamentos;
Aos professores da banca, pela disposição em examinar e contribuir
neste trabalho;
À UFSCar (em especial ao DQ), ao LIEC e à EMBRAPA\CNPDIA, que forneceram a estrutura para desenvolvimento deste trabalho. Ao CNPq, pelo suporte financeiro e à FAPESP pela bolsa concedida;
A Todos os colegas da UFV que estão aqui em São Carlos. A todos os meus colegas da pós-graduação, LIEC e EMBRAPA\CNPDIA. Me perdoem, mas não vou citar nomes, pois são muitos e com certeza vou esquecer alguns injustamente;
Ao Cleocir e Vagner que me auxiliaram nas discussões que contribuíram muito neste trabalho;
À Andréa, pelo amor, companhia e pela ajuda nas discussões que contribuíram muito neste trabalho;
À minha família: aos meus pais Maria de Fátima e Geraldo e ao meu
Resumo
SÍNTESE E CARACTERIZAÇÃO DE NANOCOMPÓSITOS MAGNÉTICOS E SUA APLICAÇÃO NA DESPOLUIÇÃO DE ÁGUAS: O desenvolvimento de novos materiais deve buscar produtos cujas propriedades estejam integradas de
forma a permitir que os processos de interesse sejam executados de forma eficiente. Assim, na busca de novos catalisadores heterogêneos, um desafio é integrar de forma eficiente a atividade catalítica do material à capacidade de manipular, reter e separar a estrutura do meio reacional. Desta forma, este trabalho propôs-se à síntese de catalisadores baseados em semicondutores associados à ferritas magnéticas na
forma de nanocompósitos. Para isso, foram sintetizadas ferritas CoFe2O4 e Fe3O4
por diferentes métodos. Pelo método dos precursores poliméricos, foi observada maior estabilidade da ferrita CoFe2O4, enquanto que pelo método sol gel hidrolítico
foi obtida somente a ferrita Fe3O4. A seguir, foram sintetizados nanocompósitos
TiO2/CoFe2O4 em diferentes proporções mássicas de CoFe2O4:TiO2 e também
nanocompósitos SnO2/CoFe2O4 na proporção mássica 56:44, ambos pelo método
dos precursores poliméricos. Pelo método sol gel hidrolítico, foram sintetizados nanocompósitos de TiO2/Fe3O4 e SnO2/Fe3O4 na proporção em massa de 56:44 de
Fe3O4:TiO2 e Fe3O4:SnO2. Os nanocompósitos de TiO2 apresentaram aumento de
área superficial, resultado da alta rugosidade superficial devido à nucleação heterogênea das nanopartículas de TiO2 sobre a superfície das ferritas. Foi
observada maior fotoatividade dos nanocompósitos obtidos pelo método dos precursores poliméricos devido ao maior grau de cristalinidade destes materiais. A
avaliação da cinética da reação de fotodegradação do corante Rodamina B na presença dos nanocompósitos sintetizados apresentou uma reação de pseudozero ordem em relação à Rodamina B. Finalmente, os nanocompósitos de SnO2
(SnO2/CoFe2O4 e SnO2/Fe3O4) também apresentaram atividade fotocatalítica, sendo
Abstract
SYNTHESIS AND CHARACTERIZATION OF MAGNETIC NANOCOMPOSITES AND YOUR APPLICATION IN THE WATER DEPOLLUTION: The development of new materials should seek to products
whose properties are integrated to enable that processes of interest are implemented efficiently. Thus, in the search for new heterogeneous catalysts, a challenge is integrate efficiently the catalytic activity with the ability to manipulate, separate and retain the structure from the reaction medium. Thus, this work proposed to the synthesis of catalysts based on semiconductors associated to ferrites, tailoring a
nanocomposite. In order to obtain this, ferrites CoFe2O4 e Fe3O4 were synthesized
through different methods. It was observed higher stability of the ferrite CoFe2O4
by the polymeric precursor method, while by the hydrolytic sol gel method only the ferrite Fe3O4 could be obtained. Following, TiO2-coated CoFe2O4 (TiO2/CoFe2O4)
nanocomposites were synthesized in different weight proportions of CoFe2O4:TiO2
and also the SnO2/CoFe2O4 nanocomposites in the 56:44 weigh proportion, both by
the polymeric precursor method. The nanocomposites TiO2/Fe3O4 and SnO2/Fe3O4
were synthesized by the hydrolytic sol gel method, in weigh proportion of 56:44
(Fe3O4:TiO2 or Fe3O4:SnO2). TiO2 nanocomposites showed surface area increase,
due the higher surface roughness obtained by heterogeneous nucleation of TiO2
nanoparticles on ferrites surfaces. In SnO2 nanocomposites, the homogeneous
nucleation of SnO2 nanoparticles also occurred. Also, it was observed higher
photoactivity of the nanocomposites obtained by the polymeric precursor method
due to the high crystallinity of these materials. The kinetic evaluation of the Rhodamine B photodegradation using the synthesized nanocomposites showed a
pseudozero order reaction regarding to Rhodamine B. Finally, SnO2
nanocomposites (SnO2/CoFe2O4 e SnO2/Fe3O4) showed photocatalytic activity,
Publicações
1. Mourão, H. A. J. L.; Malagutti, A. R.; Ribeiro, C.; Synthesis of TiO2-coated CoFe2O4 photocatalysts applied to the degradation of atrazine and
rhodamine B in water. Submetido para J Sol-Gel Sci Technol (2009);
2. Malagutti, A. R.; Mourão, H. A. J. L.; Garbin, J. R.; Ribeiro, C.; Deposition of TiO2 and Ag:TiO2 thin films by the polymeric precursor method and
their application in the photodegradation of textile dyes. Aceito para publicação na
Appl. Catal. B: Environ.DOI: 10.1016/j.apcatb.2009.03.014;
3. Mourão, H. A. J. L.; Malagutti, A. R.; Mendonça, V. R.;
Ribeiro, C.; Nanoestruturas em fotocatálise: uma revisão sobre estratégias de síntese de fotocatalisadores em escala nanométrica. Aceito na Quim. Nova;
4. Ribeiro, C.; Mourão, H. A. J. L.; Desenvolvimento de
catalisadores magnéticos para despoluição de águas contaminadas com pesticidas.
São Carlos, SP: Embrapa Instrumentação Agropecuária, Circular Técnica 39 2007. 7p;
5. Mourão, H. A. J. L.; Arruda, C. C.; Ribeiro, C.; Photocatalysis with magnetic properties apllied in the degradation of pesticides In: VII Encontro
da Sociedade Brasileira de Pesquisa em Materiais, 2008, Guarujá-SP.
6. Mourão, H. A. J. L.; Ribeiro, C.; Photocatalysis with
semiconductors: a comparative discussion of the photodegradation mechanisms of rhodamine and atrazine. In: VII Encontro da Sociedade Brasileira de Pesquisa em Materiais, 2008, Guarujá-SP.
7. Mourão, H. A. J. L.; Arruda, C. C.; Ribeiro, C.;
8. Mourão, H. A. J. L.; Malagutti, A. R.; Ribeiro, C.; Synthesis of CoFe2O4@TiO2 Photocatalysts Applied to the Degradation of Atrazine and
Rhodamine B in Water: a Comparative Study. 2009 MRS Spring Meeting, San Francisco-CA, USA.
9. Mourão, H. A. J. L.; Mendonça, V. R.; Ribeiro, C.; Avaliação da influência do método de síntese na fotoatividade de nanocompósitos de TiO2/CoFe2O4 e TiO2/Fe3O4. 32a Reunião Anual da Sociedade Brasileira de
Lista de Figuras
Figura 1. 1. Mecanismo fotocatalítico para um semicondutor: ... 10
Figura 1. 2. Esquema de uma heteroestrutura com atividades magnética e
fotocatalítica... 17
Figura 1. 3. Fluxograma descritivo do método sol-gel hidrolítico. ... 19
Figura 1. 4. Fluxograma descritivo do método dos precursores poliméricos. ... 21
Figura 4. 1. Difratogramas das nanopartículas de Fe3O4 sintetizadas a 400 e 450oC
em atmosferas de ar e N2.. ... 36
Figura 4. 2. Difratogramas das nanopartículas de CoFe2O4 sintetizadas a 400 e
450oC em ar... 39
Figura 4. 3. Difratograma das nanopartículas de Fe3O4 sintetizadas por hidrólise 42
Figura 4. 4. Difratograma das nanopartículas de CoFe2O4 sintetizadas por
hidrólise... 44
Figura 4. 5. Difratogramas dos nanocompósitos de TiO2/CoFe2O4... 46
Figura 4. 6. Espectro Raman dos nanocompósitos de TiO2/CoFe2O4... 48
Figura 4. 7. Imagens obtidas por HRTEM dos nanocompósitos de TiO2/CoFe2O4
... 50
Figura 4. 8. Imagens obtidas por MEV do nanocompósito de proporção – 61: 39,
Figura 4. 9. Curva de degradação da Atrazina (gráfico A) e da Rodamina B
(gráfico B) e Rodamina B (Ro-B) na presença de TiO2 e DBS (gráfico C), sob
radiação visivel... 54
Figura 4. 10. Mecanismo de transferência eletrônica na fotodegradação da Rodamina B (Ro-B). ... 56
Figura 4. 11. Curva de degradação da Atrazina e da Rodamina B, sob radiação UV... 57
Figura 4. 12. Curva de degradação da Atrazina na presença de TiO2 e DBS, sob radiação UV. ... 58
Figura 4. 13. Difratograma dos nanocompósitos de SnO2/CoFe2O4... 60
Figura 4. 14. Imagens obtidas por MEV dos nanocompósitos de SnO2/CoFe2O4. 62 Figura 4. 15. Imagens obtidas por MET dos nanocompósitos de SnO2/CoFe2O4.. 63
Figura 4. 16. Padrão de difração de elétrons dos nanocompósitos de SnO2/CoFe2O4 e as imagens em campo escuro... 64
Figura 4. 17. Difratograma dos nanocompósitos de TiO2/Fe3O4. ... 67
Figura 4. 18. Imagens obtidas por MEV dos nanocompósitos de TiO2/Fe3O4. ... 69
Figura 4. 19. Imagens obtidas por MET dos nanocompósitos de TiO2/Fe3O4... 70
Figura 4. 20. Difratograma dos nanocompósitos de SnO2/Fe3O4. ... 71
Figura 4. 21. Imagens obtidas por MEV dos nanocompósitos de SnO2 /Fe3O4... 73
Figura 4. 23. Padrão de difração de elétrons dos nanocompósitos de SnO2/Fe3O4 e
as imagens em campo escuro. ... 75
Figura 4. 24. Curva de degradação comparando-se a fotatividade dos
nanocompósitos... 77
Figura 4. 25. Regressão linear para obtenção da pseudoconstante de velocidade
para o TiO2/CoFe2O4. ... 80
Lista de Tabelas
Tabela 4. 1. Tamanho médio de cristalito de Fe3O4 calculados a partir da equação
de Scherrer. ... 37
Tabela 4. 2. Tamanho médio de cristalito de CoFe2O4 calculados a partir da
equação de Scherrer. ... 40
Tabela 4. 3. Características de CoFe2O4 e Fe3O4, obtidas pelo método dos
precursores poliméricos... 41
Tabela 4. 4. Tamanho médio de cristalito de Fe3O4 calculados a partir da equação
de Scherrer. ... 43
Tabela 4. 5. Tamanho médio de cristalito de CoFe2O4 e TiO2 calculados a partir da
equação de Scherrer. ... 47
Tabela 4. 6. Área superficial (AS) dos materiais puros e dos nanocompósitos de
TiO2/CoFe2O4... 52
Tabela 4. 7. Tamanho médio de cristalito de CoFe2O4 e SnO2, calculados a partir
da equação de Scherrer... 61
Tabela 4. 8. Tamanho médio de cristalito de Fe3O4 e TiO2, calculados a partir da
equação de Scherrer. ... 68
Tabela 4. 9. Tamanho médio de cristalito de Fe3O4 e SnO2, calculados a partir da
Tabela 4. 10. Valores das pseudoconstantes de velocidade (kp) de fotodegradação
SUMÁRIO
1. INTRODUÇÃO ... 1
1.1. Considerações gerais... 1
1.2. Contaminação da água com compostos orgânicos ... 2
1.3. Mecanismos de degradação de moléculas orgânicas... 4
1.3.1. Fotólise direta e POAs. ... 5
1.3.2. Fotocatálise com semicondutores ... 9
1.4. Aplicação dos semicondutores em fotocatálise... 14
1.5. Métodos de síntese utilizados... 17
1.5.1. Método sol-gel hidrolítico (hidrólise)... 18
1.5.2. Método dos Precursores Poliméricos... 19
1.6. O estado da arte...21
2. OBJETIVOS ... 23
3. PARTE EXPERIMENTAL... 24
3.1. Síntese das ferritas ... 24
3.1.1. Síntese das ferritas pelo método dos precursores poliméricos ... 24
3.1.2. Síntese das ferritas pelo método sol gel hidrolítico ... 25
3.2. Recobrimento das ferritas com o material fotoativo ... 26
3.2.1. Recobrimento das ferritas pelo método dos precursores poliméricos .... 26
3.3. Métodos de caracterização utilizados... 29
3.3.1. Difração de raios x... 29
3.3.2. Espectroscopia Raman... 30
3.3.3. Medidas de área superficial ... 31
3.3.4. Microscopia eletrônica de transmissão (MET) e varredura (MEV)... 32
3.4. Avaliação do potencial fotocatalítico... 33
4. RESULTADOS E DISCUSSÃO ... 35
4.1. Caracterização e avaliação da estabilidade das ferritas ... 35
4.1.1. Ferritas via método dos precursores poliméricos... 35
4.1.2. Ferritas via sol gel hidrolítico (hidrólise)... 41
4.2. Avaliação da síntese dos nanocompósitos de TiO2/CoFe2O4 e SnO2/CoFe2O4 via Precursores Poliméricos. ... 45
4.2.1. Caracterização dos nanocompósitos de CoFe2O4 recoberta com TiO2 (TiO2/CoFe2O4) ... 45
4.2.2. Avaliação do potencial fotocatalítico dos nanocompósitos de TiO2/CoFe2O4... 52
4.2.3. Caracterização dos nanocompósitos de CoFe2O4 recoberta com SnO2 (SnO2/CoFe2O4)... 59
4.3.1.Caracterização dos nanocompósitos de Fe3O4 recoberta com TiO2
(TiO2/Fe3O4) ... 66
4.3.2.Caracterização dos nanocompósitos de Fe3O4 recoberta com SnO2 (SnO2/Fe3O4) ... 70
4.4. Avaliação da influência do método de síntese e do semicondutor na fotoatividade dos nanocompósitos. ... 76
4.4.1. Determinação da cinética da reação de fotodegradação... 76
4.4.2. Influência do método de síntese: precursores poliméricos versus sol gel hidrolítico ... 81
4.4.3. Influência do semicondutor: TiO2versus SnO2... 82
4.5. Propriedade magnética dos nanocompósitos... 83
5. CONCLUSÕES... 84
6. SUGESTÕES PARA TRABALHOS FUTUROS... 85
1. INTRODUÇÃO
1.1. Considerações gerais
Atualmente, a questão ambiental é pauta de discussões em todo o mundo e projetos de diversas áreas cada vez mais devem considerar este tema. Um
problema ambiental bastante grave é a contaminação de águas, sendo a contaminação por resíduos de compostos orgânicos uma das mais preocupantes.
O Brasil é pioneiro na edição de normas regulamentadoras para o descarte de efluentes líquidos gerados no setor agrícola, como exemplifica a Instrução Normativa No- 2 de 3 de janeiro de 2008 [1] do MAPA (Ministério da
Agricultura, Pecuária e Abastecimento). Trata-se de novas normas de trabalho a serem seguidas pela aviação agrícola em conformidade com os padrões técnicos operacionais e de segurança para este setor. Estabeleceu-se que os eventuais restos de agrotóxicos remanescentes no avião utilizado para aplicação do pesticida
deverão passar por um sistema de oxidação de agrotóxicos, para redução da concentração de potenciais poluentes. Apesar de o gerador de ozônio (ozonizador) ser o sistema de oxidação citado, novas estratégias de oxidação que apresentarem comprovado potencial poderão ser utilizadas para este fim, como também poderão ser utilizadas em processos de descontaminação de outros poluentes, como por
exemplo, na despoluição de áreas contaminadas com corantes, atividade microbiana, entre outros.
Diversos métodos de tratamento de resíduos de compostos orgânicos vêm sendo estudados, em especial, os processos oxidativos avançados (POAs).
Estes envolvem a geração de radicais por diversos sistemas, como por exemplo, a geração destes radicais na superfície de semicondutores fotoexcitados. A maioria dos trabalhos desta área é relativa à utilização do TiO2, especialmente na forma
às do TiO2 (como por exemplo, valores de band gap próximos) ainda foi pouco
explorado em fotocatálise.
Em fotocatálise heterogênea, a alta área superficial do fotocatalisador seja importante para a eficiência do processo, sendo este fato o grande motivador
para utilização de materiais nanoestruturados, visto que estes possuem elevada área superficial. No entanto, a utilização dos óxidos acima citados, como fotocatalisadores nanopartículados, tem como principal obstáculo a sua separação do meio reacional para reutilização após o processo fotocatalítico, devido à alta estabilidade em meio aquoso.
Uma alternativa para contornar este problema é associar à fase de interesse uma fase com propriedade magnética pela formação de um nanocompósito que possa ser efetivamente desestabilizado pela aplicação de campo magnético. Esta foi a meta central deste trabalho: o desenvolvimento de
nanocompósitos magnéticos com potencial para aplicação na fotodegradação de compostos orgânicos.
Assim, o desenvolvimento do presente trabalho consiste no estudo de estratégias de síntese destes fotocatalisadores magnéticos, utilizando-se dois métodos: o método dos precursores poliméricos e o método sol gel hidrolítico.
1.2. Contaminação da água com compostos orgânicos
Inúmeros processos de utilização da água implicam na geração de
efluentes tóxicos ou ricos em atividade microbiana, impróprios para reutilização em atividades agrícolas e uso humano. Por exemplo, existe um grande interesse no tratamento eficiente do efluente têxtil, pois cerca de 30% dos corantes sintéticos utilizados industrialmente são transformados em resíduos, uma vez que apresentam
Outro exemplo de grande interesse encontra-se no tratamento de águas de irrigação agrícola contaminadas por pesticidas e fertilizantes químicos. Atualmente pesticidas e fertilizantes químicos são considerados uma das maiores fonte de contaminação da água potável nos países em desenvolvimento, devido à
aplicação de doses elevadas e muitas vezes desnecessárias destes compostos sobre plantas e solo, e também devido ao cultivo em locais próximos a mananciais ou em áreas de recarga do lençol freático [3]. Além destas fontes de contaminação, a geração de água contaminada com resíduos de pesticidas também ocorre durante a fabricação, transporte e manuseio destes compostos, e através de resíduos
resultantes dos processos de lavagem de produtos agrícolas, como frutas e legumes, implementos agrícolas, equipamentos de proteção individual (EPI) e das próprias embalagens de pesticidas que devem ser adequadamente lavadas antes da reciclagem. Estas últimas fontes de contaminação produzem, em geral, pequenas
quantidades de água com alta concentração de resíduos e podem ser contidas evitando que tais resíduos sejam descartados no ambiente. Entretanto, feita a contenção, os resíduos necessitam de tratamento adequado, o que não é trivial [4].
As técnicas de tratamento fundamentadas em processos físico-químicos como coagulação, seguidos de separação por filtração ou sedimentação, apresentam uma elevada eficiência na remoção de material particulado, porém, mostram-se deficientes na remoção de compostos orgânicos dissolvidos. Para a
remoção destes compostos, pode ser utilizado um processo de adsorção em carvão ativado que apresenta uma eficiência significativamente grande, contudo, em função da superfície química do carvão ser positiva, a adsorção dos compostos de caráter catiônico é limitada, reduzindo assim a eficiência deste processo. Também é importante salientar que todos os processos citados correspondem a sistemas
Portanto, a busca por novas alternativas para o tratamento adequado dos efluentes de compostos orgânicos deve ser considerada como uma prioridade dos profissionais que atuam nesta área, considerando as previsões de uma possível escassez de água potável.
Entre os métodos alternativos propostos nos últimos anos, um dos mais promissores baseia-se na utilização de técnicas fotoquímicas para degradar resíduos de contaminantes orgânicos em água. O princípio de funcionamento destes métodos está no fato de que a radiação ultravioleta (UV) tem energia suficiente para quebrar as ligações químicas de algumas moléculas orgânicas
contaminantes. Quebras sucessivas podem transformar o resíduo inicial em subprodutos inertes, geralmente menos tóxicos, ou mesmo à CO2 e H2O [6,7].
Em todo o mundo já existem diversas plantas experimentais utilizando estes processos. A maior parte está voltada para o uso de luz solar como fonte de
radiação UV. Entretanto, como a luz solar que chega até a superfície do planeta não possui energia suficiente para promover a fotólise direta dos resíduos, torna-se necessário o uso de processos fotocatalíticos, em especial os POAs [8].
1.3. Mecanismos de degradação de moléculas orgânicas
Mecanismos de fotólise direta, e a utilização dos POAs em fotocatálise serão discutidos, sendo enfatizado o mecanismo de ação de semicondutores fotoexcitados na fotodegradação de moléculas orgânicas. Desta forma, os embasamentos teóricos sobre o assunto como apresentados, possibilitarão o melhor entendimento da
1.3.1. Fotólise direta e POAs.
Reações de fotodegradação do substrato orgânico (molécula a qual se pretende degradar) que ocorrem com a utilização somente de radiação são denominadas reações de fotólise direta. Estas reações implicam, na maioria dos
casos, em transferência eletrônica do substrato no estado excitado (C*. eq. 1) para uma molécula receptora, geralmente o oxigênio molecular em solução (eq. 2). Esta transferência eletrônica forma radicais catiônicos e aniônicos que podem sofrer subsequente recombinação inibindo futuras reações ou podem sofrer posteriores reações de oxidação [9].
O substrato pode também ser quebrado pela incidência da radiação (eq. 3) para formar radicais que reagem com o oxigênio molecular dissolvido (eq. 4) formando os radicais orgânicos peroxila (RO2.). Estes radicais (RO2.) são
considerados os verdadeiros propagadores da reação, podendo levar à completa
degradação do substrato [9].
C C* (1)
C* + O2 C.+ + O2.- (2)
RX R. + X. (3)
R. + O2 RO2. Substrato degradado (4)
A fotólise direta, na maioria das vezes, não é capaz de promover a fotodegradação completa dos substratos, mas a sua utilização é importante quando a degradação por radical hidroxila (.OH) não é eficiente [9].
hυ
A degradação de pesticidas, por exemplo, é possível através de diferentes processos fotoquímicos que necessitam de uma fonte de luz artificial ou luz solar natural. A maioria destes métodos requer períodos de longo tratamento com fótons de alta energia e raramente alcançam à completa degradação do
poluente. Desta forma, fontes de baixa energia (como por exemplo, a radiação solar natural) possuem pouca eficiência no tratamento da maioria dos resíduos. Em contrapartida, radiação com maior energia, especialmente na região do UVC (200-280 nm) pode ser utilizada eficientemente.
Por estas razões, geralmente é necessária a associação de outros
processos de fotodegradação. Neste sentido, utiliza-se fotocatalisadores que aceleram as reações de fotólise direta do contaminante. Alguns estudos comparativos demonstram essa necessidade de associação de processos. No entanto, demonstram também que, em algumas condições específicas e bastante
raras, o processo de fotólise direta é mais eficiente que os processos indiretos.
Garbin et al.[10] estudaram a fotólise direta e indireta de resíduos dos pesticidas atrazina, imazaquine e iprodione em soluções aquosas, sob radiação UV-visível (280-480 nm). A fotólise indireta foi feita através da adição de TiO2 às amostras.
Neste caso, como esperado houve um aumento de 40 % na eficiência da
fotodegradação para atrazina e iprodione em relação à fotólise direta. No entanto, o imazaquine apresentou uma diminuição na sua velocidade de degradação com a adição de TiO2. Durante a fotogeração de radicais, as partículas de TiO2 em
suspensão competem com as moléculas de pesticidas pela absorção de luz
incidente. Quando a concentração de TiO2 aumenta, a velocidade da fotólise direta
Macounová et al.[11] documentaram também a fotodegradação do pesticida metamitron em solução aquosa com radiação UV na presença de TiO2 na
forma de filme imobilizado e também como material particulado em suspensão. Foi observado que na presença do filme de TiO2 ocorreu um aumento na velocidade de
degradação do metamitron (6 vezes maior) em relação à fotólise direta. No entanto, para o TiO2 em suspensão, um grande aumento de sua concentração (partículas em
suspensão) ocasionou uma diminuição na velocidade de degradação, devido à existência de uma competição na absorção da radiação entre as partículas TiO2 e as
moléculas de metamitron, visto que ambos possuem bandas de absorção muito
próximas.
Texeira et al.[12] documentaram a aplicação de vários POAs para descontaminar água contendo resíduo do pesticida formulado Padron® (composto por um corante e pesticida) através da utilização de fotoreator com luz artificial e
reator com luz solar. Nos ensaios realizados para verificar a fotólise do pesticida com lâmpada germicida (máximos de emissão em 254 e 365 nm) observou-se que esta promoveu a degradação de 69% do corante e 73% do pesticida após 60 min de experimento. Quando foi utilizada a lâmpada negra (radiação máxima em 365 nm) não foi observada nenhuma degradação do corante e do pesticida. A alta fotólise
promovida pela lâmpada germicida explica-se pela emissão de radiação mais energética que a lâmpada negra. Além disso, a lâmpada germicida (2,9.1018 fotóns/s) gera 5 vezes mais fótons que a lâmpada negra (5,9.1017 fotóns/s). O teste de fotólise do pesticida, através da recirculação da solução no reator durante
exposição à luz solar mostrou que nessas condições experimentais também não houve decomposição do pesticida e dos componentes da formulação por ação apenas da luz solar.
Quando se trata de processos utilizados para a fotodegradação de
POAs baseiam-se na geração de radicais altamente reativos, tal como o radical hidroxila (.OH), um oxidante forte, não seletivo que reage com a maioria dos compostos orgânicos de forma muito rápida, em escala de nanosegundos [8,13,14]. Os radicais livres HO2. e O2.− também podem estar envolvidos nos processos de
degradação, mas estes radicais são menos reativos do que os radicais hidroxila [13]. Essas espécies oxidam o poluente orgânico dissolvido ou disperso, removendo cor, demanda bioquímica de oxigênio (DBO) e demanda química de oxigênio (DQO) do sistema. A geração destes radicais pode ocorrer a partir de diversos processos, dos quais destacam-se: UV/TiO2 [15,16], UV/H2O2 [17], Fenton e foto-Fenton
[18,19], ozônio [20], entre outros.
O radical hidroxila (.OH) gerado nestes processos pode oxidar compostos orgânicos, principalmente pela abstração de hidrogênio (eq. 5). Essa reação gera radicais orgânicos que podem reagir com o oxigênio molecular para
formar o radical peroxila (RO2
.
) (eq. 6), os quais iniciam reações subseqüentes de degradação oxidativa podendo formar subprodutos ou ser totalmente oxidados, dependendo das condições e substratos a serem degradados [9].
.OH + RH R. + H2O (5)
R. + O2 RO2. CO2 + H2O (6)
Os radicais hidroxila (.OH) gerados na presença de um substrato
orgânico, além da abstração de hidrogênio, podem também reagir por adição eletrofílica (eq. 7), transferência eletrônica (eq. 8) podendo também ocorrer a recombinação radical-radical (eq. 9) [9].
.
.
OH + RX RX.+ + OH- (8)
2 .OH H2O2 (9)
1.3.2. Fotocatálise com semicondutores
Dentre as maneiras de se gerar o radical responsável pelas reações de fotodegradação está o uso de semicondutores fotoexcitados. Quando ocorre a oxidação completa, o processo global de fotodegradação de um composto orgânico
utilizando-se semicondutores pode ser representado pela seguinte equação reacional (eq. 10) [21]:
poluente + O2 CO2 + H2O + minerais (10)
Porém, em muitos processos de fotodegradação utilizando semicondutores ou outros fotocatalisadores, não se consegue chegar à oxidação completa do composto, observando-se somente a formação de subprodutos,
geralmente menos tóxicos [9,21].
A Figura 1.1 é uma representação esquemática do processo global de fotocatálise com semicondutores, apresentando a fotogeração e transferência das cargas, incluindo a formação e o ataque dos radicais às moléculas do poluente.
semicondutor
Figura 1. 1. Mecanismo fotocatalítico para um semicondutor:
1) fotogeração das cargas elétron (e-) e buraco (h+) pela absorção de um fóton hυ ≥ Ebg; 2) recombinação das cargas com liberação de energia em forma de calor; 3) processo de redução através da transferência do elétron da condução (BC) para um aceptor de elétrons adsorvido à superfície do semicondutor (geralmente, o O2); 4) formação do radical hidroxila (.OH) através da transferência do buraco da banda de valência (BV) para grupos hidroxila adsorvidos; 5) ataque do radical .OH às moléculas orgânicas.
Semicondutores (TiO2, SnO2, ZnO, entre outros) possuem potencial
para serem utilizados como fotocatalisadores devido às suas estruturas eletrônicas serem caracterizadas por uma banda de valência (BV) preenchida e uma banda de
condução (BC) vazia. Quando um fóton incide sobre a superfície de um semicondutor com energia hυ, igual ou maior à energia de "band gap" (Ebg) do
forma de calor ou luz, ou os elétrons podem reagir com aceptores de elétrons, respectivamente, que estejam adsorvidos na superfície do semicondutor [22].
Na ausência de apropriados “sequestradores” para os buracos e elétrons, a energia armazenada é dissipada dentro de poucos nanosegundos pela
recombinação. Caso um “sequestrador” consiga prender o elétron ou o buraco, a recombinação é prevenida e reações redox subsequentes podem ocorrer[22]. Desta forma, considera-se que o elétron livre atua como um agente redutor, e o buraco como um oxidante.
Vários semicondutores possuem band gap suficiente para promover ou
catalisar uma grande variedade de reações químicas de interesse ambiental, sendo que o TiO2 demonstrou ser até momento o mais adequado para tal fim, [22] devido
à sua pequena velocidade de recombinação. O Óxido de titânio é polimórfico e pode existir em três formas cristalográficas distintas: anatase (tetragonal) que é
considerado de maior fotoatividade, brookite (ortorrômbica) e rutilo (tetragonal) [23]. Brookite ocorre naturalmente, sendo extremamente difícil de sintetizar. Anatase e rutilo também ocorrem naturalmente, mas podem ser sintetizadas em laboratório com maior facilidade do que a brookite [23].Seu espectro de absorção, com band gap em 3,2 eV que corresponde a absorção óptica em 387 nm, permite
sua excitação nas regiões de UVC (200-280 nm), UVB (280-320 nm), UVA (320-380 nm) e quando excitado eletronicamente exibe alto poder de oxidação devido ao buraco (h+) na BV (eq. 11) [9,21,22].
TiO2 hυ TiO2 (e -
+ h+) (11)
Na BV, duas reações de oxidação podem ser observadas: a transferência eletrônica direta do substrato orgânico (molécula) a ser degradado RX
adsorvidas para o buraco (eq.13, 14) formando os radicais hidroxila (.OH). As reações de formação de .OH, aparentemente, são as de maior relevância no processo de degradação oxidativa, provavelmente devido à alta concentração de H2O e -OH adsorvidos na superfície do semicondutor [9,21,22].
TiO2 (h +
) + RX ads TiO2 + RX
.+
(12)
TiO2 (h+) + H2O ads TiO2 + .OH + H+ (13)
TiO2 (h +
) + OH- ads TiO2 +
.
OH (14)
Na BC, os elétrons são transferidos para um aceptor de elétrons. Como no processo de fotodegradação oxidativa o oxigênio molecular deverá estar
presente, a transferência eletrônica geralmente ocorre da banda de condução do fotocatalisador para o oxigênio molecular dissolvido (eq. 15) [9,21,22].
TiO2 (e-) + O2 TiO2 + .O2- (15)
Apesar das várias vantagens anteriormente citadas, existem dois problemas principais para a aplicação em larga escala do TiO2 como
fotocatalisador. O primeiro é que o TiO2, devido ao seu valor de band gap,
somente é ativado sob radiação UV, mais especificamente radiação com
comprimento de onda ≤ 387 nm e desta forma não pode ser excitado utilizando-se radiação na região do visível. Assim, o uso da radiação solar é pouco eficiente no processo, visto que ela possui somente uma pequena fração em radiação UV, em torno de 3-5 % [8]. Procedimentos que possam estender a banda de absorção do
fotocatalítica sob radiação solar. Para este fim, a modificação do TiO2 com
dopantes não-metálicos tais como C [24], N [25] e S [26] mostraram ser eficientes para promover a excitação do TiO2 sob luz visível. Estes dopantes, quando
incorporados à estrutura do TiO2, ampliam a banda de absorção deste material para
comprimentos de onda maiores, ocasionando maior atividade fotocatalítica devido ao número maior de cargas fotogeradas.
O segundo problema é a recombinação das cargas fotogeradas (elétron e buraco), que diminui consideravelmente a eficiência do processo fotocatalítico. As cargas fotogeradas são extremamente instáveis e a recombinação destas cargas
pode ocorrer rapidamente. A eficiência fotocatalítica depende da competição entre a velocidade de transferência das cargas na superfície do semicondutor e a velocidade de recombinação destas. Sendo assim, aumentar seus tempos de vida é fundamental para a fotodegradação mais eficiente. Em outras palavras, se a
recombinação acontecer para um par de cargas elétron-buraco, estes não mais participarão do processo de degradação, logo a eficiência do processo tende a diminuir.
A incorporação de alguns metais (Ag, Pt, Pd, entre outros) à estrutura do semicondutor tem se mostrado bastante eficiente no aumento da sua
fotoatividade, através do aumento do tempo de vida das cargas fotogeradas. Anpo e Takeuchi [27] apresentaram maiores fotoatividades para sistemas TiO2/Pt em
relação ao TiO2 puro. Este comportamento é explicado em termos de um
mecanismo fotoeletroquímico em que os elétrons da banda de condução do TiO2
rapidamente se transferem para as partículas de Pt na superfície do TiO2 e os
buracos permanecem no TiO2, podendo participar de reações de oxidação
posteriores de forma direta ou indireta. Deste modo, as partículas de Pt atuam efetivamente para aumentar a separação das cargas fotogeradas resultando na
eficiência fotocatalítica de TiO2 anatase de alta área superficial com nanopartículas
de Ag depositadas sobre sua superfície. O aumento da fotoatividade foi também atribuído à diminuição da recombinação pelas partículas de Pt.
Este mesmo efeito pode aparecer em alguns tipos junções de
semicondutores ou suas soluções sólidas com diferentes valores de band gap. Lin et al. [29] avaliaram a atividade fotocatalítica de soluções sólidas de rutilo Ti1-xSnxO2
na reação de oxidação de acetona. Foram comparadas as fotoatividades de TiO2
rutilo e Ti1-xSnxO2, de variadas frações de Sn. Eles observaram que a substituição
de Sn4+ no lugar de Ti4+ no TiO2 rutilo ocasionou um aumento na velocidade de
oxidação da acetona. Esta substituição resultou na diminuição na velocidade de recombinação que está relacionada com aumento do band gap da solução sólida. Neste trabalho também foi avaliado o número de grupos hidroxilas existentes nas superfícies do TiO2 rutilo e anatase. De acordo com seus experimentos, o TiO2
rutilo possui mais grupos hidroxilas superficiais do que o TiO2 anatase e assim, a
baixa fotoatividade conhecida do TiO2 rutilo não poderia ser explicada em termos
dos grupos hidroxilas superficiais e sim pela alta velocidade de recombinação das cargas fotogeradas.
Vinodgopal et al. [30] estudando a degradação de um corante,
demonstraram também que filmes de compósitos SnO2/TiO2 apresentam velocidade
de degradação maior do que filmes de SnO2 e TiO2 puros. Este aumento na
velocidade de degradação do corante foi atribuído a uma maior separação das cargas nestes compósitos, prevenindo a recombinação.
1.4. Aplicação dos semicondutores em fotocatálise
Vários trabalhos já demonstraram a eficiência do TiO2 na
constitui-se em um caso importante do papel da escala nanométrica para a adequada obtenção do material. Estudos demonstram que a formação da fase anatase somente é preferencial em relação à fase TiO2 rutilo (de menor atividade
fotocatalítica) para tamanhos de partícula nanométricos, inferiores a 12 - 13 nm em
partículas esféricas [34], acima dos quais há a tendência de transformação de fase. Portanto, a estrutura nanométrica é fundamental para a estabilização da fase desejada.
Além disso, existe outra grande vantagem em se utilizar fotocatalisadores nanoestruturados. Isto acontece porque quando se utiliza POAs
através de sistemas heterogêneos (no caso, semicondutores em suspensão), a efetividade do processo fotocatalítico – visto corresponder a um processo de catálise heterogênea – dependerá da área superficial do semicondutor, que é variável diretamente ligada ao tamanho da partícula utilizada [35]. Desta forma,
metodologias de síntese do material capazes de controlar o tamanho de partícula são necessárias para o desenvolvimento da fase desejada e, consequentemente, para a obtenção de fotocatalisadores com maior área superficial.
Um outro óxido com potencial para se utilizado nas mesmas aplicações é o dióxido de estanho (SnO2). O SnO2 possui alta mobilidade eletrônica
e boa condutividade térmica e valor de band gap em torno de 3,6 eV, valor este muito próximo ao valor do TiO2 (3,2 eV) e embora o SnO2 seja muito utilizado em
outras aplicações, ele é pouco estudado em fotocatálise [36]. A obtenção de SnO2
puro e dopado é bem descrita na literatura. Nütz e Hasse [37] prepararam
nanopartículas de SnO2 puro e dopado com Sb2O3 a partir de processo hidrotermal.
As suspensões coloidais foram obtidas através da dissolução de SnCl4 em HCl a
85oC (para as suspensões dopadas, foi adicionado SbCl3 ou SbCl5) e precipitação
com NH4OH. A suspensão foi hidrotermalizada a 270oC por 4 dias, acelerando o
estrutura do tipo rutilo e diâmetro de 4 a 9 nm. Giraldi [38] apresentou a síntese de suspensões coloidais de nanopartículas de SnO2, preparadas a partir da rota de
hidrólise de SnCl2 e diálise para obtenção de colóides estáveis de nanopartículas
cristalinas à temperatura ambiente. A síntese foi otimizada com concentração de
0,025 M de Sn2+ em pH 8.
Além das características anteriormente citadas, suspensões coloidais de óxidos simples, como TiO2 e SnO2, possuem alta estabilidade em meio aquoso.
Esta característica torna-se um complicador ao fim do processo de fotodegradação, visto que a estabilidade do colóide dificulta a separação das nanopartículas para
reutilização. Desta forma, o processo de estabilização – desestabilização do colóide pode ser visto como o principal obstáculo ao uso da metodologia em larga escala. A utilização do semicondutor imobilizado, especificamente na forma de filmes finos, é uma alternativa viável para contornar este problema. Além desta vantagem, a alta
estabilidade mecânica dos filmes é outra característica da utilização de sistemas imobilizados. Na literatura, vários trabalhos têm surgido sobre a preparação de filmes finos de TiO2 por diferentes técnicas, tais como: spin-coating [39],
dip-coating [40], entre outras [41].
Uma outra forma de se contornar a dificuldade de separação do
material após o processo fotocatalítico é associar às nanopartículas de interesse uma fase com atividade magnética, como por exemplo, ferritas (CoFe2O4 ou Fe3O4
(magnetita)) [42], por meio da formação de um compósito, o qual pode ser submetido à ação de um campo magnético. A Figura 1.2 representa uma
heteroestrutura formada pela associação de uma fase com atividade magnética no centro (como por exemplo, CoFe2O4 ou Fe3O4) e uma fase fotoativa na superfície
(como por exemplo, TiO2 ou SnO2) formando assim, um compósito com atividades
Figura 1. 2. Esquema de uma heteroestrutura com atividades magnética e fotocatalítica.
Beydoun et al. [42] documentaram a síntese de magnetita (Fe3O4)
recoberta com TiO2 (TiO2/Fe3O4) utilizando a técnica sol-gel no processo de
recobrimento. O material obtido apresentou atividade fotocatalítica associada à propriedade magnética. Porém, os autores observaram redução da atividade fotocatalítica dos nanocompósitos comparativamente ao TiO2 puro, associando o
fato a mecanismos de recombinação na interface das fases. Lin et al [43]
sintetizaram nanopartículas da ordem de 50 nm de magnetita recobertas com sílica (SiO2/Fe3O4), com boa dispersão das nanopartículas em água na ausência de campo
magnético e com efetiva captura magnética das mesmas. Os autores demonstraram a efetividade da estratégia de síntese através da adsorção de um corante à superfície
das nanopartículas em suspensão, modificando sua coloração e eliminando seletivamente o mesmo corante através do arraste magnético das nanopartículas.
1.5. Revisão sobre os métodos de síntese utilizados
Nesta seção, serão discutidos os dois métodos de síntese utilizados neste trabalho para a obtenção dos nanocompósitos magnéticos: o método sol-gel hidrolítico e o método dos precursores poliméricos.
Centro magnético
(Fe3O4 ou CoFe2O4 )
1.5.1. Método sol-gel hidrolítico (hidrólise)
O termo “sol-gel” compreende diversos métodos de síntese, que se caracterizam por uma reação em meio homogêneo (“sol”) que desestabilize o meio de forma controlada, formando partículas (“gel”). Essa definição ampla aplica-se a
vários métodos, porém, na literatura, o termo é frequentemente associado ao processo hidrolítico, ou seja, a reação de um precursor anidro em meio aquoso. A
rota de hidrólise envolve a ligação do íon OH- ao metal proveniente do precursor
orgânico / haleto numa reação típica [44]:
M-OR+H2O→M-OH↓ + R+ + OH- (16)
onde M representa Si, Ti, Zr, Al e outros metais e R é um ligante
orgânico. Um metal parcialmente hidrolisado pode reagir com outras moléculas parcialmente hidrolisadas numa reação de policondensação (eq. 17 e 18):
M-OH + M-OR → M-O-M + R+ + OH- (17)
M-OH + M-OH → M-O-M + HOH (18)
O processo permite boa homogeneidade e em geral leva à obtenção de
fases metaestáveis, incluindo amorfas [45]. Neste último caso é necessária uma etapa de cristalização dos óxidos formados, termicamente (por calcinação) ou por tratamento hidrotermal.
Vários fatores afetam o processo sol-gel, incluindo o tipo de material
nanoparticulados, como TiO2 [46], óxidos de Fe [42], SnO2 dopado [37] e não dopado [47]. Na Figura 1.3 está apresentado um fluxograma descritivo da rota de síntese sol-gel hidrolítica com as principais etapas de síntese.
Figura 1. 3. Fluxograma descritivo do método sol-gel hidrolítico.
1.5.2. Método dos Precursores Poliméricos
O método dos precursores poliméricos é uma variante do processo
sol-gel, no qual a reação de formação é não hidrolítica e gera um polímero, o qual, após calcinação, forma o óxido de interesse [48,49]. O processo é uma alternativa viável para sínteses com um rigoroso controle da estequiometria, morfologia do pó e pureza de fase [50].
Este método consiste primeiramente na formação de um complexo
uma solução geralmente transparente. Um novo aquecimento (150-250oC) causa a reação de condensação com formação de uma molécula de água, e se o aquecimento persistir, a poliesterificação acontece e o excesso de água é removido, resultando em uma resina polimérica sólida [50].
A idéia central do método é distribuir os cátions por toda a estrutura polimérica e, num tratamento térmico em temperaturas a partir de 400oC liberar a matéria orgânica e formar os cristalitos devidamente ordenados. Este resultado é importante quando deseja-se a obtenção de materiais com alta cristalinidade e controlada distribuição dos constituintes na rede cristalina [50]. A principal
desvantagem deste método é o fato de que o aquecimento necessário para liberação de toda matéria orgânica pode ocasionar a formação de aglomerados parcialmente sinterizados e consequentemente, o crescimento das partículas.
Diversos trabalhos apresentaram a síntese de materiais
nanoestruturados utilizando-se o método dos precursores poliméricos, incluindo a síntese de nanopartículas de TiO2 [51], filmes nanoestruturados de TiO2 [39] e
SnO2 [52], entre outros. Na Figura 1.4, está apresentado o fluxograma com as
Figura 1. 4. Fluxograma descritivo do método dos precursores poliméricos.
1.6. O estado da arte
De acordo com exposto, pode-se perceber que semicondutores vêm sendo muito utilizados em fotocatálise e que o TiO2, especialmente na forma
anatase, é o mais utilizado para tal fim. A utilização de fotocatalisadores nanoestruturados possui como grande vantagem a alta área superficial destes materiais, contudo a dificuldade de separação dos fotocatalisadores após o processo
aumenta. Neste caso, o uso de nanocompósitos magnéticos é uma boa alternativa para contornar este problema e já é bem conhecida a utilização da ferrita Fe3O4,
sendo ainda necessário estudar a utilização de outras fases magnéticas. Outros semicondutores também precisam ser melhor explorados como fotocatalisadores.
Por exemplo, o SnO2 ainda é pouco estudado e não existem trabalhos que reportem
2. OBJETIVOS
O objetivo do presente trabalho é o desenvolvimento de estratégias de
síntese de nanocompósitos magnéticos fotocatalisadores, utilizando-se o método dos precursores poliméricos e o método sol-gel hidrolítico. Os nanocompósitos serão obtidos utilizando-se ferritas como centro, Fe3O4 ou CoFe2O4, recobertas com
3. PARTE EXPERIMENTAL
3.1. Síntese das ferritas
3.1.1. Síntese das ferritas pelo método dos precursores poliméricos
Para a síntese das nanopartículas magnéticas (ferritas) pelo o método dos precursores poliméricos, foram dissolvidos 15,76 g de ácido cítrico (J. T. Baker) em aproximadamente 150 mL de água deionizada, sob agitação a 50°C. Após a dissolução do ácido cítrico, adicionou-se 6,95 g de sulfato ferroso
(FeSO4.7H2O, Synth) e completou-se o volume para 250 mL. Desta forma, foi feita
a complexação do Fe2+, obtendo-se um citrato com proporção molar 3:1 (ácido cítrico:metal). O mesmo procedimento foi feito para os citratos de Fe3+ e Co2+, sendo adicionados 6,76 g de cloreto férrico (FeCl3.6H2O, synth) ou 6,2 g de acetato
de cobalto ([Co(CH3COO)2], Carlo Erba), respectivamente.
Após a complexação, foi feita a análise gravimétrica dos citratos para quantificação dos metais complexados. Isto foi necessário para que a proporção molar (2Fe3+:1Fe2+ e 2Fe3+:1Co2+) seja exatamente obedecida quando os citratos forem misturados. Os citratos foram misturados numa proporção molar de
2Fe3+:1Fe2+ para formar Fe3O4 e 2Fe 3+
:1Co2+ para formar CoFe2O4 e logo após foi
adicionado etilenoglicol aos citratos, numa proporção 2:1 (Etilenoglicol:ácido cítrico), sob agitação a 50°C por aproximadamente 30 minutos. Após o procedimento de poliesterificação, as resinas foram calcinadas para formação das
ferritas. Para a obtenção das ferritas CoFe2O4 e Fe3O4, as resinas poliméricas foram
calcinadas a 400 e 450°C por 2 horas em ar e a 450°C em N2. A Figura 3.1
Figura 3.1. Síntese das ferritas pelo método dos precursores poliméricos.
3.1.2. Síntese das ferritas pelo método sol gel hidrolítico
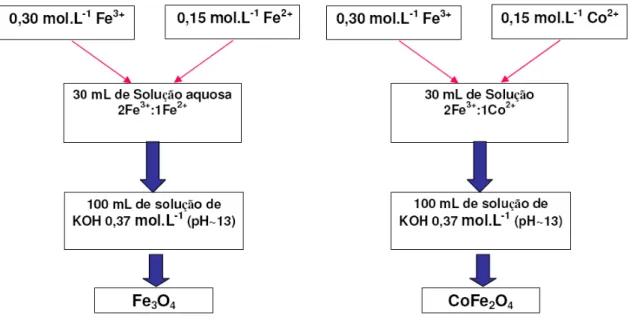
Para a síntese da ferrita Fe3O4 pelo método sol gel hidrolítico, foram
dissolvidos 4,182 g de FeSO4.7H2O (Synth) juntamente com 5,998 g de Fe2(SO4)3
(Synth) em 100mL de água destilada, sob agitação e leve aquecimento, obtendo-se uma solução a 0,15 mol/L de Fe2+ e a 0.30 mol/L de Fe3+. Foi preparado também, 100mL de uma solução de KOH a 0.37 mol/L (pH ≅ 13,6), na qual foram
adicionados 30 mL da solução contendo 2Fe3+/1Fe2+, sob agitação e leve
aquecimento, precipitando as partículas de Fe3O4 em suspensão. Para a síntese da
ferrita CoFe2O4, foi utilizado procedimento semelhante e acetato de cobalto
(Co(CH3COO)2, Carlo Erba) e Fe2(SO4)3 (Synth). Como tentativa de se melhorar a
cristalinidade de CoFe2O4, foi testado o tratamento térmico do material obtido em
utilizados) possivelmente aderidos à superfície das nanopartículas. As nanopartículas obtidas foram secas em uma chapa aquecedora em temperaturas brandas (aproximadamente 50 °C) e posteriormente levadas à caracterização. A Figura 3.2 apresenta um fluxograma com as principais etapas de síntese das
ferritas, pelo método sol gel hidrolítico.
Figura 3. 2. Síntese das ferritas pelo método sol gel hidrolítico.
3.2. Recobrimento das ferritas com o material fotoativo
Foi feito o recobrimento da ferrita CoFe2O4 via método dos
precursores poliméricos e o recobrimento da ferrita Fe3O4 via método sol gel
hidrolítico.
3.2.1. Recobrimento das ferritas pelo método dos precursores
poliméricos
ácido cítrico, foi adicionado isopropóxido de titânio (Ti[OCH(CH3)2]4, Aldrich) em
uma razão molar ácido cítrico: isopropóxido de titânio igual a 3:1. Esta solução foi mantida em refluxo por aproximadamente 12 h para dissolução do isopropóxido hidrolisado e formação do citrato. Em seguida, adicionou-se etilenoglicol à solução
em uma proporção molar etilenoglicol:ácido cítrico igual a 2:1, sob agitação a 50°C por aproximadamente 30 minutos, obtendo-se assim a resina de Ti à 0,1 mol/L.
Posteriormente, as nanopartículas de CoFe2O4 obtidas pelo método dos
precursores poliméricos foram dispersas nesta resina de Ti. Esta suspensão foi levada a moinho atritor por 2 horas para desaglomeração das nanopartículas
dispersas. Após a moagem, esta suspensão foi rotoevaporada e o produto obtido foi tratado termicamente a 450oC por 2 horas, obtendo-se os nanocompósitos de TiO2/CoFe2O4. Para estudar o efeito da variação da espessura de recobrimento
foram testadas 4 condições de recobrimento, utilizando-se 1 g, 0,50 g, 0,30 g, 0,10
g de CoFe2O4 por 100 mL de resina Ti, o que resultou em razões mássicas de 44:
56; 61: 39; 73: 27 e 89: 11 (TiO2: CoFe2O4), respectivamente. A proporção em
massa 44: 56 (TiO2: CoFe2O4) foi selecionada levando-se em conta a área
superficial inicial da ferrita CoFe2O4 (42 m2g-1) e a quantidade de TiO2 necessária
para um recobrimento teórico total, sabendo-se da molaridade da resina de Ti e da
área superficial do TiO2 obtido pela calcinação desta resina (49,4 m 2
g-1). Para as outras proporções, foi feito o aumento da quantidade de TiO2 objetivando um
melhor recobrimento da superfície da ferrita. A Figura 3.3 apresenta o esquema com as principais etapas de síntese utilizadas para a obtenção do nanocompósito
magnético de TiO2/CoFe2O4 com razão mássica 44:56 (TiO2: CoFe2O4). Para os
Figura 3. 3. Síntese de TiO2/CoFe2O4 pelo método dos precursores poliméricos.
Foram sintetizados também, nanocompósitos magnéticos de CoFe2O4
recoberta com SnO2 (SnO2/CoFe2O4). Neste caso, foi sintetizado somente o
nanocompósito com menor proporção em massa do material modificador, ou seja,
foi sintetizado SnO2/CoFe2O4 com razão mássica 44: 56 (SnO2: CoFe2O4), a partir
do mesmo procedimento descrito anteriormente, utilizando-se resina de Sn que foi obtida pelo método dos precursores poliméricos usando-se SnCl2 como precursor.
3.2.2. Recobrimento das ferritas pelo método sol gel hidrolítico
Foram gotejadas sobre as nanopartículas de Fe3O4 em suspensão e
Sn a 0,025 mol/L (SnCl2 dissolvido em etanol) para a obtenção de SnO2/Fe3O4.
Mais uma vez, foi feito o recobrimento somente com a menor quantidade de materiais modificadores, sendo sintetizados, portanto, os nanocompósitos com 44 % de TiO2 e 56 % de Fe3O4; e 44 % de SnO2 e 56 % de Fe3O4. Neste caso também,
foi necessária a diálise do material obtido para posterior caracterização e avaliação do potencial fotocatalítico. Na Figura 3.4, está apresentado os fluxogramas com as principais etapas de síntese dos nanocompósitos TiO2/Fe3O4 e SnO2/Fe3O4.
Figura 3. 4. Síntese de SnO2/Fe3O4 e TiO2/Fe3O4 pelo método sol gel hidrolítico.
3.3. Métodos de caracterização utilizados
3.3.1. Difração de raios X
A difração de raios X (DRX) é uma técnica que permite determinar as fases cristalinas formadas nos processos de síntese. Também é possível a medida indireta do tamanho de cristalito, por meio de rotinas de análises que permitam maior número de contagem e identificar corretamente o alargamento do pico de
2 2 cos 9 . 0 2 R R D Β − Β = = θ λ (19)
Onde λ é o comprimento de onda da fonte de raios X utilizada, θ é o
ângulo de difração observado, B é a largura à meia-altura do pico de difração e BR
é a largura à meia-altura de um cristal de referência, analisado nas mesmas condições (ex. silício cristalino).
A aplicação desta metodologia apresenta o diferencial de determinar o
domínio de coerência cristalográfica em várias direções, determinando indiretamente a anisotropia das nanopartículas. Vale ressaltar que o tamanho de cristalito obtido utilizando-se a equação 19, somente é igual ao tamanho de partícula para materiais monocristalinos, entretanto o valor obtido é bastante
utilizado como uma estimativa do tamanho de partícula [54]. As medidas de DRX foram feitas utilizando-se um equipamento Rigaku modelo D Max 2500PC (radiação CuKα). Os tamanhos de cristalitos obtidos por meio da equação 19 foram estimados sem a utilização do fator de correção relativo à referência de silício. Assim, os resultados obtidos foram utilizados somente de forma comparativa, em
outras palavras, como o erro é o mesmo para todas as amostras pode-se avaliar comparativamente os tamanhos dos materiais sintetizados.
3.3.2. Espectroscopia Raman
A Espectroscopia Raman é usada para estudar os modos vibracionais em um sistema através da avaliação do espalhamento da radiação incidente. Para avaliação do espalhamento Raman é utilizado um laser como fonte de radiação de excitação. O efeito Raman ocorre quando a luz incide sobre uma subatância e interage com a nuvem eletrônica das ligações químicas levando os elétrons
será excitada do estado fundamental para um estado de energia virtual e relaxa em um estado vibracional excitado, e isto gera o espalhamento Raman denominado
Stokes. Uma variação da polarizabilidade da molécula é requerida para a molécula exibir efeito Raman, sendo que a dimensão da mudança da polarizabilidade
determinará a intensidade do espalhamento Raman [55,56]. Estes espalhamentos são característicos da estrutura do material e assim a Espectroscopia Raman pode ser usada para identificar as fases de alguns materiais sintetizados, complementarmente à difração de Raios X. As análises por Espectroscopia Raman foram feitas utilizando-se um equipamento FT Raman-Bruker RFS 100/S, usando
laser YAG a 1063 nm.
3.3.3. Medidas de área superficial
A textura de um sólido é definida pelas disposições e dimensões
relativas dos diferentes elementos constituintes. No caso de materiais porosos, a determinação da textura do sólido envolve normalmente medidas de área específica, distribuição de tamanhos e forma de poros e de partículas. Esses parâmetros são de fundamental importância em vários processos, como por
exemplo, em catálise. A forma dos poros pode ser estimada a partir da análise das isotermas de adsorção e dessorção, possibilitando a determinação precisa da distribuição de tamanho de poros e área específica [57].
Ao colocar um sólido finamente dividido em contato com um gás, ocorre uma diminuição progressiva da pressão parcial do gás e um aumento da
massa no sólido. Esse fenômeno, denominado adsorção, resulta de interações físicas ou químicas entre as moléculas do gás e os átomos da superfície do sólido. Vários modelos são propostos na literatura para descrever os fenômenos de adsorção, resultando em expressões matemáticas distintas. Brunauer, Emmett e
específica de sólidos a partir de isotermas de adsorção. Esta expressão relaciona o volume de gás necessário para recobrir inteiramente à superfície de um grama de sólido como uma camada monomolecular [57]. Este modelo foi usado para determinação da área superficial dos materiais sintetizados, através de um
equipamento que avalia a adsorção de N2 na superfície destes materiais, utilizando
isoterma de BET. Através da área superficial específica e da equação 20 é possível obter a estimativa do tamanho de partícula dos materiais sintetizados, considerando-se partículas esféricas. As análises de área superficial deste trabalho foram feitas em um equipamento ASAP 2000, utilizando isoterma BET.
s
A
R
.
6
2
ρ
=
(20)Onde R é o raio da partícula, AS é a área superficial específica em
m2.g-1 e ρ é a densidade do óxido, assumida como 3.89 g.cm-3 para o TiO2 anatase,
5.304 g.cm-3 para o CoFe2O4, 5.18 g.cm -3
para o Fe3O4 e 7.02 g.cm -3
para o SnO2.
3.3.4. Microscopia eletrônica de transmissão (MET) e varredura
(MEV)
Ensaios de microscopia eletrônica são fundamentais para observação direta dos materiais obtidos. A microscopia eletrônica de varredura (MEV) fornece informações morfológicas de alto nível e também informações químicas (por meio
Em geral, em nanopartículas de tamanhos inferiores a 20 - 30 nm a microscopia eletrônica de transmissão (MET) é mais adequada. Neste caso, há a vantagem da obtenção de informações estruturais localizadas, como por exemplo, a observação dos planos cristalinos existentes nas amostras obtidas, isso em
microscópios de alta resolução (“high resolution transmission electron microscopy” HRTEM) e, principalmente, diferenciar características típicas da formação dos nanocompósitos, que possam elucidar o processo de recobrimento [59].
As análises aqui apresentadas foram feitas em um microscópio eletrônico de varredura Zeiss FE-SEM Supra 35, e em um microscópio eletrônico
de transmissão Philips CM200.
3.4. Avaliação do potencial fotocatalítico
Para os estudos de fotodegradação de moléculas orgânicas, suspensões
coloidais dos nanocompósitos sintetizados à 100 mg.L-1 foram preparadas em soluções do pesticida Atrazina à 10 mg.L-1 ou em soluções do corante Rodamina B à 2.5 mg.L-1. Os ensaios de fotodegradação foram feitos em um fotoreator termostatizado, utilizando-se uma fonte de radiação UV ou fonte de radiação
visível. A irradiação foi feita no centro do fotorreator e todos os materiais foram testados sem agitação, isto devido à dificuldade de agitação por se tratarem de materiais magnéticos. Em intervalos regulares, amostras foram coletadas e analisadas por espectroscopia UV-Visível (equipamento Shimadzu UV-1601PC), para monitoramento da concentração dos compostos orgânicos fotodegradados. A
de sódio (DBS) a 1,2.10-3 mol/L, para o estudo do efeito da adsorção das moléculas dos contaminantes sobre atividade fotocatalítica.
4. RESULTADOS E DISCUSSÃO
4.1. Caracterização e avaliação da estabilidade das ferritas
Nesta seção, serão apresentados os resultados e as discussões sobre a síntese das ferritas Fe3O4 e CoFe2O4 utilizadas como suporte para o recobrimento
com o material fotoativo. Foi observado que o método dos precursores poliméricos foi mais adequado para a obtenção de CoFe2O4, enquanto que pelo o método sol gel
hidrolítico obteve-se somente Fe3O4.
4.1.1. Ferritas via método dos precursores poliméricos
As resinas poliméricas de Fe3O4 foram calcinadas por 2 horas, nas
temperaturas de 400 e 450 oC em ar e a 450 oC em atmosfera de N2. A Figura 4.1
apresenta os difratogramas de raios X das amostras de Fe3O4 calcinadas a 400 oC
em ar e a 450oC em ar e em fluxo de N2. A identificação da fase Fe3O4 foi obtida
em todas as amostras. No entanto, mesmo a 400oC, identificou-se a presença de óxidos de Fe3+ (Fe2O3), provavelmente a fase hematita (α-Fe2O3), indicando que o
tratamento térmico ao ar pode levar à oxidação dos íons Fe2+ presentes na estrutura, levando à desestruturação da ferrita. A influência da atmosfera é confirmada na
condição de tratamento térmico a 450oC em atmosfera de N2, onde os picos
relativos à fase hematita reduzem significativamente – no entanto, ainda há um residual da fase, identificado pelo pico a 2θ=25o, que corresponde ao pico relativo ao conjunto de planos (012) da hematita. No entanto, não foram identificados picos
10 20 30 40 50 60 70 80
(442)
Fe3O4, 400oC, ar
* * * * (511) (400) (111) (220) (440)
2 θ
(311)
*
(442)
Fe3O4, 450oC, ar
(511) (400) (111) (220) (440) (311) * * (511) (400) (111) (220) (440) (311) *
Fe3O4, 450oC, N2
(442)
Figura 4. 1. Difratogramas das nanopartículas de Fe3O4 sintetizadas a 400 e 450oC em atmosferas de ar e N2. Os picos referentes ao Fe2O3 aparecem marcados por asterisco.
difratograma da Fe3O4 obtida a 400 o
C apresenta uma pequena elevação da linha de base, provavelmente devido à presença de resíduo orgânico, visto que esta temperatura está no limite inferior de temperatura necessário para eliminação do material orgânico.
A partir dos difratogramas, foram feitas as estimativas do tamanho médio de cristalito para as nanopartículas de Fe3O4. A Tabela 4.1 apresenta os
valores de tamanho médio de cristalito obtidos a partir da equação de Scherrer (equação 19) para cada plano identificado nos difratogramas. Considerando-se que as condições de síntese podem levar a nanopartículas dispersas, o tamanho médio
de cristalito é um indicativo do tamanho de partículas e também pode ser utilizada para avaliar a anisotropia presente.
Tabela 4. 1. Tamanho médio de cristalito de Fe3O4 calculados a partir da equação de Scherrer.
Fe3O4, 450 oC ar
Fe3O4, 450 oC N2
Fe3O4, 400 oC ar
2θ hkl DDRX (nm) DDRX (nm) DDRX (nm)
30,095 220 25,6 16,8 7,9
35,422 311 22,7 17,2 16,8
43,052 400 23,8 17,2 21,0
53,391 422 15,2 16,4 14,2
56,942 511 18,9 16,1 16,9
62,515 440 20,9 15,3 13,2
Média 21,2 16,5 15
Na calcinação a 450oC em N2 os tamanhos de partícula inferidos, ligeiramente
menores (valor médio de 16,5 nm) provavelmente devem-se à diminuição da mobilidade de contornos das partículas em contato, pela ausência de oxigênio – portanto, induzindo possíveis vacâncias de oxigênio superficiais.
Pode-se observar também, que quando se utiliza N2, as nanopartículas
obtidas são de características isotrópicas, com valores variando somente entre 15,3 e 17,2 nm para todas as direções cristalográficas. A calcinação a 400oC induziu maior anisotropia, indicada pela dispersividade da medida (valores variando entre 7,9 e 21,0 nm). Novamente, os cristais formados a 400 oC mostraram-se significativamente menores que os calcinados a 450oC, devido a menor sinterização que ocorre à temperaturas menores.
Devido à baixa estabilidade das ferritas de Fe3O4 demonstrada pelas
análises de DRX apresentadas na Figura 4.1 onde observa-se a presença de outras
fases (Fe2O3), foi testada a incorporação de cátions Co 2+
à estrutura das ferritas em substituição aos cátions Fe2+. Neste caso, foram testadas as temperaturas de 400 e 450oC para calcinação das resinas poliméricas somente em ar. A Figura 4.2 apresenta os difratogramas de raios X das amostras de CoFe2O4 obtidas por
calcinação a 400 e 450oC, sendo observados picos da ferrita CoFe2O4 nos
difratogramas para as duas condições de síntese. Observa-se também, a presença de picos bem definidos, indicando alta cristalinidade e nenhuma mistura de fases, a não ser pela presença de um pequeno pico a 2θ =38o, possivelmente relacionado ao óxido de cobalto, Co3O4 (identificado por um asterisco). Porém, a identificação do
Co3O4 não é conclusiva e a principal fase indesejada, hematita, não foi identificada