Monitorização farmacocinética de gentamicina num serviço de medicina interna
Texto
(2) Faculdade de Farmácia da Universidade de Lisboa. MONITORIZAÇÃO FARMACOCINÉTICA DE GENTAMICINA NUM SERVIÇO DE MEDICINA INTERNA. Maria Luísa de Morais Machado. Mestrado em Farmácia Hospitalar. Dissertação orientada por: Prof. Dr. José Augusto Guimarães Morais. Lisboa 2008.
(3) Tese de Mestrado Maria Luísa de Morais Machado. “Experience does not ever err, it is only your judgment that errs in promising itself results which are not caused by your experiment.” (Leonardo Da Vinci). Este trabalho destina-se à candidatura ao grau de mestre no âmbito do Curso de Mestrado em Farmácia Hospitalar..
(4) ÍNDICE AGRADECIMENTOS ................................................................................................................3 ÍNDICE DE TABELAS...............................................................................................................4 ÍNDICE DE GRÁFICOS ............................................................................................................6 RESUMO......................................................................................................................................7 ABSTRACT .................................................................................................................................8 PALAVRAS CHAVE/ KEYWORDS ........................................................................................9 ABREVIATURAS .....................................................................................................................10 1.. Introdução...........................................................................................................................11. 2.. Objectivos............................................................................................................................12. 3.. História................................................................................................................................13. 4.. Química ...............................................................................................................................14. 5.. Espectro de acção ...............................................................................................................14. 6.. Mecanismo de acção...........................................................................................................17. 7.. Mecanismo de resistência ..................................................................................................17. 8.. Farmacocinética .................................................................................................................18 8.1.. Absorção .......................................................................................................................18. 8.2.. Distribuição...................................................................................................................19. 8.3.. Eliminação ....................................................................................................................20. 8.4.. Parâmetros farmacocinéticos ........................................................................................21. 9.. Factores que alteram a farmacocinética dos aminoglicosidos........................................22. 10.. Efeitos adversos...............................................................................................................24. 10.1.. Nefrotoxicidade .........................................................................................................24. 10.2.. Ototoxicidade ............................................................................................................26. 10.3.. Neurotoxicidade ........................................................................................................27. 10.4.. Outros efeitos ............................................................................................................27. 11.. Vias, regimes de administração e posologia .................................................................28. 11.1.. Administração convencional .....................................................................................28. 11.2.. Administração em dose única....................................................................................28. 11.2.1. Acção bactericida concentração-dependente .........................................................30 11.2.2. Efeito pós-antibiótico (EPA) .................................................................................30 11.2.3. Resistência adaptativa............................................................................................32 11.2.4. Processo saturável de transporte através das células do túbulo renal ....................33 11.2.5. Custos ....................................................................................................................33 11.2.6. Estudos...................................................................................................................34 12.. Margem terapêutica .......................................................................................................41 1.
(5) 13.. Área sob a curva (AUC) .................................................................................................43. 14.. Monitorização farmacocinética – metodologia ............................................................45. 15.. Método de doseamento e determinação dos parâmetros farmacocinéticos...............46. 16.. Metodologia.....................................................................................................................47. 16.1. 17.. Parâmetros a avaliar ..................................................................................................47. Resultados e discussão....................................................................................................48. 17.1.. Consumo de antimicrobianos ....................................................................................48. 17.2.. Evolução da actividade de monitorização ao longo dos 7 anos ................................50. 17.3.. Análise dos resultados obtidos com a monitorização................................................54. 17.4.. Avaliação de nefrotoxicidade ....................................................................................67. 17.5.. Comparação dos resultados obtidos pela monitorização e pela aplicação do método. AUC. ...................................................................................................................................70. 17.5.1. Doentes com duas determinações de gentamicinémia no mesmo intervalo ..........70 17.5.2. Evolução dos resultados no grupo AUC................................................................73 17.5.3. Doentes com uma determinação de gentamicinémia.............................................76 18.. Conclusões .......................................................................................................................78. 19.. Bibliografia......................................................................................................................80. 2.
(6) AGRADECIMENTOS. Ao Professor Morais pela aprendizagem constante, conhecimento científico e crítica construtiva que fizeram crescer este trabalho.. Ao Professor Begg pela avaliação preliminar dos dados segundo a sua metodologia e pelos comentários e sugestões.. À família e aos amigos por todo o tempo retirado do seu convívio. Em especial à minha Mãe pelo apoio de toda uma vida.. À Sara e à Marta pela amizade incondicional, motivação constante e pela revisão crítica.. A todos os que, directa ou indirectamente, contribuiram de alguma forma para a realização deste trabalho.. 3.
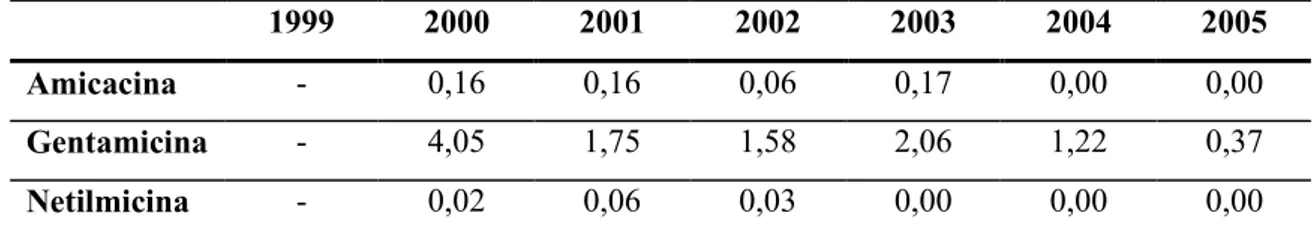
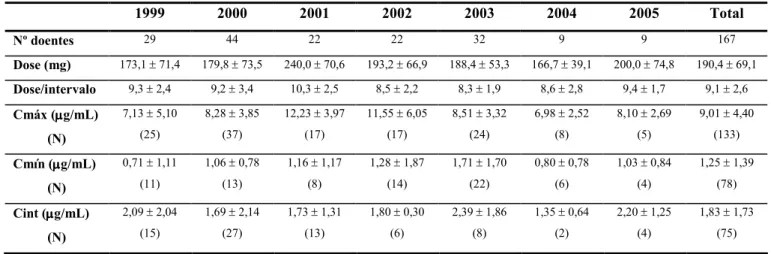
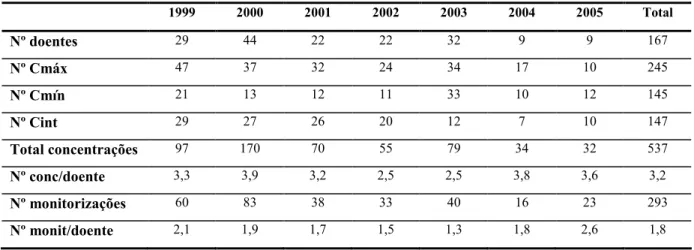
(7) ÍNDICE DE TABELAS Tabela 1 – Actividade antimicrobiana dos aminoglicosidos .......................................................16 Tabela 2 – Parâmetros farmacocinéticos dos aminoglicosidos para função renal normal (média ± desvio padrão) (140)....................................................................................................................22 Tabela 3 – Factores que alteram a farmacocinética dos aminoglicosidos (54, 123, 140, 192)....23 Tabela 4 – Factores de risco de nefrotoxicidade .........................................................................25 Tabela 5 – Estudos em humanos comparando administração em regime de dose única diária com administração convencional.................................................................................................37 Tabela 6 – Meta-análises comparando administração em regime de dose única diária com administração convencional ........................................................................................................38 Tabela 7 – Margem terapêutica da gentamicina ..........................................................................41 Tabela 8 – Referências para o valor da concentração intermédia................................................43 Tabela 9 – Dose inicial segundo o método de Begg (20) ............................................................44 Tabela 10 – Parâmetros a avaliar.................................................................................................48 Tabela 11 – Consumo total de antimicrobianos – DDD/100 camas-dia......................................49 Tabela 12 – Consumo de aminoglicosidos – DDD/100 camas-dia .............................................49 Tabela 13 – Consumo dos diferentes aminoglicosidos no serviço Medicina 1 – DDD/100 camasdia ................................................................................................................................................49 Tabela 14 – Evolução das concentrações e dose iniciais ao longo dos 7 anos (média ± desvio padrão).........................................................................................................................................50 Tabela 15 – Número de concentrações determinadas e monitorizações realizadas nos 7 anos...51 Tabela 16 – Evolução do tipo de infecção principal ao longo dos 7 anos...................................53 Tabela 17 – Antibioterapia concomitante ao longo dos 7 anos ...................................................53 Tabela 18 – Características demográficas (média ± desvio padrão) ...........................................55 Tabela 19 – Parâmetros farmacocinéticos finais (média ± desvio padrão) .................................55 Tabela 20 – Dose e concentrações iniciais (média ± desvio padrão) ..........................................62 Tabela 21 – Alteração de dose e concentrações após modificação de regime com a primeira monitorização (média ± desvio padrão) ......................................................................................64 Tabela 22 – Doses e concentrações ao longo das monitorizações – total de doentes (média ± desvio padrão) .............................................................................................................................65 Tabela 23 – Doses e concentrações ao longo das monitorizações – dose única (média ± desvio padrão).........................................................................................................................................65 Tabela 24 – Doses e concentrações ao longo das monitorizações – dose convencional (média ± desvio padrão) .............................................................................................................................66 Tabela 25 – Doentes com aumento de creatinina segundo definição de nefrotoxicidade ...........67 Tabela 26 – Evolução das concentrações e creatininémias ao longo das várias monitorizações 69 4.
(8) Tabela 27 – Proposta de dose inicial (mg/kg) em função da Cl cr (mL/min) – média ± desvio padrão ..........................................................................................................................................70 Tabela 28 – Próxima dose em mg (média ± desvio padrão)........................................................71 Tabela 29 – Evolução dos resultados de monitorização comparados com o proposto pelo método de Begg (grupo AUC)..................................................................................................................75 Tabela 30 – Concentrações obtidas após 1ª e 2ª monitorizações (grupo AUC) – µg/mL ...........76 Tabela 31 – Determinação da AUC para os doentes em regime convencional ...........................77. 5.
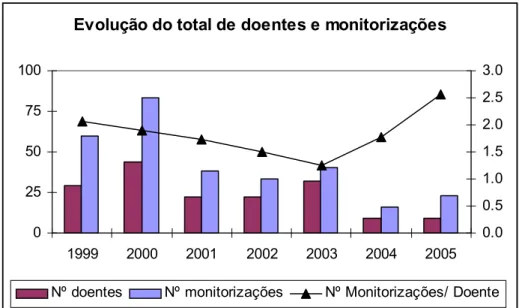
(9) ÍNDICE DE GRÁFICOS Gráfico 1 – Evolução das concentrações e dose iniciais ao longo dos 7 anos.............................50 Gráfico 2 – Evolução do total de doentes e monitorizações ao longo dos 7 anos .......................52 Gráfico 3 – Frequência da clearance da creatinina – doentes totais ............................................56 Gráfico 4 – Frequência da clearance da creatinina – dose única .................................................56 Gráfico 5 – Frequência da clearance da creatinina – dose convencional ....................................57 Gráfico 6 – Frequência de idades – doentes totais ......................................................................57 Gráfico 7 – Frequência de idades – dose única ...........................................................................58 Gráfico 8 – Frequência de idades – dose convencional...............................................................58 Gráfico 9 – Relação entre a constante de eliminação da gentamicina (h-1) e a clearance da creatinina (mL/min) – doentes totais ...........................................................................................59 Gráfico 10 – Relação entre a constante de eliminação da gentamicina (h-1) e a clearance da creatinina (mL/min) – dose única................................................................................................59 Gráfico 11 – Relação entre a constante de eliminação da gentamicina (h-1) e a clearance da creatinina (mL/min) – dose convencional ...................................................................................59 Gráfico 12 – Relação entre a clearance da gentamicina e da creatinina (mL/min) – doentes totais .....................................................................................................................................................60 Gráfico 13 – Relação entre a clearance da gentamicina e da creatinina (mL/min) – dose única 61 Gráfico 14 – Relação entre a clearance da gentamicina e da creatinina (mL/min) – dose convencional................................................................................................................................61 Gráfico 15 – Doses sugeridas em cada monitorização para o conjunto de todos os doentes e para o grupo de doentes AUC .............................................................................................................72 Gráfico 16 – Sugestões de dose obtidas através do método de monitorização utilizado e através do cálculo da AUC para a 2ª dose (ver Tabela 28)......................................................................72 Gráfico 17 – Doses sugeridas pela monitorização e pelo método AUC, para AUC alvo de 70 e 100 mgL-1h para os doentes AUC, e doses sugeridas para todos os doentes...............................73. 6.
(10) RESUMO. Este trabalho pretende fazer a caracterização da utilização de aminoglicosidos, nomeadamente do regime de administração em dose única diária. Foi feita uma revisão sobre o tema e análise dos resultados obtidos em 7 anos (1999 a 2005) de monitorização farmacocinética de gentamicina num serviço de Medicina Interna (número de doentes e concentrações estudados, dados demográficos, parâmetros farmacocinéticos, doses e concentrações iniciais e sua evolução, relação entre eliminação da gentamicina e clearance da creatinina, nefrotoxicidade). São apresentados também os dados referentes ao consumo total de antimicrobianos e de aminoglicosidos (DDD/100 camas-dia). Finalmente, procedeu-se à comparação de duas metodologias de monitorização farmacocinética:. monitorização. de. concentrações. máximas. e. intermédias. e. determinação da área sob a curva (AUC). Os parâmetros farmacocinéticos obtidos são semelhantes aos descritos na literatura. As concentrações iniciais encontram-se dentro da margem terapêutica, assegurando eficácia e segurança, mas os ajustes realizados são de aumento de dose, sugerindo que a dose inicial é baixa. No regime dose única as sugestões são conservadoras, como se verifica pelos baixos valores de concentrações máximas. A AUC média após a primeira dose é inferior à obtida após monitorização. As doses sugeridas foram inferiores às determinadas pelo método AUC. Da comparação dos dois métodos não se pode concluir que existam diferenças nas sugestões propostas, uma vez que estas resultam de informação integrada (clínica, microbiológica, analítica). Este foi um estudo retrospectivo, onde está ausente informação sobre isolamentos microbiológicos ou evolução clínica. A monitorização farmacocinética precoce selecciona o regime mais adequado a cada indivíduo. Actualmente a questão é a escolha apropriada do antimicrobiano: a utilização de aminoglicosidos em monoterapia está limitada a infecções urinárias e a evidência clínica sugere que a sua associação com β-lactâmicos de largo espectro já não seja necessária. Outro problema que subsiste é a de saber qual o intervalo mais adequado para a concentração intermédia.. 7.
(11) ABSTRACT. This study intends to characterize the aminoglycoside use, namely the once daily administration. We made a review on the subject and an analysis of the data obtained within 7 years (1999 to 2005) of gentamicin pharmacokinetic monitoring in a medical ward (number of patient and concentrations studied, demographic data, pharmacokinetic parameters, initial doses and concentrations and their evolution, relation between gentamicin elimination and creatinine clearance, nephrotoxicity). We present also data referring to total antimicrobial and aminoglycoside consumption (DDD/100 beds-day). Finally, we compared two pharmacokinetic monitoring methodologies: pharmacokinetic monitoring of maximum and intermediate concentrations and area under the curve (AUC). Pharmacokinetic parameters are similar to those found in the literature. Initial concentrations are within therapeutic levels, assuring efficacy and safety. However, adjustments were made to increase doses, suggesting that initial dose was low. In once daily regimen suggestions were conservative, what is confirmed by low maximum concentration. Mean AUC after the first dose was lower than after monitoring. Suggested doses were always lower than the ones determined by AUC method. The comparison of the two monitoring methods cannot show any differences in the suggestions made, because they are always a result of combined information (clinical, microbiological, analytical). This was a retrospective study with data lacking regarding microbiologic isolation or treatment outcome. Early pharmacokinetic monitoring will select the most suitable regimen for each patient. Today’s issue is the right drug choice: aminoglycoside use in monotherapy is restricted to urinary tract infections. Clinical evidence suggests that association with broad spectrum β-lactams is not necessary. Another question that subsists is the adequate level for intermediate concentration.. 8.
(12) PALAVRAS CHAVE/ KEYWORDS. Gentamicina Aminoglicosidos Antimicrobianos Monitorização farmacocinética Dose única Área sob a curva. Gentamicin Aminoglycosides Antimicrobials Pharmacokinetic monitoring Once daily administration Area under the curve. 9.
(13) ABREVIATURAS. AG – aminoglicosidos AINES – anti-inflamatórios não esteróides AUC – área sob a curva C – comparativo CG – cego Css – concentração no estado estacionário CIM – concentração inibitória mínima Cint – concentração intermédia Cmáx – concentração máxima Cmín – concentração mínima Cl – clearance Cr – creatinina ClCr – clearance da creatinina D – dose DC – administração em regime de dose convencional DU – administração em regime de dose única EPA – efeito pós-antibiótico FA – fibrilhação auricular HD – hemodiálise IC – insuficiência cardíaca ICC – insuficiência cardíaca congestiva IR – insuficiência renal NCG – não cego NS – estatisticamente não significativo PC – perfusão contínua R – randomisado Ke – constante de eliminação t1/2 – semi-vida de eliminação Τ – intervalo de administração TFG – taxa de filtração glomerular Vd – volume de distribuição. 10.
(14) MONITORIZAÇÃO FARMACOCINÉTICA DE GENTAMICINA NUM SERVIÇO DE MEDICINA INTERNA. 1. Introdução. Desde o início do século XX que se vêm desenvolvendo medicamentos com acção antimicrobiana que permitiram o combate eficaz de doenças de elevada mortalidade. Em 1910 Ehrlich marca o início da era da quimioterapia com a descoberta do salvarsan. Desde então foram identificadas numerosas substâncias que vieram revolucionar o tratamento das doenças infecciosas. Até há algum tempo, a utilização de antimicrobianos foi baseada em princípios farmacodinâmicos, ou seja, segundo o princípio dose-resposta: a administração de uma dose de um fármaco produz sempre uma determinada resposta. Conceitos de farmacocinética, que analisam e interpretam a evolução ao longo do tempo das concentrações de medicamento e seus metabolitos nos diferentes compartimentos do organismo mediante o estabelecimento de modelos matemáticos e de relações farmacocinética/farmacodinâmica, permitiram alterar a prática tradicional e a administração de fármacos evoluiu no sentido de individualização do regime posológico. A aplicação destes conhecimentos tem particular interesse no caso de fármacos como os aminoglicosidos, cuja variabilidade inter e intra-individual, margem terapêutica estreita e existência de numerosos factores que alteram o seu comportamento justificam a monitorização farmacocinética de níveis séricos, com base na relação que existe entre dose, concentração e efeito. Este grupo de antimicrobianos caracteriza-se pela sua actividade sobre bactérias aeróbias Gram – e algumas Gram +, continuando a ocupar na actualidade um lugar importante em numerosas situações de infecção. Trata-se de um grupo com elevada eficácia terapêutica, sinergismo com β-lactâmicos, baixa incidência de resistências e baixo custo de aquisição, o que justifica a sua importância terapêutica.. 11.
(15) As suas características particulares levaram à definição de uma nova estratégia posológica, a administração em dose única diária, com os objectivos de maximizar a eficácia e minimizar a toxicidade. Esta tem como base racional: acção bactericida concentração-dependente, marcado efeito pós-antibiótico, resistência adaptativa e o processo saturável de transporte através das células do túbulo renal. Os aminoglicosidos são moléculas básicas, de elevada polaridade, propriedade que condiciona o seu comportamento farmacocinético. Apresentam relação entre as concentrações no sangue e os seus efeitos, sendo a concentração máxima relacionada genericamente com eficácia terapêutica e a concentração mínima com efeitos tóxicos. Estes princípios básicos norteiam a monitorização farmacocinética dos aminoglicosidos, no entanto, a administração em dose única diária coloca novas questões, tendo sido propostas metodologias diferentes. Alguns métodos propõem a monitorização com base na área sob a curva, outros utilizam a determinação de uma concentração intermédia (Cint) entre as 6 e as 14 horas após administração. É este último que nos propomos estudar, tendo por base uma das actividades que constitui parte integrante do trabalho diário de Farmácia Clínica e que resulta na proposta de sugestões posológicas que vão no sentido da optimização do regime terapêutico.. 2. Objectivos. Caracterização da utilização de antimicrobianos, nomeadamente do regime de administração de aminoglicosidos em dose única diária. Análise dos resultados obtidos ao longo de 7 anos com a actividade de monitorização farmacocinética de gentamicina num serviço de Medicina Interna no Hospital de Santo António dos Capuchos/Desterro. Comparação de duas metodologias de monitorização farmacocinética: comparação dos resultados obtidos com base na monitorização de concentrações intermédias com os obtidos mediante determinação da AUC.. 12.
(16) 3. História. Os aminoglicosidos têm sido utilizados desde a descoberta da estreptomicina em 1944, obtida a partir de um actinomicete (Streptomyces griseus) por Waksman, que viria a ganhar o Prémio Nobel em 1952. Esta descoberta revestiu-se de grande valor terapêutico devido à sua actividade sobre microrganismos que tinham deixado de ser sensíveis à penicilina, em particular os causadores da tuberculose (42, 194). A identificação deste antibiótico resultou de estudos sobre a microbiologia dos solos, levados a cabo por este investigador da Universidade de New Jersey. A estreptomicina é mais estável do que a penicilina, razão pela qual foi mais fácil de isolar e produzir. É também mais tóxica e rapidamente se verificou o aparecimento de bacilos resistentes, comprometendo a sua utilização até à identificação de novos fármacos que permitiram a utilização de terapêutica combinada. A sua importância foi notória como “life saving” na tuberculose, nomeadamente no caso da tuberculose miliar, fatal na época (194). Em 1949, Waksman e Lechevalier isolaram mais um microrganismo do solo, Streptomyces fradiae, que produzia um conjunto de substâncias que foram denominadas “neomicina” das quais a neomicina B ainda é utilizada mas apenas pelo seu efeito local sobre a flora intestinal devido aos seus efeitos nefro e ototóxicos (42, 194). A canamicina foi isolada em 1957, a partir do Streptomyces kanamyceticus, por Umezawa et al e utilizada durante algum tempo, mas a toxicidade e emergência de resistências levou à sua substituição (42, 194). A gentamicina e a netilmicina foram obtidas a partir de uma espécie de Micromonospora. A gentamicina foi isolada em 1964 por Roselot et al e é ainda largamente utilizada uma vez que possui um espectro mais alargado do que o da canamicina e menor toxicidade (42, 194). A tobramicina é semelhante à gentamicina em espectro e toxicidade e foi isolada em 1967 por Higgins e Kastners a partir do Streptomyces tenebrarius (42, 194). A amicacina é um derivado semi-sintético da canamicina, foi descrita por Kawagushi et al em 1972 e o seu interesse reside no seu maior espectro de acção e na maior dificuldade em desenvolver resistências (42, 194).. 13.
(17) 4. Química. Os aminoglicosidos são constituídos por dois ou mais açúcares aminados que se ligam, através de uma ponte glicosídica, a uma hexose que constitui geralmente o núcleo da molécula. Esta hexose é denominada aminociclitol, e pode ser a estreptidina (no caso da estreptomicina) ou a 2-desoxiestreptamina (nos restantes aminoglicosidos disponíveis). Estes compostos são aminociclitóis aminoglicosídicos, sendo designados geralmente apenas como aminoglicosidos (42). As famílias de aminoglicosidos distinguem-se pelos açúcares ligados ao aminociclitol. Assim, a família da neomicina, que inclui a neomicina e a paramomicina, apresenta três aminoaçúcares ligados à 2-desoxiestreptamina e as restantes famílias possuem apenas dois açúcares. A família da canamicina (canamicina A e B, amicacina, tobramicina) apresenta 2 aminoaçúcares ligados à 2-desoxiestreptamina, sendo um deles uma 3aminohexose. A família da gentamicina (gentamicina C1, C1a e C2, sisomicina, netilmicina) possui um açúcar diferente, a garosamina. A estreptomicina difere dos outros aminoglicosidos pelo facto de possuir estreptidina e de esta não se encontrar em posição central (42). Os aminoglicosidos são moléculas de características básicas, de elevada polaridade, o que justifica em parte o seu comportamento farmacocinético. São relativamente insolúveis nos lípidos e as suas propriedades antimicrobianas são potenciadas em pH alcalino (42, 123). A sua actividade antimicrobiana é inibida em presença de pH ácido, anaerobiose e catiões divalentes, pelo que não são muito activos em presença de secreções brônquicas, abcessos, necrose tissular ou grande quantidade de detritos orgânicos (67, 149).. 5. Espectro de acção. A actividade antimicrobiana dos aminoglicosidos é dirigida essencialmente a bacilos Gram –. Têm sido utilizados pela sua acção contra a Pseudomonas aeruginosa, sendo também importantes em infecções provocadas por outros microrganismos Gram –, como Proteus ou Serratia (42, 67, 123). A sua importância voltou a acentuar-se com o aparecimento. de. infecções. provocadas. por. Pseudomonas. e. Acinetobacter. multiresistentes e espécies de Enterobacteriaeceae produtoras de betalactamases de 14.
(18) espectro alargado. Nestas situações, a única opção terapêutica disponível é frequentemente o recurso a polimixinas e aminoglicosidos (65). A sua acção sobre microrganismos Gram + é limitada, no entanto, os aminoglicosidos possuem efeito sinérgico sobre enterococos e estreptococos, quando usados em combinação com agentes que actuam sobre a parede bacteriana (ex.: penicilina, vancomicina), promovendo um efeito bactericida mais rápido do que o obtido com cada um dos fármacos isoladamente. O mecanismo deste sinergismo resulta da penetração facilitada do aminoglicosido no interior da célula bacteriana devido à destruição da parede celular pelo fármaco associado (42, 67, 123).. 15.
(19) Tabela 1 – Actividade antimicrobiana dos aminoglicosidos. CIM (µ µg/mL). BACTÉRIAS GRAMPOSITIVAS Staphylococcus aureus Streptococcus pyogenes Streptococcus pneumoniae Enterococcus faecalis BACTÉRIAS GRAMNEGATIVAS Escherichia coli Klebsiella aerogenes Klebsiella spp Proteus mirabilis Proteus vulgaris Proteus morganii Proteus rettgeri Salmonella spp Shigella spp Pseudomonas aeruginosa Serratia marcescens Providencia stuartii Enterobacter. Gentamicina. Tobramicina. Amicacina. Netilmicina. 0.03-0.12 16 16.0-32.0 2.0-4.0. 0.12-0.25. 0.4-3.1 12.5 12.5. 0.05-0.8. 0.25-1.0 1.0-2.0 0.06-1.0 0.25-2.0 1.0-4.0 1.0-4.0 1.0-8.0 0.25-1.0 1.0-2.0 0.25-2.0 0.25-0.5. 0.25-1.0. 1.6-3.1. 0.2-6.3. 0.25-1.0 1.0-4.0. 1.6-3.1 3.1 1.6 3.1 1.6. 0.2-6.3 0.2-25 0.2-12.5. 2.0-8.0. 1.0-4.0 1.0-4.0. 3.1-25. 1.6-12.5 0.8-3.1 0.8-3.1 0.8-3.1. 0.2-1.6 0.2-1.6 0.2-12.5 0.4-50 0.4-25 0.2-63. MICOBACTÉRIAS Mycobacterium tuberculosis. 0.6. 16.
(20) 6. Mecanismo de acção. Os aminoglicosidos são antimicrobianos com acção bactericida a nível intracelular por inibição da síntese proteica e alteração da integridade da parede celular (22). O transporte para o interior da célula bacteriana desenvolve-se em dois passos. O primeiro resulta de um processo de difusão passiva dependente da concentração e o segundo divide-se em duas fases dependentes de energia. O transporte inicia-se com a entrada no espaço periplasmático, após difusão através de canais aquosos formados por porinas da membrana exterior. A passagem através da membrana citoplasmática efectua-se mediante um processo de transporte dependente de energia designado por fase I. Este é um processo limitante e pode ser inibido por catiões divalentes (cálcio, magnésio), hiperosmolaridade, anaerobiose e pH baixo (22, 42, 179). Após transporte através da membrana citoplasmática, os aminoglicosidos actuam por ligação irreversível a uma proteína da subunidade ribossomal 30S, conduzindo a um erro de transcrição do RNA mensageiro (RNAm). Esta ligação leva à produção de proteínas defeituosas que, sendo incluídas na membrana celular, provocam alterações na sua permeabilidade. Desta forma o transporte do fármaco para dentro da célula bacteriana encontra-se facilitado, o que constitui uma fase II dependente de energia, resultando na acumulação intracelular. A ruptura da membrana celular, com perda do conteúdo da célula bacteriana, acaba por provocar a sua morte (22, 42, 67, 123). Este mecanismo resulta numa acção bactericida concentração-dependente, ou seja, o efeito aumenta com o aumento da concentração do aminoglicosido.. 7. Mecanismo de resistência. A resistência aos aminoglicosidos pode resultar de 3 mecanismos. O primeiro mecanismo de resistência resulta da falência de penetração através da membrana citoplasmática bacteriana e constitui um importante mecanismo de resistência à amicacina. Este tipo de resistência exclui geralmente a utilização de todos os aminoglicosidos (42, 67, 123). O mecanismo mais comum deve-se à produção de enzimas bacterianas que modificam e inactivam o fármaco, através da acetilação de grupos amino ou por fosforilação ou 17.
(21) adenilação de grupos hidroxilo. Estas enzimas localizam-se próximo da membrana bacteriana, junto das estruturas responsáveis pelo transporte do fármaco para dentro da célula. A informação genética necessária para a sua produção é mediada por plasmídeos, podendo ser transferida entre microrganismos Gram –. Estes plasmídeos encontram-se largamente difundidos na natureza, particularmente em ambiente hospitalar, e codificam um número elevado de enzimas que são responsáveis pelo aumento da resistência à canamicina, gentamicina e tobramicina. A amicacina é o aminoglicosido mais resistente a este tipo de enzimas, devido a cadeias laterais que protegem a molécula, o que justifica o seu interesse em determinado tipo de infecções (42, 67, 112, 123). Finalmente, o mecanismo menos comum de resistência está associado a uma alteração da subunidade ribossomal 30S que conduz à impossibilidade de ligação do aminoglicosido ao seu local de acção (42, 67, 123).. 8. Farmacocinética. 8.1. Absorção. Os aminoglicosidos são catiões altamente polares pelo que são pouco absorvidos no tracto gastrointestinal após administração oral. A absorção pode ser aumentada em caso de doença gastrointestinal (úlcera, doença inflamatória intestinal). Podem apresentar uma absorção considerável após aplicação tópica durante períodos prolongados sobre grandes extensões (feridas, queimaduras, úlceras cutâneas) ou no espaço peritoneal (42, 123). A sua absorção é praticamente completa após administração intramuscular, com concentrações máximas após 30 a 90 minutos semelhantes às que se verificam 30 minutos após perfusão intravenosa da mesma dose durante 30 minutos (42, 123). A administração intraperitoneal a doentes submetidos a diálise peritoneal contínua ambulatória produz níveis terapêuticos, com uma biodisponibilidade sistémica média de 49 a 84% após 4 a 6 horas. A absorção a partir da cavidade peritoneal é errática, pelo que conduz à necessidade de monitorização das concentrações plasmáticas (42, 123). A administração endotraqueal foi utilizada no tratamento de pneumonias que não respondiam à administração sistémica de antimicrobianos. O grau de absorção sistémica 18.
(22) após administração endotraqueal é muito variável, podendo alguns doentes apresentar uma absorção considerável. Desta forma, a administração de aminoglicosidos por esta via requer uma monitorização cuidadosa, especialmente se for concomitante com administração sistémica (42, 123).. 8.2. Distribuição. A distribuição dos aminoglicosidos é descrita de forma mais correcta através de um modelo de dois ou três compartimentos, no entanto o modelo monocompartimental é o mais utilizado na prática devido à sua simplicidade e preditibilidade. Após administração intravenosa verifica-se uma distribuição rápida aos tecidos e orgãos profusamente irrigados, com uma semi-vida de distribuição (α) de 5 a 15 minutos. A fase de distribuição processa-se geralmente em cerca de 25 a 75 minutos. Numa segunda fase (β), mais lenta, a concentração plasmática começa a diminuir, coexistindo os processos de distribuição e eliminação. Está descrita também uma terceira fase (γ) no modelo tri-compartimental que corresponde à eliminação limitada pela redistribuição a partir dos denominados compartimentos profundos (42, 123). Em concentrações séricas terapêuticas, os aminoglicosidos não atravessam a barreira hemato-encefálica de modo a produzir concentrações terapêuticas no líquido cefaloraquideano, mesmo quando existe inflamação das meninges (42, 123). A concentração de aminoglicosidos nas secreções brônquica e pleural é de cerca de 14 a 66% da concentração plasmática, aumentando de forma directa com o aumento da concentração plasmática. Devido à dificuldade de atingir concentrações terapêuticas no local da infecção, a utilização isolada de aminoglicosidos no tratamento de pneumonias provocadas por microrganismos Gram – não é recomendada (42, 123). A difusão de aminoglicosidos no líquido sinovial é lenta, no entanto as concentrações observadas são normalmente adequadas para o tratamento de artrite séptica, podendo mesmo exceder em 50% os níveis plasmáticos obtidos (42, 123). A penetração dos aminoglicosidos na bílis depende do fármaco e do grau de obstrução. A concentração observada é geralmente inferior à concentração plasmática, com valores pouco. superiores. às. concentrações. inibitórias. mínimas. dos. microrganismos. potencialmente infectantes (42, 123).. 19.
(23) Os aminoglicosidos não apresentam penetração no humor aquoso do olho, sendo necessária a administração por injecção intra-vítrea para o tratamento de endoftalmite bacteriana (149). Os estudos em doentes com ascite indicam que as concentrações de aminoglicosidos aumentam lentamente no líquido ascítico, atingindo valores máximos ao fim de 2 a 6 horas. Os níveis obtidos estão próximos da concentração inibitória mínima de Gram –, atingindo equilíbrio com o plasma 2 a 4 horas após administração (42, 123). Após administração intravenosa, a penetração dos aminoglicosidos no dialisado peritoneal é variável, independentemente de existir peritonite. As concentrações no dialisado aumentam proporcionalmente ao aumento da concentração plasmática ao longo do tempo (42, 123). As concentrações de aminoglicosidos no córtex renal são 10 a 50 vezes superiores às verificadas no plasma. O rim pode reter até 40% do total de aminoglicosido no organismo. Estudos em animais demonstraram que a captação de aminoglicosidos pelo córtex renal é saturável para a gentamicina, tobramicina e netilmicina, enquanto para a amicacina parece ser saturável para concentrações plasmáticas baixas e linear para concentrações elevadas. No Homem verifica-se a mesma relação, pelo que doses únicas de gentamicina, tobramicina, amicacina e netilmicina produzem menor acumulação no tecido renal do que a mesma dose administrada em perfusão (42, 123). Os tecidos do ouvido interno apresentam também elevada afinidade para os aminoglicosidos, onde se observam igualmente elevadas concentrações destes fármacos (42, 123). A administração de aminoglicosidos a grávidas origina concentrações elevadas de aminoglicosidos na placenta, líquido amniótico e urina, rim e baço do feto. A administração de aminoglicosidos durante a gravidez deve ser evitada devido ao risco de efeitos tóxicos sobre o feto (42, 123). A penetração de aminoglicosidos no osso não está bem estudada. Os dados existentes indicam uma fraca penetração no osso não infectado (42, 123).. 8.3. Eliminação. Os aminoglicosidos praticamente não sofrem metabolização sendo excretados sob a forma inalterada na urina, por filtração glomerular. Uma vez filtrado, o aminoglicosido liga-se a receptores fosfolipídicos nas células no túbulo proximal, verificando-se alguma 20.
(24) reabsorção tubular sobretudo por endocitose. O fármaco reabsorvido acumula-se nos lisossomas das células do túbulo proximal, resultando em elevadas concentrações no córtex renal. As concentrações de aminoglicosidos na urina atingem valores 30 a 100 vezes superiores às observadas no plasma (42, 123). Após administração de um aminoglicosido, a sua concentração diminui em 3 fases. A fase rápida (α) corresponde à distribuição. A fase β tem uma semi-vida de 2 a 3 horas em adultos com função renal normal e aumenta proporcionalmente ao decréscimo da clearance da creatinina, com variações que vão de 17 a 150 horas para valores inferiores a 10 mL/min. A terceira fase (γ) representa a libertação do fármaco dos depósitos e apresenta valores de 112 horas (27-693 horas) para a gentamicina, 187,7 ± 62,5 horas para a amicacina, 146 horas (33-428 horas) para a tobramicina (42, 123). Os aminoglicosidos são removidos por técnicas dialíticas como hemodiálise e diálise peritoneal. A hemodiálise remove cerca de 50% da dose administrada em 12 horas, pelo que a administração de aminoglicosidos a doentes submetidos a hemodiálise deve ser feita após a sessão respectiva seguida de monitorização da concentração. A diálise peritoneal é menos eficaz na remoção de aminoglicosidos, apresentando ainda grande variabilidade. A concentração de fármaco no líquido peritoneal é cerca de 10 vezes inferior à verificada no plasma, não se observando valores terapêuticos. Assim, em caso de infecção peritoneal recomenda-se a administração no líquido dialisante (42, 123).. 8.4. Parâmetros farmacocinéticos. O comportamento farmacocinético dos aminoglicosidos é ilustrado pelos seus parâmetros farmacocinéticos, volume de distribuição (Vd) e semi-vida (t1/2). Estes derivam das características descritas, podendo dizer-se que o seu volume de distribuição se aproxima do volume do fluído extra-celular (cerca de 20 a 30% do peso magro no adulto). Praticamente não sofrem metabolização, são excretados rapidamente e de forma inalterada na urina e têm uma semi-vida curta.. 21.
(25) Tabela 2 – Parâmetros farmacocinéticos dos aminoglicosidos para função renal normal (média ± desvio padrão) (140). Vd (L/kg). t1/2 (h). Cl (Lh-1kg-1). Recém-nascidos (≤ 4 semanas). 0,5 ± 0,1. 6±2. 0,05 ± 0,01. Lactentes (> 4semanas – 1 ano). 0,4 ± 0,1. 4 ±1. 0,1 ± 0,05. 0,35 ± 0,15. 2±1. 0,1 ± 0,03. Adolescentes (> 13 - ≤ 18 anos). 0,3 ± 0,1. 1,5 ± 1. 0,09 ± 0,03. Adultos (> 18 anos). 0,25 ± 0,1. 2±1. 0,08 ± 0,03. Adultos (> 60 - ≤ 75 anos). -. 3,5 ± 3. 0,06 ± 0,03. Adultos (> 75 anos). -. 4±3. -. Crianças (> 1 - ≤ 13 anos). 9. Factores que alteram a farmacocinética dos aminoglicosidos. Diversos. factores. podem. alterar. as. características. farmacocinéticas. dos. aminoglicosidos, podendo-se considerar populações distintas no que se refere ao comportamento farmacocinético perante a sua administração (Tabela 3).. 22.
(26) Tabela 3 – Factores que alteram a farmacocinética dos aminoglicosidos (54, 123, 140, 192) FACTOR. OBSERVAÇÕES. PARÂMETROS FARMACOCINÉTICOS. Vd IDADE. ↓ função cardíaca, ↓ fluxo sanguíneo renal, ↓ filtração glomerular.. DOENTES GERIÁTRICOS. ↓ TFG (↓ ↓ produção Cr endógena pode ser mau indicador). Podem desenvolver Doença Cardíaca Congestiva 2ária a sépsis Gram - ⇒ ↑ fluído extra-celular e edema.. FUNÇÃO RENAL. Condiciona a eliminação. Cr é indicador tardio; ↑ Cr pode ser devido a desidratação.. DESNUTRIÇÃO GRAVE. ⇒ ↓ albumina, ↑ fluído extra-celular. ↓ produção Cr.. OBESIDADE. AG polares ⇒ ↑ Vd por ↑ espaço extra-celular (muito inferior do que com fármacos lipídicos).. ASCITE/ EDEMA. ↓ albumina ⇒ ↓ pressão oncótica das proteínas ⇒ ↓ filtração glomerular ⇒ ↑↑ espaço extra-celular (↑ ↑ dose).. FEBRE. ⇒ ↑ frequência cardíaca ⇒ ↑ fluxo sanguíneo renal e ↑ filtração glomerular ⇒ ↑ eliminação.. I.C.C.. ↓ trabalho cardíaco, ↓ perfusão renal e ↓ TFG ⇒ ↑ fluído extra-celular e edema.. QUEIMADOS. Fase aguda ⇒ ↓ fluxo sanguíneo renal e ↓ ClCr ⇒ ↓ Vd e ↑ t1/2. Fase hipermetabólica (↑ ↑ taxas metabolismo basal e Cl O2) ⇒ alterações hemodinâmicas ⇒ ↑ eliminação e ↑↑ fluído extra-celular ⇒ ↑↑ Vd e ↑ t1/2. Após a diurese pós-queimadura, Vd volta ao normal, mas Cl mantém-se ↑.. DOENTES PEDIÁTRICOS. Eliminação + rápida.. DIÁLISE PERITONEAL. Grande variabilidade (fluxo sanguíneo renal, função renal, fluído extra-celular, ...); parâmetros farmacocinéticos variam de acordo com idade e peso ⇒ variações diárias de Vd, Cl, t1/2; dificuldade em controlar concentrações. Geralmente > fluído extra-celular, que normaliza nos1os meses. 1) Administração de uma dose diária que mantenha Css média e uma dose de reposição pós-HD; OU 2) Administração apenas após HD. Muito < eficácia na remoção de AG do que HD. Mas, como é constante durante ≈ 36 h, pode remover 30%.. CIRURGIA. Doentes cirúrgicos têm geralmente outros factores que podem alterar a ke e Cl dos AG (idade, aporte de fluídos, albumina, patologia de base, ...).. RECÉM-NASCIDOS HEMODIÁLISE. ↑. ke. t1/2. Cl. ↓. ↑. ↓. ↓. ↑. ↓. ↓. ↑. ↓. ↑. ↑↑. ↑. SEPSIS. ↑ trabalho cardíaco, ↓ resistência vascular sistémica, hipermetabolismo, ↑ permeabilidade capilar, ↑ aporte de fluídos. ↑. DOENTES CRÍTICOS. Ventilação: ↑pressão intratoráxica compromete o retorno venoso ⇒ retenção de fluídos e ↑ Vd. Malnutrição: alterações de H2O no organismo. Hipermetabólicos: ↑ consumo O2, ↑ trabalho cardíaco, ↑ fluxo sanguíneo aos orgãos vitais, especialmente rim ⇒ ↑ Cl AG. Falência orgânica: ↓ fluxo sanguíneo e ↓ Cl AG.. ↑. DOENÇA GINECOLÓGICA. Infecção ginecológica ↑ ke ⇒ ↑ dose: porque grupo jovem, que responde à febre com ↑ trabalho cardíaco e ↑ fluxo sanguíneo renal ⇒ ↑ Cl.. FIBROSE QUÍSTICA. Necessidade de doses diárias muito ↑. ↑ CrCl, ↑ eliminação e Cl de fármacos excretados pelo rim: provavelmente devido a estado hipermetabólico associado à doença e > TFG associada à idade jovem.. ↑. ONCOLOGIA. Geralmente ↓ albumina, ↑ H2O no organismo, ↑ Vd ⇒ ↑ dose.. ↑. SIDA. Geralmente ↓ albumina, ↑ H2O no organismo, ↑ Vd ⇒ ↑ dose.. ↑. INTERACÇÕES. Penicilinas: risco de inactivação dos AG ⇒ ↓ t1/2, ↑ Cl Furosemida: ↑↓ Cl dos AG (deplecção de volume não compensada ⇒ ↑ risco de toxicidade) Vancomicina, Anfotericina, Ciclosporina, Cisplatíneo: ↑ risco de toxicidade. ↓. ↑. ↓. ↑. ↓. ↑. ↓. ↑. ↓. ↑. ↓. ↑. ↑↓ ↑. ↓. ↑. ↑. ↓. ↑. 23.
(27) 10. Efeitos adversos. O maior factor limitante da utilização de aminoglicosidos em terapêutica é a existência de efeitos adversos, principalmente nefro e ototoxicidade (42, 44, 123, 162, 163, 164, 188). Outros efeitos adversos estão também associados à administração de aminoglicosidos, embora com menor incidência, como bloqueio neuromuscular, alterações electrolíticas, rash cutâneo ou anafilaxia.. 10.1. Nefrotoxicidade. A nefrotoxicidade dos aminoglicosidos está relacionada com a sua reabsorção ao nível do túbulo proximal por endocitose, conduzindo ao armazenamento nos lisossomas das células tubulares. Uma vez dentro dos lisossomas, os aminoglicosidos tendem a ligar-se aos fosfolípidos das membranas, reduzindo a sua mobilidade nas bicamadas lipídicas que constituem as membranas celulares. Esta ligação dos aminoglicosidos à bicamada lipídica provoca a agregação das membranas assim como a inibição das fosfolipases e esfingomielinases lisossomais, o que resulta em acumulação de fosfolípidos nos lisossomas. A acumulação de fármaco e fosfolípidos conduz à fosfolipidose com libertação do conteúdo lisossomal para o citoplasma, o que leva à perda da integridade das membranas celulares, acabando por contribuir para a ruptura celular e necrose tubular. A reabsorção ao nível do túbulo proximal torna-se deficitária e a filtração glomerular diminui de modo a impedir a perda massiva de fluído (7, 57, 72, 123, 124, 132, 183). Os aminoglicosidos inibem a actividade das enzimas fosfatidilinositol fosfolipase C e ATPase Na/K. A inibição da fosfatidilinositol fosfolipase C provoca uma diminuição da produção de prostaglandinas vasodilatadoras e a inibição da ATPase Na/K leva a um aumento da actividade da renina. A combinação destes efeitos resulta em vasoconstrição local, com uma redução da filtração glomerular (7, 123). A nefrotoxicidade associada a aminoglicosidos apenas se torna manifesta após 5 a 7 dias de tratamento. A primeira manifestação clínica de nefrotoxicidade é a enzimúria, resultante da perda de integridade das membranas celulares e da libertação de enzimas lisossomais. A alteração da reabsorção conduz a uma deficiência na capacidade de concentração da urina, com poliúria, proteinúria ligeira e aparecimento de cilindros hialinos e granulares no sedimento urinário. Alguns dias mais tarde a situação evolui 24.
(28) com insuficiência renal não oligúrica, caracterizada pela redução da taxa de filtração glomerular, associada a um aumento de BUN (blood urea nitrogen). A necrose tubular grave está associada a um aumento de creatinina no plasma (0,5 a 2,0 mg/dL) e de sódio na urina, que se verifica apenas após perda de integridade de um número significativo de nefrónios, e, mais raramente, hipocaliémia, hipocalcémia e hipofosfatémia (22, 42, 179, 183). Embora seja uma situação reversível, devido à capacidade de regeneração das células do túbulo renal, contribui para o aumento da morbilidade e dos custos associados (42, 67). O aumento de creatininémia é, no entanto, um indicador tardio da insuficiência renal provocada por administração de aminoglicosidos, apenas se manifestando quando os mecanismos compensatórios falharam, e continuando a agravar mesmo após interrupção ou redução da dose (123, 174).. Têm sido descritos diversos factores de risco de nefrotoxicidade (Tabela 4): duração da terapêutica, concentrações mínimas elevadas, hipotensão, doença hepática, idade avançada, administração concomitante de outros fármacos nefrotóxicos (vancomicina, anfotericina, ciclosporina, cisplatíneo, etc.) (22, 28, 67, 123, 124, 183).. Tabela 4 – Factores de risco de nefrotoxicidade. Estado inicial do doente. Fármacos nefrotóxicos. Idade avançada. Furosemida (com deplecção de volume). Alteração da função renal. Cefalosporinas. Terapêutica prévia com AG. Vancomicina. Insuficiência hepática. Anfotericina B. Redução de volume plasmático. Cisplatíneo. Hipotensão, choque. Ciclosporina. Associados ao fármaco Dose total elevada. Contrastes radiológicos AINEs. Duração da terapêutica Intervalo de administração frequente Concentrações elevadas. Na prevenção da insuficiência renal associada a aminoglicosidos devem ser considerados os potenciais factores de risco, a monitorização da função renal e a monitorização de concentrações plasmáticas de aminoglicosidos (7, 28, 69, 105, 123).. 25.
(29) O volume plasmático deve ser corrigido, de modo a manter a perfusão renal normal, assim como a dose a administrar no caso de já existir algum compromisso da função renal ou em idosos (7, 28, 69, 105, 123). A monitorização das concentrações plasmáticas é também de grande utilidade. Uma vez que os aminoglicosidos são excretados essencialmente por filtração glomerular, qualquer factor que interfira com a função renal se reflecte nos valores obtidos. Uma redução da função renal traduzir-se-à num aumento da concentração mínima como preditor de insuficiência renal, o que conduzirá à correcção do regime posológico, evitando a ocorrência de nefrotoxicidade (7, 28, 69, 105, 123). A incidência da nefrotoxicidade é muito variável conforme os estudos (foram descritos valores até 55%) e dependente da definição de nefrotoxicidade considerada (179). A definição de nefrotoxicidade associada à administração de aminoglicosidos baseia-se na alteração do valor basal de creatininémia do doente. Para se poder considerar toxicidade, terá de se verificar um aumento de creatininémia igual ou superior a 0,5 mg/dL, para um indivíduo com função renal normal. No caso de os valores basais de creatininémia serem elevados, 2,0 a 4,9 mg/dL ou 5,0 a 10,0 mg/dL, o aumento considerado deve ser igual ou superior a 1,0 ou 1,5 mg/dL, respectivamente (123).. 10.2. Ototoxicidade. A ototoxicidade, ao contrário da nefrotoxicidade, é irreversível e pode produzir-se a nível coclear ou vestibular. A sua incidência, tal como a ototoxicidade diferencial entre os vários aminoglicosidos, é objecto de grande controvérsia, podendo variar de 2-10% a 43% conforme os estudos (67, 179). A avaliação clínica desta situação é difícil devido a várias razões: a perda de audição afecta tipicamente as altas frequências, pelo que não é facilmente detectável durante o internamento hospitalar; não existe nenhum método universalmente aceite como padrão para a definição da ototoxicidade provocada por fármacos; e a avaliação clínica da disfunção vestibular em doentes hospitalizados é praticamente impossível. Assim, existem poucos estudos que documentem devidamente este efeito adverso dos aminoglicosidos (37, 67, 74, 179). O tinitus é geralmente o primeiro sintoma de ototoxicidade a nível coclear. A perda de audição resulta da degeneração das células (hair cells) da cóclea, com início nas células da base e progressão para o apex. A perda de audição nas altas frequências é seguida. 26.
(30) geralmente pelas baixas frequências que são as utilizadas na comunicação. Quando a situação se torna clinicamente aparente já se verificou dano substancial (22, 123, 179). No aparelho vestibular, a destruição tem início no apex das cristas e regiões estriolares da mácula, progredindo para a periferia do receptor vestibular. As terminações nervosas sensitivas aferentes são afectadas. A toxicidade vestibular apresenta-se clinicamente como desequilíbrio, ataxia, vertigens, náuseas, nistagmus (37, 67, 74, 123, 179). Devido à dificuldade em estudar a ototoxicidade, também os factores de risco são difíceis de isolar. No entanto, tem sido associada a dose cumulativa elevada, dose total diária, duração da terapêutica, concentrações máximas elevadas ocasionadas por insuficiência renal, exposição prévia a aminoglicosidos, idade, patologias de base e estado nutricional (22, 74, 123, 179).. 10.3. Neurotoxicidade. Os aminoglicosidos têm sido associados também a efeitos adversos neurológicos, que se manifestam habitualmente como paralisia muscular e depressão respiratória (42, 123, 179). O bloqueio neuromuscular resulta da interferência com a libertação pré-sináptica de acetilcolina ou da redução da resposta pós-sináptica à acetilcolina. Verifica-se com a utilização de qualquer via de administração e a potência de bloqueio difere de acordo com o aminoglicosido, de forma decrescente: neomicina e netilmicina > estreptomicina > amicacina > gentamicina e tobramicina (42, 123, 179). O risco de se verificar este efeito aumenta em doentes com miastenia gravis, doença de Parkinson, hipocalcémia grave ou sob terapêutica com bloqueadores neuromusculares (42, 123, 179).. 10.4.. A. Outros efeitos. terapêutica. com. aminoglicosidos. pode. provocar. alterações. electrolíticas,. nomeadamente, hipomagnesémia, hipocaliémia e hipocalcémia. A hipomagnesémia foi descrita em até 38% dos doentes e resulta de perda renal induzida pelos aminoglicosidos.. A. hipocaliémia. e. a. hipocalcémia. são. consequência. da. hipomagnesémia e podem ser corrigidas com a administração de magnésio. A. 27.
(31) hipomagnesémia e a hipocalcémia induzidas pelos aminoglicosidos podem provocar irritabilidade neuromuscular e convulsões (123). Podem também observar-se outros efeitos adversos, mais raros, que incluem anafilaxia, alopécia, trombocitopénia, rash cutâneo (123).. 11. Vias, regimes de administração e posologia. A administração de aminoglicosidos faz-se geralmente por via intravenosa, mediante uma perfusão de 30 minutos após diluição da dose total a administrar. A administração intramuscular constitui uma alternativa quando a via intravenosa não é possível, uma vez que a absorção é praticamente completa. São utilizadas outras vias de administração como a inalatória no caso específico da fibrose quística, intra-vítrea no tratamento de endoftalmite, etc... 11.1. Administração convencional. O regime de administração convencional, regime de doses múltiplas ou regime intermitente, corresponde à administração de uma dose a intervalos fraccionados num dia, geralmente, para adultos com função renal normal, 1 – 1,7 mg/kg/8h. Este regime foi desenhado de modo a que as concentrações séricas ficassem acima da CIM durante a maioria do intervalo de administração (18, 43).. 11.2. Administração em dose única. A administração em dose única diária corresponde à administração da dose total diária numa única administração e as doses propostas são de 4 – 7 mg/kg (179). Este regime é também designado por administração em intervalo alargado, uma vez que o intervalo não tem de ser necessariamente de 24 horas.. O objectivo de evitar ou reduzir a nefrotoxicidade dos aminoglicosidos levou ao desenvolvimento de várias ideias. Uma destas estratégias seria a competição para a ligação à membrana “brush border”, por exemplo, associando substâncias ou alterando o pH urinário. Estas hipóteses não se traduziram em resultados clínicos, mas levaram ao 28.
(32) reconhecimento de que os aminoglicosidos poderiam ser os seus próprios competidores, surgindo a ideia da administração de uma dose única diária de aminoglicosido ser menos tóxica do que a administração da mesma dose dividida em 2 ou 3 administrações por dia. A explicação para este facto resulta de que o transporte do fármaco através das células do túbulo renal é um processo saturável, ou seja, uma vez atingido determinado nível de concentração o fármaco que passa para o lúmen já não é reabsorvido (39, 183). Dois estudos verificaram ainda a variação circadiana da taxa de filtração glomerular, o que poderá fornecer indicações quanto à hora mais adequada para a administração da dose única diária de aminoglicosido de modo a reduzir a disponibilidade no rim, contribuindo assim para a redução da nefrotoxicidade (165, 174). Prins (165) demonstrou que a administração durante o período de descanso está associada a maior incidência de nefrotoxicidade e os estudos de Rougier (174) sugerem que a melhor hora para administração de aminoglicosidos é às 13h30’.. Simultaneamente outros estudos demonstravam que a obtenção de uma concentração máxima elevada era determinante para a eficácia do tratamento com aminoglicosidos (135, 136). Moore demonstrou que a presença de concentração máxima superior a 5 µg/mL para a gentamicina nas primeiras 24-48 horas permite aumentar a sobrevivência em doentes com bacteriémia (136) e que concentrações máximas superiores a 7 µg/mL estão associadas a melhor resultado em doentes com pneumonia do que concentrações mais baixas (135). A obtenção de concentrações mais elevadas mais precocemente com o regime de administração única diária permite a erradicação mais rápida do microrganismo responsável pela infecção e consequentemente a redução do tempo de terapêutica com aminoglicosido. Desta forma a exposição ao fármaco é menor, o que se traduzirá numa redução do risco de toxicidade (141, 151). A redução do tempo de terapêutica e do risco de toxicidade implicam também uma redução dos custos associados à terapêutica.. A base teórica e racional para a administração de aminoglicosidos em dose única diária foi descrita por numerosos autores e assenta em 4 pressupostos (10, 18, 39, 43, 59, 67, 73, 77, 79, 83, 84, 93, 114, 122, 124, 142, 144, 149, 160, 169, 173, 191): -. acção bactericida concentração-dependente,. -. efeito pós-antibiótico (EPA),. -. resistência adaptativa, 29.
(33) -. processo saturável de transporte através das células do túbulo renal.. 11.2.1. Acção bactericida concentração-dependente. Os aminoglicosidos são antimicrobianos concentração-dependentes, ou seja, para os quais o aumento da concentração de fármaco está relacionado com o aumento da taxa e extensão da actividade bactericida (22, 50, 67, 73, 123, 124, 144, 149, 173, 179). Estes antimicrobianos devem ser administrados de modo a optimizar a concentração máxima, sendo as relações Cmáx/CIM e AUC/CIM os principais parâmetros que se correlacionam com a sua eficácia (4, 18, 39,48, 49, 50, 70, 102, 103, 114, 148). A relação Cmáx/CIM é o maior determinante da resposta clínica para aminoglicosidos e deve ser mantida em valores de 8 – 10. Os estudos demonstram que uma concentração máxima 8 a 10 vezes superior à CIM permite obter valores de resposta clínica superiores a 90% e reduzir a emergência de subpopulações resistentes (24, 33, 50, 102, 103, 134, 144). A obtenção de valores de concentração máxima desta ordem de grandeza é mais fácil com a administração em regime de dose única diária (10, 18, 22, 31, 39, 59, 70, 73, 75, 113, 114, 122, 142, 144, 157, 160, 169, 200, 201).. 11.2.2. Efeito pós-antibiótico (EPA). O efeito pós-antibiótico define-se como a supressão persistente do crescimento bacteriano após exposição transitória a um antimicrobiano (18, 50, 70, 84, 95, 206). Corresponde ao tempo durante o qual o crescimento bacteriano permanece inibido após eliminação do antimicrobiano do local de acção (39, 84, 205). O mecanismo associado ao efeito pós-antibiótico não é bem conhecido, depende do par antibiótico-microrganismo e é multifactorial (120, 205, 206). O efeito pós-antibiótico pode resultar da união irreversível de uma quantidade subletal de aminoglicosido às subunidades ribossomais bacterianas impedindo a síntese proteica ou corresponder ao tempo necessário para os ribossomas retomarem a síntese proteica após a exposição a aminoglicosidos (95, 120, 160, 169). O contributo da resposta imunitária do hospedeiro para o controlo da divisão bacteriana é outro factor envolvido no mecanismo do efeito pós-antibiótico (120, 122, 169). Durante a fase de efeito pós-antibiótico as bactérias estão mais susceptíveis à acção dos. 30.
Imagem
Outline
Documentos relacionados
Estaca de concreto moldada in loco, executada mediante a introdução no terreno, por rotação, de um trado helicoidal contínuo. A injeção de concreto é feita pela haste
Este estudo, assim, aproveitou uma estrutura útil (categorização) para organizar dados o que facilitou a sistematização das conclusões. Em se tratando do alinhamento dos
Ocorre o fenômeno da crase diante dos pronomes relativos “a qual” e “as quais”, quando o verbo da oração introduzida por esses pronomes exigir a
17.1 A Alfa Seguradora se reserva o direito de a qualquer tempo, durante a vigência deste contrato, proceder inspeção no local do Seguro, devendo o Segurado proporcionar todos
A versão reduzida do Questionário de Conhecimentos da Diabetes (Sousa, McIntyre, Martins & Silva. 2015), foi desenvolvido com o objectivo de avaliar o
Colhi e elaborei autonomamente a história clínica de uma das doentes internadas no serviço, o que constituiu uma atividade de importância ímpar na minha formação, uma vez
Ninguém quer essa vida assim não Zambi.. Eu não quero as crianças
Para obter um sistema simbólico universal e concreto, capaz de abarcar de uma só vez a pluralidade de todas as trocas e a realização de suas concretudes sobre vidas,