QUINZE ANOS DE AVALIAÇÃO ECONÓMICA
DE MEDICAMENTOS EM PORTUGAL: UMA REVISÃO
Resumo
Objetivos: Os objetivos principais desta revisão são quantificar e analisar, à luz das orientações
metodoló-gicas, os estudos de avaliação económica de medicamentos apresentados e publicados nos últimos 15 anos. Adicionalmente, com base na evidência empírica deste estudo e na experiência dos seus autores, pretende--se lançar a discussão para uma futura revisão das orientações metodológicas.
Métodos: Foi realizada uma revisão compreensiva da literatura que permitiu identificar os estudos
rea-lizados para Portugal e publicados entre janeiro de 1999 e dezembro de 2013. O processo utilizado para a pesquisa bibliográfica assenta na técnica iterativa de pearl growing, utilizando métodos de captura-recaptu-ra. A pesquisa foi complementada com um pedido de envio dos estudos através da lista de associados da APIFARMA e da APES, o que possibilitou a integração de literatura cinzenta.
Resultados: Esta revisão permitiu identificar e analisar um total de 99 estudos divulgados nos últimos 15 anos,
sendo que, na sua maioria, foram apresentados sob a forma de poster/comunicação oral (64 por cento) e 33 (33 por cento) foram publicados como artigos científicos. Observou-se uma tendência crescente do número de apresentações/publicações, refletindo a necessidade e a importância destes estudos para o apoio à tomada de decisões sobre financiamento público de medicamentos em Portugal. A maioria dos estudos incidiu sobre medicamentos oncológicos ou biológicos (32 por cento). Grande parte dos estudos (36 por cento) reportou resultados de dominância versus comparação e apenas 14 por cento dos estudos reporta rácios superiores a 30 mil euros, o que pode indiciar algum viés de seleção de publicações de estudos com resultados mais positivos. Sobre as orientações metodológicas em vigor, alguns aspetos relacionados com a perspetiva social e custos in-diretos, as taxas de atualização, as estimativas dos custos e dos recursos de saúde consumidos e as estimativas do efeito de tratamento no caso de comparações indiretas beneficiariam de uma discussão alargada.
Conclusão: Observou-se uma tendência crescente do número de publicações, refletindo a obrigatoriedade
de apresentar estudos de avaliação económica no momento da submissão de pedidos de comparticipação e avaliação prévia de medicamentos. Parece existir alguma evidência de viés de publicação de resultados positivos. Apesar dos enormes ganhos que as orientações metodológicas vieram proporcionar à realização e padronização de estudos de avaliação económica, e por conseguinte à política do medicamento em Portugal, o passar do tempo revelou que estas incorporam um conjunto de princípios cuja validade se tem mantido inalterada ao longo do tempo, mas também que existem alguns pontos a necessitar de revisão.
Palavras-chave: Avaliação económica, medicamentos, custo-efetividade, custo-utilidade, Portugal.
Abstract
Objectives: The aim of this review is to quantify and analyze, under Portuguese methodological guidelines,
studies of economic evaluation of medicines presented and published in the last fifteen years. Additionally, based on empirical evidence from this revision and the experience of the authors, it is our purpose to launch the discussion for a future review of methodological guidelines.
Mónica Inês
MSc, PFIZER – Health and Value Department. FCTS/ULHT – Faculdade de Ciências e Tecnologias da Saúde/Universidade Lusófona de Humanidades e Tecnologias
Miguel Gouveia
PhD, CEA/UCP – Católica Lisbon School of Business and Economics
Céu Mateus
PhD, ENSP/UNL – Escola Nacional de Saúde Pública, Universidade Nova de Lisboa
Luis Silva Miguel
PhD, CISEP/ISEG – Centro de Investigação Sobre Economia Portuguesa, Instituto Superior de Economia e Gestão
António Pinto
MSc, FCTS/ULHT – Faculdade de Ciências e Tecnologias da Saúde/Universidade Lusófona de Humanidades e Tecnologias
Carlos Gouveia Pinto
PhD, CISEP/ISEG – Centro de Investigação Sobre Economia Portuguesa, Instituto Superior de Economia e Gestão
18
Methods: A comprehensive literature review identified the studies published between January 1999 and
December 2013 was performed for Portugal. The literature search method is based on the iterative technique of growing pearl using capture-recapture methods. The search was supplemented with a request for studies through the list of associated APIFARMA and APES, which enabled the integration of grey literature.
Results: This review identified and analyzed a total of 99 studies presented in the last fifteen years being
the majority of studies presented as a poster/oral communication (64%) and 33 (33%) published as scien-tific articles. There was observed an increasing trend in the number of studies trough the years, reflecting the need and the importance of these studies to support decision-making on public funding of medicines in Portugal. Most studies have focused on cancer or biological medicines (32%). Most studies (36%) reported dominance conclusions and only 14% of studies reported cost effectiveness ratios over 30 000 €, which may indicate a selection presentation bias, towards studies with more positive results. Regarding Portuguese methodological guidelines, some aspects related to social perspective, indirect costs, discount rates, esti-mative of costs, health care resources consumption and estimates of treatment effect in the case of indirect comparisons would benefit from an extended discussion in Portuguese guidelines.
Conclusions: There was an increasing trend in the number of publications trough the years, reflecting the
need to execute studies of economic evaluation for submission of requests for reimbursement of medicines in Portugal. There seems to be some evidence of publication bias towards positive results. Despite the huge gains that methodological guidelines provided to the execution and standardization of economic evalua-tion studies, and therefore to the decision making policy in Portugal, the last fifteen years show that our guidelines did incorporated a set of principles whose validity remained steady over time but there are areas to improve and a thorough revision is necessary.
Keywords: Economic evaluation, medicines, cost-effectiveness, cost-utility, Portugal.
Introdução
Desde 2011 que Portugal tem estado sob interven-ção da «Troika» (Comissão Europeia, Banco Central Europeu e Fundo Monetário Internacional), tendo o Governo português assumido o compromisso de fazer poupanças significativas no setor da saúde. A estratégia para controlar a despesa pública neste se-tor focou-se essencialmente em ajustar orçamentos, aumentando as contribuições dos cidadãos, regular a procura de serviços e controlar o custo dos cuidados prestados. A contenção de custos tem sido feita tanto nos medicamentos como nos cuidados ambulatórios, hospitalares e serviços administrativos.
Assim, também na área dos medicamentos, as deci-sões dos profissionais de saúde e administradores pretendem conduzir a níveis superiores de eficiência, de forma a manter ou aumentar os ganhos em saúde da população portuguesa, num contexto de ajusta-mento dos orçaajusta-mentos. Estudos como o de Barros1 evidenciam que o crescimento dos gastos em saúde se deveu, em parte significativa, à generalização da uti-lização de novas tecnologias de preço elevado, nome-adamente medicamentos. Neste contexto, a avaliação económica de medicamentos assume um papel cada vez mais relevante no apoio à tomada de decisões. Depois da Austrália, em 1992, e do Canadá, em 1994, Portugal foi o primeiro país europeu a desenvolver
e a publicar oficialmente orientações metodológicas para a realização de estudos de avaliação económica de medicamentos. O requisito legal para estes estudos surge no nosso país com a publicação do Decreto-Lei n.º 305/98, de 7 de outubro2, que revê o regime de com-participação do Estado no preço dos medicamentos. Esta regulamentação assentou nos objetivos da afeta-ção eficiente dos recursos da saúde e no uso racional do medicamento em Portugal. Em sequência, as orienta-ções metodológicas para estudos de avaliação económi-ca de medieconómi-camentos3 foram aprovadas há 15 anos, atra-vés do Despacho do ministério da Saúde n.º 19064/99, de 9 de setembro4, nele se prevendo também a sua revi-são futura, o que não aconteceu até ao momento. Em 2006, com a publicação do Decreto-Lei n.º 195/2006, de 3 de outubro5, a necessidade de apre-sentação de estudos de avaliação económica passou a ser aplicável também nos pedidos de avaliação prévia de medicamentos de utilização exclusiva hospitalar e de outros medicamentos sujeitos a receita médica res-trita e comercializados apenas em âmbito hospitalar. Atualmente, em Portugal, todos os medicamentos são avaliados à luz de critérios económicos formal-mente explícitos. Outras tecnologias de saúde, tais como dispositivos médicos ou outros procedimen-tos utilizados na prestação e gestão dos cuidados de saúde, não são sujeitas a avaliação económica, no
tido habitualmente dado à avaliação de tecnologias em saúde. Contudo, o INFARMED anunciou recentemen-te a criação de um Sisrecentemen-tema Nacional de Avaliação de Tecnologias de Saúde (SiNATS)6, com o objetivo principal de garantir um sistema global, estendendo a avaliação económica a outras tecnologias de saúde, nomeadamente aos dispositivos médicos. Pretende-se também que a avaliação de custo-efetividade passe a ser realizada ao longo de todo o ciclo de vida de cada tecnologia de saúde, com consequências sobre o preço e utilização em função da demonstração de efetividade na prática clínica corrente. Implicitamente, a implementa-ção do SiNATS permitiria também, de forma integrada e regular, retirar ou reduzir o financiamento público do Serviço Nacional de Saúde às tecnologias de saúde que, ao longo do tempo, se revelem menos custo-efetivas face às novas alternativas existentes e cujos ganhos em saúde sejam inferiores aos ganhos em saúde que tería-mos de perder para continuar a financiá-las, no contex-to de um orçamencontex-to para a saúde mais rígido.
É sob esta perspetiva de evolução para um cenário abrangente de avaliação de tecnologias de saúde ao longo do seu ciclo de vida que importa rever e analisar os estudos de avaliação económica de medicamentos publicados nos últimos 15 anos, período pós-publica-ção das orientações metodológicas. A janela de opor-tunidade para efetuar esta revisão parece ser também claramente adequada no seguimento da estratégia em desenvolvimento7, por parte do INFARMED, de revi-são das orientações metodológicas.
Assim, o objetivo desta revisão é identificar e analisar os estudos de avaliação económica de medicamentos, quer quantitativamente quer de forma qualitativa, à luz das orientações metodológicas, já com o intuito de discutir a aplicação destas e contribuir para a sua futura revisão com base na evidência recolhida.
Métodos
Foi efetuada uma revisão compreensiva da literatura sobre o tema «estudos de avaliação económica, custo-efetividade ou custo-utilidade de medicamentos» re-alizados para Portugal. A pesquisa foi restrita a ava-liações económicas de medicamentos, em inglês ou português, que incluissem quer o impacto económico das intervenções quer os ganhos em saúde associados. As análises de minimização de custos foram também incluídas, desde que incluíssem outros custos além dos das terapêuticas em comparação.
O processo utilizado para a pesquisa bibliográfica assenta na técnica iterativa de pearl growing8,9, utili-zando métodos de captura-recaptura, com alguns exemplos de aplicação na área da saúde10. Nesta
revisão iniciou-se o trabalho com base no capítulo de Pinto et al «A Avaliação Económica de Medica-mentos» (2010)11, que consiste na pearl desta revisão. A revisão de literatura utilizando a base de pesquisa PubMed/Medline (www.pubmed.gov) efetuada origi-nalmente nesse estudo foi alargada até ao período de dezembro de 2013, através das combinações das pala-vras-chave custo, efetividade, utilidade, minimização, avaliação económica e Portugal.
Adicionalmente foi efetuada pesquisa da literatu-ra cinzenta, que incidiu sobre o progliteratu-rama das con-ferências realizadas pela International Society for Pharmacoeconomics and Outcomes Research (ISPOR) desde 1999 e pela Associação Portuguesa de Economia da Saúde (APES) entre 2007 e 2013, por serem confe-rências privilegiadas pelos autores portugueses para apresentação dos trabalhos que desenvolvem nesta área de investigação. Foi ainda efetuada uma pesquisa manual na Revista Portuguesa de Farmacoterapia, por não estar indexada nos motores de seleção bibliográfica uti-lizados.
Uma vez que a consulta às apresentações das con-ferências permitia, na maioria das situações, aceder apenas ao resumo do estudo, foi também enviado um pedido de partilha de estudos publicados ou apresen-tados publicamente entre 1999 e2013 através das listas de associados da APIFARMA e da APES. A pesquisa bibliográfica foi ainda complementada com outros es-tudos identificados numa análise bibliométrica efetua-da recentemente por Mateus et al12.
Relativamente aos critérios de inclusão dos artigos optou-se por estudos de avaliação económica rea-lizados para o contexto português com resultados apresentados publicamente: 1) sobre medicamentos; 2) do tipo minimização-custo; custo-efetividade, custo-utilidade; 3) com pelo menos um autor portu-guês. Excluíram-se estudos sobre outras tecnologias de saúde, como por exemplo dispositivos médicos, estudos de custo da doença ou meras estimativas de custos de terapêuticas.
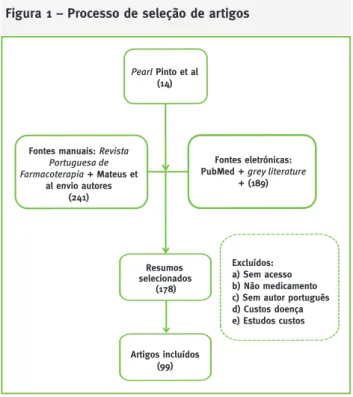
Apesar de não ter sido efetuada uma revisão sistemá-tica, cremos que esta revisão abrangente permite ana-lisar os estudos de avaliação económica realizados para Portugal com validade considerável. O processo de seleção ilustra-se na Figura 1.
O processo permitiu identificar e incluir um total de 99 estudos apresentados publicamente nos últi-mos 15 anos, sendo que 33 (33 por cento) foram pu-blicados sob a forma de artigos científicos. Do total de artigos, 11 foram publicados em revistas interna-cionais. Foram incluídos 63 estudos sob a forma de poster/comunicação oral (64 por cento) e três incluí-dos em teses de mestrado ou doutoramento.
20
Figura 1 – Processo de seleção de artigos
Resultados
A análise dos estudos incluídos por ano de publica-ção permite observar uma tendência crescente do número de publicações, refletindo a necessidade e a importância desta área de conhecimento (Gráfico 1). A partir do Gráfico 1 pode concluir-se que a necessi-dade de apresentar estudos de avaliação económica
0 2 4 6 8 10 12 14 16 18 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013
Gráfico 1 – Número de estudos por ano de apresentação/publicação
Resumos selecionados (178) Excluídos: a) Sem acesso b) Não medicamento c) Sem autor português d) Custos doença e) Estudos custos Artigos incluídos (99) Pearl Pinto et al (14)
Fontes manuais: Revista Portuguesa de Farmacoterapia + Mateus et
al envio autores (241)
Fontes eletrónicas: PubMed + grey literature
+ (189)
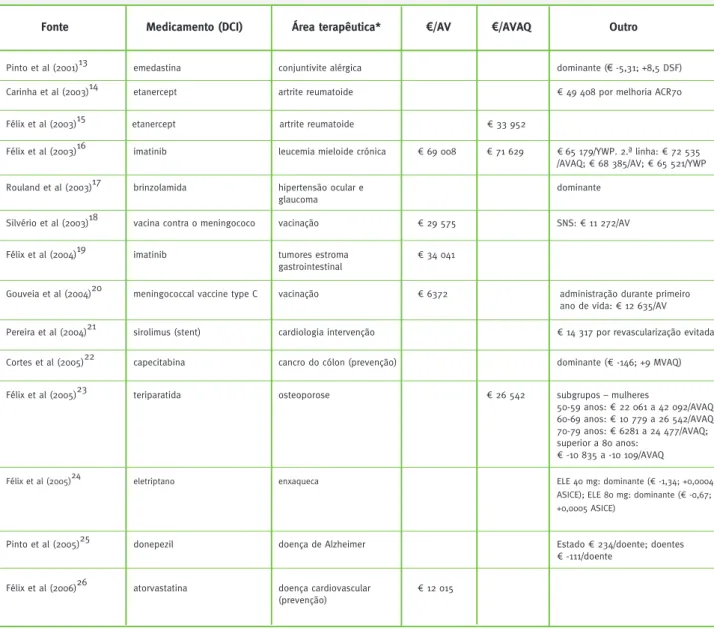
A análise por classificação farmacoterapêutica do me-dicamento em avaliação económica permite concluir que a maioria dos estudos incidiu sobre medicamentos antineoplásicos e imunomoduladores (31 por cento), an-ti-infeciosos (18 por cento), sistema nervoso central (11 por cento) e cardiovasculares (11 por cento) (Gráfico 2). Na Tabela 1 descrevem-se os estudos incluídos, por or-dem cronológica de publicação e primeiro autor. Apre-sentam-se dados sumários relativos ao medicamento estudado, à área terapêutica e resultados de efe-tividade reportados para caso base, por rácio de custo--efetividade incremental medido por anos de vida (AV) e por anos de vida ajustados pela qualidade (AVAQ). Na coluna «Outro» apresentam-se resultados de outras comparações além do caso base, com outros indicado-res de efetividade ou de dominância. Em estudos com múltiplas comparações (por exemplo, comparadores, subgrupos populacionais, etc.) nem sempre está claro qual é o caso base e, portanto, sempre que apropriado, optou-se por incluir um deles nas colunas «€/AV» ou «€/AVAQ» e a restante informação na coluna «Outro». Os resultados económicos não foram atualizados para valores de 2013; optou-se por reportar os resultados como divulgados originalmente pelos seus autores.
no momento da submissão de pedidos de comparti-cipação e avaliação prévia contribuiu para um grande incremento da produção científica e divulgação, ten-do-se atingido um pico em 2011, ano de conferência da APES em Lisboa.
Grande parte dos estudos (36 por cento) reportou resultados de dominância: medicamentos novos cuja adoção induz poupanças e benefícios superiores versus a comparação. No Gráfico 3 detalham-se os resultados de acordo com o valor do rácio de custo-efetividade incremental. Para os estudos que re-portam rácios por AVAQ e AV inclui-se, no Gráfico 3, o rácio por AVAQ, por ser mais informativo. Um total de cinco estudos em que o medicamento avaliado não induz poupanças e cujos benefícios não foram estimados em AV ou AVAQ foi excluído do Gráfico 3 (por exemplo, € 49 408 por melho-ria ACR70, € 35 374 por surto evitado, etc.), pela falta de comparabilidade dessa opção metodológica.
A partir do Gráfico 3 constata-se que apenas 14 por cento dos estudos publi-cados apresentam rácios superiores a 30 mil euros, o que pode indiciar algum viés, por parte dos autores, na seleção de estudos com resultados mais positivos para serem divulgados. Em Portugal não é obrigatório a divulgação pública dos resultados dos estudos eco-nómicos realizados e as avaliações publicadas no site do INFARMED também não apresentam os rácios de cus-to-efetividade incremental subjacentes à decisão.
Gráfico 2 – Número de estudos por classificação farmacoterapêutica
17; 17% 11; 11% 10; 10% 11; 11% 9; 9% 31; 32% 5; 5% 5; 5%
Sistema nervoso central Aparelho cardiovascular
Hormonas e medicamentos usados no tratamento das doenças endócrinas Aparelho locomotor
Medicamentos antineoplásicos e imunomoduladores Vacinas e imunoglobulinas
Outros
Medicamentos anti-infecciosos
Tabela 1 – Estudos de avaliação económica sobre medicamentos em Portugal: 1999-2013
Fonte Medicamento (DCI)
Pinto et al (2001)13 emedastina
Área terapêutica* €/AV €/AVAQ Outro
dominante (€ -5,31; +8,5 DSF) conjuntivite alérgica
Carinha et al (2003)14 etanercept artrite reumatoide € 49 408 por melhoria ACR70
Félix et al (2003)15 etanercept artrite reumatoide € 33 952
Félix et al (2003)16 imatinib € 65 179/YWP. 2.ª linha: € 72 535
/AVAQ; € 68 385/AV; € 65 521/YWP
leucemia mieloide crónica € 69 008 € 71 629
Rouland et al (2003)17 brinzolamida hipertensão ocular e dominante
glaucoma
Silvério et al (2003)18 vacina contra o meningococo vacinação € 29 575 SNS: € 11 272/AV
Félix et al (2004)19 imatinib tumores estroma
gastrointestinal
€ 34 041
Gouveia et al (2004)20 meningococcal vaccine type C vacinação € 6372 administração durante primeiro
ano de vida: € 12 635/AV
Pereira et al (2004)21 sirolimus (stent) cardiologia intervenção € 14 317 por revascularização evitada
Cortes et al (2005)22 capecitabina cancro do cólon (prevenção) dominante (€ -146; +9 MVAQ)
Félix et al (2005)23 teriparatida osteoporose subgrupos – mulheres
50-59 anos: € 22 061 a 42 092/AVAQ; 60-69 anos: € 10 779 a 26 542/AVAQ; 70-79 anos: € 6281 a 24 477/AVAQ; superior a 80 anos: € -10 835 a -10 109/AVAQ € 26 542
Félix et al (2005)24 eletriptano enxaqueca ELE 40 mg: dominante (€ -1,34; +0,0004
ASICE); ELE 80 mg: dominante (€ -0,67; +0,0005 ASICE)
Pinto et al (2005)25 donepezil doença de Alzheimer Estado € 234/doente; doentes
€ -111/doente
Félix et al (2006)26 atorvastatina doença cardiovascular
(prevenção)
€ 12 015
22
Fonte Medicamento (DCI) Área terapêutica* €/AV €/AVAQ Outro
Inês et al (2006)27 cabergolina hiperprolactinemia € 6650 € 2581/YWHA
Macedo et al (2006)28 samário (153Sm) dor oncológica (próstata) dominante (€ -138,83 por doente)
Pimentel et al (2006)29 gemcitabina-cisplatina cancro do pulmão € -326 vs.
Doc/Cis; € -1201 vs. Vin /Cis; € -1717 vs. Pac/Cis; € -2925 vs. Pac/Carb
Macedo et al (2007)30 sunitinib cancro do rim dominante (€ -833; +0,112AV
e +0,145AVAQ)
Pereira et al (2007)31 TSH humana recombinante cancro da tiroide custo-efetivo
Pinto et al (2007)32 exemestano cancro da mama € 13 537 € 16 889 € 700 por mês sem recorrência
Pinto et al (2007)33 linezolida pneumonia nosocomial € 1816,22/cura e € 1603,77/morte
evitada € 116
Santos et al (2007)34 anfotericina B lipossómica infeções fúngicas dominante
Alves et al (2008)35 insulina detemir diabetes tipo 1 € 72 617 € 23 691
Araújo et al (2008)36 erlotinib cancro do pulmão € 70 424 € 161 742 vs. docetaxel ou pemetrexedo
– dominante ou reduz custos
Heeg et al (2008)37 risperidona esquizofrenia dominante vs. convencional depot
€ -3603/-0,44 relapses; vs. atípico oral: € -4682/0,59 relapses
Miguel et al (2008)38 rosuvastatina* doença cardiovascular
(prevenção)
pravastatina 10 mg, 20 mg e atorvastatina 10 mg dominadas € 61 670
Conde et al (2009)45 vareniclina cessação tabágica € 8746
Félix et al (2009)46 agomelatina depressão major € 3460
Gouveia et al (2009)47 natalizumab esclerose múltipla € 28 907 a 35 374 por surto
evitado; € 75 682 a € 450 817 por PPEDSS
Inês et al (2009)48 maraviroc VIH dominante (€ -1123; +0,177AV
e +0,237AVAQ)
Pereira et al (2008)39 vacina HPV vacinação € 13 810
Pinto et al (2008)40 duloxetina depressão major dominante (€ -106; +0,01AVAQ)
Pinto et al (2008)41 rosuvastatina doença cardiovascular
(prevenção)
dominante vs. atorvastatina; € 39 340/AV vs. sinvastatina € 30 350
Schwarz et al (2008)42 sitagliptina diabetes tipo 2 dominante vs. rosiglitazona
(€ -687; +0,063AVAQ) € 5949
Alves et al (2009)43 voriconazol aspergilose invasiva dominante (€ -2174/doente)
André et al (2009)44 lapatinib cancro da mama dominante (€ -4536; +0,026AVAQ)
Macedo et al (2009)49 peginterferão alfa-2a hepatite C crónica/VIH dominante (€ -4378; +1,61AV
e +1,17AVAQ)
Macedo et al (2009)50 capecitabina cancro gástrico dominante (€ -5868,6/doente)
Maia et al (2009)51 octreótido LAR acromegália dominante (€ -7034 por doente
livre de doença ativa)
Pereira et al (2009)52 aprepitant náusea e vómito
(prevenção)
vs. regime 2: € 20 910,87/AVAQ
€ 22 671
Pinto et al (2009)53 cinacalcet hiperparatireoidismo € 78 698
Pinto et al (2009)54 pemetrexedo cancro pulmão € 31 154 € 63 859 SNS: € 30 950/AV e € 63 441/QALY
Pinto et al (2009)55 docetaxel cancro da mama € 21 905
Silvério et al (2009)56 temsirolimus cancro do rim dominante
(€ -2999; +0,11AV e +0,08AVAQ)
Braga et al (2010)57 rituximab linfoma folicular € 2407 € 2661
Chaudhary et al (2010)58 raltegravir VIH dominante (€ -5189; +0,18AVAQ)
Gouveia et al (2010)59 ranibizumab degenerescência macular
relacionada com a idade
lesões PC MC O: € 12 322, € 17 603 e € 30 045/AVAQ e € 64, € 82 e € 138/GL-AETDRS € 30 045
Gouveia et al (2010)60 aliscireno hipertensão
€ 12 040
Macedo et al (2010)62 anidulafungina candidémia e candidíase
invasiva
vs. FLU € 21 682/SC; vs. CAS
dominante (€ -625,25); vs. VOR € 3193/SC; vs. ABL dominante (€ -4104,98)
Macedo et al (2010)63 trastuzumab cancro da mama € 7400 € 7790 SNS: € 10 067/AV e € 10 595/QALY
Fonte Medicamento (DCI) Área terapêutica* €/AV €/AVAQ Outro
Mateus (2010)64 dabigatrano tromboembolismo venoso
(prevenção) dominante: anca 220 mg (€ -255 +0,013AVAQ) 250 mg (€ -306 +0,005AVAQ); joelho 220 mg 821/AVAQ € 7914 € 18 889
Nuijten et al (2010)65 lidocaína neuralgia pós-herpética € 49 (MASS); lidocaína
(1,1/dia) dominante (AVAQ e MASS) € 1112
Palmer et al (2010)66 exenatido diabetes tipo 2 vs. insulina glargine: € 53 275/AV
e € 14 699/AVAQ
€ 61 637 € 17 222
Areias et al (2011)67 peginterferão alfa-2a hepatite C crónica dominante; todos genótipos
(€ -44 + 0,432AV +0,165AVAQ); genótipos 1/4: (€ -259 + 0.552AV + 0,211AVAQ); genótipos 2/3: 0 (€ -1647 0,631AV + 0,241AVAQ)
Carvalho et al (2011)68 detemir diabetes tipo 2 € 3239 € 393
Cristino et al (2011)69 denosumab osteoporose € 14 487
Darbà et al (2011)70 dasatinib leucemia mieloide crónica € 39 941 vs. imatinib 800 mg/dia: € 14 470
/AVAQ; vs. nilotinib € 29 422/AVAQ Diamantopoulos et al
(2011)71
tocilizumab artrite reumatoide dominante (+0,15 AV 0,22 AVAQ)
vs. sequência 1 (€ -1908); vs.
sequência 2 (€ -4499); vs. sequência (€ -1885)
Félix et al (2011)72 abraxane cancro da mama € 29 535
Gouveia et al (2011)73 Vacina adsorvida pneumocócica poliosídica conjugada
vacinação € 3738 € 606/infeção evitada,
€ 24 880/morte evitada
Inês et al (2011)74 collagenase clostridium histolyticum
contractura Dupuytren dominante (€ -1300/doente)
Inês et al (2011)75 linezolida pneumonia nosocomial dominante
Macedo et al (2011)76 atorvastatina doença cardiovascular
(prevenção)
€ 4016
Inês et al (2010)61 eplerenona doença cardiovascular
(prevenção) € 11 309 dominante (€ -552,32 +0,093AVAQ +0,142AV) € 14 431 24 € 13 706
Fonte Medicamento (DCI) Área terapêutica* €/AV €/AVAQ Outro
Macedo et al (2011)77 paricalcitol hiperparatiroidismo
secundário associado a insuficiência renal crónica
€ 10 381 vs. não tratamento nos estádios IRC
3-4 e alfacalcidol no estádio IRC 5: € 10 352/AVAQ e € 9827/AV € 9 854
Mota (2011)78 trastuzumab cancro da mama € 38 591
Obradovic et al (2011)79 tapentadol dor crónica € 7995 € 7995/AVAQ vs. oxicodona,
€ 8685/AVAQ vs. TDB, € 13 943 /AVAQ vs. TDF e € 17 547/AVAQ
vs. morfina
Paquete et al (2011)80 pegfilgrastim neutropenia febril € 9354 € 10 638
Pinto et al (2011)81 imunoglobulina antilinfócitos (coelho)
doença do enxerto contra hospedeiro
dominante (€ -1840/doente)
Saramago et al (2011)82 celecoxib osteoartrose dominante
(€ -0,41/0,0005AVAQ)
Soares et al (2011)83 sunitinib tumores pancreáticos
neuroendócrinos
€ 24 035
Aragão et al (2012)84 2NRTI+NNRTI VIH dominante (€ -19 573 +0,12AV
+0,14 AVAQ)
Café et al (2012)85 tocilizumab artrite reumatoide mais elevada taxa de resposta
ACR70 ajustada (28,5%); menor custo por resposta ACR70 (€ 18 827)
Calado et al (2012)86 vildagliptina diabetes tipo 2 € 12 794
Cristino et al (2012)87 denosumab osteoporose dominante (€ -1170; +0,044AVAQ
+ 0,521 SRE evitados)
Duran et al (2012)88 darbepoetina alfa anemia induzida
quimioterapia
vs. EPO-A: € -1995/doente; vs.
EPO-B € -1782/doente
Garrison et al (2012)89 trastuzumab cancro da mama € 12 696 SNS: € 15 112/AVAQ
Inês et al (2012)90 somatropina deficiência de hormona do
crescimento
€ 18 923 sexo feminino: € 25 198/AV e € 22 943/AVAQ
€ 17 727
Lothgren et al (2012)91 denosumab osteoporose dominante (€ -1101; +0,004AVAQ
+ 0,37 SRE evitados)
Lourenço et al (2012)92 apixabano tromboembolismo venoso
(prevenção)
dominante: anca (€ -44,70 +0,0085 AV +0,0003AVAQ); joelho (€ -56,65 +0,025AV +0,0008AVAQ)
Monteiro et al (2012)93 tocilizumab artrite reumatoide € 21 145
Pereira et al (2012)94 sitagliptina diabetes tipo 2 € 11 198
Vanness et al (2012)95 tenofovir hepatite B crónica dominante (€ -11 894 +0,03AV
+0,04AVAQ)
Verheggen et al (2011)96 atazanavir VIH dominante (€ -14 578 +1,69AV
+1,77AVAQ)
Wilson et al (2012)97 vareniclina cessação tabágica € 4178 € 5357 sociedade: dominante
Elbasha et al (2013)98 boceprevir hepatite B crónica € 11 600 tratados previamente € 8700/AVAQ
Gouveia et al (2013)100 fidaxomicina infeção por claustridium
difficile
€ 13 245 € 321/RE; ICD recorrente: dominante: € -33,701/AVAQ e € -828/RE
Gouveia et al (2013)99 belimumab lúpus eritematoso sistémico € 20 649 € 25 917
Fonte Medicamento (DCI) Área terapêutica* €/AV €/AVAQ Outro
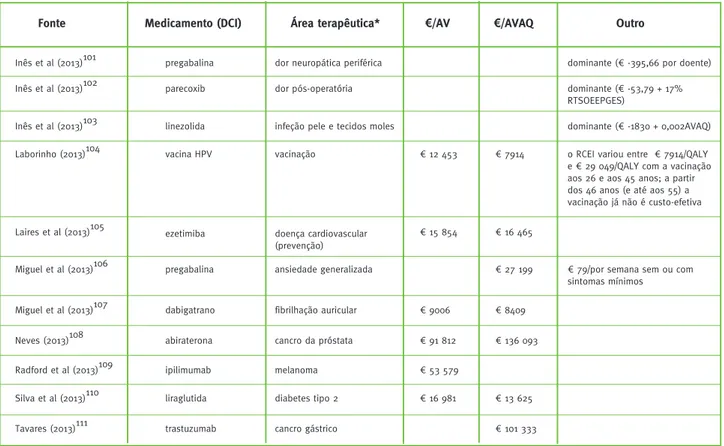
Inês et al (2013)101 pregabalina dor neuropática periférica dominante (€ -395,66 por doente)
Inês et al (2013)102 parecoxib dor pós-operatória dominante (€ -53,79 + 17%
RTSOEEPGES)
Inês et al (2013)103 linezolida infeção pele e tecidos moles dominante (€ -1830 + 0,002AVAQ)
Laborinho (2013)104 vacina HPV vacinação € 7914 o RCEI variou entre € 7914/QALY
e € 29 049/QALY com a vacinação aos 26 e aos 45 anos; a partir dos 46 anos (e até aos 55) a vacinação já não é custo-efetiva € 12 453
Laires et al (2013)105 ezetimiba doença cardiovascular
(prevenção)
€ 16 465 € 15 854
Miguel et al (2013)106 pregabalina ansiedade generalizada € 27 199 € 79/por semana sem ou com
sintomas mínimos
Miguel et al (2013)107 dabigatrano fibrilhação auricular € 9006 € 8409
Neves (2013)108 abiraterona cancro da próstata € 91 812 € 136 093
Radford et al (2013)109 ipilimumab melanoma € 53 579
Silva et al (2013)110 liraglutida diabetes tipo 2 € 16 981 € 13 625
Tavares (2013)111 trastuzumab cancro gástrico € 101 333
SC – sucesso clínico; LYR – life years in remission; MVAQ – meses de vida ajustados pela qualidade; ASICE – anos sem incapacidade motivada pelas crises de enxaqueca; DSF – days
free of symptoms; RTSOEEPGES – resposta ao tratamento sem ocorrência de efeitos adversos e com excelente na resposta ao patient’s global evaluation survey; PC MC O –
predomi-nantemente clássicas, minimamente clássicas e ocultas; GL-AETDRS – ganho de letras/ano na escala ETDRS; PPEDSS – ponto de progressão na escala EDSS evitada; RE – recorrência evitada; SRE – Skeletal-related events; YWHA – years without hyperprolactinaemia and amenorrhea.
* Forma simplificada. Deve ser consultada a referência bibliográfica para exatidão quanto à indicação terapêutica.
** Estudo com múltiplas comparações. Reporta-se por questão de simplificação RCEI para a comparação rosuvastatina versus sinvastatina 20 mg.
Gráfico 3 – Número de estudos por tipo de resultado
36 34 10 14 0 5 10 15 20 25 30 35 40
Dominante RCEI inferior 20 000€ RCEI entre 20 000
e 30 000€ € RCEI superior 30 000€ Na Tabela 2 descrevem-se os estudos, à luz das
orienta-ções metodológicas para estudos de avaliação económi-ca de medieconómi-camentos em Portugal.
A maioria dos estudos analisou a adoção de um novo medicamento sob a perspetiva da sociedade (49 por cento). Contudo, dos 49 estudos que declaram a pers-petiva da sociedade (ou sociedade e Serviço Nacional de Saúde), apenas 15 (31 por cento) incluíram estimativas da produtividade perdida na análise. Apenas custos di-retos são incluídos na análise numa elevada proporção (85 por cento). Nesta análise, não se diferenciaram os estudos que incluíam apenas custos diretos médicos, ou seja, excluindo custos diretos não médicos, como por exemplo o custo de transporte dos doentes. Contudo, a perceção desta revisão é de que os custos diretos não médicos são excluídos na grande maioria dos estudos. A medição dos recursos da saúde consumidos com as alternativas em comparação tem sido frequentemente estimada através de painéis de peritos (78 por cento), sendo residual a utilização de estudos observacionais (5 por cento). Detetou-se uma proporção não negligenciá-vel (14 por cento) de estudos que utiliza pressupostos ou refere protocolos ou orientações clínicas para
quan-tificar a utilização de recursos, opção não contemplada nas orientações e para a qual não existe evidência sobre a incerteza que pode gerar nos resultados.
Como fonte de dados primária, a maior parte dos estu-dos (65 por cento) utilizou ensaios clínicos aleatoriza-dos. Contudo, alguns dos estudos económicos, por falta de ensaios clínicos de comparação direta, utilizam mais
26
do que um ensaio clínico mas na forma naïve (17 por cento), ou seja, sem utilização de métodos de síntese de evidência como meta-análises, meta-análises em rede ou meta-regressão.
No seguimento do preconizado nas orientações, a maio-ria dos autores optou pela utilização de modelos, nome-adamente processos estocásticos de tipo Markov (65 por cento), para estimar custos e consequências das al-ternativas em comparação para o horizonte temporal do estudo. Apenas um estudo estimou custos e consequên-cias ao longo do ensaio clínico. A opção por horizontes temporais longos (até ao final da vida) foi a mais esco-lhida (44 por cento), seguida de horizontes até cinco anos (40 por cento). Nem sempre os autores deixaram claro que horizontes são sobreponíveis à opção «até ao final da vida», quando as consequências de um ou outro medicamento se refletem nos indicadores de custos ou efetividade ao longo da sobrevida do doente.
A maior parte dos estudos optou pelo recurso à técnica de custo-utilidade e custo-efetividade em simultâneo (43 por cento), mas nem sempre a efetividade foi men-surada em AV, uma vez que outras medidas de resulta-dos mais específicas da patologia foram também repor-tadas. Apenas um estudo de custo-eficácia foi incluído e oito estudos de minimização de custos (8 por cento). Relativamente à atualização de resultados para hori-zontes temporais superiores a um ano, as orientações definem claramente a taxa de 5 por cento, mas nem sempre os autores seguiram essa orientação. Alguns es-tudos utilizaram taxas inferiores, nomeadamente de 3 por cento. Neste ponto, algumas vezes existe também omissão sobre o valor da taxa utilizada (9 por cento dos estudos).
Na avaliação do impacto da incerteza dos parâmetros nos resultados obtidos, cerca de 41 por cento dos estu-dos executam uma análise multivariada probabilística e apenas 8 por cento não reportaram a realização de lise de sensibilidade. Apresentar resultados para aná-lise de sensibilidade probabilística não é obrigatório à luz das orientações em vigor e, portanto, esta eleva-da proporção reflete, de alguma forma, a preocupação dos autores portugueses em validarem a robustez das conclusões retiradas sob condições de incerteza. Finalmente, como esperado, a esmagadora maioria dos estudos (94 por cento) teve como fonte de fi-nanciamento o titular de AIM do medicamento em estudo. Tal decorre naturalmente da obrigatoriedade da submissão deste tipo de estudos para obtenção de comparticipação desde 1999, para os medicamentos de ambulatório, e para obtenção de avaliação prévia positiva desde 2007, para os medicamentos hospita-lares.
Conclusão
Quinze Anos de Estudos de Avaliação Económica de Medicamentos em Portugal
Esta revisão identificou e analisou um total de 99 estu-dos divulgaestu-dos publicamente nos últimos 15 anos, ob-servando-se uma tendência crescente de divulgação ao longo dos anos. Ao longo do tempo observou-se também uma melhoria na qualidade dos estudos, principalmente na inclusão de análise de sensibilidade probabilística. Grande parte dos estudos (36 por cento) reportou resul-tados de dominância versus comparador e apenas 14 por cento dos estudos reporta rácios de custo-efetividade in-cremental superiores a 30 mil euros, o que pode indiciar algum viés de seleção de divulgação dos resultados dos estudos. A área farmacoterapêutica mais relevante foi a dos medicamentos oncológicos ou biológicos (31 por cento). As principais características dos estudos são: a) medição dos recursos obtida frequentemente através de painel de peritos (78 por cento); b) fonte de dados pri-mária – ensaios clínicos aleatorizados (65 por cento); c) utilização de modelos, nomeadamente processos esto-cásticos de tipo Markov (65 por cento); d) estudos de custo-utilidade reportando em simultâneo também re-sultados de custo-efetividade (43 por cento); e) alguns estudos (9 por cento) utilizaram taxas de atualização inferiores a 5 por cento, nomeadamente 3 por cento; f) cerca de 41 por cento dos estudos executam análise mul-tivariada probabilística e apenas 8 por cento não repor-taram análise de sensibilidade; g) a esmagadora maioria dos estudos (94 por cento) teve como fonte de finan-ciamento o titular de AIM do medicamento em estudo.
Orientações Metodológicas: um Contributo para a sua Revisão
As orientações metodológicas ajudaram a definir o que a avaliação económica de tecnologias deveria ser na práti-ca, fornecendo um modelo e uma estrutura de análise e, com isso, produzindo um importante efeito pedagógico, sobretudo num país com escassez de especialistas. Os ganhos pela introdução de uma metodologia mais ob-jetiva são enormes, dado que a alternativa seria a apre-ciação de pedidos de financiamento público de medica-mentos com base em critérios ad hoc e com um espaço muito maior para decisões discricionárias.
Apesar de as orientações serem um pouco vagas em al-gumas áreas, a sua flexibilidade também deixou espaço para se lidar com circunstâncias que poderiam requerer abordagens com especificidades no que diz respeito aos medicamentos, às populações em causa ou às doenças. As linhas de orientação incorporam um conjunto de princípios cuja validade se tem mantido com robustez
ao longo do tempo. Entre estes destacam-se a adoção de uma perspetiva social, a flexibilidade na definição do comparador tendo como base principal a prática clínica corrente, a admissão de várias alternativas no que às téc-nicas de análise diz respeito, a distinção clara entre efi-cácia e efetividade, os princípios definindo o horizonte temporal da análise apropriado como aquele coinciden-te com os efeitos da coinciden-terapêutica e com as alcoinciden-terações nos consumos de recursos. Estes princípios formam parte de uma estrutura orientada para a realização de uma análi-se incremental, em que os indicadores fundamentais de valor económico são dados pela comparação dos ganhos de saúde e das diferenças de custos de duas ou mais al-ternativas terapêuticas.
No entanto, apesar dos enormes ganhos que as orienta-ções vieram proporcionar à realização e padronização de estudos de avaliação económica, e por conseguinte à política do medicamento em Portugal, o passar do tem-po revelou áreas a necessitar de alterações.
A primeira área de reforma desejável prende-se com o tipo de tecnologias de saúde em avaliação, sendo que as orientações foram concebidas para serem aplicadas em medicamentos. É necessário ter orientações que con-templem outras tecnologias de saúde, como por exem-plo o caso dos dispositivos e procedimentos médicos. Uma segunda limitação é que, apesar de se ter adotado uma perspetiva social, esta foi definida de uma forma um pouco estreita. Em particular, será de discutir a forma de inclusão e valorização dos custos de produtividade, in-cluindo o caso de cuidadores em geral e de pessoas fora dos mercados de trabalho formais (domésticas). A ex-clusão dos custos de produtividade associados à morte prematura será também uma área a repensar. Os dados empíricos revelam que a maioria dos estudos analisou a adoção do novo medicamento com a perspetiva social (48 por cento), mas apenas 31 por cento desses estudos incluíram na análise custos decorrentes das perdas de produtividade.
Uma terceira área onde as orientações têm conduzido a situações eventualmente menos desejáveis está relacio-nada com as taxas de atualização. Com efeito, a taxa de atualização de 5 por cento tem-se revelado muito pena-lizadora de intervenções com benefícios a longo prazo (por exemplo, as vacinas). Este ponto também não é consensual entre peritos e entre países com diferentes realidades e, nessa medida, o valor da taxa de base pode-ria ser revisto. Os dados empíricos desta revisão revelam que em 12 por cento dos estudos (em que seria aplicável taxa de atualização) foi selecionada uma taxa inferior de 3 por cento.
A quarta limitação, e talvez a área onde haja mais pro-blemas com o seguimento das orientações na prática,
é a das estimativas dos custos. Nas orientações é feita referência a futuras tabelas oficiais de custos unitários que nunca se chegaram a realizar, pelo que esta área acabou por se tornar, na prática, muito dependente da legislação, mais especificamente das portarias definindo os preços dos grupos de diagnósticos homogéneos. Na medida em que estes preços são definidos também com base em critérios administrativos e políticos, podem ocasionalmente afastar-se muito do verdadeiro custo de oportunidade para a sociedade decorrente da prestação dos cuidados em causa, e que deveria ser o verdadeiro input dos estudos de avaliação económica. Também a forma como se estima a utilização de recursos da saúde pode ser uma questão a melhorar. A maioria dos autores elicita a utilização de recursos através de painéis de peri-tos, metodologia aceitável de acordo com as orientações. Contudo, alguns autores (14 por cento) socorreram-se simplesmente de pressupostos ou de informação disper-sa em protocolos clínicos para identificar e quantificar a utilização de recursos, o que pode fragilizar a robustez dos resultados e, por consequência, a validade das con-clusões apresentadas.
Uma quinta limitação está associada à consistência das estimativas do efeito de tratamento de cada um dos me-dicamentos em comparação, parâmetro fulcral na esti-mativa dos resultados de custo-efetividade. Assim, es-tudos com comparações indiretas poderão beneficiar de mais rigor do que o possibilitado por comparações naïve. Isso justifica que, no futuro, se faça a inclusão de uma discussão explícita desta questão nas orientações. Uma área que poderá precisar de melhorias é a definição do âmbito de aplicação das orientações metodológicas. Por exemplo, estas não preveem casos com uma avalia-ção diferenciada no caso de medicamentos órfãos, para os quais em geral é estatisticamente complexo estimar com precisão os parâmetros específicos para Portugal necessários para realizar uma avaliação económica ro-busta. Assim, esta questão pode dificultar o acesso a no-vos medicamentos por populações já muito prejudicadas pela raridade dos problemas de saúde de que padecem. Uma questão em aberto, e que deverá ser resolvida rapidamente, prende-se com a omissão de orienta-ções para as avaliaorienta-ções de impacto orçamental. Dada a cada vez maior relevância destas avaliações no pro-cesso de tomada de decisão, a disparidade de critérios e a falta de padronização de metodologias só podem ser vistas com muita preocupação.
Finalmente, existem algumas questões decorrentes da interpretação na prática de alguns pontos das orientações em vigor. A escolha do comparador ou a definição do horizonte temporal de análise são áreas onde ocorrem discordâncias entre autores e regula-28
Tabela 2 – Características dos estudos divulgados ou publicados entre 1999-2013
Perspetiva
Sociedade 43 43%
Serviço Nacional Saúde 44 44%
Sociedade + Serviço Nacional Saúde 6 6%
Hospitalar 5 5% Não reportado 1 1% n % Identificação de custos Diretos 84 85% Diretos e produtividade 15 15% Painel de peritos 77 78% Dados observacionais 5 5%
Referências protocolos, orientações 14 14%
Não reportado 3 3%
Medição de utilização recursos em saúde Ensaio clínico randomizado 64 65%
Comparação indireta naïve 17 17%
Meta-análises 8 8%
Meta-análises em rede 1 1%
Meta-regressão 2 2%
Estudo observacional 6 6%
Não reportado 1 1%
Fonte de dados primária efeito tratamento Modelo – árvore decisão 20 20%
Modelo – Markov 64 65%
Modelo – Simulação discreta eventos 11 11%
Ao longo de ensaio clínico 1 1%
Não reportado 3 3%
Avaliação do efeito terapêutico Até à morte 44 44% Inferior/igual a 1 ano 23 23% Entre 2-5 anos 17 17% Entre 5-20 anos 8 8% Superior a 20 anos 5 5% Não reportado 2 2% Horizonte temporal Custo-efetividade 25 25% Custo-utilidade 22 22% Minimização custos 8 8% Custo-efetividade e custo-utilidade 43 43% Custo-eficácia 1 1% Técnicas de análise 5% 57 58% 3% 9 9% 0% 1 1% Não aplicável 23 23% Não reportado 9 9% Taxa de atualização Univariada 50 51% Multivariada probabilística 41 41% Não reportado 8 8%
Avaliação do impacto da incerteza sobre os resultados
dor, dificultando o cumprimento do que está estabele-cido nas orientações metodológicas, pelo que a defini-ção de um mecanismo de apelo ou de arbitragem poderá vir a revelar-se apropriada. Importa ainda referir que haveria muito a ganhar com mais transparência no pro-cesso e divulgação dos resultados de custo-efetividade subjacentes à decisão, assim como com a divulgação de mais informação sobre os processos, entidades e peritos envolvidos, sendo esta uma forma de aumentar a trans-parência e idoneidade do processo de decisão de finan-ciamento público de medicamentos em Portugal.
Agradecimentos
Agradece-se aos autores e financiadores (titulares de AIM) pela resposta e envio dos estudos publica- dos/apresentados, assim como ao diretor da Revista Portuguesa de Farmacoterapia, Dr. José Aranda da Silva, pela partilha de artigos publicados na revista. Agradece-se à APIFARMA e à APES pelo envio inicial do pedido de partilha de estudos através das suas listas de associados.
Declaração
Todos os autores, à exceção de António Pinto, fazem parte da direção do capítulo ISPOR Portugal. Alguns resultados e conclusões desta revisão foram divulga-dos no ISPOR 16th Annual European Congress Forum (Dublin, novembro de 2013), «Economic evaluation of pharmaceuticals in Portugal: from pioneers to the limi-tations imposed by the economic crisis».
Referências Bibliográficas
1. Barros PP. The Black Box of Health Care Expenditure Growth Determi-nants. Health Economics. 1998;7:533-544.
2. www.dre.pt. Decreto-Lei n.º 305/98, de 7 de outubro.
3. Silva EA, Pinto CG, Sampaio C, Pereira J, Drummond M, Trindade R. Orientações Metodológicas para Estudos de Avaliação Económica de Medicamentos. INFARMED; 1998 Nov.
4. www.dre.pt. Despacho do ministério da Saúde n.º 19064/99, de 9 de setembro.
5. www.dre.pt. Decreto-Lei n.º 195/2006, de 3 de outubro. 6. INGARMED Notícias. N.º 50; 2014 Mai.
7. INFARMED, I.P. Balanço de gestão. Atividades estratégicas implementadas e em desenvolvimento. 2012 – setembro – 2013. Disponível em www.infarmed.pt/portal/page/portal/INFARMED/ MAIS_NOVIDADES/Balanco_gestao_2012-2013.pdf.
8. Markey K, Cochrane P. ONTAP: Online Training and Practice Manual for ERIC Database Searchers, 2nd edn, Syracuse University, N.Y. October 1981. ERIC Clearinghouse on Information Resources; 1981.
9. Ramer S. Site-ation pearl growing: Methods and librarianship history and theory. Journal of the Medical Library Association. 2005;93(3):399-400.
10. Claxton K, Palmer S, Longworth L, Bojke L, Griffin S, McKenna C, et al. Informing a decisión framework for when NICE should
recommend the use of health technologies only in the context of an appropriately designed programme of evidence development. Health Technology Assessment, 2012;16(46).
11. Pinto CG, Miguel LS, Paquete AT. A Avaliação Económica de Medicamentos. In: Simões J, coord. 30 Anos do Serviço Nacional de Saúde – Um Percurso Comentado. Coimbra: Edições Almedina; 2010. 12. Mateus C, Moura A. A Investigação em Economia da Saúde. In: Campos AC, Simões J, coord. 40 Anos de Abril na Saúde. Coimbra: Edições Almedina; 2014.
13. Pinto CG, Lafuma A, Fagnani F, Nuijten MJ, Berdeaux G. Cost effectiveness of emedastine versus levocabastine in the treatment of allergic conjunctivitis in 7 European countries. Pharmacoeconomics. 2001;19(3):255-65.
14. Carinha P, Silvério N, Chinopa P, Ganguly R, Singh A. Custo-efectividade em Portugal de duas alternativas biológicas, etanercept e infliximab, no tratamento da artrite reumatoide após falha de medicamentos anti-reumatismais modificadores da doença (DMARDs) convencionais. APFH – Porto; 2003.
15. Félix J, Inês M, Acosta C. The cost effectiveness of etanercept in the treatment of active rheumatoid arthritis in adults with inadequate response to DMARD’s, including methotrexate. 8th National Conference on Health Economics. Lisbon, Portugal; 2003 Out. 16. Félix J, Inês M, Acosta C, Santos R. The cost-effectiveness of Glivec(imatinib) for Chronic Myeloid Leukaemia in Portugal. APFH – Porto; 2003.
17. Rouland JF, Le Pen C, Pinto CC, Berto P, Berdeaux G. Cost-minimisation study of dorzolamide versus brinzolamide in the treatment of ocular hypertension and primary open-angle glaucoma: in four European countries. Pharmacoeconomics. 2003;21(3):201-13. 18. Silvério NM, Chinopa PF, Brandão JT. Cost-Effectiveness of two different vaccination strategies for the prevention of meningococcal C disease in Portugal. ISPOR Sixth Annual European Congress. Barcelona, Spain. 2003 Nov.
19. Félix J, Soares M, Acosta C. Custo-Efectividade da utilização de Imatinib em Tumores do Estroma Gastrointestinal (GIST) Kit Positivos, Irressecáveis e/ou Metastizados. Jornadas Oncologia. Coimbra, Portugal; 2004.
20. Gouveia M, Borges M, Tavares L, Portugal R. Meningococcal vaccine in Portugal – a cost-effectiveness analysis. ISPOR Ninth Annual International Meeting. Arlington, VA, USA; 2004 Mai. 21. Pereira E, Pereira J, Baptista J, Pereira H, Carrageta M. Avaliação económica em cardiologia de intervenção: Stent convencional vs stent com libertação controlada de sirolimus. XXV Congresso Português de Cardiologia. Vilamoura, Portugal; 2004 Mar.
22. Cortes P, Douillard JY, Twelves C, McKendrick J, Coxons F, Díaz-Rubio E, Maughan TS, Scheithauer W, Burris H, Monteiro I, Cassidy J. Pharmacoeconomic analysis of adjuvant oral capecitabine vs intravenous 5-FU/LV in Dukes’ C colon cancer. 9.ª Conferência Nacional de Economia da Saúde. Coimbra, Portugal; 2005 Nov. 23. Félix J, Inês M, Acosta C. Utilização de modelos de simulação individual em avaliação económica de medicamentos: uma aplicação ao tratamento da osteoporose. 9.ª Conferência Nacional de Economia da Saúde. Coimbra, Portugal; 2005 Nov.
24. Félix JM, Inês MS, Acosta CM. Probabilistic cost-effectiveness analysis of oral eletriptan in the treatment of acute migraine in Portugal. Acta Med Port. 2005 Jan-Fev;18(1):77-87.
25. Pinto CG, Brito de Sá A, Sousa M, Cristino J, Vilas S. Avaliação Económica da Terapêutica e do Suporte Não Farmacológico da Doença de Alzheimer. Arq Med. 2005 Set;19(5-6).
26. Félix J. Custo-efectividade do tratamento hipolipemiante com atorvastatina em doentes hipertensos e risco cardiovascular moderado. Revista Factores de Risco. 2006;1(2):92-98.
27. Inês M, Félix J, Acosta C. The use of nonlinear functions to incorporate clinical trial data into cost-effectiveness analysis: cabergoline vs bromocriptine in hyperprolactinaemia. 22nd International Conference on Pharmacoepidemiology & Therapeutic Risk Management. Lisbon, Portugal; 2006.
28. Macedo A, Araújo A, Melo FC, Nunes G, Cantinho G, Amorim I. Análise custo-efectividade do samário-153-EDTMP versus terapêutica convencional da dor em doentes com metástases ósseas múltiplas dolorosas em Portugal. Act Med Port. 2006;19:421-426. 29. Pimentel FL, Bhalla S, Laranjeira L, Guerreiro M. Cost-minimization analysis for Portugal of five doublet chemotherapy regimens from two phase III trials in the treatment of advanced non-small cell lung cancer. Lung Cancer. 2006 Jun;52(3):365-71. Epub 2006 Mai 2.
30. Macedo A, Santos MJ. Sunitinib em primeira linha no tratamento de doentes com carcinoma de células renais metastizado, em Portugal. 10.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2007 Nov.
31. Pereira J, Mernagh P, Silva AR, Limbert E, Weston A. Análise custo-utilidade do uso da TSH humana recombinante antes da ablação com radioiodo na neoplasia da tiróide. 10.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2007 Nov. 32. Pinto CG, Castanho MS, Miguel LS, Rocha E. Avaliação custo-efectividade do exemestano no tratamento do cancro da mama em estadios iniciais. PharmacoEconomics & Outcomes News. 2007;1(1):1-7. 33. Pinto CG, Manaças M, Miguel LS, Nicola P. Análise Custo-Efectividade do Linezolide no Tratamento da Pneumonia Nosocomial por Staphylococcus aureus. 10. ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2007 Nov.
34. Santos MJ, Macedo A, Furtado T. Análise de minimização de custos do tratamento empírico de infecções fúngicas em doentes com febre e neutropénia grave, em Portugal. 10.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal. 2007 Nov. 35. Alves C, Silva C, Negreiro F, Fonseca AM, Aagren M. Cost-effectiveness of insulin detemir versus NPH insulin for type 1 diabetes patients treated with basal-bolus therapy in Portugal. ISPOR 13th Annual International Meeting. Toronto, Canada; 2008 May.
36. Araújo A, Parente B, Sotto-Mayor R, Teixeira E, Almodôvar T, Barata F, Queiroga H, Pereira C, Pereira H, Negreiro F, Silva C. Avaliação económica do erlotinib, docetaxel, pemetrexedo e tratamento de suporte no tratamento de segunda ou terceira linhas de doentes com cancro do pulmão de não pequenas células. Revista Portuguesa de Pneumologia. 2008;XIV(6):803-827. 37. Heeg BM, Antunes J, Figueira ML, Jara JM, Marques Teixeira J, Palha AP, Vaz Serra A, Buskens E, Caleo S, Gouveia-Pinto C, Van 30
Hout BA. Cost-effectiveness and budget impact of long-acting risperidone in Portugal: a modeling exercise. Curr Med Res Opin. 2008 Fev;24(2):349-58.
38. Miguel LS, Pinto CG, Paquete AT. The first mover strikes again. Cost-effectiveness of statins and prescribing behavior in Portugal. ISPOR 13th Annual International Meeting. Toronto, Ontario, Canada; 2008 Mai.
39. Pereira J, Barbosa C, Mateus C, Standaert B. Cost-effectiveness Analysis of an HPV – 16/18 Prophylactic Cervical Cancer Vaccine in a Setting of Existing Screening in Portugal: Results from a Mathematical Model. ISPOR 13th Annual International Meeting. Toronto, Ontario, Canada; 2008 Mai.
40. Pinto CG, Barbosa A, Miguel LS, Feio M. Cost-utility analysis of duloxetine versus venlafaxine in the management of major depression in Portugal. ISPOR 11th Annual European Congress. Athens, Greece; 2008 Nov.
41. Pinto CG, Carrageta MO, Miguel LS. Cost-effectiveness of rosuvastatin in the prevention of ischemic heart disease in Portugal. Value Health. 2008 Mar-Abr;11(2):154-9.
42. Schwarz B, Gouveia M, Chen J, Nocea G, Jameson K, Cook J, Krishnarajah G, Alemao E, Yin D, Sintonen H. Cost-effectiveness of sitagliptin-based treatment regimens in European patients with type 2 diabetes and haemoglobin A1c above target on metformin monotherapy. Diabetes Obes Metab. 2008 Jun;10 Suppl 1:43-55. 43. Alves C, Silva C, Santos A, Queiroz MJ. Avaliação económica do voriconazol e anfotericina B convencional no tratamento de um episódio de aspergilose invasiva. Hematoncologia. 2009 Out;7. 44. André S, Delea T, Silva C. Cost-effectiveness analysis of lapatinib plus capecitabine in the treatment of patients with ErbB2+ advanced or metastatic breast cancer in Portugal. 11.ª Conferência Nacional de Economia da Saúde. Porto, Portugal; 2009 Out.
45. Conde V, Miguel LS, Manaças M. Avaliação económica sobre a utilização da vareniclina na cessação tabágica em Portugal. 11.ª Conferência Nacional de Economia da Saúde. Porto, Portugal; 2009 Out.
46. Félix J, Almeida J, Varandas P. A discrete event simulation model in major depressive disorder – cost-effectiveness analysis of agomelatine. ISPOR 12th Annual European Congress. Paris, France; 2009 Out.
47. Gouveia M, Fontouna P. Estudo de custo-efectividade do natalizumab no tratamento da esclerose múltipla recidivante-remitente em Portugal. Rev Port Farmacoter. 2009;1:11-17.
48. Inês M, Conde V, Miguel LS, Pinto CG, Janeiro N. Cost-effectiveness of maraviroc plus optimized background therapy in treatment- -experienced patients with R5 HIV-1 in Portugal. 11.ª Conferência Nacional de Economia da Saúde. Porto, Portugal; 2009 Out.
49. Macedo A, Monteiro I, Farinha S, Carrasco J. Análise de custo- -efectividade do tratamento com peginterferão alfa-2a e ribavirina em doentes co-infectados com vírus da imunodeficiência humana e vírus hepatite C, em Portugal. Revista Portuguesa de Doenças Infecciosas. 2009 Mai-Ago;5(2).
50. Macedo A, Pereira C, Gonçalves J, Sousa C. Economic evaluation of capecitabine use as first line treatment in patients with
advanced gastric carcinoma in Portugal. Acta Med Port. 2009 Nov-Dez;22(6):827-32. Epub 2010 Jan 10.
51. Maia S, Rosado F, Vidinha S. Estudo de avaliação económica de análogos da somatostatina no tratamento da Acromegália. 11.ª Conferência Nacional de Economia da Saúde. Porto, Portugal; 2009 Out.
52. Pereira RG, Silva BA, Wisniewski T, Pellissier J. Análise de custo-efectividade da utilização de aprepitant na prevenção da náusea e vómito associados a quimioterapia antineoplásica altamente emetizante em Portugal. 11.ª Conferência Nacional de Economia da Saúde. Porto, Portugal; 2009 Out.
53. Pinto CG, A Weigert, MI Pissarra e AT Paquete. Análise custo-utilidade do cinacalcet na terapêutica adjuvante do hiperparatireoidismo secundário. Rev Port Farmacoter. 2009;1(2):6-15.
54. Pinto CG, Manaças M, Miguel LS. Cost-effectiveness of pemetrexed in first line treatment of non-small cell lung cancer in Portugal. ISPOR 12th Annual European Congress. Paris, France; 2009 Out.
55. Pinto CG, MoreiraA, Miguel LS, Esteves S. Economic evaluation of docetaxel in the context of breast cancer in Portugal. ISPOR 12th Annual European Congress. Paris, France; 2009 Out.
56. Silvério NM, Yang S, Alemao E. Cost-effectiveness analysis of temsirolimus vs. sunitinib malate in poor prognosis metastatic renal cell carcinoma (MRCC) in Portugal. ISPOR 12th Annual European Congress. Paris, France; 2009 Out.
57. Braga P, Carvalho S, Gomes M, Guerra L, Lúcio P, Marques H, Negreiro F, Pereira C, Silva C, Teixeira A. Análise económica de rituximab em associação com ciclofosfamida, vincristina e prednisolona no tratamento de doentes com linfoma folicular avançado em Portugal. Acta Med Port. 2010;23:1025-1034.
58. Chaudhary MA, Elbasha EH, Pereira R, Kumar RN. A continuous-time economic model to evaluate raltegravir use strategies in treatment-naive HIV-1 patients in Portugal. ISPOR 13th Annual European Congress. Prague, Czech Republic; 2010 Nov.
59. Gouveia M, Borges M, Costa J, Carneiro AV. Avaliação económica do Ranibizumab na degenerescência macular relacionada com a idade em Portugal. Rev Port Farmacoter. 2010;2(3):155-162. 60. Gouveia M, Borges M, Costa J, Pinheiro L, Carneiro AV. Estudo de custo-efectividade do aliscireno no tratamento da hipertensão em doentes com diabetes tipo 2 e nefropatia em Portugal. Rev Port Farmacoter. 2010;2(1):8-23.
61. Inês M, Soares M, Vitorino R. Cost-effectiveness of eplerenone compared with spironolactone in patients with heart failure after acute myocardial infarction. ISPOR 13th Annual European Congress. Prague, Czech Republic; 2010 Nov.
62. Macedo A, Andrade S, Santos A. Avaliação económica da anidulafungina no tratamento de candidemia e candidíase invasiva em Portugal. PharmacoEconomics & Outcomes News. 2010:1-8. 63. Macedo A, Monteiro I, Andrade S, Cirrincione A, Ray J. Cost-effectiveness of trastuzumab in the treatment of early stages breast cancer patients, in Portugal. Acta Med Port. 2010 Mai-Jun;23(3):475-82. Epub 2010 Jun 14.
64. Mateus C. Análise custo-utilidade: uma aplicação à prevenção do tromboembolismo venoso em ortopedia. Tese Doutoramento. 2010. Disponivel em http://run.unl.pt/handle/10362/4249.
65. Nuijten MJC, Gouveia M, Brandao J, Fleischhackl RH, Liedgens H. Cost-effectiveness of lidocaine 5% medicated plaster relative to pregabalin in treatment of post-herpetic neuralgia in Austria and Portugal. Montréal, Canada; 2012 Set 2; IASP Ago 29.
66. Palmer JL, Pinto CG, Duarte R, Miguel L, Gregor Z. Cost-effectiveness of exenatide versus insulin glargine and versus biphasic insulin aspart for the treatment of type 2 diabetes in Portugal: a long-term health economic analysis. ISPOR 13th Annual European Congress. Prague, Czech Republic; 2010 Nov.
67. Areias J, Branco T, Calinas F, Carvalho A, Macedo G, Manata MJ, Matos L, Rodrigues B, Velosa J, Pereira C, Sanches M, Rubio-Terrés C. Treatment of chronic hepatitis C patients with peginterferon alfa-2a or peginterferon alfa-2b: a cost-effectiveness analysis for the Portuguese NHS setting. ISPOR 14th Annual European Congress. Madrid, Spain; 2011 Nov.
68. Carvalho D, Lindner L, Kozarzewski M. Cost-effectiveness of transferring type 2 diabetic patients from neutral protamine hagedorn (nph) to detemir in Portugal settings. ISPOR 14th Annual European Congress. Madrid, Spain; 2011 Nov.
69. Cristino J, Canhão H, Perelman J, Santos C, Pereira J. Cost-utility analysis of denosumab versus standard care in the treatment of post-menopausal osteoporosis in Portugal. ISPOR 16th Annual International Meeting. Baltimore, MD, USA; 2011 Mai.
70. Darbà J, Kaskens L, Abecasis M, Vitorino R, Carrasco J. Cost-effectiveness of dasatinib versus high-dose imatinib and nilotinib in patients with chronic myeloid leukaemia resistant to standard-dose imatinib in Portugal. ISPOR 14th Annual European Congress. Madrid, Spain; 2011 Nov.
71. Diamantopoulos A, Andrade S, Bernardo A, Branco J, Inês L, Pereira da Silva JA, Santos MJ, Monteiro I. Cost-effectiveness of tocilizumab compared to standard therapeutic sequences for the treatment of moderate/severe rheumatoid arthritis (RA) patients in Portugal. ISPOR 14th Annual European Congress. Madrid, Spain; 2011 Nov.
72. Félix J, Vandewalle B, Almeida A, Silva MJ, Luz R. Comparação entre abraxane (paclitaxel-albumina) e paclitaxel com base de solvente no tratamento do cancro da mama metastático – análise de custo-efectividade. 12.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2011 Out.
73. Gouveia M, Borges M, Costa J, Pinheiro L, Inês M, Carneiro AV. Avaliação Económica da vacina Prevenar 13®. 12.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2011 Out. 74. Inês M, Silverio NM, Erdogan-Ciftci E. Cost-minimization analysis of collagenase clostridium histolyticum compared with fasciectomy in patients with Dupuytren’s contracture in Portugal. ISPOR 14th Annual European Congress. Madrid, Spain; 2011 Nov. 75. Inês MS, Miguel LS, Pinto CG. Análise de Custo-Efectividade da Linezolida no tratamento da Pneumonia Nosocomial por MRSA em Portugal. 12.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2011 Out.
76. Macedo A, Conde V, Inês M, Carvalho de Sousa J. Custo-efectividade da atorvastatina na prevenção primária de eventos cardiovasculares em doentes com diabetes tipo 2. 12.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2011 Out. 77. Macedo A, Andrade S, Mulchande M, Marx SE, Nuijten M. Estudo de avaliação do custo-efectividade da utilização de paricalcitol no tratamento de doentes com insuficiência renal terminal e hiperparatiroidismo secundário em Portugal. Rev Port Farmacoter. 2011;3(2):75-86.
78. Mota R, Valente J, Moreira MR. Análise Económica de Custo-Utilidade Aplicada ao Tratamento Adjuvante do Cancro da Mama Precoce HER2+ com Trastuzumab (Hercepin) no Contexto do SNS. Dissertação de Mestrado. Disponivel em info.fep.up.pt/fotos/ editor2/poster_saude_rui_mota.pdf.
79. Obradovic M, Hertel N, Ikenberg R, Gouveia M, Liedgens H. Modeling cost-effectiveness of drug treatments for severe chronic non-cancer pain in Portugal. ISPOR 14th Annual European Congress. Madrid, Spain; 2011 Nov.
80. Paquete AT, Luz R, Danel A, Roquete I. Avaliação económica do pegfilgrastim como profilaxia primária de neutropenia febril em doentes com linfoma não-Hodgkin: resultados portugueses de um modelo europeu. 4ª Semana APFH – XIV Simpósio Nacional, Centro de Congressos do Estoril; 2011 Nov 16-18.
81. Pinto CG, Miguel L. Cost minimization study on ATG-Fresenius for prevention of graft versus host disease. 12.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2011 Out.
82. Saramago P, Inês M, Gordo AC, Faustino A. Cost-utility of celecoxib compared with NSAID plus PPI in patients with osteoarthritis. 12.ª Conferência Nacional de Economia da Saúde. Lisboa, Portugal; 2011 Out.
83. Soares M, Inês M, Contente M. Cost-effectiveness of sunitinib in patients with advanced or metastatic pancreatic neuroendocrine tumors in Portugal. ISPOR 14th Annual European Congress. Madrid, Spain; 2011 Nov.
84. Aragão F, Vera J, Vaz Pinto I. Cost-effectiveness of the third-agent class in treatment-naive human immunodeficiency virus-infected patients in Portugal. PLoS One. 2012;7(9):e44774. 85. Café A, Loff J, Encarnação R, Monteiro I. Análise de custo-eficácia de medicamentos biológicos utilizados no tratamento da artrite reumatóide activa com resposta inadequada a DMARDs não biológicos – abordagem simplificada. XV Simpósio Nacional da APFH. Lisboa, Portugal; 2012 Nov.
86. Calado F, Gruenberger JB, Silva-Nunes J, Carvalho D. Cost-effectiveness of vildagliptin compared to generic sulphonylureas added on to metformin from the portuguese societal perspective. ISPOR 15th Annual European Congress, Berlin, Germany; 2012 Nov. 87. Cristino J, Lothgren M, Bracco A, Lundkvist J, Biteeva I, Schwenkglenks M, Pereira J, Halperin M, Macarios D, Chung K, Danese MD. Cost-effectiveness of denosumab versus zoledronic acid (ZA) for the prevention of skeletal-related events (SRE) in patients with bone metastases (BM) from breast cancer in Sweden, Switzerland and Portugal. 9th Annual HTAi Meeting. Bilbao, Spain; 2012 Jun.
32