PROGRAMA DE PÓS-GRADUAÇÃO STRICTO SENSU EM EDUCAÇÃO FÍSICA
ANÁLISE DA FORÇA, QUALIDADE MUSCULAR, COMPOSIÇÃO CORPORAL E FADIGA EM SOBREVIVENTES DE LINFOMA DE HODGKIN
Filipe Dinato de Lima Brasília 2016
ANÁLISE DA FORÇA, QUALIDADE MUSCULAR, COMPOSIÇÃO CORPORAL E FADIGA EM SOBREVIVENTES DE LINFOMA DE HODGKIN
Filipe Dinato de Lima
Dissertação de mestrado apresentada ao Programa de Pós-graduação Stricto Sensu da Faculdade de Educação Física da Universidade de Brasília como requisito para a obtenção do Grau de Mestre em Educação Física.
ORIENTADOR: PROF. DR. RICARDO JACÓ DE OLIVEIRA Brasília 2016
DEDICATÓRIA
Dedico este trabalho à minha avó, Nilda de Sousa Dinato (in memoriam), que nos ensinou tudo o que há de mais precioso: valorizar e amar a família acima de tudo, pois juntos somos mais fortes. Vó, luto todos os dias para te orgulhar e ser o melhor possível em tudo. Não acho que a senhora mereça menos do que isso por tudo que fez por nós.
AGRADECIMENTOS
O maior ensinamento que o amadurecimento proporciona é a certeza da impossibilidade de se fazer algo sozinho, seja o que for.
Inicialmente, gostaria de agradecer a Deus e a Nossa Senhora por todas as condições dadas para que eu chegasse até aqui. Sei que por muitas vezes somos carregados nos braços, como um pai faz com seu filho. Sem essa força, é impossível se manter firme.
Agradeço com todas as minhas forças a minha mãe. Não conheço e jamais conhecerei uma mulher tão determinada a vencer qualquer dificuldade para alcançar seu objetivo: criar seu filho. Tudo o que sou e o que poderei ser, devo a ela. Mãe, obrigado por me propiciar todas as possibilidades de desenvolvimento, mesmo com dificuldade. Obrigado pelo amor e pelo carinho incondicional que sempre me deu, apesar de eu ser um filho teimoso e arredio. Obrigado por ser meu maior exemplo.
Agradeço ao meu pai, pelo apoio e pelas conversas longas que me acalmavam, pelo amor que me deu mesmo quando eu me distanciava, por ter permitido uma aproximação cada vez maior. Aos meus irmãos Bruno e Paula, Lauro Júnior e Luciana. Cada um de vocês desempenhou um papel muito importante e são exemplos para mim. Paula, luto para ser exemplo para você em algumas coisas. Aos meus pais de coração tia Doetti e tio Lauro, sou muito feliz por poder dar orgulho a vocês. As minhas tias, tios, primas e primos.
Agradeço de forma muito especial a minha companheira de todas as horas. Ana Luiza, meu amor, você conhece o melhor e o pior de mim;; você esteve comigo em todos os momentos difíceis e me ajudou a superá-los;; você é responsável por essa conquista tanto quanto eu. Te amo sem medidas.
Agradeço, sem exceção, a todos os meus colegas de grupo e de forma muito especial ao GPEC, não tenho palavras para agradecer o acolhimento e a parceria que desenvolvemos. Lo e Ju, vocês são pessoas muito especiais. Agradeço particularmente a Ritielli Valeriano. Riti, seu exemplo de luta e determinação são dignos de um filme. Sua amizade e seus ensinamento, em todas as áreas, foram fundamentais durante todo o processo. Você é um anjo que Deus colocou aqui na Terra.
Agradeço aos professores, Dr. Márcio Rabelo Mota e Dra. Renata Aparecida Elias Dantas, meus pais acadêmicos, sem o incentivo deles não teria ingressado no mestrado.
Ao professor Dr. Martim Bottaro, pelos direcionamentos recentes nas pesquisas e por todo o conhecimento passado. Tenho-o como exemplo de pesquisador.
Aos demais professores do Programa de Pós-Graduação em Educação Física, pelos ensinamentos durante as aulas e pelas conversas de corredor. A todos os meus colegas e a todos os funcionários da Faculdade de Educação Física da Universidade de Brasília, pela companhia, convivência e aprendizados ao longo desses anos.
A CAPES, pela bolsa de estudos concedida ao longo do curso.
Agradeço de coração ao meu orientador Dr. Ricardo Jacó de Oliveira. Sua orientação foi fundamental durante todo o processo. Sou extremamente grato por nossa convivência e pelos ensinamentos que absorvi. Nossos objetivos e a vontade de nos superarmos fez com que nos tornássemos grandes amigos, apesar de nossas personalidades. Hoje, fica claro para mim que os desentendimentos que tivemos ao longo do processo aconteceram porque nos parecemos na vontade de fazer sempre o melhor. Agradeço pela sua paciência e pela sua amizade e tenho certeza que muitas coisas boas ainda surgirão dessa parceria.
RESUMO
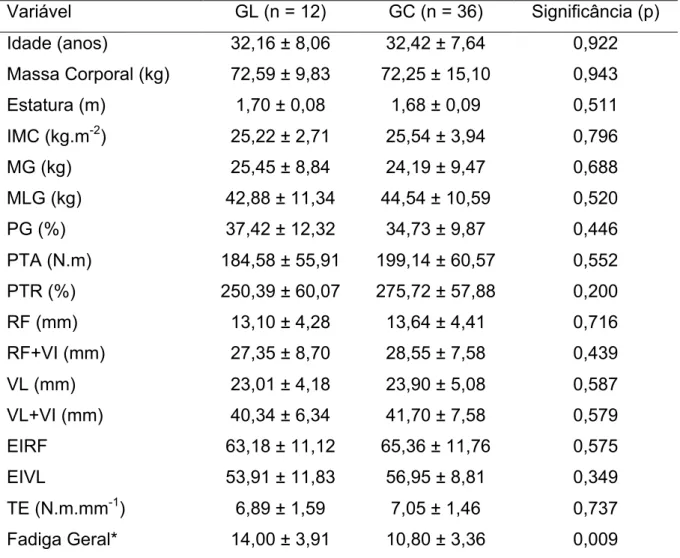
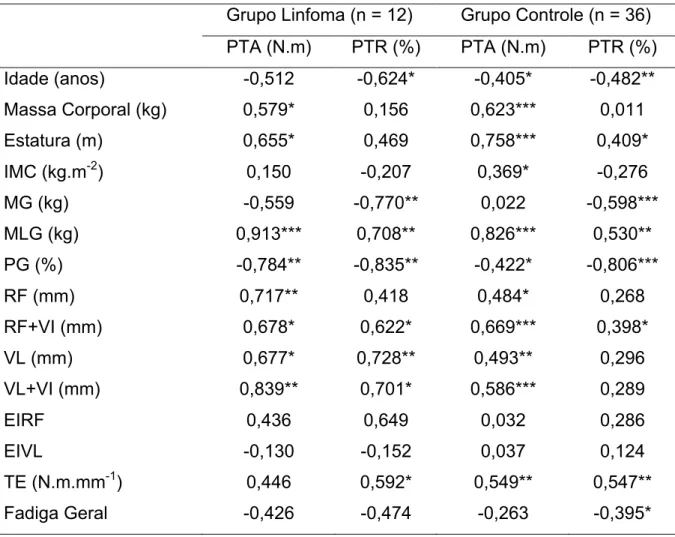
Sobreviventes de câncer vivenciam uma sensação subjetiva de exaustão que não é amenizada com o repouso, promovendo um efeito depressor nos aspectos físico, emocional e mental, denominada Fadiga Relacionada ao Câncer (FRC). Adicionalmente, podem ser acometidos por uma redução do tecido muscular esquelético que ocorre em função do desequilíbrio entre síntese e degradação de proteínas contráteis. Consequentemente, a redução da força muscular em indivíduos com câncer parece estar relacionada à própria redução de tecido muscular além de alterações estruturais deste tecido. Objetivo: Analisar a força, qualidade muscular, composição corporal e fadiga em sobreviventes de linfoma de Hodgkin (LH) e compará-los a indivíduos saudáveis. Além de verificar a relação entre as variáveis de qualidade muscular e de composição corporal e a força muscular em sobreviventes de LH. Materiais e Métodos: Doze sobreviventes de LH (GL;; 32,16 ± 8,06 anos), que concluíram o tratamento há mais de seis meses, e 36 indivíduos saudáveis (GC;; 32,42 ± 7,64 anos) foram recrutados. Todos os indivíduos foram submetidos a avaliação subjetiva de fadiga (IMF-20), análise da composição corporal, espessura e qualidade muscular dos músculos do quadríceps direito, além da mensuração do pico de torque isocinético da extensão de joelho a 60º.s-1. Os dados foram comparados entre os grupos através do Teste T independente para as variáveis normais e através do teste de U de Mann-Whitney para as variáveis não normais. A correlação de Pearson para as variáveis normais e de Spearman para as variáveis não normais foram utilizadas para identificar as variáveis relacionadas à força. Resultados: Não houve diferença (p > 0,05) entre os grupos nas variáveis de caracterização, de composição corporal, de força e de qualidade muscular. Entretanto, o GL apresentou uma fadiga geral significantemente maior que o GC (p = 0,009). No GL, o pico de torque absoluto apresentou uma relação positiva significativa (p < 0,05) com a estatura, com a massa corporal, e com as variáveis de qualidade muscular. Conclusões: Sobreviventes de linfoma de Hodgkin apresentam uma maior fadiga, comparados com indivíduos saudáveis. Entretanto, não há alterações na composição corporal, força, quantidade e qualidade musculares.
Palavras-chave: Linfoma de Hodgkin, Fadiga Relacionada ao Câncer, Força Muscular;; Qualidade Muscular
ABSTRACT
Cancer survivors experience a subjective sensation of exhaustion that is not relieved with rest, promoting a depressant effect on physical, emotional and mental aspects, called Cancer Related Fatigue (CRF). Additionally, there may be affected by a decline of skeletal muscle tissue which occurs due to the imbalance between synthesis and degradation of contractile proteins. Consequently, reduced muscle strength in individuals with cancer may be related to specific reduction of muscle tissue as well as structural changes of this tissue. Purpose: To analyze the strength, muscle quality, body composition and fatigue in Hodgkin lymphoma survivors (HL) and compare to healthy subjects. In addition to assess the relation between the variables of muscle quality, body composition and muscle strength in HL survivors. Methods: Twelve HL survivors (LG;; 32.16 ± 8.06 years), who have completed treatment for more than six months, and 36 healthy subjects (CG;; 32.42 ± 7.64 years) were recruited. All subjects performed the subjective assessment of fatigue (MFI-20), body composition analysis, muscle thickness and quality of the right quadriceps muscle, as well as measurement of isokinetic knee extension peak torque at 60º.s-1. Data were compared between groups using an independent t-test for normal variables and using the Mann-Whitney U-test for non-normal variables. The Pearson correlation for the normal variables and Spearman correlation for non-normal variables were used to identify variables related to strength. Results: There was no difference (p > 0.05) between groups in the sample
characteristics, body composition, strength and muscle quality. However, the LG has
presented a general fatigue significantly higher than CG (p = 0.009). In LG, the absolute peak torque showed a significant positive correlation (p < 0.05) with height, body mass, and the variables of muscle quantity. Conclusion: Hodgkin's lymphoma survivors present a higher fatigue, compared to healthy subjects. However, there are no changes in body composition, strength, muscle quantity and quality.
Keywords: Hodgkin lymphoma;; Cancer Related Fatigue;; Muscular Strength;; Muscle quality.
SUMÁRIO 1. INTRODUÇÃO ... 13 2. OBJETIVOS ... 17 2.1. Objetivo Geral ... 17 2.2. Objetivos Específicos ... 17
3. REVISÃO DE LITERATURA ... 18
3.1. Linfoma de Hodgkin ... 18
3.2. Fadiga Relacionada ao Câncer ... 21
3.3. Redução do Tecido Muscular Esquelético Relacionada ao Câncer ... 25
3.4. Força Muscular ... 27
3.5. Qualidade Muscular ... 29
4. MATERIAIS E MÉTODOS ... 32
4.1. Amostra ... 32
4.2. Aspectos Éticos ... 33
4.3. Delineamento Experimental ... 33
4.4. Instrumentos e Procedimentos de Avaliação ... 34
4.4.1. Anamnese e Perfil Sociodemográfico ... 34
4.4.2. Nível de Atividade Física ... 34
4.4.3. Fadiga ... 34
4.4.4. Avaliação Antropométrica e Composição Corporal ... 35
4.4.5. Qualidade Muscular ... 36 4.4.6. Força Muscular ... 38 4.5. Análise Estatística ... 40 5. RESULTADOS ... 41 6. DISCUSSÃO ... 44 7. CONCLUSÃO ... 49 REFERÊNCIAS BIBLIOGRÁFICAS ... 50 APÊNDICE A ... 61 APÊNDICE B ... 62 APÊNDICE C... 64
ANEXO 1 ... 66 ANEXO 2 ... 68 ANEXO 3 ... 70 ANEXO 4 ... 74
LISTA DE FIGURAS
Figura 1 Células de Reed-Sternberg em linfócitos CD30. ... 19 Figura 2 Fatores tratáveis que contribuem para a FRC. ... 24 Figura 3 Análise da composição corporal em aparelho de Absorciometria com Raios-
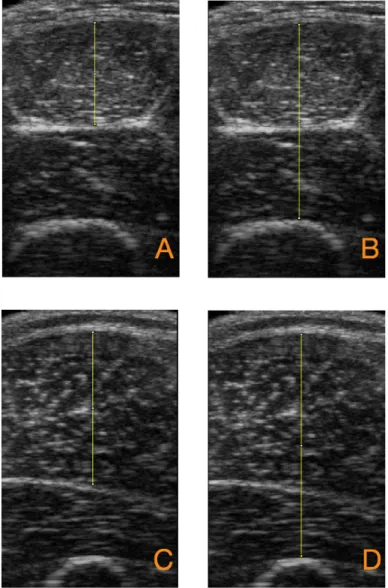
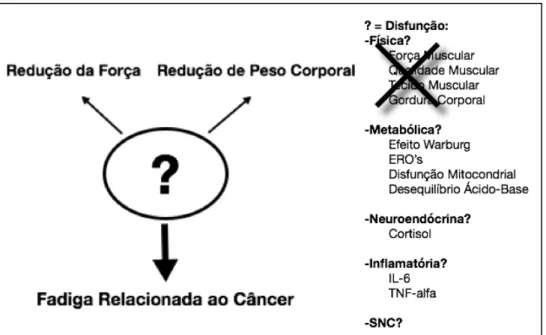
X de Dupla Energia. ... 35 Figura 4 Medida da espessura muscular do reto femoral (A), reto femoral + vasto intermédio (B), vasto lateral (C) e vasto lateral + vasto intermédio (D). ... 37 Figura 5 Análise da Echo Intensity no músculo reto femoral. ... 38 Figura 6 Dinamômetro Isocinético Biodex System III ... 40 Figura 7 Possíveis fatores causadores da Fadiga Relacionada ao Câncer e, em menor escala, das alterações de massa corporal e força muscular. ... 47
LISTA DE TABELAS
Tabela 1 Características Clínicas do GL expressas em Média ± Desvio Padrão. .... 41 Tabela 2 Análise descritiva e comparação entre grupos das variáveis de caracterização, composição corporal, força, qualidade muscular e fadiga, expressas em média ± desvio padrão. ... 42 Tabela 3 Coeficientes de correlação entre o pico de torque absoluto, pico de torque relativo e as variáveis de caracterização, composição corporal, qualidade muscular e fadiga. ... 43
LISTA DE ABREVIATURAS E SIGLAS
ABVD Adriamicina, bleomicina, vinblastina e dacarbazina ACSM American College of Sports Medicine
ACTH Hormônio Adrenocorticotrófico CEP Comitê de Ética em Pesquisa
EBV Vírus Epstein-Barr
EI Echo Intensity
EIRF Echo Intensity do Reto Femoral EIVL Echo Intensity do Vasto Lateral
EM Espessura Muscular
EROs Espécies Reativas de Oxigênio FEF Faculdade de Educação Física
FRC Fadiga Relacionada Ao Câncer
FS Faculdade de Ciências da Saúde FSH Hormônio Folículo Estimulante
GC Grupo Controle
GH Hormônio do Crescimento
GL Grupo Linfoma
HIV Vírus da Imunodeficiência Humana
IMC Índice de Massa Corporal
IMF-20 Inventário Multidimensional de Fadiga INCA Instituto Nacional do Câncer
IPAQ Questionário Internacional de Atividade Física
LH Hormônio Luteinizante
LH Linfoma de Hodgkin
MLG Massa Livre de Gordura
NCCS National Coalition for Cancer Survivorship
NK Natural Killers
PG Percentual de Gordura
PT Pico de Torque
PTA Pico de Torque Absoluto
PTR Pico de Torque Relativo
QM Qualidade Muscular
QT Quimioterapia
RF Reto Femoral
RF+VI Espessura do Reto Femoral e do Vasto Intermédio
RT Radioterapia
TE Torque Específico
TSH Hormôinio Estimulante da Tireóide
UnB Universidade de Brasília
VI Vasto Intermédio
VL Vasto Lateral
VL+VI Espessura do Vasto Lateral e do Vasto Intermédio
1. INTRODUÇÃO
O câncer se caracteriza por um processo complexo, progressivo e de múltiplas etapas, promovendo um crescimento celular desordenado, afetando órgãos e sistemas, de forma específica em relação ao seu tipo (WEINBERG, 2013). Segundo o Instituto Nacional de Câncer (INCA, 2015), em 2016 estima-se que surjam aproximadamente 596 mil novos casos no Brasil, afetando mulheres e homens em 49% e 51% dos casos, respectivamente.
Dentre os diversos tipos de câncer, os linfomas são tumores malignos que se originam nas células B e nas células T do sistema linfático, divididos em Linfoma de Hodgkin (LH) e Linfoma não-Hodgkin (SMITH, N.E. e TIMBY, 2005). O LH acomete células do sistema imunológico, como os linfonodos, se desenvolvendo nas regiões mediastinal, axiliar e cervical (RUIZ-ARGÜELLES, 2009). De forma específica, estima- se que aproximadamente 2.470 novos casos de Linfoma de Hodgkin surjam em 2016 no Brasil (INCA, 2015). Entretanto, pacientes diagnosticados com LH apresentam uma alta taxa de sobrevida, tornando fundamental a busca por alternativas que aprimorem a qualidade de vida e reduzam os efeitos colaterais da patologia e de seu tratamento (SPECTOR, 2004).
A fadiga é um sintoma que acomete sobreviventes de câncer e se caracteriza como um efeito colateral tardio e persistente que afeta negativamente a capacidade de realização das funções diárias e a qualidade de vida em seus aspectos físico, psicológico e relacional (DIAZ et al., 2008;; WANG et al., 2014;; KLUTHCOVSKY e URBANETZ, 2015;; MCCABE et al., 2015). A denominação “sobrevivente” é feita a partir do momento no qual o câncer é descoberto, permanece durante o tratamento e segue até a morte do indivíduo. Portanto, são caracterizados como sobreviventes tanto o indivíduo em tratamento, quanto aquele que já concluiu a terapêutica (MULLAN, 1985).
Denominado Fadiga Relacionada ao Câncer (FRC), este sintoma é consideravelmente mais duradouro e severo que a fadiga típica e não é amenizado com o repouso (WANG e WOODRUFF, 2015), afetando, em pelo menos metade do tempo, 69% a 82,1% dos indivíduos diagnosticados com câncer (PORTENOY e ITRI, 1999;; DIAZ et al., 2008). Em um estudo com indivíduos em tratamento de leucemia e linfoma não Hodgkin, Wang et al. (2002), relataram que pelo menos 50% dos
pacientes sofriam de fadiga severa, que interferia substancialmente nas suas funções normais.
Os mecanismos fisiopatológicos da FRC ainda permanecem indefinidos, dificultando a precisão nas intervenções que buscam prevenir ou tratar este sintoma (WANG et al., 2014). Uma complexa sequência de eventos que afeta diversos sistemas e mecanismos fisiológicos parece contribuir e favorecer o surgimento da fadiga, como uma produção inflamatória acentuada, disfunções na ativação das glândulas hipófise, hipotálamo e adrenal, desregulação metabólica e endócrina, alteração no ritmo circadiano, além de anormalidades nas funções neuromusculares, provocando redução de força muscular e capacidade funcional (THORNTON;; ANDERSEN e BLAKELY, 2010;; BERGER;; GERBER e MAYER, 2012;; SALIGAN et al., 2015;; SHA et al., 2015;; WANG e WOODRUFF, 2015).
Com o objetivo de reduzir os efeitos da FRC, o exercício físico tem sido proposto por promover adaptações positivas em diversos mecanismos relacionados a ocorrência da fadiga (DIMEO et al., 2008), reduzindo os níveis de citocinas pró- inflamatórias, aumentando a força muscular e atenuando a perda de tecido muscular (AL-MAJID e GRAY, 2009). Os efeitos positivos do exercício na redução da fadiga, acompanhados por uma potencialização da performance física, foram sugeridos inclusive em sobreviventes de linfoma de Hodgkin (OLDERVOLL et al., 2003). Adicionalmente, o ganho de força muscular induzido pelo treinamento parece contribuir para a prevenção da fadiga (GALVAO et al., 2006), posto que diversos estudos que investigaram os efeitos do treinamento resistido em indivíduos com câncer em tratamento e em sobrevida, obtiveram como resultado um aumento de força acompanhado de uma redução da fadiga (DE BACKER et al., 2007;; HEIM;; V D MALSBURG e NIKLAS, 2007;; BATTAGLINI et al., 2009).
Nesse sentido, o American College of Sports Medicine (ACSM) propõe a realização do exercício físico regular para manutenção da saúde e da qualidade de vida, prevenindo, atenuando, tratando ou removendo alterações fisiológicas e psicológicas promovidas pelo câncer e seus tratamentos, ressaltando a segurança na prática do exercício resistido (SCHMITZ et al., 2010). Esta prática se mostra benéfica também após o término do tratamento, afetando o bem estar físico e emocional, reduzindo a manifestação de efeitos colaterais relacionados ao tratamento do câncer, promovendo o desenvolvimento de tecido muscular, produzindo alterações efetivas na funcionalidade e aumentando a sobrevida de indivíduos sobreviventes de câncer
de mama (BATTAGLINI et al., 2014;; DIELI-CONWRIGHT e OROZCO, 2015). Assim, parece claro a influência da força muscular na fadiga, posto que aumentos na capacidade de produção de força se relacionam com a redução da FRC (MILNE et al., 2008).
Outro sintoma persistente e crônico presente em sobreviventes é a redução do tecido muscular esquelético relacionado ao câncer, caracterizada por uma redução involuntária maior que 5% do peso corporal em um período de até seis meses, que ocorre em função do desequilíbrio entre síntese e degradação de proteínas contráteis (AL-MAJID e WATERS, 2008). Nesse sentido, a redução da força muscular em indivíduos com câncer parece estar relacionada à própria redução de tecido muscular, além de alterações estruturais deste tecido (AL-MAJID e WATERS, 2008;; NEIL- SZTRAMKO et al., 2014) Estas alterações promovem um declínio do desempenho funcional, aumentam a taxa de mortalidade e reduzem a responsividade ao tratamento (ATTAIX et al., 2005;; MUSCARITOLI et al., 2006;; STEWART;; SKIPWORTH e FEARON, 2006;; NEIL-SZTRAMKO et al., 2014). Adicionalmente, apesar do decréscimo da quantidade de tecido muscular esquelético ser preponderante no declínio da força muscular, o entendimento sobre a qualidade muscular parece ser limitado (GORSELINK et al., 2006).
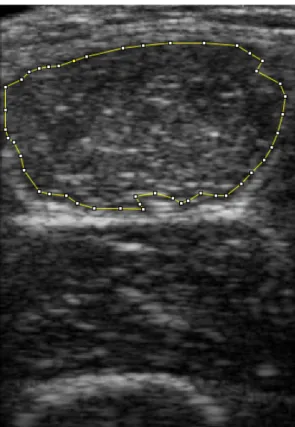
Em homens saudáveis, a força muscular se relaciona de maneira significativa com a qualidade muscular (QM) analisada através da Echo Intensity (EI), independentemente do próprio volume e tamanho do músculo (CADORE et al., 2012;; FUKUMOTO et al., 2012;; WATANABE et al., 2013), pois reflete a capacidade funcional do tecido analisado (RADAELLI et al., 2011). A EI analisa a proporção entre fibras contráteis e tecido não contrátil, como gordura, presente em um músculo através da análise de escalas de cinza de uma imagem transversal coletada com o ultrassom (FUKUMOTO et al., 2012;; MASAKI et al., 2015).
Tanto a qualidade muscular quanto o próprio volume do tecido parecem ser influenciados pelo envelhecimento e pela presença de patologias. Indivíduos idosos apresentam uma menor qualidade muscular associada a uma menor quantidade de fibras contráteis, resultando em uma esperada redução da força (GOODPASTER et al., 2006). Como exemplo, indivíduos com síndrome pós-pólio apresentam redução de força, QM e volume muscular quando comparados a indivíduos saudáveis (BICKERSTAFFE et al., 2015). Resultados semelhantes foram encontrados em indivíduos com doença pulmonar obstrutiva crônica, evidenciando uma maior
infiltração de gordura intramuscular, redução do tamanho do musculo, e uma consequente perda de força muscular, promovendo deficiências nas funções musculares (ROBLES et al., 2015).
Considerando que a manifestação da fadiga em sobreviventes parece ser dependente, pelo menos em parte, de fatores neuromusculares, como a redução da força, volume e qualidade musculares (BERGER et al., 2012;; SALIGAN et al., 2015;; WANG e WOODRUFF, 2015), faz-se necessário verificar diferenças entre a fadiga, força e qualidade muscular entre sobreviventes de linfoma de Hodgkin e indivíduos saudáveis pareados por idade, sexo e nível de atividade física. Desta forma, existe a possibilidade de inferir, mesmo que de forma parcial, fatores que podem contribuir com a FRC, além de propor intervenções a fim de reduzir seus efeitos.
2. OBJETIVOS
2.1. Objetivo Geral
O objetivo deste estudo foi analisar a força, qualidade muscular, composição corporal e fadiga em sobreviventes de linfoma de Hodgkin (LH) e compará-los a indivíduos saudáveis pareados por idade, sexo e nível de atividade física.
2.2. Objetivos Específicos
• Verificar e analisar o pico de torque absoluto e o pico de torque relativo na extensão de joelho de sobreviventes de LH e compará-los com indivíduos saudáveis pareados por idade, sexo e nível de atividade física.
• Verificar e analisar a espessura muscular (EM), a Echo Intensity (EI) e o torque específico (TE) do reto femoral e do vasto lateral de sobreviventes de LH e compará-los com indivíduos saudáveis pareados por idade, sexo e nível de atividade física.
• Verificar e analisar a massa livre de gordura (MLG), massa gorda (MG) e o percentual de gordura (PG) de sobreviventes de LH e compará-los com indivíduos saudáveis pareados por idade, sexo e nível de atividade física. • Verificar e analisar a fadiga auto percebida de sobreviventes de LH e compará-
la com indivíduos saudáveis pareados por idade, sexo e nível de atividade física.
• Verificar e analisar a relação entre as variáveis de qualidade muscular e de composição corporal e a força muscular em sobreviventes de LH.
3. REVISÃO DE LITERATURA
3.1. Linfoma de Hodgkin
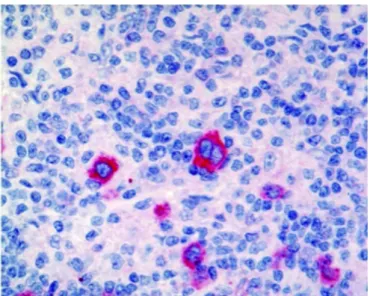
O Linfoma de Hodgkin foi descrito pela primeira vez em 1832 pelo médico Thomas Hodgkin, após observações em sete casos de pacientes com tumores localizados nos linfonodos e no baço, em seu trabalho intitulado “On some morbid appearances of the absorbent glands and spleen” (HODGKIN 1832). Entretanto, somente entre os anos de 1898 e 1902, os patologistas Dorothy Reed e Carl Sternberg, em um trabalho realizados no Hopkins Laboratories, descobriram desordens neoplásicas em células sanguíneas associadas ao LH (PARRY, 2006). Essas células, chamadas a partir desse momento de células de Reed-Sternberg, passaram a caracterizar a neoplasia maligna nos linfonodos chamada de doença de Hodgkin (RUIZ-ARGÜELLES, 2009).
As células de Reed-Sternberg possuem, usualmente, um núcleo central proeminente e múltiplos núcleos ao redor (Figura 1), além de menores retículos endoplasmáticos (GLICK et al., 1976). Quanto a sua origem, as células de Reed- Sternberg parecem expressar os marcadores das células T, células B, células citotóxicas, células Natural Killers (NK cells), células mielóide e granulócitos (KUPPERS;; ENGERT e HANSMANN, 2012). No entanto, Smith e Timby (2005) afirmam que as células neoplásicas relacionadas ao LH são originadas predominantemente nas células B e, em menor concentração, nas células T.
A etiologia do LH ainda não está clara. Diversos autores apontam a importância das bases genéticas como um fator de risco considerável para se desenvolver a patologia (KERZIN-STORRAR et al., 1983;; CRUMP et al., 2012). Nesse sentido, o risco relativo de se desenvolver LH aumenta em até 100 vezes quando analisados gêmeos monozigóticos (MACK et al., 1995;; GOLDIN et al., 2004). Por outro lado, o desenvolvimento da doença parece estar relacionado a presença do vírus Epstein- Barr (EBV), em 20-100% dos casos, dependendo da idade, do gênero, da região geográfica e da histologia (MANI e JAFFE, 2009). Segundo Weiss et al. (1987) e Gulley et al. (1994), uma possível explicação para a relação entre o vírus EBV e o LH se deve a presença da infecção por EBV no interior das células de Reed-Sternberg, promovendo sua clonagem e multiplicação. Em virtude disto, a presença deste vírus aumenta de 3 a 4 vezes o desenvolvimento do LH (CARTWRIGHT e WATKINS, 2004).
Figura 1 Células de Reed-Sternberg em linfócitos CD30.
Figura adaptada de KUPPERS et al. (2012)
Ainda de acordo com Mani e Jaffe (2009), a incidência de LH, consequência de desordens no sistema imunológico, também está associada a infecção pelo vírus HIV. Esta associação entre HIV e células neoplásicas de Hodgkin também apresenta uma relação com a presença de diversas variações do vírus EBV, promovendo alterações na concentração de diferentes tipos de linfócitos. Consequentemente, o risco de indivíduos infectados pelo vírus HIV desenvolverem LH é aumentado em até 10 vezes (THOMPSON et al., 2004;; PANTANOWITZ;; SCHLECHT e DEZUBE, 2006).
O desenvolvimento e a detecção do tumor acontecem a partir do reconhecimento de sintomas específicos, como o desenvolvimento de linfonodos na região cervical, em sua maioria, com característica indolor (SMITH, N.E. e TIMBY, 2005). Além da região cervical, a presença de linfonodos desenvolvidos na região mediastinal ocorre em 80% dos casos (RUIZ-ARGÜELLES, 2009). Adicionalmente, os sintomas B, como febre, perda significativa de peso corporal sem motivo aparente (acima de 10kg em seis meses) e sudorese noturna excessiva, estão presentes em até 40% dos casos e representam um mau prognóstico (ANSELL, 2012).
Nesse sentido, a partir do diagnóstico, o indivíduo com LH é caracterizado e o estadiamento da doença é realizado considerando a localização, a quantidade e a distribuição das regiões afetadas, seguindo as recomendações propostas por Carbone et al. (1971), da seguinte maneira:
• Estágio 1: Envolvimento de apenas uma região de linfonodo, de apenas uma região ou órgão extralinfático.
• Estágio 2: Envolvimento de duas ou mais regiões de linfonodos do mesmo lado do diafragma ou envolvimento localizado de uma região ou órgão extralinfático e um ou mais regiões de linfonodo de um mesmo lado do diafragma.
• Estágio 3: Envolvimento de regiões de linfonodos em dois lados do diafragma que pode vir acompanhado do envolvimento de outras regiões ou órgãos extralinfáticos e/ou baço.
• Estágio 4: Envolvimento difuso ou disseminado de um ou mais regiões ou órgãos extralinfáticos.
Segundo Goldman et al. (2009), o estadiamento da doença é fundamental para pautar uma adequada abordagem terapêutica, além de classificar quanto à severidade da patologia. A partir desta classificação, o tratamento do LH pode ou não ser associado à radioterapia nas regiões afetadas.
O tratamento padrão do LH, inclusive para pacientes em estágios avançados, é feito através da quimioterapia (QT). A partir de 1975, o protocolo de tratamento mais aceito é composto pelos fármacos adriamicina, bleomicina, vimblastina e decarbazina, denominado como protocolo ABVD (BONADONNA et al., 1975;; CANELLOS et al., 1992). A administração do método ABVD apresenta uma maior eficácia quando comparado a outros métodos de QT, além de uma taxa de sobrevida similar (CANELLOS et al., 1992;; CANELLOS e NIEDZWIECKI, 2002).
Apesar de serem considerados seguros, o tratamento com QT e radioterapia, assim como a própria patologia, promovem a ocorrência de diversos efeitos colaterais durante e após a intervenção terapêutica, além de uma maior possibilidade de desenvolver neoplasias secundárias (BONADONNA et al., 1975;; CANELLOS e NIEDZWIECKI, 2002;; HODGSON, 2008). A severidade dos efeitos colaterais tanto durante o tratamento como após seu término depende da própria severidade da patologia, posto que indivíduos em estágios avançados são expostos a um tratamento mais agressivo (CELLA e TROSS, 1986).
Segundo Machado e Sawada (2008), os efeitos colaterais presentes durante o tratamento são, predominantemente, náuseas e vômitos, dor, fraqueza muscular acompanhada de uma fadiga severa, reduções nas funções cognitivas e alterações
emocionais. São observadas também a disfunção gonodal e a toxicidade da medula óssea, tornando maior o risco de se desenvolver leucemia após o tratamento (NIXON e AISENBERG, 1974;; SANTORO et al., 1987).
De forma crônica, os efeitos colaterais tardios proporcionam grande impacto na qualidade de vida e na saúde do sobrevivente em virtude de alterações metabólicas, hormonais, morfológicas, cardíacas e neurais, como o aumento da cardiotoxicidade e da neurotoxicidade (BOIVIN et al., 1992;; HEIDENREICH et al., 2003;; TARLACI, 2008). Em virtude das diversas alterações físicas, fisiológicas e psicológicas promovidas pela patologia, sobreviventes de câncer tendem a apresentar, de forma tardia, a caquexia, redução da capacidade de concentração e desenvolvimento cognitivo, depressão, ansiedade, distress psicológico, alterações na qualidade do sono, redução do apetite e desconforto físico, gerado pela própria fadiga, pela redução da força muscular e do tecido muscular esquelético (CELLA e TROSS, 1986;; ZEBRACK et al., 2002;; AL-MAJID e WATERS, 2008;; DIAZ et al., 2008;; HARTMAN et al., 2008;; THORNTON et al., 2010;; BERGER et al., 2012;; NEIL-SZTRAMKO et al., 2014;; WANG et al., 2014;; KLUTHCOVSKY e URBANETZ, 2015;; MCCABE et al., 2015;; SALIGAN et al., 2015;; SHA et al., 2015;; WANG e WOODRUFF, 2015). Essas complicações tardias, promovidas pelas alterações geradas pela patologia ou pelo seu tratamento, reduzem significativamente a qualidade de vida e a capacidade funcional do sobrevivente (JENSEN et al., 2013;; DANIELS et al., 2014;; VERMAETE et al., 2014).
3.2. Fadiga Relacionada ao Câncer
A manifestação de uma fadiga prolongada e significativa em sobreviventes, quando comparados a indivíduos saudáveis pareados por sexo e idade, é bem documentada em indivíduos após tratamento de câncer de mama (KLUTHCOVSKY e URBANETZ, 2015) e em indivíduos após tratamento de linfoma (DANIELS et al., 2014). A Fadiga Relacionada ao Câncer (FRC) é reportada em 50% - 90% dos sobreviventes e está associada a outros efeitos adversos tardios, como depressão e ansiedade (CAMPOS et al., 2011;; DANIELS et al., 2014).
Segundo Stasi et al. (2003), apesar de uma prevalência bem documentada e estabelecida, as dificuldades no entendimento e, consequentemente, no tratamento da fadiga vivenciada por sobreviventes se iniciam na definição da patologia, em
virtude da característica multifatorial e da ausência de esforço físico como causa do sintoma. Em virtude desta dificuldade, o National Comprehensive Cancer Network (NCCN) definiu a FRC como uma patologia distressante, persistente, composta por uma sensação subjetiva de cansaço ou exaustão física, emocional e/ou cognitiva relacionada ao câncer ou ao seu tratamento, que não é proporcional as atividades recentes e interfere na funcionalidade habitual (MOCK et al., 2000).
Portanto, a FRC se caracteriza por uma sensação subjetiva de fadiga e exaustão vivenciada por pacientes com câncer, que não é amenizada com o repouso, promovendo um efeito depressor no aspecto físico, emocional e mental (BENNETT et al., 2004). Dados recentes demonstram que tanto pacientes acometidos pelo câncer em tratamento quanto pacientes em sobrevida apresentam essa fadiga (WANG et al., 2014). Nesse sentido, a ocorrência da FRC está relacionada à própria patologia e a seus tratamentos, pois as alterações na resposta inflamatória e nos processos neuroimunes são induzidas por mecanismos biológicos comuns (CLEELAND et al., 2003).
Diversos estudos buscaram relacionar a FRC a alterações bioquímicas que pudessem explicar os sintomas. Em uma recente revisão, Saligan et al. (2015) apontaram uma relação estreita da fadiga com o aumento na concentração de IL-6, TNF-α e PCR, demonstrando um quadro inflamatório constante em pessoas com câncer. Da mesma forma, Sha et al. (2015) apontaram a existência de uma correlação positiva entre os níveis de TNF-α e IL-1 e a severidade da FRC, indicando inclusive a possibilidade de avaliar a fadiga através de exames bioquímicos, estimando os efeitos adversos e promovendo um tratamento quimioterápico individual.
Além disso, a FRC se relacionou significativamente com alterações nas funções metabólicas e endócrinas, sugerindo que variações na secreção do hormônio adrenocorticotrófico (ACTH), epinefrina, noraepinefrina e cortisol se relacionam com o aparecimento de dor e depressão (THORNTON et al., 2010). Adicionalmente, a desregulação na liberação de cortisol ao longo do dia, evidenciada por um declínio atenuado no período noturno e uma secreção elevada durante o dia, afeta a dimensão física da fadiga, mas não as dimensões cognitiva e afetiva (SCHMIDT et al., 2016). Em virtude das alterações imunes, metabólicas e neuroendócrinas, a fisiopatologia da FRC sugere ser uma cascata ordenada e cíclica de eventos que compreende o aumento na produção de citocinas pró-infamatórias, a disfunção na ativação do eixo hipotálamo-hipófise-adrenal, a desregulação metabólica e endócrina,
a alteração no ritmo circadiano, e anormalidades nas funções neuromusculares (SALIGAN et al., 2015).
Nesse sentido, a ineficiência na atividade metabólica causada pelo câncer e pelo seu tratamento, através do aumento da necessidade energética, da diminuição da oferta de substrato e de oxigênio e do acúmulo anormal e acentuado de metabólitos como o H+, se caracteriza como uma potencial causa da fadiga, gerando efeitos negativos no metabolismo, produção de energia e atividade muscular (WANG e WOODRUFF, 2015). Tal ineficiência metabólica parece ocorrer em virtude da potencialização e da predominância do metabolismo glicolítico, pois células tumorais, linfócitos, enterócitos e células medulares do rim continuam a converter glicose em lactato e H+ mesmo na presença de oxigênio, fenômeno denominado “efeito Warburg” (SWIETACH et al., 2014).
Por outro lado, Rovigatti (2012) aponta uma possível relação entre a FRC e a Síndrome da Fadiga Crônica, por compartilharem diversas características. Dentre as características em comum, os sintomas semelhantes, os potenciais mecanismos de exacerbação da doença, o envolvimento do sistema nervoso central e periférico, o impacto negativo e considerável na qualidade de vida e na funcionalidade e o fator subjetivo parecem ser fundamentais para a caracterização da FRC como uma síndrome. Nesse sentido, a influência da FRC nos níveis de qualidade de vida relacionada a saúde, nas funções físicas e cognitivas parecem preponderantes (ANDRADE;; SAWADA e BARICHELLO, 2013).
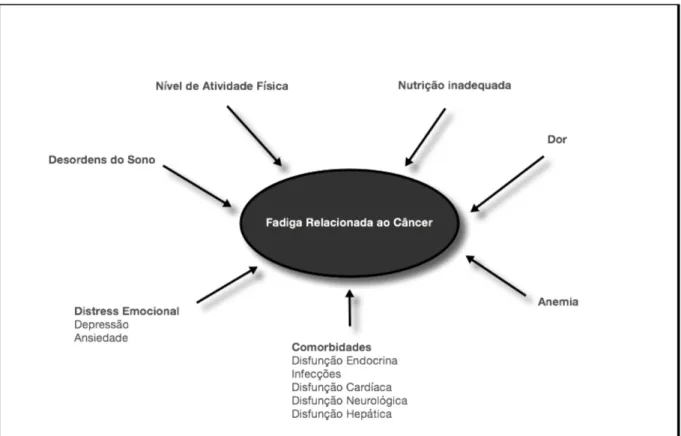
A partir da definição e da caracterização da FRC, ainda que limitadas e subjetivas, torna-se possível desenvolver a intervenção tratativa. O tratamento de condições que podem contribuir para a FRC, como as desordens metabólicas, depressão, dor, anemia e outras comorbidades não relacionadas diretamente ao câncer (Figura 2) é um primeiro passo e o objetivo usual das intervenções, inclusive farmacológicas (CARROLL et al., 2007). De modo geral, as intervenções farmacológicas mais utilizadas estão direcionadas na administração de estimuladores de hematopoese, psicoestimulantes, antidepressivos, corticoesteróides, suplementação de L-carnitina e estimulantes do sistema nervoso central (CARROLL et al., 2007;; WANG e WOODRUFF, 2015).
Entretanto, a partir de um novo entendimento da fadiga como consequência de alterações e disfunções nos mecanismos de produção e depleção de energia, sejam eles morfológicos, metabólicos, hormonais e/ou neurais, dependentes de um equilíbrio
entre processos anabólicos e catabólicos, novas abordagens terapêuticas foram propostas e têm obtido sucesso, como a intervenção nutricional, psicológica e a prática de exercícios físicos (WINNINGHAM, 2001;; KIRSHBAUM, 2010;; WANG e WOODRUFF, 2015).
Figura 2 Fatores tratáveis que contribuem para a FRC.
Figura adaptada de CARROLL et al. (2007).
Nesse sentido, uma recente metanálise avaliou o efeito do exercício físico supervisionado na FRC de sobreviventes de câncer de mama (MENESES-ECHÁVEZ;; GONZÁLEZ-JIMÉNEZ e RAMÍREZ-VÉLEZ, 2015). Este consistente trabalho analisou nove ensaios clínicos randomizados compostos por diferentes programas de exercício: exercício aeróbico associado ao exercício de força (CAMPBELL et al., 2005;; MUTRIE et al., 2007;; CANTARERO-VILLANUEVA et al., 2013;; ERGUN et al., 2013);; somente exercício aeróbico (SEGAL et al., 2001;; COURNEYA et al., 2003;; SAARTO et al., 2012);; somente exercício de força (WINTERS-STONE et al., 2012) ou exercício aeróbico, de força e alongamento (MILNE et al., 2008). Seus resultados demonstram a segurança e a eficácia da atividade física na redução da FRC e, consequentemente, no aumento dos indicadores de qualidade de vida.
Em estudos de mesma linha com sobreviventes de canceres hematológicos, a intervenção a partir do exercício físico aeróbico em sobrevivente de LH também se mostrou eficiente na redução da FRC ao interromper o ciclo de inatividade física, redução da capacidade física e aumento da fadiga (OLDERVOLL et al., 2003). Na mesma linha, a associação entre exercício aeróbico e exercício resistido também proporciona a redução da FRC, acompanhada de um aprimoramento da função cardiovascular, da redução da depressão e do aumento da capacidade muscular (BATTAGLINI et al., 2009).
O treinamento de força promove também o aumento da massa livre de gordura, da síntese proteica e da força de contração, reduzindo o efeito da perda do tecido muscular esquelético relacionado ao câncer e aumentando a qualidade muscular (proporção entre gordura intramuscular e tecido contrátil) (LIU et al., 2009). Consequentemente, a amenização da perda de tecido muscular ou até mesmo o aumento da massa magra promovem a redução da FRC, apontando, mesmo que indiretamente, uma possível associação entre massa livre de gordura e fadiga (GALVAO e NEWTON, 2005).
3.3. Redução do Tecido Muscular Esquelético Relacionada ao Câncer
A redução do tecido muscular esquelético relacionado ao câncer é caracterizada por ser uma síndrome multifatorial que promove um decréscimo progressivo no desempenho físico, capacidade funcional e qualidade de vida do sobrevivente. Sua fisiopatologia é caracterizada pelo desequilíbrio entre síntese muscular e degradação tecidual, relacionado à uma ingestão inadequada e a alterações negativas no metabolismo energético, podendo ou não fazer parte da caquexia (CORONHA;; CAMILO e RAVASCO, 2011).
A perda de tecido muscular acompanhada por uma potencialização da lipólise, atrofia muscular, anorexia, náusea crônica e astenia acomete 80%-90% dos sobreviventes, contribuindo para a redução da qualidade de vida e aumento da morbidade, podendo levar ao óbito (DUVAL et al., 2010). Segundo da Silva (2006), a redução na quantidade e/ou qualidade tecidual é promovida por alterações metabólicas, entre elas o efeito “Warburg”, alterações hormonais, como a redução da secreção de insulina e leptina, alterações inflamatórias, como o aumento da liberação de citocinas pro-inflamatórias e alterações sensoriais.
As alterações metabólicas ocorridas no câncer estão relacionadas tanto ao déficit de oxigênio (hipóxia) promovido pelo tumor quanto às modificações naturais da patologia, o que gera disfunções no funcionamento e biologia celular através do aumento na expressão do fator induzido por hipóxia (HIF1α) (SWIETACH et al., 2014). Uma menor taxa de sobrevivência aos canceres de pulmão, mama, estomago, esôfago, cabeça e pescoço está fortemente relacionada a uma alta expressão do HIF1α (MARIN-HERNANDEZ et al., 2009).
Em um dos estudos mais abrangentes sobre o tema, Al-Majid e Waters (2008) definem a perda de tecido muscular esquelético relacionada ao câncer como uma redução involuntária maior que 5% do peso corporal em um período de até seis meses que ocorre em função de um desequilíbrio entre a síntese de proteínas e a degradação de proteínas musculares. Em seu estudo, os autores detalham os mecanismos de redução da síntese e da degradação proteica. Nesse sentido, a redução da síntese de proteínas musculares esqueléticas parece estar relacionada a secreção tumoral do fator de indução da proteólise (PIF), que inibe a translação proteica inicial (ELEY;; RUSSELL e TISDALE, 2007). Por outro lado, o PIF também induz a degradação tecidual, favorecendo a redução da massa livre de gordura (COSTELLI et al., 2005;; AL-MAJID e WATERS, 2008).
Nesse sentido, o metabolismo muscular oxidativo, altamente dependente da função mitocondrial, e o metabolismo muscular glicolítico desempenham papel fundamental na síntese energética e na mobilização de substratos, se mostrando determinante na redução do tecido muscular esquelético relacionado ao câncer. Em sobreviventes, a perda do conteúdo mitocondrial nos músculos e a consequente redução na capacidade oxidativa estão fortemente associadas, inclusive em relação de causa e efeito, a redução tecidual (CARSON;; HARDEE e VANDERVEEN, 2015).
Adicionalmente, a função mitocondrial também parece ser influenciada pela secreção acentuada e constante de citocinas pro-inflamatórias, promovendo um quadro inflamatório sistêmico (MCLEAN;; MOYLAN e ANDRADE, 2014). Esta inflamação sistêmica promove a produção de Espécies Reativas de Oxigênio (EROs), gerando disfunção e morte mitocondrial (SMITH, I.J. et al., 2014). Adicionalmente, as alterações metabólicas que promovem um ambiente ácido e pobre em oxigênio também contribuem para a formação de EROs, promovendo também a perda de massa muscular esquelética (KLIMOVA e CHANDEL, 2008).
Outro fator que contribui para a disfunção mitocondrial e para a redução do tecido muscular esquelético é a alteração na secreção de hormônios sexuais. A regulação das funções gonodais é cíclica, e diretamente afetada pela patologia, pela composição corporal e pelo equilíbrio energético. Entretanto, a própria secreção hormonal desregulada, caracterizada por baixa produção de testosterona e estrogênio, promove a redução da massa muscular esquelética, o desequilíbrio energético e a capacidade de regeneração, afetando o volume muscular, a resistência a insulina e a inflamação (MCCLUNG et al., 2006;; BURNEY e GARCIA, 2012;; BURNEY et al., 2012;; CARSON et al., 2015).
A importância do tecido muscular esquelético em indivíduos com câncer está relacionada a redução da toxicidade da quimioterapia, possibilitando um melhor prognóstico em sobreviventes. Em sentido oposto, a redução da massa magra é um fator de risco para o desenvolvimento de neoplasias secundárias e doenças metastáticas, aumento da morbidade e da mortalidade dos sobreviventes (TSAI, 2012;; SJOBLOM et al., 2015).
Em virtude desta importância, a prática do exercício físico é proposta a fim de reduzir a perda de tecido muscular e os efeitos deletérios consequentes. De forma específica, o exercício resistido tem sido apontado como potencial intervenção no desenvolvimento da massa muscular, além de reduzir os processos catabólicos (AL- MAJID e MCCARTHY, 2001). Nesse sentido, Lonbro (2014) propõe a realização do exercício resistido progressivo como uma evidência moderada da reconstrução do tecido muscular esquelético. Além disso, o treinamento de força é capaz de promover o aumento da capacidade de contração, pois tal perda favorece a redução da força muscular e da capacidade funcional, reduzindo a responsividade ao tratamento e potencializando a taxa de mortalidade (ATTAIX et al., 2005;; MUSCARITOLI et al., 2006;; STEWART et al., 2006;; BATTAGLINI et al., 2014).
3.4. Força Muscular
A redução da força muscular é uma das consequências mais severas associadas à redução do tecido muscular esquelético e à caquexia (STENE et al., 2013). Esta redução promove um declínio na qualidade de vida, nas funções físicas e na realização das atividades diárias, além de colaborar para o aumento do risco de queda e do desenvolvimento de comorbidades (STEWART et al., 2006;; KEOGH e
MACLEOD, 2012). Adicionalmente, os prejuízos na capacidade funcional induzidos pela redução da força muscular se relacionam de forma cíclica com a fadiga e com as dores (SIEFERT, 2010).
De forma geral, a redução da força muscular em sobreviventes de câncer apresenta como causa principal a perda de tecido muscular esquelético (MUSCARITOLI et al., 2006). Nesse sentido, os mecanismos fisiopatológicos parecem ser compartilhados, se apresentando em uma sequencia de eventos recorrente, promovendo um desequilíbrio entre síntese e degradação proteica. Estes eventos podem ser caracterizados pelo declínio na expressão e fosforilação de sinalizadores de síntese de proteínas mTOR e p70s6k, pela elevação da concentração do fator de indução da proteólise, secretado pelo tumor, e citocinas pró-inflamatórias, e, por fim, pelo decréscimo na atividade muscular contrátil (AL-MAJID e WATERS, 2008). Esses mecanismos parecem ser induzidos tanto pela patologia quanto pelo tratamento (CLEELAND et al., 2003;; AL-MAJID e WATERS, 2008;; SIEFERT, 2010).
Desta forma, estudos que investigam a força muscular em sobreviventes, apontam um declínio da função muscular em comparação com indivíduos saudáveis. Muratt et al. (2011) avaliaram a força de extensão de joelho no dinamômetro isocinético, em uma velocidade de 60º/s, de 10 crianças (13,9 ± 1,5 anos) em tratamento para leucemia linfoide aguda e compararam com crianças saudáveis pareadas por sexo, idade e IMC. Seus resultados apontam a redução de 29,8% e 30,8% do pico de torque na extensão do membro direito e esquerdo, respectivamente. Nesse sentido, os autores sugerem a presença relevante da fraqueza muscular em virtude de diversos fatores combinados, como: limitações na função neuropsicológica, distúrbios motores, alterações nas funções endócrina e cardíaca e da própria redução da atividade (LUCIA et al., 2005;; MURATT et al., 2011).
Adicionalmente, as alterações hormonais presentes em sobreviventes de leucemia linfoide aguda, expostos a radioterapia e a quimioterapia, são causadas por uma deficiência na ação da hipófise e uma consequente redução na secreção dos hormônios do crescimento (GH), luteinizante (LH), estimulante da tireóide (TSH), adrenocorticotrófico (ACTH) e folículo estimulante (FSH). Essas alterações são proporcionais à severidade do tratamento e promovem, além da fraqueza muscular, alterações na distribuição de gordura corporal, balanço energético negativo, diminuição da tolerância ao exercício, distúrbios de equilíbrio e fadiga, persistindo por mais de 20 anos (SIMPSON, 2015). Coincidentemente, o desequilíbrio nas funções
da glândula hipófise também se relaciona com a presença e a severidade dos sintomas da FRC, sugerindo possíveis mecanismos semelhantes (THORNTON et al., 2010;; SALIGAN et al., 2015).
Ao se analisar especificamente sobreviventes de linfoma, Vermaete et al. (2014) avaliaram 29 sobreviventes, sendo 17 de linfoma não Hodgkin e 12 de LH, quanto às capacidades físicas antes, durante e cinco semanas após o tratamento. Seus resultados apontam uma redução significativa tanto do pico de torque da extensão de joelho quanto da força de preensão manual após o término da intervenção tratativa, em virtude de um aumento da miotoxicidade, da secreção do fator de necrose tumoral e da redução da atividade física. Entretanto, os autores sugerem que os efeitos de destruição da quimioterapia e da patologia são dominantes em relação aos efeitos da atividade física, posto que a interrupção desta foi temporária, mas a redução de força ocorreu durante todo o tempo (VERMAETE et al., 2014).
O declínio da força muscular em sobreviventes parece ser influenciado pela gordura corporal, posto que indivíduos obesos apresentam, após 13 meses do diagnóstico de câncer de mama, a força muscular reduzida quando comparados com indivíduos eutróficos ou com sobrepeso (CANTARERO-VILLANUEVA et al., 2015). Esses resultados podem ser explicados por alterações metabólicas induzidas pelo acúmulo de gordura e por uma possível facilitação a sarcopenia (ABDUL-GHANI e DEFRONZO, 2010;; PRADO et al., 2013;; CANTARERO-VILLANUEVA et al., 2015).
3.5. Qualidade Muscular
A instauração e potencialização da fadiga crônica, denominada Fadiga Relacionada ao Câncer, e a redução do tecido muscular esquelético em sobreviventes de diversos tipos de câncer, durante e após o término do tratamento, já são bem documentadas e se relacionam de forma cíclica com o declínio da força muscular (AL- MAJID e WATERS, 2008;; SIEFERT, 2010;; STENE et al., 2013). Entretanto, o entendimento da qualidade muscular (QM) como determinante da força perece restrito e limitado em sobreviventes (GORSELINK et al., 2006).
De forma geral, estudos que avaliaram a QM através da Echo Intensity (EI) e relacionaram essa medida com a capacidade de produzir força são recentes (CADORE et al., 2012;; FUKUMOTO et al., 2012;; WATANABE et al., 2013;; RECH et
al., 2014). A EI é uma medida não invasiva, analisada através de uma imagem transversal captada por um ultrassom, que avalia a proporção entre tecido não contrátil, como gordura, e fibras contráteis funcionais através de escalas de cinza (WATANABE et al., 2013).
Nesse sentido, Fukumoto et al. (2012) avaliaram a QM através da EI, a espessura e a força muscular do quadríceps femural em indivíduos de meia idade e idosos. Seus resultados apontam que a EI, apesar de ser influenciada pela idade, posto que o envelhecimento provoca a redução de tecido contrátil e o aumento de gordura intramuscular, se associou de forma independente com a força muscular. Desse modo, os autores sugerem que a QM seja determinante na capacidade de produzir força independentemente da própria quantidade muscular avaliada pela espessura do reto femoral.
Estes resultados foram confirmados por Watanabe et al. (2013), ao apontarem que as alterações na qualidade muscular induzidas pelo envelhecimento afetam de forma independente a força máxima, mesmo quando controladas as variáveis relacionadas a quantidade muscular e a composição corporal. Adicionalmente, a EI parece se relacionar a outros indicadores de aptidão física, como os limiares ventilatórios e à própria capacidade cardiorrespiratória, além da força muscular em indivíduos idosos (CADORE et al., 2012)
Por outro lado, a redução da QM pode representar um determinante da força mais precisa, pois a infiltração de tecido não contrátil relacionada ao envelhecimento e a presença de patologias pode não evidenciar a redução da espessura muscular e mascarar uma perda real de tecido muscular esquelético e uma redução na função contrátil (LOPEZ et al., 2015). Portanto, a QM parece ser uma medida mais importante e significativa na força muscular e demais aptidões físicas, por refletir a capacidade funcional real do tecido analisado (RADAELLI et al., 2011;; RECH et al., 2014).
Nesse sentido, tanto a QM quanto a própria espessura muscular se alteram na presença de patologias. Indivíduos com síndrome pós-pólio apresentam uma redução considerável de força, volume muscular e QM comparados com indivíduos saudáveis pareados por sexo e idade (BICKERSTAFFE et al., 2015). Adicionalmente, indivíduos com doença pulmonar obstrutiva crônica apresentam uma maior infiltração intramuscular de tecido adiposo, um declínio na quantidade muscular e, por consequência, na capacidade de produção de força (ROBLES et al., 2015).