UNI VERSI DADE DE BRASÍ LI A
I NSTI TUTO DE CI ÊNCI AS BI OLÓGI CAS DEPARTAMENTO DE BI OLOGI A CELULAR
PÓS GRADUAÇÃO EM BI OLOGI A MOLECULAR
R
ESOLUÇÃO DA ESTRUTUR A
TRI D I M EN SI ON AL D O I NI BI DOR
TRÍ PTI CO E QUI M OTRÍ PTI CO DE
V
I GN A UN GUI CULATA EM COM PLEXOS
BI N ÁRI O E TERN ÁRI O
.
Gisele Ferreira Est eves
UNI VERSI DADE DE BRASÍ LI A
I NSTI TUTO DE CI ÊNCI AS BI OLÓGI CAS DEPARTAMENTO DE BI OLOGI A CELULAR
PÓS-GRADUAÇÃO EM BI OLOGI A MOLECULAR
R
ESOLUÇÃO DA ESTRUTUR A
TRI D I M EN SI ON AL D O I NI BI DOR
TRÍ PTI CO E QUI M OTRÍ PTI CO DE
V
I GN A UN GUI CULATA EM COM PLEXOS
BI N ÁRI O E TERCI ÁRI O
.
Dissertação apresentada ao
Departam ento de Biologia
Celular do I nstituto de
Ciências Biológicas da
Universidade de Brasília,
com o requisito parcial à
obtenção do grau de doutor
em Biologia Molecular.
Gisele Ferreira Est eves
Orientadora
Prof
aDr
aSonia M. de Freitas
Co-orient ador
Prof. Dr. João Alexandre Barbosa Guim arães
Aos m eus pais, m inha irm ã
AGRAD ECI M EN TOS
Prim eiram ent e agradeço a professora Dra. Sonia Maria de Freit as, por t udo. Nada disso t eria sido possível se você não t ivesse m e abert o as port as do seu laborat ório, da sua casa, da sua vida. Obrigada por t odo o aprendizado e pelo seu exem plo de vida e pelos diversos conselhos nos m om ent os difíceis.
Agradeço aos m eus pais, Carlos e Regina, pela sólida form ação, pelo incent ivo sem pre carinhoso e pelo apoio durant e t odos os m eus est udos. Essa vit ória t am bém é de vocês!
Ao m eu noivo, Adem ar, pela sua com preensão e abdicação do t em po que t em os de convívio, em prol de realização dest e t rabalho, encoraj ando - m e a prosseguir na execução dest a t ese. Sua presença foi a grande responsável pela m inha saúde afet iva.
À m inha irm ã, Geisa, pelo carinho e am izade em t odos os m om ent os.
Ao prof. João Alexandre por t oda a colaboração e pelo auxílio na m inha est ada no LNLS.
Aos professores Beat riz, Eliane, Jaim e e Luciano pelos preciosos com ent ários e t oda a colaboração nest a t ese.
A t odo o pessoal do laborat ó rio, pela convivência, t ant o nos m om ent os duros de t rabalho com o nos m om ent os de diversão. Aos com panheiros que cont ribuíram de m uit as form as: Adelson, Alice, Larissa, Muriele, Graziela, Crist iano, Sandriele e Evert on.
Aos m eus am igos, que souberam ent ende r os m om ent os em que eu t ive de est ar ausent e: ao pessoal do anim e, ao pessoal do j aponês. Vocês são ót im os.
Aos m eus colegas de t rabalho: Beat riz, Hayslla, Rachel, Daniele, Marcus, Andre, Renat o, Luciana. Obrigada pela força.
E a t odos os out ros que não est ão cit ados, m as não esquecidos, e que de algum a form a deram a sua cont ribuição para que est a t ese fosse realizada.
RESUM O
ABSTRACT
SUM ÀRI O
AGRADECI MENTOS ... - 4 -
RESUMO ... - 6 -
ABSTRACT ... - 7 -
SUMÀRI O ... - 8 -
LI STA DE FI GURAS ... - 10 -
LI STA DE TABELAS ... - 14 -
LI STA DE ABREVI AÇÕES E SI GLAS ... - 15 -
1.1 Prot eases... 17
1.1.1 Serinoprot eases... 18
1.2 I nibidores de proteases ... 23
1.2.1 Aspectos Gerais ... 23
1.2.2 Modo de ação dos inibidores ... 28
1.2.3 Fam ília Bowm an-Birk ... 30
1.2.4 Estrutura dos inibidores de protease... 33
1.2.5 I m portância dos inibidores de protease... 35
1.3 Obj eto de estudo... 38
2 JUSTI FI CATI VA... 43
3 OBJETI VOS GERAI S ... 46
3.1 Obj et ivos específicos... 46
4 MATERI AI S E MÉTODOS... 47
4.1 Obtenção do extrato bruto de Vigna unguiculat a... 47
4.2 Purificação do btci ... 47
4.3 Obtenção e purificação dos com plexos ... 47
4.4 Cristalização dos com plexos ... 48
4.5 Coleta de dados ... 49
4.6 Construção do m odelo... 51
4.7 Refinam ento do m odelo ... 52
4.8 Análise do m odelo ... 54
4.9 Espectroscopia de fluorescência dinâm ica ... 55
4.10 Estabilidade térm ica ... 58
5. RESULTADOS E DI SCUSSÃO ... 60
5.1 Purificação do BTCI ... 60
5.2 Purificação dos com plexos binários ... 60
5.3 Coleta e processam ento de dados da difração de raios-X do com plexo binário com tripsina ... 63
5.4 Construção do m odelo da estrutura tridim ensional do com plexo binário com t ripsina ... 63
5.5 Análise do m odelo da estrutura tridim ensional do com plexo binário com t ripsina ... 66
5. 6 Obtenção e purificação do com plexo ternário... 76
5.7 Colet a e processam ent o de dados da difração de raios X do com plexo ternário... 77
5.8 Construção do m odelo da estrutura tridim ensional do com plexo t ernário... 78
5.9 Análise da região de interface da tripsina... 86
5.11 Análise das diferenças na estrutura tridim ensional observadas
com a alteração do pH... 98
5.12 Análise do tem po de vida de fluorescência... 105
5.12.1 Com plexo binário com a tripsina ... 109
5.12.2 Com plexo binário com a quim otripsina ... 112
5.12.3 Com plexo t ernário ... 115
5.12.4 BTCI livre... 119
5.13 Dicroísm o circular ... 124
7 CONCLUSÃO ... 134
8 REFERÊNCI AS BI BLI OGRÁFI CAS ... 136
LI STA DE FI GURAS
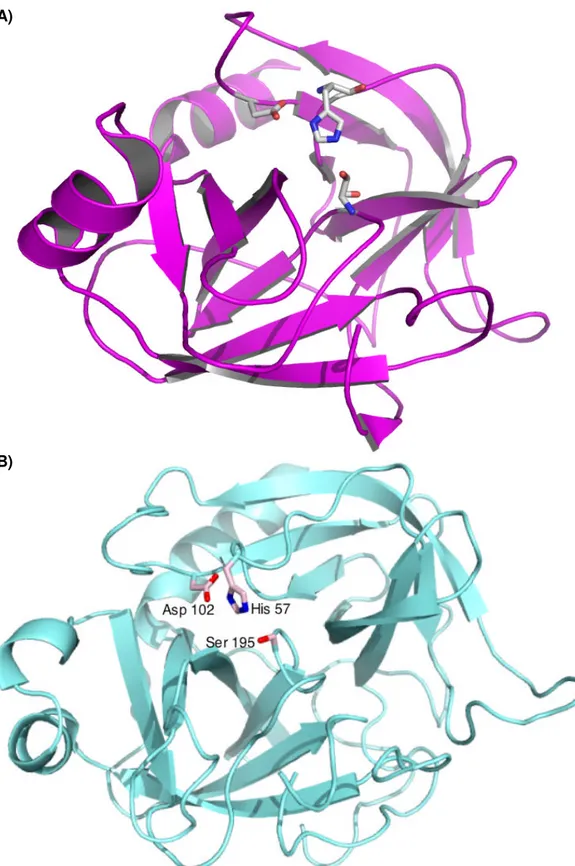
Figura1 . Estrutura tridim ensional da A) tripsina ( PDB: 2ptc) e B) da quim ot ripsina ( PDB: 4cha) os resíduos da t ríade cat alít ica, Hist idina 57, Aspartato 102 e Serina 195 estão destacados.
Figura 2 . Represent ação das est rut uras dos inibidores com loops
canônicos e resíduos P1 destacados em verm elho. A estrutura secundaria est á colorida em azul ( folhas-β) e verde (α-hélice). Nom e da fam ília do inibidor em negrit o e nom e do represent ant e indicado logo abaixo. Adapt ado de (Krowarsch et . al., 2003).
Figura 3: Est rut ura t ridim ensional da superfície da t ripsina
( m agent a) com o BBI na fenda. A set a verm elha indica o local de clivagem da ligação pept ídica, a ligação dissulfet o que m ant ém o inibidor associado à enzim a está em laranj a ( PDB: 1tx6) .
Figura 4 . Est rut ura t ridim ensional de um inibidor da fam ília bowm an birk isolado de soj a ( PDB: 1bbi) . Em m agenta, os dois sítios reativos ( P1, lisina e fenilalanina) .
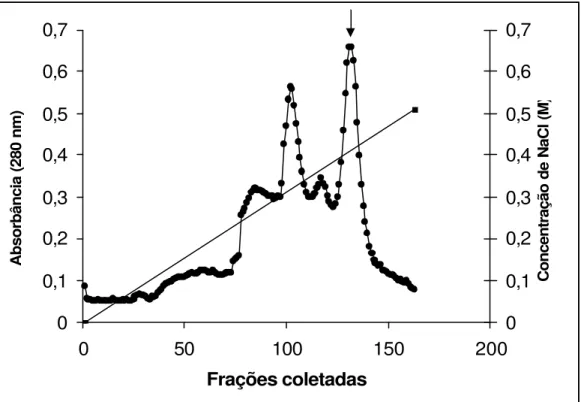
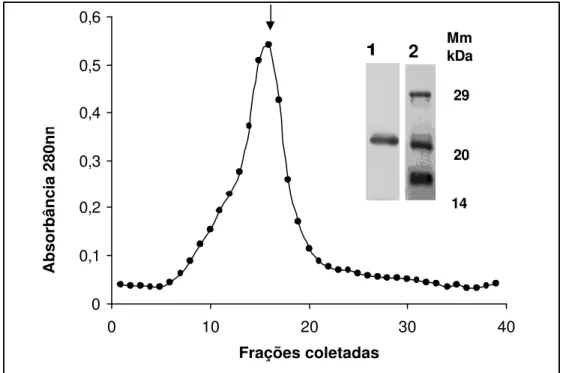
Figura 5 . Crom atografia de troca iônica indicando a eluição do BTCI .
Figura 6 . Crom at ografia de exclusão molecular do com plexo binário com t ripsina do BTCI . A set a indica a eluição do com plexo. Figura inser ida: Gel de poliacrilam ida 12% desnat urant e. Poço 1: com plexo binário da β-tripsina (~ 24kDa) com o BTCI (10 kDa) , Poço 2: Marcadores m oleculares (Mm) , anidrase carbônica ( 29 kDa) , inibidor
de soj a BBI ( 20kDa) , m ioglobina ( 14kDa) .
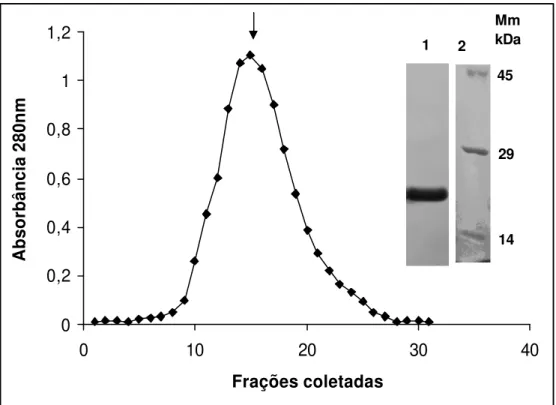
Figura 7 . Crom at ografia de exclusão m olecular do com plexo binário com quim ot ripsina do BTCI . A set a indica a eluição do com plexo. Figur a inser ida: Gel de poliacrilam ida 12% desnaturant e. Poço 1: com plexo binário da α-quim otripsina ( ~ 25kDa) com o BTCI ( 10 kDa) . As bandas acim a da quim ot ripsina ( banda m ais fort e) correspondem ao com plexo e a agregados; Poço 2: Marcadores m oleculares (Mm) , ovoalbum ina ( 45 kDa) , anidrase carbônica ( 29
kDa) , m ioglobina ( 14kDa).
Figura 8 . Alinham ent o seqüencial do inibidor de Phaseolus angularis ( PDB 1TAB cadeia I ) , com o BTCI ( PDB 2G81, cadeia I ) .
Figura 9 . Modelo da est rut ura do com plexo BTCI ( verde) com a t ripsina ( m agent a) incluindo as águas crist alográficas ( verm elho) PDB: 2G81.
Figura 1 0 . Pot encial elet rost át ico da superfície da t ripsina e do BTCI .
A) Superfície da tripsina evidenciando a carga negativa do bolsão cat alít ico, represent ação em fit as (ribbon) da cadeia principal do BTCI em am arelo. B) Superfície do BTCI evidenciando a carga posit iva da Lisina 26, represent ação em fit as (ribbon) da cadeia principal da t ripsina em m agent a.
e W2. Os resíduos da t ríade cat alít ica da enzim a ( His57, Asp102, Ser195) e o triptofano 215 estão evidenciados.
Figura 1 2 . I nt eração ent re o BTCI ( verde) região P2 a P9 e a t ripsina ( m agenta) m ostrando algum as das pontes de hidrogênio ( preto) .
Figura 1 3 . A) Região de int erface do com plexo BTCI -tripsina
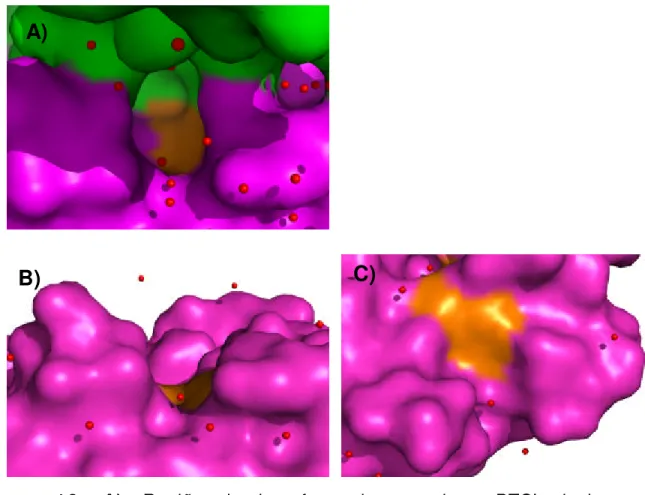
m ost rando a superfície do t ript ofano 215 da t ripsina ( visão lat eral em m agent a) e o BTCI em verde. B) Superfície do triptofano 215 ( visão lat eral) da t ripsina livre ( m agent a) . C) Superfície do t ript ofano 215 ( visão superior) da tripsina livre ( m agenta) .
Figura 1 4 . Crom atografia de exclusão m olecular do com plexo
t ernário do BTCI em Sephadex G-75 de 75 cm , fluxo de 25 m L/ h. A seta indica a eluição do com plexo ternário.
Figura 1 5 . Gel de poliacrilam ida 12% não desnat urant e. Poço 1 e 4: m arcadores m oleculares (Mm) , album ina sérica bovina ( 66 kDa) ,
ovoalbum ina ( 45 kDa) , anidrase carbônica ( 29 kDa) . Poço 2: com plexo ternário do BTCI ( ~ 55 kDa) .
Figura 1 6 . BTCI ( verde) em com plexo ternário com a tripsina ( rosa – bolsão em pret o) e a quim ot ripsina ( ciano – bolsão em cinza) em pH 7,5. Os sítios reativos do BTCI estão m ostrados em laranj a ( tripsina) e am arelo ( quim otripsina) . Os resíduos P1 do BTCI estão destacados em azul ( lisina 26) e verm elho ( fenilalanina 52) . Em oliva est ão as ligações dissulfeto do inibidor.
Figura 1 7 . Át om os do com plexo t ernário do BTCI ( verde - t raço) com a tripsina (rosa) e a quim otripsina (ciano) em pH 7,5. O detalhe m ostra a região entre as duas enzim as.
Figura 1 8. BTCI ( verde- fit as-β num eradas) em com plexo com a tripsina (rosa) e a quim otripsina (ciano) em pH 7,5. Em preto a distância entre a Lisina 26 ( azul) e Fenilalanina 53 ( laranj a) .
Figura 1 9 . I nteração entre o BTCI ( verde) m ostrando as cadeias lat erais dos resíduos P1-P6 e P1’ a P5’ e a tripsina ( m agenta) no com plexo t ernário m ost rando as várias ligações de hidrogênio ( pret o – t abela 8) com algum as águas ( esfera verm elha) . O sít io cat alít ico Histidina 57, Aspartato 102, Serina 195 está representado em cinza. Para m elhor visualização outras regiões foram om itidas.
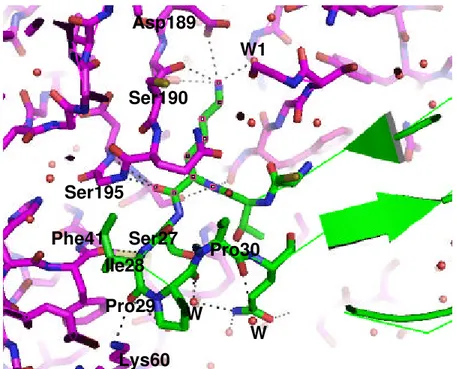
Figura 2 0. Mapa de densidade elet rônica da int erface de int eração ent re a lisina 26 do BTCI ( verde) com as águas W1 e W2 ( esfera verm elha) , o Aspart at o 189 e Serina 190 da t ripsina ( rosa) no com plexo t ernário, sít io cat alít ico, Histidina 57, Aspartato102, Serina 195 ( cinza) . Em am arelo um a ligação dissulfeto no BTCI . Para m elhor visualização out ras regiões foram om it idas.
Figura 2 1 . Resíduos responsáveis pela interação do inibidor com a enzim a - sobreposição da tripsina do com p lexo t ernário ( m agent a) com a tripsina livre ( laranj a – 2PTN Walter et . al., 1982).
Figura 2 2 . Mapa de densidade eletrônica do BTCI ( verde) em
com a quim ot ripsina ( cyano) e em dest aque estão os resíduos Trp171, Trp215, Val 225 ( cyano) e a tríade catalítica His57, Asp102 e Ser195 ( cinza) .
Figura 2 3 . Representação estrutural em superfície de van der Waals da interface do BTCI ( verde) em com plexo ( ternário) com o resíduo P1 Phe53 ( laranj a) em dest aque dent ro do bolsão da quim ot ripsina ( cyano) . Os resíduos Trp171, Trp215, e Val225 ( salm ão) e His57, Asp102 e Ser195 ( cinza) da quim ot ripsina são m ost rados. A set a verm elha indica a região da cadeia do inibidor a ser hidrolisada. Para m elhor visualização alguns trechos das m oléculas foram om itidos.
Figura 2 4 . Região de interface da quim otripsina ( azul) com o BTCI ( verde) em com plexo ternário, com o resíduo P1 Phe53 ( laranj a) em dest aque. As ligações de hidrogênio são m ost radas em linhas pret as t racej adas. As águas são exibidas com o esferas. Para m elhor visualização alguns t rechos das m oléculas foram om it idos, incluindo o sít io cat alít ico da enzim a.
Figura 2 5 . Resíduos da quim ot ripsina responsáveis pela int eração com o inibidor - sobreposição da quim ot ripsina do com plexo ternário ( verde) com a quim otripsina livre ( cyano – 4cha Tsukada e Blow, 1985).
Figura 2 6. Sobreposição da cadeia principal do BTCI em pH 7,5
( am arelo) e 4,5 ( verde) m ostrando os resíduos lisina 26 e fenilalanina 53.
Figura 2 7. Sobreposição da cadeia principal do BTCI em pH 7,5
( am arelo) e 4,5 ( verde) m ostrando as diferenças de conform ação das cadeias laterais dos resíduos arginina 21 e 33 e fenilalanina 60.
Figura 2 8 . Sobreposição da tripsina ( m agenta) em com plexo em pH 7,5 ( escuro) e 4,5 ( claro) m ost rando as diferenças na conform ação das cadeias lat erais dos am inoácidos. A cadeia principal est á m ost rada em t raço e foi evidenciada apenas a superfície dos resíduos selecionados.
Figura 2 9 . Sobreposição da quim ot ripsina ( azul) em com plexo em pH 7,5 ( escuro) e 4,5 ( claro) m ostrando as diferenças nas cadeias lat erais dos am inoácidos indicados. A cadeia principal est á m ost rada em t raço e foi evidenciada apenas a superfície dos resíduos selecionados.
Figura 3 0 . Gráfico da diferença de fase ( círculo) e da m odulação
( quadrado) obt idas em relação à fase ( verde) e m odulação calculadas ( azul) do m odelo em função da freqüência de m odulação em MHz para o t em po de vida do com plexo t ernário. Abaixo est ão represent ados os valores residuais após o aj uste para o m odelo bim odal discreto.
Figura 3 2 . Representação da superfície m olecular da tripsina e dos triptofanos ( em laranj a) . Triptofanos expostos ( A e B) e em interação com o solvente ( C a E) .
Figura 3 3. Represent ação da superfície m olecular da t ripsina e t ript ofanos ( em laranj a) evidenciando sua localização na superfície ( A) e sua exposição e int eração com o solvent e ( B) .
Figura 3 4 . Representação do com plexo binário com o BTCI ( verde) e a quim ot ripsina ( cyano) com os t ript ofanos ( 51, 141, 172, 207, 215 e 237) da enzim a coloridos em laranj a, evidenciados na superfície da m olécula (PDB de Freitas et .al., 1997).
Figura 3 5 . Represent ação do com plexo t ernário do BTCI ( verde) com a quim otripsina ( cyano) e a tripsina ( m agenta) com os t ript ofanos coloridos em laranj a, evidenciados na superfície da m olécula ou parcialm ent e ent errados.
Figura 3 6 . Representação do com plexo ternário do BTCI ( verde) com a quim otripsina ( cyano) e a tripsina ( m agenta) com os triptofanos da t ripsina coloridos em laranj a, evidenciando sua exposição ao
solvente.
Figura 3 7 . Represent ação do com plexo t ernário do BTCI (verde) com a quim otripsina ( cyano) e a tripsina ( m agenta) com os t ript ofanos da quim ot ripsina coloridos em laranj a, evidenciando sua exposição ao solvent e.
Figura 3 8. Superfície m olecular dos oligôm eros form ados pelo BTCI em dím ero ( A) , trím ero ( B) e hexâm ero ( C, D) com a região do triptofano colorida em laranj a, evidenciando sua localização na superfície da m olécula ( Modelos de Silva et . al., 2005) .
Figura 3 9 . Curvas de desnaturação térm ica das proteínas: tripsina, quim ot ripsina, BTCI em com plexo binário com quim otripsina, com tripsina e com plexo ternário com am bas as enzim as, em pH 7,0.
Figura 4 0 . Fração desnat urada t erm icam ent e das proteínas: tripsina, quim ot ripsina, BTCI em com plexo binário com quim ot ripsina, com tripsina e com plexo ternário com am b as as enzim as, em pH 7,0.
Figura 4 1 . Variação de energia livre de Gibbs (∆G) est im ada a part ir das curvas de desnat uração t érm ica das prot eínas: tripsina, quim ot ripsina, BTCI em com plexos binário com quim ot ripsina, tripsina, e com plexo ternário com am bas as enzim as, em pH 7,0.
Figura 4 2 . Gráfico de Van’t Hoff para a desnaturação térm ica da
LI STA DE TABELAS
Tabela 1 . Coleta de dados do com plexo BTCI - Tripsina e est at íst icas de refinam ento. Os valores entre parênteses correspondem aos dados relativos à últim a cam ada de resolução de 1,63 – 1,55o Å.
Tabela 2. Valor m édio dos fat ores de t em perat ura do BTCI em
com plexo com a Tripsina.
Tabela 3 . Contatos polares entre o BTCI , a tripsina e águas
selecionadas.
Tabela 4 . Coleta de dados do com plexo ternário em pH 7,5 e
est at íst icas de refinam ent o. Os valores ent re parênt eses correspondem aos dados relativos à últim a cam ada de resolução de 1,96 – 1,7o Å.
Tabela 5 . Coleta de dados do com plexo ternário em pH 4,5 e
est at íst icas de refinam ent o. Os valores ent re parênt eses correspondem aos dados relativos à últim a cam ada de resolução de 1,69 – 1,63o Å.
Tabela 6. Valor m édio dos fat ores de tem peratura do BTCI em
com plexo ternário em pH 7,5 .
Tabela 7. Valor m édio dos fat ores de t em perat ura do BTCI em
com plexo ternário em pH 4,5.
Tabela 8 . Contatos polares entre o BTCI , a tripsina e águas
selecionadas no com plexo ternário.
Ta be la 9. Contatos polares entre o BTCI , a quim otripsina e águas selecionadas no com plexo ternário.
Ta bela 1 0. Resíduos da tripsina que apresentam diferenças entre o pH 4,5 e 7,5.
Tabela 1 1 . Resíduos da quim ot ripsina que apresent am diferenças entre o pH 4,5 e 7,5.
Ta bela 1 2 . Análise dos dados de t em po de vida de fluorescência do BTCI em com plexo t ernário.
Tabela 1 3 . Dados obt idos dos valores aj ust ados de fluorescência dinâm ica para o BTCI e seus com plexos.
Ta bela 1 4. Parâm etros term odinâm icos dos com plexos com o BTCI
LI STA DE ABREVI AÇÕES E SI GLAS
∆G25 Variação da energia livre de Gibbs a 25º C
∆H Variação de entalpia
∆S Variação de entropia
BTCI “ Black eyed pea t rypsin and chym ot rypsin inhibit or” DC Dicroísm o Circular
Fu Fração desnaturada da proteína
LNLS Laboratório Nacional de Luz Síncrotron MPD 2-m et il 2,4-pent anodiol
PDB “Prot ein dat a bank” PEG Polietilenoglicol
RMSD “Root m ean squar e deviat ion” Tm Tem peratura m édia de desnaturação
Abreviações de Resíduos de am inoácidos 3 LETRAS – 1 LETRA
Alanina Ala A
Arginina Arg R
Asparagina Asn N
Ácido aspárt ico Asp D
Cist eína Cys C
Glut am ina Gln Q Ácido glut âm ico Glu E
Glicina Gly G
Hist idina His H I soleucina I so I
Leucina Leu L
Lisina Lys K
Met ionina Met M Fenilalanina Phe F
Prolina Pro P
Serina Ser S
Treonina Thr T Tript ofano Trp W
“ Não exist e um cam inho para a felicidade.
A felicidade é o cam inho.”
1 I N TROD UÇÃO
1 .1 Prot eases
Proteases com preendem um grande grupo de enzim as prot eolít icas envolvidas em vários t ipos de event os fisiológicos. Essas enzim as cat alisam a clivagem hidrolít ica de ligações pept ídicas present es em subst rat os prot éicos ou pept ídicos; podendo t am bém ser cham adas peptidases. Esta clivagem resulta em ativação, inat ivação funcional, prot eólise lim it ada ou na digest ão da m olécula em questão. As enzim as proteolíticas estão presentes em vários tecidos de anim ais, plantas e m icroorganism os ( Macedo et .al., 2000). At ualm ent e as prot eases são classificadas em seis fam ílias: serino, treonina, cisteíno, aspártico, m etaloproteases e proteases de ácido glut âm ico ( Cai et .al., 2005). A classificação é baseada em sua função, especificidade, est rut ura t ridim ensional, com paração dos sítios ativos e m ecanism o catalítico ( Grzonka et .al., 2001; Powers et .al., 2002).
As cist einoprot eases, present es em t odos os organism os vivos, possuem um resíduo de cist eína no sít io at ivo ( Barret e Rawlings, 2001) . Dentre elas pode se destacar a fam ília da papaína por ser a m ais bem estudada. A papaína é caracterizada por um a estrutura de dois dom ínios com o sít io at ivo sit uado ent re esses dom ínios. Os resíduos catalíticos cisteína 25 e a histidina 159 são evolutivam ente preservados em todas as cisteínoproteases ( Grzonka et .al., 2001).
As asparticoproteases apresentam resíduos de aspartato no sít io at ivo e são enzim as cuj o pH ót im o se encont ra na faixa ácida, com o exem plo a pepsina ( Cooper, 2002) .
ou com o, a colagenase que requer a presença de Ca²+ (DeClerk, 2000) . Treonino proteases são proteases que apresentam treonina no sít io at ivo e são responsáveis pelo funcionam ent o do prot eassom a. Essa classe foi incluída apenas a partir de 1995 ( Hooper, 2002) . As glut âm ico prot eases foram descritas recentem ente e apresentam apenas um a fam ília, cuj a at ividade cat alít ica parece iniciar-se com a ativação do resíduo de ácido aspártico. Essas enzim as têm sido descritas som ente em fungos ( Sim s et .al., 2004).
As serinoproteases representam o grupo das enzim as prot eolít icas m ais bem est udado e caract erizado e apresent am um resíduo de serina, hist idina e ácido aspárt ico no sít io at ivo ( Hedst rom , 2002; Get t ins, 2002) . Essas enzim as são divididas em endopept idases e exopet idases, de acordo com a posição da ligação peptídica a ser clivada na cadeia peptídica. As endopeptidases atuam preferencialm ent e nas regiões int ernas da cadeia polipept ídica, ent re as r egiões N- e C-term inal e as exopeptidases atuam som ente nas regiões N ou C t erm inal. Cada fam ília tem um a característica com um de resíduos de am inoácidos funcionais arranj ados num a configuração específica, form ando o sít io at ivo ( Koiwa et .al., 1997; Powers et .al., 2002).
1 .1 .1 Serinoprot eases
As serinoprot eases são am plam ent e dist ribuídas na nat ureza, em duas principais fam ílias representadas pela subtilisina e pela t ripsina ( Kraut , 1977) , am bas apresent ando est rut uras tridim ensionais diferentes, todavia com a m esm a geom etria do sítio at ivo. As enzim as da fam ília subt ilisina são encont radas apenas em bact érias, enquant o as da t ripsina são encont radas t ant o em procariontes quanto em m icroorganism os eucariontes, plantas e anim ais ( invertebrados e vertebrados) , com preendendo enzim as com o a quim ot ripsina, t ripsina, elast ase e calicreína ( Coom bs et . al., 1999; Hartley, 1970) .
As proteases serínicas em geral apresentam um sítio ativo circundado por duas alças flexíveis em form a de um bolsão que perm it e o acesso de subst rat os ou inibidores com form as com plem ent ares. Além da com plem ent aridade de form a, a int eração de subst rat os e inibidores com a enzim a ocorre por at ração elet rost át ica e/ ou hidrofóbica. O sit io at ivo das serinoprot eases é form ado pelos resíduos de aspartato, serina e histidina, conhecidos com o tríade catalítica e estão envolvidos diretam ente com a hidrólise das ligações peptídicas ( Bode e Huber, 1992) . Os am inoácidos que form am a ligação pept ídica a ser hidrolisada por essas enzim as são designados com o P1-P1’. Os out ros resíduos, que int eragem com a enzim a na região de especificidade são denom inados com o P4-P2 ( r egião N-t erm inal) e com o P2’-P4’ ( r egião C-t erm inal) ( Schect he e Berger, 1967).
Dentre as enzim as que constituem as serinoproteases da fam ília da t ripsina, três delas são destacadas: a tripsina, que cliva substratos com resíduos de am inoácidos carregados positivam ente;
1 .1 .1 .1 T ripsina
A tripsina ( 3.4.21.4) é um a serinoprotease do tipo endopept idase encont rada no aparelho digest ivo, onde cliva prot eínas. É form ada por um a cadeia de 223 resíduos de am inoácidos e cont ém seis ligações dissulfet o. É um a prot eína globular com um a predom inância de folhas ß ant iparalelas e hélices na sua est rut ura secundária e tem dois dom ínios iguais. A β-tripsina tem um a única cadeia de polipept ídios, enquant o α-tripsina tem duas cadeias result ant es de um a clivagem aut ocat alít ica. As duas enzim as apresent am diferent es caract eríst icas cinét icas em suas reações com alguns substratos sintéticos ( Hruska et .al., 1969).
A t ripsina predom inant em ent e cliva cadeias pept ídicas no lado carboxila dos am inoácidos lisina e arginina, excet o quando são seguidos por prolina ( Keildlou et .al., 1971). O resíduo aspartato (Asp 189) localizado no “ bolsão” cat alít ico ( S1) da t ripsina é responsável pela captação e estabilização da lisina carregada posit ivam ent e e / ou arginina, e é assim responsável pela especificidade da enzim a.
1 .1 .1 .2 Quim ot ripsina
A quim otripsina ( 3.4.21.1) é um a serinoprotease do tipo endopeptidase encontrada no aparelho digestivo de vertebrados, onde at ua principalm ent e na clivagem de proteínas. A quim otripsina predom inantem ente cliva cadeias peptídicas no lado carboxila dos am inoácidos arom át icos t irosina, t ript ofano, fenilalanina que encaixam em um bolso hidrofóbico na enzim a.
O m ecanism o enzim át ico é sem elhant e a t odas as out ras serinoproteases: a tríade catalítica favorece a form a nucelofílica da serina. A hidrólise ocorre em duas etapas. Prim eiro ocorre acilação do substrato para form ar um interm ediário acil-enzim a, e, em seguida, um a deacilação a fim de devolver a enzim a a seu estado original. I sto é conseguido por m eio da m odificação do am bient e elet rost át ico da serina 195 que brevem ent e se liga covalent em ent e ao subst rat o, form ando um interm ediário, enzim a-subst rat o.
Figura 1. Est rut ura t ridim ensional da A) t ripsina ( PDB: 2pt c) e B) da quim ot ripsina ( PDB: 4cha) os resíduos da t ríade cat alít ica, Hist idina 57, Aspartato 102 e Serina 195 estão destacados.
Asp 102 His 57
Ser 195 A)
Um a prot eólise descont rolada, desregulada e indesej ada pode conduzir a m uit os est ados de enferm idade, incluindo enfisem a, derram e cerebral, câncer, m al de Alzheim er, inflam ação e art rit e ( Powers et .al., 2002) . Para lim it ar esses pot enciais danos, t ais m oléculas devem ser estritam ente controladas.
O cont role da at ividade prot eolít ica ocorre pela biosínt ese dest as enzim as sob a form a de precursores inat ivos, denom inados zim ogênios, cuj a ativação dependerá de um a proteólise ou rem oção de am inoácidos na porção N-term inal da m olécula precursora; pela regulação da expressão/ secreção; pelo bloqueio t ot al ou dim inuição da atividade catalítica sobre um determ inado substrato por m eio de m oléculas denom inadas inibidores, que foram um com plexo estequiom étrico com a protease ( Powers et .al., 2002).
1 .2 I nibidores de prot eases
1 .2 .1 Aspect os Gerais
Em bora as serinoproteases possam realizar várias funções essenciais à vida suas at ividades precisam ser cont roladas. Est e pode ser o m otivo pela qual a atividade dessas proteases não só é cont rolada pela at ivação prot eolít ica de suas form as inat ivas, por sua aut o-inat ivação ( aut ólise) , assim com o por sua inibição com inibidores de protease específicos ( Mosolov et . al., 2001). I nibidores de proteases coexistem com suas proteases alvo por m eio de um processo alt am ent e regulado - limitando a proteólise do substrato às suas enz im as cognatas ( Karban e Baldin, 1997) .
cont ra at aques de predadores e infecção por m icrorganism os ( Haq et .al., 2004). Est es inibidores t êm sido est udados part icularm ent e em plant as das fam ílias Legum inosae, Gr am ineae e Solanaceae (Konarev et .al., 2002). I nibidores aparecem com o constituintes protéicos em diferent es fases da vida veget al, sendo que é na sem ent e onde aparecem os m ais elevados níveis dessa m olécula, que é essencial para a germ inação (Shewry, 1995; Shewry e Lucas, 1997) e para o cont role e desenvolvim ent o do em brião ( Tang et .al., 1993).
Em sem ent es de Gr am ineae e Legum inosae têm sido relatadas alt as concent rações de inibidores de prot ease ( Richardson, 1977) . Nos grãos de soj a, os inibidores de t ripsina correspondem a 6% do total de proteína (Brandon e Friedm an, 2002), sendo que cerca de 20% da inibição da at ividade t rípt ica nos grãos é causada pela ação do I nibidor da fam ília Bowm an Birk – BBI (Brandon e Bates, 1989). Em folhas, os níveis de inibidores são norm alm ente baixos podendo ser rapidam ente induzidos a níveis elevados quando as plantas sofrem danos m ecânicos, ou são expost as a alguns t ipos de fitohorm ônios com o o ácido j asm ônico aum entando a expressão dos genes do inibidor ( Rakwal et .al., 2001).
Além da sínt ese de inibidores de prot eases induzida no local do at aque, foi dem onst rado que sinais específicos originários dos t ecidos danificados são transportados via floem a e estim ulam a síntese desses inibidores por toda a planta ( Jongsm a e Bolter, 1997) , se expressando em folhas e caules subm et idos à inj úria ( McGurl et .al., 1995; Rakwal et .al., 2001; Rohrm eier e Lehle, 1993) .
celular. Em invertebrados, agem em processos fisiológicos fundam entais de m aneira sim ilar aos vertebrados: na cascata de regulação da coagulação e respost a im une inat a.
I nibidores naturais são classificados em 18 diferentes fam ílias. Não há consenso ent re os aut ores quant o a m elhor nom enclat ura, m as quase t odos os aut ores preferem agrupá-los de acordo com as prot eases alvo. As diversas classes de inibidores de prot eases são subdividas em várias fam ílias baseando-se na ext ensiva hom ologia da estrutura prim ária entre seus m em bros, nas relações topológicas ent re as ligações dissulfet o, na localização do sít io reat ivo ( Laskowski e Kato, 1980; Laskowski e Qasim , 2000), nos m ecanism os de ação e na estrutura tridim ensional destas proteases (Jongsm a e Bolter, 1997).
Além disso, apesar de existirem classes de inibidores com diferentes dobram entos, todos parecem partilhar um form ato de alça de m esm a conform ação tanto em form a livre quanto em com plexos com as prot eases, o que é o principal det erm inant e da inibição ( Bode e Huber, 1992) . Dentre estes os m ais estudados são os inibidores de serinoproteases do tipo Bowm an-Birk e do tipo Kunitz ( Ascenzi et . al., 2003).
As est rut uras gerais de prot eínas que represent am as diversas fam ílias de inibidores são com pletam ente diferentes. Na m aioria das vezes eles com preendem som ent e folha β ou prot eínas t ipo α/β: que t am bém podem ser prot eínas com α-hélices ou prot eínas irregulares ricas em ligações dissulfet o (Krowarsch et . al., 2003) com 9 a 21 kDa por dom ínio.
ligação é com post o de poucos resíduos (em torno de 9) e m antido em um a conform ação pouco flexível.
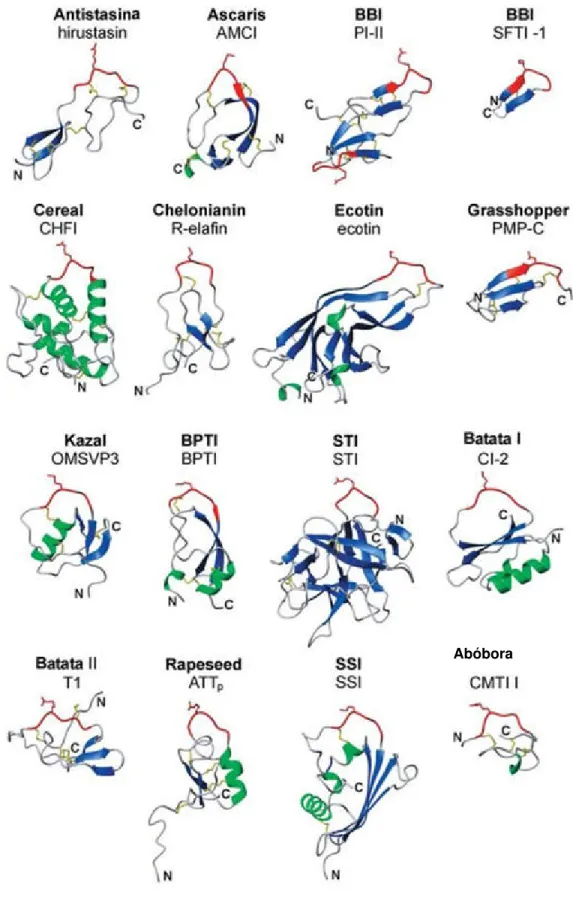
Os inibidores com estruturas canônicas representam o exem plo singular e extenso de evolução convergente de proteínas, um a vez que um a função biológica sem elhant e foi im plem ent ada várias vezes durant e a evolução por m eio da preservação da conform ação do loop canônico em m uit as prot eínas independent es (Laskowski e Qasim , 2000) . Exem plos de dobram ent os diferent es de est rut uras de inibidor de diferentes fam ílias são m ostrados na figura 2.
Figura 2 . Represent ação das est rut uras dos inibidores com loops
canônicos e resíduos P1 destacados em verm elho. A estrutura secundaria est á colorida em azul ( folhas-β) e verde (α-hélice). Nom e da fam ília do inibidor em negrit o e nom e do represent ant e indicado logo abaixo. Adapt ado de (Krowarsch et . al., 2003).
1 .2 .2 M odo de ação dos inibidores
O m odo de ação dos inibidores de protease consiste em form ar com plexos com as enzim as proteolíticas resultando em sua inativação ( Mosolov et . al., 2001). A inibição de um a enzim a prot eolít ica é com petitiva e ocorre pela ligação do sítio ativo da enzim a à região reativa do inibidor ( sítio reativo) , exposto e m antido em um a conform ação sim ilar àquela do substrat o das enzim as alvo (Laskowski e Qasim , 2000).
Os inibidores reagem num com plexo estequim étrico 1: 1. A equação do m ecanism o clássico, sugerida por Laskowksi e Kat o (1980)
E+ I ↔ C ↔ E+ I *
E e I são respect ivam ent e a enzim a e o inibidor, I * é o inibidor m odificado, C é o com plexo estável. Essa equação se refere à inibidores com o m ecanism o clássico, ist o é, inibição reversível, em que a concentração da enzim a é m uito pequena em relação à concent ração do inibidor e do subst rat o, e o equilíbrio ent re a enzim a e o inibidor é rapidam ente alcançado.
A inibição decorre da não ligação do substrato à enzim a devido ao im pedim ent o est ereoquím ico provocado pela ligação do inibidor à enzim a ( Bode e Huber, 1992; Laskowski e Kato, 1980; Bieth, 1995; GarciaCarreno, 1996) . Essa ligação ocorre de m odo sem elhante ao da ligação do substrato, form ando com plexos estáveis do inibidor com as prot eases alvo, bloqueando, alt erando ou prevenindo o acesso ao sít io at ivo da enzim a ( Laskowski e Kato, 1980; Haq et . al., 2004).
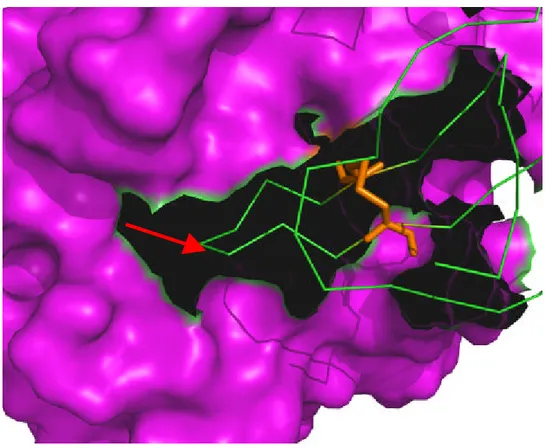
al 1996) , um a vez que a enzim a reage com a m olécula do inibidor com o se ele fosse um substrato. Entretanto, o produto form ado é o inibidor com um a ligação peptídica clivada, m as perm anentem ente ligado ao bolsão catalítico devido à presença de um a ligação dissulfet o que envolve o sít io reat ivo no loop canônico, não ocorrendo a dissociação do inibidor j á clivado pela enzim a ( figura 3) .
Figura 3 . Est rut ura t ridim ensional da superfície da t ripsina
( m agent a) com o BBI na fenda. A set a verm elha indica o local de clivagem da ligação pept ídica, a ligação dissulfet o que m ant ém o inibidor associado à enzim a está em laranj a ( PDB: 1tx6) .
concent rações norm alm ent e ut ilizadas e em pH neut ro a hidrólise dos inibidores é ext rem am ent e lent a, e o sist em a se com port a com o se fosse um sim ples equilíbrio entre, de um lado,o inibidor e a enzim a livres, e do out ro, o com plexo ( Laskowski e Kat o, 1980) . A ligação pept ídica hidrolisada especificam ent e no inibidor é a do resíduo P1 do sít io reat ivo. Em t odos os inibidores que obedecem ao m ecani sm o padrão, o sít io reat ivo que cont ém a ligação pept ídica est á englobado em pelo m enos um loop definido por um a ligação dissulfet o, que assegura que durante a conversão do inibidor virgem ao inibidor clivado, as duas cadeias pept ídicas do inibidor não podem se dissociar, m ant endo o inibidor associado à enzim a ( Laskowski e Kat o, 1980).
1 .2 .3 Fam ília Bow m an- Birk
Os I nibidores Bowm an-Birk foram isolados e caracterizados inicialm ente em sem entes de soj a ( Bowm an, 1946; Birk et . al. , 1963). Est e t ipo de inibidor é am plam ente distribuído em sem entes de legum inosas ( Norioka e I kenaka, 1983) e de gram íneas ( Odani et .al., 1986), em cereais, e t am bém encont rados em folhas e caules danificados (McGurl et . al., 1995; Rakwal et .al., 2001; Rohrm eier e Lehle, 1993) .
Out ras seqüências de am inoácidos sim ilares a est a fam ília t êm sido encont radas em inibidores isolados de out ras legum inosas, com o de am endoim Aracht s hypogaea (Norioka e I kenaka, 1983), feij ão azuki - Vign a an gu lar is (I shikawa et .al., 1985) e feij ão de corda - Vigna unguiculat a (Morhy e Ventura, 1987).
Bowm an-Birk isolado da soj a – BBI é o m ais est udado m em bro dessa fam ília, referenciado com o “ BBI clássico” . O significado fisiológico dos BBI foi associado a t rês principais funções: regulação de prot eínas endógenas, reserva de am inoácidos sulfurados ( Richardosn, 1977) e defesa cont ra o at aque de pat ógenos e inset os. No últ im o caso, os BBI parecem at uar inibindo a at ividade prot eolít ica das enzim as digest ivas desses organism os, int erferindo t ant o em seu desenvolvim ent o com o na reprodução ( Pom perm ayer et . al. , 2001; Tanaka et .al., 1996; Tiffin e Gaut, 2001).
Os inibidores dessa fam ília são represent ados por prot eínas altam ente estáveis, apresentando de 60 a 90 resíduos de am inoácidos e 8 a 10 kDa de m assa m olecular. Estes inibidores são const it uídos por um a única cadeia polipept ídica com duas ou m ais regiões internas repetidas ( Birk, 1985) . Um a característica m arcante dest as prot eínas é a t endência a form ação de dím eros ( Birk, 1985; Kum ar e Rao, 2004; Laskowski e Kato 1980; Rao e Suresh, 2007) .
Além de variação na seqüência, os BBI s apresentam várias isoform as com seqüência de resíduos am inoácidos bastante sim ilares devido a cisões na região N e C term inal ( Prakash et . al., 1996) . Essas cisões ocorrem durante a m aturação, quiescência e germ inação de sem ent es, sendo result ant es da expressão de genes dist int os durant e essas fases ( Odani e I kenaka, 1973; Tan-Wilson et . al., 1986).
com posta por dois dom ínios independentes localizados em extrem os opostos da m olécula, ( Gariani e Leatherbarrow, 1997) que inibem sim ult aneam ent e e independent em ent e duas serinoproteases, não necessariam ente idênticas, sendo um inibidor am bivalente ( Birk et . al., 1967; Krahn e Stevens 1970; Tan e Stevens, 1971).
O prim eiro sít io reat ivo da m aioria dos inibidores das dicot iledôneas inibe t ripsina, enquant o que o segundo sít io inibe t ripsina, quim ot ripsina ou elastase ( Tsunogae et . al., 1986; Qi et . al., 2005). O resíduo P1’ no segundo sit io reat ivo é bem variável podendo ser arginina, t irosina, leucina, fenilalanina ou alanina ( Odani e Ono, 1980; Cam pos et . al. , 2004). Se o resíduo for um a alanina pode ser inibida a tripsina ou a quim otripsina , esta últim a com constantes de inibição com valores bem reduzidos ( Castro e Anderson, 1996) .
Os BBI são m oléculas m uito resistentes ao calor, força iônica e pH e à prot eólise por prot eases. Vários inibidores são resist ent es a grandes int ervalos de t em perat ura, norm alm ent e 4 a 120º C, e variação de pH de 3 a 10 ( Barbosa et al, 2007; Birk, 1985; Lin et . a l., 1993; Chen et . al. , 1992; Silva et . al. , 2001). Est a est abilidade t em sido at ribuída ao alt o cont eúdo de ligações dissulfet o e t am anho reduzido ( Gerst enberg et . al., 1980). O conhecim ento da estabilidade, sob ação da tem peratura e pH, constitui um a im p ortante ferram enta nos processos de purificação dos BBI . A redução do conteúdo protéico de extratos brutos por desnaturação da m aioria das prot eínas, usando t rat am ent os baseados nessas propriedades, dim inui a com plexidade desses ext rat os e facilit a a obt enção e o isolam ento dos inibidores de proteases, um a vez que esses t rat am ent os não alt eram a at ividade inibit ória.
1 .2 .4 Est rut ura dos inibidores de prot ease
A prim eira est rut ura t ridim ensional de inibidores BBI obtida foi a do inibidor isolado de pâncreas bovino ( Huber et . al. , 1970). At ualm ent e, várias est rut uras de inibidores isolados de dicot iledôneas est ão disponíveis em form a livre (figura 4) (DeLaSierra et . al., 1999; Suzuki et . al., 1993; Werner e Wem m er, 1992) em com plexo binário com a tripsina ( Lin et . al., 1993; Tsunogae et . al., 1986; Barbosa et . al., 2007) e em com plexo t ernário com t ripsina ( Koepke et . al., 2000).
caract eríst ica im port ant e é a baixa flexibilidade da alça de inibição. Est a conform ação rígida do inibidor é originada pelo seu t am anho reduzido, pela presença de ligações dissulfet o, pela ocorrência de um a ou m ais prolinas na alça, pela presença de um a treonina β -ram ificada na posição P2 e pela form ação de int erações intram oleculares de hidrogênio entre os resíduos P5' ( Gln) e P2 ( Thr) e P1' (Ser) ( Maeder et . al. , 1992). Em geral, os sít ios reat ivos dos BBI são alças am plam ente expostas, com postos por nove resíduos de am inoácidos caract eríst icos, incluindo o resíduo P1, que está com pletam ente exposto ( Bode e Huber, 1992; Radisky e Koshland, 2002; Barbosa et . al., 2007) . Alguns inibidores apresentam os m esm os valores dos ângulos diedrais phi e psi para os resíduos das alças inibit órias - tanto em form a livre, quanto em com plexos.
Apesar da exist ência da est rut ura t ridim ensional dos inibidores na form a livre, ainda não existe nenhum com plexo ternário com tripsina e quim otripsina com estrutura resolvida e depositada no PDB. Existe apenas na literatura um est udo de cristalização desse com plexo cuj os crist ais difrat aram em baixa resolução e não perm item obter as inform ações necessárias para que a estrutura t ridim ensional sej a resolvida, ( Gaier et . al. , 1981) e, atualm ente, o t rabalho publicado pelo nosso grupo de biofísica estrutural ( Esteves et . al. , 2007) de cristais desse com plexo ternário difratando a 2.8 Å. Além disso, não exist e est rut ura t ridim ensional de inibidores da fam ília Bowm an-Birk em com plexos com a quim ot ripsina. O único
m odelo t ridim ensional form ado pelo inibidor em com plexo com a quim ot ripsina foi const ruído baseado na hom ologia desses inibidores pelo nosso grupo de biofísica estrutural ( Freitas et . al., 1997).
1 .2 .5 I m port ância dos inibidores de prot ease
I nicialm ent e, o est udo de inibidores de proteases foi m otivado pela busca de desenvolvim ento biotecnológico de variedades de plantas resistentes a insetos predadores ( Richardson, 1977; Ryan, 1973). Hoj e, os inibidores de prot ease est ão relacionados a out ras m últ iplas aplicações t ecnológicas em áreas econôm icas e m édicas (Fear et . al., 2007) . Com o exem plo, esses inibidores são im portantes no t rat am ent o de dist úrbios m et abólicos associados às enzim as prot eolít icas, com o pancreatites, enfisem a, alergias, inflam ação, hipert ensão e cert os t ipos de câncer ( Richardson, 1991, Kennedy, 1998).
O efeit o dessas m oléculas est á com preendido dent ro de algum as categorias básicas com o, efeito nas vias de sinalização, na inibição de prot eases nucleares e na degradação da m at riz ext racelular ( Garcia-Gasca et . al. , 2002). A sinalização por proteases difere da m aioria das out ras vias de sinalização por ser irreversível ( Turk, 2006) . Essa caract eríst ica é im port ant e para a busca de inibidores que possam atuar com o fárm acos.
2000) , atuação em desordens inflam atórias e alérgicas pela inibição da Bet a-triptase hum ana ( Scarpi et . al., 2004).
Evidências epidem iológicas t êm m ost rado que os inibidores dim inuem a incidência dos principais tipos de câncer em hum anos em população que consom e alim entos que contenham estes inibidores ( Huang et . al., 1999) e apresentam ter efeito sobre a prim eira etapa do processo de t ransform ação em células t um orais ( Kennedy e Little, 1981). Sabe-se que inibidores da fam ília Bowm an-Birk em especial podem at uar em diferent es t ipos de câncer e em carcinom as induzidos por agent es quím icos e físicos ( Kennedy, 1978) . Esses inibidores são agent es pot enciais para at uar em diversas et apas da carcinogênese com o na t ransform ação em células t um orais, na at ividade prot eolít ica alt erada, na angiogênese, no crescim ent o tum oral e na m etástase. Em abril de 1992, o órgão regulador am ericano FDA ( “Food and Dr ug Adm inist r at ion” ) , delegou ao extrato de soj a com concent rações alt as do inibidor do t ipo Bowm an-Birk o status de nova droga a ser investigada.
A capacidade de BBI de suprim ir a t ransform ação de células in vit ro e sua at ividade ant it um oral em sist em as m odelo t am bém foram diret am ent e demonst radas ( Kennedy, 1993) . Além disso, um pot ent e efeit o ant iinflam at ório t em sido associado à ingest ão de BBI em vários estudos realizados em anim ais ( Kennedy, 1998; Tikhonova et . al., 1994).
sobre a transform ação induzida por radiação in vitro ( Kennedy, 1982; Kennedy e Little, 1981; Yavelow et . al., 1983).
Adicionalm ent e, o BBI est im ula a internalização ( localização nuclear) do recept or do fat or de crescim ent o epiderm al, EGFR, inibe sua at ivação ( Dit t m an et . al., 2008 e 2003; Gueven et . al. , 1998) e estabiliza a at ividade de t irosino-fosfatases específicas que interferem na ativação de EGFR (Gueven et . al., 1998). O EGFR está envolvido em m ais de 70% das neoplasias e foi encont rado est ar hiperexpresso ( 100 vezes m ais que o norm al) em neoplasias clínicas agressivas ( Yarden, 2001) .
O BBI est im ula a at ivação de quinase dependent e de DNA (DNA-PK) , a qual participa no reparo de DNA de extrem idades não hom ólogas ( Dit t m an et . al. , 2003) . A form ação de crom ossom os dicênt ricos induzida por radiação foi reduzida significativam ente após pré-t rat am ent o de células com BBI , e o t rat am ent o com BBI result ou em um a est im ulação do nível basal da at ividade de DNA-PK. Observou-se que o BBI exerce seu efeit o radioprot et or por um a redução de reparo do DNA incorret a, result ando em um a dim inuição da quantidade de crom ossom os dicêntricos. Este efeito sobre a fidelidade de reparo do DNA é dependente do gene TP53 e está correlacionado com a indução da atividade de DNA-PK.
t erapêut ico em pacient es com esclerose m últ ipla sendo um a alternativa ao tratam ento de inj eções diárias e com alto custo.
O BBI pode at uar de form a prevent iva e curat iva se utilizado em m odelos anim ais que sofrem esclerose m últ ipla. A adm inist ração via oral do BBI em rat os durant e a indução ou na fase efet ora da doença prom oveu atraso no início da doença e a dim inuição da gravidade da doença clinica e patologicam ente, em todos os prot ocolos de t rat am ent o. I n vit ro e ex vivo, BBI C inibiu a proliferação de células linfát icas no sist em a nervoso cent ral de rat os tratados ( Gran et . al. , 2006) . O tratam ento com BBI m elhorou significativam ente os parâm etros que caracterizam essa doença ( t em po para início, gravidade, perda de peso, inflam ação e desm ielinização) . O BBI reduziu significat ivam ent e a incidência de neurit e ópt ica e previniu a perda de células ganglionares da ret ina. Na m aioria dos experim ent os a proliferação de células im unes derivadas foi significat ivam ent e m enor dos cam undongos t rat ados com BBI em relação ao grupo cont role. O BBI reduz a inflam ação e at enua a perda de neurônios, t ornando-o um excelent e candidat o para a t erapia oral em esclerose m últ ipla, e a provável m elhora se deve a inibição de m últiplos cam inhos envolvidos na patogênese da doença ( Touil et . al. , 2008) . Finalm ent e, vale ressalt ar que proteases at ualm ent e são consideradas alvos em pot encial por est arem associadas a doenças crônicas, e são, port ant o, j unt am ent e com os inibidores de prot eases, cam pos de grande int eresse para as indúst rias farm acêut icas.
1 .3 Obj et o de est udo
Est a é um a im port ant e cult ura t ropical de alt o valor nut ricional para as populações carentes das regiões norte e nordeste do Brasil, bem com o de países dos cont inent es asiát icos e africanos. O feij ão é frequent em ent e subm et ido a severas condições de est resses am bientais, j á que é principalm ente cultivado por pequenos produt ores cuj os sist emas de m anej o agrícolas em geral são carent es de insum os e defensivos.
O inibidor a ser est udado nesse proj et o “ Black eyed pea t rypsin and chym otrypsin inhibitor” – BTCI - é m em bro da fam ília Bowm an-Birk e t em sido ext ensivam ent e est udado sob o pont o de vista biofísico estrutural. A seguir estão apresentadas as características im portantes e propriedades desse inibidor. O BTCI é com posto por um a cadeia polipept ídica única de 83 resíduos de am inoácidos e m assa m olecular de 9,1 kDa. A sequência dos resíduos de am inoácidos foi det erm inada por Morhy e Vent ura em 1987 ( Morhy e Vent ura, 1987) . O BTCI cont ém apenas um único resíduo de t ript ofano, um resíduo de t irosina e t rês resíduos de fenilalanina. Os resíduos de fenilalanina est ão em regiões expost as ao solvent e ( Barbosa et . al., 2007; Mizut a et . al., 1983) . Os est udos de at enuação de fluorescência est át ica com íons iodet o, de espect roscopia de t erm opert urbação e de espect roscopia de diferença com perturbação pelo solvente indicaram que o único resíduo de t ript ofano tam bém está com pletam ente exposto ao solvente ( Morhy e Ventura, 1978; Martin e Ventura, 1983; Ventura, et . al. , 1984; Ventura e Aragão, 1977).
bet as ( Aragão e Ventura, 1986; Barbosa et . al., 2007; Freitas e Ventura, 1996) . A estrutura nativa apresenta 7 ligações dissulfeto, que lhe conferem estabilidade conform acional, m antendo sua at ividade de inibição após a exposição a t em perat uras de at é 95oC e a um a variação de pH de 3 a 11 ( Silva et . al., 2001) . Estas ligações podem ser reduzidas e novam ente oxidadas com correspondente variação na sua atividade inibitória. No ent ant o, o rom pim ento das ligações dissulfet o provoca um a alt eração significativa da conform ação deste inibidor ( Mizut a et . al., 1982).
O BTCI apresent a dois sít ios reat ivos diferent es e independentes responsáveis pela inibição sim ultânea de quim ot ripsina e t ripsina, respect ivam ent e ( Vent ura e Filho, 1966) . O sit io reat ivo para a t ripsina com preende os resíduos Lisina 26 e Serina 27 e, para a quim otripsina, os resíduos Fenilalanina 53 e Serina 54. Os com plexos estáveis de BTCI Tripsina, BTCI -Quim otripsina e o com plexo ternário apresentam estequiom etria de 1: 1, 1: 1 e 1: 1: 1, respectivam ente ( Ventura et . al., 1975).
A associação do BTCI com a tripsina, com um a constante de associação da ordem de 10- 8 M é um processo endotérm ico, que ocorre com aum ento significativo da entropia, ocasionado pela liberação de m oléculas de água localizadas na região de contato entre as duas prot eínas ( Fachet t i et . al. , 1984) . As const ant es de equilíbrio da ligação da quim ot ripsina ao BTCI foram est im adas para várias tem peraturas e os valores encontrados variam entre 0,32 × 107 a 1,36 × 107 M- 1. Os result ados indicam que a ligação de quim ot ripsina de BTCI é um processo ent ropicam ent e favorável ( Freit as et . al., 1999).
int ernas da m olécula. No caso da form ação do com plexo t ernário, os result ados obt idos por t erm opert urbação não indicaram diferença no t ot al de grupos t ript ofis expost os e enterrados ( Morhy e Ventura, 1978).
Além disso, podem ocorrer interações entre subunidades do BTCI em concentrações acim a de 0,082 g/ dL, correspondendo a um sist em a aut o-associante com o equilíbrio ent re as form as de m onôm ero e hexâm ero ( Vent ura et . al. , 1981). Essa t endência de auto associação foi confirm ada pela detecção de estados m ultim éricos do BTCI em form as globulares-elipsóides que foram ident ificados a part ir de est udos de m icroscopia de força at ôm i ca e análises com put acionais ( Silva et . al., 2005) . Pelos cálculos de volum e m olecular foram encont radas form as est áveis de aut o-associação do BTCI , havendo um equilíbrio ent re a form ação de m onôm eros-dím eros-t rím eros e hexâm eros.
O BTCI é um inibidor que pode ser ut ilizado em um grande espect ro de at uação aplicações biot ecnológicas. Nesse sent ido, alguns t rabalhos t êm sido desenvolvidos visando a aplicação desse inibidor em principalm ent e duas áreas im port ant es da aplicação biot ecnologia.
2 JUSTI FI CATI VA
Em bora int ensivam ent e est udados sob o pont o de vista bioquím ico e estrutural, o m ecanism o de ação dos inibidores de serinoprot eases ainda é obj et o de invest igação cient ífica. Est rut uras t ridim ensionais de out ros inibidores pert encent es à fam ília Bowm an-Birk em form a livre ( Werner e Wem m er, 1992; Suzuki et . al. , 1993; Voss et . al., 1996; Catalano et . al., 2003) e em com plexo com a tripsina ( Park et . al., 2004, Barbosa et . al., 2007) j á foram resolvidas. Ent ret ant o nenhum a est rut ura de com plexo com quim ot ripsina foi ainda resolvida, sendo os est udos estruturais no nível at ôm ico realizados apenas a part ir de com plexos obt idos por m eio da t écnica de m odelagem m olecular ( de La Sierra et . al. , 1999; Freit as et . al. , 1997). A estrutura do com plexo ternário de inibidores Bowm an-Birk com t ripsina e quim ot ripsina não foi ainda elucidada, e as estruturas cristalográficas depositadas no pdb de com plexos t ernários, são t odas elas represent adas pelo BBI ( “ Bowm an-Birk I nhibitor” ) com plexado com t ripsina.
Um estudo estrutural a partir das estruturas cristalográficas de com plexos binários do BTCI com a t ripsina e a quim ot rispina e o com plexo ternário com am bas é fundam ental para a caracterização da afinidade e com portam ento dos resíduos de am inoácidos responsáveis por essa interação. Tam bém é necessário avaliar a dinâm ica dest a int eração relacionada às m udanças conform acionais que ocorrem durante o processo de form ação de com plexos.
aum ent ada cont ra o bicudo do algodoeiro (Franco et . al., 2003). O BTCI apresentou efeitos significativos na regulação da hom eostase de fluidos e eletrólitos pela via da guanilato ciclase expressa nos rins. A utilização do BTCI im pediu a degradação da função renal prom ovendo aum ent o no fluxo urinário, aum ent o na excreção de sódio e aum ent o na t axa de filt ração glom erular ( Sant os-Net o et . al., 2008). Além disso, j á foi com provado o potencial anticarcinogênico do BTCI , que apresent ou efeit os cit ost át icos e cit ot óxicos em linhagem carcinogênica, associados à indução da apopt ose e da perm eabilização da m em brana de lisossom os em células de câncer de m am a, considerada um a das neoplasias m alignas m ais freqüentes e agressivas no Brasil e no m undo ( Joanitti et . al., 2010). Parte de resultados dessa linha de pesquisa resultou recentem ente no deposito de um a patente, que tem sido analisada por grupos de pesquisa de int eresse t ecnológico no Brasil.
Os dados a serem obt idos a part ir do desenvolvim ent o dessa tese, em conj unto com outras características físico-quím icas e est rut urais det erm inadas com o desenvolvim ent o de pesquisas do grupo de Biofísica estrutural do laboratório de biofísica, sob a supervisão da Prof Dra Sonia Maria de Freitas, são essenciais para caract erização do m ovim ent o int rínseco da m olécula e do m ecanism o de int eração e reconhecim ent o ent re est as prot eínas. Cert amente esses result ados facilit arão a com preensão dos m ecanism os envolvidos na ação desse inibidor nas áreas cit adas, além de possibilitar o desenho de partes estru turais da m olécula para serem testadas em ensaios de atividade anticarcinogênica e ensaios de regulação da hom eostase.
prevent ivos ou quim iot erápicos cont ra o câncer, at uação prevent iva e curativa na esclerose m últipla ( Gran et . al., 2006; Touil et . al., 2008), em atuações no sistem a im une – sistem a respiratório, sistem a de defesa e pele, na regulação da hom eostase, agentes antivirais ( SARS, Hepat it e C, Dengue, HI V) , agent es ant ibact ericidas (tuberculose, anthrax) , agentes antifúngicos ( candida) , agentes antiparasíticos, ( chagas, m alária) dentre outros ( Joanitti et . al., 2006) .
3 OBJETI VOS GERAI S
Este trabalho tem com o obj etivo geral o estudo das interações do BTCI com as enzim as quim ot ripsina e t ripsina em com plexos binário e t ernário por fluorescência dinâm ica e a part ir das est rut uras crist alográficas desses com plexos a serem det erm inadas nesse trabalho por difração de raios X.
3 .1 Obj et ivos específicos
♦ Purificação e cristalização do com plexo binário BTCI – t ripsina.
♦ Resolução da estrutura tridim ensional do com plexo binário BTCI – t ripsina.
♦ Análise com parat iva da est rut ura t ridimensional do com plexo binário com outros com plexos de inibidores de tripsina.
♦ Análise dos cont at os int erm oleculares caract eríst icos da ligação do BTCI – t ripsina.
♦ Purificação e cristalização do com plexo ternário quim otripsina – BTCI – t ripsina.
♦ Resolução da estrutura tridim ensional do com plexo ternário quim ot ripsina – BTCI – t ripsina.
♦ Análise das interfaces e m udanças estruturais no com plexo ternário quim otripsina – BTCI – t ripsina.
♦ Análise da estabilidade térm ica dos com plexos por técnica de dicroísm o circular.
4 M ATERI AI S E M ÉTODO S
4 .1 Obt enção do ext rat o brut o de Vigna unguiculat a
O BTCI foi isolado de sem ent es do feij ão Vigna unguiculat a ( variedade seridó) . 500g de sem entes trituradas foram m antidas sob agit ação const ant e em 2 L de água dest ilada por 12 horas a um a tem peratura de 4° C . A m istura foi hom ogeneizada em um liquidificador por 15 m inutos, filtrada e centrifugada a 8000 g por 30 m inut os a 4° C e o sobrenadant e foi reservado. Um a nova ext ração das proteínas contidas no precipitado foi realizada com 1 L de água por m ais 15 m inut os. A m ist ura foi cent rifugada a 8000 g por 30 m inut os em 4° C e o sobrenadant e reservado.
O m at erial foi precipit ado com TCA 2,5% , em seguida precipitado em sulfato de am ônio 50% . Após filtrar a 4° C, foi centrifugado por 8000 g por 40 m inutos a 4° C, coletando-se o precipit ado. O ext rat o foi dialisado para rem oção dos sais por 12 horas a 4° C e liofilizado para posterior utilização.
4 .2 Purificação do bt ci
O m at erial liofilizado foi ressuspenso em t am pão fosfat o 0,01 M pH 7,3 para a purificação em crom at ografia de t roca iônica em DEAE-celulose. O inibidor a ser purificado foi eluído em um gradient e de 0-0,8 M de NaCl em um fluxo de 4 m L/ m in. A presença de prot eínas foi m onitorada por absorbância em 280 nm e a confirm ação da pureza foi feita por gel de poliacrilam ida 13% em condição desnaturante.
4 .3 Obt enção e purificação dos com plexos
0,05 M pH 7,5 KCl 0,2 M na razão m olar 1: 1 nos com plexos binários ( BTCI -t ripsina e BTCI -quim otripsina) e 1: 1: 1 no com plexo ternário (tripsina -BTCI -quim ot ripsina) em um a concent ração de 500 m M. As m ist uras foram incubadas durant e 30 m inut os a t em perat ura am bient e.
O com plexo ternário tripsina -BTCI -quim ot ripsina foi obt ido em duas et apas. Em prim eiro lugar, BTCI e t ripsina foram dissolvidos em um a proporção de 1: 1 em solução Tris 0,05 M pH 7,5 KCl 0,2 M por 30 m inut os em t em perat ura am bient e.A quim ot ripsina foi ent ão adicionada a est a solução, que foi incubada por um período adicional de 30 m in. Todas as três proteínas foram diretam ente dissolvidas no tam pão para relação 1: 1: 1 em um a concentração de 500 m M
Os com plexos form ados foram purificados de acordo com a m et odologia de Vent ura et . al.( 1975) por crom atografia de exclusão m olecular em Sephadex G-75 em um fluxo de 25 m L/ h. A eluição das prot eínas foi m onit orada por absorbância em 280 nm e a confirm ação da pureza foi feit a por gel de poliacrilam ida 13% em condição não-desnat urant e.
4 .4 Crist alização dos com plexos
lacradas, com a m enor pert urbação possível. A part ir da observação dos result ados prelim inares dest es experim ent os, as condições que apresentarem cristais foram subm etidas a sucessivos refinam entos at é se conseguir crist ais que apresent em 2 di m ensões m aiores que 0,2 m m .
Foram obt idos crist ais em diversas condições, m as som ent e duas em dois pHs diferent es foram escolhidas para a resolução e refinam ent o, sendo em 0,1 M HEPES de sódio pH 7,5, 0,5 M de sulfat o de am ônia e 30% de 2-m et il 2,4-pent anodiol (MPD) e 0,1M de acet at o de sódio pH 4,5, 0,1 M de cloret o de cobalt o hidrat ado e 1 M de hexanodiol. A colet a de dados dos crist ais foi realizada na linha de cristalografia de proteínas MX1 do LNLS.
4 .5 Colet a de dados
A colet a de dados foi realizada na linha MX1-D03B do Laborat ório Nacional de Luz Síncrot ron a ? = 1.427 Å. Os crist ais foram banhados em um a solução crioprotetora form ulada de acordo com as condições de obt enção de cada crist al, e só ent ão m ont ados em loops de nylon. A colet a foi feit a com o cristal resfriado inst ant aneam ent e num fluxo de nit rogênio gasoso a aproxim adam ent e 100 K. I st o perm it iu a redução dos efeit os danosos da radiação direta e aum entou o tem po de vida do cristal.
form a a chegar o m ais próxim o possível da m elhor resolução, lim it ada pela qualidade do crist al. A colet a foi feit a com oscilação do cristal a cada 1° com o m áxim o de reflexões possíveis, visando m aior com plet eza de dados.
De posse das im agens ( 360 im agens) , os dados ( intensidades) foram indexados utilizando o program a HKL2000 ( Otowinowski e Minor, 1997) , para a determ inação do grupo espacial, das dim ensões e orient ação da célula unit ária, e est im ar a m osaicidade. A part ir da m edida da dist ância e dos eixos da rede recíproca do padrão de difração foi possível determ inar o tam anho e os eixos do cristal no espaço real.
No processo de int egração foi quant ificada a int ensidade do pont o, ret irando-se a cont ribuição provenient e da difração do solvent e. Cada im agem em um m esm o conj unt o de dados t em intensidades gravadas em um a escala diferent e um as das out ras, por diversos m otivos com o a variação na radiação incidente, absorção dos raios difrat ados ou dest ruição do crist al. Port ant o, é necessário colocar t odos os pont os em um a m esm a escala. Após esse passo foi realizada o som at ório dos dados: os pont os com o m esm o índice de Miller foram som ados e as intensidades correspondentes aos pontos que foram agrupados com o reflexões equivalent es sim ét ricas de diferentes im agens foram tam bém som adas.
concordância entre as várias m edidas de intensidade de um a m esm a reflexão de im agens ou conj unto de dados diferentes, que indica o quant o elas concordam ou discordam . Já que, na realidade t odas as m edidas de um m esm o ponto não apresent am a m esm a intensidade, dependendo da orient ação do crist al. Rsymm por sua vez, é um parâm et ro que relaciona, da m esm a form a, as m edidas de int ensidade de reflexões sim et ricam ent e relacionadas de im agens ou conj unto de dados diferentes ( McRee, 1993) .
4 .6 Const rução do m odelo
O m apa de densidade elet rônica é que perm it e a const rução de um m odelo de est rut ura t ridim ensional. A fim de obt er esse m apa de densidade de elét rons, a am plit ude e fase devem ser conhecidas. Durant e um experim ent o de difração a fase não pode ser diretam ente gravada: ist o é conhecido com o o problem a de fase. A fase inicial pode ser obtida por diversas técnicas, um a delas é a substituição m olecular.
Se um a est rut ura relacionada é conhecida, ela pode ser usada com o um m odelo de busca em subst it uição m olecular para determ inar a posição e orientação das m oléculas dentro da célula unitária. Partindo da observação de que m oléculas com seqüências prim árias hom ólogas apresent am enovelam ent os sim ilares, o conhecim ent o dest as m oléculas est rut uralm ente conhecidas, perm ite sim ular um experim ento com um m odelo inicial do cristal a ser resolvido, e deste m odelo obter as inform ações necessárias sobre a fase da radiação difratada pelo cristal real. Mas para isso é necessário saber quantas m oléculas estão presentes na unidade assim étrica.
present es na unidade assim ét rica. Conhecendo o núm ero de m oléculas na unidade assim étrica é possível realizar o processo de subst it uição m olecular, o que perm it e a obt enção do prim eiro m odelo inicial da estrutura tridim ensional. O m étodo da Substituição Molecular foi utilizado neste trabalho com a estrutura do inibidor de Phaseolus angular is ( PDB: 1TAB Tsunogae et . al, 1986) com o m odelo inicial, ut ilizando o program a MOLREP do pacot e CCP4 ( Vagin e Teplyakov, 1997) .
O program a utilizado calcula funções de m ovim entos de rotação e t ranslação do m odelo, cuj as coordenadas espaciais de seus átom os referem-se ao seu posicionam ento no próprio cristal. De posse das rot ações e t ranslações necessárias para posicionarm os o m odelo corretam ente na cela unitária, estas transform ações são aplicadas e o fator de estrutura ( Fcalc) é calculado. As fases obtidas para cada reflexão são assum idas com o as fases correspondent es aos fat ores de estrutura observados, e esta inform ação será utilizada com o ponto de partida de um processo de refinam ento, para obtenção da estrutura efetiva da m olécula difratada.
4 .7 Refinam ent o do m odelo
a est rut ura t enha alcançado o seu m ínim o energét ico, com convergência m áxim a ( McRee, 1993) .
Refinam ent o é o processo de encont rar um a m elhor concordância ent re o m odelo propost o e os dados observados do experim ento. Esta concordância deve refletir num a igualdade entre os fatores de estrutura calculados ( Fcalc) e os fatores de estrutura observados ( Fobs). Cada refinam ento realizado com o program a Refm ac do pacote CCP4 foi seguido por um a intervenção m anual, utilizando o program a gráfico “ WinCoot” (Em sley e Cowtan , 2004) para aj ustes da geom etria da m olécula, otim ização dos ângulos das cadeias laterais, otim ização das dim ensões das ligações covalentes, enquadram ento da cadeia principal e cadeias laterais no m apa de densidade elet rônica seguindo o padrão das dim ensões das ligações, aj ust es do m apa de densidade eletrônica para as densidades negativas e positivas. É necessária a realização de vários ciclos de refinam ent o para que t odos os át om os do m odelo represent em de m aneira m ais fiel possível a realidade experim ent al m edida, e, além disso, est ej am no m elhor posicionam ent o possível levando em cont a a geom etria das m oléculas, valores dos ângulos e dim ensão das ligações covalent es. O processo de refinam ent o visa t razer o valor de (Fcalc) o m ais próxim o possível de (Fobs) , variando as coordenadas at ôm icas e o fat or de tem peratura B, porém , sem pre respeitando as restrições estereoquím icas e eletrostáticas.