EXTRAÇÃO E QUANTIFICAÇÃO DE a— E p—CAROTENO EM DOZE ESPÉCIES DE MACROALGAS MARINHAS "IN NATURA" COLETADAS NA
PRAIA DO PACHECO, CAUCAIA, CEARÁ
FILIPE DE OLIVEIRA NEPOMUCENO
Monografia apresentada ao Departamento de Engenharia de Pesca, do Centro de Ciências Agrárias, da Universidade Federal do Ceará, como parte das exigências para obtenção do título de Engenheiro de Pesca.
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Universitária
Biblioteca Central do Campus do Pici Prof. Francisco José de Abreu Matos
N362e Nepomuceno, Filipe de Oliveira.
Extração e quantificação de α– e β– caroteno em doze espécies de
macroalgas marinhas "in natura" coletadas na Praia do Pacheco, Caucaia, Ceará / Filipe de Oliveira Nepomuceno – 2008.
30 f. : il. color.
Monografia (Graduação) – Universidade Federal do Ceará, Centro de Ciências Agrárias, Departamento de Engenharia de Pesca, Curso de Engenharia de Pesca, Fortaleza, 2008.
Orientação: Profa. Dra. Silvana Saker Sampaio.
1. Algas. 2. Algas como alimento. 3. Engenharia de Pesca. I. Título.
COMISSÃO EXAMINADORA
5
,Q,„„, c., Som
5 0.
Prof2 Silvana Saker Sampaio, Ph.D. Orientadora
Bióloga Márcia Barbosa de Sousa, M.Sc. Membro
Eng. de Pesca Kelma Maria dos Santos Pires, M.Sc. Membro
VISTO
Prof. Moisés Almeida de Oliveira, D.Sc. Chefe do Departamento de Engenharia de Pesca
Dedico,
A minha mãe Silvia e a minha avó Elza, por me amarem e terem tido paciência comigo durante minha jornada como estudante.
AGRADECIMENTOS
A Deus, por guiar meus caminhos.
A minha orientadora Silvana Saker Sampaio, por ter me acolhido como seu orientando e ter sido tão atenciosa e compreensiva no período de graduação sendo também um exemplo de seriedade e sabedoria.
Aos meus irmãos não de sangue, do curso de Engenharia de Pesca, em especial Átila Elias, Euclides Cunha, Ewerton Sousa, Felipe Lima, Felipe Rocha, Felipe Ximenes, Francisco Santiago, Rafahel Fontenele, Tércio Alexandre, Vitor Matheus, Wictor Edney e Jonas Guarany, pela sincera amizade e todos os momentos que passamos juntos.
Aos meus amigos de laboratório Kelma Pires, Márcia Barbosa, Daniel Alencar e Rômulo Nascimento, pelo companheirismo e ensinamentos todos esses anos, sem eles meu trabalho não teria se concretizado.
A minha namorada Mariana Araújo Mendes, pelo carinho e incentivo durante essa etapa final do curso, sem os quais teria sido tudo mais difícil.
Aos meus amigos de surf, Jonatas Magno, Caio Magno, Tibério Almeida, Felipe Augusto, Valter Pinheiro, Emílio Jerry, Anderson Dias, Djacir Neto, Vitor Viana, Carlito Silva, Caio Lívia e vários outros.
Aos meus amigos, Carlos Bruno Pinheiro, Rodrigo Nobre, Rafael Brito e André Barbosa por valorizar nossa amizade desde os tempos de ensino fundamental.
Aos meus tios e tias que sempre me incentivaram.
A todos os amigos da Átomos Lan House que sempre foram tão prestativos comigo.
A Universidade Federal do Ceará, por ter me concedido uma bolsa durante parte do meu período de graduação.
A todos os professores do Departamento de Engenharia de Pesca que de alguma forma me ajudaram.
SUMÁRIO
Página
LISTA DE FIGURAS vi
LISTA DE TABELAS vii
RESUMO viii
1 INTRODUÇÃO 1
1.1 Carotenóides 2
1.2 Carotenóides provitamina A 4
2 MATERIAL E MÉTODOS 7
2.1 Algas e Reagentes 7
2.2 Extração, Saponificação e Partição 7
2.3 Quantificação de a— e [—caroteno 8
2.4 Solução padrão de 13—caroteno 8
2.5 Cálculo para conversão de a— e f3—caroteno em vitamina A 9
3 RESULTADOS E DISCUSSÃO 10
4 CONCLUSÕES 18
LISTA DE FIGURAS
Página
Figura 1 - Estrutura química de alguns carotenos e xantofilas
(AMBRÓSIO et al., 2006). 2
Figura 2 - Biossíntese de vitamina A a partir de Vcaroteno. 4
Figura 3 - Curva padrão do p—caroteno (C-9750, Sigma), submetido à
saponificação e partição. 10
Figura 4 - Teores de a—caroteno e p—caroteno nos extratos das algas marinhas Chlorophyta, coletadas em setembro de 2007, na
Praia do Pacheco, Caucaia — CE. 12
Figura 5 - Teores de a—caroteno e p--caroteno nos extratos das algas marinhas Rhodophyta, coletadas em setembro de 2007, na
Praia do Pacheco, Caucaia — CE. 13
Figura 6 - Teores de (3—caroteno nos extratos das algas marinhas Phaeophyta, coletadas em setembro de 2007, na Praia do
Pacheco, Caucaia — CE. 15
Figura 7 - Retino! equivalente (RE) nos extratos das algas marinhas coletadas em setembro de 2007, na Praia do Pacheco,
LISTA DE TABELAS
Página
Tabela 1 -
Tabela 2 -
a-Caroteno e p-caroteno nos extratos das algas marinhas Chlorophyta, coletadas em setembro de 2007, na Praia do Pacheco, Caucaia - CE.
a-Caroteno e 13-caroteno nos extratos das algas marinhas Rhodophyta, coletadas em setembro de 2007, na Praia do Pacheco, Caucaia - CE.
12
13
Tabela 3 - f3-caroteno nos extratos das algas marinhas Phaeophyta, coletadas em setembro de 2007, na Praia do Pacheco,
Caucaia - CE. 14
Tabela 4 - Retinol equivalente nos extratos das algas marinhas coletadas em setembro de 2007, na Praia do Pacheco,
RESUMO
Em diversas partes do mundo, as algas têm sido utilizadas na alimentação humana para suprir as necessidades nutricionais, pois apresentam proteínas, aminoácidos essenciais, ácidos graxos poliinsaturados e micronutrientes, como carotenóides, vitaminas e minerais. Os carotenóides são importantes micronutrientes, pois além de atuarem como antioxidantes possuem atividade de vitamina A, que atua na visão, no crescimento ósseo e na diferenciação de tecidos. Neste trabalho, avaliou-se as quantidades de a- e P-caroteno em doze espécies de macroalgas marinhas "in natura",
pertencentes às Chlorophyta (Enteromorpha sp., Caulerpa prolífera, C.
racemosa e Ulva fasciata), Rhodophyta (Acantophora specifera, Amansia multifida, Gracilaria domingensis e Pterocladia americana) e Phaeophyta (Dictyota dichotoma, Lobophora variegata Sargassum sp. e Spatoglossum schroedert). A extração dos carotenóides foi seguida de saponificação com
metanol-água contendo 5% de KOH, a 70°C por 30 minutos, e de partição em n-hexano. As análises foram feitas por CLAE em coluna Waters-Hichrom Spherisorb S5 ODS 2 (4,6 x 250 mm) e metanol-tetrahidrofurano (90:10, v/v) como fase móvel, com fluxo de 1,5 mL min-1. Alíquotas de 100 µL dos resíduos suspensos em metanol foram injetadas manualmente e os cromatogramas registrados em 450 nm. Os teores de a- e p-caroteno foram calculados através da comparação entre a área do pico da solução padrão e das amostras. As doze espécies estudadas no presente trabalho apresentaram
13-caroteno (i_tg gl peso fresco), cujos valores variaram de 0,61 ± 0,03 em
Lobophora variegata a 18,48 ± 4,09 em Ulva fasciata. Os valores
de a-caroteno (pg g-1 peso fresco) variaram de 1,40 ± 0,22 em Amansia
multifida a 20,46 ± 2,29 em Caulerpa prolifera. Não foi detectado a-caroteno na
clorófita Enteromorpha sp., nas rodófitas Gracilaria domingensis e Acantophora
specifera e em nenhuma espécie de feófita. A presença de a- e 13-caroteno
EXTRAÇÃO E QUANTIFICAÇÃO DE a— E f—CAROTENO EM DOZE ESPÉCIES DE MACROALGAS MARINHAS "IN NATURA" COLETADAS NA
PRAIA DO PACHECO, CAUCAIA, CEARÁ
FILIPE DE OLIVEIRA NEPOMUCENO
1 INTRODUÇÃO
As algas são classificadas em cianofíceas ou algas azuis, clorofíceas ou algas verdes, rodofíceas ou algas vermelhas e feofíceas ou algas pardas (SZE, 1997; VIDOTTI; ROLLEMBERG, 2004). São seres capazes de se estabelecer em diferentes ambientes, desde que esses lhe forneçam luz e umidade suficientes. São organismos fundamentalmente aquáticos, que apresentam algumas características particulares, como a presença de determinados pigmentos fotossintetizantes, clorofilas, carotenóides e ficobilinas, que absorvem luz e posteriormente a convertem em energia química, ATP (adenosina trifosfato) e NADP (nicotinamida adenina dinucleotídeo fosfatado), e conferem às algas um grande poder de adaptação à luz incidente.
Assim como os alimentos de origem vegetal, as algas marinhas consistem em uma fonte natural de proteínas, carboidratos, ácidos graxas poliinsaturados, vitaminas e minerais para o homem. Os teores de provitaminas A e vitaminas B e C são semelhantes àqueles de frutas, verduras e legumes comestíveis, enquanto certos minerais, como ferro e iodo, estão presentes em quantidades maiores (GUNSTHEIMER; JAHREIS, 1998).
---L
.HWL;•
fs -C a roteno a-Caroteno
Zeaxantina
CH. C H,
CH CH,
Violaxantinà
Fucexantina
OH
HO
HO
1.1 Carotenóides
Os carotenóides são sintetizados por plantas, bactérias, fungos e algas, e os animais, incapazes de sintetizá-los, os incorporam através de suas dietas (MAYNE, 1996). Nas plantas e algas, esses compostos atuam na proteção do aparato fotossintético contra a fotoxidação e juntamente com a clorofila, atuam na fotossíntese (HAVAUX, 1998). Nos animais, sua principal função é ter atividade de vitamina A, cujas funções nos organismos estão relacionadas à visão, ao crescimento ósseo e a diferenciação de tecidos (NELSON; COX, 2006).
Os carotenóides são moléculas lipossolúveis, geralmente tetraterperáides de quarenta átomos de carbono, de coloração amarela, laranja ou vermelha, com um sistema de duplas ligações conjugadas. A cadeia central pode incluir um grupo final cíclico em uma ou ambas as extremidades da molécula que pode ser substituído por um grupo funcional contendo oxigênio.
Com base na sua composição, os carotenóides são divididos em duas classes: os carotenos, contendo apenas átomos de carbono e hidrogênio, e os oxicarotenos ou xantofilas, que contêm pelo menos um átomo de oxigênio (OLIVER; PALOU, 2000; STAHL; SIES, 2005) , como mostrado na Figura 1. A característica do sistema de duplas ligações confere aos carotenóides instabilidade à luz, oxigênio ou calor (BUNEA et al., 2008).
HO Criptoxantina
O conjunto de duplas ligações pode conferir a molécula dos
carotenóides diversas configurações cis e trans, porém a forma ali-trans é a
mais abundante na natureza, assim reações como ciclização, hidrogenação, desidrogenação, migração de duplas ligações, encurtamento ou alongamento da cadeia, rearranjo, isomerização, introdução de funções com oxigênio ou a combinação dessas modificações resultam na diversidade de estruturas dos carotenóides (RODRIGUEZ-AMAYA, 1999; OLIVER; PALOU, 2000; STAHL; SIES, 2003; RAO; RAO, 2007).
A ação dos carotenóides na prevenção e tratamento de diversas patologias como catarata, câncer, doenças cardiovasculares e do sistema imunológico tem atraído a atenção de pesquisadores. Em virtude do seu potencial antioxidante e seu papel no desenvolvimento e na diferenciação celular, os carotenóides podem proteger o organismo de desordens degenerativas. Há evidências que associam a ingestão de uma dieta rica em carotenóides e sua elevada concentração nos tecidos com a redução do risco de câncer (MELÉNDEZ-MART(NEZ, 2004; TAPIERO et al., 2004).
O foco dos carotenóides no organismo humano é sua atuação nas espécies reativas de oxigênio (EROS) que são moléculas altamente reativas, resultantes do metabolismo do oxigênio, incluindo os radicais livres, como ânions superóxido (02), os radicais hidroxila (OH), peroxila (R02) e hidroperoxila (HR02), assim como espécies que não possuem radicais livres, mas que são agentes oxidantes e podem gerar radicais, como o peróxido de hidrogênio (H202) e o oxigênio simples (02) (WISEMAN; HALLIWELL, 1996; HALLIWELL, 1999; EVANS et ai., 2002).
As proteínas, fosfolipídios, glicoproteínas e glicolipídios presentes nas membranas são alguns dos potenciais alvos das EROs. Uma lesão na membrana celular expõe as estruturas intracelulares, deixando o DNA vulnerável, o que pode gerar mutações genéticas que desfavorecem a renovação do ciclo celular (HALLIWELL, 2007).
O meio mais eficaz de combate as EROs consiste na intervenção da reação para promover sua cessação o que, conseqüentemente, protege o organismo contra lesões oxidativas celulares e genéticas. Os carotenóides, por suas propriedades antioxidantes, servem como substrato para as EROs ou outros metabólitos gerados no organismo humano, impedindo a propagação da reação em cadeia (YEUM; RUSSELL, 2002).
1.2 Carotenóides provitarnina A
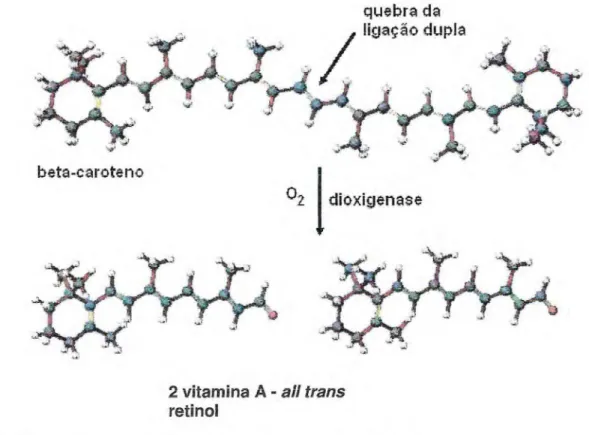
Mais de setecentos carotenóides são conhecidos (HORNERO-MÉNDEZ; BRITTON, 2002) e, entre eles, cerca de cinqüenta são precursores de vitamina A. Os carotenóides com atividade de vitamina A possuem pelo menos um anel Vionona insubstituível com cadeia lateral poliênica com um mínimo de onze
átomos de carbonos. A simetria da molécula de l3—caroteno sugere que sua clivagem ocorra na posição central, produzindo duas moléculas de vitamina A (Figura 2) (AMBRÓSIO et al., 2006).
quebra da ligação dupla
beta-caroteno
02i
dioxijenase2 vitamina A - ali trans
retinol
A vitamina A é um micronutriente encontrado sob diferentes formas -retinol, retini!, retinal e ácido retináico, apenas em alimentos de origem animal. Os vegetais fornecem provitaminas A, como a— e f—caroteno e —criptoxantina, que podem ser biologicamente convertidas em vitamina A no organismo animal. O mais ativo dos carotenóides com atividade de vitamina A é o í3—caroteno, amplamente encontrado em alimentos, como o menor ou como o principal constituinte carotenogênico (RODRIGUEZ-AMAYA et al., 2008).
Além do poder antioxidante, alguns carotenóides são precursores da vitamina A e evitam deficiências nutricionais como a hipovitaminose A, que consiste em uma doença carencial capaz de causar a perda total ou parcial da visão. Essa doença se desenvolve principalmente entre grupos de baixo nível socioeconômico que se alimentam de forma inadequada e vivem em condições sanitárias insatisfatórias (RONCADA, 2000).
Segundo a Organização Mundial da Saúde nas Américas a prevalência de hipovitaminose A é cerca de 20%. A carência de vitamina A é um problema endêmico em grandes regiões brasileiras (SARNI et ai., 2002). Nos estados do Amazonas, Rio Grande do Norte, Paraíba, Pernambuco, Bahia, Minas Gerais, São Paulo e Santa Catarina, essa deficiência existe e, em alguns locais, ela foi reconhecida como um problema de saúde pública. Entre as principais estratégias utilizadas no combate à deficiência de vitamina A estão a suplementação medicamentosa, a fortificação de alimentos e mudanças na alimentação, incluindo maior consumo de vegetais ricos em carotenóides (GERALDO et al., 2003).
Como a vitamina A e os carotenos existem em mais de uma forma química, que não são igualmente ativas, é normal usar o termo retino' para se referir à vitamina A pura. Assim, a quantidade total de vitamina A presente em um alimento, seu retino! equivalente (RE), é determinado pelo teor de retinol ou substâncias químicas muito similares ao retinol, mas não tão ativas, e uma gama de carotenos de atividade variável (AMBRÓSIO et al., 2006).
distúrbios nutricionais e doenças associadas à alimentação e nutrição. A IDR
de vitamina A para o homem adulto é de 600 ug RE (BRASIL, 2005).
O presente trabalho teve como objetivo extrair e quantificar a- e
f3-c aroten o de doze espécies de macroalgas marinhas "in natura",
pertencentes as Chlorophyta (Enteromorpha sp., Caulerpa prolifera,
C. racemosa e Uiva fasciata), Rhodophyta (Acantophora specifera, Amansia
multifida, Gracilaria domingensis e Pterocladia americana) e Phaeophyta
(Dictyota dichotoma, Lobophora variegata, Sargassum sp. e Spatoglossum
2 MATERIAL E MÉTODOS
2.1 Algas e Reagentes
As algas marinhas Chlorophyta (Enteromorpha sp., Caulerpa prolifera, Caulerpa racemosa e Uiva fasciata), Rhodophyta (Acantophora specifera, Amansia multifida, Gracilaria domingensis e Pterocladia americana) e
Phaeophyta (Dictyota dichotoma, Lobophora variegata Sargassum sp. e Spatoglossum schroederi) foram coletadas em setembro de 2007 na Praia do
Pacheco, Município de Caucaia - Ceará, durante a maré baixa, transportadas para o laboratório e lavadas em água corrente para a retirada de impurezas e epífitas. As algas limpas foram estocadas a —20°C separadamente em sacos plásticos fechados e etiquetados até sua utilização.
p—Caroteno, tipo 1 ali trans sintético aproximadamente 95% (C-9750) foi
obtido da Sigma, Estados Unidos. Os solventes utilizados na diluição do padrão e nas análises cromatográficas, metano! (MeOH), n-hexano e tetrahidrofurano (THF), todos grau HPLC, foram obtidos da OmniSolv, Merck, Alemanha. Todas as soluções foram preparadas utilizando-se água milli-Q (Millipore, Estados Unidos).
2.2 Extração, Saponificação e Partição
Para a preparação dos extratos de alga, o material foi macerado em um gral de aço inoxidável com nitrogênio líquido até a obtenção de um pó fino.
A extração foi realizada em triplicata a partir de 1 g do pó pesado em tubos de vidro graduados com tampa esmerilhada, onde foram adicionados 10 mL de Me0H-água (90:10, v/v), contendo 5% de hidróxido de potássio. Esses extratos foram homogeneizados e submetidos à saponificação em banho-maria (Thermomixe BM, modelo 18 BU, B. Braun Biotech International) a 70°C por 30 minutos.
Depois de resfriados à temperatura ambiente, os extratos foram centrifugados por 5 minutos a 2.000 x g. Após a centrifugação, porções de
rosqueada e particionadas com 2,5 mL de n-hexano e 1,5 mL de água milli-Q por 10 minutos, usando-se urna plataforma misturadora. A partição consistiu na migração dos carotenãides não saponificáveis do metanol para o n-hexano.
Após a partição, 1 mL da fase hexânica superior foi transferido para tubos de ensaio e evaporado sob corrente de ar. O resíduo foi, então, suspenso em 1 mL de Me0H e, em seguida, filtrado em membrana 0,45 µrn (Acrodisc® Syringe Filter, Gelman Laboratory). Alíquotas de 100 µL foram injetadas manualmente na coluna, usando-se um injetor Rheodyne 7210 (Hamilton Co.).
2.3 Quantificação de a— e 13—caroteno
As análises foram feitas por cromatografia líquida de alta eficiência (CLAE ou HPLC, em inglês). O sistema cromatográfico (AKTA Basic 10 P-900, Amersham) envolveu urna coluna Waters-Hichrom Spherisorb S5 ODS-2 (250 x 4,6 mm), uma fase móvel constituída de Me0H-THF (90:10, v/v), bombeada a 1,5 mL min-1 e um detector ajustado em 450 mn. Os cromatogramas foram registrados através do programa UnicornTM, versão 5.0.
Os teores de a— e f3—caroteno nos extratos de alga foram calculados pela fórmula abaixo e expressos em gg g-1 peso fresco:
in g = área amostra x µg padrão na coluna x 1 g
á
re
a padr
ã
o g alga2.4 Solução padrão de 13—caroteno
Essa solução padrão de trabalho (10 µg (3—caroteno mL-1 Me0H) foi saponificada e particionada, separadamente e em conjunto com 1 g de alga — co-cromatografia, de forma idêntica aos extratos de alga. O procedimento de co-cromatografia assegurou a detecção de P—caroteno onde ele era adicionado propositalmente.
2.5 Cálculo para conversão de a— e p—caroteno em vitamina A
Para expressar os teores de a— e/ou 3—caroteno, encontrados nos extratos das algas estudadas, em termos de vitamina A, foi considerado o preconizado pela Resolução Nº 269, ou seja, 1 lig retino! = 1 1.1g RE; 1 µg
0.2 0.4 0.6 0.8 10 y = 1,23 + 90,89 x
r = 0,9977 n = 6
80 - Ç
70 -
Q 60 _ <
E
50 - o o o 40 -o -o 30 -as
.< 20 -
10
o
00 100 -
90 -
3 RESULTADOS E DISCUSSÃO
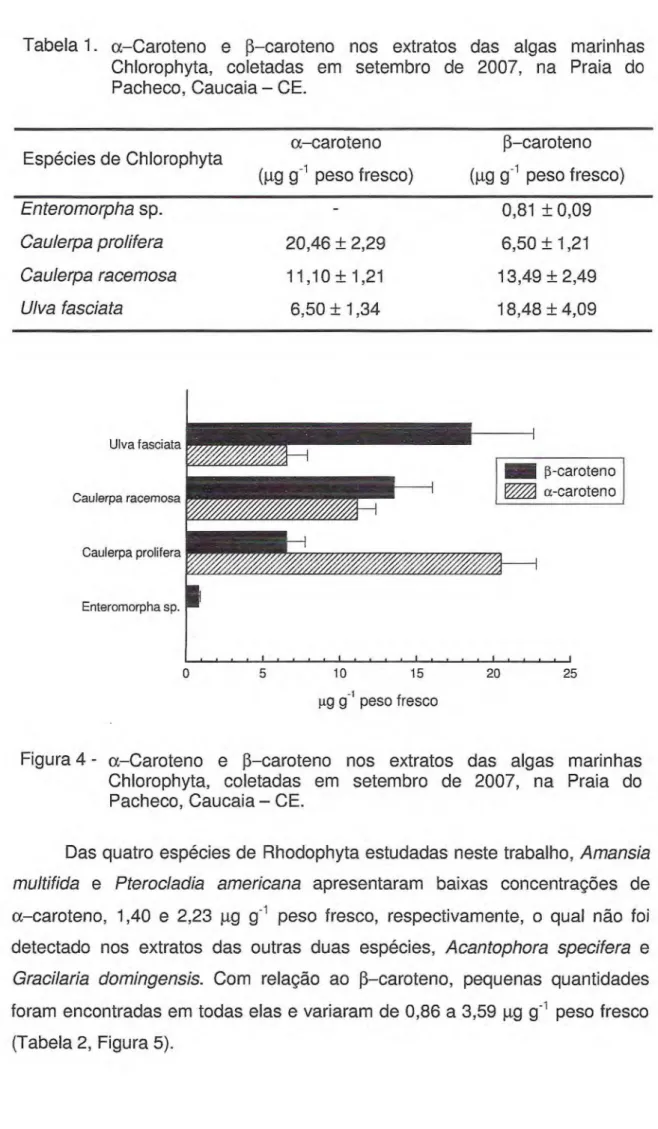
Houve correlação estatisticamente significativa (r = 0,9977, p < 0,05)
entre a área do pico e a quantidade de 13-caroteno aplicada na coluna (Figura 3).
13-caroteno na coluna
Figura 3 - Curva padrão do f3-caroteno (C-9750, Sigma), submetido à saponificação e partição.
Injeção de 0,1 a 1,0 lig em coluna Waters-Hichrom Spherisorb S5 ODS-2 (250 x 4,6 mm) com fase móvel constituída de MeOH:THF (90:10), bombeada a 1,5 mL min-1 e detecção em 450 nm.
O tempo de retenção e a área do pico registrados para a solução padrão de 10 gg 0-caroteno foram comparados com aqueles referentes aos extratos das doze espécies de alga analisadas, possibilitando a identificação e a
quantificação os carotendides provitamina A, a- e [3-caroteno.
A identificação e conseqüente quantificação de a-caroteno foi realizada com base na curva padrão de 10 µg de 13-caroteno. Este procedimento foi
adotado devido à dificuldade na aquisição do padrão comercial de a-caroteno.
Entretanto, como as áreas dos picos correspondentes a 10 'Lig de a-caroteno e 10 I,tg de 13-caroteno não apresentam diferença estatisticamente significativa
quantificação de a-caroteno nos extratos de algas é válido. Em um sistema cromatográfico com coluna C18 de fase reversa, a única diferença entre eles
dois consiste no tempo de retenção, ou seja, o a-caroteno, por ser mais polar
permanece no sistema por menos tempo e, portanto, elui antes do 0-caroteno.
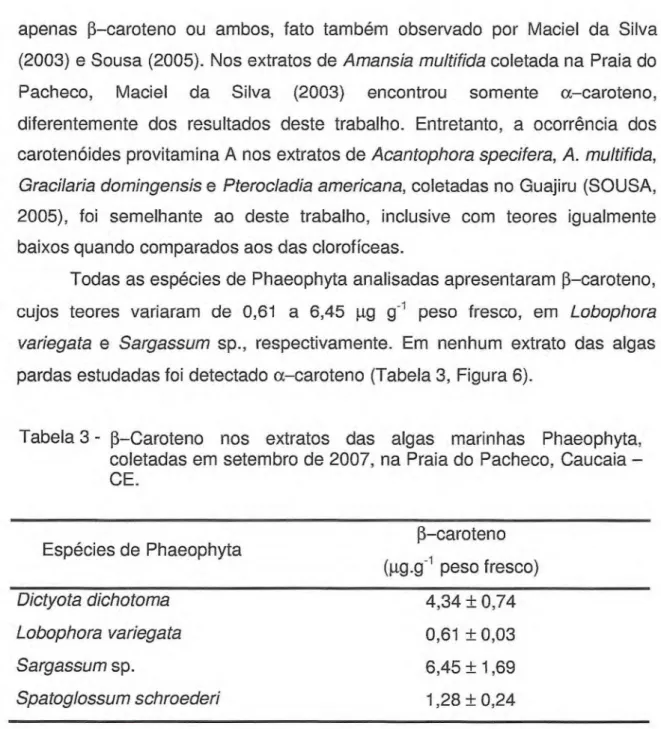
O teor de a-caroteno (µg g-1 peso fresco) nos extratos das algas verdes,
foi máximo e igual a 20,46 ± 2,29 em Caulerpa prolifera, e mínimo e igual a 6,50 ± 1,34 em U. fasciata. Somente nos extratos de Enteromorpha sp.,
a-caroteno não foi detectado. Todas as quatro espécies de algas verdes
estudadas no presente trabalho apresentaram 13-caroteno (µg g-1 peso fresco),
cujos valores variaram de 0,81 ± 0,09 em Enteromorpha sp. a 18,48 ± 4,09 em
Uiva fasciata (Tabela 1, Figura 4).
A distribuição de a- e p-caroteno nas algas verdes não obedeceu a um
padrão único, podendo ser encontrado apenas a-caroteno, apenas Vcaroteno
ou ambos. Essas variações podem ser observadas até mesmo entre algas de um mesmo gênero (MACIEL DA SILVA, 2003; SOUSA, 2005; PIRES, 2007).
Maciel da Silva (2003) investigou a presença de a-caroteno e
3-caroteno em seis espécies de clorofíceas coletadas na Praia do Pacheco e
encontrou variações entre 1,8 e 25,8 gg g-1 peso fresco para a-caroteno e
entre 2,1 e 13,6 gg g-1 peso fresco para J3-caroteno.
Sousa (2005) quantificou a- e 0-caroteno em sete espécies de
clorofíceas, coletadas em julho de 2004, na Praia do Guajiru. Os teores de a- e
0-caroteno em Caulerpa prolífera, C. racemosa e Uiva fasciata foram
respectivamente, 71,4 e 18,4; 39,7 e 8,9 e 3,4 e 26,7 µg g peso fresco. As
quantidades máximas e mínimas não coincidiram com as observadas neste trabalho e isso pode ser decorrente da existência de variação sazonal e/ou estágio de desenvolvimento da planta que influi na concentração destes compostos, como estudado por Pires (2007), em C. prolifera e C. racemosa, coletadas durante doze meses na Praia do Guajiru.
o 5 10 15 20 25
. 1 • . 1 • • 1
lel
p-caroteno a-caroteno Tabela 1. a-Caroteno e f3-caroteno nos extratos das algas marinhasChlorophyta, coletadas em setembro de 2007, na Praia do Pacheco, Caucaia - CE.
Espécies de Chlorophyta a-caroteno (µg g-1 peso fresco)
p-caroteno
(gg g-1 peso fresco)
Enteromorpha sp. 0,81 ± 0,09
Caulerpa prolífera 20,46 ± 2,29 6,50 ± 1,21
Caulerpa racemosa 11,10 ± 1,21 13,49 ± 2,49
Ulva fasciata 6,50 ± 1,34 18,48 ± 4,09
Ulva fasciata
Caulerpa racemosa
Caulerpa prolifera
Enteromorpha sp.
-
lig g 1 peso fresco
Figura 4 - a-Caroteno e p-caroteno nos extratos das algas marinhas Chlorophyta, coletadas em setembro de 2007, na Praia do Pacheco, Caucaia - CE.
Das quatro espécies de Rhodophyta estudadas neste trabalho, Amansia
multifida e Pterocladia americana apresentaram baixas concentrações de
a-caroteno, 1,40 e 2,23 pg g-1 peso fresco, respectivamente, o qual não foi detectado nos extratos das outras duas espécies, Acantophora specifera e
Gracilaria domingensis. Com relação ao p-caroteno, pequenas quantidades
Pterocladia americana
Gracilaria domingensis
Amansia multifida
Acantophora specifera
Espécies de Rhodophyta a—caroteno
(gg g-1 peso fresco)
Vcaroteno (gg g-1 peso fresco)
Acantophora specifera 0,86 ± 0,13
Amansia multifida 1,40 ± 0,22 1,44 ± 0,43
Gracilaria domingensis 1,06 ± 0,31
Pterocladia americana 2,23 ± 0,52 3,59 ± 0,94
II I
2 3 4 5
fie
13-caroteno a-caroteno11111111-1
Tabela 2. a—Caroteno e 13—caroteno nos extratos das algas marinhas Rhodophyta, coletadas em setembro de 2007, na Praia do Pacheco, Caucaia — CE.
µg g 1 peso fresco
Figura 5 - a—Caroteno e f3—caroteno nos extratos das algas marinhas Rhodophyta, coletadas em setembro de 2007, na Praia do Pacheco, Caucaia — CE.
Nas algas vermelhas Corallina officinallis, C. elongata e Jania sp.
Palerma et ai. (1991) mostraram a presença de oito carotenáides, com predominância de 13-caroteno, cujos teores (mg 100 g-1 peso seco) foram 18,4; 12,2 e 20,9, respectivamente.
De maneira semelhante ao que foi observado nas clorofíceas, a
distribuição de a— e 13—caroteno nas algas vermelhas também não seguiu o
apenas Vcaroteno ou ambos, fato também observado por Maciel da Silva (2003) e Sousa (2005). Nos extratos de Amansia multifida coletada na Praia do
Pacheco, Maciel da Silva (2003) encontrou somente a—caroteno, diferentemente dos resultados deste trabalho. Entretanto, a ocorrência dos carotenóides provitamina A nos extratos de Acantophora specifera, A. multifida, Gracilaria domingensis e Pterocladia americana, coletadas no Guajiru (SOUSA,
2005), foi semelhante ao deste trabalho, inclusive com teores igualmente baixos quando comparados aos das clorofíceas.
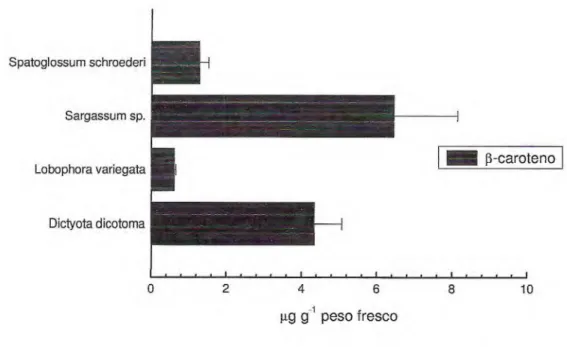
Todas as espécies de Phaeophyta analisadas apresentaram í3—caroteno, cujos teores variaram de 0,61 a 6,45 µg g-1 peso fresco, em Lobophora variegata e Sargassum sp., respectivamente. Em nenhum extrato das algas
pardas estudadas foi detectado a—caroteno (Tabela 3, Figura 6).
Tabela 3 - f3—Caroteno nos extratos das algas marinhas Phaeophyta, coletadas em setembro de 2007, na Praia do Pacheco, Caucaia — CE.
Espécies de Phaeophyta (3—caroteno
(p.g.g-1 peso fresco)
Dictyota dichotoma 4,34 ± 0,74
Lobophora variegata 0,61 ± 0,03
Sargassum sp. 6,45 ± 1,69
Spatoglossum schroederi
Sargassum sp.
Lobophora variegata
Dictyota dicotoma
15
ele
p-carotenoo 2 4 6 8 10
lig g peso fresco 1
Figura 6 - (3-Caroteno nos extratos das algas marinhas Phaeophyta, coletadas em setembro de 2007, na Praia do Pacheco, Caucaia -CE.
A distribuição dos carotenóides provitamina A nas algas pardas foi diferente, ocorrendo apenas f3-caroteno, mas nenhum a-caroteno. A ausência
de a-caroteno também foi verificada em Laminaria digitata (SAKER-SAMPAIO,
1997), em Lobophora variegata, Sargassum filipendula e S. vulgare (MACIEL
DA SILVA, 2003) e em Dictyopteris delicatula, Dictyota dichotoma, L. variegata,
Padina gymnospora e S. cymosum (SOUSA, 2005).
De acordo com Haugan e Liaaen-Jensen (1994), os carotenóides apresentam distribuição diferenciada nas algas marinhas. As cloráfitas normalmente contêm a-caroteno, 13-caroteno e comumente luteína, zeaxantina, anteraxantina, violaxantina e neoxantina derivados do I3-caroteno. As rodófitas normalmente contêm a-caroteno e (3-caroteno, assim como seus derivados hidroxilados, luteína e zeaxantina, respectivamente. As feófitas apresentam fucoxantina como principal pigmento, mas também --caroteno e violaxantin a.
provável que nas algas verdes, a quantidade realmente tenha que ser maior do que nas vermelhas e pardas, considerando que sua localização no litoral determina uma exposição mais prolongada.
Do ponto de vista nutricional, um alimento pode ser classificado como fonte "excelente" ou "útil" de um determinado nutriente, quando é responsável pelo fornecimento de 1/2 ou de 1/6 da ingestão diária recomendada (IDR), respectivamente. A IDR da vitamina A para o homem adulto é de 600 gg de retino! equivalente (RE), onde para ser fonte "excelente" ou "útil" dessa vitamina, o consumo diário de uma porção razoável do alimento deve fornecer 300 in RE ou 100 gg RE, respectivamente.
Entre as clorofíceas, as espécies que forneceriam as maiores
quantidades de RE, se fossem consumidas, seriam Uiva fasciata (3,62 1..tg g-1
peso fresco), Caulerpa racemosa (3,20 .t.g g-1 peso fresco) e C. prolifera
(2,79 gg g-1 peso fresco) (Tabela 4, Figura 7).
Das rodofíceas, a espécie Pterocladia americana forneceria o maior teor
correspondente a 0,741.1g RE g-1 peso fresco (Tabela 4, Figura 7).
Dentre as feofíceas, as espécies Sargassum sp. e Dictyota dichotoma
forneceriam as maiores quantidades de RE, respectivamente, 1,08 µg g-1 peso fresco e 0,72 µg g-1 peso fresco (Tabela 4, Figura 7).
Para ser considerada uma fonte excelente de vitamina A, as porções a serem consumidas por dia não são viáveis, pois para isso seria necessário que um indivíduo consumisse, em alguns casos, mais de 2 kg de alga fresca (Tabela 4).
Da mesma forma, as porções correspondentes à fonte útil também foram
consideradas elevadas, exceto para eeeb pui Uiva fasciata, Caulerpa
racemosa e C. prolífera cujas quantidades variaram de 27,62 a 35,84 g por dia
Tabela 4 - Retinol equivalente (RE) nos extratos das algas marinhas coletadas em setembro de 2007, na Praia do Pacheco, Caucaia -CE.
Espécies ¡.tg RE g-1 peso fresco
Porção de alga fresca (g) a ser consumida para ser: Fonte Fonte excelente útil Enteromorpha sp. 0,13 ± 0,02 2.307,69 769,23
Caulerpa prolifera 2,79 ± 0,39 107,53 35,84
Caulerpa racemosa 3,20 ± 0,47 93,75 31,25
Ulva fasciata 3,62 ± 0,73 82,87 27,62
Acantophora specifera 0,15 ± 0,02 2.000,00 666,67
Amansia multifida 0,36 ± 0,08 833,33 277,78
Gracilaria domingensis 0,17 ± 0,05 1.764,70 588,24
Pterocladia americana 0,74 ± 0,20 405,40 135,14
Dictyota dichotoma 0,72 ± 0,12 416,67 138,89
Lobophora variegata 0,10 ± 0,005 3.000,00 1.000,00
Sargassum sp. 1,08 ± 0,28 277,78 92,59
Spatoglossum schroederi 0,21 ± 0,04 1.428,57 476,19
Spatoglossum schroederi Sargassum sp. Lobophora variegata 2
Dictyota dichotoma Pterocladia americana Gracilaria domingensis Amansia multifida Acantophora specifera Ulva fasciata Caulerpa racemosa Caulerpa prolifera Enteromorpha sp.
. . . . 1 .
C) 1 2 3 4 5
µg RE gl peso fresco
4 CONCLUSÃO
A ocorrência dos carotenáides provitamina A (a- e f3-caroteno) nas espécies de Chlorophyta, Rhodophyta e Phaeophyta analisadas não seguiram o mesmo padrão de distribuição.
As quantidades também foram variáveis e, provavelmente, estão relacionadas com a zona do litoral em que as diferentes espécies são encontradas.
Dentre todas as espécies analisadas, a cloráfita Uiva fasciata foi a
5 REFERÊNCIAS
AMBRÓSIO, C. L. B.; CAMPOS, F. A. C. S.; FARO, Z. P. Carotenáides como
alternativa contra a hipovitaminose A. Revista de Nutrição, Campinas, v. 19,
n. 2, p. 233-243, mar./abr. 2006.
BRASIL. Resolução da Diretoria Colegiada (RDC) N2 269 de 22 de setembro de 2005 da Agência Nacional de Vigilância Sanitária. Ministério da Saúde. Brasília, DF. Anvisa, 2005.
BUNEA, A.; ANDJELKOVIC, M.; SOCACIU, C.; BOBIS, O.; NEACSU, M.; VERHÉ, R.; CAMP, J. V. Total and individual carotenoids and phenolic acids
content in fresh, refrigerated and processed spinach (Spinacia oleracea L.).
Food Chemistry, Oxford, v. 108, p. 649-656, May 2008.
EVANS, J. L.; GOLDFINE, I. D.; MADDUX, B. A.; GRODSKY, G. M. Oxidative
stress and stress-activated signaling pathways: a unifying hypothesis of type 2
diabetes. Endocrine Reviews, Bethesda, v. 23, n. 5, p. 599-622, Oct. 2002.
GERALDO, R. R. C.; PAIVA, S. A. R.; PITAS, A. M. C. S.; GODOY, I.;
CAMPANA, A. O. Distribuição da hipovitaminose A no Brasil nas últimas quatro
décadas: ingestão alimentar, sinais clínicos e dados bioquímicos. Revista de
Nutrição, Campinas, v. 16, n. 4, p. 443-460, 2003.
GROSSWEINER, L.I. Singlet oxygen: generation and properties. Internet
Photochemistry & Photobiology. Educational Articles. [cited 2007 May 6]. Disponível em: <http://www.photobiology.com/educational/len2/singox.html> Acesso em: 11 nov. 2008
GUNSTHEIMER, S.; JAHREIS, G. Marine macroalgae. Ernahrungs-Umschau,
Frankfurt, v. 45, n. 12, p. 424-428, Dec. 1998.
HALLIWELL, B. Oxygen and nitrogen are pro-carcinogens. Damage to DNA by reactive oxygen, chlorine and nitrogen species: measurement, mechanism and
the effects of nutrition. Mutation Research - Genetic Toxicology and
Environmental Mutagenesis, Amsterdam v. 443, n. 1-2, p. 37-52, July 1999.
HALLIWELL, B. Oxidative stress and cancer: have we moved forward?
HAUGAN, J. A.; LIAAEN-JENSEN, S. Alga! carotenoids 54. Carotenoids of
brown algae (Phaeophyceae). Biochemical Systematics and Ecology,
Oxford, v. 22, n. 1, p. 31-41, Jan. 1994.
HAVAUX, M. Carotenoids as membrane stabilizers in chloroplasts. Trends in
Plant Science, Oxford, v. 3, n. 4, p. 147-151, Apr. 1998.
HORNERO-MÉNDEZ, D.; BRITTON, G. Involvement of NADPH in the
cyclization reation of carotenoid biosynthesis. FEBS Letters, Oxford, v. 515, n.
1-3, p. 133-136, Mar .2002.
MABEAU, S.; FLEURENCE, J. Seaweed in food products: biochemical and
nutritional aspects. Trends in Food Science & Technology, Oxford, v. 4, n. 4,
p. 103-107, Apr. 1993.
MACIEL DA SILVA, H. C. Levantamento da ocorrência de carotenóides
pró-vitamina A em algas marinhas do Estado do Ceará. 2003. 60 f. Dissertação (Mestrado) — Universidade Federal do Ceará, Fortaleza, 2003.
MAYNE, S. T. Beta-carotene, carotenoids, and disease prevention in humans.
FASEB Journal, Bethesda, v. 10, n. 7, p. 690-701, May 1996.
McDERMID, K. J.; STUERCKE, B. Nutritional composition of edible Hawaiian
seaweeds. Journal of Applied Phycology, Dordrecht, v. 15, n. 6, p. 513-524,
Nov. 2003.
MELÉNDEZ-MARTÍNEZ, A. J.; VICARIO, I. M.; HEREDIA, F. J. Importancia
nutricional de los pigmentos carotenáides. Archivos Latinoamericanos de
Nutrición, Caracas, v. 54, n. 2, p. 209-215, June 2004.
NELSON, D. L.; COX, M. M. Lipídios. In: Lehninger — Princípios de
Bioquímica. São Paulo: Sarvier, 2006, cap. 10. p. 341-367.
OLIVER, J.; PALOU, A. Chromatographic determination of carotenoids in foods.
Journal of Chromatography, Amsterdam, v. 881, n. 1-2, p. 543-555, June 2000.
PALERMO, J. A.; GROS, E. G.; SELDES, A. M. Carotenoids from three red
algae of the Corallinaceae. Phytochemistry, Oxford, v. 30, n. 9, p. 2983-2986,
PIRES, K. M. S. Avaliação sazonal de carotenóides provitamina A (alfa- e beta-caroteno) e vitamina E (alfa- e delta-tocoferol) em macroalagas
marinhas pertencentes à família Caulerpaceae (Filo Chlorophyta). 2007. 94 f. Dissertação (Mestrado em Engenharia de Pesca) - Universidade Federal do Ceará, Fortaleza, 2007.
RAO, A. V.; RAO, L. G. Carotenoids in human health. Pharmacological
Research, London, v. 55, n. 3, p. 207-216, Mar. 2007.
RISSO, S.; ESCUDERO, C.; BELCHIOR, S. E.; DE PORTELA, M. L.;
FAJARDO, M. A. Chemical composition and seasonal fluctuations of the edible
green seaweed, Monostroma undulatum, Wittrock, from the Southern Argentina
coast. Archivos Latinoamericanos de Nutrición, Caracas, v. 53, n. 3, p.
306-311, Sept. 2003.
RODRIGUEZ-AMAYA, D. B. Latin American food sources of carotenoids.
Archivos Latinoamericanos de Nutrición, Caracas, v. 49, p. 74S-85S, 1999.
RODRIGUEZ-AMAYA, D. B.; KIMURA, M.; GODOY, H. T.; AMAYA-FARFÁN, J. Updated Brazilian database on food carotenoids: factors affecting carotenoid
composition. Journal of Food Composition and Analysis, San Diego, v. 21,
n. 6, p. 445-463, Sept. 2008.
RONCADA, M. J. Vitaminas Iipossolúveis. In: DUTRA-DE OLIVEIRA, J. E.;
MARCHINI, J. S. Ciências Nutricionais. São Paulo: Sarvier, 2000. p.167-189.
SAKER-SAMPAIO, S. Evaluation of Palmaria palmata and Laminaria
digitata as potential human food products. 1997. 165 f. Tese (PhD) —
University of Portsmouth, Portsmouth, 1997.
SARNI, R. S.; KOCHI, C.; RAMALHO, R. A.; SCHOEPS, D. O.; SATO, K.; MATTOSO, L. C. Q.; XIMENES, C. F.; SOUZA, F. I. S.; DAMIANI, F. M. Vitamina A: nível sérico e ingestão dietética em crianças e adolescentes com
déficit estatura( de causa não hormonal. Revista da Associação Médica
Brasileira, São Paulo, v. 48, n.1, p. 48-53, jan./mar. 2002.
SOUSA, M. B. Extração e quantificação de a—caroteno, p—caroteno e
a—tocoferol em macroalgas marinhas utilizando cromatografia líquida de alta eficiência em fase reversa. 2005. 75 f. Dissertação (Mestrado) —
SPECIFICATIONS AND CRITERIA FOR BIOCHEMICAL COMPOUNDS. 3. ed. Ed. National Academy of Sciences. Washington, DC. 1972.
STAHL, W.; SIES, H. Antioxidant activity of carotenoids. Molecular Aspects of
Medicine, Amsterdam, v. 24, n. 6, p. 345-351, Dec. 2003.
STAHL, W.; SIES, H. Bioactivity and protective effects of natural carotenoids.
Biochimica et Biophysica Acta-Molecular Basis of Disease, Amsterdam, v. 1740, n. 2, p. 101-107, May 2005.
SZE, P. Introduction to algal characteristics and diversity. In: . A
biology of the algae. 3. ed. New York: McGraw-Hill, 1997. Chapter 1, p.1-20.
TAPIERO, H.; TOWNSEND, D. M.; TEW, K. D. The role of carotenoids in the
prevention of human pathologies. Biomedicine & Pharmacotherapy, Paris, v.
58, n. 2, p. 100-110, Mar. 2004.
VIDOTTI, E. C.; ROLLEMBERG, M. C. E. Algas da economia nos ambientes
aquáticos à bioremediação e à química analítica. Química Nova, v. 27, n. 1,
p.139-145, 2004.
WISEMAN, H.; HALLIWELL, B. Damage to DNA by reactive oxygen and nitrogen species: role in inflammatory disease and progression to cancer.
Biochemical Journal, London, v. 313, p. 17-29, Jan. 1996.
YEUM, K. J.; RUSSELL, R. M. Carotenoid bioavailability and bioconversion.