UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE MEDICINA
DEPARTAMENTO DE MEDICINA CLÍNICA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS MÉDICAS
ÁLISSON MENEZES ARAÚJO LIMA
Efeitos da privação do sono sobre o comportamento, o estresse oxidativo
e interações com a modafinila - estudo realizado em camundongos
UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE MEDICINA
DEPARTAMENTO DE MEDICINA CLÍNICA
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS MÉDICAS
ÁLISSON MENEZES ARAÚJO LIMA
Efeitos da privação do sono sobre o comportamento, o estresse oxidativo
e interações com a modafinila - estudo realizado em camundongos
Tese submetida ao Programa de
Pós-Graduação
em
Ciências
Médicas da faculdade de Medicina
da Universidade Federal do Ceará
como
requisito parcial
para
aprovação do título de doutor em
Ciências Médicas.
Orientadora: Prof
a. Dr
a. Veralice
Meireles Sales de Bruin.
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
L696e Lima, Álisson Menezes Araújo.
Efeitos da privação do sono sobre o comportamento, o estresse oxidativo e interações com a modafinila - estudo realizado em camundongos. / Álisson Menezes Araújo Lima. – 2015.
90 f.: il. color.
Tese (doutorado). – Universidade Federal do Ceará, Faculdade de Medicina, Departamento de Fisiologia e Farmacologia, Programa de Pós-Graduação em Ciências Médicas, Doutorado em Ciências Médicas, Fortaleza, 2015.
Área de Concentração: Sono e Alterações Circadianas. Orientação: Profa. Dra. Veralice Meireles Sales de Bruin.
1. Privação do Sono. 2. Estresse Oxidativo. 3. Comportamento. 4. Depressão. I. Título.
ÁLISSON MENEZES ARAÚJO LIMA
Efeitos da privação do sono sobre o comportamento, o estresse oxidativo
e interações com a modafinila - estudo realizado em camundongos
Tese submetida ao Programa de
Pós-Graduação
em
Ciências
Médicas da faculdade de Medicina
da Universidade Federal do Ceará
como
requisito
parcial
para
aprovação do título de doutor em
Ciências Médicas.
Aprovado em: 26/03/2015.
BANCA EXAMINADORA
________________________________________
Profa. Dra. Veralice Meireles Sales de Bruin (Orientador)
Universidade Federal do Ceará (UFC)
_________________________________________
Prof. Dr. John Fontenele Araújo
Universidade Federal do Rio Grande do Norte (UFRN)
_________________________________________
Prof. Dr. Expedito Rogildo Cordeiro Carlos
Universidade de Fortaleza (UNIFOR)
_________________________________________
Profa. Dra. Mirian Parente Monteiro
Universidade Federal do Ceará (UFC)
_________________________________________
Prof. Dr. Pedro Felipe Carvalhedo de Bruin
DEDICATÓRIA
AGRADECIMENTOS
Agradeço primeiramente a minha esposa, Ione Cavalcante Lacerda, que sempre me encorajou nos momentos em que pensei que não conseguiria. Sua força, companheirismo e amor me fizeram prosseguir e concluir este trabalho. Obrigado por sempre me ajudar e sempre apoiar em todos os momentos.
Um agradecimento todos especial a minha orientadora, a Profa. Dra. Veralice Meireles Sales de Bruin, que é um exemplo de profissional responsável e companheira. Seus conhecimentos, dedicação, tranquilidade e senso de humor fizeram com que os momentos mais difíceis se tornassem plenamente agradáveis. Mesmo na dificuldade encontramos caminhos de conquista e conhecimento.
RESUMO
(58,58µM±6,58) e 72hPSP (65,01µM±3.72) . Ambos os grupos 48hPSP e
72hPSP, mostraram níveis mais elevados de substâncias reativas ao ácido
tiobarbitúrico (TBARS) no corpo estriado, hipocampo e no córtex pré-frontal. No
corpo estriado, o controle (11,74µmol±2,28) apresentou níveis mais baixos do
que o 48hPSP (50,17µmol±3.45 e 72hPSP (33,65µmol±2.79). No hipocampo, o
controle apresentou valores inferiores (6,95µmol±0,68) ao grupo 48hPSP
(40,96µmol±3,54) e 72hPSP (38,34µmol,±4.25, p=) de TBARS. No córtex
pré-frontal, o controle apresentou valores menores de TBARS (7,18µmol±0,98) em
relação ao grupo 48hPSP (37,22µmol±3.92) e 72hPSP (39,83µmol±2.03). Em
resumo, a PSP pelo método das plataformas múltiplas, sem recuperação do
sono, mostrou um comprometimento dos parâmetros comportamentais de
ansiedade e memória. O uso da Modafinila reverteu vários desses parâmetros
comportamentais induzidos pela PSP. Nós mostramos que um menor tempo de
PSP associa-se a maior déficit de memória e sugerimos que isso pode ser mais
benéfico para evitar o condicionamento do medo relacionado a memória de
estresse pós-traumático. O uso da Modafinila foi capaz de alterar vários efeitos
indesejáveis induzidos pela PSP e isso deve ser levado em consideração
durante a terapia com esse medicamento.
ABSTRACT
±3.729). Both groups showed significantly higher TBARS levels in striatum,
hippocampus and prefrontal cortex. In the striatum, the control group (2.285±
11,74
μ
mol) showed lower levels compared to 48hPSD groups (50,17
μ
mol±
3.454) and 72hPSD (33,65
μ
mol±2.792). In the hippocampus, controls showed
lower values (6,955
μ
mol±0.687) compared to the private group 48h (40,96
μ
mol
±3.548) and 72 hours (38,34
μ
mol±4.250). For the prefrontal cortex controls had
lower TBARS values (7,183
μ
mol±0.988) compared to the private group 48h
(37,22
μ
mol±3.921) and 72 hours (39,83
μ
mol±2.033) . In summary, the method
of PSD multiple platforms, without recovery sleep showed an impairment of
behavioral parameters of anxiety and memory. The use of modafinil reversed
many of these behavioral parameters induced by PSD. We show that a shorter
PSD is associated with greater memory deficits and suggest that this may be
useful in the manipulation of fear conditioning in posttraumatic stress. The use
of modafinil was able to change various undesirable effects induced by the PSD
and this should be taken into account during therapy with this medication.
LISTA DE FIGURAS
Figura 1 - Hipnograma de um paciente normal 18
Figura 2 - Molécula da Modafinila 27
Figura 3 - Junções Comunicantes 31
Figura 4 - Canais Juncionais na membrana 32
Figura 5 - Teste do Campo Aberto 41
Figura 6 - Teste do Nado Forçado 42
Figura 7 - Teste da Suspensão de Cauda 42
Figura 8 - Labirinto em cruz elevada 43
Figura 9 - Labirinto em Y 44
Figura 10 - Aparelho para Step Down 45
Figura 11 - Dissecação da área cerebral 45
Figura 12 - Efeito da privação de sono paradoxal na atividade locomotora (A), rearing (B) e grooming (C) de camundongo
48
Figura 13 - Efeito da privação de sono paradoxal sobre o teste do labirinto em Y (Y-maze)
49
Figura 14 - Efeito da privação de sono paradoxal sobre o teste step-down em camundongos
49
Figura 15 - Efeitos da privação de sono paradoxal sobre o estresse oxidativo mensurado pelos níveis de nitrito no corpo estriado (A), no hipocampo (B) e no córtex préfrontal (C) de camundongos
51
Figura 16 - Efeitos da privação de sono paradoxal sobre o estresse oxidativo mensurado por níveis de TBARS no corpo estriado (A), o hipocampo (B) e córtex préfrontal (C) em corte
51
Figura 17 - Efeito da privação de sono paradoxal e Modafinila sobre a atividade locomotora de camundongos (A), elevações (B) e de auto-higiene (C)
53
Figura 18 - Efeito da privação de sono paradoxal e Modafinila no número de entradas nos braços abertos (A), nos braços fechados (B) e no tempo no braço aberto (C) do labirinto em cruz elevado
53
Figura 19 - Efeito da privação de sono paradoxal e Modafinila no tempo de imobilidade no teste de suspensão pela cauda (A), a
latência de imobilidade (B) e de natação forçada (C)
Figura 20 - Microscopia de fluorescência apresentando uma forte valorização da Cx36 após imunomarcação no córtex pré-frontal de camundongos submetidos a 72hPSP grupo (72h) em relação ao grupo controle (C)
LISTA DE TABELAS
Tabela 1 - Nomenclaturas mais utilizadas das conexinas e suas localizações
34
Tabela 2 - Distribuição tecidual das conexinas nos tecidos dos mamíferos
35
Tabela 3 - Doenças genéticas relacionadas às mutações das conexinas 37 Tabela 4 -
Análise descritiva dos testes de memória (
y-maze
e
step
down
) e análises bioquímicas para nitrito e TBARS em
todos os grupos
LISTA DE ABREVEATURAS, SIGLAS E SÍMBOLOS
48hPSD – 48 horas de privação de sono paradoxal 72hPSD – 72 horas de privação de sono paradoxal AMPc – Adenosina monofosfato cíclico
ANOVA – Análise de variância
ANVISA – Agência de Vigilância Sanitária CA – Campo aberto
CEPA – Comitê de Ética em pesquisa Animal cGMP – Guanosina monofosfato ciclico CIJG – Canais intercelulares de junções gap CREB – cAMP-responsive element binding protein Cx – Conexinas
DA – Dopamina
DNA – Ácido desoxirribonucléico DOPAC – Metabólico da dopamina GABA – Ácido gamaaminobutírico GLI – Glicina
GLU – Glutamato
GPx – Glutationa peroxidase h - Horas
HFO – High Frequency Oscillations
HPLC – High Performance Liquid Chromatography LCE – Labirinto em cruz elevado
M32-WSD – Modafinila sem privação de sono
M32-72hPSD – Modafilina com 72 horas de privação de sono MDA – Malonildialdeído
NE – Norepinefrina
NEED - N-1-naftilenodiamina NF – Nado forçado
NO – Óxido Nítrico
NREM – No Rapid Eye Movement PS – Privação de sono
REM – Rapid Eye Movement RNA – Ácido ribonucléico
ROS – Espécies reativas ao oxigênio SOD – Superóxido dismutase
SPSS – Statistical Package for the Social Sciences TAU – Taurina
SUMÁRIO
RESUMO – ... 7
ABSTRACT – ... 9
LISTA DE FIGURAS – ... 11
LISTA DE TABELAS – ... 13
LISTA DE ABREVEATURAS – ... 14
1. INTRODUÇÃO – ... 18
1.1 Considerações gerais sobre o sono... 18
1.2 Transtornos afetivos e alterações do sono... 19
1.3 Memória... 20
1.3.1 Memória Aversiva ... 21
1.3.2 Memória de Trabalho ... 22
1.4 Alterações da memória devido à privação do sono...22
1.5 Estresse oxidativo e privação do sono ... 24
1.6 Modafinila ... 27
1.7 Comunicações intercelulares não-sinápticas ... 30
1.8 Comunicação Juncional ... 30
1.9 As conexina ... 33
2. JUSTIFICATIVA – ... 38
3. OBJETIVOS – ... 39
3.1 Objetivo geral ... 39
3.2 Objetivos específicos ... 39
4. MATERIAL E MÉTODOS – ... 40
4.1 Animais e Drogas ... 40
4.2 Privação de sono e procedimentos ...40
4.3 Avaliação da atividade locomotora ... 41
4.4 Nado forçado ... 41
4.5 Teste da Suspensão de Cauda ... 42
4.6 Teste do Labirinto em cruz elevado (Plus maze) ... 43
4.7 Avaliação da memória de trabalho - Teste do labirinto em Y ... 43
4.8 Teste de Esquiva Inibitória ... 44
4.9 Dissecação das áreas cerebrais ... 45
4.10 Análise do Estresse Oxidativo ...46
4.10.1 Dosagem de nitrito na amostra de tecido cerebral ... 46
4.11 Preparo e análise das conexinas em microscópio confocal ... 47
4.12 Análise Estatística ... 47
5. RESULTADOS –………... 48
6. DISCUSSÃO –……… 56
7. CONCLUSÃO –………. 68
8. ARTIGOS PUBLICADOS –……….……… 69
9. ANEXOS –………. 70
1 INTRODUÇÃO
1.1 Considerações gerais sobre o sono
Ao contrário do que se acreditava, o sono não é um estado passivo com função apenas de repouso do sistema muscular, órgãos viscerais e sistema nervoso, mas sim um processo ativo composto por mecanismos e alterações fisiológicas complexas (HORNER & BRADLEY, 2006).
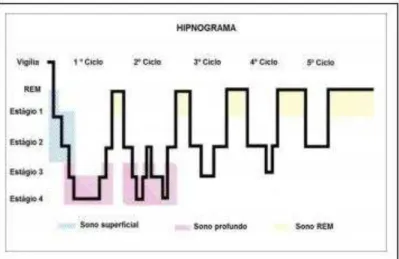
O sono apresenta-se fisiologicamente dividido em duas fases: sono REM (Rapid Eye Movement) e sono não REM (NREM) e este último divide-se em quatro estágios distintos (OHAYON, CARSKADON et al., 2004). Tais estágios apresentam características específicas observadas nos registros de polissonografia com sucessões previsíveis, ordenadas e cíclicas de ondas cerebrais de amplitudes e freqüência diferentes, além de movimentos oculares e alterações do tônus muscular.
Figura 1 – Hipnograma das fases do ciclo vigília-sono em seres humanos (ANDERSEN; TUFIK, 2010).
O sono é essencial para a consolidação da memória, além de diversas outras funções relacionadas com a saúde. A influência do sono sobre as atividades biológicas faz parte de um processo complexo. Estudos mostram que o sono influencia a consolidação da memória, possivelmente em graus variáveis para cada tipo de memória e situações onde mecanismos de recompensa estão envolvidos (DIEKELMANN & BORN, 2010).
memória durante o sono (DIEKELMANN & BORN, 2010; VARELA, KUMAR et al., 2014). Recentemente, foi sugerido que células localizadas no tálamo podem coordenar diretamente a atividade do córtex pré-frontal medial e do hipocampo e são importantes para a consolidação da memória (VARELA, KUMAR et al., 2014).
Sabe-se que a privação de sono, observada com freqüência na sociedade atual, é uma relevante preocupação social devido às conseqüências importantes no desequilíbrio da saúde individual, como por exemplo, aumento das concentrações de cortisol e da atividade simpática e aumento da concentração de marcadores inflamatórios (TASALI, LEPROULT et al., 2008). Dessa forma, a privação de sono associa-se ao aparecimento de situações de risco para a população e aumento da morbimortalidade.
Do ponto de vista social e histórico deve ser observado que o tempo de sono para os seres humanos compreende um terço da vida. No entanto, devido a circunstâncias sociais, atualmente, o período de sono tem se reduzido em função das atividades observando-se uma redução do tempo total de sono na sociedade moderna. Possivelmente e em conseqüência do cenário socioeconômico, a população é induzida a prolongar a jornada de trabalho. Além disso, a exposição à luz artificial possibilitou a ampliação do período das atividades de trabalho e de lazer, prolongando a vigília e reduzindo significativamente o tempo de sono (BITTENCOURT, SANTOS-SILVA et al., 2009). No modo de vida atual, a maior parte da privação do sono ocorre na fase REM, na segunda metade da noite.
Diversos estudos que objetivam avaliar os prejuízos conseqüentes a essas mudanças de comportamento têm sido realizados. Modelos experimentais de privação de sono também têm sido utilizados, particularmente o modelo de privação de sono paradoxal em ratos e em camundongos.
1.2 Transtornos afetivos e alterações do sono
Distúrbios do ciclo sono-vigília estão presentes em grande parte dos transtornos afetivos e em outros transtornos psiquiátricos. Sabe-se que a privação de sono (PS) pode causar a remissão de um episódio de depressão, o que sugere a sua possível utilização como terapia alternativa ou adjuvante aos antidepressivos (KASPER, KICK et al., 1991; BENEDETTI, BARBINI et al., 1997).
forma variável, o sono tem uma relação com os transtornos do humor (SOUTHMAYD, DAVID et al., 1990; KASPER, KICK et al., 1991; PAPADIMITRIOU, CHRISTODOULOU et al., 1993). Os mecanismos de ação que explicam a relação entre a privação de sono e os transtornos de humor ainda não estão inteiramente esclarecidos.
Diversos estudos têm demonstrado que a privação de sono, tanto em homens como em animais, provoca diversas alterações, assim como aspectos negativos sobre o desempenho psicomotor e cognitivo, variações de humor, disfunções metabólicas, parâmetros comportamentais e avaliações cerebrais (SUCHECKI, ANTUNES et al., 2003; SILVA, CHEHIN et al., 2004; HIPÓLIDE, MOREIRA et al., 2005; ALLARD, TIZABI et al., 2007; GUZMAN-MARIN, BASHIR et al., 2007; PERRY, D'ALMEIDA et al., 2007; ALVARENGA, PATTI et al., 2008; VAN CAUTER, SPIEGEL et al., 2008).
Estudos sobre as relações entre a privação de sono paradoxal e a as funções cerebrais em animais e humanos mostram que, áreas e circuitos cerebrais específicos estão envolvidos e que as alterações induzidas pela privação de sono paradoxal podem servir de modelo para estudos farmacológicos (SHAFFERY, SINTON et al., 2002; KIM & YOUNG, 2005; VECSEY, BAILLIE et al., 2009). Portanto, torna-se importante um conhecimento aprofundado sobre as alterações cerebrais específicas que ocorrem em associação com a privação de sono e a influência que o uso de medicamentos específicos tem sobre tais alterações.
1.3 Memória
Por definição, a memória é a capacidade de armazenamento de todas as formas de conhecimento adquirido pelo homem em suas relações com o meio ambiente (KANDEL et al, 2000). A memória nos possibilita relembrar fatos ocorridos desde os mais tenros anos de nossas vidas até o momento atual. Quando a memória é comprometida, ficamos incapazes de dar sentido aos eventos passados e trabalhar mentalmente com idéias, impressões e imagens. (SQUIRE & KANDEL, 2003).
fixação. A evocação é o processo mediante o qual a informação consolidada é recuperada e expressada (IZQUIERDO 2002; SQUIRE & KANDEL, 2003).
Diversos mecanismos envolvidos no aprendizado da memória têm participação paralela e seqüencial de várias cascatas bioquímicas. Grande parte das quais são iniciadas por receptores de glutamato (NMDA) no hipocampo e estruturas relacionadas anatomicamente. Algumas cascatas, no hipocampo, córtex entorrinal e córtex parietal posterior, resultam na formação de memórias de curta duração que perduram de 3 a 6 horas. Outras cascatas paralelas no hipocampo, córtex entorrinal, amígdala basolateral e várias áreas do córtex cingular resultam em consolidação de memória de longa duração (CAMMAROTA et al, 2007).
1.3.1 Memória Aversiva
Seres vivos evoluídos que vivenciam, presenciam ou tomam conhecimento de um fato traumático, podem desenvolver quadros clínicos psiquiátricos como Reação Aguda ao Estresse, Transtorno do Estresse Pós-Traumático e/ou Alterações Permanentes de Personalidade Após Experiência Catastrófica (QUEVEDO et al, 2003). Apesar da resposta ao estresse ser importante à sobrevivência, pode também resultar na formação de redes neuronais que facilitam memórias intrusivas e sintomas associados de hipervigilância: resposta de sobressalto exagerada, labilidade afetiva, ansiedade, perturbação e hiperreatividade do sistema nervoso autônomo. Essa rede neuronal pode ser ativada por estímulos sensoriais externos ou internos, como estímulos cognitivos, afetivos ou somáticos (CAHILL, 1995a).
1.3.2 Memória de Trabalho
A memória de trabalho envolve um arquivamento temporário de informações para o desempenho de diferentes tarefas cognitivas (BADDELEY, 2003; HELENE & XAVIER, 2003; GRUBER et al., 2007; LINDEN, 2007; SOTO et al., 2008). Segundo Baddeley (2003), memória de trabalho compreende um conjunto de componentes do processamento cognitivo que permitem a manutenção temporária e processamento posterior da informação no cérebro. Esse sistema tem capacidade limitada, que mantém e armazena informação, sustenta os processos do pensamento humano, fornecendo uma interface entre percepção, memória de longo prazo e ação (BADDELEY, 2003).
Baddeley e Hitch propuseram inicialmente que a memória de trabalho se dividisse em um sistema tripartite de armazenamento, constituído de três componentes: o primeiro, executivo central, constitui um modelo de controle atencional, que é o controlador do comportamento responsável por padrões de hábitos, ou esquemas, implicitamente guiados por pistas ambientais, também denominado supervisor de ativação (BADDELEY & HITCH, 2000). O segundo componente é alça fonológica e o terceiro componente se refere a um sistema visuo-espacial, que tem a função de adquirir conhecimento semântico acerca da aparência dos objetos e de como utilizá-los, orientação espacial e conhecimento geográfico, tratando-se assim de um componente de armazenagem de informações visuais.
1.4 Alterações da memória devido à privação do sono
Muitos experimentos em animais sugerem que o sono, principalmente o sono REM, tem efeito no processo de aprendizado/memória. Baseado em estudo de modelos animais, foi sugerido, por exemplo, que depois da aquisição de um teste
comportamental, há uma pequena e vulnerável “janela do sono paradoxal”,
caracterizada por um aumento na duração normal dessa fase do sono. Durante essa janela, pode ocorrer plasticidade neuronal acelerada. De acordo com essas hipóteses, estudos em animais de laboratório demonstraram que a privação de sono REM gera déficit de memória (DIEKELMANN & BORN, 2010).
morbimortalidade e que uma redução do sono pode causar diretamente ou conseqüentemente doenças neurodegenerativas, como a doença de Alzheimer ou a doença de Parkinson. (HURTADO-ALVARADO et al., 2013).
Deve ser considerado que algumas alterações de comportamento observadas em animais privados de sono potencialmente diminuem o tempo de reação, modificam a função motora, a resposta ao estresse modificado e a resposta ao medo podendo portanto, contribuir para uma alteração dos testes de memória (PATTI, ZANIN et al., 2010).
Recentemente, foi demonstrado que durante o sono um sistema denominado
“glinfático” ocorre. Em tempo real, foi mostrado que ocorre um aumento dos espaços perivasculares cerebrais e um fluxo convectivo do córtex para os ventrículos laterais carreia o fluxo perivascular realizando um clearance de partículas tóxicas indesejáveis, como o amilóide. Assim, ficou demonstrado que um fenômeno dinâmico de limpeza das estruturas cerebrais ocorre durante o sono e, confirmando, o papel essencial do sono para a homeostase cerebral (XIE, KANG et al., 2013).
Tem sido sugerido que a PS em animais de experimentação é um processo diferente daquele que ocorre em seres humanos. No modelo de plataformas múltiplas, durante o sono, os animais relaxam, perdem o tônus e caem de uma superfície (plataforma) para uma caixa contendo água, provocando assim um despertar (BERGMANN, EVERSON et al., 1989). Dessa forma os animais ficam com PS total e desenvolvem pelos eriçados, lesões de pele, cauda e patas, queda da temperatura corporal, aumento da ingestão de alimentos, perda de peso, hipermetabolismo, hipertireoidismo e, se a PS for prolongada, morte.
O sono REM (Rapid Eye Movement) tem se mostrado fundamental para a plasticidade sináptica cortical e a formação de memórias espaciais e não-espaciais. A privação de sono REM (PSREM) realizada através do método de plataformas múltiplas tem sido amplamente usada como um modelo para testar os efeitos da privação de sono sobre a memória e o aprendizado (DE OLIVEIRA, CUNHA et al., 2004).
Recente estudo clínico sugere que durante o sono de ondas lentas, a memória codifica-se em uma armazenagem temporária. Por exemplo, a memória declarativa ficaria temporariamente no hipocampo podendo ser reativada e redistribuída para uma armazenagem de longo prazo no neocórtex (BORN & WILHELM, 2012).
a reativação repetida das representações de memórias hipocampais junto com a formação das ondas agudas no eixo tálamo-cortical e no hipocampo.
Embora observações comportamentais demonstrassem claramente que dormir é importante para a consolidação da memória, os papéis das diferentes fases do sono ainda não estão totalmente compreendidos.
Postula-se que devido a sua relação com os sonhos, o sono REM é fundamental para a formação da memória.
Deve ser lembrado que a maioria dos estudos através de eletroencefalografia realizados até agora, tem mostrado que o sono NREM, especialmente o sono de ondas lentas, também possui uma participação importante na retenção da memória. A privação de sono NREM, ou do sono de ondas lentas, após a aprendizagem, impede a consolidação e o aprimoramento posterior das memórias (HU, STYLOS-ALLAN et al., 2006; WALKER, 2009; DIEKELMANN & BORN, 2010).
De forma importante, deve ser lembrado que existem vários tipos de memória e que o sono REM também tem sido associado com a memória emocional (WALKER, 2009). Atualmente, sabe-se que os modelos de privação de sono em animais provavelmente envolvem certo grau de perda de sono REM e NREM e isso aproxima-se, na verdade, com o que ocorre em situações clínicas onde a redução do sono envolve tanto uma perda de sono REM quanto NREM.
1.5 Estresse oxidativo e privação de sono
A privação de sono causa dano celular predispondo a anormalidades
metabólicas, e erros de replicação celular” podendo, portanto, ser o elo que relaciona a privação de sono com diversas doenças. Foi recentemente demonstrado que o sono recupera o equilíbrio molecular e reduz o dano celular (EVERSON, HENCHEN et al., 2014). O papel que o estresse oxidativo desempenha nessa cadeia de eventos ainda não está inteiramente esclarecido.
Recentemente, foi sugerido que o aumento de radicais livres associados ao envelhecimento é mais um resultado de adaptações necessárias dos sinais celulares
do que simplesmente um efeito deletério, portanto as “espécies reativas de oxigênio”
têm uma participação importante na biologia celular. Nesse sentido, parece que a mitocôndria tem um papel discutível e possivelmente importante no envelhecimento,
pois não acumula grande quantidade de “espécies reativas de oxigênio”
Estudos mostram que o estresse oxidativo é uma importante conseqüência da privação de sono. Reimund (1994) teorizou que o sono aumenta a eficiência de mecanismos antioxidantes no cérebro. Foi relatado que a privação de 96h de sono REM produz alteração em vários índices de antioxidantes em cérebros de ratos. Alterações dos níveis de superóxido dismutase (SOD), glutationa e a catalase foram demonstradas (REIMUND, 1994).
O metabolismo oxidativo e a produção de energia no corpo geram radicais livres e não-radicais derivados do oxigênio e do nitrogênio. Embora esses produtos sejam essenciais ao metabolismo e a função celular, um desequilíbrio entre a produção destes e o sistema de defesa antioxidante resulta em estresse oxidativo. Os distúrbios do sono associam-se com alterações metabólicas (KNAUERT, MALIK et al., 2014) e imunológicas (MAJDE & KRUEGER, 2005). A privação do sono pode gerar um desequilíbrio dos mecanismos antioxidantes. Enzimas antioxidantes, como a catalase e a glutationa peroxidase apresentam-se reduzidas em ratos submetidos privação de sono (SILVA, ABÍLIO et al., 2004). Há também estudos que mostram que o estresse oxidativo é o intermediário biológico para diversos efeitos deletérios à saúde causados pela privação de sono (NOGUTI, ANDERSEN et al., 2013). Possivelmente, um hipermetabolismo e imunopatologia associados à privação de sono em animais produzem uma carga excessiva de metabólitos e agentes pró-oxidantes. O estresse oxidativo, pode em parte, originar disfunção metabólica, comprometimento imune e outros problemas orgânicos (VOLLERT, ZAGAAR et al., 2011; ALZOUBI, KHABOUR et al., 2013).
Previamente, foi demonstrado que a privação do sono aumenta o estresse oxidativo no cérebro (VOLLERT, ZAGAAR et al., 2011; ALZOUBI, KHABOUR et al., 2013). Vários estudos têm confirmado a hipótese que os efeitos da privação de sono são, pelo menos parcialmente, mediados por espécies reativas de oxigênio (RAMANATHAN, GULYANI et al., 2002; BROWN & NAIDOO, 2010). Na verdade, a privação de sono induz alterações metabólicas e imunológicas nocivas que eventualmente podem levar a conseqüências letais e pensa-se que o desequilíbrio antioxidante medeia estas alterações (EVERSON, LAATSCH et al., 2005). A teoria de que o sono remove os radicais livres acumulados no cérebro durante a vigília foi proposto (REIMUND, 1994) para compreensão de como a memória e as diferentes partes do cérebro são afetadas pelo estresse oxidativo seguinte a privação do sono, sendo este um assunto que merece maior elucidação.
BENNETT et al., 2006). Esta última proteína de ligação é essencial para a resposta do AMPc envolvida no processo de aprendizagem e memória. Assim, existe uma conexão direta entre NO e função de aprendizagem/ memória. Deve ser considerado que os radicais livres, que incluem nitrogênio reativo e espécies reativas de oxigênio, são difíceis de medir-se por causa de sua extrema reatividade. Os níveis de NO podem, secundariamente, ser deduzidos a partir dos níveis de seus metabólitos, nitrato/nitrito. Notavelmente, NO é a única fonte endógena de nitratos e nitritos do cérebro, porque nitratos e nitritos provenientes da dieta não atravessam a barreira hemato-encefálica (RAMANATHAN, GULYANI et al., 2002). Nitrito é um composto estável que tem sido freqüentemente utilizada como um marcador de produção de NO, no entanto, só reflete a soma dos eventos que ocorrem com o óxido nítrico dentro de uma determinada janela de tempo (CLEMENT, SARDA et al., 2004). Quando antioxidantes são incapazes de eliminação dos radicais livres, os lipídios sofrerão dano oxidativo que se expressarão através do TBARS (RAMANATHAN & SIEGEL, 2011).
Vale ressaltar que, previamente, os principais resultados relacionados a alterações do estresse oxidativo foram obtidos de amostras de tecidos periféricos. Também, muitas alterações anteriores relacionadas ao estresse oxidativo e a privação de sono em modelos animais são manifestações sistêmicas. O estudo atual avalia alterações do comportamento relacionadas a função cerebral e alterações do estresse oxidativo em regiões cerebrais específicas. No presente estudo, usaremos o nitrato-nitrito como marcador de estresse oxidativo e a peroxidação lipídica.
1.6 Modafinila
Figura 2: Molécula da Modafinila
A Modafinila, composto químico [2-(Difenilmetil-sufinil) acetamina], é um fármaco que promove o aumento do estado de alerta. Foi desenvolvido primeiramente na França por volta de 1990. Este medicamento tem se mostrado eficiente no tratamento da sonolência excessiva diurna relacionada à narcolepsia (indicação principal no registro da ANVISA), no tratamento do distúrbio do sono relacionado à mudança de turno no trabalho e na síndrome da apneia e hipoapneia obstrutiva do sono (FERRARO, TANGANELLI et al., 2001; BALLON & FEIFEL, 2006; MINZENBERG & CARTE, 2007).
também demonstrado que a modafinila inibe as vias GABAérgicas nas mesmas regiões (FERRARO, ANTONELLI et al., 1999).
Alguns estudos clínicos, de forma controversa, têm apresentado efeitos positivos deste fármaco quando utilizado para tratar outras importantes doenças como o distúrbio de hiperatividade e déficit de atenção, sonolência e fadiga relacionadas à doença de Parkinson, esclerose múltipla, depressão, sintomas negativos da esquizofrenia e os déficits cognitivos causados pela doença de Alzheimer (FERRARO, ANTONELLI et al., 1998); (TAYLOR & RUSSO, 2000); (NIEVES & LANG, 2002); (TURNER, CLARK et al., 2004); (KRAFT & BOWEN, 2005); (MORGAN, CROWLEY et al., 2007). Um estudo demonstrou uma maior relação entre o sistema dopaminérgico e os efeitos do modafinila. Segundo Ferraro e colaboradores (1996), a modafinila aumenta, de forma dose dependente, a liberação de dopamina no núcleo accumbens e que tal aumento é diminuído pelo antagonista do receptor GABAb baclofen, pelo antagonista GABAa muscimol e pelo inibidor da recaptação do neurotransmissor GABA SKF 89976A. Dessa forma, uma interação entre o sistema dopaminérgico e GABAérgico nos efeitos do modafinila foi demonstrada. A participação da molécula de modafinila no sistema dopaminérgico pode estar relacionada à sua ação primária na diminuição da liberação do neurotransmissor GABA (FERRARO, ANTONELLI et al., 1997).
Diversas características da hiperatividade dopaminérgica, como por exemplo, o aumento da locomoção, são observadas após o uso do modafinila. Dopheide et al (2007) demonstrou que a modafinila aumenta a liberação de dopamina em regiões estriatais (DOPHEIDE, MORGAN et al., 2007) e outros observaram haver uma correlação entre o aumento de dopamina no núcleo accumbens e um aumento de estereotipia em ratos sob o efeito do modafinila (ZOLKOWSKA, JAIN et al., 2009). De fato, a modafinila tem sido descrita até mesmo como um agonista de receptores D2 por alguns pesquisadores (KOROTKOVA, KLYUCH et al., 2006).
Partindo desses achados, o aumento na liberação de dopamina parece estar intrinsecamente relacionado aos efeitos de aumento do estado de alerta causado pela modafinila. Desse modo, níveis elevados de dopamina no núcleo accumbens e no córtex pré-frontal parecem ser importantes para o aumento do estado de alerta de acordo com experimentos realizados em roedores (DE SAINT HILAIRE, OROSCO et al., 2001).
efeitos promotores da vigília ocorram além do aumento da atividade locomotora observada em animais.
A modafinila também parece modular outros sistemas, como o glutamatérgico, GABAérgico e serotoninérgico, em regiões cerebrais que estão envolvidas no estado da vigília e nas funções cognitivas (WARD, HARSH et al., 2004). A ação se daria inibindo a liberação de GABA no núcleo accumbens, fazendo com que se tenha uma menor liberação de dopamina nessa região. Além disso, esse mecanismo de ação indireto no sistema dopaminérgico pode explicar o baixo potencial de abuso do modafinila, comparado à outras drogas de abuso, como a anfetamina, que agem diretamente aumentando a liberação de dopamina.
Alguns relatos apontam que a modafinila modifica a atividade em áreas do encéfalo envolvidas com a formação e consolidação da memória, tais como o hipocampo e o córtex pré-frontal (BERACOCHEA, CELERIER et al., 2003). Tais evidências indicam que a modafinila melhora as habilidades cognitivas em roedores após serem submetidos a diferentes paradigmas de aprendizagem.
Outros efeitos relatados foram a melhora da discriminação visual e atenção em roedores (MORGAN, CROWLEY et al., 2007), a facilitação do aprendizado e da memória em tarefas espaciais e contextuais em ratos adultos saudáveis (BURGOS, CASTILLO et al., 2010; TSANOV, LYONS et al., 2010) e em camundongos (BÉRACOCHÉA, LISCIA et al., 2008; SHUMAN, WOOD et al., 2009). Além disso, demonstrou-se que a modafinila pode restaurar déficits de memória induzidos pela privação de sono (PIÉRARD, LISCIA et al., 2007; MOREIRA, FERREIRA et al., 2010; HE, PENG et al., 2011; PIERARD, LISCIA et al., 2011) ou por estresse crônico (PIERARD, LISCIA et al., 2006).
memória e são também afetadas de forma diferente pelos processos de lesão celular relacionados à privação do sono.
Durante o ciclo de sono ocorrem alterações no circuito cerebral e, aparentemente os astrócitos, desempenham um papel importante na homeostase do sono. A injeção de modafinila no córtex cerebral aumenta a expressão do RNAm da Conexina-30 e não da Conexina-43 com um aumento do “coupling” de astrócitos
corticais; injeção de GABA tem um efeito oposto. Essa evidência mostra o papel importante dos astrócitos no ciclo sono-vigília e uma participação das “gap-junctions”
(LIU, PETIT et al., 2013).
1.7 Comunicações intercelulares não-sinápticas
As células que compõem os organismos multicelulares encontram-se organizadas em tecidos e necessitam estar em contato para originar grupos cooperativos que, por sua vez, estão associados em várias combinações formando os órgãos. Foram descritos três tipos de associações, ou junções, que permitem o contato celular direto e colaboram com a homeostasia. Estas são classificadas de acordo com a função que desempenham. As junções de ancoramento promovem a adesão de uma célula à outra ou nos elementos da matriz extracelular. As junções de oclusão atuam de forma a restringir a passagem de substâncias pelo espaço entre as células, principalmente as da pele. E por fim, as junções comunicantes do tipo gap, que promovem a comunicação entre células adjacentes (ALBERTS, BRAY et al., 1994).
1.8 Comunicação Juncional
Os canais intercelulares de junção do tipo gap foram descritos pela primeira vez na década de 60 (KANO & LOEWENSTEIN, 1964). Foi utilizado o termo “junção
comunicante do tipo gap” com a finalidade de descrever regiões especializadas onde
Figura 3 – A. Observa-se a região mais distante entre as células (flechas azuis) e a região onde ocorre íntimo contato entre as células com o máximo de aproximação (flechas
vermelhas). B. Representação da estrutura pentalaminar na região de contato (três “faixas”
mais elétron densas e duas menos eletro densas). C. Eletromicrografia de varredura da placa juncional após criofratura. D. Representação esquemática da placa juncional mostrando os canais formados pelas conexinas. (AVANZO, 2005).
A comunicação via gap junctions, ou comunicação juncional, é realizada pelo alinhamento de conjuntos de canais protéicos transmembranares, chamados de placas juncionais, presentes entre células apostas. Cada placa juncional pode conter até milhares destes canais protéicos. Estes canais são formados pelo alinhamento de dois conjuntos de proteínas transmembranares, chamadas conexinas (Cx), cada grupo de seis proteínas compõem um hemicanal, ou conexon (DERMIETZEL, HWANG et al., 1990; BEYER, 1993).
Além de atuarem de forma direta no desenvolvimento, crescimento e diferenciação celular (KOJIMA, SPRAY et al., 2002), as junções do tipo gap permitem a harmonização e sincronização das atividades celulares. As junções desempenham importante função na regulação da homeostasia tecidual, como a manutenção das constantes fisiológicas (pH e concentrações iônicas) através do rápido transporte de pequenas moléculas célula a célula. São também responsáveis pelo fluxo direto de moléculas com peso molecular variáveis, tais como: íons K+, Cl- e outros mensageiros
compostos do metabolismo intermediário, como os aminoácidos (YAMASAKI, 1990; KUMAR & GILULA, 1996; YAMASAKI & NAUS, 1996).
Conexons, compostos por conexinas do mesmo tipo, formam canais homotípicos, enquanto que aqueles compostos por conexinas de tipos diferentes formarão canais heterotípicos, com propriedades diferentes daquelas esperadas para canais homotípicos (WILLECKE, EIBERGER et al., 2002; GOODENOUGH & PAUL, 2003). A variedade de canais aumenta quando dentro de cada conexon encontramos diferentes tipos de conexinas (WILLECKE, EIBERGER et al., 2002). Canais intercelulares funcionais são formados quando células adjacentes expressam hemicanais complementares que, quando alinhados, permitem o intercâmbio bidirecional de íons e pequenas moléculas entre as células, determinando o acoplamento metabólico e elétrico. Inicialmente pensava-se que somente moléculas de até 1 kDa atravessariam os canais juncionais (LOEWENSTEIN, 1981; KUMAR & GILULA, 1996), atualmente sabe-se que dependendo da conformação, é possível que moléculas com mais de 1,5 e com até 4 kDa passem pelo poro juncional (VALIUNAS, POLOSINA et al., 2005).
De forma importante, o acoplamento juncional pode ainda ser classificado como homocelular, portanto envolvendo células do mesmo tipo, ou heterocelular, quando estabelecido entre células de tipos diferentes (ROUACH, AVIGNONE et al., 2002). Muitas vezes o acoplamento heterocelular envolve conexinas ou conexons de natureza diversa, canais heterotípicos, que combinam características de seletividade e permeabilidade dos diferentes conexons. Sendo assim, possivelmente os acoplamentos heterocelulares apresentam características mais complexas do que as que ocorrem nos acoplamentos homocelulares.
O agrupamento dos canais juncionais na membrana depende de contato intercelular e resulta na formação da placa juncional (normalmente composta de centenas de canais). A placa juncional não é uma estrutura estática e sim dinâmica, isto é, pode ser desagregada e reagrupada, em seguida, numa outra região da membrana celular em resposta a estímulos fisiológicos (EVANS & MARTIN, 2002; THOMAS, JORDAN et al., 2005). Além disso, cada conexon possui meia-vida curta (1-5h, dependendo do tipo de conexina) e é continuamente renovado na membrana, isolado ou agrupado nas placas juncionais (EVANS & MARTIN, 2002; SALAMEH & DHEIN, 2005; THOMAS, JORDAN et al., 2005).
1.9 As conexinas
As conexinas são proteínas transmembranares não glicosadas, com massa molecular variando entre 21 a 70 kDa. Estudos realizados sobre suas estruturas moleculares por técnicas bioquímicas, a partir de frações subcelulares ricas em junções tipo gap, mostraram que a extração destas frações a partir do tecido, só foi possível graças à relativa resistência destas placas juncionais à solubilização por determinados detergentes (N-Laurilsarcosina; Triton–X 100) ou por compostos alcalinos, como o hidróxido de sódio (HERTZBERG & SKIBBENS, 1984).
A primeira conexina identificada e caracterizada foi a Cx32, encontradas em fígado de rato. Após a obtenção da seqüência de aminoácidos da extremidade aminoterminal da proteína pelo método de degradação de Edman, os oligonucleotídeos foram sintetizados e serviram como sondas para produzir bancos de cDNA: fita de ácido desoxirribonucléico complementar a ácido ribonucléico que contém a mensagem que codifica determinada proteína de diferentes tecidos (NICHOLSON, HUNKAPILLER et al., 1981; GOODENOUGH, GOLIGER et al., 1996; HEYNKES, KOZJEK et al., 1986).
Algumas conexinas apresentam certo grau de predominância celular, p. ex.: os astrócitos apresentam canais juncionais formados principalmente pela Cx43, também descrita em neurônios imaturos e alguns neurônios já diferenciados. As Cx30, Cx45 e talvez a Cx26; Cx36 são expressas exclusivamente em neurônios, embora alguns tipos de neurônios também expressem as conexinas Cx32, Cx37, Cx45, Cx47 e Cx57. A Cx26, predomina nas células precursoras do sistema nervoso: células leptomeningeais, ependimócitos, astrócitos e neurônios maduros. Os oligodendrócitos acoplam-se entre si via Cx32, Cx29 e Cx47. Uma visão geral dos tecidos e suas conexinas é apresentada na Tabela 1 (KUMAR & GILULA, 1996).
Atualmente, pouco se sabe sobre o impacto decorrente das alterações nos genes das conexinas. Possivelmente, a identificação de doenças genéticas relacionadas a alterações de conexinas nos fornecerá evidências de que a comunicação via CIJG é crucial para o desenvolvimento e funcionamento de numerosos órgãos (AVANZO, 2005).
tumorais, como por exemplo, em condições em que há um aumento da proliferação celular, a capacidade de comunicação através dos CIJG e a expressão das conexinas encontram-se reduzidas (BUNDUNOVA & WILLIAMS, 1994; GUAN, HARDENBROOK et al., 1995). Além disso, a maioria das células neoplásicas apresenta níveis alterados de expressão das conexinas observando-se uma redução na capacidade de comunicação por CIJG (YAMASAKI & NAUS, 1996). Sabe-se que alguns produtos de oncogenes, como as proteínas src, ras e neu, reduzem as junções intercelulares tipo gap (CHANG, TROSKO et al., 1985).
Evidências anteriores sobre a participação elétrica das comunicações elétricas ou gap junctions no ciclo sono-vigília existem. Inicialmente deve ser considerado que as gap-junctions são a base estrutural para as transmissões rápidas de potenciais elétricos entre neurônios. A atividade elétrica cerebral durante o sono envolve padrões de oscilação de freqüência previsíveis. Presume-se que durante as oscilações relacionadas a níveis de vigília com quietude ou durante o sono, particularmente nas oscilações de alta freqüência (High Frequency Oscillations – HFO), não haja necessidade da transmissão juncional através das gap-junctions (POSLUSZNY, 2014). No entanto, esse assunto parece ser mais complexo.
O núcleo reticular do tálamo participa da regulação do ciclo sono-vigília entre outras funções (CONA, LACANNA et al., 2014). Sabe-se que a comunicação entre o núcleo reticular do tálamo e o córtex é realizada através de sinapses axo-dendríticas e dendro-dendríticas. Chausson et al (2013) sugerem que o influxo de cálcio nas terminações dendro-dendríticas do núcleo reticular do tálamo provoca descargas
tônicas e rajadas de desparos (“burst firing”) que podem envolver as comunicações
elétricas ou gap junctions (CHAUSSON, LERESCHE et al., 2013).
sugerindo um papel para as HFOs durante o sono e nos processamento da memória (BUKALO, CAMPANAC et al., 2013; TORT, SCHEFFER-TEIXEIRA et al., 2013).
2 JUSTIFICATIVA
O sono, diferente do que a maioria da população acredita, é um estado ativo e essencial ao organismo. Evidências cumulativas indicam que o sono desempenha um papel importante em processos neurocomportamentais, tais como a memória. Contudo, os mecanismos subjacentes envolvidos permanecem obscuros. A privação do sono é um achado clínico comum e compromete o desempenho do indivíduo que é essencial ao trabalho na escola e em outras tarefas diárias. Na verdade, as repercussões da perda do sono sobre o funcionamento humano são tão comuns que é difícil encontrar funções que permaneçam intactas. A perda de sono afeta a segurança e representa um perigo para o trabalhador em seu ambiente laboral. Neste contexto, as pesquisas têm cada vez mais investigado o papel do sono no funcionamento cognitivo, bem como as alterações comportamentais e estruturais que ocorrem em associação com a privação do sono.
3 OBJETIVOS
3.1 Objetivo Geral
Avaliar os efeitos da privação de sono paradoxal, sem recuperação do sono, sobre o comportamento, as alterações cerebrais e as interações com o uso da Modafinila.
3.2 Objetivos específicos
Avaliar em um modelo de privação de sono induzido em camundongos após 48h e 72h:
A atividade locomotora nos modelos de campo aberto; O comportamento de ansiedade e depressão;
A memória aversiva recente e tardia A memória de trabalho
O estresse oxidativo;
4 MATERIAL E MÉTODOS
Este estudo foi realizado de acordo com os princípios éticos da Sociedade Brasileira de Ciências em Animais de laboratório (SBCAL) e o protocolo foi previamente aprovado pelo Comitê de Ética da Universidade Federal do Ceara.
4.1 Animais e Drogas
Camundongos machos foram alojados em grupos de oito em condições normais de laboratório, em caixa com comida e água ad libitium em ciclo claro-escuro (22 ± 2°C, ciclo 12 h claro/escuro luzes as 7:00 horas).
Os animais foram obtidos do Biotério do Departamento de Fisiologia e Farmacologia da UFC. O trabalho foi APROVADO pelo Comitê de Ética e Pesquisa Animal segundo o protocolo 67/09 em reunião realizada em 29 de junho de 2009.
.Foi utilizado a Modafinila 32mg/kg administrada por via oral
4.2 Privação de sono e procedimentos
O método de privação de sono utilizado é uma adaptação do teste de plataformas múltiplas, originalmente desenvolvido em ratos. Grupos de quatro animais foram colocados em tanques de água (41x34x16.5cm), circundados de água contendo 14 plataformas (3cm de diâmetro) cada com água ate 1 cm abaixo da superfície durante 48h e 72h. Neste modelo, os animais (N = 08 em cada grupo no total, divididos em duas etapas com 4 animais) são capazes de se mover no tanque pulando de uma plataforma para outra. Comida e água são colocadas a disposição através de uma grade o topo do tanque. Animais não privados de sono são mantidos na suas caixas na mesma sala. Este protocolo mostrou prevenir a ocorrência de sono de ondas lentas e sono REM sob tais condições de laboratório (VAN HULZEN & COENEN, 1981). Para estudo de efeito rebound os animais privados de sono são permitidos 24 horas nas suas caixas de origem.
4.3 Avaliação da atividade locomotora
O teste do campo aberto foi usado antes e após a privação do sono para avaliação da atividade motora (ARCHER, 1973). O aparato para camundongos é feito de acrílico (com paredes transparentes e piso escuro, medindo 30x30x15cm) e dividido em 09 quadrantes iguais. Após a privação de sono (ou não, nos casos controles) um animal por vez é colocado no centro do campo aberto onde foi medido o número de cruzamentos (uma entrada no quadrado foi contada quando o animal coloca todas as 4 patas). O número de movimentos de autolimpeza (grooming) e a freqüência de rearing (número de vezes que o animal fica apoiado nas patas traseiras) também foi medido. O sistema foi lavado com etanol (5%) antes e após o teste para evitar odores entre os animais.
Figura 5: Teste do Campo Aberto
4.4 Nado forçado
Figura 6: Teste do Nado Forçado
4.5 Teste da Suspensão de Cauda
Neste experimento todos os grupos foram avaliados, um animal por vez. O teste consta em suspender o animal, preso por fita adesiva a cerca de 1cm da ponta da cauda em uma plataforma 58cm acima da bancada durante 6 minutos. Os parâmetros avaliados foram o tempo em segundos de imobilidade e a latência da primeira imobilidade (STERU, CHERMAT et al., 1985).
4.6 Teste do Labirinto em cruz elevado (Plus maze)
O labirinto em cruz elevado (LCE) é baseado no modelo proposto, em ratos, por Pellow (PELLOW, CHOPIN et al., 1985) e validado por Lister (LISTER, 1987) para camundongos, e consiste de dois braços abertos opostos (30x5x25 cm) e dois fechados (30x5x25 cm), também opostos, em forma de cruz grega. Os braços abertos e fechados estão conectados por uma plataforma central (5x5 cm). A plataforma (figura 8), as paredes laterais dos braços fechados e o chão foram confeccionados em acrílico. O aparelho fica elevado a uma altura de 45 cm do nível do chão. Uma hora (v.o.) após os tratamentos ou o veículo, os camundongos foram colocados no centro do aparelho com a cabeça voltada para um dos braços fechados e o seu comportamento observado por 5 minutos.
As medidas comportamentais registradas no LCE foram: número de entradas e o tempo despendido nos braços abertos e nos fechados. Neste modelo, os roedores evitam os braços abertos do labirinto, restringindo a maioria de suas atividades aos braços fechados. Um aumento seletivo nos parâmetros correspondentes aos braços abertos (entradas e tempo) revela um efeito ansiolítico (PELLOW, CHOPIN et al., 1985, PELLOW & FILE, 1986), e o inverso é verdade para compostos ansiogênicos. O número de entradas nos braços fechados avalia a atividade motora dos animais (RODGERS, JOHNSON et al., 1996; RODGERS & DALVI, 1997).
Figura 8: Labirinto em cruz elevada
4.7 Avaliação da memória de trabalho - Teste do labirinto em Y (SARTER et al., 1988).
com os três braços iguais (SARTER, BODEWITZ et al., 1988). Os animais apresentam forte tendência de alternar a entrada nos diferentes ambientes.
O labirinto em Y é composto por três braços de madeira com 16 cm de altura, 5 cm de largura e 40 cm de comprimento (Figura 9).
Figura 9 - Labirinto em Y. Fonte: arquivo pessoal.
Para a avaliação da memória os braços foram numerados. O animal foi colocado no aparelho e durante 8 minutos o número de cada braço que o animal entrou foi anotado. Foi considerado acerto cada vez que o animal entrou em 3 diferentes braços sem repetição. O resultado foi expresso em porcentagem e obtido através da seguinte fórmula matemática:
O sucesso do teste é indicado pela alta taxa de alternância nos grupos controle, indicando que os animais podem se lembrar em qual braço entraram por último (STONE, WALSER et al., 1991). Entre cada sessão, o labirinto foi higienizado com uma solução de álcool a 20% e secado com toalhas de papel.
4.8 Teste de Esquiva Inibitória (Step Down Inhibitory Avoidance Test).
plataforma e a latência de descida foi mensurada (índice que avalia a memória de curto prazo), sendo que não houve mais choques nas patas. Vinte e quatro horas depois, o animal foi novamente posicionado na caixa e a latência de descida foi registrada como um índice de memória de longo prazo. A caixa foi limpa com álcool 70% após cada sessão.
Figura 10: Aparelho para Step Down
4.9 Dissecações das áreas cerebrais (córtex pré-frontal, hipocampo e corpo estriado)
Figura 11: Dissecação da área cerebral
4.10 Análise do Estresse Oxidativo
4.10.1 Dosagem de nitrito na amostra de tecido cerebral.
O método é baseado na utilização do reagente de Griess que mostra a presença de nitrito na amostra por uma reação de diazotização que forma um cromóforo de cor rósea. O reagente é preparado utilizando partes iguais de Ácido Fosfórico 5%, N-1-naftilenodiamina (NEED) 0,1%, Sulfanilamida 1% em ácido fosfórico 5% e água destilada. Para realização do ensaio foi adicionado 100µL do sobrenadante do homogenato a 10%, feito com tampão de fosfato de potássio, em 100µL do reagente de Griess, para o branco foi adicionado 100µL do reagente em 100µL de tampão e para a obtenção da curva do padrão foram feitas diluições em série (100; 50; 25; 12,5; 6,25; 3,12; 1,56 µM) de nitrito. Todo o ensaio foi feito em uma placa de 96 poços e a leitura feita na faixa de absorbância de 560nm (GREEN, TANNENBAUN et al., 2000).
4.10.2 Papel da lipoperoxidação no modelo avaliado
4.11 Preparo da amostra para o corte em criostato e análise das conexinas em microscópio confocal.
Os animais foram perfundidos através do ventrículo esquerdo com salina gelada, seguido de paraformaldeído a 4% em PBS. Os cérebros foram removidos e pós-fixados com formol tamponado por 24 horas, após esse período foram armazenados em solução crioprotetora de sacarose a 30% em geladeira. O tecido foi cortado no criostato fatias de 40µm e montado em lâminas gelatinizadas.
4.12 Análise Estatística
5 RESULTADOS
A atividade locomotora espontânea, de elevação e de higiene foram os parâmetros analisados e os resultados foram expressos em número de cruzamentos (crossing), de elevação (rearing) e auto-higiene (grooming). Como demonstrado na Figura 12, quando comparado ao controle [69,57±3,09], o grupo 48hPSP [68,50±4,42] não apresentou qualquer efeito sobre a atividade exploratória dos animais. Por outro lado, o grupo 72hPSP [24,50±4,04], mostrou efeito depressor visualizado pela acentuada redução no número de cruzamentos (p=0,001).
Considerando o comportamento de rearing, a privação de sono paradoxal, em ambos os grupos, apresentou um efeito de diminuição do número de rearings [48hPSP=4,00±0,86 vs 72hPSP= 2,67±0,95], quando comparado ao grupo controle [21,50±1,89, p=0,002].
Na avaliação da ocorrência de comportamento de grooming na Figura 12, quando comparado ao controle [2,75±0,31], o grupo 48hPSP [17,00±1,46] apresentou um aumento do número desse comportamento (p=0,007), como também ocorreu com os animais submetidos a 72hPSP [17,50±1,63; p=0,007].
Efeitos sobre a memória e biomarcadores de estresse oxidativo
Nossos resultados mostram que a privação de sono paradoxal reduz os níveis de NO em quase todas as regiões estudadas, com exceção do corpo estriado em camundongos privados de sono paradoxal por 48 horas. Observa-se também um aumento dos níveis de TBARS em todas as áreas examinadas e grupos estudados. A memória de trabalho foi afetada em ambos os grupos submetidos a PSP enquanto a memória aversiva foi afetada apenas no grupo que foi submetido a PSP durante 48 horas.
Os grupos de camundongos submetidos a 48hPSP (p=0,002) e 72hPSP (p=0,000) mostraram pior desempenho no teste do labirinto em Y (Figura 13). Animais submetidos a 48hPSP tiveram a memória aversiva, avaliada pelo teste do step-down, prejudicada. Animais submetidos a 72hPSP não apresentaram déficit na memória aversiva em comparação com os controles (Figura 14).
Figura 14 - Efeito da privação de sono paradoxal sobre o teste step-down em camundongos. Os animais privados pro 48h de sono paradoxal mostraram pior desempenho para a memória aversiva, quando avaliado pelo step-down, em comparação com ao grupo controle (teste de Mann-Whitney, p=0,007). Camundongos privados de sono paradoxal por 72h não mostraram déficit na memória aversiva em comparação aos controles.
Nossos dados mostram que a privação de sono paradoxal reduz os níveis de NO em quase todas as regiões estudadas, com exceção do corpo estriado em camundongos privados de sono paradoxal por 48 horas. Observa-se também um aumento dos níveis de TBARS em todas as áreas examinadas e grupos estudados. A memória de trabalho foi afetada em ambos os grupos submetidos a PSP enquanto a memória aversiva foi afetada apenas no grupo que foi submetido a PSP durante 48 horas.
Os camundongos submetidos à 72hPSP apresentaram níveis reduzidos de nitrito no corpo estriado (Figura 15 (A), p=0,004). Não foram encontradas diferenças nos animais submetidos a 48hPSP. Ambos os grupos de animais submetidos a 48hPSP e 72hPSP apresentaram níveis menores de nitrito no hipocampo (Figura 15 (B), p=0,01 e p=0,007, respectivamente).
Diferenças foram encontradas também no córtex pré-frontal em ambos os grupos de animais (Figura 15 (C), p= 0,01 e p= 0,002, respectivamente).
No corpo estriado, os animais do grupo controle apresentaram valores mais elevados de nitrito (123,8 µM ± 6,125) em comparação com animais submetidos a 48hPSP (92,13 µM±15,73) e 72hPSP (64,17 µM±5.247).
No hipocampo, os animais do grupo controle, apresentaram níveis mais elevados de nitrito (96,67 µM±4.59) em comparação com os animais submetidos a 48hPSP (65,35µM±5.54) e 72hPSP (64,88µM± 4.36).
Figura 15 - Efeitos da privação de sono paradoxal sobre o estresse oxidativo mensurado pelos níveis de nitrito no corpo estriado (A), no hipocampo (B) e no córtex préfrontal (C) de camundongos. Controles apresentaram valores de nitrito maiores em todas as áreas comparados para tanto com grupos privados 48h e 72h. Resultados foram expressados considerando p <0,05 e IC 95% (teste Kruskall-Wallis seguido pelo teste post hoc de Bonferroni)
Camundongos privados de sono paradoxal, em ambos os grupos, mostraram níveis significativamente mais altos de TBARS no corpo estriado, hipocampo e no córtex pré-frontal, como demonstrado na Figura 16.
No corpo estriado, o grupo controle (11,74µmol ± 2,285) apresentou níveis mais reduzidos quando comparado aos animais submetidos a 48hPSP (50,17µmol ± 3.45) e 72h (33,65µmol ± 2.79).
No hipocampo, o controle apresentou valores inferiores (6,95µmol ± 0,68) em comparação ao grupo 48hPSP (40,96µmol ± 3,54) e 72hPSP (38,34µmol ± 4.25,).
No córtex pré-frontal, o controle apresentou valores mais reduzidos de TBARS (7,183µmol ± 0,98) em relação ao grupo 48hPSP (37,22µmol ± 3.92) e 72h (39,83µmol ± 2.03). Os valores relacionados a esse estudo estão apresentados na Tabela 4.
comparadas para ambos os grupos privados d sono paradoxal. Resultados oram expressados considerando p <0,05 e IC 95% (teste Kruskall-Wallis seguido pelo teste post hoc de Bonferroni).
Tabela 4. Análise descritiva dos testes de memória (
Y-Maze e Step Down
) e
análises bioquímicas para Nitrito e TBARS em todos os grupos.
Controle
48hPSP
72hPSP
Y
–
Maze
80.83% (± 1,98 EP)
57.51% (±3,22 EP)
66.40% (±2,72 EP)
Step
Down
276.4s (± 23.60; 48h)
272.0s (± 23.32; 72h)
71.80s (± 26.76 EP)
300.0s (± 0)
Nitrito
CE
123.8
μM
(± 6.125 EP)
92.13
μM
(15.73 ± EP)
64.17
μM
(± 5.247 EP)
Nitrito
HC
96.67μM
(± 4.592 EP)
65.35 μM
(5.542 ± EP)
64.88
μM
(± 4.367 EP)
Nitrito
CPF
117.1
μM
(± 6.196 EP)
58.58μM
(6.508 ± EP)
65.01
μM
(± 3.729 EP)
TBARS
CE
11.74
μmol
(± 2.285 EP)
50.17μmol
(3.454 ± EP)
33.65μM
(± 2.792 EP)
TBARS
HC
6.955μmol
(±0.687 EP)
40.96μmol
(3.548 ± EP)
38.34μM
(± 4.250 EP)
TBARS
CPF
7.183μmol
(± 0.988 EP)
37.22μmol
(3.921 ± EP)
39.83μM
(± 2.033 EP)
CE = Corpo estriado, HC = hipocampo, CPF = córtex prefrontal, EP = erro
padrão
Efeito da Modafinila sobre os parâmetros comportamentais
Como mostrado na Figura 17, em comparação com o controle [69,57±3,09], o grupo 72hPSP [27,14±4,31] mostrou uma acentuada redução no número de cruzamentos (p=0,006) tendo esses valores sido revertidos após o tratamento com Modafinila.
Figura 17 - Efeito da privação de sono paradoxal e Modafinila sobre a atividade locomotora de camundongos (A), elevações (B) e de auto-higiene (C). Todos os grupos têm n=8 e os testes foram feitos após a privação de sono paradoxal (grupo privação de sono paradoxal de 72 horas e os grupos tratados Modafinila). Os resultados foram expressos considerando p <0,05 e IC de 95% (Kruskall-Wallis seguida pelo teste de Bonferroni como post hoc). Em comparação entre controle e 72hPSP foi feito o teste t (Mann-Whitney) p=0,0006 (A), p=0,001 (B) e p=0,0007 (C).
No labirinto em cruz elevado (Plus maze) foi avaliado o número de entradas em cada braço (aberto ou fechado) e o tempo gasto nesses braços.
A Figura 18 mostra o número de entradas no braço aberto (NEBA) e o número de entradas nos braços fechados (NEBF). Quando comparados com o controle [NEBA=4,37±1,08 e NEBF=6,75±0,94], os animais submetidos a 72hPSP [NEBA=10,71±0,96 e NEBF=11,50±0,50] apresentaram um aumento no número de entrada para ambos os braços (p<0,05). Analisando o tempo no braço aberto em relação ao controle [67,40±13,08], os animais submetidos a 72hPSP apresentaram uma maior permanência nesse ambiente [153,2±21,02, p=0,004]. No grupo submetidos a 72hPSP e tratado com Modafinila, apresentou uma redução do NEBA no tempo de permanência no braço aberto.
Figura 18 - Efeito da privação de sono paradoxal e Modafinila no número de entradas nos braços abertos (A), nos braços fechados (B) e no tempo no braço aberto (C) do labirinto em cruz elevado. Todos os grupos têm n=8 e os testes foram feitos após a privação de sono paradoxal (grupo 72 horas). Os resultados foram expressos considerando p <0,05 e IC de 95% (ANOVA e Kruskall-Wallis seguida pelo teste de Bonferroni como post hoc). Na comparação entre o controle e o grupo 72hPSP foi realizada test t (Mann-Whitney) p=0,003 (A), p=0,028 (B) e p=0,004.
Os animais com 72hPSP apresentam maior tempo de imobilidade que os controles [Figura 19.A: Controle= 34,17±3,62 vs 72hPSP=109,0±12,8, p=0,001]. Os animais 72hPSP apresentaram menor tempo da primeira latência para a imobilidade que os controles [Figura 19.B: Controles=119,0±8,56 e 72hPSP=16,60±5,13, p=0,002] e nado forçado [Figura 19.C: Controles= 2,67±0,49 vs 72hPSP=64,60±8,49, p=0,004]. Observou-se uma reversão desses três parâmetros após o uso de Modafinila.