UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS AGRÁRIAS
DEPARTAMENTO DE ENGENHARIA DE PESCA
INVESTIGAÇÃO DA QUALIDADE MICROBIOLÓGICA DE CAMARÕES Litopenaeus vannamei COMERCIALIZADOS EM DUAS LOJAS DE UMA REDE
DE SUPERMERCADOS, DE FORTALEZA, CEARÁ.
BRUNO ÁTILA BATISTA MOREIRA
Monografia apresentada ao Departamento de Engenharia de Pesca do Centro de Ciências Agrárias da Universidade Federal do Ceará, como parte das exigências para a obtenção do título de Engenheiro de Pesca.
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
M836i Moreira, Bruno Átila Batista.
Investigação da qualidade microbiológica de camarões Litopenaeus vannamei
comercializados em duas lojas de uma rede de supermercados, de Fortaleza, Ceará / Bruno Átila Batista Moreira. – 2008.
43 f. : il. color.
Trabalho de Conclusão de Curso (graduação) – Universidade Federal do Ceará, Centro de Ciências Agrárias, Curso de Engenharia de Pesca, Fortaleza, 2008.
Orientação: Prof. Dr. Regine Helena Silva dos Fernandes Vieira.
1. Camarão - Controle de qualidade. 2. Alimentos - Controle de qualidade. 3. Segurança alimentar. I. Título.
COMISSÃO EXAMINADORA:
ect È ei9
.9.-1-.0.S
Profa. Regine Helena Silva dos Fernandes Vieira, DSc. Orientador/Presidente
Francisca Gleire Rodrigues de Menezes, MSc. Membro
Fátima Cristiane Teles de Carvalho, MSc. Membro
VISTO:
Prof. Moisés Almeida de Oliveira, DSc. Chefe do Departamento de Engenharia de Pesca
Resumo
Lista de Figuras ii
Lista de Tabelas
1. INTRODUÇÃO 1
1.1. Revisão Bibliográfica 4
1.2. Doenças Transmitidas por Alimentos (DTA's) 4
1.3. Staphylococcus coagulase positiva 5
1.4. Salmonella 6
1.5. (coliformes totais e termotolerantes) Escherichia coli 8
2. MATERIAL E MÉTODOS 10
2.1. Procedimento das Coletas 10
2.2. Análises Microbiológicas: Diluições das amostras 11 2.2.2. Pesquisa de Staphylococcus coagulase positiva 12 2.2.2.1.Quantificação e isolamento de Staphylococcus coagulase positiva 12
2.2.2.2. Teste de Gram - Morfologia das cepas 13
2.2.2.3. Prova da coagulase 14
2.2.3. Pesquisa de Salmonella 15
2.2.3.1. Pré-Enriquecimento 15
2.2.3.2. Enriquecimento seletivo 15
2.2.3.3. Isolamento em meios seletivos 16
2.2.4. Colimetria - Quantificação de coliformes totais 18
2.2.4.1. Prova Presuntiva 18
2.2.4.2. Prova confirmatória 18
2.2.4.3. Prova completa 18
2.2.4.4. Testes bioquímicos do IMViC 19
2.2.4.4.1. Indo' 19
2.2.4.4.2. Teste do Vermelho de Metila (VM) 19
2.2.4.4.3. Teste de Voges-Proskauer (VP) 20
3. RESULTADOS E DISCUSSÃO 22
4. CONCLUSÕES 28
11
LISTA DE FIGURAS;
FIGURA 1 - Disposição dos camarões Litopenaeus vannamei
nas gôndolas dos supermercados em Fortaleza, CE 10
FIGURA 2 - Transporte das amostras de camarão ao laboratório,
em caixa isotérmica com gelo. 11
FIGURA 3 - Placa com colônias típicas de Staphylococcus aureus
em meio Baird-Parker. 12
FIGURA 4 - Método de coloração de Gram utilizado para verificação
morfológica das cepas utilizadas. 14
FIGURA 5 - Fluxograma de identificação de Staphylococcus coagulase positiva a partir de amostras camarão comercializados em dois supermercados em
Fortaleza, CE. 15
FIGURA 6 - Fluxograma para identificação de Salmonella a partir de isolados de amostras de camarão de duas lojas de uma
rede de supermercados em Fortaleza, CE. 17
FIGURA 7 - Fluxograma para contagem de coliformes totais e termotolerantes e identificação de Escherichia coli
a partir de isolados de amostras de camarão de duas lojas de uma rede de supermercados em
TABELA 1 Resultado das contagens CPP para Staphylococcus coagulase positiva das amostras de camarão adquiridas nas duas lojas de uma rede de supermercados de
Fortaleza-CE 22
TABELA 2 - Número Mais Provável (NMP) de coliformes totais e termotolerantes nas amostras de camarão coletadas
da loja A. 25
TABELA 3 - Número Mais Provável (NMP) de coliformes totais e termotolerantes nas amostras de camarão coletadas
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 1
INVESTIGAÇÃO DA QUALIDADE MICROBIOLÓGICA DE CAMARÕES
Litopenaeus vannamei COMERCIALIZADOS EM DUAS LOJAS DE UMA REDE
DE SUPERMERCADOS, DE FORTALEZA, CEARÁ.
Bruno Átila Batista Moreira.
1. INTRODUÇÃO
A preocupação com a higiene dos alimentos vem crescendo no decorrer dos anos com o aumento do número de pessoas que fazem suas refeições fora de casa. Os alimentos ficam vulneráveis à contaminação por microrganismos, devido à manipulação e aos procedimentos inadequados durante o processamento e consumo (BENEVIDES; LOVATTI, 2004). A manipulação de alimentos é fator de risco para contaminação, dependendo do tempo de exposição e do tipo de matéria prima manipulada. Também a higienização inadequada de utensílios e equipamentos, temperatura inadequada, conservação dos alimentos, higiene pessoal são fatores de risco para contaminação, podendo essa contaminação advir da matéria-prima, do ar, do pó e/ou do próprio manipulador (GERMANO et al., 2000).
A conseqüência da falta de cuidados higiênico-sanitários na produção de alimentos é a ocorrência de Doenças Transmitidas por Alimentos (DTA). Estas doenças, além de ocasionarem danos a saúde, também podem prejudicar a credibilidade dos estabelecimentos, gerando gastos com indenizações, tratamentos médicos e até mesmo autuação e prisão dos responsáveis, entre outras penalidades (BENEVIDES; LEOVATTI, 2004).
Segundo Ungar et al. (1992), estima-se que, anualmente, entre 1 milhão e 100 milhões de indivíduos no mundo contraem doenças decorrentes do consumo de água e alimentos contaminados. Os dados estatísticos mostram que mais de 60% dos casos de toxinfecções surgem em decorrência de deficiências no controle higiênico-sanitário durante o processamento dos alimentos (BRYAN, 1984; SHILLING, 1995).
O pescado é um alimento de excelente valor nutritivo, devido às suas proteínas de alto valor biológico, vitaminas e ácidos graxos insaturados. Entretanto é bastante perecível, necessitando de condições sanitárias adequadas desde a captura até a manipulação e comercialização a fim de chegar ao consumidor como um produto seguro e de boa qualidade microbiológica (FRANCO; LANDGRAF, 1996; GERMANO et al., 1993). O camarão, sendo um pescado, segue o mesmo raciocínio. Seu cultivo, principalmente o de origem marinha, vem se intensificando no mundo, sendo implantado com sucesso em países como Equador, México, Panamá, Tailândia e Estados Unidos. No Brasil este tipo de cultivo é encontrado na Região Nordeste, basicamente nos Estados do Ceará, Paraíba, Piauí e Rio Grande do Norte (VALENÇA; MENDES, 2004).
Uma das principais preocupações do cultivo do camarão marinho, que é a proliferação de bactérias, abrange todas as fases: desde o cultivo até o consumo. Dentre as bactérias de importância para os consumidores que pode ser vinculado aos camarões, encontram-se: Salmonella, Staphylococcus coagulase positiva e
Escherichia coli, limitadas na legislação vigente nacional (BRASIL, 2001).
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 3
salmonelas são amplamente distribuídas na natureza, sendo ainda encontradas na microbiota de alguns animais de sangue frio (JAKABI et al., 1999).
A legislação RDC 12/2001 (BRASIL, 2001) recomenda ausência total de
Salmonella spp. em qualquer produto alimentar_
Staphylococcus aureus é uma bactéria responsável por uma grande
variedade de infecções, desde as leves / moderadas — como as superficiais, de pele / partes moles — até aquelas envolvendo elevada morbidade e mortalidade, como a infecção de corrente sangüínea e a pneumonia (LOPES, 2005). Surtos de intoxicação alimentar são freqüentemente relatados e os causados por
Staphylococcus aureus são os mais comuns (RADDI et al., 1988).
O grupo dos coliformes termotolerantes é formado pelos coliformes que fermentam lactose, com produção de gás dentro de 48 horas, em temperaturas entre 44,5 e 45,5 "C, normalmente em caldo EC. Podem ser recuperadas por esse teste Escherichia coli, Citrobacter freundii, Enterobacter sp. (incluindo E.
aerogenes e E cloacae). Entretanto, Escherichia coli é a única espécie cujo
habitat primário é o trato gastrintestinal do homem e de animais (VIEIRA; TORRES, 2004).
Segundo Dias et ai. (1994), E. coli da microbiota normal do intestino humano pode contaminar, colonizar e subseqüentemente causar infecções extra-intestinais, sendo um dos principais agentes etiológicos de septicemias, meningites e infecções do trato urinário de humanos.
O objetivo deste trabalho foi verificar em duas lojas de uma rede de supermercados a qualidade microbiológica do camarão de cultivo Litopenaeus
vannamei ofertado ao público, através de análises que quantificam
1.1. REVISÃO BIBLIOGRÁFICA
1.1.2. Doenças Transmitidas por Alimentos (DTA's)
A sigla DTA refere-se àquelas Doenças Transmitidas pelos alimentos ao homem (VIEIRA, 2004). Existem duas maneiras dos microrganismos provocarem doenças ao consumidor: através de intoxicação, quando nos referimos à ingestão da toxina previamente formada pelo microrganismo no alimento e por infecção, que é a ingestão do microrganismo no alimento, sua fixação, colonização de órgãos ou tecidos ou tecidos específicos, desenvolvimento, multiplicação e lançamento de suas toxinas, por ventura, elaboradas (LEITÃO, 1988).
As doenças transmitidas por alimentos (DTA's) são comuns em nosso país mas representam atualmente um sério problema para a saúde pública. Muito embora a maioria dos casos seja considerada como leves e moderados, algumas infecções mais graves podem causar seqüelas e até mesmo óbitos, além dos gastos hospitalares, do afastamento de atividades profissionais e escolares. Estudos relacionados ao tema tornam-se necessários, não apenas para o conhecimento da doença e do ambiente, mas para aprimorar a segurança alimentar e as praticas de manipulação e comércio de alimentos para a população (LIRA, 2005).
O desenvolvimento nas técnicas de produção e industrialização de alimentos de origem animal resultaram em melhoras consideráveis em suas condições higiênicas. Porém, apesar de inúmeros avanços, ainda hoje se constata surtos de doenças transmitidas por alimentos (DTA's) (NADVORNY et al., 2004).
Salmonella, E coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 5
1.1.3. Staphylococcus Coagulase Positiva
As bactérias pertencentes ao gênero Staphylococcus são cocos Gram-positivos, pertencentes à família Micrococcaceae e, por dividirem-se em planos diferentes, quando vistos ao microscópio, aparecem na forma de cachos de uva. São facultativamente anaeróbias, com maior crescimento sob condições aeróbias, quando produzem catalase (FRANCO; LANDGRAF, 1996), sendo que algumas espécies são associadas freqüentemente a uma ampla variedade de infecções de caráter oportunistas, em seres humanos e animais (MARTINS, 1999). As espécies que se destacam como patógenos potenciais são S. aureus, S. intermedius, S.
delphini, S. schleiferi subsp coagulans e várias espécies de S. hyicus, sendo o S.
aureus o mais importante deles (KLOOS; BANNERMAN, 1999). Para a maioria dos laboratórios clínicos, os isolados de fontes humanas sendo coagulase positivos são sempre considerados S. aureus (LARSEN; MAHON,1995).
O referido gênero bacteriano é amplamente distribuído na natureza, sendo encontrado no ar, solo e água, de modo que as mucosas das cavidades nasais e superfícies da pele do homem e animais são os maiores reservatórios da espécie
Staphylococcus coagulase positiva (FILHO; FILHO, 2000).
São produtores de enterotoxina e têm um comportamento mesofílico, apresentando temperatura de crescimento na faixa de 7 a 48,7°C, com ótimo na faixa de 30 a 37°C. As enterototoxinas são produzidas entre 10 e 46°C, com ótimo entre 40 e 45°C (FRANCO ; LANDGRAF, 1996).
Crescem em concentrações de 10 a 20% de cloreto de sódio (NaCI) e em meios contendo nitratos, o que torna os alimentos curados ótimos veículos para as mesmas (GABUTTI et al., 2000).
A presença de Staphylococcus aureus nos alimentos é relativamente freqüente, particularmente naqueles submetidos a manuseio intenso, refrigeração inadequada e condições precárias de higiene (ROITMAN et al., 1988), entretanto
ação de enzimas proteolíticas gastrointestinais, tomando-se por exemplo a pepsina (BENNET,1984).
S. aureus são largamente disseminados no ambiente, sendo o homem e outros animais seu principal reservatório. A cavidade nasal é o principal habitat dos estafilococos no homem e a partir deste foco, atingem tanto a epiderme e feridas como o ar, água, solo e qualquer tipo de objeto que tenha entrado em contato com o homem (FRANCO; LANDGRAF, 1996). Segundo Konemam et al. (2001) estima-se que a bactéria esteja presente nas fossas nasais de 20% a 40% de humanos adultos saudáveis. Embora encontrado com relativa freqüência como membro da microbiota normal do corpo humano, Staphylococcus aureus é uma das bactérias patogênicas mais importantes, uma vez que atua como agente de uma ampla gama de infecções, variando desde aquelas localizadas, geralmente superficiais, até algumas disseminadas, com elevada gravidade (TRABULSI et al., 2004).
aureus causa intoxicação alimentar, sendo a gastrenterite a doença mais mais comum, provocada pela ingestão de alimentos que apresentam sua toxina pré-formada, onde o agente casual do surto não é a bactéria e, sim, sua toxina (SOARES et al., 1997).
1.1.4. Salmonella
A contaminação de alimentos de origem marinha por bactérias Gram-negativas patogênicas ao homem é de grande interesse do ponto de vista de saúde pública. A salmonelose é uma das doenças zoonóticas mais prevalentes e apesar de constantes inspeções por parte de órgãos competentes, os surtos de Doenças Transmitidas por Alimentos (DTA) estão aumentando, particularmente nos países ocidentais (EVANGELISTA - BARRETO, 2004).
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 7
peritríquios, exceção feita à S. Pulorum e à S. Gallinarunn, que são imóveis (FRANCO ; LANDGRAF, 1996).
Segundo Trabulsi et al. (2004), existem 2.501 sorotipos de salmonelas dentre os quais 1.478 pertencem à subespécie enterica. A classificação das salmonelas, atualmente baseia-se na hibridação DNA-DNA, embora a literatura mostre que não há consenso definitivo. Admite-se que o gênero Salmonella apresente duas espécies, Salmonella enterica e Salmonella bongori, entretanto, estudos apontam para a descoberta de mais uma espécie, que foi chamada de
Salmonella subterrânea sp. nov.
Embora Salmonella esteja presente em toda parte, seu reservatório primário é o trato intestinal (ANTUNES et al., 2003) do homem e de animais, tais como: aves, suínos, eqüinos, roedores, anfíbios, répteis, cães, gatos, pássaros, etc (FRANCO; LANDGRAF, 1996).
A transmissão de Salmonella para o homem geralmente ocorre pelo consumo de água e alimentos contaminados, embora, a transmissão de pessoa para pessoa possa ocorrer, particularmente nos hospitais, ou ainda, através do contato com animais infectados, principalmente entre veterinários e trabalhadores de granjas e fazendas (TRABULSI, 2008).
A excreção da Salmonella através das fezes de humanos e/ou animais, pode contaminar água, solo, outros animais e alimentos. Os animais são infectados pelo contato direto de fezes, água e alimentos contaminados (ARGÔLO FILHO, 2007).
Em função da capacidade de disseminação e de sobrevivência por longo período de tempo no meio ambiente, as salmonelas podem ser isoladas de águas doces superficiais, da costa marítima e, conseqüentemente, de diversas matérias-primas alimentares (JAKABI et al. 1999).
1.1.5. Coliformes Totais e Coliformes Termotolerantes ou Fecais: Escherichia coli
Em 1885, Theodor Von Escherich descreveu um organismo isolado de fezes de crianças, denominado Bacterium coli commune, também chamado
Bacillus coli, que em sua homenagem foi finalmente denominado Escherichia coli
(ASHBOLT et al., 2001; TÔRRES, 2004).
A principal causa de doenças diarréicas é a ingestão de alimentos e/ou águas contaminadas por microrganismos patogênicos. Um dos agentes etiológicos das infecções entéricas é a bactéria Escherichia coli que, presente em águas ou alimentos, indica uma contaminação de origem fecal e um possível risco à saúde (TÔRRES, 2004).
O grupo dos coliformes totais incluem bactérias Gram-negativas, não esporuladas, aeróbios e anaeróbios facultativos, em forma de bastonetes curtos capazes de fermentar a lactose com produção de ácido e gás em 24 a 48 horas a 35 °C (HAGLER; MENDONÇA-HAGLER, 1988; SIQUEIRA, 1995; SILVA et al., 2001; MENDONÇA-HAGLER et 2001).
Fazem parte desse grupo predominantemente bactérias pertencentes aos gêneros Escherichia, Enterobacter, Citrobacter e Klebsiella (FRANCO; LANDGRAF, 1996).
O habitat e principal reservatório de E. coli é o trato intestinal do homem e de outros animais de sangue quente (LEITÃO, 1988). É um comensal do intestino suprimindo bactérias nocivas e participa da síntese de numerosas vitaminas. Representa 80% da flora intestinal aeróbia, sendo eliminada nas fezes, o que propicia a contaminação do solo e das águas (GERMANO; GERMANO, 2003).
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 9
a outros fatores, tais como a temperatura, radiação solar e competição com outros seres vivos (VIEIRA et al., 2001).
Por não fazer parte da microbiota dos pescados marinhos, a presença de E.
coli está associada à contaminação fecal da água do local de captura e/ou ao transporte e manuseio do pescado (TÔRRES, 2004).
2. MATERIAL E MÉTODOS 2.1. Procedimento das Coletas
Foram analisadas 24 amostras obtidas de duas lojas de uma mesma rede de supermercados de Fortaleza-CE, entre os meses de Abril a Novembro de 2008. As lojas comercializam camarão cinza (Litopenaeus vannamei), exposto geralmente em cubas com gelo na área de vendas da loja (Figura 1).
As amostras foram coletadas assepticamente, sempre no final da manhã, acondicionadas em saco plástico estéril e transportadas ao laboratório, em caixa isotérmica com gelo, onde eram feitas as análises (Figura 2).
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 11
Figura 2 — Transporte das amostras de camarão ao laboratório, em caixa isotérmica com gelo.
2.2. Análises Microbiológicas: Diluições das amostras
2.2.2. Pesquisa de Staphylococcus coagulase positiva
2.2.2.1.Quantificação e isolamento de Staphylococcus coagulase positiva
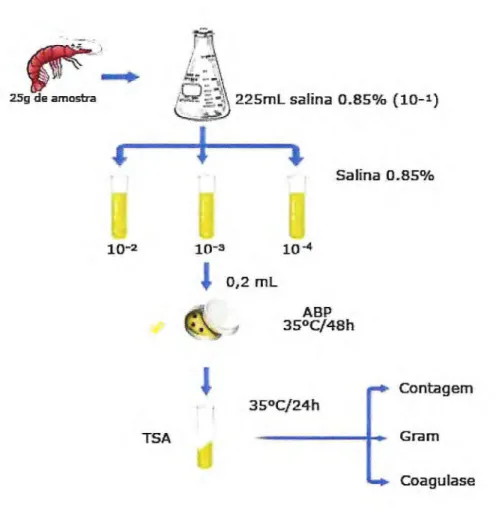
Placas com Ágar Baird-Parker ABP em duplicata foram inoculadas com alíquotas de 0,2 mL de cada diluição (10-1 até 104) e pelo método de espalhamento, foram distribuídos na superfície do meio usando-se alça de Drigalski. As placas foram então incubadas em estufa, invertidas, onde permaneceram a 35°C/48h (BENNET, 1984).
Decorrido o tempo de incubação foram contadas as colônias crescidas nas placas e delas isoladas 2 a 3 típicas (negras, pequenas com halo claro de 2 a 5 mm de largura). As colônias foram então transferidas para tubos com Ágar Triptona Soja-Difco (TSA) inclinado e incubados por 35°C/24h. Após esse período, os tubos foram conservados a 23°C, em estufa B.O.D (modelo 347 Fanem, Brasil) até as cepas, já purificadas, serem submetidas à prova bioquímica de coagulase.
Figura 3 — Placa com colônias típicas de Staphylococcus aureus em meio Baird-Parker.
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 13
Ex:
Colônias típicas = 30 Diluição = 10-2
Col. Submetidas à confirmação = 5 Col. Confirmadas = 3 (60%)
Ináculo = 0,2 mL
Confirmando apenas 3 como coagulase positiva tenho 60%.
Como 30 colônias foram contadas como típicas e somente 60% apresentaram coagulase, confirmo 18 cepas coagulase positiva.
Calculando esses dados tenho:
18 x 100 (Diluição) x 5 (Fator de correção para 0,2mL) então a CPP de
Staphylococcus coagulase positiva será 9.000 ou 9 x 103 UFC/g
2.2.2.2. Prova de coloração de Gram (Soares et al., 1991)
Nesta prova são utilizadas cepas isoladas a partir de ágar triptona soja (TSA) inclinado com 24 horas de incubação, onde são seguidos os passos descritos a seguir:
1- Inicialmente faz-se um esfregaço fino:
Com auxílio de uma pinça, tomar uma lâmina de microscópio imersa em álcool; Colocar uma pequena gota de água destilada sobre a lâmina na parte central; Retirar assepticamente, com uma agulha de inoculação, uma porção do crescimento da cultura a ser analisada; Espalhar a massa celular na gota e em seguida fixar a preparação, passando a lâmina um pouco acima da chama do Bico de Bulsen (sem superaquecê-la).
2- Cobrir o esfregaço com cristal violeta por 1 minuto; 3- Lavar com água corrente;
4- Cobrir o esfregaço com lugol por 1 minuto; 5- Descorar com álcool 95%;
6- Lavar com água corrente;
8- Lavar com água corrente e secar, absorvendo a água com lenço de papel;
9- Observar ao microscópio óptico com objetiva de imersão. OBS: Microrganismos Gram positivos: azuis ou violetas Microrganismos Gram negativos: vermelhos.
Figura 4 — Método de coloração de Gram utilizado para verificação morfológica das cepas utilizadas.
2.2.2.3. Prova da coagulase
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 15
especificação do fabricante. Os tubos foram incubados a 35°C/24h quando então foi realizada a leitura. A prova era considerada positiva quando houvesse coagulação do plasma em qualquer grau.
- -á 225mL salina 0.85% (10-1)
10-2 10-3 o -4
Salina 0.85%
,2 mL
ABP 35°C/48h
[ Contagem 35°C/24h
Gram
Figura 5 — Fluxograma de identificação de Staphylococcus coagulase positiva a partir de amostras camarão comercializados em dois supermercados em Fortaleza, CE.
TSA
2.2.3. Pesquisa de Salmonella
2.2.3.1. Pré-Enriquecimento
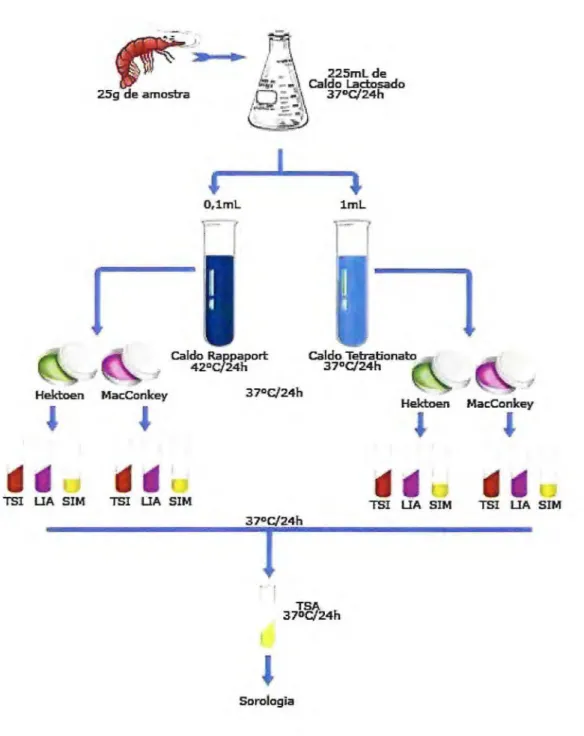
Foram maceradas 50g de cada amostra separadamente em cadinho esterilizado, sendo então retiradas 25g de cada amostra, adicionadas a 225 mL de Caldo Lactosado Difco (Difco) que então era incubado em estufa a 37 °C por 24
horas compreendendo a etapa de pré-enriquecimento.
2.2.3.2. Enriquecimento seletivo
A partir do pré-enriquecimento em caldo lactosado eram inoculados 0,1 mL em 10 mL do meio Rappaport-Vassiliadis (Difco) e 1 mL em 9 mL do meio caldo Tetrationato-Difco e incubados ,respectivamente, em banho-maria a 42°C e estufa a 37°C por 24 ± 2 horas.
2.2.3.3. Isolamento em meios seletivos
A partir do crescimento microbiano em ambos os tubos, com o auxílio de uma alça de níquel-cromo, foram retiradas alíquotas de cada meio e estriadas em duas placas de Petri contendo o meio de média seletividade Ágar Hektoen (BD) e baixa seletividade Ágar MacConkey (Difco). As placas foram então incubadas invertidas em estufas de crescimento por 24 horas a 37°C.
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 17
indo! para o meio sulfureto, indol, motilidade - SIM), uma nova alíquota era retirada e semeada em TSA, para teste posterior de sorologia (VIEIRA, 2004).
lmL 0,1mL
Caldo Rappaport Caldo Tetrationato 42°C/241-1 37°C/24h
Hektoen
4
4
MacConkey 37°C/24h
37°C/24h
Hektoen
4
dl
MacConkey
4
TSI LIA SIM TSI UA SIM TSI LIA SIM TSI LIA SIM
37°~C/24h
1
Sorologia
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 19
2.2.4. Colimetria- Quantificação de coliformes totais e termotolerantes
2.2.4.1. Prova Presuntiva
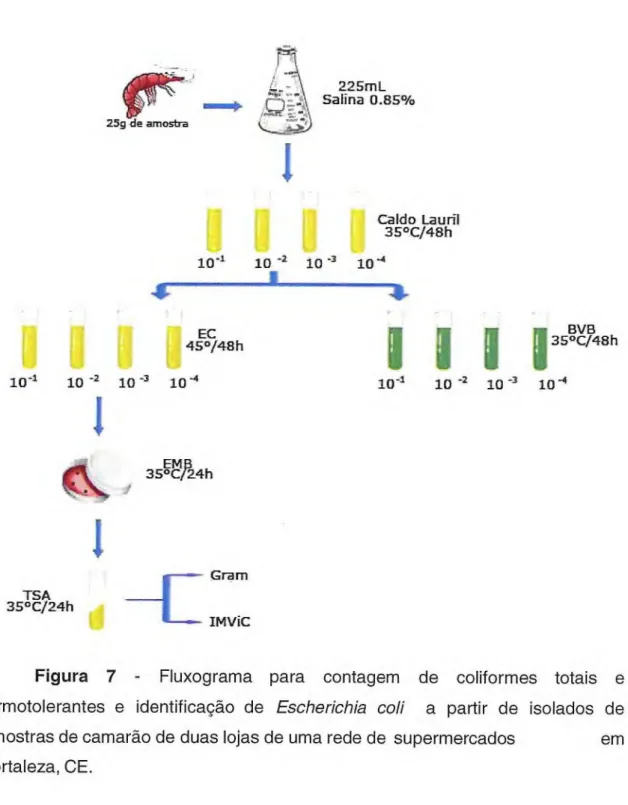
De cada diluição foram transferidos 1,0 mL, em triplicata, para tubos de Caldo Lauril Sulfato de Sódio (Difco), sendo então incubados em estufa a 37°C por 48h. A positividade para esse teste é a turvação do meio e a formação de gás detectado em tubos de Duhran invertidos.
2.2.4.2. Prova confirmatória
Dos tubos positivos da prova presuntiva, foram retiradas alíquotas e inoculadas em tubos contendo Caldo Bile Verde Brilhante - BVB (MERCK) para detecção de coliformes totais e em Caldo EC (VETEC) para detecção de Coliformes Termotolerantes. A positividade para esse teste consiste no turvamento do meio e formação de gás. Os tubos inoculados em BVB foram para estufa a 37°C por 48 horas enquanto, os inoculados no Caldo EC foram incubados em banho-maria a 45°C por 48 horas. Através da tabela de Hoskins (VIEIRA, 2004), fazia-se o cálculo do NMP de coliformes totais e termotolerantes para os tubos com resultado positivo, onde:
NMP tabela x Fator de diluição média ÷ 100 = NMP/g ou mL.
2.2.4.3. Prova completa
Dos tubos positivos do teste em caldo EC, foram retiradas alíquotas que, posteriormente foram estriadas em meio de Agar Eosina Azul de Metileno (EMB Merck).
As colônias características de E.coli se apresentam com coloração escura apresentando ou não um brilho metálico.
2.2.4.4. Testes bioquímicos do IMViC
O teste do IMViC consiste nas seguintes provas bioquímicas: teste do Indol, do Vermelho de Metila, de Voges-Proskauer e do Citrato (KORNACKI e JOHNSON, 2001).
2.2.4.4.1. Indol
Do crescimento em TSA tirava-se uma alçada e inoculava-se em um tubo de meio SIM que era incubado a 37°C por 24h. Após este tempo, eram adicionados 0,2mL do reativo de Kovacs ao meio. O aparecimento de um anel vermelho na superfície do meio indicava positividade para formação de Indol, oriundo da degradação do aminoácido triptofano pela enzima bacteriana triptofanase.
2.2.4.4.2. Teste do Vermelho de Metila (VM)
No teste do Vermelho de Metila, o meio de cultura utilizado foi o Caldo MR-VP (Merck) em tubos que foram semeados e incubados a 37°C durante 96 horas. Após esse período de incubação foram adicionadas três a cinco gotas de solução do indicador de pH Vermelho de Metila e o aparecimento de uma coloração vermelha produzida através do metabolismo das bactérias que utilizam a fermentação ácida mista resultava na positividade do teste. Os produtos finais formados dessa fermentação são responsáveis pela acidez do meio, sendo
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 21
2.2.4.4.3. Teste de Voges-Proskauer (VP)
Através dos mesmos crescimentos em TSA eram inoculados tubos com Caldo MR-VP com o auxílio de uma alça de níquel-cromo e incubados por 48 horas a 37°C. Para cada 1,0 mL do meio eram adicionados 0,6 mL do reativo de Barrit I (a-naftol) e 0,2 mL do reativo de Barrit II (KOH a 40%). Após agitação o tubo era aberto e deixado em repouso à temperatura ambiente por 30 minutos. A produção de coloração vermelha para caracterizar a prova como positiva, foi verificada após 30 minutos.
2.2.4.4.4. Teste de Citrato
225mL Salina 0.85%
ENIO 35°C/24h
Caldo Lauril 35°C/48h
10-1 10 -2 1.0 —3 10 -4
EC 450/48h
10-1 lo —2 10 —3 10 —4
BVB 35°C/48h
10-1 10 —2 10 —3 10 —4
Gram TSA
35°C/24h
IMViC
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 23
3. RESULTADOS E DISCUSSÃO
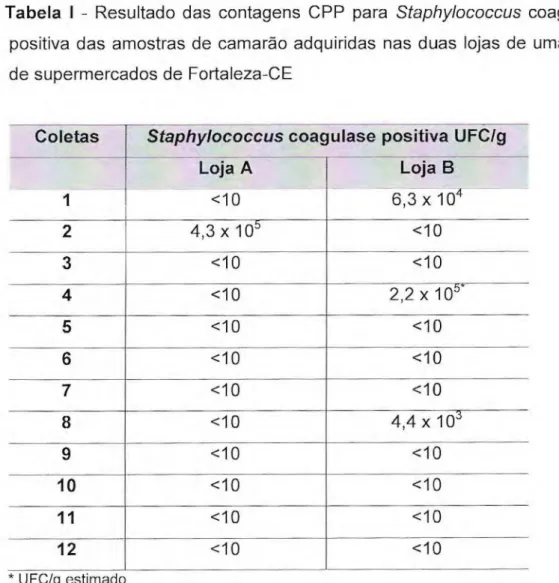
Os valores das Contagens Padrão em Placas (CPP) para Staphylococcus coagulase positiva das amostras de camarão, adquiridas nas duas lojas de uma rede de supermercados de Fortaleza-CE, variaram de <10 a 4,3 x 105 UFC/g. Quatro (16,6%) das amostras apresentaram valores acima dos permitidos pela legislação, sendo uma da loja A e três da loja B. A loja A apresentou 8,3% de desconformidade com valores além dos permitidos pela legislação vigente, enquanto que a loja B apresentou (25%) de desconformidade.
Tabela 1 - Resultado das contagens CPP para Staphylococcus coagulase positiva das amostras de camarão adquiridas nas duas lojas de uma rede de supermercados de Fortaleza-CE
Coletas Staphylococcus coagulase Loja A
<10
positiva UFC/g
Loja B
6,3 x 104
1
2 4,3 x 105 <10
3 <10 <10
4 <10 2,2 x 105*
5 <10 <10
6 <10 <10
7 <10 <10
8 <10 4,4 x 103
9 <10 <10
10 <10 <10
11 <10 <10
12 <10 <10
Resultados semelhantes foram encontrados por Anand et al. (2002) ao analisarem a qualidade bacteriológica de alimentos de origem marinha em Tamil Nadu, na índia_ Segundo os autores as contagens de S. aureus em camarões marinhos variaram de O a 106 UFC/g.
Contrário a esses resultados, Valdimarsson (1998) detectaram
Staphylococcus aureus em menos de 0,2%, ao analisarem 7.913 amostras de
camarão de águas frias da Islândia (Pandalus borealis) processado (cozido, congelado, descascado).
A manipulação dos camarões nas lojas embora seja pequena (contato direto manipulador / alimento) existe, sendo os resultados encontrados, uma prova de que houve contaminação das amostras por parte dos manipuladores.
É necessário conferir as condições de higiene pessoal dos funcionários da empresa e se os mesmos estão utilizando os descartáveis necessários para a manipulação (Luvas e Máscaras) durante o processo de manipulação.
Os manipuladores de alimento têm um papel importante na prevenção das toxinfecções alimentares. A microbiota comensal das mãos geralmente consiste de estafilococos (HOBBS; ROBERTS, 1999).
A resolução RDC N" 12, de 02 de janeiro de 2001, da Agência Nacional de Vigilância Sanitária — ANVISA (BRASIL, 2001), estipula um limite máximo para presença de Estafilococos coagulase positiva em camarão fresco que não será consumido cru, de até 103 UFC/g.
Não houve detecção de Salmonella em nenhuma das amostras, sugerindo que a qualidade do camarão tem sido mantida durante todo o processo (despesca, transporte, manipulação e exposição de venda).
Resultados semelhantes foram encontrados por Mohamed Hatha et ai. (1998), ao analisar 1.264 amostras de camarão cultivado (Penaeus monodon) após congelamento, e detectar apenas uma, com resultado positivo sendo confirmada como Salmonella Typhimurium.
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 25
bactéria em frutos do mar tem sido relatada em todo o mundo (HEINITZ et al., 2000).
Apesar de Salmonella ser facilmente destruída após cozimento, sua presença em produtos crus não pode ser tolerada em função dos baixos números de células necessários para causar uma infecção, além de que, este microrganismo pode ser transferido para outros alimentos através de contaminação cruzada (VIEIRA, 2004).
A Vigilância Sanitária — ANVISA (BRASIL, 2001) impõe sua ausência em 25g de amostra de qualquer alimento, incluindo os pescados. Essa preocupação vem do fato de que, a presença de Salmonella em qualquer amostra representa um risco à saúde, uma vez que todas as cepas desse gênero, com exceção da S.
subterranea, ainda não bem conhecida, são patogênicas ao homem (LANDGRAF, 2004).
A pesquisa de coliformes fecais ou termotolerantes nos alimentos fornecem, com maior segurança, informações sobre as condições higiênicas do produto e é a melhor indicação da eventual presença de enteropatógenos (LANDGRAF, 2004). Segundo Tôrres (2004), a principal causa de doenças diarréicas é a ingestão de alimentos e/ou águas contaminadas por microrganismos patogênicos, sendo E. coli um dos principais agentes etiológicos das infecções entéricas.
Apesar dos coliformes termotolerantes não serem limitados para crustáceos
in natura, refrigerado ou congelado, não consumidos crus (BRASIL, 2001) a presença de Escherichia coli deve ser ressaltada pelo fato dela ser uma redutora de óxido de trimetilamina a trimetilamina (ARAÚJO et al., 1975). Um dos parâmetros para se medir a qualidade do pescado.
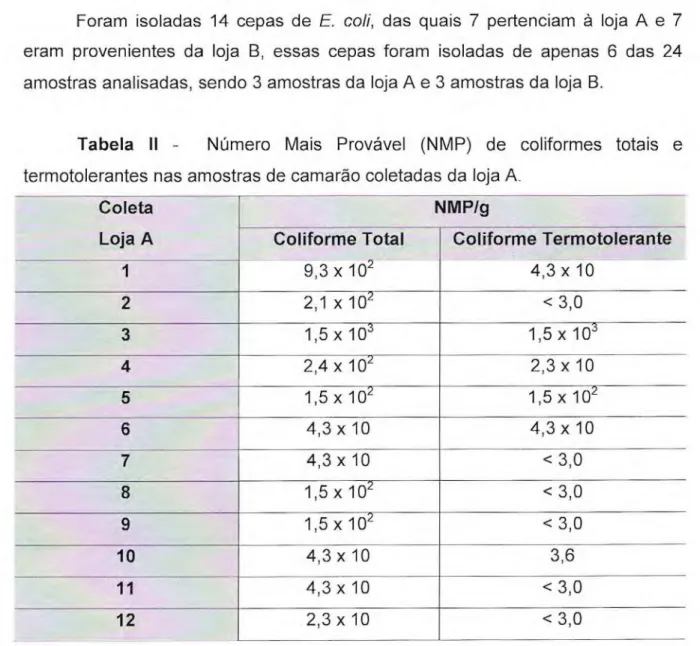
Foram isoladas 14 cepas de E. coli, das quais 7 pertenciam à loja A e 7 eram provenientes da loja B, essas cepas foram isoladas de apenas 6 das 24 amostras analisadas, sendo 3 amostras da loja A e 3 amostras da loja B.
Tabela II - Número Mais Provável (NMP) de coliformes totais e termotolerantes nas amostras de camarão coletadas da loja A
Coleta Loja A
NMIng Coliforme Total
9,3 x 102
Coliforme Termotolerante 4,3 x 10
1
2 2,1 x 102 < 3,0
3 1,5 x 103 1,5 x 103
4 2,4 x 102 2,3 x 10
5 1,5 x 102 1,5 x 102
6 4,3 x 10 4,3 x 10
7 4,3 x 10 < 3,0
8 1,5 x 102 < 3,0
9 1,5 x 102 < 3,0
10 4,3 x 10 3,6
11 4,3 x 10 <3,0
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 27
Tabela III - Número Mais Provável (NMP) de coliformes totais e termotolerantes nas amostras de camarão coletadas da loja B.
Coleta Loja B
NMPig
Coliforme Total Coliforme Termotolerante
9,3 x 10
1 4,3 x 102
2 1,0 x 104 1,0 x 104
3 1,0 x 103 1,0 x 103
4 4,3 x 102 3,6
5 9,3 x 102 9,3 x 102
6 2,4 x 102 9,3 x 10
7 < 3,0 < 3,0
8 1,0 x 103 < 3,0
9 1,1 x 103 < 3,0
10 4,3 x 10 <3,0
11 4,3 x 102 7,4
12 1,0 x 102 < 3,0
Reis et al. (2004) estudando camarão de água doce, encontraram altos índices de coliformes totais e termotolerantes variando de < 3,0 a >1.11/g e de < 3,0 a 460/g respectivamente. Bhaskar et al. (1995) em seus estudos com camarão cultivado obtiveram índices de coliformes totais e termotolerantes variando de 84 a 920 coliformes totais /g e de < 3,0 a 540 coliformes termotolerantes /g. Semelhante variação foi encontrada no presente estudo.
Apesar da suspeita sobre contaminação através de manipulação inadequada dos alimentos, um fator que também deve ser levado em consideração é a qualidade da água em que esse pescado foi cultivado e a qualidade da água formadora de gelo em que esse pescado foi armazenado.
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 29
4. CONCLUSÕES
Do presente estudo podemos deduzir as seguintes conclusões:
Quatro (16,6%) das amostras apresentaram valores para Staphylococcus coagulase positiva acima dos permitidos pela legislação, sendo uma da loja A e três da loja B.
Não houve detecção de Salmonella em nenhuma das amostras, sugerindo que a qualidade do camarão tem sido mantida durante todo o processo (despesca, transporte, manipulação e exposição de venda).
A detecção acentuada de coliformes totais e termotolerantes nas amostras de camarão é um fato preocupante, uma vez que a qualidade microbiológica do camarão reflete as condições higiênico-sanitárias de onde estes foram capturados e manipulados.
5. REFERÊNCIAS BIBLIOGRÁFICAS
ANAND, C. et al. Bacteriological quality of seafoods landed in tuticorin fishing harbour of Tamil Nadu, India, Journal of Science and Technology-Mysore. 694-697, nov-dec 2002.
ANTUNES, P.; RÉU, C.; SOUSA, J.C., PEIXE, L. & PESTANA, N. Incidence of Salmonella from poultry products and their susceptibility to antimicrobial agents. International Journal of Food Microbiology, v.82, p.97-103, 2003.
ARAÚJO, G. A.; VIEIRA, G. H. F.; TELLES, F. J. S.; VIEIRA, R. H. S. F. Redução do óxido de trimetilamina por bactérias. Arg. Ciên. Mar, Fortaleza, v.15, p. 101-103, 1975.
ARGÔLO FILHO, R. C. A. Identificação, sorotipagem e diferenciação pela PCRDGGE de sorotipos de Salmonella isolados de teiús criados em cativeiro. 2007. 96 f. Dissertação (Mestrado em Genética e Biologia Molecular) —
Universidade Estadual de Santa Cruz, Ilhéus-BA, 2007.
ASHBOLT, N.J.; GRABOW, W.O.K. & SNOZZI, M. Indicators of microbial water quality. World Health Organization (WHO). Water Quality Guildelines, Standards and Health, 2001.
BANWART, G. J. Basic Food Microbiology, 3° Edição, Westport: AVI 1983.
BENEVIDES, C.M.J.; LOVATTI, R.C.C., Segurança Alimentar em
Estabelecimentos Processadores de Alimentos. Revista Higiene Alimentar, São Paulo, v. 18, n° 125, p. 24-27, 2004.
BENNET, R. W. Staphylococcus aureus_ In: Bacteriological Analytical Manual: of the Division of Microbiology. 6th ed. Arlington, VA: US. Food and Drug
Administration, cap. 14, p. 14.01-14.05, 1984.
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 31
BRASIL - AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA — ANVISA. Resolução n° 12, de janeiro de 2001. Regulamento técnico sobre os padrões microbiológicos para alimentos. Diário Oficial da República Federativa do Brasil, Brasília, DF, 10 jan. 2001. Disponível em:
<http://www.anvisa.qov.brileqisiresol/12 01rdc.htm>, Acessado em 29 de Setembro de 2008.
BRYAN, F.L. Análise de risco nas empresas de alimentos. Revista Higiene Alimentar, São Paulo, v. 3, n. 2, 1984.
CAHIL, M. M. Bacterial flora of fisheries: a review. Microbial Ecology, n. 19, p. 21-41, 1990.
CASTRO, H. M. P.; VIEIRA, R. H. S. F. & TORRES, R. C. O. Balneabilidade e doenças de veiculação hídrica: Situação das praias de Fortaleza, Estado do Ceará, Brasil. Arq. Ciên. Mar, Fortaleza, v. 35, p. 119-124, 2002.
DIAS, A. M. G.; KANO, E.; NAKAHARA, L. D., et al. Virulence factors in
Escherichia coli isolated from blood and cerebrospinal fluid. Reviews Microbiology. São Paulo, v. 25, n. 2, p. 77-82, 1994.
EVANGELISTA - BARRETO, N.S.E Salmonella, in VIEIRA, R.H.S.F. (ed.), Microbiologia, Higiene e Qualidade do Pescado — teoria e prática. Varela, São Paulo, p.111-123, 380p, 2004.
FILHO, E. S. A.; FILHO, A. N. Ocurrence of Staphylococcus aureus in chease made in Brazil. Journal of Public Health. v.34; p.578-580, 2000.
FRANCO, B.D.G.M.; LANDGRAF, M., Microbiologia dos Alimentos. São Paulo: Atheneu, 182p. p. 43-46, 1996.
GERMANO, M. I. S.; GERMANO, P.M.L.; KAMEI, C.A.K.; ABREU, E.S.; RIBEIRO, E.R.; SILVA, K.C.; LAMARDO, L.C.A.; ROCHA, M.F.G.; VIEIRA, V.K.I.;
KAWASAKI, V.M. Manipuladores de alimentos: Capacitar? É preciso.
Regulamentar?...Será Preciso???. Revista Higiene Alimentar, São Paulo, v. 14, n 78/79, p. 18-22, nov/dez. 2000.
GERMANO, P.M.L. ; GERMANO, M.I.S., Higiene e Vigilância Sanitária de Alimentos, Varela, 655p. São Paulo, 2003.
GERMANO, P. M. L; OLIVEIRA, J. C. F.; GERMANO, M. I. S. O., Pescado como causa de toxinfecções bacterianas. Revista Higiene Alimentar, v. 7, n. 28, p. 40-5, 1993
HAGLER, A. N. & MENDONÇA-HAGLER, L. C. S. Indicadores microbiológicos de qualidade sanitária, In: ROITMAN, TRAVASSOS, L. R.; AZEVEDO, J.L. (eds.), Tratado de Microbiologia. Manole, São Paulo, p. 88-90, 1988.
HEINITZ, M. L.; RUBLE, R. D.; WAGNER, D. E.; TATINI, S. R. Incidence of Salmonella in fish and seafood. Journal Food Protect: p. 579-592, 2000.
HOBBS, B. C.; ROBERTS, D., Toxinfecções e Controle Higiênico-Sanitário de Alimentos. São Paulo: Varella, 377 p, 1999.
JAKABI, M.; BUZZO, A. A.; RISTORI, C. A.; TAVECHIO, A. T., SAKUMA, H.; PAULA, A. M. R.; GELLI, D. S. Observações laboratoriais sobre surtos alimentares de Salmonella sp. Ocorridos na Grande São Paulo, no período de 1994 a 1997. Revista do instituto Adolfo Lutz, São Paulo v 58, n. 8, p. 47-51, 1999.
KLOSS, W.E.; BANNERMAN, T.L. Staphylococcus and Micrococcus. In: Murray, P.R. et al. Manual of Clinical Microbiology. 7th ed. Washington: ASM Press, cap. 16, p. 264-282, 1999.
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 33
KORNACKI, J.L.; JOHNSON, J.L. Enterobacteriaceae, Coliforms and Escherichia coli as quaiity and safety indicators. In: DOWNES, F.P.; ITO, K. Compendium of Methods for the Microbiological examination of foods. 4' ed. Washington: APHA, 676 p. cap. 8, p. 69-82, 2001.
KUMAR, R.; SURENDRAN, P. K.; THAMPURAN, N. An eight-hour PCR-based technique for detection of Salmonella serovars in seafood, World Journal Microbiol Biotechnol, v. 24, p. 627-631, 2008.
LANDGRAF, M. Microrganismos Indicadores. In: FRANCO, B. D. M. G.,
LANDGRAF, M. Microbiologia de Alimentos. São Paulo, Atheneu, cap. 3, p. 27-32., 2004.
LANCETTE, G. A.; BENNET, R. W. Staphylococcus aureus and Staphylococcal enterotoxins. In: DOWNES, F.P.; ITO, K. (Ed.) Compendium of methods for the microbiological examination of foods. 4' ed. Washington D.C.: SHERIDDAN, p. 387-404, 2001.
LARSEN, H.S., MAHON, C.R. Staphylococcus. In: Diagnostic Microbiology. Ed. Connie R. Mahon, George Manuselis Jr. Philadelphia: W.B. Saunders, cap. 10, p. 325-338, 1995.
LEITÃO M.F.F. Microbiologia de Alimentos. In: ROITMAN I.; TRAVASSOS L.R.; AZEVEDO J.L. (Ed). Tratado de Microbiologia. São Paulo: Manole, pp. 30-31, 1988.
LIRA, E. N., Ocorrência de doenças transmitidas por alimentos no período de 1999 a 2003, em Guarapuava-PR: um levantamento epidemiológico. 93f. (Dissertação de Mestrado) — Escola de Enfermagem de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, 2005.
LOPES, H. V. CA-MRSA —A new problem for the infectologist. Revista
panamericana de infectologia, v. 7, n. 3, 2005. Disponível em: <http://www.revista-api.com/3%20edicao%202005/pq/art 6.html>, acessado em 30 de setembro de 2008.
MENDONÇA - HAGLER, L. C.; VIEIRA, R. H. S. F.; HAGLER, A. N. Microbial quality of water, sediment, fish as shellfish in some brazilian coastal regions, In: FARIA, B. M.; FARJALLA, V. F.; ESTEVES, F. A. (ed). Aquatics Microbial Ecology in Brazil. Series Oecollogia Brasiliensis, Rio de Janeiro, v. 9, p. 197-216. 2001.
MOHAMED HATHA, A. A.; LAKSHMANAPERUMALSAMY, P. Prevalence of Salmonella in fish and crustaceans from markets in Coimbatore, South India. Food Microbiology, London, v.14, p. 111-116, 1997.
MOHAMED HATHA, A. A.; PAUL, N.; RAO, B. Bacteriological quality of individually quick-frozen (IQF) raw and cooked readyto-eat shrimp produced from farm raised black tiger shrimp (Penaeus monodon). Food Microbiology, v. 15, p. 177-183, 1998.
NADVORNY, A..; FIGUEIREDO, D.M.S.; SCHIMIDT, V., Ocorrência de
Salmonella sp. em surtos de doenças transmitidas por alimentos no Rio Grande do Sul, em 2000. ActaScíentiaeVeterinariae. 32: 47-51, 2004.
PAGNOCCA, F. C.; MENDONÇA, H. L. C. & HAGLER, A. N. Yeasts associated with the White shrimp Penaeus schmmitti, sediment, and water of Sepetiba Bay, Rio de Janeiro, Brazil, Yeast, n. 5, p. 479-483, 1989.
RADDI, M. S. G.; LEITE, C. Q. F.; MENDENÇA, C. P., Staphylococcus aureus: food handler carriers. Revista de Saúde Pública, V. 22, n. 1, 1988. Disponível em:<http://www.scielo.br/scielo.php?pid=S003489101988000100005&script=sci a rttext>, acessado em 23 de Agosto de 2007.
REIS, J. A.; HOFFMANN, P.; MARCOS, L. M.; TADDEI, F. G.; GONÇALVES, T. M. V. & HOFFMANN, F. L.. Estudo higiênico-sanitário dos camarões dulcícolas Macrobrachim amazonicum e M. jelskii. Higiene Alimentar, v. 18, n. 116/117, p. 58-67, 2004.
ROITMAN, I; TRAVASSOS, LR.; AZEVEDO, J.L.; Tratado de Microbiologia. São Paulo. Ed. Manoele, v. 1 p. 44-46, 1988.
Salmonella, E. coli e Staphylococcus em camarão comercializado Moreira, B.A.B. 35
SILVA Jr., E. A., Contaminação microbiológica como indicadora das condições higiênico-sanitárias de equipamentos e utensílios de cozinhas industriais para a determinação de pontos críticos de controle. (Dissertação de Mestrado). 83 f. Universidade de São Paulo, São Paulo, 1992.
SILVA, C. H. P. M. Bacteriologia: um texto ilustrado. Teresópolis — RJ. p. 165 — 206, 1999.
SILVA, N.; JUNQUEIRA, V. C. A.; SILVEIRA, N. F. A. Manual de métodos de análises microbiológicas de alimentos. São Paulo: Livraria Varela, 295 p, 1997.
SILVA, N.; JUNQUEIRA, V. C. A.; SILVEIRA, N. F. A. Detecção de Salmonella. In: Manual de métodos de análises microbiológicas de alimentos. São Paulo: Livraria Varela, p. 41-110, 2001.
SIQUEIRA, R. S. Manual de Microbiologia de Alimentos. Embrapa — Merck, 159p., Rio de Janeiro, 1995.
SOARES, J. B.; CASEMIRO, A. R. S. & ALBUQUERQUE, L. M. Metabolismo bacteriano — fermentação de carboidratos e outras provas bioquímicas. in: Microbiologia Básica. Fortaleza: Ed. UFC, 180p. 1991.
SOARES, M. J. S.; TOKUMARU-MIYAZAKI, N. H.; NOLETO, A. L. S.;
FIGUEIREDO, A. M. S. Enterotoxin production by Staphylococcus aureus clones and detection of Brazilian epidemic MRSA clone (III::B:A) among isolates from food handlers. Journal Medical Microbiology, Philadelphia, v. 46, p. 214-221, 1997.
TORRES, R. C. O. Escherichia coli, In: Vieira, R.H.S.F. (ed.), Microbiologia, Higiene e Qualidade do pescado — teoria e prática. Varela, 380p., São Paulo, p.
125-138, 2004.
TRABULSI, L.R.; ALTERTHUM, F. Microbiologia. 5' ed. São Paulo: Atheneu, 760p, 2008.
UNGAR, M. L.; GERMANO, M.I.S.; GERMANO, P.M.L., Riscos e conseqüências da manipulação de alimentos para saúde pública. Revista Higiene Alimentar, São Paulo, v. 6, n. 21, p. 14-17, 1992.
VALDIMARSSON, G.; EINARSSON, H.; GUDBJO-RNSDOTTIR, B.;
MAGNUSSON, H. Microbiological quality of Icelandic cooked-peeled shrimp (Pandalus borealis), International Journal of Food Microbiology, v. 45, p. 157-161, 1998.
VALENÇA. A. R.; MENDES, G. N.; Importância da composição iônica da água oligahalina e "doce" no cultivo de Litopenaeus vannamei. Panorama da
Aqüicultura. Rio de Janeiro, V. 14, n° 85, 2004.
VIEIRA, R. H. S. F., Doenças transmitidas por alimentos (DTA). Microbiologia, Higiene e Qualidade do Pescado, p. 89 — 94, Varela editora, 380p., São Paulo, 2004.
VIEIRA, R. H. S. F., SILVA, A. I. M.; SOUSA, O. V. 5.; HOFER, E.; VIEIRA, G. H . F.; SAMPAIO, S. S. & LIMA, E. A. Análise experimental sobre a viabilidade de Escherichia coli em água do mar. Arq. Ciên. Mar, Fortaleza, v.34, p. 43-48, 2001.
VIEIRA, R. H. S. F., TÔRRES, R. C. O. Estimativa da população de coliformes totais e fecais (termotolerantes) e Escherichia coli através do Número Mais Provável (NMP). Microbiologia, Higiene e Qualidade do Pescado, p. 219-226, Varela editora, 380p., São Paulo, 2004.