Tese de doutorado
“ESTUDO DA REDUÇÃO DE SULFATO EM
REATORES CONTÍNUOS UTILIZANDO
GILCEROL”
Autora: Sueli Moura Bertolino
Orientador: Co-orientador:
Prof. Versiane Albis Leão Prof.Sérgio Francisco de Aquino
Sueli Moura Bertolino
“ESTUDO DA REDUÇÃO DE SULFATO EM REATORES
CONTÍNUOS UTILIZANDO GLICEROL”
Área de concentração: Processos de fabricação Orientador: Prof. Versiane Albis Leão Coorientador: Prof. Sérgio Francisco de Aquino
Ouro Preto, maio de 2012
i
Catalogação: sisbin@sisbin.ufop.br
B546e Bertolino, Sueli Moura.
Estudo da redução de sulfato em reatores contínuos utilizando glicerol [manuscrito] / Sueli Moura Bertolino. – 2012.
xii, 138 f.: il. color.; grafs.; tabs.
Orientador: Prof. Dr. Versiane Albis Leão.
Coorientador: Prof. Dr. Sérgio Francisco de Aquino.
Tese (Doutorado) - Universidade Federal de Ouro Preto. Escola de Minas. Rede Temática em Engenharia de Materiais.
Área de concentração: Processos de Fabricação.
iii
"A ciência humana de maneira nenhuma nega a existência de Deus. Quando considero quantas e quão maravilhosas coisas o homem compreende, pesquisa e consegue realizar, então reconheço claramente que o espírito humano é obra de Deus, e a mais notável."
iv
v AGRADECIMENTOS
À Deus, pelo dom da vida.
Obrigada mãe, por ser meu exemplo de vida! Uma professora que orgulha de ter como maior recompensa, o reconhecimento de tantos alunos, hoje adultos, que tiveram a honra de ser alfabetizados pela senhora. Uma mãe, que mesmo cansada de sua jornada de trabalho, tinha sempre um lindo sorriso para nos receber. Uma mulher, que tira em Deus toda sua fé para superar as dificuldades e nos mostrar que a vida é nosso maior presente de Deus. Te amo mãe!
À minha família, que é o alicerce da minha vida. Agradeço o amor e o companheirismo de meus irmãos, Rosana, Mílber, Simone e Nélio. A meu cunhado Zé, e minhas cunhadinhas Lu e Fabi. Aos meus lindos sobrinhos, Helena, Thiago, Pedro, Ana Clara e Ana Laura.
À todos os meus familiares,“Mouras e Bertolinos”, que fazem minha vida fazer sentido.
Ao meu orientador.É indiscutível seu comprometimento com a pesquisa e orientação de seus alunos, o que é refletido no nosso aprendizado.Foram muitas reuniões, muitas conversas, muitos erros e acertos, até chegar aqui. Muito obrigada,professor Versiane, pela confiança e pela enorme contribuição na minha formação.
vi À equipe do laboratório de Biologia Molecular da UFOP, principalmente, professora Renata e a mestranda Isabel.
Às eternas amigas/irmãs, unidas desde: o pré-escolar (Érica e Quel), o ensino fundamental (Fábia e Cris), o ensino médio (Bi e Juli), a graduação (Fafá, Mi, Angel e San), o mestrado (Jojô) e, também,à amiga Cintia. Obrigada amigas, vocês entraram em momentos diferentes na minha vida, mas todasfazem parte da minha história.
À família SELETA! Jojo, Wandinha, Bia, Lili, Lessandra, Na, Mandinha, Nininha, Kkau, e aos agregados, Emerson, Alan e Chatubinha. Obrigada seleteiras e seleteiros pela amizade e companheirismo. Em particular, às seleteiras, agradeço pelas risadas, pelos bate-papos, pelas conversas sérias, pela paciência em me aturar nos momentos de cansaço e, principalmente,pela oportunidade de ensinar e também de aprender. Amo todas vocês!
Aos alunos de IC, Frederico, Jamily, Nayara e Lucas, que com muito comprometimento me ajudaram a cuidar de meus reatores e de minhas bactérias.
Ao técnico de laboratório, Sérgio, por todas as análises realizadas para a execução deste projeto e, também, pela troca de conhecimentos.
A todos os colegas do laboratório de bio-hidrometalurgia, em especial minhas colegas de sala Damaris e Larissa, por toda ajuda e companheirismo.
À Vale, pelo financiamento que possibilitou o desenvolvimento técnico/científico desta tese de doutorado.
Ao Conselho Nacional de Pesquisa pelo financiamento da bolsa de doutorado.
v RESUMO
A hidrodinâmica do reator desempenha um papel chave durante a redução do sulfato porque bactérias redutoras de sulfato (SRB) não formam lodo granular facilmente. Além disso, entre os maiores desafios para a implementação da bioredução do sulfato estão o custo da fonte de elétrons e sua disponibilidade.Nesta tese, o desempenho de um reator anaeróbio de fluxo ascendente e manta de lodo (UASB) foi comparado com o de um reator de leito fluidizado (RLF), tratando efluente sintético contendo lactato como fonte de carbono e de elétrons.A carga orgânica, a redução do sulfato e as condições de mistura foram os principais parâmetros monitorados. O perfil dos ácidos graxos voláteis (AGV) e técnicas moleculares permitiram propor as vias metabólicas envolvidas durante a degradação do lactato. Para altas cargas orgânicas observou-se que: (i) olactato foi oxidado a acetato e dióxido de carbono por bactérias que oxidam incompletamente o substrato (Desulfomonas, Desulfovibrio, Desulfolobus, Desulfobulbus e Desulfotomaculum spp.); (ii) o lactato foi convertido a acetato
por bactérias fermentativas (BF), tais como Clostridium sp. Sem recirculação, o reactor
vi ABSTRAT
Reactor hydrodynamics plays a key role during sulfate reduction because sulfate reducing bacteria (SRB) do not granulate easily. In addition, one of the greatest challenges for the full implementation of biological sulfate reduction is the cost of the electron source along with its availability. In this thesis, the performance of an Upflow Anaerobic Sludge Blanket (UASB) reactor was compared to that of a fluidized bed reactor (FBR), treating lactate as carbon and electron source. Organic loading, sulfate reduction and mixing conditions were the main parameters monitored. Volatile fatty acids (VFA) profile and molecular biology techniques enabled the assessment of the metabolic pathways accounting for lactate degradation. At high organic loadings, it was observed that: (i) lactate was oxidized to acetate and carbon dioxide by incomplete-oxidizing SRB (Desulfomonas, Desulfovibrio, Desulfolobus, Desulfobulbus and Desulfotomaculum spp.); (ii) lactate was converted to acetate by fermenting bacteria (FB)
such as Clostridium sp. Without recirculation, the UASB reactor showed a maximum
volumetric sulfate reduction rate of 1.3g/(L.d)) (66% removal), while high propionate concentrations were associated to low sulfate reduction efficiencies, a result of the competition between FB and SRB for the substrate. Biomass recirculation considerably improved sulfate reduction yields to 0.089±0.014g/(gSSV.d), (89% reduction), for an COD/sulfate mass ratio value of 2.5±0.2. Nevertheless, values twice as higher (0.191±0.016g/(gSSV.d)) were achieved in the FBR, treating the same substrate. In the best operational conditions, the FBR depicted a sulfate reduction efficiency of 97% (64mg/L residual sulfate) and negligible fermentative activity during lactate oxidation. It was then selected for experiments utilizing glycerol as an alternative carbon source and the sulfate reduction performance was compared to that observed with lactate. Sulfate reduction in the presence of glycerol produced residual COD (1700mg/L) smaller than that produced with lactate (2500mg/L C2H3O2) at the same COD/sulfate mass ratio (2.5). It was estimated that
vii SUMÁRIO
LISTA DE FIGURAS ... ix
LISTA DE TABELAS ... xi
LISTA DE NOTAÇÕES ... xii
CAPÍTULO 1 ... 1
1.1 Introdução...1
1.2. Objetivos e organização da tese ... 13
1.3. Referências ... 16
CAPÍTULO 2 ... 22
PERFORMANCE OF CONTINUOUS BIOREACTORS FOR SULFATE REDUCTION AIMING AT UTILIZING GLYCEROL AS CARBON SOURCE ... 22
2.1. Introduction ... 23
2.2. Materials and methods ... 25
2.2.1. Bioreactors ... 25
2.2.2. Microorganisms and reactor start-up ... 26
2.2.3. Analytical methods ... 28
2.3. Results ... 29
2.3.1. Performance and stability of UASB and Fluidized Bed reactors. ... 29
2.3.2. COD consumption and sulfate reduction yields ... 35
2.3.3. Effect of the reactor configuration in sulfate removal ... 36
2.3.4. Sulfate reduction in the presence of pure glycerol as substrate ... 41
2.4. Discussion ... 42
2.5. Conclusions ... 47
2.6. Acknowledgements ... 48
2.7. References ... 48
CAPÍTULO 3 ... 54
IMPLICATIONS OF VOLATILE FATTY ACID PROFILE ON THE METABOLIC PATHWAY DURING CONTINUOUS SULFATE REDUCTION ... 54
3.1. Introduction ... 55
3.2. Experimental... 57
3.2.1. Microorganisms and growth medium ... 57
3.2.2. Anaerobic reactor and operational methods ... 57
viii
3.3. Results and discussion ... 60
3.3.1. Reactor start-up and biomass ... 60
3.3.2. Reactor performance ... 63
3.3.3. Influence of effluent recirculation in sulfate reduction ... 76
3.4. Conclusions ... 77
3.5. Acknowledgements ... 78
3.6. References ... 78
CAPÍTULO 4 ... 85
GLYCEROL AS AN ELECTRON DONOR FOR SULFATE REDUCTION IN FLUIDIZED BED REACTORS ... 85
4.1. Introduction ... 86
4.2. Experimental... 88
4.2.1. Anaerobic reactor... 88
4.2.2. Microorganisms and reactor start-up ... 89
4.2.3. Operational methods ... 90
4.2.4. Batch experiments with glycerol ... 91
3.2.5. Analytical methods ... 92
4.3. Results and discussion ... 93
4.3.1. Reactor start-up and biomass ... 93
4.3.2. Reactor performance ... 95
4.4. Conclusions ... 108
4.5. Acknowledgements ... 109
4.6. References ... 109
CAPÍTULO 5 ... 112
CAPÍTULO 7 ... 117
ix LISTA DE FIGURAS
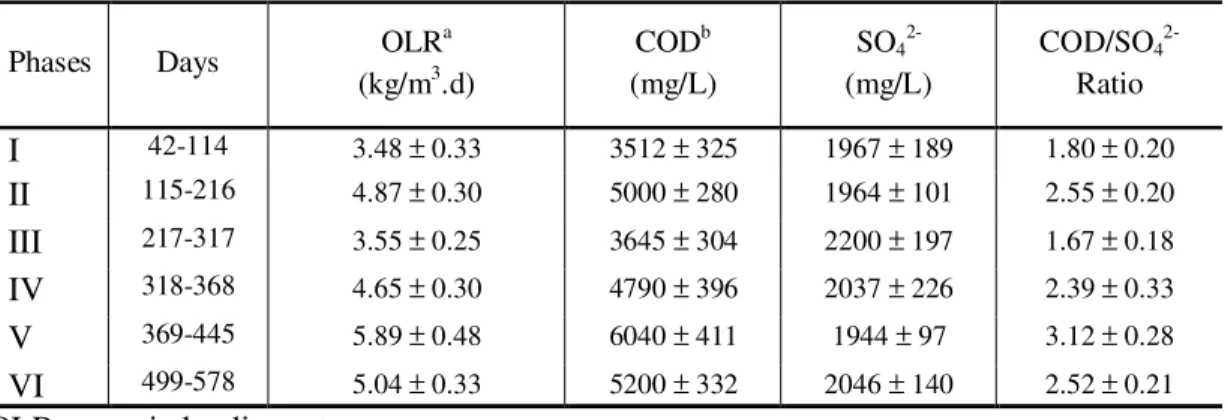
x Figure 3.2. Evolution of biomass monitored in the UASB reactor: (I) OLR = 3.48 kg/m3.d; (II) OLR = 4.87 kg/m3.d; (III) OLR = 3.55 kg/m3.d; (IV) OLR = 4.65 kg/m3.d; (V) OLR = 5.89 kg/m3.d; (VI) OLR = 5.04 kg/m3.d. ... 61 Figure 3.3. Performance parameters of the UASB reactor, in different phases (according to table 3.1). VFA: volatile fatty acids; BA: bicarbonate alkalinity. ... 63 Figure 3.4. Parameters monitored during sulfate reduction with lactate. Volumetric organic loading (A); COD removal efficiency (B). Volumetric sulfate loading (C). Sulfate removal efficiency (D), during the phases I to VI (according to table 3.1). ... 66 Figure 3.5. Metabolic pathways relevant in this study involving the anaerobic metabolism of lactate. Species and reaction refer to identified microorganism (table 3.2) and anaerobic degradation reactions (table 3.3). ... 69 Figure 3.6. Comparison between estimated and analytical concentrations of: (A) acetate; (B) propionate, during phases I to VI (table 3.1). OLR: organic load rate (kg/m3.d)... 70 Figure 3.7. Values of effluent- and CODVFA during sulfate reduction in the UASB reactor.
CODout was measured and CODVFA values were determined from the measured propionate
xi LISTA DE TABELAS
xii LISTA DE NOTAÇÕES
AB Alcalinidade Bicarbonato
AGV Ácidos Graxos Voláteis
AnSBBR “Anaerobic Sequencing Biofilm Batch Reactor”
BA “Bicarbonate Alkalinity”
BF Bactérias Fermentativas
BRS Bactéria Redutora de Sulfato
COA Carga Orgânica Aplicada
COD “Chemical oxygen demand”
CONAMA Conselho Nacional do Meio Ambiente
CSA Carga de Sulfato Aplicada
CSR Carga de Sulfato Removida
DAM Drenagem Ácida de Mina
DQO Demanda Química de Oxigênio
EGSB “Expanded Granular Sludge Blanket”
ETE Estação de Tratamento de Esgoto
FB “Fermentatives bactérias”
FBR “Fluidized bed reactor
HPLC “High Performance Liquid Chromatography”
HRT “Hydraulic retention time”
INAP “International Network for Acid Prevention”
MPM “Micoorganisms producing methane”
ORL “Organic Rate Loading”
xiii
RLF Reator de leito fuidizado
SLR “Sulfate Loading Rate”
SSV Sólidos Suspensos Voláteis
TDH Tempo de Detenção Hirdráulica
TDS “Total Dissolved Solids”
TOC “Total organic carbon”
UASB “Upflow Anaerobic Sludge Blanket”
UFOP Universidade Federal de Ouro Preto
VFA “Volatile Fatty Acids”
VSS “Volatile suspended solids”
WHO “World Health Organization”
1
CAPÍTULO 1
1.1 Introdução
A geração da drenagem ácida de mina (DAM) pode ser considerada como um dos impactos responsáveis pela regulação de efluentes com altas concentrações de sulfato, o que levou à crescente busca de tecnologias para o seu tratamento. A DAM é formada quando minerais sulfetados presentes em resíduos da mineração (rejeito ou estéril) são oxidados em presença de água, liberando uma solução ácida. Como consequência, no meio hídrico, ocorre o aumento da acidez e da concentração de metais tóxicos, bem como da concentração de sulfato(AKCIL e KOLDAS, 2006). O sulfato está também presente em efluentes de outras indústrias tais como, a de papel, curtumes,a de alimentos, a de explosivos, a de tensoativos, a de xenobióticos e aquímica/metalúrgica. Nestes efluentes industriais, a concentração de sulfato pode chegar a 8g/L(LENSet al., 1995; WHO, 2011).
A presença do íon sulfato em efluentes industriais está associada aos possíveis efeitos tóxicos causados pelo íon sulfeto que se forma no processo anaeróbio da redução de sulfato. Este último pode comprometer a qualidade dos corpos d´água devido ao aumento da demanda química de oxigênio (LENSet al., 1998). Além disso, o reuso de tais efluentes pelas indústrias
é, normalmente, um processo inviável, pois a presença de sulfeto promove a corrosão de tubulações, estruturas e equipamentos, tornando-se, portanto, necessário o desenvolvimento de técnicas eficientes e de baixo custo que possam ser utilizadas no tratamento de efluentes com tais características (INAP, 2003; WHO, 2011).
2 Pessoas adultas que consomem água potável contendo sulfato em concentrações superiores a 600 mg/L podem apresentar quadro de diarréia, embora também seja reportado que, com o tempo, os humanos podem se adaptar a altas concentrações do íon(WHO, 2011). Em função dos possíveis problemas causados pela ingestão de altas concentrações de sulfato, o valor limítrofe para águas de abastecimento no Brasil, estabelecido pela Portaria 518/2004 do Ministério da Saúde, é 250 mg/L. A Resolução 358/2005 do CONAMA (2005) e a Deliberação Normativa COPAM n° 010/86 (1986) do estado de Minas Gerais limita a concentração de sulfato para águas doces das Classes 1 e 2 também em 250 mg/L. Esse limite é definido para o corpo receptor e não para o efluente em si. No Estado de São Paulo, a Lei nº 997 de 31 de maio de 1976, no Artigo 19-A, estabelece a concentração máxima de1,0gS-SO42-/L em efluentes líquidos lançados direta ou indiretamente nos corpos receptores,
impondo obrigatoriedade de tratamento às fontes emissoras cujas concentrações de sulfato ultrapassem este valor determinado. A recomendação dos órgãos fiscalizadores de outros países é que a concentração de sulfato esteja entre 250 a 500mg/L em águas de abastecimento e/ou efluentes (INAP, 2003; WHO, 2011).
As tecnologias disponíveis para a remoção do sulfato podem ser classificadas em três grupos:(i) processos de precipitação química (gesso, etringita e sulfato de bário); (ii) processos que utilizam membranas ou resina de troca iônica; (iii) redução biológica. As técnicas que envolvem os processos físico-químicos têm se mostrado ou economicamente inviáveis (precipitação como etringita e sulfato de bário, uso de membranas e resinas de troca iônica) ou ineficientes (precipitação como gesso) (SILVEIRAet al., 2008). As aplicações
3 industriais contendo metais e sulfato, além de potencialmente atender ao critério de reduzir o teordo ânionpara concentrações inferiores a 250mg/L, surge como uma alternativa principalmente por diminuir a produção de lodo e permitir a recuperação de metais de interesse econômico (como Cu, Ni e Zn).
O interesse pela redução de sulfato em sistemas de tratamento de águas residuárias surgiu a partir dos problemas causados por esta rota metabólica nos reatores metanogênicos.Muito conhecimento sobre o processo sulfetogênico foi adquirido entre as décadas de 1970-1980s, por meio das pesquisas voltadas para a prevenção ou minimização da redução de sulfato durante o tratamento metanogênico de águas residuárias (ISAet al., 1986; RINZEMA e
LETTINGA, 1988; VISSER et al., 1992; VISSER et al., 1993). Tal interesse compreende
desde a produção de H2S, passando por sua toxicidade, seus efeitos corrosivos, as questões de
odor e de aumento da demanda química de oxigênio (DQO) do efluente, bem como a redução na qualidade e quantidade de biogás produzido (LENSet al., 2002).
A partir da década de 1990, cresceu o interesse em utilizar a redução de sulfato no tratamento de efluentes ricos em sulfato, tais como, a drenagem ácida de mina (STUCKIet al., 1993) e
águas da lavagem de gases de combustão (LENSet al., 2002). Por conseguinte, diversos
4 Tabela 1.1 Reações envolvidas no metabolismo de grupos de bactérias durante o processo anaeróbio.
Equação ∆∆∆∆G°
(kJ/reação) Reações de Redução de sulfato
4 + + → + - 151,9
+ → + -47,6
+ , → + + , + , -37,7
+ , → + , + , -27,8
+ , → + + . + , -80,2
Reações Acetogênicas
+ → + + + +76,1
+ → + + +48,3
+ → + + + -4,2
Reações Metanogênicas
+ + → + -153,6
+ → + -31,0
Reações Homoacetogênicas
+ + → + -104,6
→ !, + , -56,5
A concentração (expressa em termos da demanda química de oxigênio – DQO) e a qualidade do substrato orgânico e a concentração de sulfato no efluente podem ser fatores importantes para uma eficaz remoção do sulfato. Além do substrato, os principais fatores estudados e que podem afetar o desempenho da redução biológica do sulfato são: pH, temperatura, razão DQO/sulfato, tempo de detenção hidráulica (TDH) e o tipo de reator utilizado (SHEORAN et al., 2010). Em relação ao pH e à temperatura, as condições ideais para o crescimento BRS
são: valores de 5 a 9, e de 20°C a 40°C, respectivamente. Valores de pH e temperatura fora destas faixas normalmente resultam em redução da atividade sulfetogênica (TANG et al.,
5 A biorredução do íon sulfato ocorre mediante a oxidação de um composto orgânico (substrato) pela atividade metabólica das BRS. Portanto, no caso de efluentes industriais com alta concentração de sulfato, mas que não possuem matéria orgânica em sua constituição, como no caso do efluente gerado pela DAM, a adição de uma fonte de carbono e elétrons externa se faz necessária.Por causa da variedade de substratos orgânicos que as BRS podem utilizar (SHEORANet al., 2010), diversas rotas metabólicas durante a redução do sulfato são
possíveis. Tais rotas são influenciadas pela competição, pelo substrato orgânico, entre as BRS e outros grupos de micro-organismos envolvidos na digestão anaeróbia. As BRS podem competir com arqueias metanogênicas por acetato e H2(GUPTAet al., 1994; COLLERAN et al., 1998); com as bactérias acetogênicas, por propionato ou butirato (O'FLAHERTY et al.,
1998) ou com micro-organismos fermentativos por lactato, glicerol, etanol, sacarose, glicose, entre outros(SHEORANet al., 2010). A razão DQO/sulfato é um fator determinante do nível
de competição entre estes grupos(CHENet al., 2008) e, portanto, do desempenho dos sistemas
sulfetogênicos. A razão DQO/sulfato foi investigada em diferentes estudos envolvendo quimiostatos (RENet al., 2007), reatores contínuos (DE SMUL et al., 1999; LOPES et al.,
2010) e em batelada (CAOet al., 2009). Chen e Rim (1991) relataram experimentalmente que
6 Avaliando a diversidade de BRS, a melhor razão DQO/sulfato poderá ser definida pela forma como as BRS oxidam a matéria orgânica. Existem dois grupos diferentes de BRS, classificados quantoà capacidade de oxidar o substrato. As espécies capazes de oxidar o substrato orgânico de forma completa até CO2(acetoclásticas) são representadas pelas
espécies Desulfobacter, Desulfobacterium, Desulfonema, Desulfosarcina, Desulfococcus, Desulfomonile, entre outras.As espécies de BRS que oxidam a matéria orgânica de forma
incompleta até acetato (acetogênicas) são representadas pelos gêneros Desulfobulbus, Desulfomicrobium, Desulfomonas, Desulfovibrio, entre outros(BARTON, 1995). Todas estas
representantes das BRS são caracterizadas pelo uso de sulfato como aceptor final de elétrons durante a respiração anaeróbia. Muitos estudos relatam o predomínio de BRS que oxidam incompletamente o substrato durante a redução do sulfato, resultando em acúmulo do acetato, devido a ausência da atividade sulfetogênica acetoclástica(KAKSONENet al., 2003; CAO et al., 2009; CELIS-GARCIA et al., 2009). Portanto, em sistemas com alta concentração de
sulfato, se a matéria orgânica é incompletamente oxidada, menor será o fluxo de elétrons para a redução do íon sulfato, o que sugere que mais substrato deverá ser adicionado, ou seja, a razão DQO/sulfato deverá ser maior que a estequiométrica (0.67).
7 PARRY, 2003), o anaeróbio de batelada sequencial (como o AnSBR)(SARTI e ZAIAT, 2011), o compartimentado (BAYRAKDARet al., 2009), o de leito fluidizado
(FBR)(KAKSONENet al., 2003) e o acoplado a membranas (CHUICHULCHERM et al.,
2001). Nestatese, os reatores contínuos UASB e de Leito Fluidizado (RLF) foram escolhidos para avaliar a biorredução do sulfato devido às suas diferentes características hidrodinâmicas e tipos de formação da biomassa.
Os reatores UASB são descritos como de construção simples e de baixo custo de operação, além de trabalhar com baixos valores de TDH no tratamento de esgotos domésticos. Sendo que para isto é fundamental a formação de uma biomassa floculenta ou granular (SPEECE, 1983).Contudo, no tratamento de efluentes com altas cargas de sulfato, o que se observa é a ruptura (ou a não formação) destes grânulos (SCHMIDT e AHRING, 1996). Consequentemente, para evitar que células de bactérias sejam lavadas do reator, é necessário alto tempo de detenção hidráulica (TDH)(LENSet al., 2002).Além disso, as condições de
mistura no reator devem proporcionar adequado contato entre a biomassa e o substrato. Como nos reatores sulfetogênicos, a degradação da matéria orgânica é realizada, sobretudo pelas BRS, convertendo sulfato a sulfeto dissolvido, nestes biorreatores,há pouca formação de biogás, o que está diretamente relacionadoà baixa atividade metanogênica (inibição pela toxicidade do íon sulfeto). Diante do fato de que a evolução do biogás tem sido associada à diminuição da resistência à difusão no lodo granular (LENSet al., 2002), os reatores
sulfetogênicos com biomassa em suspensão operam a menores taxas de transferência de massa, o que resulta em menores eficiências de redução de sulfato. Nesses reatores, asformas mais usuaispara aumentar a taxa de transferência de massa são; (i) elevar a velocidade superficial do líquido no reator(OMILet al., 1996), (ii) injeção de gás inerte no leito do lodo
8 recirculação da biomassa pode ser um recurso eficiente em reatores sulfetogênicos por aumentar a velocidade superficial do líquido e, portanto, melhorar a condição de mistura no reator UASB.
9 Tabela 1.2.Desempenho de vários reatores UASB usados para a redução de sulfato.
Referência Características do sistema Substrato T(ºC) COA
(KgDQO/m3.d)
Razão
DQO/SO42- pH
Sulfato
Afluente (kgSO42-/m3.d)
Redução (%)
Residual (mg.L-1)
Lopes et al.(2010) TRH -10h; com recirculação Sacarose 55 4.0 4 5.0 0.98 50-70% 120-200
Kosinska and Miskiewicz (2009)
TRH -0.6-10d; com recirculação
Efluente da
suinocultura 38 5.25-0.315 7-1.2 5.0 0.273-4.55 84-98% 50-430
Poinapen et al (2009) TRH -18h; com recirculação Lodo primário* 35 3.45 1.44 6.0 2.4 92% 144
Poinapen et al. (2009) TRH -20h; com recirculação Lodo primário* 20 1.975 1.75 6.0 1.7 93% 109
Lopes et al., (2007) TRH -10h; com recirculação e injeção de N2
Sacarose 55 4.76 1 6.0 4.76 95% 100
Gonçalves et al. (2007) TRH -18h; semrecirculação Etanol 25 - 0.75 7.0 0.53 38% 248
Mohan et al. (2005) TRH -37h; sem recirculação Efluente
industrial** 30 4.26 4.85 7.0 0.88 90-95% 68-151
Shayegan et al. (2005) TRH -37h; velocidades-0.5 e
1m/h; sem recirculação Melaço 35 0.65 2 7.0 0.32 >80% 99
Kaksonen et al. (2003) TRH -16h; com recirculação Lactato 35 - - 3.0 2.46 75% 402
Vallero et al. (2003) TRH -7.5h; com recirculação Metanol 55 18.56 5 7.0 3.84 99% 12
10 Além dos fatores acima citados (natureza do substrato e razão DQO/sulfato) que influenciam a redução do sulfato, outro aspecto importante é a taxa de crescimento específica relativamente baixa das BRS (para Desulfovibrio sp, são citados valores de µmaxem torno de
0,25h-1)(ZELLNER et al., 1994). O problema do crescimento de culturas microbianas que
apresentam baixas taxas de crescimento, é resolvido pelo uso de reatores que utilizam biomassa imobilizada como os reatores de leito fixo, por exemplo(HAMMACK e EDENBORN, 1992; GROUDEVA e GROUDEV, 1997; HAMMACK e DIJKMAN, 1999). Entretanto, estes reatores estão sujeitos a entupimentos e problemas de transferência de massa, o que diminui seus níveis de eficiência a longo prazo(SOMLEV e BANOV, 1998). Uma alternativa é o uso de reatores de leito fluidizado (KAKSONENet al., 2006)que possuem
11 Tabela 1.3.Desempenho de vários reatores de leito fluidizado usados para a redução do sulfato.
Referências Características do sistema Substrato T
(ºC)
Razão
DQO/SO42- pH
Sulfato Afluente (kgSO42-/m3.d)
Redução (%) Residual (mg.L-1)
Nevatalo et al. (2010) Fluidização-20% TRH-8h Etanol + metais 35 0.67-0.75 4 4.55 47 800
Celis-García et al.. (2009) Fluidização -25% TRH - 2d
Polietileno Etanol 25 0.6 6.5 1.66 28 2400
Sahinkaya et al. (2007) Mineral silicatado TRH -1d Etanol 8 0.74 6.5 1.63 23 1255
Celis-García et al. (2007) TRH 0.67 – 1d Fluidização -25%Polietileno
Lactato/Propionato/
Butirato 30 0.67 – 1.25 7 2.0 – 7.3 73-79 175-1024
Sahinkaya et al.(2011) Mineral silicatado TRH -1d Fluidização-25%
Etanol 65 0.67 - 1.5 70 450
Kaksonen et al. (2003)
TRH -16h Fluidização -20%
Material silicatado Lactato e Etanol 35 0.67 5-2.5 1.49 - 3.3
77-95(lactate)
60-75(Ethanol) -
Kaksonen et al. (2006) Fluidização -20% TRH -6.5h
Mineral silicatado Etanol 35 0.67 3 7.7 57 894
Nagpal et al. (2000) TRH -5h e 55h Etanol 30 2 7 11.9 95(55h)
12 A principal barreira para a aplicação da tecnologia de biorredução de sulfato para o tratamento de efluentes com alta carga de sulfato é o custo da fonte de carbono e elétrons (INAP, 2003). Tanto a seleção de uma fonte de carbono adequada quanto a quantidade do substrato utilizada estão relacionadas à sustentabilidade dos reatores sulfetogênicos. Dos mais de 34 substratos identificados como utilizáveis pelas BRS (SHEORANet al., 2010), os ácidos
graxos voláteis (acetato, propionato e butirato) e os ácidos graxos produtos intermediários da fermentação (lactato, piruvato e malato) estão entre as principais fontes de carbono e elétrons(LIAMLEAM e ANNACHHATRE, 2007). Em termos de energia disponível e biomassa produzida, o lactato é um doador de elétrons superior ao etanol, ao acetato, ao propionato e ao ácido acético (NAGPAL, CHUICHULCHERM, LIVINGSTONet al., 2000),
além de poder ser utilizado por uma grande variedade de espécies de BRS (BARTON, 1995). Portanto, é uma escolha lógica como controle positivo (SHEORANet al., 2010), nos estudos
de seleção de diferentes fontes de carbono para crescimento de BRS. Porém, seu uso em escala real é economicamente inviável. Diversas fontes de carbono mais baratas têm sido propostas tais como, feno, alfafa, lascas de madeira, estrume de animais, melaço e lodo de esgoto (LIAMLEAM e ANNACHHATRE, 2007). Considerando que as BRS não são capazes de utilizar diretamente substratos orgânicos complexos, a presença de micro-organismos capazes de degradar estes compostos a moléculas mais simples é essencial para o desempenho da redução de sulfato (TANGet al., 2009).
Com o desenvolvimento da indústria de biocombustíveis, particularmente de biodiesel, a disponibilidade de glicerol bruto será cada vez maior e, portanto, novas formas para o uso deste resíduo industrial são necessárias. A alta energia contida no glicerol faz com que seja um interessante substrato para a digestão anaeróbia (KOLESÁROVÁet al., 2011). Estudos
13 substratos para a produção de biogás em reatores metanogênicos (YANGet al., 2008;
FOUNTOULAKIS e CZACZYK, 2009; LOPÉZ et al., 2009; ALVAREZ et al., 2010).
Entretanto, na redução de sulfato, poucos estudos que utilizam o glicerol como fonte de carbono e elétrons têm sido relatados(QATIBI, 1990; DINKELet al., 2010). As BRS relatadas
capazes de oxidar glicerol são todas do gênero Desulfovibrio(KREMER e HANSEN, 1987;
QATIBIet al., 1991) o que implica que o glicerol é degradado incompletamente a acetato.
Entretanto, o glicerol pode ser fácil e rapidamente fermentado por outras bactérias, o que reduz o pH dos reatores e inibe a atividade sulfetogênica. Nesse sentido, Qatibi et al. (1991) descreveram em estudo com cultura mista de micro-organismos, em que as BRS competem com bactérias fermentativas pelo glicerol e sugeriram que a redução de sulfato ocorre acoplada à oxidação de produtos da fermentação do glicerol. Assim, a presença de micro-organismos fermentativos parece ser essencial para a redução do sulfato a partir da degradação do glicerol. Nesta tese, postula-se a hipótese de que o glicerol pode ser substrato para as BRS promovendo a redução do sulfato como uma fonte viável de matéria orgânica.
Esse conjunto de aspectos da redução biológica de sulfato, sucintamente descritos, é o suporte para o desenvolvimento dessa tese. Seus objetivos e a organização geral do texto são apresentados a seguir.
1.2. Objetivos e organização da tese
14 • Definir as rotas metabólicas predominantes no reator UASB, em função dadiversidade
de micro-organismos presentes na biomassa (Capítulo III).
• Identificar os principais grupos de micro-organismos presentes na biomassa dos reatores através de técnicas moleculares (Capítulo II, III e IV).
• Avaliar o efeito do aumento da carga orgânica na competição entre as bactérias redutoras de sulfato e fermentativas no reator UASB (Capítulo III).
• Avaliar o efeito da recirculação da biomassa no reator UASB na redução do sulfato (Capítulo III).
• Descrever e comparar as rotas metabólicas predominantes em um reator de leito fluizidado (RLF)sob alta carga de sulfato, utilizando lactato e/ou glicerol puro como fonte de carbono e elétrons (Capítulo IV).
• Comparar as eficiências de redução do sulfato utilizando um substrato controle (lactato) e um alternativo (glicerol) no reator RLF (Capítulo IV).
• Determinar os parâmetros para a redução de sulfato nos reatores contínuos, UASB e RLF (Capítulo II).
• Comparar as taxas específicas de redução de sulfato entre o reator com imobilização de biomassa (Leito Fluidizado) e o reator com biomassa dispersa (UASB) (Capítulo II).
15 configurações e condições operacionais e discutiu a eficiência de redução do sulfato, selecionando o melhor reator para avaliar a eficiência da biorredução do sulfato utilizando o glicerol como fonte de carbono e elétrons. Este artigo foi submetido ao periódico “Biochemical Engineering Journal”.
No CAPÍTULO 3, serão discutidos os resultados obtidos durante o monitoramento do reator UASB, no trabalho intitulado:“IMPLICATIONS OF VOLATILE FATTY ACID PROFILE ON THE METABOLIC PATHWAY DURING A CONTINUOUS SULPHATE REDUCTION”. Neste artigo,a eficiência da biorredução do sulfato no reator UASB foi detalhadamente discutidasob diferentes cargas orgânicas e condições hidrodinâmicas (sem e com recirculação). As principais rotas metabólicas foram propostas para o processo de redução do sulfato durante a degradação do lactato em função da diversidade microbiana presente no reator. Este artigo foi publicado na revista “Jornal Environmental Management”.
16 1.3. Referências
AKCIL, A. e S. KOLDAS. Acid Mine Drainage (AMD): causes, treatment and case studies.
Journal of Cleaner Production, v.14, n.12, p.1139-1145. 2006.
ALVAREZ, J. A., et al. A methodology for optimising feed composition for anaerobic co-digestion of agro-industrial waste. Bioresource Technology, v.101, n.4, p.1153-1158. 2010.
BARTON, L. L. Sulfate-reducing bacteria. New York: Plenum Press, v.8. 1995. 336 p.
(Biotechonology Handbooks)
BAYRAKDAR, A., et al. Performance of sulfidogenic anaerobic baffled reactor (ABR) treating acidic and zinc-containing wastewater. Bioresource Technology, v.100, n.19,
p.4354-4360. 2009.
CAO, J., et al. Precipitation of valuable metals from bioleaching solution by biogenic sulfides.
Minerals Engineering, v.22, n.3, p.289-295. 2009.
CELIS-GARCIA, L., et al. Characterization of sulfate-reducing bacteria dominated surface communities during start-up of a down-flow fluidized bed reactor. Journal of Industrial Microbiology & Biotechnology, v.36, n.1, p.111-121. 2009.
CELIS-GARCÍA, L. B., et al. Performance of a down-flow fluidized bed reactor under sulfate reduction conditions using volatile fatty acids as electron donors. Biotechnology and Bioengineering, v.97, n.4, p.771-779. 2007.
CHANG, I. S., et al. Biological treatment of acid mine drainage under sulphate-reducing conditions with solid waste materials as substrate. Water Research, v.34, n.4, p.1269-1277.
2000.
CHEN, W. H. e J. M. RIM.Competition and inhibition of sulfate reducers and methane producers in anaerobic treatment.Water Science Technology, v.23, p.1259-1264. 1991.
CHEN, Y., et al. Inhibition of anaerobic digestion process: A review. Bioresource Technology, v.99, n.10, p.4044-4064. 2008.
CHUICHULCHERM, S., et al. Treatment of metal-containing wastewaters with a novel extractive membrane reactor using sulfate-reducing bacteria.Journal of Chemical Technology & Biotechnology, v.76, n.1, p.61-68. 2001.
COLLERAN, E., et al. Full-scale and laboratory-scale anaerobic treatment of citric acid production wastewater.Biodegradation, v.9, n.3, p.233-245. 1998.
CONAMA. Conselho Nacional do Meio Ambiente - Resolução n° 357/2005: <http://www.mma.gov.br/port/conama/res/res05/res35705.pdf> 2005.
17 DE SMUL, A., et al. Effect of COD to sulphate ratio and temperature in expanded-granular-sludge-blanket reactors for sulphate reduction. Process Biochemistry, v.34, n.4, p.407-416.
1999.
DINKEL, V., et al. Kinetics of anaerobic biodegradation of glycerol by sulfate-reducing bacteria.Applied Biochemistry and Microbiology, v.46, n.7, p.712-718. 2010.
FOUNTOULAKIS, M. S. e K. CZACZYK. Enhanced methane and hydrogen production from municipal solid waste and agro-industrial by-products co-digested with crude glycerol.
Bioresource Technology, v.100, p.3043-3047. 2009.
GONÇALVES, M. M. M., et al. Heavy metal removal from synthetic wastewaters in an anaerobic bioreactor using stillage from ethanol distilleries as a carbon source. Chemosphere,
v.69, n.11, p.1815-1820. 2007.
GROUDEVA, V. I. e S. N. GROUDEV. Bioremediation of Acid Drainage Waters from a Cooper Mine. In: International Biohydrometallurgy Symposium IBS-97. Sidney, Australia, 1997. p. 50.
GUPTA, A., et al. Methanogenesis and sulfate reduction in chemostats.Kinetic studies and experiments.Water Research, v.28, n.4, p.781-793. 1994.
HAMMACK, R. W. e H. DIJKMAN. The Application of Bacterial Sulfate Reduction Treatment to Severely Contaminated Mine Waters: Results of Three Years of Pilot Plant Testing. In: Copper 99 - Cobre 99. Phoneix, Arizona, USA: TMS, 1999. p. 97-111.
HAMMACK, R. W. e H. M. EDENBORN.The Removal of Nickel from Mine Waters Using Bacterial Sulfate Reduction.Applied Microbiology and Biotechnology, v.37, n.5, Aug,
p.674-678. 1992.
HUTTON, B., et al. Operating and maintenance experience at the eMalahleni Water Reclamation Plant. In: International Mine Water Conference. Pretoria, South Africa, 2009. p. 415-430.
INAP.Treatment of sulphate in mine effluentes.International network for acid prevention, p.129. 2003
ISA, Z., et al. Sulfate Reduction Relative to Methane Production in High-Rate Anaerobic Digestion: Technical Aspects. Appl. Environ. Microbiol., v.51, n.3, March 1, 1986,
p.572-579. 1986.
JONG, T. e D. L. PARRY. Removal of sulfate and heavy metals by sulfate reducing bacteria in short-term bench scale upflow anaerobic packed bed reactor runs. Water Research, v.37,
n.14, p.3379-3389. 2003.
KAKSONEN, A., et al. Performance and Ethanol Oxidation Kinetics of a Sulfate-Reducing Fluidized-Bed Reactor Treating Acidic Metal-Containing Wastewater.Biodegradation, v.14,
18 KAKSONEN, A. H., et al. The performance, kinetics and microbiology of sulfidogenic fluidized-bed treatment of acidic metal- and sulfate-containing wastewater.Hydrometallurgy,
v.83, n.1-4, p.204-213. 2006.
KAKSONEN, A. H. e J. A. PUHAKKA. Sulfate Reduction Based Bioprocesses for the Treatment of Acid Mine Drainage and the Recovery of Metals. Engineering in Life Sciences,
v.7, n.6, p.541-564. 2007.
KOLESÁROVÁ, N., et al. Utilization of Biodiesel By-Products for Biogas Production.
Journal of Biomedicine and Biotechnology, v.2011, p.1-15. 2011.
KOSINSKA, K. e T. MISKIEWICZ.Performance of an anaerobic bioreactor with biomass recycling, continuously removing COD and sulphate from industrial wastes.Bioresource Technology, v.100, n.1, p.86-90. 2009.
KREMER, D. R. e T. A. HANSEN.Glycerol and dihydroxyacetone dissimilation in
Desulfovibrio strains.Archives Microbiology, v.147, p.249-256. 1987.
LENS, P., et al. Perspectives of sulfate reducing bioreactors in environmental biotechnology.Reviews in Environmental Science and Biotechnology, v.1, n.4, p.311-325.
2002.
LENS, P. N., et al. Sulfate reducing and methane producing bacteria in aerobic wastewater treatment systems.Water Research, v.29, n.3, p.871-880. 1995.
LENS, P. N. L., et al. Use of Sulfate Reducing Cell Suspension Bioreactors for the Treatment of SO2 Rich Flue Gases.Biodegradation, v.14, n.3, p.229-240. 2003.
LENS, P. N. L., et al. Biotechnological treatment of sulfate-rich wastewater.Critical reviews in Environmental Science and Technology, v.28, n.1, p.41-88. 1998.
LIAMLEAM, W. e A. P. ANNACHHATRE.Electron donors for biological sulfate reduction.Biotechnology Advances, v.25, n.5, p.452-463. 2007.
LOPES, S. I. C., et al. Sulfate reduction during the acidification of sucrose at pH 5 under thermophilic (55 °C) conditions. II: Effect of sulfide and COD/ SO 4 2 - ratio. Bioresource Technology, v.101, n.12, p.4278-4284. 2010.
LOPES, S. I. C., et al. Effect of COD/SO42- ratio and sulfide on thermophilic (55°C) sulfate
reduction during the acidification of sucrose at pH 6.Water Research, v.41, n.11,
p.2379-2392. 2007.
LOPÉZ, J. A. S., et al. Anaerobic digestion of glycerol derived from biodiesel manufacturing.
Bioresource Technology, v.100, p.5609-5615. 2009.
19 MOOSA, S., et al. A kinetic study on anaerobic reduction of sulphate, Part I: Effect of sulphate concentration. Chemical Engineering Science, v.57, n.14, p.2773-2780. 2002.
NAGPAL, S., et al. Ethanol utilization by sulfate-reducing bacteria: An experimental and modeling study. Biotechnology and Bioengineering, v.70, n.5, p.533-543. 2000.
NAGPAL, S., et al. Microbial sulfate reduction in a liquid–solid fluidized bed reactor.
Biotechnology and Bioengineering, v.70, n.4, p.370-380. 2000.
NEVATALO, L. M., et al. Biological hydrogen sulfide production in an ethanol lactate fed fluidized-bed bioreactor. Bioresource Technology, v.101, n.1, p.276-284. 2010.
O'FLAHERTY, V., et al. Long-term competition between sulphate-reducing and methane-producing bacteria during full-scale anaerobic treatment of citric acid production wastewater.Water Research, v.32, n.3, p.815-825. 1998.
OMIL, F., et al. Effect of upward velocity and sulphide concentration on volatile fatty acid degradation in a sulphidogenic granular sludge.Process Biochemistry 31 (1996) 699-710.
1996.
POINAPEN, J., et al. Biological sulphate reduction with primary sewage sludge in an upflow anaerobic sludge bed (UASB) reactor - Part 2: Modification of simple wet chemistry analytical procedures to achieve COD and S mass balances. Water SA, v.35, p.535-542. 2009.
POINAPEN, J., et al. Biological sulphate reduction with primary sewage sludge in an upflow anaerobic sludge bed (UASB) reactor - Part 3: Performance at 20ºC and 35ºC. Water SA,
v.35, p.543-552. 2009.
QATIBI, A. I. Fermentation du lactate, du glycerol et des diols par les bactéris sulfato-réductrices du genere Desulfovibrio. Microbiology, University of Provence, France, 1990.165
p.
QATIBI, A. I., et al. Desulfovibrio alcoholovorans sp. nov., a sulfate-reducing bacterium able
to grow on glycerol, 1,2-and 1,3-propanediol. Microbiology, v.155, p.143-148. 1991.
REN, N.-Q., et al. Effects of COD/SO42- Ratios on an Acidogenic Sulfate-Reducing Reactor.
Industrial & Engineering Chemistry Research, v.46, n.6, 2007/03/01, p.1661-1666. 2007.
RINZEMA, A. e G. LETTINGA.Anaerobic treatment of sulfate containing wastewater. In:
W. D.L. (Ed.). Biotreatment systems. Bonda Raton, FL: CRC Press, 1988. p.65 - 109
SAHINKAYA, E., et al. Sulfidogenic fluidized-bed treatment of metal-containing wastewater at 8 and temperatures is limited by acetate oxidation. Water Research, v.41, n.12,
p.2706-2714. 2007.
20 SARTI, A. e M. ZAIAT.Anaerobic treatment of sulfate-rich wastewater in an anaerobic sequential batch reactor (AnSBR) using butanol as the carbon source.Journal of Environmental Management, v.92, n.6, p.1537-1541. 2011.
SCHMIDT, J. E. e B. K. AHRING.Granular sludge formation in upflow anaerobic sludge blanket (UASB) reactors.Biotechnology and Bioengineering, v.49, n.3, p.229-246. 1996.
SHAYEGAN, J., et al. The effect of influent COD and upward flow velocity on the behaviour of sulphate-reducing bacteria.Process Biochemistry, v.40, n.7, p.2305-2310. 2005.
SHEORAN, A. S., et al. Bioremediation of acid-rock drainage by sulphate-reducing prokaryotes: A review. Minerals Engineering, v.23, n.14, p.1073-1100. 2010.
SILVEIRA, A. N., et al. Técnicas para tratamento e alternativas de reúso de águas ácidas de minas de carvão. In: VI Simpósio Internacinal de Qualidade Ambiental da Associação Brasileira de Engenharia Sanitária (ABES). Porto Alegre. 26 - 28, maio, 2008, 2008. p. 1-8. SOMLEV, V. e M. BANOV. Three stage process for complex biotechnological treatment of industrial wastewater from uranium mining. Biotechnology Techniques, v.12, n.8, Aug,
p.637-639. 1998.
SPEECE, R. E. Anaerobic biotechnology for industrial wastewaster treatment.Environmental Science Technology v.17, n.9, p.416 - 427. 1983.
STUCKI, G., et al. Biological sulfuric acid transformation: Reactor design and process optimization. Biotechnology and Bioengineering, v.41, n.3, p.303-315. 1993.
SUTTON, P. M. e P. N. MISHRA. Activated carbon based biological fluidized beds for contaminated water and wastewater treatment: a state-of-the-art review. Water Science and Technology, v.29, p.309-317. 2004.
TANG, K., et al. Bacteria of the sulphur cycle: An overview of microbiology, biokinetics and their role in petroleum and mining industries. Biochemical Engineering Journal, v.44, n.1,
p.73-94. 2009.
VALLERO, M. V. G., et al. Effect of sulfate on methanol degradation in thermophilic (55 °C) methanogenic UASB reactors. Enzyme and Microbial Technology, v.32, n.6, p.676-687.
2003.
VISSER, A., et al. Granulation and immobilisation of methanogenic and sulfate-reducing bacteria in high-rate anaerobic reactors.Journal Applied Microbiology and Biotechnology,
v.40, p.575-581. 1993.
VISSER, A., et al.The anaerobic treatment of synthetic sulfate containing wastewater under thermophilic (55°C) conditions.Water Science Technology, v.25, p.193-202. 1992.
21 YANG, Y., et al. Biodegradation and methane production from glycerol-contaning synthetic waste with fixed-bed bioreactor under mesophilic and thermophilic anaerobic conditions
Process Biochemistry, v.43, p.362-367. 2008.
22
CAPÍTULO 2
PERFORMANCE OF CONTINUOUS BIOREACTORS FOR SULFATE REDUCTION AIMING AT UTILIZING GLYCEROL AS CARBON SOURCE
Abstract
Reactor hydrodynamics is important for sulfidogenesis because sulfate reduction bacteria (SRB) do not granulate easily. In this work, the sulfate reduction performance of an Upflow Anaerobic Sludge Blank (UASB) reactor was compared to that of a fluidized bed reactor (FBR). Organic loading, sulfate reduction, COD removal and mixing conditions were the main parameters monitored during lactate and glycerol degradation. The UASB reactor showed a maximum volumetric sulfate reduction specific rate of 1.3g/(L-1.d-1 (66% removal) working without recirculation, and this was a result of competition between fermentative bacteria and SRB for the available substrate. Biomass recirculation considerably enhanced the sulfate reduction specific rate to 0.089±0.014g/(gSSV.d) (89% reduction), for a COD/sulfate mass ratio value of 2.5±0.2, whereas values twice as higher were achieved in the FBR treating either lactate (0.191±0.016g/(gSSV.d)) or glycerol (0.172±0.010 g/(gSSV.d)). Sulfate reduction in the presence of pure glycerol as an organic substrate produced a smaller residual COD (1700mg/L) than that produced with lactate (2500mg/L) at the same COD/sulfate mass ratio of 2.5. It was estimated that 50% of glycerol degradation was due to sulfate reduction and 50% to fermentation, which was supported by the presence of butyrate in the FBR effluent. The UASB reactor was unable to produce an effluent with sulfate concentrations below 250mg/L due to poor mixing conditions. Conversely, the FBR consistently ensured residual sulfate concentrations below this target value.
23 2.1. Introduction
Treatment of sulfate-containing effluents is a major issue for both mining, metallurgical and chemical industries, due to a frequently large anion content, which can reach 8g/L [1]. The reasons for such contamination are the widespread use of sulfuric acid in chemical and metallurgical industries, in addition to the natural oxidation of sulfide minerals in mining operations.
Sulfate is not a very toxic compound, but above 600mg/L in drinking water, it usually has laxative effects. Therefore, the World Health Organization (WHO) does not establish a guideline value for sulfate and only recommends that authorities should be notified when the anion concentration is above 500mg/L in drinking water. On the other hand, since the presence of sulfate in concentrations higher than 250mg/L may affect acceptability of drinking water, this concentration is usually taken as target from a water quality perspective. Regarding wastewaters, most countries do not specify a value for sulfate, but maximum TDS (total dissolved solids) limits are usually set implying that sulfate concentrations must comply with such limits [1]. Overall, discharge limits varying between 250mg/L and 500mg/L are common place in mining countries, requiring effluent treatment if sulfate concentrations are above such threshold value [1, 2].
24 avoid microorganism washout [17, 18]. Overall, the performance of anaerobic reactors treating high sulfate loading rates (SLR) is defined by: (i) substrate type [19]; (ii) COD/sulfate ratio [8, 20]; (iii) inoculum source and enrichment procedure [21]; (iv) pH values [22]; (v) competition among it different groups of microorganisms [23, 24] and reactor configuration [13, 25]. Moreover, competition between sulfate-reducing bacteria (SRB) and methane-producing microorganisms (MPM) in anaerobic reactors is well documented [26-28], but the fermentative metabolism, although having an important contribution to organic matter oxidation [24, 29, 30], is less discussed in the context of continuous sulfate reduction.
25 2.2. Materials and methods
2.2.1. Bioreactors
Two lab-scale bioreactors were projected and assembled as shown in figure 2.1. Both reactors were placed inside a fume hood in a temperature-controlled room, whereby the temperature was maintained at 25±2ºC. Peristaltic pumps fed Postgate C medium supplemented with sulfate into both reactors. The UASB reactor had a total volume of 3.0L and contained three sampling ports (a, b and c) and a gas outlet at its top. Peristaltic pump was used for biomass
recirculation by port c, as detailed in Table 2.1.
26 Table 2.1.Characteristics and operating conditions of the reactors studied.
Parameters UASB FBR
Volume (L) 3.0 1.3
Flow rate (L/h) 0.125-0.167±0.01 0.13±0.01
Hydraulic retention time (h) 18 (phase VI)
24±1 (phases I-V; VII)
18 ±1 (phase VI)
10±1 (all phases)
Recirculation rate (L/h) 12 166
Temperature 25±2 25±2
Carrier material - activated carbon
Fluidization (%) - 86
The total volume of the FBR was 1.3 liter. Three sampling ports (D, E and F), a gas outlet
(G), a feed tank, as well as an effluent tank completed the system. Activated carbon was used
as the biomass carrier material (150g; 2.1mm mean diameter; density: 1.63g/cm3) and it was fluidized by means of flow recirculation by a second pump with the flow rate set at 166L/h (table 2.1). This resulted in a upflow velocity of 75.0m/h and 86% of bed expansion (table 2.1). For fluidization, the effluent from the outlet port (g) was recycled in to the system.
2.2.2. Microorganisms and reactor start-up
The original inoculum (granular sludge) was obtained from an UASB reactor (real scale) treating domestic wastewater. Enrichment of sulfate-reducing bacteria was performed in a batch reactor (5 liters) for about 500 days with Postgate C mineral medium containing 0.5g/L KH2PO4; 1.0g/L NH4Cl; 0.06g/L MgSO4.7H2O; 0.1g/L FeSO4.7H2O; 0.25g/L yeast extract;
2.96g/L Na2SO4; and 3.76g/L lactate as carbon and electron source.
27 growth. During the FBR operation, sulfate concentration was kept at 2.0 gSO42-/L in phases I
and II, while in phases III and IV, the COD was set at 5.0g/L. The optimum COD/sulfate ratio (2.5) was applied during phase V, aiming at preparing the FBR for a substrate change (from lactate to glycerol). Phase VI was run with glycerol as the only carbon source, since it replaced lactate in the Postgate C medium. Similarly, the operational conditions for the UASB reactor were as follow: reactor start-up during phases I and II; COD increasing from 3.6gCOD/L to 6.0gCOD/L in phases III to V; flow rate change from 0.125 L/h to 0.167L/h (HRT reduced from 24h to 18h) (phase VI) and effluent recirculation during phase VII.
Figure 2.2.Time diagram showing experimental conditions applied in both the UASB reactor and the FBR. Inside each box is depicted the COD/sulfate mass ratio. When there was a change on the COD or sulfate loading the other parameter was kept constant. During phase VI (UASB reactor), the change on the COD/Sulfate ratio was due to different flow rate applied.
28 (Eh). Once a week, a sample from inside the reactor was withdrawn for measuring VSS, alkalinity, pH and redox potential, whereas viable cells were determined monthly. In the FBR, the total biomass concentration was determined only in the phase V, according to the following procedure: 5g of the colonized activated carbon was removed from within the reactor and then submitted to sonication in an ice bath, for 5 minutes. This procedure was performed 3 times and afterwards the carbon fraction was filtered before submitting the liquid phase to standard VSS measurement [36].
2.2.3. Analytical methods
Sulfate concentration was determined by ionic chromatography (Metrohm) using an ASSUP-10 column and conductivity detection. VFA (acetic, propionic, valeric, butyric) were analyzed by high performance liquid chromatography, (HPLC, Shimadzu), with an ion exchange column Aminex HPX-87H 300mm x 7.8mm (Bio-Rad). Prior to injection, samples were filtered using 0.22µm membrane filters (Millipore). The chromatographic method was properly validated and is detailed elsewhere [37]. Bicarbonate alkalinity (BA), VSS and COD analysis were carried out according to the Standard Methods for Water and Wastewater [36]. Before COD determination, any sulfide present in effluent samples was stripped off by adding a drop of HCl (35%) and flushing the sample for 10 min with N2. The solution’s pH (Hanna HI931400) and its redox potential (Digimed) (vs an Ag/AgCl electrode) were also recorded.
29 1.5atm, 20min). Subsequently, culture tubes plus the control were incubated for 30 days, at 35oC.
2.3. Results
The performance of both an UASB and a fluidized bed reactors treating sulfate-laden solutions was compared under different operational conditions (figure 2.2) such as organic and sulfate loading rates, mixing conditions and organic substrate type (only in the FBR). Furthermore, the sulfidogenic activity was monitored through sulfate and lactate profiles and by the volatile fatty acids produced.
2.3.1. Performance and stability of UASB and Fluidized Bed reactors.
30
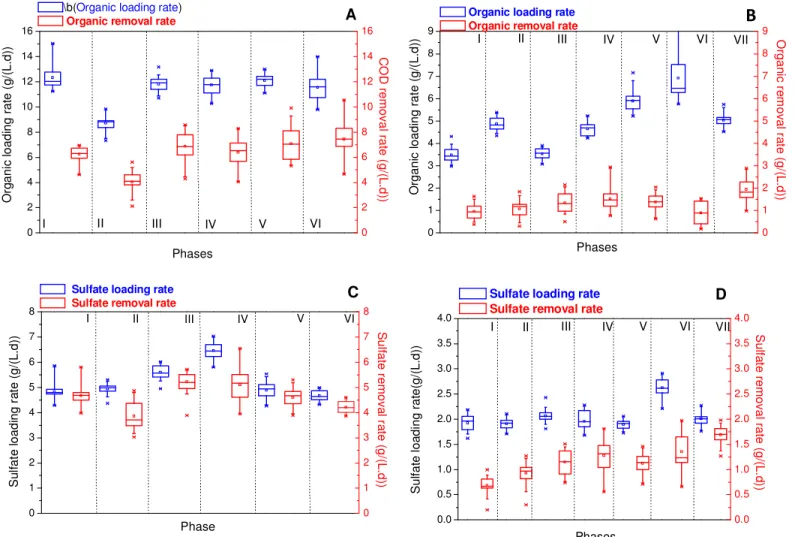
I II III IV V VI
0 25 50 75 100 Sulfate removal Phases S u lf a te r e m o v a l e ff ic ie n y ( % ) 0 250 500 750 1000 1250 1500 1750
Residual sulfate target
A
S u lfa te c o n c e n tra tio n ( m g /L )I II III IV V VI VII 0 25 50 75 100 Sulfate removal
B
Phases S u lf a te r e m o v a l e ff ic ie n c y ( % ) 0 250 500 750 1000 1250 1500 1750Residual sulfate target
S u lfa te c o n c e n tra tio n ( m g /L )
Figure 2.3. Sulfate removal, residual and target sulfate concentrations in different phases of the FBR (A) and UASB reactor (B) operations.
31 value of 250mg/L, it can be seen that during phases I, III, V and VI, the FBR resulted in residual sulfate concentrations below that limit. Conversely, the UASB reactor was unable to produce final sulfate concentrations below 250mg/L and the lowest average sulfate concentration was achieved during phase VII (with recirculation), however, with a considerable scattering (275±106mg/L), as shown in figure 2.3B.
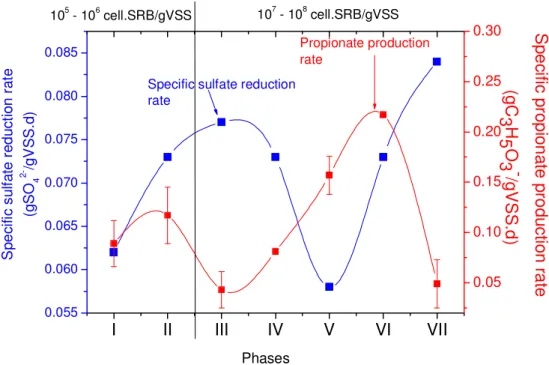
As sulfate reduction (and alkalinity production) was constantly higher in the FBR than in the UASB reactor, the former showed a much more stable operation. The pH fluctuated between 7.9 and 8.8, with a mean value of 8.3 (figure 2.4A) when lactate was the carbon source, dropping to 7.5 when glycerol was the substrate. Going from phase I (COD/sulfate mass ratio of 2.6) to phase 2 (COD/sulfate mass ratio of 1.8) there was a decrease in both alkalinity and VFA concentrations, which is likely a consequence of both lower organic loading rates (OLR) (figure 2.5A) and sulfate reduction yields (figure 2.3A). The FBR showed a tendency towards stabilization during the remaining phases treating lactate (III to V), which was reflected in values of free SRB cells above 109cells/mL (figure 2.6A). The large data scattering observed in VFA figures during phase IV (figure 2.4C) can be ascribed to an increased in the sulfate loading rate (SLR) from 5.01 ± 0.29gSO42-/(L.d) in phases I and II to 6.46 ± 0.34gSO42-/(L.d)
32 6.0 6.5 7.0 7.5 8.0 8.5 9.0 9.5 10.0 Phases A VI V IV III II I p H 6.0 6.5 7.0 7.5 8.0 8.5 9.0 9.5 10.0 Phases B VII V I V IV III II I p H 0 1000 2000 3000 4000 5000 Phases C VI V IV III II I V F A a n d B A c o n c e n tr a ti o n s ( m g /L )
Volatile fatty acids (mgH2C2O4/L) Bicarbonate alkalinity (mgCaCO3/L)
0 1 0 0 0 2 0 0 0 3 0 0 0 4 0 0 0 5 0 0 0
D V II V I V IV III II I
P h a s e s
V F A a n d B A c o n c e n tr a ti o n s ( m g /L )
V o latile fa tty a cid s (m g H2C2O4/L )
B ica rb o n ate alk alin ity (m g C aC O 3/L )
33 0 2 4 6 8 10 12 14 16 0 2 4 6 8 10 12 14 16 Phases C O D re m o v a l r a te ( g /(L .d )) A VI V IV III II I
\b(Organic loading rate) Organic removal rate
O rg a n ic lo a d in g r a te ( g /( L .d )) 0 1 2 3 4 5 6 7 8 9 0 1 2 3 4 5 6 7 8 9
B
O rg a n ic r e m o va l r a te (g /(L .d ))Organic loading rate Organic removal rate
Phases VII VI V IV III II I O rg a n ic l o a d in g r a te ( g /( L .d )) 0 1 2 3 4 5 6 7 8 0 1 2 3 4 5 6 7 8 S u lfa te r e m o v a l r a te (g /(L .d )) Phase C VI V IV III II I
Sulfate loading rate
Sulfate removal rate
S u lf a te l o a d in g r a te ( g /( L .d )) 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 0.0 0.5 1.0 1.5 2.0 2.5 3.0 3.5 4.0 Phases S u lfa te re m o v a l r a te (g /(L .d )) D VII VI V IV III II I S u lf a te l o a d in g r a te (g /( L .d ))
Sulfate loading rate
Sulfate removal rate
34
I II III IV V 0 10 20 30 40 50 60 70 80 90 100 Phases O xi z id e d l a c ta te ( % ) 1E7 1E8 1E9 1E10 Lactate oxidized by SRB SRB population
A
S R B p o p u la tio n ( M P N )I II III IV V VI VII 0 25 50 75 100 Lactate oxidized
by SRB SRB population
Phases O x iz id e d la c ta te (% ) 1E7 1E8 1E9 1E10 1E11
B
S R B p o p u la tio n ( M P N )35 In the UASB reactor during the phases without recirculation (I to VI) pH values increased from 7.1 (phase I) to 7.6 (phase III), figure 2.4B, which can be related to the increase and stabilization of the SRB population, which attained 1010free SRBcells/mL in phase III (figure 2.6B). As a result, alkalinity stabilized in the 1300-1500mg/L range (phase IV onward) as show in figure 2.4D, which agrees with the data of Ren et al. [30], who stated that high sulfate reduction rates (80% to 90%) required alkalinity values in this range. During phases IV and V, the reduction in pH values (7.4 to 6.9, figure 2.4B) can be ascribed to the increase applied in the OLR (from 4.65 ± 0.30g/(L.d) to 5.89 ± 0.48g/(L.d)), figure 2.5B, that implied in larger VFA production (figure 2.4D). Biomass recirculation (phase VII) enabled stabilization of both VFA and alkalinity, which resulted in higher pH values (7.5, figure 2.4B). A common consequence of VFA build-up is the failure of anaerobic reactors, derived from a sharp drop in pH values, which results in inhibition of the methanogenic activity [39]. However, during sulfidogenesis there was a large production of alkalinity (figures 2.4C and 2.4D) caused by the activity of different SRB groups (Desulfovibrio, Desulfobulbus, Desulfotomaculum, Desulfomona), during the incomplete substrate oxidation (either lactate or glycerol) [40].
Such alkalinity enabled the pH values to be maintained in the optimum values for SRB growth [41], without any external alkalinity requirement.
2.3.2. COD consumption and sulfate reduction yields
36 Mixing conditions and improved of mass transfer might have accounted for such behavior because when the recirculation was performed in the UASB reactor (phase VII), COD consumption (figure 2.5B) increased to 1.94±0.56gCOD/(L.d), which was still lower than that observed in the FBR. In addition, data scattering was more pronounced in the UASB reactor as compared to the FBR, confirming the lower operational stability of the former.
Both reactors showed low overall COD removal rates (figure 2.5A and 2.5B), which can be explained by lactate conversion to acetate by incomplete-oxidizing SRB (predominant in the reactor biomass) and due to a lack of both acetoclastic-SRB and methanogenic activities [40]. Such behavior was confirmed by acetate accumulation in reactor effluents (figure 2.7). Similar studies also observed that the incomplete COD removal was due to the absence of microbial species which can metabolize acetate [42, 43].
2.3.3. Effect of the reactor configuration in sulfate removal
37 observed in the reactor effluent in all phases (figure 2.7B). In addition, increased influent COD resulted in larger propionate concentrations and such a behavior can be ascribed to poor mixing conditions in the UASB reactor, which did not enable a faster SRB growth as it will be discussed further in this work. Mass transfer is particularly impaired during sulfidogenesis due to a lack of methanogenic activity and also because roughly only 50% of the total sulfide is present as H2S, i.e. there is a small (or negligible) gas production.
0 500 1000 1500 2000 2500 3000 3500 4000 Phases A VI V IV III II I A c e ta te /b u ty ra te c o n c . (m g /L ) Acetate Butyrate 0 1000 2000 3000 4000 Phases B VII VI V IV III II I Acetate Propionate A c e ta te /p ro p io n a te c o n c . (m g /L )
38 Moreover, an important limitation of UASB reactors treating sulfate is the granulation of the biomass [46]. Several studies have shown that granular sludge formation is related to the presence of methanogens, among other microorganisms [47, 48]. However, methanogens are highly sensitive to high sulfide concentrations, whereas propionibacteria, which are nucleation centers of the granules are outcompeted by SRB at high sulfate loading rates [49]. In addition, the latter also reduce granule sizes [50]. Methanogens were not identified in neither reactors operated here, therefore granulation was not expected. Indeed, the fine and weightless sludge observed in the UASB reactor (data not shown), was prone to washout. Such phenomenon occurred during phase VI, when it was attempted to improve the mixing conditions in the UASB reactor by increasing the flow rate from 0.125L/h to 0.167L/h and thus the upflow velocity from 0.018m/h to 0.024m/h. This resulted in increased VSS concentrations in the UASB effluent, from 80mg/L (on average) to nearly 500mgSSV/L towards the end of the phase. Such biomass loss impaired the reactor performance with a drop in both COD consumption (from 1.6g/(L.d) in phase V to 0.8g/(L.d) in phase VI; figure 2.5B) and sulfate reduction (which progressively decreased from 70% to 40% during phase VI, figure 2.3B). Omil et al. [15] also reported that increasing the upward velocity impaired sulfidogenesis. Conversely, better mixing conditions coupled to the presence of a solid enabled the presence of a SRB population larger than 109 free cells/mL (figure 2.6A) and therefore much larger sulfate reductions in the FBR (above 90%), already in phase I.
Because increasing the superficial upflow velocity resulted in bacterial washout, biomass recirculation was tested so that the upward velocity was increased to 1.75m/h, thus improving mass transfer in the UASB reactor. Accordingly, sulfate reduction was improved to 89% (specific activity of 1.6gSO42-/(gVSS.d)) in the UASB reactor during phase VII, as shown in
39 VFA and alkalinity values, i.e., more stable reactor operation (figures 2.4 and 2.5). This is because, in such new configuration, no biomass washout was observed and the bacterial population distribution throughout the UASB reactor was homogenized as shown in figure2.8. Conversely, in the FBR the presence of immobilized biomass (larger bacterial population, table 2.2) along with improved mass transfer (due to fluidization) enabled larger sulfate reduction efficiencies, which reached 97% (specific sulfate reducing activity rate of 4.8gSO4
2-/(gVSS.d)), during phase I (table 2.2). Several studies have reported efficient biomass retention and improved mass transfer in the FBR, therefore larger reaction rates are normally expected [51-53].
III VII
0 2 4 6 8 10 12
V
S
S
m
a
s
s
(
g
)
Phases
Port A Port B Port C