RICARDO DIAS DE CASTRO
ATIVIDADE ANTIFÚNGICA DO ÓLEO ESSENCIAL DE Cinnamomum zeylanicum Blume (CANELA) E DE SUA ASSOCIAÇÃO COM ANTIFÚNGICOS
SINTÉTICOS SOBRE ESPÉCIES DE Candida
UNIVERSIDADE FEDERAL DA PARAÍBA - UFPB CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS
RICARDO DIAS DE CASTRO
ATIVIDADE ANTIFÚNGICA DO ÓLEO ESSENCIAL DE Cinnamomum zeylanicum Blume (CANELA) E DE SUA ASSOCIAÇÃO COM ANTIFÚNGICOS
SINTÉTICOS SOBRE ESPÉCIES DE Candida
Tese apresentada ao Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde da Universidade Federal da Paraíba, como parte dos requesitos para obtenção do título de DOUTOR EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS. Área de concentração: FARMACOLOGIA
Orientadora: Profa. Dra. Edeltrudes de Oliveira Lima
C355a Castro, Ricardo Dias de.
Atividade antifúngica do óleo essencial de Cinnamomum zeylanicum Blume (canela) e sua associação com antifúngicos sintéticos sobre espécies de Candida / Ricardo Dias de Castro. - - João Pessoa: [s.n.], 2010.
168 f.: il. -
Orientadora: Edeltrudes de Oliveira Lima.
Tese (Doutorado) – UFPB/CCS, Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos.
1. Agentes contra Candida albicans - Canela. 2. Cinnamomum zeylanicum. 3. Canela. 4. Miconazol. 5. Candidíase. 6. Sinergismo Farmacológico.
RICARDO DIAS DE CASTRO
ATIVIDADE ANTIFÚNGICA DO ÓLEO ESSENCIAL DE Cinnamomum zeylanicum
Blume (CANELA) E DE SUA ASSOCIAÇÃO COM ANTIFÚNGICOS SINTÉTICOS SOBRE ESPÉCIES DE Candida
Tese ________________ em ___/___/______
COMISSÃO EXAMINADORA
______________________________________________
Profa. Dra. Edeltrudes de Oliveira Lima
Universidade Federal da Paraíba – Orientadora
______________________________________________
Prof. Dr. José Pinto de Siqueira Júnior
Universidade Federal da Paraíba – Examinador interno
______________________________________________
Profa. Dra. Margareth Formiga de Melo Diniz
Universidade Federal da Paraíba – Examinadora interna
______________________________________________
Profa. Dra. Lindomar de Farias Belém
Universidade Estadual da Paraíba – Examinadora externa
______________________________________________
Prof. Dr. Thompson Lopes de Oliveira
Universidade Federal da Paraíba – Examinador externo
______________________________________________
Prof. Dr. Alessandro Leite Cavalcanti
Universidade Estadual da Paraíba – Examinador exteno (suplente)
______________________________________________
Profa. Dra. Marianna Vieira Sobral Castello Branco
AGRADECIMENTOS
À Profa. Dra Edeltrudes de Oliveira Lima pela orientação, convívio agradável e pelo aprendizado imenso que tive ao longo deste trabalho;
Aos docentes do Programa de Pós Graduação em Produtos Naturais e Sintéticos Bioativos por todo auxílio e ensinamentos;
Aos docentes, técnicos e pesquisadores do Laboratório de Micologia do Departamento de Ciências Farmacêuticas pelo apoio e presteza.
Aos familiares, em especial a minha esposa (Gisely Maria Freire Abílio de Castro) e mãe (Inês Maria Dias de Castro), pelo apoio incondicional na condução e construção de minha vida profissional.
Ao Conselho Nacional de Pesquisa (CNPq) pelo fornecimento da bolsa de doutorado no primeiro ano de estudo.
Aos alunos do curso de graduação em odontologia, especialmente os que integram o Grupo de Pesquisa em Odontopediatria e Clínica Integrada, que compreenderam minha ausência em alguns momentos.
Aos professores do Grupo de Pesquisa em Odontopediatria e Clínica Integrada (GPOCI) pelo apoio e parceria.
Aos integrantes do Grupo de Estudos Culturais Transdisciplinares em Educação e Saúde (GETES), em especial a Ana Elvira Steinbach Silva Raposo e Eduardo Antônio de Pontes Costa, pelo apoio, amizade e incentivo.
CASTRO, R. D. Atividade atifúngica do óleo essencial de Cinnamomum zeylanicum Blume (Canela) e de sua associação com antifúngicos sintéticos
sobre espécies de Candida. 2010. 168f. Tese (Doutorado em Produtos Naturais
e Sintéticos Bioativos – Área de Concentração: Farmacologia) – UFPB/CCS, João Pessoa.
RESUMO
Objetivou-se investigar a ação antifúngica do óleo essencial (OE) de Cinnamomum zeylanicum Blume isolado e associado a antifúngicos sintéticos sobre espécies de Candida. Para tanto, foi determinada a Concentração Inibitória Mínima (CIM), a Concentração Fungicida Mínima (CFM), índice de Concentração Inibitória Fracionada (ICIF), a Curva de Morte Microbiana promovida pelo OE isolado e associado a antifúngicos sintéticos, a ação sobre a parede celular fúngica e a interferência dessa associação sobre a micromorfologia fúngica. Quando avaliados isolados, C. zeylanicum e nistatina apresentaram CIM de, respectivamente, 312,5 µg/mL e 64 µg/mL. Após associação dos produtos avaliados, foi observada diminuição nos valores de CIM para ambas as substâncias, sendo encontrados valores de, respectivamente, 39 µg/mL e 32 µg/mL para o OE e nistatina, sendo verificado o valor do ICIF de 0,6024 (aditividade). Foi observado que em todas as concentrações avaliadas, os produtos isolados e associados foram capazes de reduzir significativamente o número de UFC/mL, quando comparados ao grupo controle a partir de 30 min. Também foi observada redução no desenvolvimento das estruturas morfológicas das células de C. albicans, como pseudo-hifas, bastoconídios e clamidoconídios. Quando associado ao miconazol, foi observado ICIF de, respectivamente, 4,1248 (antagonismo), 1,1248 (indiferença) e 1,1248 (indiferença), para C. albicans, C. tropicalis e C. krusei. Assim, verifica-se que C. zeylanicum exibiu ação sobre cepas de Candida, que essa atividade antifúngica apresentada pelo C. zeylanicum ocorre, provavelmente, por ação do óleo essencial no processo de síntese da parede celular fúngica, que associação do OE de C. zeylanicum e nistatina promoveu potencialização do efeito inibitório sobre o crescimento das cepas de C. albicans, promovendo redução na capacidade de desenvolvimento de estruturas morfológicas das células. Todavia, a associação do óleo essencial de C. zeylanicum ao miconazol não constitui em uma possibilidade vantajosa para inibição de crescimento de Candida spp.
CASTRO, R. D. Antifungal activity of the essential oil of Cinnamomum zeylanicum Blume (cinnamon) and its combination with synthetic antifungals
on Candida species. 2010. 168p. Thesis (PhD in Bioactive Synthetic and Natural
Products - Concentration Area: Pharmacology) - UFPB / CCS, Joao Pessoa.
ABSTRACT
This study aimed to investigate the antifungal activity of essential oil (EO) of Cinnamomum zeylanicum Blume alone and combined with synthetic antifungal agents against Candida species. For this, it was determined the Minimum Inhibitory Concentration (MIC); Minimum Fungicidal Concentration (MFC); Fractional Inhibitory Concentration Index (FICI); microbial death curve promoted by the EO alone and combined with synthetic antifungals; action on fungal cell wall and interference of this combination on the fungal micromorphology. When assessed alone, C. zeylanicum and nystatin showed MIC of 312.5 µg/mL and 64 µg/mL, respectively. After combination, there was a reduction in MIC values for both substances, and were found values of respectively 39 µg/mL and 32 µg/mL for the EO and for Nystatin. It was verified a FICI value of 0.6024 (additivity). At all concentrations tested, these products alone and combined were able to reduce the number of CFU/mL, when compared with the control group from 30 min. It was also observed a reduction in the development of morphological structures of C. albicans cells, like pseudohyphae, blastoconidia and chlamydoconidia. When combined with miconazole, FICI values were 4.1248 (antagonism), 1.1248 (indifference) and 1.1248 (indifference), respectively, for C. albicans, C. tropicalis and C. krusei. Thus, it can be concluded that: C. zeylanicum showed activity against the Candida strains; this antifungal activity occurs, probably, by action of the essential oil in the process of fungal cell wall synthesis; the combination between C. zeylanicum EO and nystatin potentiated the inhibitory effect on growth of C. albicans strains, promoting a reduction in the development capacity of cellular morphologic structures. Nevertheless, the combination of C. zeylanicum EO and miconazole is not an advantageous possibility for growth inhibition of Candida spp.
LISTA DE ABREVIATURAS E SIGLAS
µg – Micrograma
AIDS – Síndrome da imunodeficiência adquirida AMPC – Adenosina monofosfato cíclico
ASD – Agar Sabouraud Dextrose
ATCC – American Type Culture Collection CCS – Centro de Ciências da Saúde CDR – Cadmium-inducible
CFM – Concetração Fungicida Mínima CIM – Concentração Initória Mínima cm – Centrímetro
FIC – Concentração Inibitória Fracionada g – Grama
h – Hora
HIV – Vírus da imunodeficiência humana IgA-S – Imunoglobulina A secretora IL-1 α – Interleucina 1 alfa
IL-2 α – Interleucina 2 alfa m – Metro
M – Molar
MAPK – Proteína cinase ativada por mitógeno. mg – Miligrama
OE – Óleo essencial
PNPMF – Política Nacional de Plantas Medicinais e Fitoterápicos RR – Risco relativo
LISTA DE FIGURAS
Figura 1 - Elementos moleculares presentes em mecanismos de transdução de sinal envolvidos com a formação de fatores de virulência em C. albicans . 21 Figura 2 - Estrutura química da nistatina ... 25 Figura 3 - Estrutura química do miconazol ... 28 Figura 4 - Esquema para realização do ensaio de sinergismo pela técnica de checkerboard. ...
48
Screening da atividade antifúngica de óleos essenciais sobre cepas Candida
Figura 1 - Atividade antifúngica dos óleos essenciais sobre C. albicans ICB-12 (A) e C. tropicalis LM-708 (B). 1 - Matricaria chamomilla; 2 - Eugenia uniflora; 3 - Cinnamomum zeylanicum; 4 - Citrus aurantifolia; 5 - Mentha piperita; 6 - Citrus reticulata; 7 - Zingiber officinale ...
61
Combined effect of Cinnamomum zeylanicum Blume essential oil and
nystatin on strains of Candida spp.
Figure 1 - Growth kinetics of strains of C. albicans ATCC 40277 under activity of the products assessed at MIC÷2 (p<0.0001). ……….
97
Figure 2 - Growth kinetics of strains of C. albicans ATCC 40277 under activity of the products assessed at MIC (p<0.0001). ……….
97 Figure 3 - Growth kinetics of strains of C. albicans ATCC 40277 under activity of the products assessed at MICx2 (p<0.0001). ……….
98 Figure 4 - Growth kinetics of strains of C. albicans ATCC 40277 under activity of the products assessed at MICx4 (p<0.0001). ……….
98 Figure 5 - Growth kinetics of strains of C. albicans ATCC 40277 under activity of the products assessed at MICx8 (p<0.0001). ……….
99 Effect of Cinnamomum zeylanicum Blume (Lauraceae) essential oil
alone and combined with nystatin on micromorphology of Candida albicans strains.
Figure 11 - Microscopic appearance of C. albicans strain (ATCC 40277): A - growth control; B - C. activity of C. zeylanicum EO (39 µg/mL) combined with nystatin (32 µg/ml); C - activity of nystatin (64 µg/ml); D - activity of C. zeylanicum EO (312.5 µg/mL).
...
LISTA DE TABELAS
Screening da atividade antifúngica de óleos essenciais sobre cepas de
Candida.
Tabela 1 - Medida em milímetro dos halos de inibição de crescimento
microbiano produzidos pelos óleos essenciais sobre cepas de Candida. ...
60 Tabela 2 - Concentração Inibitória Mínima do Óleo essencial de C. zeylanicum
e Nistatina sobre cepas de Candida. ...
61 Anti-Candida activity and chemical composition of Cinnamomum zeylanicum Blume essential oil.
Table 1 - Minimum Inhibitory Concentration (MIC) and Minimal Fungicidal Concentration (MFC) of C. zeylanicum essential oil, nystatin and miconazole on
Candida strains……….
84
Table 2 - Action of the essential oil of C. zeylanicum on the fungal cell
wall………
85 Table 3 - Chemical characterization of C. zeylanicum leaf essential oil. …... 86 Combined effect of Cinnamomum zeylanicum Blume essential oil and
nystatin on strains of Candida spp.
Table 1 - Minimum Inhibitory Concentration (MIC) of C. zeylanicum essential oil and Nystatin on strains of C. albicans ATCC 40277. ………...
96 Table 2 - Fractional Concentration Index (FIC) and Minimum Inhibitory
Concentration (MIC) (µg/mL) after combination of C. zeylanicum essential oil with Nystatin on the strain of C. albicans ATCC 40277. ..………
96
Combined effect of Cinnamomum zeylanicum Blume essential oil and
nystatin on strains of non-albicans Candida.
Table 1 - Minimum Inhibitory Concentration (MIC) of C. zeylanicum essential oil and Nystatin on strains of C. tropicalis ATCC 40042 and C. krusei ATCC
40147……….
123
Table 2 - Fractional Inhibitory Concentration Index (FIC) after combination between C. zeylanicum essential oil and Nystatin on C. tropicalis strain ATCC 40042. ……….
125
Table 3 - Fractional Inhibitory Concentration Index (FIC) after combination between C. zeylanicum essential oil and Nystatin on C. krusei strain ATCC
40147. ……….
Combined effect of Cinnamomum zeylanicum Blume essential oil and
miconazole on Candida strains.
Table 1 - Minimum Inhibitory Concentration (MIC) of C. zeylanicum essential oil and miconazole on Candida strains…………...
138 Table 2 - Fractional Inhibitory Concentration index (FIC) and MIC (µg/mL) after
combination between C. zeylanicum essential oil and miconazole against strains of C. albicans ATCC 40277, C. tropicalis ATCC 40042 and C. krusei ATCC 40147………..…
LISTA DE QUADROS
Quadro 1 - Óleos essenciais utilizados no ensaio para determinação da atividade anti-Candida. ...
43 Effect of Cinnamomum zeylanicum Blume (Lauraceae) essential oil
alone and combined with nystatin on micromorphology of Candida albicans strains.
Quadro 2 – Micromorphology changes promoted by the products under testo on C. albicans ATCC. 40277. ...
SUMÁRIO
1 INTRODUÇÃO ... 15
2 OBJETIVOS ... 18
2.1 Geral ... 18
2.2 Específicos ... 18
3 REVISÃO DA LITERATURA ... 20
3.1 Candidíase ... 20
3.2 Terapia antifúngica ... 23
3.3 Limitação dos antifúngicos sintéticos ... 28
3.4 Produtos naturais ... 30
3.5 Cinnamomum zeylanicum ... 34
3.6 Associação de drogas antifúngicas ... 38
4 MATERIAL E MÉTODOS ... 42
4.1 Local de realização de pesquisa e cepas fúngicas ... 42
4.2 Óleos essenciais ... 42
4.3 Produtos sintéticos ... 43
4.4 Screening para avaliação da atividade antifúngica ... 43
4.5 Determinação da Concentração Inibitória Mínima (CIM) ... 43
4.6 Deterteminação da Concentração Fungicida Mínima (CFM) ... 44
4.7 Ensaio de sinergismo – método checkerboard ... 44
4.8 Estudo do efeito do óleo essencial isolado e associado à nistatina sobre a cinética do crescimento das leveduras ... 46 4.9 Estudo do efeito do óleo essencial isolado e associado à nistatina sobre a micromorfologia de cepas de C. albicans ... 46 5 RESULTADOS E DISCUSSÃO ... 49 5.1 Screening da atividade antifúngica de óleos essenciais sobre cepas de
Candida...
15
5.2 Anti-Candida activity and chemical composition of Cinnamomum zeylanicum Blume essential oil. ……….…….
65 5.3 Combined effect of Cinnamomum zeylanicum Blume essential oil and nystatin
on Candida spp. ………..…
85 5.4 Efeito do óleo essencial de Cinnamomum zeylanicum Blume sozinho e associado
nistatina sobre a micromorfologia de cepas de Candida albicans.
...
100
5.5 Efeito combinado da ação do óleo essencial de Cinnamomum zeylanicum Blume e nistatina sobre cepas de Candida não-albicans.
...
115
5.6 Efeito combinado do óleo essencial de Cinnamomum zeylanicum Blume e miconazol sobre cepas de Candida. ...
1 INTRODUÇÃO
Espécies de Candida têm sido associadas às infecções micóticas superficiais e sistêmicas, podendo ser isoladas em até 60% da cavidade oral de adultos, estando Candida albicans e C. tropicalis entre as mais prevalentes (MARSH; MARTIN, 2005). Tais espécies apresentam fatores de virulência envolvidos com a formação de biofilmes, sendo os fatores ambientais (saliva, fluido gengival, pH e nutrientes) favoráveis aos processos de co-agregação e co-adesão entre Candida e outros microrganismos, incluindo as bactérias envolvidas com as principais patologias da cavidade oral, cárie dentária e doenças periodontais (THEIN; SAMARANAYAKE; SAMARANAYAKE, 2006). Destaca-se que essa habilidade para formação de biofilme está intimamente associada com a capacidade de causar infecções, representando um aumento na resistência às drogas antifúngicas e às defesas imunológicas do hospedeiro (HERIQUES; AZEREDO; OLIVEIRA, 2004; RAMAGE et al., 2005).
Mecanismos moleculares envolvidos com a patogenicidade de espécies de Candida são elucidados na perspectiva da elaboração de fármacos que apresentem maior especificidade e, consequentemente, menos efeitos indesejáveis (OROZCO; ZHOU; FILLER, 2000; MONGE et al., 2006; MÜLLER et al., 2007). Estes mecanismos estão relacionados à ativação da via de transdução de sinal MAP (mitogen-activated protein) Kinase, onde respostas celulares envolvidas com crescimento invasivo, formação de parede celular, adaptação ao estresse osmótico e reprodução ocorrem mediante vias de sinalização intracelular (MONGE et al., 2006).
Atualmente, os agentes disponíveis para tratamento de infecções fúngicas da cavidade oral, caracterizadas como superficiais, são representados pelos poliênicos (anfotericina B, nistatina, entre outros) e azólicos (fluconazol, itraconazol, miconazol, cetoconazol, entre outros), sendo estes últimos os eleitos em primeira instância para tratamento dessas doenças e são geralmente fungistáticos (WINGETER et al., 2007).
pelas reações indesejadas apresentadas pelos usuários, novos agentes são propostos na tentativa de minimizar tais eventos. A resistência dos microrganismos vem aumentando em função do uso indiscriminado de antimicrobianos utilizados no tratamento de doenças infecciosas. Essa situação tem impulsionado investigadores a estudarem novas substâncias antimicrobianas de várias fontes, incluindo as plantas medicinais (BANSOD; RAI, 2008).
A atividade antifúngica de produtos obtidos de plantas medicinais têm sido cientificamente atribuída aos óleos essenciais, extratos, cumarinas, terpenos, flavonóides, amidas, imidas e alcalóides (AQUINO et al., 2003; GAYOSO et al., 2005; MOREIRA et al., 2007).
Nesse sentido, considerando a ampla atividade biológica apresentada pelos produtos de origem natural, óleos essenciais obtidos a partir de espécies vegetais têm sido investigados para determinação de suas atividades antimicrobiana (WILSON; SOLAR; GHAOUTH, 1997; SRINIVASAN et al., 2001; BONJAR; AGHIGHI; KARIMI, 2004; KONNING; AGYARE; ENNISON, 2004; GIORDANI et al., 2006; LIMA et al., 2006; BANSOD; RAI, 2008; JANTAN et al., 2008; VIUDAS-MARTOS, 2008).
2 OBJETIVOS 2.1 Geral
Determinar a atividade antifúngica do óleo essencial obtido a partir das folhas de C. zeylanicum isolado e associado a antifúngicos sintéticos sobre Candida spp.
2.2 Específicos
Realizar screening com óleos essenciais para determinação da atividade antifúngica sobre cepas de Candida;
Determinar a Concentração Inibitória Mínima (CIM) e Concentração Fungicida Mínima (CFM) do óleo essencial obtido de C. zeylanicum sobre cepas de Candida;
Determinar a Concentração Inibitória Mínima (CIM) e Concentração Fungicida Mínima (CFM) do óleo essencial de C. zeylanicum associado a antifúngicos sintéticos sobre cepas de Candida;
Determinar o Índice de Concentração Inibitória Fracionada (método de associação – checkerboard) do óleo essencial de C. zeylanicum associado com os antifúngicos sintéticos;
Determinar a curva de morte microbiana promovida pelo óleo essencial de C. zeylanicum isolado e associado a antifúngicos sintéticos;
Analisar a ação do óleo essencial de C. zeylanicum sobre a parede celular fúngica;
3 REVISÃO DA LITERATURA 3.1 Candidíase
A candidíase é uma infecção fúngica ocasionada pela presença de leveduras do gênero Candida, que faz parte da família Cryptococcaceae, sendo reconhecidas cerca de 81 espécies, destacando-se a C. albicans pela sua virulência e potencial para promover doenças.
C. albicans é um patógeno oportunista que habita o corpo humano de forma comensal e é a maior causa de infecções fúngicas em humanos. Estas infecções normalmente ocorrem como consequência de uma alteração na resposta imunológica e virulência da C. albicans, que apresenta considerável plasticidade morfológica (MONGE et al., 2006).
Os mecanismos moleculares envolvidos com tal virulência estão relacionados à ativação da via de transdução de sinal MAP (mitogen-activated protein) Kinase, onde respostas celulares envolvidas com crescimento invasivo, formação de parede celular, adaptação ao estresse osmótico e reprodução ocorrem mediante vias de sinalização intracelular como MKc1, Cek1/2 e HOG1 MAP Kinase (MONGE et al., 2006).
Figura 1. Elementos moleculares presentes em mecanismos de transdução de sinal envolvidos com a formação de fatores de virulência em C. albicans (MONGE et al., 2006).
virulência para ocorrência de infecções sistêmicas, e do CLA4, responsável pela formação do tubo germinativo e hifas. A via de ativação PKA proporciona a formação de AMPc, que regula o fator Efg1, responsável pela formação de hifas (PHAN; BELANGER; FILLER, 2000).
Ressalta-se que outras vias de sinalização intracelular, como a p38 MAPK, também estão envolvidas com a patogenicidade da C. albicans (MULLER et al., 2007). Um vez instalada a infecção, mediadores pró-inflamatórios, como TNF-α, IL-1α e IL-2α, são sintetizados e, conseqüentemente, induzem a resposta inflamatória (OROZCO; ZHOU; FILLER, 2000).
A produção de enzimas extracelulares, como fosfolipases e proteinases, contribui para a virulência da C. albicans, já que são capazes de promover destruição dos tecidos do hospedeiro. Menezes et al. (2005) verificaram que 67% e 80% das cepas de Candida isoladas da cavidade bucal de crianças foram positivas para, respectivamente, fosfolipases e proteinases.
Assim como apresentado na Fig. 1, as vias de sinalização intracelular podem sofrer interferências, proporcionando às células de C. albicans maior complexidade na expressão dos seus fatores de virulência (MONGE et al., 2006). O conhecimento acerca desses mecanismos pode contribuir para a descoberta de novos agentes anti-Candida.
Pacientes com candidíase recorrente apresentam uma baixa resposta imune celular para antígenos de C. albicans. Este fato contribui para o entendimento acerca da patogênese da cadidíase recorrente, abrindo perspectivas para a utilização de agentes imunomoduladores com a finalidade de restaurar a resposta imune destes pacientes (CARVALHO et al., 2003).
Clinicamente, a doença pode surgir como manifestações em mucosas até quadros sistêmicos, com a invasão de diversos órgãos. As mucosas oral, vaginal e esofágica são as mais acometidas em quadros de candidíases (SIDRIM; MOREIRA, 1999).
As infecções sistêmicas, ocasionados pela disseminação hematológica, podem causar microabscessos por todo corpo. Para disseminação das células de C. albicans, o endotélio vascular participa ativamente do processo, havendo interação entre receptores presentes nas células endoteliais e adesinas expressas pelas leveduras (FILLER et al., 1995; MULLER et al., 2007).
Com relação às infecções superficiais, especialmente as que acometem a cavidade bucal, objeto de interesse deste estudo, sabe-se que a mucosa dessa região é o sítio mais frequente de candidíase superficial, e a colonização por C. albicans ocorre em 10 a 50% dos indivíduos sadios. De forma geral, essa colonização é controlada por antagonismo competitivo da microbiota comensal, por competições nutritivas e pela produção de substâncias tóxicas que podem também interferir no mecanismo de aderência dessas leveduras às células epiteliais. A produção de ácido lático por essas células ou a manutenção do pH salivar também são fatores limitantes da colonização dessas leveduras (LORENZO, 2004).
desse contexto, a pesquisa de novos agentes terapêuticos torna-se uma medida de extrema importância.
A candidíase orofaríngea apresenta manifestações clínicas distintas, que proporcionaram a seguinte classificação: a) pseudomembranosa (caracterizada pela presença de placas brancas, facilmente destacáveis, que recobrem áreas eritematosas da mucosa); b) eritematosa (presença de eritema de mucosa e/ou atrofia de papilas do dorso da língua); c) hiperplásica (placas brancas que são removidas apenas por leve abrasão); estomatite induzida por dentadura (consiste em eritema granular confinado à área de palato duro recoberto pela dentadura e muitas vezes associado à queilite angular. Essa estomatite está presente em 65% dos portadores de dentaduras).
Essas lesões podem ser assintomáticas ou produzir dor, sensação de queimação na língua, alteração do gosto, impedimento de fala e deglutição e pertubação da qualidade de vida (WANNMACHER; FERREIRA, 2007).
Dentre os microrganismos evolvidos com infecções fúngicas superficiais da mucosa bucal, C. albicans representa o mais frequente. Entretanto, outras espécies contribuem para o desenvolvimento da doença, como Candida tropicalis e Candida krusei.
3.2 Terapia antifúngica
A abordagem medicamentosa para tratamento da candidíase inclui agentes antifúngicos tópicos e sistêmicos (WANNMACHER; FERREIRA, 2007). As três principais classes de antifúngicos usados, atualmente, no tratamento da candidíase são os polienos (como nistatina e anfotericina B), os imidazóis (como clotrimazol e miconazol) e os triazóis (como o fluconazol e itraconazol) (PAIVA et al., 2009).
apresente resultados, é iniciado o tratamento sistêmico, sendo o fluconazol a droga mais prescrita (PAIVA et al., 2009).
A nistatina é um antifúngico extraído de culturas de Streptomyces, foi descoberta em 1950 e é utilizada há mais de 50 anos na terapêutica. Seu uso é fortemente influenciado pelo aumento do número de indivíduos imunocomprometidos (casos de candidíase em pacientes com neoplasias, AIDS e outros problemas sistêmicos) (TAVARES, 2001; SHIP; VISSINK; CHALLACOMBE, 2007).
Ela pertence ao grupo dos polienos, classe de substância que se caracteriza pela presença de átomos de carbono com dupla ligação, e mais especificamente, aos grupos dos tetraenos, que são polienos com quadro duplas ligações não saturadas em sequência. Devido a presença de grupos carboxílicos e amino, que se encontram carregados em pH fisiológico, a nistatina é considerada uma molécula anfotérica (CROY; KNOW, 2004; KATZUNG, 2006).
Figura 2. Estrutura química da nistatina (Fonte: SILVA et al., 2003)
No que se refere ao mecanismo de ação, de forma geral, os antifúngicos imidazólicos e nistatina bloqueiam a síntese do ergosterol, promovendo defeitos na membrana celular e alterando padrões de permeabilidade, o que proporciona a morte da célula (WANNMACHER; FERREIRA, 2007).
magnésio e fosfato, além de perdas de açúcares, ésteres de fosfato e nucleotídeos (TAVARES, 2001; CROY; KNOW, 2004; SILVA et al., 2006).
A nistatina também se liga, em menor proporção, ao colesterol presente na membrana plasmática, promovendo efeitos tóxicos nas células. Por este fato, ela não é administrada por via parenteral, já que é capaz de promover hemólise, necrose e abscesso no local da injeção, devido sua ligação à membrana plasmática das hemácias (TAVARES, 2001; CROY; KNOW, 2004; KATZUNG, 2006; SILVA et al., 2006).
Devido a este fato, a nistatina é empregada para uso tópico, mesmo quando utilizada por via oral, buscando-se um efeito superficial na mucosa oral ou disgestiva (FARAH; ASHMAN; CHALLACOMBE, 2000; TAVARES, 2001; KATZUNG, 2006).
No tratamento da candidíase orofaríngea, a nistatina se apresenta na forma de suspensão oral contendo 100.000 UI da droga em cada mL, e deve ser administrada 3 a 4 vezes ao dia. O paciente deve bochechar o medicamento por alguns minutos e em seguida deglutí-lo (GILMAN; HARDMAN; LIMBIRD, 2003).
Bergendal e Isacsson (1980) avaliaram o efeito da nistatina no tratamento de 48 pacientes com candidíase, que fizeram uso de nistatina três vezes ao dia durante 14 dias. Os pacientes foram examinados em três ocasiões distintas, a primeira no início do experimento, a segunda 14 dias após o início do tratamento e no 28º dia após a suspensão do tratamento. Os resultados apresentados demonstraram a redução dos aspectos clínicos de inflamação após os 14 dias de tratamento, porém no 28º dia notou-se a recorrência dos sinais de inflamação iguais aos encontrados anteriormente ao tratamento.
concluíram que não houve diferença nos resultados dos tratamentos com os dois fármacos, porém a aceitação do fluconazol pelos pacientes foi melhor.
A nistatina tem sido proposta para o tratamento e profilaxia de infecções fúngicas invasivas em pacientes imunodeprimidos. Em revisão sistemática, onde foram incluídos 12 estudos (total de 1464 pacientes) que realizaram experimentos clínicos randomizados que compararam a nistatina com o fluconazol, anfotericina B e grupo controle não tratado (placebo), os autores verificaram que o efeito da nistatina na colonização fúngica foi similar àquele observado para o controle (RR=0,65), não houve diferença estatística significante entre nistatina e fluconazol sobre a mortalidade dos pacientes e que o fluconazol foi mais eficaz em impedir a infecção fúngica sistêmica (RR=0,37). A partir dos dados observados o estudo indica que a nistatina não deve ser recomendada para tratamento e profilaxia de infecções fúgicas em pacientes imunocomprometidos (GOTZSCHE; JOHANSEN, 2002).
Em outra revisão sistemática onde foram incluídos 12 ensaios clínicos controlados e randomizados envolvendo 1606 pacientes, foi verificado que para profilaxia de infecções fúngicas sistêmicas em pacientes susceptíveis o fluconazol deve ser prescrito (PLAYFORD et al., 2006).
Ainda na perspectiva da profilaxia de infecções fúngicas, uma revisão sistemática que avaliou o efeito da nistatina e miconazol (agentes tópicos) na prevenção de infecções fúngicas sistêmicas em recém-nascidos de baixo peso identificou apenas 3 estudos clínicos, que apresentaram várias limitações metodológicas, como ausência de randomização, falta de critérios para alocamento da amostra, ausência de cegueira na intervenção e avaliação dos resultados. Diante disso, os autores indicam que existe uma redução no risco de desenvolvimento de infecções fúngicas sistêmicas nos recém-nascidos tratados com antifúngicos tópicos. Entretanto, os resultados devem ser analisados de forma cautelosa, considerando as limitações metodológicas identificadas nos estudos avaliados (AUSTIN; DARLOW; MCGUIRE, 2009).
HIV-positivos com a utilização da nistatina, clotrimazol, fluconazol, cetoconazol e itraconazol (PATTON; BONITO; SHUGARS, 2001).
O miconazol também é utilizado para tratamento das infecções fúngicas superficiais. Sua atividade contra fungos, incluído Candida spp., é comparável aos efeitos promovidos pela nistatina (SAWYER et al., 1975).
Figura 3. Estrutura química do miconazol (Fonte: KATZUNG, 2006).
Cardozo et al. (2001) avaliaram a eficácia clínica do miconazol na forma de gel (Daktarin®) no tratamento de estomatite protética induzida por Candida em 10 pacientes, que fizeram uso do medicamento quadro vezes ao dia, durante 21 dias. O estudo indicou que miconazol na forma de gel promove efetiva redução em todos os casos de infecção fúngica, quando comparada ao grupo controle, formado por pacientes que não fizeram uso de nenhum medicamento.
Um estudo clínico controlado randomizado (n=180 pacientes) que teve como objetivo comparar o cetoconazol sistêmico (400 mg/dia) ao miconazol mucoadesivo de liberação lenta (10 mg, 1 vez ao dia), foi verificado que em 7 dias a resposta clínica dos dois medicamentos foi semelhante. Entretanto, associou-se maior ocorrência de reações adversas ao cetoconazol de utilização sistêmica (VAN ROEV et al., 2004).
a radioterapia para tratamento do câncer, os autores verificaram que ambos medicamentos são capazes de tratar a infecção (p<0,0001) (BENSADOUN et al., 2008).
Como dito anteriormente, a colonização fúngica, especialmente por C. albicans, em pacientes em mucosa oral de usuários de próteses dentárias, verifica-se com frequência a infecção, conhecida como estomatite protética. Para combater tal infecção é proposta, além dos antifúngicos de uso superficial (nistatina e miconazol) aqui descritos, a utilização de outros agentes químicos, como hipoclorito de sódio e ácido acético, que são utilizados para emergir as peças protéticas com a finalidade de desinfecção das mesmas (WEBB; THOMAS; WHITTLE, 2005; AZUMA et al., 2006; ANDRADE, 2008).
3.3 Limitações dos antifúngicos sintéticos
A resistência fúngica aos agentes terapeuticamente disponíveis vem aumentando como consequência do crescimento da população imunocomprometida e do uso cada vez mais frequente de profilaxia e auto-medicação (WANNMACHER; FERREIRA, 2007). A diminuição da susceptibilidade de espécies de C. albicans e não-albicans foi inicialmente relatada em 1970 em pacientes com candidíase mucocutânea crônica com repetidos e prolongados tratamentos (RAUTEMAA et al., 2007).
O diagnóstico tardio e o relativo número reduzido de classes de antifúngicos terapeuticamente disponíveis favorecem a mortalidade, que é atribuída às infecções sistêmicas. Aliado a isso, a resistência fúngica aos agentes disponíveis torna-se um problema para alguns grupos de pacientes, especialmente os imunocomprometidos (CANNON et al., 2009).
et al. 1986). Em estudo que avaliou 168 amostras clínicas de candidíase oral crônica foi verificado que 31,4% apresentaram-se resistente ao fluconazol (CIM de 19,5 mg/mL) (RAUTEMAA et al., 2007).
Smith et al. (1986) apontam que o estudo da resistência das espécies de Candida frente aos antifúngicos disponíveis deve levar em consideração: condições clínicas dos pacientes (imunossupressão, possibilidade de interação medicamentosa, presença de abscessos e cateteres); terapia antifúngica (droga, dose, duração, via de administração); análise micológica antes e após o tratamento e o método utilizado para diagnóstico.
Outro fator que pode contribuir para o desenvolvimento de resistência fúngica é a necessidade de uso prolongado dos agentes antifúngicos. Em estudo que avaliou a terapia antifúngica para tratamento de candidíase orofaríngea em 61 pacientes imunocomprometidos, foi verificado que a duração da terapia com clotrimazol, cetoconazol e fluconazol, variaram de, respectivamente, 3 a 240, 11 a 44 e 7 a 138 dias (FAN-HAVARD et al., 1991).
Segundo Andes et al. (2006), doses administradas frequentemente tendem a impedir a seleção de células resistentes aos antifúngicos. Em contrapartida, regimes posológicos prolongados parecem contribuir para o desenvolvimento de resistência.
(LÖFFLER; EINSELE; HEBERT, 2000). Ressalta-se que estes mecanismos podem ocorrer simultaneamente, contribuindo para ampliar o fenômeno de resistência.
Segundo Sanglard et al., (1995), a superexpressão do gene BENr, que codifica a bomba de efluxo, está intimamente relacionada ao mecanismo de resistência aos agentes antifúngicos azóis apresentado pela C. albicans isoladas de pacientes com HIV/AIDS.
Para Martel et al., (2010), isolados clínicos de C. albicans podem apresentar resistência aos azóis (fluconazol, itraconazol, voriconazol, cetoconazol e clotrimazol) e anfotericina B devido mutação dos genes ERG11 e ERG5, mesmo na presença de inibição de bombas de efluxo. O estudo mostra que esses genes também estão envolvidos na produção do ergosterol, alvo para as drogas estudadas. Dunkel et al. (2008) relatam que a expressão do ERG11 e outros genes envolvidos com a biossíntese do ergosterol depende da superexpressão do fator de transcrição UPC2P.
Segundo Pozzati et al., (2008), os mecanismos de resistência de Candida spp. aos azóis podem ser explicados resumidamente da seguinte forma: o gene EGR11 codifica a enzima alvo para ação do fármaco, lanosterol 14α-demetilase. Assim, quando esse gene sofre mutação, a enzima alvo passa a não ser reconhecida pelos azóis. Além disso, em células resistentes observa-se um aumento expressivo na expressão dos genes CDR e MDR que codificam bombas de efluxo. Mutações em genes que codificam outras enzimas envolvidas na via da biossíntese do ergosterol, como o ERG3, podem também contribuir para a resistência.
O conhecimento dos mecanismos genéticos envolvidos com a resistência de cepas de C. albicans fomenta o desenvolvimento de drogas que possam atuar em outros alvos celulares.
3.4 Produtos naturais
apenas 1% dos produtos utilizados ganha reconhecimento científico (KHAN et al., 2009).
Sartorato et al. (2004) destacam que o uso de plantas medicinais é uma prática rotineira nos países em desenvolvimento, especialmente na África, Ásia e América Latina, onde existe uma necessidade de utilização da medicina popular com solução alternativa para problemas de saúde.
Considerando a perspectiva de obtenção de novos fármacos, os produtos naturais se diferenciam dos sintéticos sob o aspecto da diversidade molecular. Sabe-se que a diversidade molecular dos produtos de origem natural é muito superior àquela derivada dos processos de síntese, que, apesar dos avanços consideráveis, é ainda limitada. Isso proporciona a elaboração de diversos novos fármacos com funções terapêuticas diversificadas (NISBET; MOORE, 1997).
No Brasil, país com vasta biodiversidade, experiências atreladas ao conhecimento popular aproximam a utilização de produtos naturais aos recursos terapêuticos disponíveis, sendo, inclusive, esta prática recomendada pelo poder público (ALBUQUERQUE; HANAZAKI, 2006). Em 3 de maio de 2006, o Ministério da Saúde, através da Portaria nº 971, aprovou a Política Nacional de Práticas Integrativas e Complementares (PNPIC) no âmbito do Sistema Único de Saúde (SUS) (BRASIL, 2006).
O documento supracitado apresenta como diretriz o incentivo a formação e a capacitação de recursos humanos para o desenvolvimento de pesquisas, tecnologias e inovação em plantas medicinais e fitoterápicos. Para tanto, reconhece-se a importância do apoio a qualificação técnica dos profissionais da saúde, e demais envolvidos na produção e uso desses produtos (BRASIL, 2007).
Essa política de atuação governamental visa enfrentar os empecilhos para a utilização dos produtos naturais apontados por Oliveira, Oliveira e Diniz (1997), que levantaram a problemática do desconhecimento dos profissionais de saúde sobre as indicações e cuidados no uso de plantas medicinais. Do ponto de vista dos usuários dos serviços de saúde, Ness, Sherman e Pan (1999) retratam que as plantas medicinais são vistas apenas como uma alternativa aos elevados custos dos medicamentos convencionais e não como opção terapêutica devido às suas propriedades curativas das plantas.
Para Borba e Macedo (2006), existe uma clara necessidade de minimizar a distância entre a técnica e pesquisas científicas das tradições e crenças populares, proporcionando uma valorização dos conhecimentos populares, agregando-lhes comprovação científica e, permitindo, assim, divulgação à população em geral de conhecimentos úteis, antes utilizados apenas in loco, valorizando tanto a cultura quanto a ciência de um povo.
A escolha da planta para utilização em estudos que avaliam suas propriedades farmacológicas é feita considerando o uso terapêutico, o estudo etnobotânico, a presença de determinadas substâncias ou de acordo com a sua disponibilidade (MACIEL; PINTO; VIEGA, 2002). A abordagem etnofarmacológica consiste em associar informações obtidas junto as comunidades locais que utilizam a flora medicinal com estudos químicos e farmacológicos desenvolvidos em laboratórios especializados (ELISABETSKY; SOUZA, 2007).
dos serviços odontológicos do serviço público, foi verificado que, na maioria dos casos, as plantas utilizadas são nativas da flora regional, sendo a Punica granatum L. (Romã) a mais citada (SANTOS et al., 2009).
Em outro estudo realizado na cidade de Santa Cruz, Mato Grosso, Brasil, Borba e Maciel (2006) verificaram que, para tratamento e prevenção de afecções bucais, os habitantes locais citaram 87 espécies nativas do bioma nativo, estando a Matricaria chamomilla (camomila), Crocus sativus (açafrão) e Brickelia brasiliensis (arnica-da-serra), entre as lembradas.
Alguns extratos de plantas e metabólitos secundários possuem efeitos inibitórios e letais dose-dependentes sobre diferentes microrganismos (SMITH-PALMER; STEWART; FYFE, 1998). Dentre as substâncias extraídas, tomam destaque os óleos voláteis, que em sua maioria evidencia forte atividade antibacteriana e antifúngica, atribuídas a presença de monoterpenos, que representam cerca de 90% dos compostos presentes (POZZATI, 2007; SIMÕES et al., 2007).
Do ponto de vista das funções biológicas dos óleos essenciais, Harbone (1993) aponta a existência de funções ecológicas, especialmente como inibidores da germinação, na proteção contra predadores, na atração de polinizadores, na proteção contra aumento de temperatura, entre outras. Em relação às atividades farmacológicas, destacam-se a ação carminativa, antiespasmódica, estimulante sobre secreções do aparelho digestivo, ação cardiovascular (aumento do ritmo cardíaco), atividade secretora do epitélio respiratório, ações sobre o SNC (estimulantes ou depressoras), ação anestésica local, antiinflamatória e anti-séptica (SIMÕES et al., 2007).
mecanismos de ação desses compostos e seus constituintes não estão totalmente elucidados. Especula-se que a maioria dos óleos essenciais exerça sua atividade antimicrobiana através de modificações na estrutura da parede celular do microrganismo, aumentando a permeabilidade da membrana citoplasmática, promovendo a deterioração de processos essenciais à sobrevivência da célula. Sugere-se também que o rompimento da parede celular deva-se ao caráter lipofílico (presença de monoterpenos) dos óleos essenciais, que se acumulam nas membranas (COWAN, 1999; DORMAN; DEANS, 2000; LAMBERT et al., 2001). Pozzatti (2007) refere-se, ainda, que a ação antimicrobiana dessas substâncias pode ocorre devido à inativação de algumas enzimas, incluindo as envolvidas na produção de energia e síntese de componentes estruturais.
Diante do exposto, evidencia-se que novas pesquisas para avaliar a atividade antifúngica de óleos essenciais apresentam perspectivas positivas, representando possibilidades de obtenção de novos fármacos que sejam utilizados no tratamento contra agentes infecciosos ou outras doenças.
3. 5 Cinnamomum zeylanicum
Cinnamomum zeylanicum, conhecida popularmente como canela, é uma planta que pertence a família Lauraceae. Trata-se de uma árvore que apresenta aproximadamente 10-15 m de altura, tem folhas com formato oval-longo e flores que florescem em pequenos maços, com cor esverdeada e odor característico.
A família Lauraceae pertence à divisão Magnoliophyta, sendo considerada uma das famílias mais antigas. As Lauraceae apresentam-se amplamente distribuídas nas regiões tropicais e subtropicais do planeta, sendo formadas por 49 gêneros e 2500 a 3000 espécies.
O gênero Cinnamomum contém cerca de 250 espécies, que se caracterizam por serem arbustos e árvores de pequeno a médio porte. As espécies são encontradas em florestas tropicais onde crescem em montanhas e planícies em solos bem drenados. Nas latitudes com circunstâncias climáticas sazonais, tornam-se excessivamente raras (JANTAM et al., 2003; JANTAN et al. 2008).
Esse gênero ocorre principalmente no sudeste e na Ásia oriental, especialmente na Malásia. C. zeylanicum, C. loureirri, C. burmanni e C. cassia são as espécies mais estudadas e utilizadas pela população. O óleo essencial obtido das cascas é utilizado como condimento alimentar, na perfumaria e em preparações farmacêuticas. O óleo da folha do C. zeylanicum apresenta expressiva quantidade de eugenol (REYNOLDS, 1993).
Marques (2001) destaca que as Lauraceae, incluindo C. zeylanicum, apresentam, na medicina popular, diferentes funções contra diversas doenças e que o óleo essencial, armazenado em células secretoras encontradas na folha e caule, representa um dos principais produtos responsáveis pelas atividades farmacológicas. Na Europa, o óleo essencial obtido da casca dessa planta vem sendo utilizado no controle da glicemia em pacientes portadores de diabetes tipo II (MEADES et al., 2010).
Em relação a estas atividades, as propriedades antimicrobianas, incluindo a antifúngica, do óleo essencial obtido do C. zeylanicum vêm sendo amplamente estudadas por diversos pesquisadores (LIMA et al.,1993; BELÉM, 2002; BONJAR; AGHIGHI; KARIMI, 2004; MOREIRA, et al., 2007; ATAYDE et al., 2008; BANSOD; RAI, 2008; JANTAM et al., 2008; KAHN et al., 2009; PUANGPRONPITAG; SITTIWET, 2009).
De forma semelhante, Pozzatti (2007) avaliou in vitro a atividade antifúngica do óleo essencial de C. zeylanicum sobre isolados de Candida comprovadamente susceptíveis e resistentes ao fluconazol. A autora verificou que o produto testado apresentou CIM e Concentração Fungicida Mínima (CFM) que variaram entre 200 a 1600 e 800 a 1600 µg/mL, respectivamente.
Carmo et al (2008) verificaram a interferência do óleo essencial C. zeylanicum sobre o crescimento e morfogênese de algumas espécies de Aspergillus potencialmente patogênicas. O produto testado apresentou potente efeito antifúngico demonstrado pela visualização de grandes zonas de inibição de crescimento de todas as linhagens testadas. Os valores de CIM50 e de CIM90 foram 40 e 80 µL/mL, respectivamente. Nas concentrações de 80, 40 e 20 µL/mL o óleo demonstrou um significativo efeito fumigante, inibindo o crescimento micelial radial de A. niger, A. flavus e A. fumigatus ao longo de 14 dias de exposição. A 80 e 40 µL/mL o óleo essencial promoveu inibição de 100% da germinação de esporos, das três espécies de Aspergillus.
Além do óleo essencial do C. zeylanicum, extratos obtidos dessa espécie vegetal podem apresentar expressiva atividade antifúngica. Mishra et al. (2009) verificaram que extratos obtidos em diferentes solventes foram capazes de inibir crescimento de Alternaria solani e Curvularia lunata, consideras espécies fúngicas capazes de promover infecções dermatológicas.
Lima et al. (2006) verificaram a atividade antifúngica do óleo essencial de C. zeylanicum sobre 12 cepas de Candida, entre elas C. albicans, C. guilliermondii, C. krusei, C. parapsilosis, C. stellatoidea e C. tropicalis a partir da técnica de difusão em meio sólido. Os autores puderam identificar que o óleo avaliado apresentou destacáveis resultados, uma vez que houve inibição de crescimento de 58% das cepas ensaiadas e CIM de 4%.
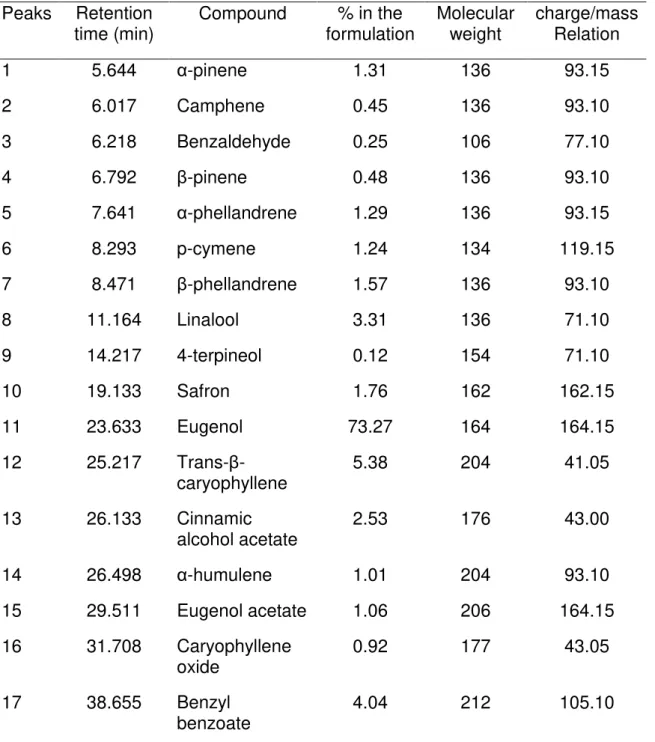
Schmidt et al (2007) avaliaram a atividade antifúngica dos compostos químicos presentes no óleo essencial de C. zeylanicum. Os autores verificaram que o referido óleo inibe crescimento de cepas de Candida e que o eugenol, composto majoritário do produto, apresenta expressiva atividade antifúngica. Entretanto, os compostos minoritários presentes no óleo participam decisivamente na atividade anti-Candida.
Em relação à composição química do óleo essencial de C. zeylanicum, as pesquisas indicam que o eugenol é o principal componente do óleo essencial de C. zeylanicum (SENANAYAKE; LEE; WILLS, 1978; LORENZI; MATOS, 2003; POZZATTI, 2007).
Ressalta-se que apesar de todos os órgãos de uma planta poderem acumular óleos essenciais, sua composição química, características físico-químicas e odores podem variar segundo sua localização, adubação, solo e clima. Embora controlada geneticamente, a biossíntese dos constituintes de uma planta é fortemente afetada pelo ambiente, colheita e pós-colheita, precipitação pluviométrica, temperatura, luminosidade e umidade (SARMAR; TRIPATHI, 2008).
O eugenol pertence a um grupo de compostos constituintes de óleos essenciais originados a partir da redução da cadeia lateral dos ácidos cinâmicos, que por sua vez são derivados da fenilalanina. Esses compostos também estão presentes em Syzygium aromaticum (cravo-da-índia), Pimpinella anisum (erva doce), Foeniculum vulgare (funcho) e Illicium verum (anis-estrelado) (SIMÕES et al., 2007).
Meades et al. (2010) sugerem que a atividade antibacteriana do óleo essencial obtido das cascas do C. zeylanicum pode ser decorrente da ação do Trans-cinamaldeído, composto encontrado em grande quantidade no produto. Segundo os autores, essa substância pode interagir com Acetil-CoA Carboxilase das bactérias, provendo sua morte.
principais substâncias presentes, o que pode sugerir provável atividade biológica das mesmas.
3. 6. Associação de drogas antifúngicas
O estudo de efeitos interativos entre moléculas tem uma longa história. Para as drogas antimicrobianas, o uso de duplas ou triplas combinações tem início com a realização de estudos in vitro que indicam interações positivas capazes de promover a inibição do crescimento dos microrganismos. Existem vários modelos experimentais que mensuram os efeitos de combinações de drogas. Um dos protocolos mais simples e conhecido é o teste chequerboard, que proporciona uma disposição bidimensional de concentrações diferentes das substâncias avaliadas. Esse teste permite o cálculo do índice de Concentração Inibitória Fracionada (CIF) (ODDS, 2003).
Segundo Cuenca-Estrella (2004), os compostos antifúngicos associados podem promover maior eficácia de cada droga, permitindo, assim, a utilização de menores doses de cada droga. Para o autor, o método chequerboard e a curva de morte microbiana são frequentemente utilizados na avaliação in vitro da atividade de antimicrobianos combinados.
O estudo e a descoberta de produtos naturais com princípios ativos que apresentem atividade antimicrobiana intrínseca ou combinada com antibióticos/antifúngicos de uso comum podem representar uma nova forma de fazer frente aos microrganismos multiresistentes, além de impedir o contato destes microrganismos com os produtos sintéticos, diminuindo o risco de se selecionar novos ou melhores mecanismos de resistência. Dessa forma, pode-se direcionar a indústria farmacêutica de forma a favorecer a produção e o uso de fitoterápicos como adjuvantes de determinados tratamentos contra agentes infecciosos ou outras doenças (COUTINHO, 2008).
Zago et al. (2009) destacam a possibilidade do uso de produtos naturais combinados aos antimicrobianos tradicionais, no intuito de aumentar a atividade antimicrobiana das drogas. Estes autores relatam que mesmo produtos naturais que apresentam um efeito antimicrobiano não tão eficiente, quando associados a produtos sintéticos apresentam sinergismo.
Nascimento et al. (2007) ressaltam que o uso associado de plantas medicinais e/ou seus subprodutos concomitante ao uso de medicamentos convencionais podem atuar inibindo, intensificando os efeitos terapêuticos dos medicamentos ou não interferindo na resposta esperada.
Oliveira et al. (2006) afirmam que tal uso associado em ocasiões especiais, como na dermatologia, plantas e seus subprodutos juntamente com os medicamentos convencionais colocam o paciente muitas vezes em risco, já que pode desencadear fitodermatoses decorrentes de mecanismos de irritação ou fotossensibilidade.
A atividade da combinação do produto de origem natural e antifúngico convencional foi avaliada por Shiin e Kang (2003). Esses autores avaliaram a atividade fungitóxica do óleo essencial de Agastache rugosa isolado e associado ao cetoconazol sobre Blastoschizomyces capitatus, sendo observada atividade sinérgica dos produtos avaliados sobre o microrganismo. A associação do beberine, alcalóide presente na Hydrastis canadensis, ao fluconazol apresentou sinergismo na atividade fungistática contra 40 cepas de C. albicans resistentes ao fluconazol obtidas de isolados clínicos. Essa interação sinérgica foi observada a partir da realização da técnica de microdiluição, difusão em agar e determinação da curva de morte microbiana (QUAN et al., 2006).
Observa-se na literatura uma escassez de estudos que retratam a atividade antimicrobiana de óleo essencial de C. zeylanicum associado a antimicrobianos convencionais. Nuryastuti et al. (2009) verificaram que o óleo essencial obtido de Cinnamomum bumanni associado ao triclosan, gentamicina ou clorexidina apresentou excelente atividade antibacteriana sobre isolados clínicos de Staphylococcus epidermidis.
Shahverdi et al. (2007) verificaram que a ação combinada do trans-cinnamaldeído, isolado do óleo essencial de C. zeylanicum, com a clindamicina foi capaz de promover, in vitro, inibição de crescimento do Clostridium difficile resistentes a clindamicina. O índice FIC foi de 0,312, confirmando a ação sinérgica da clindamicina e o trans-cinnamaldeído.
4 MATERIAL E MÉTODOS
4. 1 Local de realização da pesquisa e cepas fúngicas
Os ensaios microbiológicos foram realizados no Laboratório de Micologia do Departamento de Ciências Farmacêuticas do Centro de Ciências da Saúde da Universidade Federal da Paraíba, que disponibilizou as cepas de C. albicans LM 42V, C. albicans MD 37, C. albicans ICB 12, C. albicans ATCC 40277, C. albicans ATCC 76845, C. tropicalis ATCC 40042, C. tropicalis LM 759, C. tropicalis ATCC 13803, C. krusei ATCC 40147 e C. krusei LM 120.
4. 2 Óleos essenciais
Os óleos essenciais (Quadro 1) que tiveram a atividade antifúngica avaliada foram obtidos na Ferquima Ind. e Com. Ltda (Vargem Grande Paulista, São Paulo, Brasil), sendo seus parâmetros físico-químicos descritos pelo fornecedor, que produz e comercializa óleos essenciais em escala industrial. A emulsão do óleo essencial foi obtida seguindo as proporções sugeridas pelo protocolo recomendado por Allegrini et al. (1973).
Quadro 1. Óleos essenciais utilizados no ensaio para determinação da atividade anti-Candida.
Espécie Família Nome popular Densidade
4.3 Produtos sintéticos
Foram utilizados como controle positivo ou droga padrão a nistatina e miconazol, ambos adquiridos na Sigma-Aldrich (São Paulo), na forma de pó. As soluções foram preparadas no momento de execução dos testes, para alcance da concentração desejada nos testes de sensibilidade.
4.4 Screening para avaliação da atividade antifúngica
O ensaio para determinação da atividade antifúngica dos óleos essenciais foi realizado pelo método da difusão em meio sólido. Em placas de Petri estéreis foram adicionados 20 mL de agar Sabouraud Dextrose (ASD) fundido e resfriado a 45-50ºC. Após solidificação do agar, foi inoculado 1 mL da suspensão fúngica na concentração de 106 UFC mL-1. Em seguida, discos de papel de filtro estéreis foram embebidos em 50 µL dos óleos essenciais e colocados sobre o meio de cultura.
Os resultados foram avaliados a partir da mensuração dos diâmetros dos halos de inibição de crescimento fúngico em milímetros (mm). O ensaio foi realizado em duplicata, sendo considerada a média aritmética dos valores obtidos.
4.5 Determinação da Concentração Inibitória Mínima (CIM) – Técnica da Microdiluição.
sensibilidade das cepas ensaiadas frente à ação antifúngica da nistatina e miconazol, considerados padrões na utilização clínica, sendo ensaiados através da técnica de microdiluição.
Os ensaios foram realizados em triplicata incubados a 35ºC durante 24-48 horas. A leitura para determinação da CIM do óleo essencial sobre as cepas de leveduras foi feita a partir do método visual. Foi levada em consideração a formação ou não de aglomerados de células (“botão”) no fundo da cavidade da placa. Dessa forma, considerou-se como CIM, a menor concentração do produto em teste capaz de produzir inibição visível sobre o crescimento das cepas de leveduras utilizadas nos ensaios microbiológicos.
Para confirmação da presença de microrganismos viáveis nas concentrações não inibitórias, foi utilizado o corante TCT (2, 3, 5 trifenil cloreto de tetrazólio) no volume de 10 µL, que reflete a atividade das enzimas desidrogenases, envolvidas no processo de respiração celular. Isto torna possível distinguir as amostras vivas, coloridas de vermelho, daquelas mortas que mantêm a sua cor (GRABE, 1976; DESWAL; CHAND, 1997).
4.6 Determinação da Concentração Fungicida Mínima (CFM)
Após determinação da CIM, a concentração correspondente à inibitória e as duas concentrações imediatamente mais concentradas, bem como os controles positivos foram subcultivadas em placas de agar Sabouraud dextrose. Após 24 horas de incubação a 30ºC, as leituras das CFMs foram realizadas com base no crescimento dos controles, sendo considerada CFM a menor concentração da droga que impediu o crescimento visível do subcultivo.
4.7 Ação do óleo essencial de C. zeylanicum sobre a parede celular
fúngica.
de 132,17 g (VETEC Química Fina Ltda – Rio de Janeiro/RJ), ambos duplamente concentrados. Posteriormente, 100 µL da emulsão do óleo essencial, também duplamente concentrado, foram dispensados nas cavidades da primeira linha da placa. E por meio de uma diluição seriada a uma razão de dois, foram obtidas concentrações de 10.000 µL/mL até 10 µL/mL do óleo essencial e, no caso do sorbitol, uma concentração final de 0,8 M em cada cavidade. Por fim, foram adicionados 10 µL do inoculo das espécies nas cavidades, onde cada coluna da placa refere-se a uma cepa fúngica, especificamente.
Um controle de microrganismo foi realizado colocando-se nas cavidades 100 µL do mesmo CSD e sorbitol (0,8M) também duplamente concentrados, 100 µL de água destilada estéril e 10 µL do inoculo de cada espécie. Para verificar a ausência de interferência nos resultados pelo solvente utilizado na preparação da emulsão, no caso o Tween 80, foi feito um controle no qual foram colocado nas cavidades 100 µL do mesmo CSD e sorbitol (0,8 M) também duplamente concentrados, 100 µL de Tween 80 (10% em água destilada estéril) e 10 µL da suspensão. Um controle de esterilidade também foi realizado, onde foram colocados 200 µL do CSD em um orifício sem a suspensão dos fungos. As microplacas foram semeadas e incubadas a 37ºC por 48 horas para ser realizada a leitura (FROST et al., 1995; ZACCHINO, 2001).
4.8 Análise química do óleo essencial
4.9 Testes de sinergismo
4.9.1 Ensaio de sinergismo - Método checkerboard
O efeito combinado das duas substâncias (nistatina ou miconazol e óleo essencial de C. zeylanicum) estudadas foi determinado a partir da técnica de microdiluição - checkerboard para derivação do índice de concentração inibitória fracionada (Índice CIF).
A turbidez das suspensões fúngicas foi comparada e ajustada àquela apresentada pela suspensão de sulfato de bário do tubo 0,5 da escala McFarland, a qual corresponde a um inoculo de aproximadamente 106 unidades formadoras de colônias/mL (UFC/mL). Foram utilizadas soluções dos produtos testados em concentrações determinadas a partir de suas respectivas CIM. Inicialmente, 100 µL do meio de cultura Saboraud dextrose foram adicionados nos poços da microplaca estéril contendo 96 cavidades, com fundo em forma de “U” (ALAMAR®). Em seguida, 50 µL de cada produto testado, em diversas concentrações (CIM÷8, CIM÷4, CIM÷2, CIM, CIM×2, CIM×4 e CIM×8) foram adicionados no sentido vertical (nistatina ou miconazol) e horizontal (óleo essencial) da microplaca, assim como mostra a figura 4. Finalmente, o meio de cultura foi inoculado com 10 µL da suspensão fúngica. O crescimento fúngico foi evidenciando pelo uso do corante TCT. O ensaio foi realizado em triplicata, sendo as microplacas incubadas a 37 ºC por 48 horas (ELIOPOULOS; MOELLERING, 1991; DUTTA et al., 2004).
Ó leo es senci al d e C . z ey lanicum
CIM × 8
CIM × 4
CIM × 2
CIM
CIM ÷ 2
CIM ÷ 4
CIM ÷ 8
CIM ÷ 8 CIM ÷ 4 CIM ÷ 2 CIM CIM × 2 CIM × 4 CIM × 8
Nistatina ou miconazol
Figura 4. Esquema para realização do ensaio de sinergismo pela técnica de checkerboard.
4.7.2 Estudo do efeito do óleo essencial isolado e associado à nistatina sobre a cinética do crescimento das leveduras
O estudo da interferência do produto teste (OE de C. zeylanicum) isolado ou associado à nistatina sobre a viabilidade das cepas fúngicas foi realizado através do método de contagem de células viáveis. Neste ensaio, frente às concentrações inibitórias mínimas do OE, bem como, de sua associação com a nistatina, foi observado o comportamento das cepas de leveduras selecionadas. Inicialmente, 0,5 mL da suspensão de leveduras foi inoculado em 4,5 mL de caldo Sabouraud contendo concentrações variadas do OE, nistatina e associação dos produtos (CIM÷2; CIM; CIM×2; CIM×4 e CIM×8). Nos intervalos 0, 30 min, 60 min, 120 min, 180 min e 24 h após a incubação, uma alíquota de 10 µL desse inóculo foi uniformemente inoculada em placa de Petri contendo Agar Sabouraud dextrose. Também foi realizado o experimento controle, com crescimento livre de antifúngico.
4.6.3 Estudo do efeito do óleo essencial isolado e associado à nistatina sobre a micromorfologia de cepas de C. albicans.
Para observação de alterações morfológicas das cepas de C. albicans ATCC 40277 foi empregada a técnica do microcultivo para leveduras, utilizando o meio ágar-arroz em câmara úmida (GUNGI; ARIM; BEPPU, 1983; KURTZMAN; FELL, 1998).
5 RESULTADOS E DISCUSSÃO
5.1 Screening da atividade antifúngica de óleos essenciais sobre cepas de Candida.
5.2 Anti-candida activity and chemical composition of Cinnamomum zeylanicum Blume essential oil.
5.3 Combined effect of Cinnamomum zeylanicum Blume essential oil and nystatin on strains of Candida spp.
5.4 Effect of Cinnamomum zeylanicum Blume (Lauraceae) essential oil alone and combined with nystatin on micromorphology of Candida albicans strains.
5.5 Combined effect of Cinnamomum zeylanicum Blume essential oil and nystatin on strains of non-albicans Candida.
5. RESULTADOS E DISCUSSÃO
5.1 Screening da atividade antifúngica de óleos essenciais sobre cepas de Candida
RESUMO
SCREENING DA ATIVIDADE ANTIFÚNGICA DE ÓLEOS ESSENCIAIS
SOBRE CEPAS DE Candida1
SCREENING OF ESSENTIAL OILS ANTIFUNGAL ACTIVITY ON Candida
STRAINS
Ricardo Dias de Castro, Aluno do Curso de Doutorado Produtos Naturais e Sintéticos Bioativos (Farmacologia) da UFPB, Professor Assistente do Departamento de Clínica e Odontologia Social, Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. ricardodiasdecastro@yahoo.com.br
Edeltrudes de Oliveira Lima, Doutora, Professora Associada do Departamento de Ciências Farmacêutica, Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. edelolima@yahoo.com.br.
Autor para correspondência
Ricardo Dias de Castro
Departamento de Clínica e Odontologia Social. Centro de Ciências da Saúde. Universidade Federal da Paraíba, Campus Universitário I, Cidade Universitária, João Pessoa, Paraíba. CEP: 58059-900.
Telefone: (83) 9317-1071
E-mail: ricardodiasdecastro@yahoo.com.br
1