Mestrado em Biologia Clínica Laboratorial
CARACTERIZAÇÃO DAS PROTEÍNAS DE
CHOQUE TÉRMICO (HSP) NOS TESTÍCULOS
NORMAIS E CRIPTORQUÍDEOS DE CANÍDEOS
Manuel Filipe Teles Neves
Orientadora: Professora Doutora Maria dos Anjos Pires Co-orientadora: Professora Doutora Rita Maria Payan Correia
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO VILA REAL, 2010
ii Resumo
O criptorquidismo é uma das principais alterações que afectam o sistema reprodutor masculino em cães, acompanhando-se de um aumento da temperatura local nos testículos devido à sua localização anatómica não ser a normal, e causando complicações como a infertilidade e um maior risco de neoplasia. As proteínas de choque térmico (Hsp) são um grupo de proteínas que desempenham um papel importantíssimo na protecção de células contra agressões externas como o aumento de temperatura que se verifica no criptorquidismo. No presente trabalho foi estudada a marcação por imunohistoquímica de duas Hsp, a Hsp27 e a Hsp70, em amostras de testículos caninos escrotais e criptorquídeos, de modo a poder comparar a expressão destas duas moléculas nestes tipos de gónadas. Este trabalho permitiu evidenciar que a expressão das duas Hsp não é igual entre si, e também que varia com a população celular observada, com uma expressão mais intensa de Hsp70, relativamente á Hsp27, de uma maneira geral. As células somáticas, excepto as células de Sertoli para o marcador Hsp70, não apresentam um aumento de expressão quando expostas ao choque térmico, mantendo ou diminuindo a expressão dos marcadores.
Abstract
In dogs, cryptorchidism is one of the major diseases affecting the male reproductive system, leading to an increase of the temperature at the testes, which are maintained aside the normal anatomic position. This clinical situation often accompanies with infertility and an increased risk for tumor. Hsp are a group of proteins who have an outstanding role protecting the cells against outside aggressions, like the thermal shock associated to cryptorchidism. In the present work, Hsp27and Hsp70 expression was studied on samples from scrotal and criptorchidic dog testes, in order to compare its expression between the two types of samples. Expression of the two Hsp’s differed between the two molecules and also varied within the different cellular populations of the male gonad, with a greater expression of the Hsp70 marker, opposed to the Hsp27, generally speaking. Also, with the exception of the Hsp70 marker in Sertoli cells, none of the somatic cells showed an increase in the expression of the Hsp markers, when subjected to heat shock.
iii
INDICES
INDICE GERAL Lista de abreviaturas ... v Agradecimentos ... vi Introdução ... 7Morfologia e estrutura do testículo ... 7
Proteínas de choque térmico...12
Objectivos ...15 Materiais e Métodos ...16 Amostras ...16 Metodologia ...17 Avaliação da marcação ...18 Resultados ...19 Discussão………...28 Considerações finais ...34 Bibliografia ...35 INDICE DE QUADROS Quadro 1 – Resumo da informação disponível sobre as amostras utilizadas neste estudo. ..16
Quadro 2 – Quantificação da intensidade de imunoexpressão da proteína Heat-shock protein 27 em função do tipo celular...19
Quadro 3 – Quantificação da intensidade de imunoexpressão da proteína Heat-shock protein 70 em função do tipo celular...24
iv INDICE DE FIGURAS
Figura 1 – Marcação de imuno-histoquimica para o marcador Hsp27 em testículo escrotal de cão ...20 Figura 2 – Marcação de imuno-histoquimica para o marcador Hsp27 em testículo
criptorquídeo de cão ...22 Figura 3 – Marcação de imuno-histoquimica para o marcador Hsp70 em testículo escrotal de
cão ...25 Figura 4 – Marcação de imuno-histoquimica para o marcador Hsp70 em testículo
criptorquídeo de cão ...26
INDICE DE GRÁFICOS
Gráfico 1 – Representação da intensidade de marcação da proteína Hsp27 em testículos escrotais. ...20 Gráfico 2 – Representação da intensidade de marcação da proteína Hsp27 em testículos
retidos: ...22 Gráfico 3 – Representação da intensidade de marcação da proteína Hsp70 em testículos
escrotais. ...24 Gráfico 4 – Representação da intensidade de marcação da proteína Hsp70 em testículos
v
Lista de abreviaturas
ABP – Androgen-binding Protein ADN – Ácido desoxirribonucleotídico ATP – Adenina tri-Fosfato
AVB – Complexo Avidina-Biotina DAB – 3, 3’ – diaminobenzidina HE – Hematoxilina e eosina
Hsc – Heat-shock protein constitutive HSE - Heat shock element
Hsf - Heat-shock factors Hsp – Heat shock proteins INSL-3 – Insulin-like protein 3 kDa – kilodaltons
LHAP – Laboratório de Histologia e Anatomia Patológica ND – Não definido(a) Objs – Objectivas PBS – Tampão citrino-fosfato SPC – Espermatócito SPD – Espermatideas SPG – Espermatogónia
UTAD – Universidade Trás-os-Montes e Alto Douro W – Watts
‘ – Minutos ‘’ – Segundos
vi
Agradecimentos
Gostaria de agradecer às seguintes pessoas:
Profs Dras. Maria dos Anjos Pires e Rita Payan-CArreira, por terem aceite orientar-me na realização desta dissertação.
Profª Conceição Peleteiro, Prof. Ferreira da Silva e Drª Ana Laura Saraiva, pelo incalculável valor das cedências de amostras que fizeram e que permitiram este trabalho.
A todo o pessoal presente no Laboratório de Histologia e Anatomia Patológica pela ajuda no desenvolvimento das minhas capacidades práticas no laboratório em questão.
Às minhas colegas Ana Monteiro e Inês Santana, pelo ensino das técnicas e ajuda no aperfeiçoamento da prática das mesmas.
Aos meus colegas de mestrado, com os quais partilhei esta experiência, e sempre se disponibilizaram para levar esta etapa a bom porto.
À Eng. Cristina Silva que permitiu que eu tivesse a disponibilidade que precisava para poder fazer esta dissertação dentro dos prazos que tinha estipulado.
E por fim aos meus pais, irmão e restante família, que sempre me apoiaram de todas as maneiras possíveis e sem os quais sem dúvida que não teria sido possível chegar a este ponto.
7
Introdução
O termo criptorquidismo descreve a ausência de um ou ambos os testículos nas bolsas escrotais, a partir de um momento (que pode ser variável com a espécie) que corresponde ao encerramento do anel inguinal. É uma afecção relativamente mais frequente no cão e no garanhão do que nas restantes espécies (Romagnoli, 1991; Johnston et al., 2001). No cão é uma doença com características hereditárias, que se crê estar associado a um gene autossómico recessivo. Nos cães, a persistência do testículo retido na cavidade abdominal ou no canal inguinal predispõe ao desenvolvimento de tumores testiculares e à torção testicular (Romagnoli, 1991; Johnston et al., 2001). Segundo Mattos e colaboradores (2000), a espécie canina é a que apresenta uma maior frequência desta patologia, cerca de 10% dos indivíduos adultos, e aparenta uma tendência para aumentar.
A descida testicular e a sua localização nas bolsas escrotais são essenciais à ocorrência do processo espermatogénico, à normal produção de gâmetas e ao desenvolvimento da fertilidade no animal maturo. No entanto, esta situação não interfere com a libido do animal. Um macho com criptorquidismo poderá ser fértil caso a situação seja unilateral, apesar de a sua concentração espermática ser inferior à de um animal não criptorquídeo, bem como a qualidade do ejaculado que neste caso é inferior, dado o maior número de células anormais ou imóveis que possui (Romagnoli, 1991; Hughes, 2008).
O facto de esta afecção possuir carácter hereditário levanta algumas considerações de natureza ética, já que apesar de não existir qualquer obrigatoriedade, um macho criptorquídeo ou as cadelas cujas ninhadas apresentem cachorros criptorquídeos deveriam ser afastados da reprodução, se pretendermos reduzir a incidência de criptorquidismo nestes animais (Romagnoli, 1991)
Morfologia e estrutura do testículo
Os testículos ou gónadas masculinas são órgãos pares localizados nas bolsas escrotais. São eles os responsáveis pela produção dos gâmetas masculinos, ou espermatozóides, e pela secreção de androgénios, sobretudo de testosterona (Russel, 1983; Payan-Carreira, 1990).
8 Os testículos estão envoltos por uma camada mais densa, a túnica albugínea, que emite para o interior do órgão feixes de fibras de colagénio que delimitam lóbulos piramidais mais ou menos bem marcados no parênquima, num padrão que varia com a espécie. Estes septos convergem para o interior da gónada, onde constituem um eixo de tecido conjuntivo denso central – o mediastino testicular. No cão estes septos são incompletos. O tecido intersticial contém os vasos sanguíneos e linfáticos que suprem as necessidades da gónada. As células de Leydig são o tipo celular mais frequentemente encontrado no interstício testicular, e são elas as responsáveis pela secreção de androgénios (Russel, 1983; Payan-Carreira, 1990). São células epiteliais, relativamente grandes e de núcleo volumoso, redondo ou oval e o citoplasma é granular e eosinofílico, e regra geral contém pequenas inclusões lipídicas associadas à produção de esteróides (Russel, 1983).
O parênquima testicular integra também os tubos seminíferos. São estruturas tubulares de trajecto muito enovelado e cujas extremidades se abrem no sistema de ductos excretores (rete testis). É no interior dos tubos seminíferos que decorre a espermatogénese no qual se encontram dois tipos celulares distintos: as células de Sertoli, e as células do epitélio germinativo, que se dispõem de modo estratificado de acordo com a fase do processo espermatogénico, que culmina com a libertação dos espermatozóides para o lúmen dos tubos (Payan-Carreira, 1990). Antes da puberdade, os tubos seminíferos não apresentam lúmen, e a sua população celular está limitada às células de Sertoli e às espermatogónias. Na puberdade, em resposta à estimulação hipotálamo-hipofisária, observa-se o arranque da espermatogénese e em consequência a proliferação das células da linha germinativa; o epitélio germinativo começa a estratificar-se, expandindo as dimensões dos tubos (Russel, 1983; Payan-Carreira, 1990).
As células de Sertoli constituem a população de células somáticas dos tubos seminíferos e dispõem-se entre as células germinativas. No adulto a população de células de Sertoli no adulto mantém-se relativamente estável (Russel, 1983), e estendem-se da base dos tubos seminíferos até ao seu lúmen. Uma das funções atribuídas às células de Sertoli é o suporte e nutrição das células da linha germinativa (Payan-Carreira, 1990), fomentando a integridade do epitélio germinativo, permitindo o seu desenvolvimento sincicial e favorecendo as comunicações intercelulares, além de evitar o acesso do sistema imunitário às células da linha germinativa (Russel, 1983). É ainda atribuída às células de Sertoli uma função secretora, com a produção do fluído tubular, ou testicular, que é o meio de transporte dos
9 espermatozóides no sistema tubular masculino, e que tem por função manter a pressão e o lúmen dos tubos, além de fornecer aos espermatozóides recém-formados os nutrientes essenciais à sua sobrevivência (Payan-Carreira, 1990). Além de produzirem vários pequenos factores com actividade autócrina, elas produzem também ABP (Androgen-binding Protein – proteína de ligação aos androgénios), uma proteína fixadora dos androgénios, que permite manter um nível relativamente constante de androgénios nos tubos seminíferos, e também, de forma variável com a espécie, possuem uma capacidade limitada de produção de esteróides e de conversão da testosterona produzida no interstício testicular (Russel, 1983). O epitélio germinativo da gónada madura é constituído pelos diferentes estádios de células germinativas que comportam os diferentes passos da espermatogénese. Assim, encontram-se, as células de tipo Gónia (espermatogónias de tipo A, intermédio e B), os Citos de 1ª ordem (espermatócitos primários, em profase meiótica) e de 2ª ordem (espermatócitos II na segunda divisão meiótica) e as Tides em diferenciação (espermatídeas redondas, em alongamento e alongadas), cujo processo de diferenciação se termina com a libertação de um jovem espermatozóide (Hess e Chen, 1992).
Descida dos testículos
Durante o processo evolutivo dos mamíferos, a posição ocupada pelos testículos foi sendo progressivamente modificada, baixando em relação à localização dos ovários, e acabando por ocupar, na maioria destes animais, uma posição extra-abdominal (Hasthorpe et al., 1997). Esta mudança de posicionamento permite um decréscimo de temperatura na ordem dos 2 a 4 ºC relativamente à temperatura abdominal (Hughes e Acerini, 2008). Assim o escroto passa a ser o local onde os testículos funcionam e se alojam, diferenciando-se da cavidade abdominal por ser uma estrutura especializada com um ambiente de temperatura relativamente reduzida, sem a qual a espermatogénese encontra dificuldades em ocorrer (Hasthorpe et al., 1997).
A idade em que os testículos se alojam na sua localização final varia grandemente com a espécie. No caso dos humanos os testículos descem pouco antes do nascimento, enquanto algumas espécies como o veado e o touro têm testículos na posição escrotal bastante cedo na gestação (cerca dos 4 meses, nos bovinos). Espécies como os canídeos têm um atraso considerável neste posicionamento, comparativamente às espécies anteriores. Embora exista esta diferença entre espécies, todas elas possuem os mesmos passos que definem o
10 posicionamento final (Hughes e Acerini, 2008). Estes passos agrupam-se em 2 fases distintas, com movimentos morfo-fisiológicos e controlos hormonais distintos (Hasthorpe et al., 1997; Hughes e Acerini, 2008).
No momento de arranque da diferenciação gonadal, estas encontram-se numa localização peri-renal, fixados por acção de dois ligamentos, o ligamento suspensor cranial que liga a gónada ao diafragma, e o ligamento suspensor ventral, ou gubernáculo, que atravessa a região púbica seguindo a parede abdominal da região inguinal até ao escroto (Ivell et al., 2003; Hughes e Acerini, 2008).
A descida até ao escroto é um processo complexo, ainda não completamente esclarecido, que se pode dividir em 3 fases, que decorrem sob influências específicas a cada uma delas. A primeira delas está associada ao aumento das dimensões testiculares e à concomitante redução do mesónefros. Sob influência dos androgénios, o ligamento suspensor cranial do testículo regride, deslocando a gónada do seu local de origem caudalmente (Amann et al., 2006). A segunda fase, designada frequentemente por descida ou migração transabdominal, desloca os testículos para as proximidades do anel inguinal. Esta fase encontra-se na dependência da secreção de INSL-3 (Insulin-like protein 3 – Proteína tipo insulina 3) pelas células de Leydig (Klonish et al., 2004; Amman et al., 2006). A terceira fase, ou migração trans-inguinal, transporta os testículos para o escroto. Esta fase envolve a acção da testosterona e a retracção do gubernáculo, deslocando activamente as gónadas para as bolsas escrotais (Amman et al., 2006).
No cão, os testículos atravessam geralmente o anel inguinal externo próximo da 3ª semana de vida, sendo encontrados nas bolsas perto do dia 35. Apesar de em alguns machos este processo se prolongar por mais tempo, e tendo em consideração que os anéis inguinais encerram na periferia dos 7 meses de idade, considera-se que o macho é criptorquídeo se a partir desta data os testículos não desceram para as bolsas (Johnston et al., 2001; Klonish et al., 2004).
Criptorquidismo
O criptorquidismo é uma das principais afecções reprodutivas do cão, e caracteriza-se pela falha na descida de um ou ambos os testículos até à sua normal localização anatómica no escroto (criptorquidismo uni ou bilateral, respectivamente) (Mattos et al., 2000). Nesta
11 situação, o testículo pode encontrar-se em diferentes localizações, desde uma posição peri-renal até inguinal subcutânea (Johnston et al., 2001). O criptorquidismo pode ocorrer isoladamente, mas também pode estar associado a situações de intersexo (Mattos et al., 2000).
A incidência do criptorquidismo é relativamente elevada e pode variar muito de raça para raça, em função da política dos criadores. Existe uma clara predisposição genética na ocorrência desta afecção, sendo o Poodle e o Yorkshire Terrier as raças tidas como mais susceptíveis, tendo os Boxer e Beagle um risco relativo (Mattos et al., 2000).
O criptorquidismo traz associadas várias complicações, muitas vezes com impacto variável com a idade do animal e a localização da gónada retida. Entre as complicações mais frequentemente encontradas temos a infertilidade, a neoplasia e a torção testicular (Mialot, 1988; Romagnoli, 1991; Johnston et al., 2001).
Se até ao momento da puberdade poucas alterações estão descritas na histologia testicular, a partir deste momento o testículo torna-se progressivamente mais pequeno e fibrosado (Acland, 1998). Com a idade observa-se a deposição de fibras colagéneas no interstício, o espessamento hialino da membrana basal do túbulos seminíferos e a atrofia do epitélio germinativo, que pode encontrar-se reduzido a algumas espermatogónias, enquanto as células de Sertoli parecem relativamente aumentadas em número (Govender et al., 2004) No que respeita aos efeitos negativos para a saúde do animal criptorquídeo, o principal risco é a maior predisposição para a existência de neoplasia nos testículos retidos, comparativamente aos escrotais (cerca de 10 vezes maior). Estas neoplasias tendem a desenvolver-se sobretudo em animais com idades superiores a 6 anos, e são maioritariamente tumores das células intratubulares: seminomas (tumores das células germinativas) e sertolinomas (tumores das células de Sertoli) (Romagnoli, 1991)
Esta maior predisposição para a ocorrência de neoplasia testicular em gónadas retidas, assim como a sua ocorrência mais precoce, tem sido justificada com base no aumento da temperatura e/ou pressão local a que se encontram submetidos os testículos retidos, e que é maior em testículos abdominais (Romagnoli, 1991; Mattos et al., 2000).
12 Proteínas de choque térmico
A resposta ao choque térmico foi descoberta nos inícios dos anos 60, num estudo genético em Drosophila, em foram observados novos padrões de expressão génica associado a um aumento da temperatura, (Ritossa, 1996). Após experiências com outras fontes de stresse, verificou-se que a exposição de células de mamíferos a temperaturas elevadas estimula várias cascatas de sinalização que condicionam o destino final da célula. Se as cascatas de sobrevivência prevalecerem, as células vão desenvolver um estado de resistência ao stresse a que foram submetidas; caso contrário, serão as cascatas de morte celular a prevalecer determinando a sua morte (Gabai, 2001). A primeira cascata de sinalização de sobrevivência referida é a de indução das proteínas de choque térmico (Hsp - “heat shock proteins”). Em todos os organismos estudados até ao momento, desde bactérias até ao homem, em resposta a um aumento de temperatura observa-se a síntese em grande escala de Hsp, à custa da paragem da síntese de outras proteínas (Neuer et al., 2000).
As Hsp são um grupo de proteínas com estrutura muito similar entre espécies. No entanto, nem todos os membros desta família de proteínas são induzidos em grande escala por stresse. Existem moléculas que são expressas em condições normais e que apenas aumentam ligeiramente a sua expressão em casos de stresse, tendo-lhe alguns autores atribuído a designação de Hsc, pela sua expressão constitutiva; de acordo com estes autores, o termo Hsp seria reservado a proteínas induzíveis (Neuer et al., 2000).
As Hsp são classificadas em diferentes famílias, de acordo com o seu peso molecular (kilodaltons) e não pela sua função. As famílias mais referenciadas são as Hsp27, Hsp60, Hsp70 e Hsp90 kDa (Neuer et al., 2000).
As Hsp têm duas grandes funções: a primeira consiste na sua função em condições fisiológicas ou normais, em que as Hsp têm um papel de chaperoninas, estando envolvidas na mediação da estrutura nativa e transporte de outras proteínas intracelulares, facilitando a definição da estrutura terciária e/ou quaternária destas moléculas, além de cumprirem um papel na manutenção de proteínas em estado inactivo e prevenção da sua degradação proteica. A segunda função está associada à sua indução e acção como resposta a estímulos de stresse celular, tal como resposta a temperaturas elevadas, à formação de radicais livres, a infecções virais ou bacterianas, à acumulação de metais pesados ou etanol e à isquémia, de entre outros (Neuer et al., 2000).
13 Uma pré-exposição das células a condições de stresse moderado, o suficiente para a indução de Hsp, confere às células resistência a esse estímulo. Esta tolerância ao stresse é provavelmente promovida pela recuperação das funções celulares durante o primeiro estímulo de stresse, além de ter sido sugerido ainda a ocorrência de uma aparente melhoria na estabilização de estruturas celulares, como microfilamentos e funções celulares, como transcrição e tradução (Neuer et al., 2000). A expressão de Hsp induzidas é regulada por factores de transcripção específicos, designados por Hsf (Heat-shock factors – Factores de choque térmico). Estes factores adquirem a capacidade de ligação ao ADN, nomeadamente ao HSE (Heat shock element – Elemento do choque térmico), mediando a transcrição de genes de choque térmico de que resulta a acumulação de Hsp (Pirkkala et al., 2001).
Proteínas de choque térmico distintas têm formas diferentes de actuação. Dado que neste estudo apenas foram avaliadas duas Hsp, a Hsp27 e a Hsp70, é sobre elas que iremos incidir nos próximos parágrafos.
A Hsp27 pertence à família de moléculas de baixo peso molecular, entre 15 a 30 kDa; sendo passível de ser induzida por choque térmico, é também expressa constitutivamente, estando associada à protecção celular contra fenómenos de apoptose, interferindo em etapas específicas do processo apoptótico e com uma variedade dos seus mediadores (ligando-se a eles e condicionando a sua acção no processo), estando ainda associada à manutenção da integridade do citoesqueleto celular, nomeadamente dos filamentos intermédios e de actina (Mournier e Arrigo, 2002). Está implicada na inibição da apoptose activada por caspases, ao manter da integridade da mitocôndria, e podendo ligar-se directamente ao citocromo C (Gabai e Sherman, 2002) impedindo a sua posterior ligação a outras moléculas. Esta Hsp é expressa de forma constitutiva pela maior parte das células de mamíferos, se bem que o seu nível de expressão e o estado de fosforilação variem em função da exposição a vários factores.
As Hsp70 são constituídas por uma grande família de moléculas que têm sido associadas à resposta celular à temperatura. Actua na montagem, transporte e regulação da actividade de proteínas usando a sua propriedade de interagir com os segmentos peptídicos hidrofóbicos das proteínas num processo regulado por ATP (Mayer e Bukau, 2005)
Para além das Hsp 70 induzíveis, existem várias outras moléculas desta família que são expressas, seja de uma forma constitutiva ou de forma indutiva associada a estádios
14 específicos do desenvolvimento de gâmetas e embriões (Krawczyk, 1988)], como acontece com a Hsp 70-2, cuja expressão parece ser determinante na divisão meiótica da espermatogénese.
O choque térmico causa extensa desnaturação e agregação de proteínas intracelulares. Ao estudar estes fenómenos, descobriu-se que entre as proteínas importantes mais facilmente afectadas, estavam componentes da matriz celular e do citoesqueleto. As Hsp estão envolvidas nos processos que permitem as células recuperar rapidamente destas agressões, mas também diminuem as consequências nesta acção (Gabai, 2001).
Embora as células sejam sensíveis a ligeiros desvios de temperatura, a morte celular não acontece por acção directa do calor, mas por interferências no equilíbrio bioquímico de vida ou morte da célula, com activação das cascatas de sinalização que em último caso levam à morte da célula. A acção das Hsp nestes casos excede as suas funções básicas de chaperonina e de protecção proteica, e intervêm por acção negativa nos processos de morte celular, protegendo deste modo as células da morte (Gabai, 2001).
15
Objectivos
Um dos órgãos com maior sensibilidade à temperatura é o testículo, órgão que encontra condições óptimas de funcionamento numa localização exterior às cavidades orgânicas, a uma temperatura de cerca de 33ºC, ou seja cerca de 3 a 4 graus inferior à temperatura basal do corpo (Hutson, 1997), que no cão se encontra entre os 38 e os 39ºC.
A espermatogénese, que ocorre neste órgão, é muito sensível a temperaturas elevadas. Numa patologia como o criptorquidismo é natural questionar o papel que as Hsp possam ter na dinâmica desta doença, uma vez que a protecção por elas proporcionada poderia permitir um funcionamento, minimamente eficaz na produção de espermatozóides.
As Hsp têm um papel importante nos processos normais das células e, neste caso específico, na maturação das células da linha germinativa, nas quais, ao longo do processo espermatogénico, ocorrem importantes modificações e diferenciação (Neuer et al., 2000). Num testículo retido não há produção de espermatozóides e observa-se infertilidade, além do que acresce o risco de neoplasia, pelo que se achou interessante questionar o papel que as Hsp desempenharão nesta situação específica.
Assim, esta tese de mestrado teve como objectivo:
A expressão de Hsp27 e Hsp70 em testículos escrotais de cães.
A expressão de Hsp27 e Hsp70 em testículos retidos de cães.
16
Materiais e Métodos
Amostras
O material objecto deste estudo é pertença do acervo do Laboratório de Histologia e Anatomia Patológica (LHAP) da UTAD, do Laboratório de Patologia da Faculdade de Medicina Veterinária da Universidade Técnica de Lisboa e do Laboratório Gram. Para realização deste trabalho utilizaram-se cortes histológicos a partir de blocos de parafina de testículos de cão com localização normal no escroto e testículos com localização extra-escrotal (testículos retidos ou criptorquídeos). Os testículos tinham sido previamente classificados morfologicamente com base na coloração de rotina de hematoxilina e eosina (HE) por um patologista do LHAP. Foram considerados tecidos válidos para este estudo os testículos que apresentavam morfologia dentro dos parâmetros da normalidade para parâmetros em estudo. Foram motivo de exclusão do estudo a presença de um foco de neoplasia no testículo a utilizar ou no testículo contralateral, fosse ele retido ou escrotal. As amostras de testículos utilizadas eram provenientes de animais de várias raças e idades (Quadro 1): no entanto, para algumas da gónadas utilizadas, alguns dos dados clínicos não estavam disponíveis na ficha que acompanhava o pedido de análise.
Quadro 1 – Resumo da informação disponível sobre as amostras utilizadas neste estudo.
Testículos escrotais Testículos retidos
Nº caso Idade Raça Nº caso Idade Raça Localização
1 4 anos Caniche 10 4 anos Fox Terrier Abdominal
2 4 anos Dalmata 11 6 anos Yorkshire
Terrier Inguinal
3 6 anos Serra da
Estrela 12 1 ano ND Inguinal
4 8 anos Boxer 13 2 anos Cocker
Spaniel ND
5 8 meses ND 14 7 anos Yorkshire
Terrier ND
6 ND Podengo 15 6 meses ND Inguinal
7 ND ND 16 8 anos Boxer Subcutâneo
8 1 ano ND 17 ND Pastor Alemão ND 9 6 meses ND 18 2 anos ND ND 19 4 anos Rafeiro Alentejano ND 20 ND Podengo ND 21 ND ND ND
17 Metodologia
A técnica usada neste trabalho foi a de imuno-histoquímica indirecta com revelação pelo DAB (3, 3’ – diaminobenzidina). Esta é uma técnica que se baseia na formação de um complexo imune, uma reacção específica e de elevada sensibilidade, entre antigénios existentes nos tecidos e anticorpos primários contra essa molécula, mono ou policlonais. Utilizámos dois anticorpos policlonais, com especificidade para duas Hsp, respectivamente para as a Hsp27 (ABCAM Ref. Ab 5579), e outro para a Hsp70, (ABCAM Ref. Ab 31010). Estas proteínas (Hsp27 e 70) têm uma localização característica no citoplasma, com translocação para o núcleo quando em presença de choque térmico, no caso particular da Hsp27.
O protocolo utilizado foi aquele em uso no LHAP e que em seguida se transcreve:
1 – Os cortes colados em lâminas adesivadas com Silane®, são desparafinados em xilol durante 15 a 20 minutos.
2 – São depois hidratados com alcoóis de concentração decrescente (100% - 95% - 80% - 70%), e passados por água destilada.
3 – Recuperação antigénica é obtida pelo calor, em tampão citrato e no microondas (2 ciclos de 5 minutos, a 750W).
4 – Deixa-se arrefecer no tampão citrato, durante cerca de 20 minutos.
5 – Inactivar as peroxidases endógenas por imersão em H2O2 a 3% durante 30 minutos.
6 – As lâminas são lavadas em PBS (Tampão fosfato-salino).
7 – Incubadas com 100µl de soro normal polivalente (large volum Ultra V Block (Thermo Fisher Cientific, LabVision Corporation – ref. TA-125-UB) durante 5 minutos.
8 – Incubam-se então com o anticorpo primário (diluição 1:250 para hsp27 e 1:150 para hsp70), durante a noite, numa câmara húmida, em refrigeração.
9 – Lava-se 5’ com PBS.
10 Incuba-se com 100µl de Biotinylated Goat Anti-Polyvalent (Thermo Fisher Cientific, LabVision Corporation – ref. TP-125-BN) durante 10 minutos.
18 12 – Incuba-se com 100µl de Large Streptavidin Peroxidase (Thermo Fisher Cientific,
LabVision Corporation – ref. TS-125-HR) durante 10 minutos. 13 – Lavar com PBS.
14 – Revela-se a marcação com DAB, deixando actuar no máximo 10 minutos. 15 – Lavar-se em água corrente por 5 a 10’.
16 – Contrasta-se com Hematoxilina 20 a 40’’ que se azula lavando em água corrente. 18 – As lâminas são montadas com Entellan®.
Avaliação da marcação
A marcação ou reacção obtida é considerada positiva quando se observa uma cor castanho- -dourada de intensidade maior ou menor conforme a quantidade de substância presente nas células ou estruturas que contêm a molécula marcada. É considerada negativa se não se observa qualquer marcação acastanhada, e esta ausência de marcação é sobreponível aos controlos negativos internos e externos utilizados. Quando se obteve uma reacção positiva, esta foi classificada de acordo com a intensidade de marcação numa escala de + (fraca) até +++ (forte).
As paredes dos vasos sanguíneos foram utilizados como controlo positivo interno para ambas as Hsp, tendo esta estrutura evidenciando uma marcação de intensidade +++.
O núcleo das células de Sertoli foi usado como controlo negativo interno, uma vez que a marcação destas células, quando presente, é sempre citoplasmática.
A avaliação da marcação para as duas moléculas estudadas foi feita de forma individual para as diversas células presentes no túbulos seminíferos: as células de Sertoli, as células da linha germinativa, as células mióides que delimitam os túbulos seminíferos e as células de Leydig no interstício. No que respeita às células da linha germinativa, estas foram diferenciadas em espermatogónias e espermatócitos em pré-leptóteno (que nos resultados aparecem sob a designação conjunta de SPG), espermatócitos a partir de leptóteno, e espermatídeas redondas, em alongamento e alongadas, permitindo assim uma caracterização representativa dos vários estádios de diferenciação desta linhagem celular.
19
Resultados
Foi obtida marcação positiva para as Hsp27 e 70 em todas as amostras de testículo utilizadas neste estudo, tendo esta marcação variado em intensidade em função da população celular estudada (células da linha germinativa, células de Sertoli, células mióides péritubulares ou células de Leydig) e da localização da gónada (escrotal ou retida). Como controlo positivo interno, que permitiu aferir a validade da marcação, para as duas moléculas foi utilizada a marcação das paredes dos vasos sanguíneos, que apresentaram uma intensidade de marcação forte.
Os resultados obtidos irão ser apresentados individualmente para cada uma das proteínas e para cada grupo de testículos estudado (escrotal e retidos)
Hsp 27
No quadro 2 encontram-se resumidos os resultados encontrados neste estudo relativos à intensidade de imunomarcação para a Hsp27 em testículos escrotais e retidos de cão.
Quadro 2 – Quantificação da intensidade de imunoexpressão da proteína Heat-shock protein 27 em função do
tipo celular.
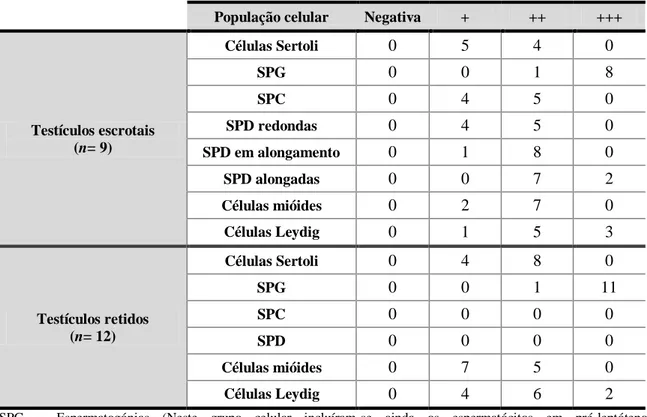
População celular Negativa + ++ +++
Testículos escrotais (n= 9) Células Sertoli 0 1 8 0 SPG 2 7 0 0 SPC 3 6 0 0 SPD redondas 3 6 0 0 SPD em alongamento 3 6 0 0 SPD alongadas 3 6 0 0 Células mióides 0 4 4 1 Células Leydig 3 5 1 0 Testículos retidos (n= 12) Células Sertoli 0 3 6 3 SPG 12 0 0 0 SPC 0 0 0 0 SPD 0 0 0 0 Células mióides 0 4 4 4 Células Leydig 9 3 0 0
SPG – Espermatogónias (Neste grupo celular incluíram-se ainda os espermatócitos em pré-leptóteno); SPC – Espermatócitos; SPD – Espermatídeas
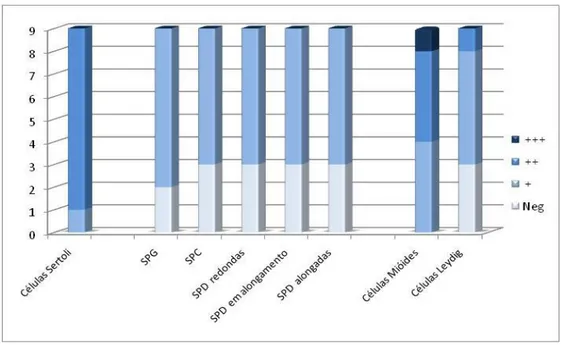
20 Nas células de Sertoli observou-se uma predominância da marcação de intensidade moderada para a Hsp27, com apenas uma amostra evidenciando uma intensidade de marcação fraca (11%) (Gráfico 1; Figura 1). As células da linha germinativa mostraram no geral uma intensidade de marcação fraca ou negativa, independentemente do tipo celular em causa (de SPG a SPD) (Gráfico 1; Figura 1).
Gráfico 1 – Representação da intensidade de marcação da proteína Heat-shock protein 27 em testículos
escrotais.
Figura 1 – Marcação de imuno-histoquimica para o marcador Heat-shock protein 27 em testículo escrotal de
cão. Observa-se uma marcação intensa nas células de Sertoli (seta oca), com as células da linha germinativa a evidenciarem marcação fraca (estrelas). (Objs 60x). AVB (complexo Avidina-Biotina) contrastada com Hematoxilina.
21 As células mióides apresentaram uma marcação para a Hsp27 de intensidade fraca a moderada na maior parte das amostras (89%), embora se tivesse observado uma marcação de intensidade forte em 11% dos casos (Quadro 2; Gráfico 1). Já nas células de Leydig predominou a intensidade de marcação fraca (mais de 56%) ou negativa (33%), tendo uma marcação moderada sido registada apenas numa das amostras (11%) (Quadro 2; Gráfico 1).
Em testículos retidos, a intensidade de marcação para a Hsp27 foi contabilizada nas células de Sertoli e nas células da linha germinativa nos estádios que antecedem a meiose (dado que se observa uma ausência de estratificação da espermatogénese em testículos criptorquídeos), nas células mióides péritubulares e nas células de Leydig (Quadro 2; Gráfico 2). As células de Sertoli apresentaram uma marcação de intensidade forte em 25% dos casos, uma intensidade moderada em 50% e as restantes 25% com marcação fraca (Gráfico 2; Figura 2). As células da linha germinativa nos estádios iniciais de desenvolvimento (SPGs e SPC em pré-leptóteno), que representam as únicas células germinativas observadas neste tipo de gónadas, não apresentaram qualquer marcação (Gráfico 2; Figura 2).
As células mióides apresentaram uma marcação nuclear distribuídas maioritariamente nas extremidades do espectro de marcação positiva, com 36% de marcações fraca e forte, e 28% de amostras a marcarem moderadamente positivo (Quadro 2; Gráfico 2), enquanto que as células de Leydig apenas apresentaram imunoreactividade em 25% das amostras (Quadro 2; Gráfico 2).
22
Gráfico 2 – Representação da intensidade de marcação da proteína Heat-shock protein 27 em amostras de
testículos retidos.
Figura 2 – Marcação de imuno-histoquimica para o marcador Heat-shock protein 27 em testículo
criptorquídeo de cão. Observa-se marcação intensa nas células de Sertoli (seta oca) e uma marcação fraca ou ausência de marcação nas células germinativas (estrelas) presentes nos túbulos. (Objs 60x). AVB (complexo Avidina-Biotina) contrastada com Hematoxilina.
23 Hsp 70
No quadro 3 resumem-se os resultados obtidos neste estudo quanto à intensidade de imunomarcação para a Hsp 70 observada em testículos escrotais e retidos.
No gráfico 3 está representada a intensidade de marcação obtida nas diversas populações celulares de testículos escrotais para a Hsp 70.
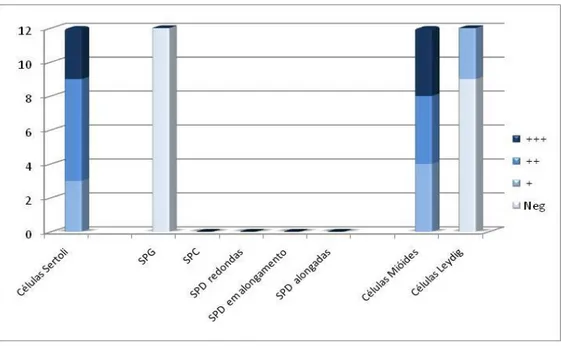
Neste grupo as células de Sertoli evidenciaram uma marcação positiva de fraca a moderada (+ e ++), tendo prevalecido neste tipo celular a intensidade de imunomarcação mais fraca (56% vs. 44%, respectivamente para a marcação de intensidade fraca e moderada). Nestas células a marcação é essencialmente citoplasmática, embora numa das amostras utilizada, o núcleo esteja também marcado.
Nas células da linha germinativas, as espermatogónias foram as células que apresentaram uma maior intensidade de marcação (+++) em 89% de amostras (Gráfico 3; Figura 3). Os espermatócitos e espermatídeas redondas apresentavam padrões de marcação idênticos, com intensidades entre fraca (44%) e moderada (56%) (Gráfico 3; Figura 3). As espermatídeas em alongamento apresentaram uma predominância de marcação de intensidade moderada (++), e as espermatídeas alongadas apresentavam positividade moderada, com apenas uma pequena percentagem (22%) de células a apresentarem uma intensidade forte.
24
Quadro 3 – Quantificação da intensidade de imunoexpressão da proteína Heat-shock protein 70 em função do
tipo celular.
População celular Negativa + ++ +++
Testículos escrotais (n= 9) Células Sertoli 0 5 4 0 SPG 0 0 1 8 SPC 0 4 5 0 SPD redondas 0 4 5 0 SPD em alongamento 0 1 8 0 SPD alongadas 0 0 7 2 Células mióides 0 2 7 0 Células Leydig 0 1 5 3 Testículos retidos (n= 12) Células Sertoli 0 4 8 0 SPG 0 0 1 11 SPC 0 0 0 0 SPD 0 0 0 0 Células mióides 0 7 5 0 Células Leydig 0 4 6 2
SPG – Espermatogónias (Neste grupo celular incluíram-se ainda os espermatócitos em pré-leptóteno); SPC – Espermatócitos; SPD - Espermatídeas
Gráfico 3 – Representação da intensidade de marcação da proteína Heat-shock protein 70 em testículos
25
Figura 3 – Marcação de imuno-histoquimica para o marcador Heat-shock protein 70 em testículo escrotal de
cão. Observa-se marcação citoplasmática intensa nas células da linha germinativa nas fases iniciais de desenvolvimento (seta) e uma marcação moderada no citoplasma das células de Sertoli (seta oca). (Objs 60x). AVB (complexo Avidina-Biotina) contrastada com Hematoxilina.
As células mióides péritubulares evidenciaram uma predominância de imunomarcação de intensidade moderada (++) em 78% dos casos (Gráfico 3), tendo apresentado marcação nuclear apenas em alguns dos casos. A imunoexpressão de Hsp70 nas células de Leydig mostrou uma intensidade intermédia em 50% dos casos, sendo esta intensidade forte em 30% das situações. Apenas em 1 caso (11%) a marcação foi fraca.
Em testículos retidos, a marcação para a Hsp 70 foi contabilizada nas células de Sertoli e nas células da linha germinativa nos estádios pré-meiose (dado que se observa uma ausência de estratificação da espermatogénese em testículos criptorquídeos), nas células mióides péritubulares e nas células de Leydig (Quadro 3; Gráfico 4). Neste tipo de gónadas, as células de Sertoli apresentaram uma marcação de intensidade moderada (++) em 67% das amostras, e uma marcação fraca (+) nas restantes (33%) (Gráfico 4; Figura 4).
Em testículos retidos apenas foram encontradas células da linha germinativa em estádios iniciais, ou seja, espermatogónias e espermatócitos em pré-leptóteno, tendo estas células apresentado uma marcação de intensidade forte (+++) na maioria das amostras (90%) (Gráfico 4; Figura 4).
26
Gráfico 4 – Representação da intensidade de marcação da proteína Heat-shock protein 70 em testículos
retidos.
Figura 4 – Marcação de imuno-histoquimica para o marcador de Heat-shock protein 70 em testículo
criptorquídeo de cão. Observa-se uma marcação de intensidade forte nas células de linhagem germinativa (seta) e uma marcação de intensidade moderada nas células de Sertoli (seta oca). (Objs 40x). AVB (complexo Avidina-Biotina) contrastada com Hematoxilina.
As células mióides péritubulares apresentaram, nos testículos retidos, uma marcação que se restringia à periferia nuclear, de intensidade predominantemente fraca (+) em 58% das
27 amostras, embora se tivesse observado uma pequena percentagem (42%) de células com marcação nuclear moderada (++) (Gráfico 4). Em contraste, as células de Leydig apresentaram um padrão de marcação de intensidade irregular, com uma marcação dispersando-se por todas as intensidades, tendo 50% das amostras apresentado uma marcação moderada (++), 33% intensidade fraca e apenas 17% uma intensidade forte (+++) (Gráfico 2).
28
Discussão
À semelhança do que foi descrito noutras espécies, este trabalho permitiu evidenciar a imunoexpressão de Hsp27 e Hsp70 em testículos de cão com localização escrotal (normal) e em testículos retidos, tendo-se observado algumas diferenças no padrão de distribuição da intensidade de marcação para estas duas moléculas.
Hsp27
Em testículos escrotais, as células de Sertoli apresentam uma maior intensidade de imunoexpressão de Hsp27, comparativamente aos outros tipos celulares. De acordo com os trabalhos de Walsh et al., (1996), realizados em ratos, praticamente toda a Hsp27 presente nos túbulos seminíferos se encontra nas células de Sertoli, numa posição idêntica à da actina presente nos microtúbulos do citoesqueleto, reforçando a relação conhecida entre estas duas moléculas. No entanto, não foi esta situação a que encontrámos no nosso estudo. Neste trabalho, nos tubos seminíferos foi observado a imunoexpressão de Hsp27 tanto nas células de Sertoli como nas células da linha germinativa. Nestas últimas, predominou uma expressão fraca para este marcador, enquanto que, em células de Sertoli, a intensidade de marcação predominante foi a moderada. Adly et al. (2008), em humanos, descrevem uma expressão forte de Hsp27 neste tipo celular, seja em testículos escrotais normais, seja em túbulos que apresentem uma interrupção no processo de maturação espermática, e nas síndromes associadas à ausência de células germinativas. De facto, em todas estas condições, são as células de Sertoli que apresentaram sempre a maior quantidade de Hsp27, não parecendo ser afectadas por condições adversas deste tipo. No trabalho apresentado, a expressão deste marcador foi diferente nos dois grupos de gónadas em estudo. Enquanto nas amostras de testículo escrotal se observou o predomínio da marcação moderada das células de Sertoli, nas amostras de testículos criptorquídeos estas células apresentam marcação irregular entre os diferentes casos utilizados, com marcação intensa em 25% dos casos, uma marcação moderada em 50% dos casos, sendo que nas restantes amostras apresentaram uma intensidade de marcação fraca. Mesmo assim podemos considerar que o resultado das marcações de Hsp27 nas células de Sertoli não apresenta diferenças relevantes nas duas populações de amostras, mostrando uma média de intensidade intermédia nos dois casos.
29 Este tipo de marcação poderá ser devida a um de dois fenómenos, que no entanto não podemos comprovar por insuficiência de dados. Uma das eventuais causas poderia ser a associação à localização testicular. De facto, a localização abdominal ou extra-abdominal, interferindo na temperatura e pressão a que a gónada se encontra sujeita, poderá fazer variar a expressão de Hsp27, uma vez que a sua síntese se encontra aumentada com a temperatura. Outra possibilidade seria os níveis constitutivos desta molécula variarem numa população estimulada para um processo proliferativo não fisiológico, como por exemplo em situações pré-neoplásicas. No entanto, e como já foi dito, a insuficiência de dados fornecidos ao Laboratório, através do preenchimento da ficha de requisição de análise, não nos permite extrair conclusões acerca desta observação.
Ao contrário de que foi observado noutros trabalhos, com o anticorpo por nós utilizado encontrámos, em testículos escrotais, o predomínio da marcação positiva de fraca intensidade nas células da linha germinativa. No estudo de Adly et al. (2008) as células da linha germinativa mais imaturas (SPG A) apresentavam uma expressão mais intensa, com as células de estádios de maturação mais avançados a apresentarem um decréscimo de expressão deste marcador, e com os espermatozóides a não mostrarem qualquer vestígio desta molécula. No presente estudo, todas as células germinativas apresentaram o mesmo padrão de marcação, com uma ligeira variação nas SPG, que apresentaram uma intensidade fraca, quando comparadas com as restantes células germinativas. Estas observações contrariam os estudos de Adly et al., (2008) no que respeita à expressão de Hsp27 em testículos normais. No entanto, os dados obtidos no nosso estudo estão de acordo com os apresentados por estes autores no que respeita à expressão de Hsp27 pelo testículo em situação de stresse, que decresce nas células germinativas podendo mesmo encontrar-se ausente. Neste trabalho verificou-se que as únicas células germinativas presentes em testículos criptorquídeos (SPG A e espermatócitos em pré-leptóteno, que foram incluídas no mesmo grupo para a classificação, dado não serem passíveis de distinção), perderam a expressão deste marcador, comparativamente ao observado em testículos escrotais.
No presente estudo, as células mióides péritubulares apresentam uma marcação fraca a moderada em testículos escrotais. Não encontrámos dados suficientes na bibliografia disponível que nos permitam comparar os nossos resultados, dado não existirem referências específicas a esta população celular nos trabalhos consultados. Adly et al. (2008), refere não ter encontrado marcação positiva na bainha de tecido conjuntivo nem miofibroblastos dos
30 túbulos seminíferos, quer de testículos com espermatogénese normal como anormal. No presente estudo verificou-se marcação irregular entre amostras, em testículos escrotais, com uma distribuição pelos três níveis de intensidade, não parecendo existir diferenças entre o observado em testículos criptorquídeos, pelo que não se pode afirmar que a alteração de condições teve um impacto na expressão de Hsp27 nestas células. Uma vez que as amostras utilizadas nos trabalhos de Adly et al. (2008) não eram testículos criptorquídeos, mas testículos com maturação de células germinativas suspensa (não progrediam além de espermatídeos), ou desprovidos de células germinativas, esta poderá ser uma explicação para as diferenças observadas entre os dois estudos.
As células intersticiais de Leydig apresentam uma marcação predominantemente fraca, indicando uma reduzida expressão de Hsp27. Em testículos retidos apenas 3 das 12 amostras apresentam uma marcação fraca deste tipo celular, predominando nesta situação a ausência de expressão para este marcador. Em aparente oposição, Adly et al. (2008) referem uma forte expressão de Hsp 27 nas células de Leydig de testículos normais, o que poderá estar associado à utilização de um anticorpo diferente, para além de diferenças espécie-específicas. No entanto, estes autores também encontraram um decréscimo da expressão desta molécula nas células de Leydig nas situações de espermatogénese anormal, que passam a evidenciar uma intensidade fraca. De resto, foi o que se encontrou neste trabalho, registando um aumento do número de amostras com marcação negativa para este anticorpo. Os estudos de Adler et al. (2008) parecem indicar que a expressão desta Hsp27 deixa de ser induzida em caso de espermatogénese anormal.
Hsp70
As células de Sertoli, as únicas células somáticas que rodeiam as células germinativas nos seus vários estágios de desenvolvimento, desempenham um importante papel de suporte, quer estrutural quer nutricional, para as células da linha germinativa. No entanto e, ao contrário destas, não são afectadas pela hipertermia (Chen et al., 2008). Até à data não é ainda claro se as células de Sertoli activam uma sobre-expressão de Hsp’s para se proteger da hipertermia, uma vez que em estudos anteriores não mostraram provas deste acontecimento específico (Chen et al., 2008). No estudo por nós apresentado, para a Hsp70, em testículos escrotais as células de Sertoli apresentam uma marcação positiva de
31 intensidade fraca a moderada, o que parece contrariar o descrito por Chen et al. (2008), que em testículos de macacos Rhesus, apenas encontraram expressão positiva de Hsp70 em células de Sertoli depois da exposição de culturas de células a temperaturas elevadas (43ºC). A partir desta exposição, a expressão de Hsp70 aumentou, sendo claramente induzida, tal como aparenta ser no presente estudo.
Os dados por nós obtidos no que respeita à marcação observada nas células da linha germinativa são semelhantes aos descritos para o murganho. Nesta espécie, as moléculas da família das Hsp70 estão presentes em abundância no testículo na ausência de estímulos de stresse (Zakeri et al., 1990). Segundo Zakeri e colaboradores, alguns membros das Hsp70, sejam as do patamar indutivo seja as do constitutivo estão ligados a estágios específicos de desenvolvimento das células germinativas (Zakeri et al., 1990), não sendo encontradas em células germinativas pós-meióticas (ou seja espermatídeas e jovens espermatozóides) como resposta ao stresse (Chen et al., 2008 e Zakeri et al., 1990). Assim, a presença desta Hsp é considerada normal mesmo na ausência de um choque térmico. No nosso estudo foi observado uma presença considerável de Hsp70, tendo em conta a marcação intermédia/intensa das células germinativas para este marcador. No entanto, e dado que o anticorpo utilizado não é específico para a identificação das diferentes proteínas desta família, não é possível associá-las a cada uma das populações que reagiram com marcação positiva e estabelecer comparações com o que se encontra descrito na bibliografia disponível. Nos trabalhos de Zakeri et al. (1990) e Chen et al. (2008), a Hsp70.1, uma das principais Hsp’s induzíveis por stresse, apresentou níveis de expressão mais altos em populações de células germinativas na fase haplóide, enquanto a Hsp70.2, uma Hsp expressa constitutivamente nos testículos, mostrou não ser activada com o choque térmico, apresentando um pico de expressão nos espermatócitos em profase meiótica. Segundo Koeva et al. (2005), as Hsp70 têm nas células da linha germinativa uma função de chaperonina, indispensável para que estas células progridam além da fase meiótica. No estudo que aqui apresentamos, os níveis mais elevados de imunoexpressão de Hsp70 em testículos escrotais de cão foram observados em espermatogónias e espermatócitos pré-leptotenos, fases em que estas linhagens ainda apresentam diploidia, apresentando uma menor intensidade de marcação nos espermatócitos (ou seja durante a fase meiótica) para depois aumentar novamente, acompanhando o grau de maturação, embora nunca apresentem intensidades de marcação tão elevadas como nas células mais imaturas. Isto
32 pode indicar a presença de outros membros da família Hsp70 nestes estágios iniciais de maturação.
Em testículos retidos, a população de células germinativas é muito diferente daquela dos testículos escrotais, com a presença de apenas espermatogónias e espermatócitos em pré-leptoteno, pelo que foi também observado, neste estudo, uma modificação no padrão global de expressão do marcador nesta linha celular. Não se encontraram, nestas amostras, células germinativas em plena fase meiótica ou em estádios haplóides posteriores, tendo as células de tipo SPG e SPC em pré-leptoteno apresentando uma forte intensidade de marcação para a Hsp70, com 11 das 12 amostras a apresentar marcação máxima, que representa um ligeiro aumento da marcação relativamente às amostras de testículos escrotais que apresentaram 8 amostras com intensidade de marcação máxima num total de 9 amostras. Nestes testículos as células germinativas meióticas não activam genes relativos à resposta de choque térmico. As Hsp70 mostraram ser induzidas como consequência de diferenciação celular durante a meiose, mas não retêm esta capacidade de serem induzidas como resposta ao choque térmico neste mesmo período (Zakeri et al., 1990). Neste estudo, as células de Leydig apresentam uma marcação positiva, de intensidade média. Segundo Koeva e colaboradores (2005), usando também uma técnica de imuno-histoquímica, no espaço intersticial intertubular as células de Leydig apresentam uma forte presença de Hsp70. Nas amostras de testículos criptorquídeos observou-se uma manutenção do nível de intensidade de marcação para este marcador. Estes resultados parecem indicar que, pelo menos nas situações de stresse térmico prolongado (como o encontrado nas situações de localização extra-escrotal), estas células apresentam uma expressão de Hsp70 semelhante ao das células em condições normais. Os resultados do presente estudo descrevem uma intensidade de marcação mais fraca, relativamente aos do estudo de Koeva et al. (2005), realizado em ratos com testículos normais, submetidos a stresse causado por exercícios de endurance. Nele, o grupo de Koeva observou as células de Leydig apresentavam níveis de intensidade de marcação de Hsp70 quase inalterados e concluiu que no testículo a Hsp70 apresenta diferentes expressões com diferentes células e por conseguinte diferentes funções nas mesmas, consoante se tratasse de células somáticas ou germinativas. No caso das células de Leydig, foi sugerido que a Hsp70 desempenhe um papel na inibição da apoptose associada ao stresse, em oposição ao papel que crê desempenhar nas células germinativas, nas quais interferiria nos processos de maturação celular, embora não pareça encontrar-se directamente associada ao stresse térmico. De certa maneira esta é uma hipótese que
33 explicaria a ausência de alteração na intensidade de marcação das células de Leydig em testículos sujeitos a stresse constante, como os criptorquídeos, ao contrário do que se observa no caso das células da linha germinativa.
As células mióides péritubulares pertencem à categoria de células somáticas existentes nos testículos e revestem exteriormente os tubos seminíferos. No entanto, estas células desempenham um papel muito específico, participando na contractilidade dos túbulos e na progressão dos espermatozóides até ao epidídimo. Isto poderá justificar as diferenças encontradas nesta população celular entre testículos retidos e escrotais, comparativamente ao que está descrito para as células da linha somática (Kretser et al., 1975). Enquanto célula somática, seria espectável que apresentasse uma baixa intensidade de marcação de Hsp70, justificado pela função de chaperonina que esta Hsp possui, e que em resposta a stresse térmico (no caso dos testículos retidos) evidenciassem um acréscimo da marcação (Zakeri et al., 1990). Contudo, não foi isso que se observou no nosso estudo, com as células mióides a mostrarem uma marcação de intensidade fraca nos testículos retidos, mostrando claramente que a indução de Hsp70 não ocorreu nestas células como resposta à alteração de condições de funcionamento dos testículos. A razão desta observação, se é consequência da resposta celular à hipertermia ou se, simplesmente, este tipo de células não contempla esta reacção como parte do seu mecanismo de defesa ao stresse térmico, está fora do âmbito deste trabalho.
34
Considerações finais
Tendo em conta os objectivos definidos para este estudo pretendemos observar que a marcação de Hsp27 e Hsp70 em testículos normais e criptorquídeos de cães apresenta intensidades diferentes em diferentes tipos de células.
A marcação de Hsp27 é de uma maneira geral mais fraca nos dois grupos de testículos, quando comparado com a marcação da Hsp70.
Para o marcador Hsp27, as células de Sertoli e células mióides apresentaram uma manutenção da intensidade de marcação entre os dois tipos de amostras, enquanto nas células germinativas (SPG) e células de Leydig, esta intensidade decresceu nas amostras de testículos criptorquídeos.
Quanto ao marcador Hsp70, as células de Sertoli apresentaram um aumento na intensidade de marcação nas amostras criptorquídeas, e uma manutenção dos níveis altos de intensidade na marcação das células germinativas (SPG). As células de Leydig também apresentaram manutenção dos níveis de intensidade de marcação, mas desta feita em níveis intermédios. As células mióides decresceram os seus níveis de marcação em amostras criptorquídeas. Será do maior interesse, em futuros estudos, estudar melhor as características das Hsp27, Hsp70 e outras Hsp, incluindo as suas isoformas, no testículo, uma vez que se trata de um local com uma população celular que apresenta características próprias, relativamente ao que se verifica noutras localizações, e que permitirá vislumbrar com maior clarividência a totalidade de papéis funcionais das Hsp’s.
Dever-se-ão aprofundar os resultados obtidos neste trabalho com outros posteriores que abordem estas temáticas, assim como ampliar a amostra de forma a tornar estes estudos mais fidedignos.
35
Bibliografia
Acland, M.H.; Carlton, W.W., Mcgavin, M.D. 1998: Patologia veterinária especial de Thompson, 2ª Ed. Artmed, Porto Alegre, pp.575-576
Adly, Mohamed A.; Assaf, Hanan A.; Hussein, Mahmoud Rezk A. 2008: Heat shock protein 27 expression in the human testis showing normal and abnormal
spermatogenesis, Cell Biology International 32, 1247-1255
Amann, R.P.; Veeramachaneni, D.N.R. 2007: Cryptorchidism in common eutherian mammals, Reproduction 133, 541-561
Amann, R.P., Veeramachaneni, D.N.R. 2006: Cryptorchidism and associated problems in animals, Animal Reproduction and Biotechnology 3(2), 108-120
Amann, R.P. 1986: Reproductive physiology and endocrinology of the dog, Current therapy in theriogenology, Vol.2; Saunders Company, pp.536-537
Amann, Rupert P. 2008: The Cycle of the Seminiferous Epithelium in Humans: A Need to Revisit?, Journal of Andrology 29(5), 469-487
Arya, Richa; Mallik, Moushami; Lakhotia, Subhash 2007: Heat shock genes – integrating cell survival and death, Journal Bioscience 32(3), 595-610
Billig, Håkan; Chun, Sang-Young; Eisenhauer, Karen; Hsueh, Aaron J.W. 1996: Gonadal cell apoptosis: hormonal-regulated cell demise, Human Reproduction Update 2(2), 103-117
Brancho, Deborah; Tanaka, Nobuyuki; Jaeschke, Anja; Ventura, Juan-Jose; Kelkar, Nyaya; Tanaka, Yoshinori; Kyuuma, Masanao; Takeshita, Toshikazu; Flavell,
Richard A.; Davis, Roger J. 2003: Mechanism of p38 MAP kinase activation in vivo, Genes & Development 17,1969-1978
Calderwood, Stuart K.; Mambula, Salamatu S.; Gray Jr, Philip J.; Theriault, Jimmy R. 2007: Extracellular heat shock proteins in cell signaling, FEBS Letters 581, 3689-3694
Chen, Min; Yuan, Jin-Xiang; Shi, Yu-Qiang; Zhang, Xue-Sen; Hu, Zhao-Yuan; Gao, Fei; Liu, Yi-Xun 2008: Effect of 43ºC treatment on expression of heat shock
proteins 105, 70 and 60 in cultured monkey Sertoli cells, Asian Journal of Andrology 10(3), 474-485
36
de Kretser D. M.; Kerr, J,B,; Paulsen, C.A. 1975: The Peritubular Tissue in the Normal and Pathological Human Testis. An Ultrastructural Study, Biology of Reproduction 12, 317-324
Dix, David J. 1997: Stress proteins in reproductive toxicology, Environ Health Prospect 105(4), 436-438
Dix, David J.; Allen, James W.; Collins, Barbara W.; Mori, Chisato; Nakamura, Noriko; Poorman-Allen, Patricia; Goulding, Eugenia H.; Eddy, E.M. 1996: Target gene disruption of Hsp70-2 results in failed meiosis, germ cell apoptosis, and male infertility, Proceedings of the National Academy of Sciences 93, 3264-3268
Eddy, Edward M. 1999: Role of heat shock protein HSP70-2 in spermatogenesis, Reviews of Reproduction 4, 23-30
Efthimiou, Ioannis; Mamoulakis, Charalampos; Papageorgiou, George; Kazoulis, Sabbas; Prevedorou, Despina; Kontogiorgos, George; Christoulakis, Ioannis 2009: Unilateral Malignant Leydig Cell Tumor of Testis in a Patient With Contralateral Cryptorchidism, Urology Journal 6(1),60-62
Gabai, Vladimir L.; Sherman, Michael Y. 2002: Interplay between molecular chaperones and signaling pathways in survival of heat shock, Journal of Apllied Phisiology 92, 1743-1748
Garrido, Carmen; Mehlen, Patrick; Fromentin, Annie; Hammann, Arlette; Assem, Mahfoud, Arrigo, André-Patrick; Chauffert, Bruno 1996: Inconstant association between 27-kDa heat-shock protein (Hsp27) content and doxorubicin-protecting effect of Hsp27, European Journal of Biochemistry 237, 653-659
Govender D.; Sing Y.; Chetty, R. 2007: Sertoli cell nodules in the undescended testis: a histochemical, immunohistochemical, and ultrastructural study of hyaline deposits, Journal of Clinical Pathology 57, 802-806
Griswold, Michael D. 1995: Interactions between Germ Cells and Sertoli Cells in the Testis, Biology of Reproduction 52, 211-216
Hess, Rex A., Chen, Paul 1992: Computer tracking of germ cells in the cycle of the seminiferous epithelium and prediction of changes in cycle duration in animals commonly used in reproductive biology and toxicology, Journal of Andrology 13(3), 185-190
37
Hess, Rex A.; Cooke; Paul S.; Hofmann, Marie-Claude; Murphy, Kenneth M. 2006: Mechanistic Insights into the Regulation of the Spermatogonial Stem Cell Niche, Cell Cycle 5(11), 1164-1170
Hettinga, Judith V.E.; Lemstra, Willy; Meijer, Coby; Los, Gerrit; de Vries, Elisabeth G.E.; Konings, Antonius W.T.; Kampinga, Harm H. 1996: Heat-shock protein expressionin ciplatin-sensitive and –resistant human tumor cells, International Journal of Cancer 67, 800-807
Hughes, Ieuan A.; Acerini, Carlo L. 2008: Factors controlling testis descent, European Journal of Endocrinology 159, S75-S82
Hutson, John M.; Hasthorpe, Suzanne; Heyns, Chris F. 1997: Anatomical and Functional Aspects of Testicular Descent and Cryptorchidism, Endocrine Reviews 18(2), 259-280
Ivell, Richard; Hartung, Stefan 2003: The molecular basis of criptorchidism, Molecular Human Reproduction 9(4), 185-181
Johnston, J.H. 1965: The undescended testis, Archives Disease in Childhood 40, 113-122
Kersten, W,; Molenaar, G.J.; Emmen, J.M.A.; Schoot, P. van der 1996: Bilateral cryptorchidism in a dog with persistent cranial testis suspensory ligaments and inverted gubernacula: report of a case with implications for understanding normal and aberrant testis descent, Journal of Anatomy 189, 171-176
Kimmins, Sarah; Kotaja, Noora; Davidson, Irwin; Sassone-Corsi, Paolo 2004: Testis-specific transcription mechanisms promoting male germ-cell diffentiation Reproduction 128, 5-12
Klonish, T.; Fowler, P.A.; Hombach-Klonish, H. 2004: Molecular and genetic regulation of testis descent external genitalia development, Development Biology 270, 1-18
Koeva, Y.; Delchev, S.; Georgieva, K; Atanassova, P 2005: Heat Shock protein-70 expression in testis Following Endurance Training of Rats, Proceedings of the Balkan Conference of Biology in Plovdiv (Bulgaria) from 19th till 21st of May 2005, 288-294
Landry, Jacques; Chrétien, Pierre; Lambert, Herman; Hickey, Eileen; Weber, Lee A. 1989: Heat Shock Resistance Conferred by Expression of the Human HSP27 Gene in Rodent Cells, The Journal of Cell Biology 109, 7-15
38
Lanneau, David; Thonel, Aurelie de; Maurel, Sebastien; Didelot, Celine; Garrido, Carmen 2007: Apoptosis Versus Cell Differentiation Role of Heat Shock Proteins HSP90, HSP70 AND HSP27, Prion 1(1), 53-60
Mattos, Marcos; Simões-Mattos, Lucilene; Domingues, Sheila Farhayldes Souza 2000: Cryptorchidism in Dogs, Ciência Animal 10(1), 61-70
Mayer, M.P.; Baku, B. 2005: Hsp70 Chaperones: Cellular functions and molecular mechanism, Cellular and Molecular Life Sciences 62, 670-684
Meistrich, Marvin L. 1986: Critical components of testicular function and sensitivity to disruption, Biology of Reproduction 34, 17-28
Mialot, J.P. 1988: Patologia do aparelho genital masculino; Patologia da reprodução dos carnívoros domésticos, Ed. 1; Metrópole. Porto Alegre, pp.69-71
Mournier, Nicole ; Arrigo, André-Patrick 2002: Actin cytoskeleton and small heat shock proteins: how do they interact?, Cell Stress & Chaperones 7(2), 167-176
Mruk, Dolores D.; Cheng, C. Yan 2004: Sertoli-Sertoli and Sertoli-Germ Cell Interactions and Their Significance in Germ Cell Movement in the Seminiferous Epithelium during Spermatogenesis, Endocrine Reviews 25(5), 747-806
Neuer, A.; Spandofer, S.D.; Giraldo, P.; Dieterle, S.; Rosenwaks, Z.; Witkin, S.S. ,2000: The role of heat shock proteins in reproduction, Human Reproduction Update 6(2), 149-159
Pauli, Daniel; Tonka, Chia-Hwa; Tissieres, Alfred; Arrigo, André-Patrick 1990: Tissue-specific Expression of the Heat Shock Protein HSP27 during Drosophila melanogaster Development, The Journal of Cell Biology 111, 817-828
Payan-Carreira, R.1990: Evolução morfo-funcional do testículo. Determinação da idade á puberdade no macho Maronês, Provas de Aptidão Científica e Capacidade Pedagógica – Trabalho de síntese, UTAD
Pirkkala, Lila; Nykänen, Päivi; Sistonen, Lea 2001: Roles of the heat shock transcription factors in regulation of the heat shock response and beyond, The FASEB Journal 15, 1118-1131
Richards, E.H.; Hickman, J.A.; Masters, J.R.W. 1995: Heat shock protein expression in testis and bladder cancer cell lines exhibiting differential sensitivity to heat, British Journal of Cancer 72, 620-626