Universidade de Lisboa
Faculdade de Farmácia
Estratégias de racionalidade terapêutica; Indicadores,
Limitações e Perspetivas
Joana Rita Neto Abrantes
Mestrado Integrado em Ciências Farmacêuticas
1
Universidade de Lisboa
Faculdade de Farmácia
Estratégias de racionalidade terapêutica; Indicadores,
Limitações e Perspetivas
Joana Rita Neto Abrantes
Monografia de Mestrado Integrado em Ciências Farmacêuticas apresentada à Universidade de Lisboa através da Faculdade de Farmácia
Orientador: Professora Doutora Maria Sofia R. Pintado Oliveira Martins
2
Agradecimentos: À Professora Doutora Sofia Oliveira Martins, pela orientação,
assertividade e dedicação; aos meus colegas pelo incentivo e partilha; aos meus pais e irmã, pelo estímulo, carinho e compreensão. A todos vós muito obrigada.
3
Resumo
A saúde é definida como um valor coletivo, um bem de todos. Através do presente enquadramento, a racionalidade terapêutica apresenta-se como uma qualidade ou estado de sensatez, assente em evidência científica e justiça social, que aloca a terapia certa ao doente certo. Determinar a otimização para o comportamento racional na saúde, exige uma compreensão das políticas de saúde muito abrangente. Através da descrição do ciclo do medicamento e da análise dos seus end-points de controlo de qualidade no que respeita à racionalidade, identificam-se limitações e perspetivas. Mais especificamente a prescrição, pressupõe um trabalho paralelo, sonegado, cuja importância é extrema. E é essa componente o foco de desenvolvimento no Capítulo I. Do ponto de vista macro, importa perceber que concomitantemente à prescrição e integrada na mesma fase do ciclo do medicamento, existe a “Seleção de Medicamentos” preconizada por diferentes entidades e a vários níveis. Este conceito será alvo de análise dos seus contributos para a racionalidade terapêutica através da observação de alguns indicadores. À semelhança o ato da dispensa é a visão particular dentro do ciclo do medicamento. A visão holística será o “Acesso” já que sem acessibilidade adequada a racionalidade terapêutica não pode ser alcançada. Ao retratar as diferentes parcelas que constituem a acessibilidade ao medicamento no capítulo II, e novamente através de indicadores congruentes, intenta-se a análise de como estas contribuem para a racionalidade terapêutica.
Em virtude, somente após extensa e laboriosa caracterização do ciclo do medicamento, são concebidos os indicadores referentes tanto à seleção como ao acesso que mais se revelam portadores de informação congruente. Cada indicador, inerente aos três âmbitos; Psicossocial, Financeiro e Jurídico logra de uma reflexão disposta com clareza. Destaco ainda a pertinência da inclusão de como os serviços de saúde e a sua otimização e inerentemente, o uso do medicamento se relacionam com a perceção do valor da saúde.
4
Abstract
Health is defined as a collective value, a good for all. Through this framework, therapeutic rationality is presented as a quality or state of wisdom, based on scientific evidence and social justice, that designate the right therapy for the right patient. Set optimization for rational behavior in health requires a very hard understanding of health policies. By describing the drug cycle and analyzing quality control end-points for rationality, some limitations and perspectives are identified. More specifically, medical prescription leads to another subject whose importance is extreme. And this component is the focus of development in Chapter I. From the macro point of view, it is important to realize that prescription is integrated in the same phase of the drug cycle, as the “Selection of Medicines” and its various levels. This concept will be the subject of analysis through the observation of some indicators. Similarly, the act of setting drugs available is the particular view within the drug cycle. The holistic view will be “Access” since without adequate accessibility, therapeutic rationality couldn’t be achieved. The portraying of the different portions that constitute accessibility will figured in chapter II, and the intention is to analyze how they contribute to therapeutic rationality. Only after extensive and laborious characterization of the drug cycle, and the respective indicators is possible to figure out wich are the most congruente. Each indicator is included in three scopes; Psychosocial, Financial, and Legal. Also, is importante to highlight the relevance of including how health services and their optimization are related to the perception of health value.
5
Índice
Índice de Figuras………...………..………..….….6 Lista de Abreviaturas……….……….…...………...…7 1. Introdução e Enquadramento ... 9 2. Capítulo I – Seleção ... 15 2.1. Conceptualização ... 15 2.2. Parametrização ... 16 2.3. Indicadores... 17 2.3.1. Over-prescribing ... 17 2.3.1.1. Antibioterapia ... 172.3.1.2. Fármacos hipnóticos e ansiolíticos ... 19
2.3.1.3. Reflexão ... 20
2.4.1. Despesa corrente em cuidados de saúde ... 21
2.4.1.1. Despesa corrente em produtos farmacêuticos ... 22
2.4.1.2. Reflexão ... 23
2.5.1 Lista de Medicamentos Essenciais da OMS ... 23
2.5.1.1. Atualização da Lista de Medicamentos Essenciais da OMS ... 24
2.5.1.2. Reflexão ... 27
3. Capítulo II - Acesso ... 27
3.1. Conceptualização ... 27
3.2. Parametrização ... 29
3.3. Indicadores... 30
3.3.1. Acesso a medicamentos de elevado custo ... 30
3.3.1.1. Reflexão ... 34
3.3.2. Pagamento direto; Out-of-pocket (OPP) ... 35
3.3.2.1. Reflexão ... 38 3.3.3. Ruturas de medicamentos ... 39 3.3.3.1. Reflexão ... 40 4. Conclusões ... 40 5. Referências bibliográficas ... 42 Anexo………46
6
Índice de Figuras
Figura 1. Volume total de antibióticos prescritos, 2015 (ou ano mais próximo)………....18
Figura 2. Doentes idosos com prescrições de benzodiazepinas ou fármacos análogos,
por 1000 habitantes com idade igual ou superior a 65 anos, 2015 (ou ano mais
próximo)………..………..….……..20
Figura 3. Gastos em saúde (retail) per capita e como percentagem da despesa global em
saúde………..23
Figura 4. Top 5 dos grupos terapêuticos com mais encargos (janeiro – maio 2019) em
Milhões€………..…..32
Figura 5. Gastos públicos em saúde como percentagem do PIB e pagamentos diretos
como percentagem dos gastos públicos em saúde nas seis regiões mundiais……….…………..…..36
Figura 6. Despesas com saúde por tipo de financiamento, 2015 (ou ano mais próximo)
7
Lista de Abreviaturas
AIDS - Acquired Immune Deficiency Syndrome AIM- Autorização de introdução no mercado
ANSM - Agence nationale de sécurité du médicament et des produits santé ATC - Anatomical Therapeutic Chemical Classification
BPD - Boas Práticas de Distribuição de medicamentos de uso humano BZ - Benzodiazepinas
CEIC - Comissão de Ética para a Investigação Clínica
CNPEM - Código Nacional para a Prescrição Eletrónica de Medicamentos DCI - Denominação Comum Internacional
DDDs - Dose diária definida DGS - Direção Geral da Saúde
DMARDs - Disease-modifying anti-rheumatic drugs EMA - Agência Europeia de Medicamentos
FDA - U.S. Food and Drug Administration FNM - Formulário Nacional do Medicamento
GMP - Comissão de Ética para a Investigação Clínica I&D - Investigação e Desenvolvimento
IACS - Infeções Associadas aos Cuidados de Saúde ICER - Incremental cost-effectiveness ratio
INFARMED - Autoridade Nacional do Medicamento e Produtos de Saúde, I. P. IVA - Imposto sobre o valor acrescentado
LME - Lista de Medicamentos Essenciais
8 MSRM - Medicamento Sujeito a Receita Médica
MSRMR - Medicamento Sujeito a Receita Médica Restrita OE - Orçamento do Estado
OMS - Organização Mundial de Saúde OPP - Out-of-pocket
OTC - Over the counter
PAPs - Programas de Acesso Precoce
PEM - Prescrição eletrónica de medicamentos PIB - Produto Interno Bruto
PPCIRA - Programa Nacional de Prevenção e Controlo de Infeções e das Resistências aos Antimicrobianos
PPP - Paridade de poder de compra PRE - Preço de referência externo PrEP - Profilaxia pré-exposição
PVA - Preço de Venda ao Armazenista PVP - Preço de Venda ao Público QALY - Quality adjusted life year
RAM - Reações adversas a medicamentos RFAI - Regime Fiscal de Apoio ao Investimento
SIFIDE - Sistema de Incentivos Fiscais à I&D Empresarial SNS - Serviço Nacional de Saúde
TDF - Tenofovir disoproxil fumarato
TNFi - Inibidores do fator de necrose tumoral UE - União Europeia
9
1. Introdução e Enquadramento
O conceito de racionalidade terapêutica não carece de uma definição unanime, quer seja pela conceção abrangente ou restritiva, intemporal ou periódica. Não obstante, o juízo do que é “racionalidade” acarreta alguns pontos de harmonização. Inicialmente, e à luz da Organização Mundial de Saúde (OMS) é preciso olhar a saúde como uma multitude de fatores; todos complexos, todos passiveis de otimização e racionalidade. A saúde define-se por “um estado de completo bem-estar físico, mental e social, e não apenas a ausência de doenças.”. (1) É um direito social, inerente à condição de cidadania, que deve ser assegurado sem distinção de raça, religião, ideologia política ou condição socioeconômica.
Em 1979 com a publicação da Lei n.º 56/79, de 15 de setembro, a criação do Serviço Nacional de Saúde (SNS), que segue os princípios básicos de todos os sistemas Beveridge, veio mudar o panorama dos cuidados de saúde em Portugal, assegurando o acesso universal e gratuito aos cidadãos. (2) A saúde é assim apresentada como um valor coletivo, um bem de todos. Através deste enquadramento, a racionalidade apresenta-se como uma qualidade ou estado de sensatez, assente em evidência científica e justiça social.
Determinar a otimização para o comportamento racional na saúde, exige uma compreensão das políticas de saúde muito abrangente. Na presente dissertação o foco incidirá na conformidade terapêutica. O termo “terapia” provém do grego therapeia; prestar cuidados, tratar. Do grego, a palavra passou para o latim, e deste, para as línguas modernas com o sentido abrangente de qualquer meio ou procedimento usado no tratamento dos enfermos, no entanto, presentemente irá retratar somente a componente do medicamento. (3) Este estreitamento do termo advém de no decorrer das últimas três décadas os países europeus terem alcançado uma melhoria importante do nível de saúde das populações, cujos resultados se devem, não só à evolução dos cuidados primários, mas predominantemente à utilização de medicamentos. (4)
O medicamento, como um circuito, é fortemente regulado, o que asseguraconfiança à inovação terapêutica e ao mesmo tempo segurança, qualidade e eficácia dos medicamentos já utilizados. Durante todo o seu ciclo de vida, o medicamento de uso humano está sujeito a padrões, alicerçados numa atuação conjunta dos responsáveis pela sua colocação no mercado, das autoridades competentes nacionais e comunitárias.
Os diferentes intervenientes (fabricantes, distribuidores, prescritores, farmácias e Utilizadores) estão sujeitos a um conjunto de obrigações e procedimentos, competindo à agência reguladora acompanhar e garantir a sua aplicação. O ciclo de vida do medicamento
10 aporta desde montante a jusante várias etapas, das quais serão abordadas duas essências, através das quais se irá perspetivar alguns dos objetivos de racionalidade terapêutica inerentes a elas, e os respetivos indicadores.
A primeira etapa é a Investigação e Desenvolvimento (I&D) de um novo fármaco que é assumida por empresas e centros de investigação. A Inovação está no centro das transformações que ocorrem numa empresa e é trabalhada desde a Inovação de Gestão até à Inovação Produtiva. Da visão estratégica do comportamento de mercado advêm os melhores dados que permitem, consequentemente, tomar as decisões com coerência. Posteriormente, é no financiamento que asseguram os projetos quer seja através de candidaturas e gestão de créditos como o Regime Fiscal de Apoio ao Investimento (RFAI) e o Sistema de Incentivos Fiscais à I&D Empresarial (SIFIDE) quer através de financiamento externo. (5) A I&D apresenta como principal desafio o equilíbrio entre investimentos, projetos que tragam crescimento futuro, técnicas disruptivas e mudanças nos paradigmas da terapêutica, ao que este balanço nem sempre consegue ser racionalizado. O aumento exponencial das tecnologias altamente especializadas e a revolução do conhecimento dos sistemas biológicos, torna esta etapa cada vez mais seletiva a grandes multinacionais farmacêuticas. A integração deste estágio na racionalidade é visível nos esforços de criação de parcerias por parte das agências reguladoras com os maiores players da indústria. No contexto português, é somente possível um incentivo ao crescimento da investigação através do apoio científico e regulamentar que a agência do medicamento, INFARMED - Autoridade Nacional do Medicamento e Produtos de Saúde, I. P., pode prestar através da sua autonomia administrativa e financeira. (6)
Findo o processo inicial é imprescindível testar as soluções terapêuticas desenvolvidas e confirmar as descobertas e testes preliminares desenvolvidos em laboratório. Assim, os ensaios clínicos constituem a segunda etapa do ciclo do medicamento. Avaliam em três fases pré- autorização de introdução no mercado (AIM); Fase I, Fase II, Fase III: Perfil de segurança, perfil farmacocinético e farmacodinâmico; Eficácia terapêutica, determinação da dose e do regime terapêutico, relação dose/resposta; Demonstração/confirmação do benefício terapêutico; respetivamente. Cada fase é caracterizada pelo objetivo, pela polução envolvida e pela duração que pode variar de semanas a anos. Existe ainda a Fase IV, pós-AIM. É nesta etapa do ciclo que o INFARMED, enquanto autoridade nacional competente, inicia o seu processo de supervisão. (7) Na ponderação da autorização dos ensaios clínicos são considerados os aspetos científicos e, por serem realizados em humanos, os aspetos éticos que envolvem a sua realização. Particularmente, a Comissão de Ética para a Investigação Clínica (CEIC), segundo
11 o disposto na Lei nº 21/2014 de 16 de abril, garante a proteção dos direitos, da segurança e do bem-estar dos participantes nos estudos clínicos, através da emissão de um parecer ético sobre os protocolos de investigação que lhe são submetidos. Consequentemente a racionalidade fica patente na autorização ou indeferimento da realização do ensaio, abrangendo igualmente as estratégias de monitorização do cumprimento das boas práticas clínicas. (8)
Uma vez que Portugal é membro da União Europeia, a aprovação de medicamentos rege-se pelas normas e procedimentos que compõem o sistema europeu de regulamentação. Este compreende quatro procedimentos para concessão de AIM de um medicamento: Procedimento nacional; Procedimento de reconhecimento mútuo; Procedimento descentralizado; Procedimento centralizado. Este processo de avaliação de que são alvos os medicamentos de uso humano constituem a etapa seguinte do ciclo. O desígnio desta avaliação é determinar a relação risco-benefício, garantir a qualidade, segurança e eficácia. Se todas as condições forem cumpridas, então o medicamento obtém consentimento de comercialização. Este processo é altamente protocolado, e harmonizado ao nível europeu garantindo uma isenção e sensatez premente a todos os níveis. No entanto, e tendo em consideração que não há medicamentos isentos de risco, a autorização pressupõe sempre que a relação risco-benefício é favorável para o fim a que o medicamento se destina e nas condições de utilização aprovadas, autorização essa que usufrui da proteção dada pelos instrumentos legais. (9)
É chegada a etapa do fabrico total ou parcial de medicamentos para uso humano e/ou medicamentos experimentais. A legalidade do processo depende da obtenção de uma autorização junto do INFARMED, ao abrigo do Decreto-Lei n.º 176/2006, de 30 de agosto. O licenciamento industrial é coordenado pelo Ministério da Economia e da Inovação, sendo que esta entidade articula esforços com o INFARMED para garantir a qualidade de fabrico do medicamento e a adequação das instalações às especificidades dos mesmos. É ainda da responsabilidade da Agência Reguladora verificar o cumprimento das boas práticas de fabrico (Good Manufacturing Practice (GMP) Guidelines) que naturalmente devem estar acordo com os processos e procedimentos enunciados na fase de autorização. (10, 11)
A garantia de qualidade e segurança deve ser igualmente acautelada durante a fase de distribuição. Esta é definida legalmente pelo artigo 3.º do Estatuto do Medicamento como - "atividade de abastecimento, posse, armazenagem ou fornecimento de medicamentos destinados à transformação, revenda ou utilização em serviços médicos, unidades de saúde e farmácias, excluindo o fornecimento ao público." Semelhante ao processo de fabrico, a legalidade do processo de distribuição carece da obtenção de uma autorização junto do INFARMED, que somente será deferida se o requerente demonstrar que cumpre com as Boas
12 Práticas de Distribuição de medicamentos de uso humano (BPD). Para ambas as etapas estão estabelecidos procedimentos e princípios de gestão do risco referentes à responsabilidade das suas atividades. A avaliação que é efetuada em sede de inspeções regulares às instalações de estabelecimentos de fabrico e distribuição, permite uma monotorização próxima. (10,12) As guidelines traduzem assim a harmonização que abona à racionalidade do processo, garantindo que o produto fornecido mantém a sua qualidade, integridade e permanece na cadeia de abastecimento legal.
Alcançada esta fase importa que o medicamento entre numa modalidade clínica de prescrição e dispensa cuja comunicação entre profissionais de saúde de diferentes instituições e a agilização de processos sejam pratica padrão. Os medicamentos dividem-se nas classificações legais quanto à dispensa ao público; Medicamento Não-Sujeito a Receita Médica (MNSRM) |Medicamento Sujeito a Receita Médica (MSRM) | MSRM restrita alínea a) | MSRM restrita alínea b) | MSRM restrita alínea c). A prescrição é efetuada por Denominação Comum Internacional (DCI), com vista a centrar a prescrição médica na escolha farmacológica, fundamentada através de instrumentos de suporte à decisão clínica.
Numa tentativa de aumentar a segurança no processo de prescrição e dispensa, aquando da publicação da Portaria n.º 284-A/2016 que procede à terceira alteração à Portaria n.º 224/2015, e estabelece o regime jurídico a que obedecem as regras de prescrição e dispensa de medicamentos e produtos de saúde e define as obrigações de informação a prestar aos utentes, a legislação torna-se mais aguerrida. Definido pelaPortaria n.º 284-A/2016, nos termos e ao abrigo do n.º 6 do artigo 20:
“6 - A SPMS, E. P. E., deve implementar mecanismos de retorno de informação de prescrição e dispensa aos utentes que permitam que o utente tenha informação e efetue uma gestão racional do seu acesso ao medicamento, nomeadamente:
a) Mecanismos de retorno de informação ao utente, sobre, entre outros aspetos, prescrição, embalagens dispensadas, custos e validade;
b) Mecanismos de monitorização ativa da prescrição e da dispensa;
c) Reforço dos mecanismos informáticos de autenticação e verificação de identidade dos prescritores;
13 O esforço na otimização da gestão de informação terapêutica quer do ponto de vista interno quer do doente é premente. Não apenas através da monitorização que foi retratada em artigo, mas também por auditorias junto das instituições de saúde públicas e privadas e fabricantes de software. A prescrição eletrónica de medicamentos (PEM) contempla ainda outra vantagem na política de racionalização de recursos: Inclusão de orientações terapêuticas. A disponibilização de tais normas permite basear melhor a decisão farmacoterapêutica na mais recente evidência científica e num profundo conhecimento das relações benefício/risco e custo/efetividade com vista a aumentar a segurança da prescrição e minimizar o desperdício. De forma a harmonizar as regras e garantir o rigor das várias soluções de prescrição médica eletrónica existentes, nunca esquecendo toda a complexidades inerente a cada indivíduo, esta parece ser, juntamente com a articulação de bases de dados licenciadas, uma ação profícua. (13) No entanto, esta visão talvez exígua do que é a prescrição, pressupõe um trabalho paralelo, sonegado, cuja importância é extrema. E é essa componente o foco de desenvolvimento no Capítulo I. Do ponto de vista macro importa perceber que concomitantemente à prescrição, e integrada na mesma fase do ciclo do medicamento, existe a “Seleção de Medicamentos” preconizada por diferentes entidades e a vários níveis. Este conceito será alvo de análise dos seus contributos para a racionalidade terapêutica através da observação de alguns indicadores.
Progredindo para a dispensa, mais concretamente, relativamente ao farmacêutico, e à exclusiva competência e responsabilidade inerente ao ato farmacêutico, importa descortinar: “Artigo 76.º Do acto farmacêutico
…
e) Preparação, controlo, selecção, aquisição, armazenamento e dispensa de medicamentos de uso humano e veterinário e de dispositivos médicos em farmácias abertas ao público, serviços farmacêuticos hospitalares e serviços farmacêuticos privativos de quaisquer outras entidades públicas e privadas, sem prejuízo do regime de distribuição ao público de medicamentos não sujeitos a receita médica fora das farmácias, nos termos da legislação respectiva;”
Ao manifestar estas competências profissionais, é fulcral visar que o farmacêutico exerce uma profissão livre, cujas funções são de inteira autonomia técnica e científica. Quer como profissional liberal quer como trabalhador por conta de outrem, a soberania profissional é sólida e não pode ser influenciada ou corrompida. Independentemente da entidade, hospital
14 da rede púbica ou privada, farmácia, ou outro estabelecimento autorizado, as normas de competência profissional e de dispensa mantêm-se. (14) Outro aspeto chave da dispensa é a obrigatoriedade de o farmacêutico informar o utente de que este tem direito de opção na escolha do medicamento, sempre que tal o seja permitido. O farmacêutico tem ainda de informar o utente sobre o medicamento comercializado que seja similar (medicamento similar: aquele que têm a mesma substância ativa, dosagem, forma farmacêutica e tamanhos de embalagens equivalentes; mesmo Código Nacional para a Prescrição Eletrónica de Medicamentos (CNPEM)) ao prescrito e apresente o preço mais baixo, como forma de auferir ao utente o livre arbítrio absoluto. Cumpridas as normas compete ao INFARMED licenciar a atividade dos espaços autorizados à dispensa de medicamentos e controlar a contínua aplicação da sua correta manutenção e qualidade do serviço, através da aplicação das regras de Boas Práticas de Farmácia e de Boas Praticas de Farmácia Hospitalar. (15,16,17)
No entanto, e à semelhança da prescrição, o ato da dispensa é a visão particular dentro do ciclo do medicamento. A visão holística será o “Acesso”, já que sem acessibilidade adequada a racionalidade terapêutica não pode ser alcançada. Ao retratar as diferentes parcelas que constituem a acessibilidade ao medicamento no capítulo II, e novamente através de indicadores congruentes, intenta-se a análise de como estas contribuem para a racionalidade terapêutica.
Finalmente, é comummente considerado que a toma efetiva do medicamento pelo doente na sua finalidade terapêutica, preventiva ou diagnóstica é a última fase do ciclo. Os dados de utilização e consumo marcam assim o término, ainda que também acarretem a responsabilidade de renovação. (4) Conforme referido o ciclo é um fenómeno periódico que se quer dinâmico e com uma infinidade de otimizações possíveis. É importante notar que transversalmente a todas as fases do ciclo é possível recolher informação. No entanto, é a forma como os dados são disponibilizados, analisados e integrados que permite a evolução deste. Não há ainda resposta para o desafio da velocidade de integração de dados e informação (pré e pós comercialização) no processo, todavia apazigua a certeza de que o foco continua a ser os ganhos em saúde. Os objetivos civilizacionais no que toca a uma terapêutica racional, em última instância, transcendem em muito os indicadores que serão apresentados, no entanto, só assim é possível expor dados que são mensuráveis e passiveis de compreensão e análise.
15
2. Capítulo I – Seleção
2.1. Conceptualização
A Seleção de Medicamentos é definida pela OMS como “Um processo contínuo, multidisciplinar e participativo, que pretende assegurar o acesso aos medicamentos essenciais a um determinado nível do sistema sanitário, tendo em conta a eficácia, segurança, qualidade e custo dos mesmos, para além de promover o uso racional de medicamentos”. (18) Visando traçar uma narrativa querente importa perceber a evolução da dificuldade deste processo que se quer continuo e, portanto, mutável. No passado a publicação do primeiro relatório de saúde mundial acarretou a pesada divulgação de um estado de saúde mundial precário, cuja primeira e mais implacável cause de morte era a extrema pobreza. Globalmente o grupo das doenças infeciosas e parasitas era o que mais vidas tirava anualmente. Já no prisma da incidência era a diarreia em crianças com menos de 5 anos seguida das doenças sexualmente transmitidas com 1.8 mil milhões e 297 milhões números de novos casos, respetivamente, que ocupavam os lugares no topo. Estes dados proporcionam uma análise ao desfasamento relativo à atualidade. Outrora, as prioridades prendiam-se nos cuidados mais básicos e no acesso universal, ao invés do cuidado preventivo, preditivo e personalizado da medicina atual, e na consequente seleção criteriosa. (19,20)
Atualmente, na região europeia, as pessoas vivem em média mais um ano do que viviam há cinco anos, e os progressos alcançados na redução das mortes por todas as causas, em todas as idades, desde o início do milénio, são de uma redução de cerca de 25% em 15 anos. Contudo, opostamente à pobreza do passado, paradoxalmente são os fatores relacionados ao estilo de vida excessivo que carecem de mais preocupação na atualidade. As taxas de tabagismo são as mais altas do mundo com uma em cada três pessoas com mais de 15 anos a fumar; o consumo de álcool em adultos é o mais alto do mundo e mais de metade da população tem peso a mais. (21)
O envelhecimento gradual da população, com um horizonte repleto de idosos polimedicados e o desenho das novas incidências resulta na adaptação do processo de seleção e respetivos critérios, como medida fundamental de racionalidade terapêutica. Importa ainda acrescentar que os medicamentos aparecem e desaparecem do mercado com uma vida média de 14 anos, pelo que a disponibilidade de um número elevado de medicamentos com indicações clínicas similares, a dificuldade na atualização constante dado o grande volume de informação
16 publicada e o marketing da Indústria Farmacêutica com uma forte componente de promoção comercial, são igualmente fatores preponderantes neste processo.
2.2. Parametrização
Após uma caracterização importa definir que a seleção é preconizada por diferentes entidades e a vários níveis. No core da decisão está o doente, constituindo este o primeiro nível através do seu medico prescritor. Seguidamente está o nível dos cuidados de saúde primários e também o nível hospitalar, ambos através do uso de Formulário de Medicamentos. O seguinte nível de seleção é o nacional (de cada país) através de AIM (Entidades Reguladoras, INFARMED I.P., Agence nationale de sécurité du médicament et des produits santé (ANSM), U.S. Food and Drug Administration (FDA), ..., etc.). Finalmente, e na abrangência a nível mundial, a seleção está preconizada na lista de medicamentos essências da OMS. Os indicadores que permitirão a análise da dependência entre «seleção de medicamentos» e «racionalidade terapêutica» foram selecionados pela inter-correlação aos diferentes níveis, pela pertinência e pela acessibilidade da informação. Estes foram ainda catalogados em três características pela forma como poderão ou não impactar a racionalidade. As categorias são:
A grande amplitude do mercado farmacêutico com 16 976 medicamentos (Igual Nome do Medicamento, Dosagem e Forma Farmacêutica), 9002 medicamentos marcas e 54 529 apresentações comerciais diferentes tece o prisma de quão impactante poderá ser a «seleção de medicamentos» na «racionalidade terapêutica». (22) Este é um problema concreto, não-empírico, cuja relevância humana e operativa é contemporânea. Carece de interesse quer pela comunidade científica e governos como pela sociedade em geral.
Psicossocial Financeira
17
2.3. Indicadores
2.3.1.
Over-prescribingRecentemente, dados da Organização para a Cooperação e Desenvolvimento Económico sugerem que um quinto dos gastos em saúde é desperdiçado. No entanto, apontam ainda que tais desperdícios podem ser eliminados sem detrimento da performance do sistema de saúde. Carece fazer-se notar que cerca de 9.6% do produto interno bruto Europeu é direcionado para a saúde. Tendo em conta que os produtos farmacêuticos representam a terceira maior fatia do total dos gastos, é incontestável que o esforço para tentar perceber como a seleção de medicamentos impacta o desperdício, e consequentemente a racionalidade terapêutica, é oportuno. No relatório Health at a Glance 2018 foram identificadas diferentes medidas aos vários níveis para abordar o problema, sendo que relativamente à seleção de medicamentos os indicadores característicos seguem-se explicitados. Foi preterido o primeiro nível do processo de seleção através do médico prescritor nos cuidados de saúde primários. (23)
Principiando a análise com o nível indicado pode identificar-se a prescrição em excesso (over-prescribing) como o aspeto na qual a seleção inerente mais se repercute na racionalidade terapêutica. Pretende-se pois, explicitar a ineficiência ou não do processo. A prescrição em excesso não só desperdiça recursos como aumenta o risco de falha terapêutica, de ocorrência de efeitos adversos e também aumenta a resistência aos antibióticos. Os dois grupos de medicamentos que são frequentemente alvo de prescrição excessiva, e cuja implicação para a saúde publica é particular são portanto, os antibióticos e os ansiolíticos/hipnóticos (principalmente as benzodiazepinas).
2.3.1.1. Antibioterapia
Os antibióticos devem ser prescritos somente quando existe uma evidência fundamentada para a sua utilização. Por exemplo as quinolonas e cefalosporinas são antibióticos de segunda linha de acordo com as principais guidelines, cuja prescrição se deve restringir apenas na ineficácia da primeira linha. O volume total de antibióticos prescrito e os antibióticos de segunda linha em proporção ao volume total são indicadores convenientes à análise (Figura 1).
18
Nota: Dados referentes a todos os setores (não somente cuidados primários)
Figura 1. Volume total de antibióticos prescritos, 2015 (ou ano mais próximo) Dados: European Centre
for Disease Prevention and Control and OECD Health Statistics 2017.
A resistência aos antibióticos representa um fardo em crescendo no espetro social global. O indicador retratado inclui-se portanto, na categoria psicossocial, ao que os dados apontam uma projeção de 33 000 mortes por ano, somente na União Europeia (UE), entre 2015 e 2050 por esta causa.
Em adição, a prescrição em excesso aporta outros custos quer diretos quer indiretos. Colocar os doentes em risco de ocorrência de efeitos adversos (e os custos para os tratar) e a medicalização de condições cuja antibioterapia não é útil, são somente alguns exemplos. Pode-se perceber através da análiPode-se (Figura 1) que do total da doPode-se diária definida (DDDs) por 1 000 habitantes, por dia, prescritas em Portugal (não somente em cuidados primários) 17% correspondem a antibioterapia de segunda linha. É ainda visível que embora haja poucas evidências das diferenças existentes ao nível da prevalência das doenças infeciosas nos diferentes países, o rácio de prescrição entre eles é díspar.
Importa ainda notar que embora os dados apresentados não cubram somente os cuidados primários, estes representam 80 a 90% de toda a prescrição pelo que as elações são aceitáveis. (24,25)
Adicionalmente, no período que compreende 2015 a 2017 já existem dados nacionais que posicionam a evolução do consumo de cefalosporinas e fluoroquinolonas em ambulatório (no qual se incluem os cuidados primários). Os dois subgrupos farmacológicos apresentam evoluções divergentes. O consumo de cefalosporinas (Anatomical Therapeutic Chemical Classification (ATC) J01DB, J01DC, J01DD e J01DE) em ambulatório neste período sofreu
0 5 10 15 20 25 30 35 2015 - All 2015 - 2nd line
DDDs por 1 000 habitantes, por dia
19 um ligeiro aumento, cerca de 5,5%, ao passo que o consumo de fluoroquinolonas (ATC J01MA) em ambulatório referente ao mesmo período diminuiu significativamente, - 39%. (22)
2.3.1.2. Fármacos hipnóticos e ansiolíticos
Os níveis de prescrição de fármacos hipnóticos e ansiolíticos, especialmente entre a população idosa, é outro indicador de como a seleção criteriosa e racional impacta o sucesso da terapêutica cujo retrato se inclui igualmente na categoria psicossocial.
As normas de orientação clínicas vigentes em Portugal apontam que as benzodiazepinas (BZ) e fármacos análogos têm indicação no tratamento da ansiedade e da insónia quando os sintomas assumem carácter patológico. Não devem ser utilizadas por rotina no tratamento sintomático da ansiedade ou insónias ligeiras a moderadas. Tanto no tratamento da ansiedade como na insónia, não deve ser prescrito mais que uma benzodiazepina ansiolítica e uma benzodiazepina hipnótica ou um fármaco análogo, respetivamente. As BZ e fármacos análogos são, no entanto, frequentemente prescritos a idosos, apesar dos riscos bem documentados de efeitos adversos como fadiga, tonturas e confusão. O uso crónico também se pode traduzir em efeitos mais severos como quedas e acidentes em sobredosagem, tolerância, aumento desajustado da dosagem e dependência, comprometimento cognitivo a longo prazo e pseudo- demência.
As questões decorrentes do uso prolongado, impõem também a preocupação com os tipos de BZ que são prescritos no grupo etário de 65 anos ou mais. Em particular, as BZ e fármacos análogos de libertação prolongada figuram na Lista de Beers, a qual contempla medicamentos considerados inapropriados e/ou pouco seguros para serem administrados em geriatria. O critério de prescrição deste tipo de BZ deve ter em conta as alterações fisiológicas e farmacocinéticas, pelo que a análise dos dados (Figura 2) é pertinente no desenho de seleção racional. (26,27)
Os dados indicam que nos países da Organização para a Cooperação e Desenvolvimento Económico (OCDE), em média, cerca de 25 em 1000 idosos usam cronicamente BZ (> 365 doses diárias definidas por ano) e 64 em 1000 idosos receberam pelo menos uma prescrição de BZ de libertação prolongada no espaço de um ano. Ainda que a disponibilização de dados seja escassa é possível verificar uma grande variação nas tendências de prescrição. Portugal coloca-se como um país em que ambos os indicadores estão acima dos valores médios dos paícoloca-ses membros da OCDE num rácio de 1,37 nas prescrições de BZ e fármacos análogos de libertação prolongada e 2,17 nas prescrições de uso crónico.
20 Tal diferença poderá dever-se às políticas de comparticipação e prescrição de BZ e fármacos análogos dispares entre os diferentes países e ainda ao facto de os dados não estarem ajustados às prevalências das patologias assim como às nuances presentes nas guidelines. (23)
Figura 2. Doentes idosos com prescrições de benzodiazepinas ou fármacos análogos, por 1000 habitantes com idade igual ou superior a 65 anos, 2015 (ou ano mais próximo) Dados: OECD Health Statistics
2018.
2.3.1.3. Reflexão
Além da mortalidade e morbidade associadas, estas tendências na prescrição quer da antibioterapia quer das BZ e fármacos análogos impõem custos adicionais substanciais e potencialmente evitáveis aos sistemas de saúde. Foi demonstrado que a variação entre os padrões de prescrição é de causa multifatorial, podendo ser dividida entre o lado de quem fornece e o de quem recebe. Quem viabiliza a prescrição é influenciado por diferenças na regulação e nas guidelines, incentivos financeiros e influências da indústria farmacêutica, atitudes e crenças relativas ao valor da terapêutica, incertezas no diagnostico, percentagens de genéricos no mercado e ainda pela forma como o sistema de saúde costeia ou reembolsa. Do lado do paciente, são as diferentes expectativas e as atitudes coerentes a crenças culturais que mais impactam na oscilação. É notório que as medidas de contenção do over-prescribing passam pela consciencialização tanto dos profissionais de saúde como da população através da melhoria dos níveis de literacia em saúde. (25) Em Portugal, relativamente à antibioterapia, a criação do Programa Nacional de Prevenção e Controlo de Infeções e das Resistências aos Antimicrobianos (PPCIRA) surgiu como uma resposta integrada que se prolonga da Direção Geral da Saúde (DGS) até às unidades de saúde. Sejam elas unidades locais de saúde, centros
150 113 102 85 82 57 36 31 20 9 64 5 18 n.a. 54 67 44 18 18 34 27 25 0 20 40 60 80 100 120 140 160
Estónia Eslovénia Espanha Portugal Irlanda Noruega Holanda Dinamarca Suécia Finlândia OECD 17 Por 1 000 habitantes com 65 ou mais anos
Elderly patients with prescriptions for long-acting benzodiazepines or related drugs
Elderly patients with long-term prescriptions for benzodiazepines or related drugs Per 1 000 persons aged 65 years and over
Doentes idosos com prescrições de benzodiazepinas de longa ação, ou fármacos análogos
21 hospitalares, hospitais, agrupamentos de centros de saúde, ou unidades de cuidados continuados. Os pilares de atuação são a redução da emergência de resistências aos antimicrobianos, promovendo o uso racional destes fármacos. Paralelamente, a promoção de boas práticas de prevenção e controlo da infeção permitirão reduzir a transmissão e a incidência da infeção, reduzindo as situações em que é necessária prescrição antibiótica. O terceiro pilar prende-se à Vigilância Epidemiológica, que permite monitorizar as boas práticas, as Infeções Associadas aos Cuidados de Saúde (IACS) e as reações adversas a medicamentos (RAM) e aplicar planos de melhoria. (28)
Em suma, quando o processo de seleção é erróneo a gama de consequências é extensa: Prejudica-se inutilmente o doente; ou os cuidados recebidos são de baixo valor, pois aportam pouca ou nenhuma diferença aos seus indicadores em saúde. Verifica-se pois, que a obtenção dos mesmos resultados pode ser alcançada com o uso de menos recursos. Num sistema económico debilitado colocar o desperdício como alvo comporta garantias de que os esforços de contenção de custos adicionais não comprometem a qualidade e os indicadores, ao aportar resiliência ao sistema. Por outro lado, num sistema económico robusto, a gestão do desperdício é vista como uma medida de estratégia sólida no aumento da qualidade. Tal permite ainda a disponibilização de recursos que podem ser alocados a áreas carenciadas, garantindo acessibilidade que outrora estava talhada a poucos. Em última instância, o progresso na redução do desperdício poderá ser visto não somente como um barómetro de melhoria da qualidade, mas também como um marco financeiro e ético na procura por um sistema de saúde mais resiliente, equitativo e racional. (25)
2.4.1. Despesa corrente em cuidados de saúde
É impossível abordar o processo de seleção de terapêutica racional, sem perceber qual o impacto económico da saúde nos orçamentos cada vez mais polivalentes e disputados dos países. É notória a variação dos níveis de despesa entre os países da UE, quer em termos de despesa per capita quer em proporção à despesa relativa ao Produto Interno Bruto (PIB). Em 2017 Portugal apresentava uma despesa em saúde de 2066 euros per capita (ajuste em paridade de poder de compra (PPP)), abaixo dos valores da UE de 2773 euros, dados influenciados por determinantes não só económico-financeiros e sociais, bem como pelas estruturas dos sistemas de saúde e de financiamento dos mesmos.
De notar que na UE a despesa em saúde per capita aumentou cerca de 1,9% ao ano em termos reais (ajustado para inflação) entre 2013 e 2017, em comparação com uma taxa de
22 crescimento anual de apenas 0,6% entre 2009 e 2013, período marcado pela crise económica. Em relação à despesa com saúde em percentagem do PIB, Portugal apresenta um valor de 9%, próximo dos valores da UE, já previamente referido (9,6%).
A compreensão das diferentes dinâmicas destes valores é complexa pois a despesa com saúde em percentagem do PIB deve ser considerada em conjunto com a despesa em saúde per capita. Enquanto países de alto rendimento económico tendem a fracionar mais dessa receita para a saúde, países com despesas relativamente elevadas per capita podem apresentar despesas com saúde em percentagem do PIB relativamente baixas, e vice-versa. De notar que no contexto português, a taxa de crescimento nominal da despesa corrente em saúde em 2017 foi inferior à evolução do PIB (-0,8 p.p.), à semelhança do que ocorreu no período 2010-2015. Para 2018 as estimativas preliminares apontam para um aumento da despesa corrente superior em 1,5 p.p. à variação nominal do PIB. (29,30)
2.4.1.1. Despesa corrente em produtos farmacêuticos
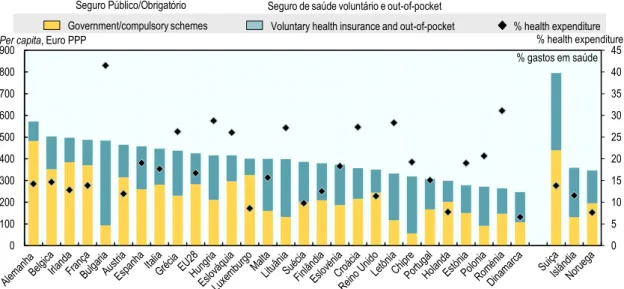
Importa agora, traçado este perfil macro, introduzir o indicador de quanto se gasta efetivamente em produtos farmacêuticos (retail) per capita e qual o rácio para a despesa global em saúde. Este inclui-se na categoria financeira. Os produtos farmacêuticos representam a terceira maior parcela da despesa, somente ultrapassados pelos cuidados inpatient e outpatient. Em 2016, na média dos países da UE, os fármacos suprimiam 16,8% da despesa total em saúde. Portugal posiciona-se abaixo com um valor de 15,1%. Traduzindo para valor monetário, Portugal surge como um dos países com menor despesa em medicamentos per capita (308 euros), situando-se 26% abaixo do valor da UE (417 euros per capita), conforme evidenciado (Figura 3). É possível auferir ainda pela análise que o rácio de despesa entre prestadores é equitativo, pois dos 308 euros, 167 euros (PPP) são atribuídos ao governo e a sistemas de descontos obrigatórios, enquanto que 141 euros (PPP) referem-se a seguros voluntários de saúde ou a dinheiro out-of-pocket (pagamento direto). (30,31)
23 Seguro Público/Obrigatório Seguro de saúde voluntário e out-of-pocket
Nota: Fármacos usados em hospitais podiam adicionar outros 30% de gastos, aos gastos em retail.
Figura 3. Gastos em saúde (retail) per capita e como percentagem da despesa global em saúde. 2016 Dados: OECD Health Statistics 2018 and Eurostat Database.
2.4.1.2. Reflexão
A variabilidade verificada na despesa com medicamentos per capita pode refletir diferenças nos preços, nas práticas de prescrição e dispensa, no consumo, bem como nas quotas de genéricos e biossimilares dos diversos países. O acompanhamento das tendências em despesa com produtos farmacêuticos constitui parte importante na perceção da evolução dos gastos globais em saúde. Embora um nível elevado de gastos, por si só não indique desperdício, otimizar o valor efetivo do dinheiro na seleção e acesso, assim como nas compras e definição de preço, permitirá negociar ao nível dos diferentes players na procura e na oferta. Em adição, identificar e eliminar as más praticas são ambas medidas críticas na obtenção de eficiência e sustentabilidade terapêutica.
2.5.1 Lista de Medicamentos Essenciais da OMS
Avaliado o impacto psicossocial e financeiro dos produtos farmacêuticos é substancial perceber como a seleção a nível global, com a Lista de Medicamentos Essenciais (LME) da OMS, se contrapõem à crescente introdução de novas moléculas no mercado e às novas indicações e de como esta impacta o sistema jurídico.
Na maioria dos países desenvolvidos, os gastos com produtos farmacêuticos representam menos de um quinto do total de gastos - Portugal 15,1% - em economias de
0 5 10 15 20 25 30 35 40 45 0 100 200 300 400 500 600 700 800 900
Per capita, Euro PPPGovernment/compulsory schemes Voluntary health insurance and out-of-pocket % health expenditure% health expenditure
24 transição os valores já representam 15 a 30% dos gastos, enquanto que nos países em desenvolvimento este valor pode variar entre 25 e 66%. Ainda assim, apesar do potencial impacto em saúde dos medicamentos essenciais, a falta de acesso, o uso irracional e a má qualidade dos mesmos continuam a ser sérios problemas de saúde pública globais, pelo que a adaptação do processo de seleção é essencial. (30)
O conceito de medicamentos essenciais pretende-se orientado para o futuro. Os Medicamentos essenciais são aqueles que satisfazem as necessidades prioritárias de cuidados de saúde da população; Estes são selecionados tendo em consideração a prevalência da doença, as evidências sobre a eficácia e a segurança e o respetivo rácio. Por fim, referenciando o objetivo de criação de tal lista: Os medicamentos essenciais devem estar disponíveis no contexto dos sistemas de saúde operacionais, em quantidades adequadas, nas formas farmacêuticas apropriadas, com qualidade assegurada e a um preço que quer o doente quer a sociedade possam pagar. Esta definição incorpora ainda a necessidade da LME integrar uma revisão regular a fim de refletir as novas opções e mudanças nas necessidades terapêuticas; a necessidade de garantir a qualidade dos medicamentos; a necessidade de investigação contínua de melhores moléculas; a presença de medicamentos para doenças emergentes e medicamentos para enfrentar os padrões de resistência atuais. (32,33)
2.5.1.1. Atualização da Lista de Medicamentos Essenciais da OMS
A OMS publicou a primeira LME em 1977 e identificou 208 medicamentos individuais que na sua amplitude terapêutica poderiam fornecer tratamento seguro e eficaz para a maioria das doenças transmissíveis e não transmissíveis. Atualmente a vigésima primeira edição da LME, está dividida em produtos farmacêuticos centrais e produtos farmacêuticos complementares. Os elementos essenciais são considerados as opções com melhor relação custo-benefício para os principais problemas de saúde e podem ser usados mesmo em situações onde existem poucos recursos clínicos. Os elementos complementares tanto podem necessitar de infraestruturas adicionais, como formação de profissionais de saúde ou equipamento médico de diagnóstico, como apresentar menor relação custo-benefício. Embora a lista vigente seja a vigésima primeira (2019) os dados disponíveis mais recentes são relativos à vigésima LMS (2017), pelo que a analise seguinte focar-se-á nas diferenças vigentes da décima nona para a vigésima LMS da OMS.
É importante notar que da décima nona para a vigésima LMS da OMS o Comitê de Especialistas considerou 92 pedidos, incluindo propostas para adicionar 41 novos
25 medicamentos, estender as indicações para 6 medicamentos já listados previamente, 5 aplicações para excluir medicamentos da lista e uma revisão abrangente dos antibacterianos e do seu uso no tratamento de patologias infeciosas. De acordo com os procedimentos de seleção já referidos, o Comitê de Especialistas avaliou a evidência científica de eficácia comparativa, segurança e relação custo-eficácia dos medicamentos.
Desta ponderação resultaram a adição de 30 novos medicamentos à LME (17 à lista central e 13 à lista complementar), e ainda a inclusão de indicações adicionais para 9 medicamentos já previamente incluídos. (34,35,36,37)
Repartindo os medicamentos por grupo terapêutico o segundo, depois dos antibióticos, para o qual foram adicionados mais medicamentos foi os antirretrovirais; Vírus da imunodeficiência humana (VIH). Observando as Diretrizes da OMS atualizadas (2016) sobre o uso de medicamentos antirretrovirais para tratamento e prevenção da infecção pelo VIH, o Comitê de Especialistas recomendou a adição de dolutegravir e raltegravir à LME. Também foi recomendada a indicação adicional de profilaxia pré-exposição (PrEP) para o tenofovir disoproxil fumarato (TDF), isoladamente ou em combinação com emtricitabina ou lamivudina. As formulações propostas contendo tenofovir alafenamida não foram incluídas. Houve ainda uma exclusão extensa de 26 diferentes formulações antirretrovirais, em conformidade com a não recomendação pelas diretrizes da OMS. Ainda referente às patologias infeciosas, foram adicionadas duas combinações de dose fixa para o tratamento da malária e dois antimicóticos para o tratamento de infeções fúngicas. Foi ainda incluída uma combinação de dose fixa para o tratamento da hepatite C que combina sofosbuvir e velpatasvir cujos dados de eficácia de cura são muito elevados. (35,37,38)
Relativamente aos medicamentos citotóxicos o Comitê de Especialistas recomendou a adição de dasatinib e nilotinib à lista complementar da LME para o tratamento de leucemia mieloide crônica cuja resistência ao imatinib foi reportada previamente. O Ácido zoledrônico, um bifosfonato foi incluído com a indicação para a utilização em doentes com metástases ósseas. Foi decidido a não inclusão de diversos outros medicamentos para o tratamento de patologias oncológicas por se considerar que a listagem desses medicamentos seria prematura.
Relativamente aos opioides analgésicos foi considerada uma revisão da metadona, fentanil e tramadol para o tratamento da dor oncológica. Assimilada a necessidade de inclusão de opções mais diversas, é observado que o acesso à morfina é limitado e que os doentes oncológicos em países de baixo e médio rendimento geralmente não recebem qualquer tratamento para o alívio da dor. Por conseguinte, o Comitê recomendou a adição de fentanil
26 transdérmico à lista principal da LME e a adição de uma nova indicação da metadona para o tratamento da dor oncológica à lista complementar da LME. O tramadol não foi adicionado pois as evidências disponíveis advertem que este apresenta inferioridade terapêutica relativa à morfina e outros comparadores opioides fortes. (35,37,39,40)
Mais pontualmente, para o tratamento da anemia em pacientes com doença renal crônica que necessitam de diálise, foram adicionados os agentes estimulantes da eritropoiese à lista complementar da LME. Também para o tratamento sintomático da asma foi incluída a associação budesonida/formoterol, uma combinação de glucocorticoide e um β2-agonista de longa ação. A Lamotrigina, um antiepilético e estabilizador de humor foi adicionado a LME na indicação de epilepsia. Foram ainda adicionados dois novos contracetivos à LME: acetato ulipristal; contraceção de emergência; e uma nova formulação: acetato de medroxiprogesterona injetável.
Relativamente a medicamentos do aparelho cardiovascular foi adicionado o losartan na indicação de hipertensão arterial. Não foi recomendada a adição de duas associações de doses fixas; prevenção secundária de eventos cardiovasculares (aspirina + atorvastatina + ramipril); hipertensão (lisinopril + hidroclorotiazida). Apesar disso, o Comitê reconheceu que para doenças não transmissíveis pode haver vantagens sobre os medicamentos de toma única/concomitante, nomeadamente o aumento da adesão. No entanto, considerou também que a sua inclusão iria limitar a escolha, pelo que sugeriu uma adenda que incentiva os países a analisarem o que se adequa mais à sua realidade.
Finalmente, a classe cujas alterações foram mais profundas foi a antibioterapia. Tal deve-se à intenção de ir ao encontro do Plano de Ação Global da OMS relativo à resistência antimicrobiana que visa "otimizar o uso de medicamentos antimicrobianos na saúde humana e animal". É ainda importante notar que alguns antibacterianos listados, são também alternativa para o tratamento da tuberculose resistente. Após consideração cuidadosa das propostas apresentadas, o Comitê decidiu incluir apenas tratamentos para infeções comuns adquiridas na comunidade, excluindo infeções raras ou adquiridas em hospitais, catalogadas através da identificação empírica amplamente aplicável na maioria dos países.
Sabendo da necessidade global de uma administração antimicrobiana eficaz, bem como a necessidade de garantir o acesso e prescrição adequada, decidiu-se a categorização dos antibióticos em três grupos: «Acesso», grupo que inclui antibióticos recomendados como opções empíricas de tratamento de primeira ou segunda linha para infeções comuns, que devem estar amplamente disponíveis, a um custo acessível em formulações apropriadas e de qualidade, e que estão listados na LME; «Vigilância», grupo que inclui classes de antibióticos cujo
27 potencial de criação de resistências é mais elevado, e que não são recomendados como tratamentos de primeira ou segunda linha, mas sim para um número muito limitado de indicações; «Reserva», grupo de antibióticos de último recurso, adaptados a situações altamente especificas e usados quando todas as outras alternativas já falharam (risco de vida devido a bactérias multi-resistentes), que devem estar envoltos em relatórios de monitorização e utilização para preservar a sua eficácia. (35, 37, 41)
Todos os novos medicamentos adicionados e os cuja indicação é nova ou foi retificada estão explicitados em anexo.
2.5.1.2. Reflexão
Outrora considerada relevante apenas em contextos com recursos limitados, a LMS da OMS é atualmente vista como igualmente relevante para países de alto, médio e baixo rendimento, particularmente com a inclusão de novos medicamentos altamente eficazes e dispendiosos na última década. Através da análise da LME, pode-se auferir quais as patologias que mais alterações sofreram no seu arsenal terapêutico e ainda quais as prioritárias para a OMS. Em paralelo, e a nível nacional, o Formulário Nacional do Medicamento (FNM) é um documento de seleção criteriosa que embora não se equiparando à LME, vai captar as suas diretrizes e adaptá-las. Recentemente, com a renovação e retificação do FNM, no âmbito dos medicamentos hospitalares, as áreas prioritárias foram definidas de acordo com os seguintes critérios: Nível elevado de consumo de medicamentos no Serviço Nacional de Saúde; Áreas com medicamentos recentemente aprovados ou em avaliação; Áreas com assimetrias nos padrões de utilização dos medicamentos. Tal semelhança no processo de seleção, transposta obviamente de um prisma nacional para um global, é notória, ao que a inquietude com uma terapêutica racional e equitativa parece estar presente.
3. Capítulo II - Acesso
3.1. Conceptualização
O conceito de acesso em saúde é parametrizado em três aspetos e pode referir-se aos diferentes níveis de cuidado. O primeiro aspeto, de acordo com a OMS, é a acessibilidade física que se entende como a “disponibilidade de bons serviços de saúde ao alcance razoável daqueles
28 que deles precisam, do respetivo horário de funcionamento, dos sistemas de marcação de consultas e ainda de outros aspetos da organização e prestação de serviços, que permitam às pessoas obter os serviços quando precisam efetivamente deles”. De igual modo, conforme definido no contexto dos direitos humanos, “[as] instalações, bens e serviços de saúde devem estar ao alcance físico seguro de todas as frações da população, especialmente grupos vulneráveis ou marginalizados, como minorias étnicas e populações indígenas, mulheres, crianças, adolescentes, idosos, pessoas com deficiência e pessoas com HIV / AIDS, inclusive nas áreas rurais”.
O segundo aspeto da acessibilidade prende-se com a economia. A acessibilidade económica traduz a "medida da capacidade do individuo de pagar por serviços sem dificuldades financeiras. Acarreta não apenas o preço dos serviços de saúde, mas também os custos indiretos e extras (por exemplo; custos de transporte de e para as instalações e o afastamento do trabalho).” Os rendimentos do agregado familiar e os métodos de financiamento dos respetivos sistemas de saúde são os influenciadores macro inerentes à visão de acessibilidade como um todo. Finalmente, mesmo estando presente a acessibilidade física e monetária, se o individuo carecer de acesso a informação relevante para a sua condição, os cuidados de saúde podem não corresponder ao requerido. Assim, a acessibilidade à informação constitui o terceiro aspeto do acesso em saúde. Deste modo inclui o “direito de procurar, receber e transmitir informações e pensamentos relativos a questões de saúde”. No entanto, é de notar que esse acesso à informação, "não deve prejudicar o direito de ver os próprios dados pessoais de saúde tratados com confidencialidade". Consumados os três aspetos da acessibilidade é importante notar que somente na plenitude destes, é possível um acesso equitativo de qualidade e quantidade. (21,42) Embora todos os residentes em Portugal, independentemente do seu estatuto jurídico, estejam abrangidos pelo SNS, a complexidade dos procedimentos administrativos, a possibilidade de ter de pagar taxa pelos serviços e medicamentos e os desequilíbrios geográficos, tornam o acesso a cuidados de saúde de qualidade dificultado. Globalmente, cerca de 2,4% da população portuguesa declarou não ter as suas necessidades de cuidados médicos satisfeitas devido ao custo elevado, à distância ou ao tempo de espera, taxa que é muito semelhante à média da UE de 2,5%. Acresce ainda, que uma vez desagregada, a taxa registada era dez vezes mais elevada nos escalões de rendimentos mais baixos (4,7%) do que no escalão de rendimentos mais elevados (0,5%). (43)
Categoricamente, ao longo dos últimos anos foram realizados muitos esforços, não só para combater esta disparidade inerente aos escalões socioeconómicos, mas também para favorecer uma abordagem mais racional na utilização dos escassos recursos. Nomeadamente, a
29 criação de sistemas de triagem destinados a identificar corretamente os doentes e orientá-los para os cuidados mais adequados (por exemplo, sistema de Manchester) e a advertência para o uso das unidades de acidente e emergência para situações realmente urgentes. Similarmente, e como acesso tem de ser sinonimo de transparência, uma das estratégias foi encorajar ao uso dos sistemas de informação disponíveis como o Portal da Saúde do SNS que se destaca por informar os doentes dos tempos de espera num determinado hospital e centros hospitalares e ainda possibilita a marcação de consultas. Denota-se que medidas como estas pretendem que se estabeleça uma relação dos cidadãos com os dirigentes e com os responsáveis, para que a responsabilidade política e dos gestores seja escrutinada como um exercício de cidadania. Somente quando os cidadãos percebem que têm o direito a saber como funcionam os serviços, como são utilizados os recursos e como se compara cada instituição entre si é possível nutrir condições para o acesso racional em saúde. (44)
3.2. Parametrização
Após uma caracterização importa definir que o acesso é preconizado por diferentes entidades e a vários níveis e que seguidamente irá somente ser abordado o acesso a medicamentos.
Os indicadores que permitirão a análise da dependência entre «acesso a medicamentos» e «racionalidade terapêutica» foram selecionados pela inter-correlação aos diferentes níveis, pela pertinência e pela acessibilidade da informação. Estes foram ainda catalogados em três características pela forma como poderão ou não impactar a racionalidade. As categorias são:
Em 2018 o consumo de medicamentos em Portugal aumentou em mais de 4 milhões de embalagens que no ano anterior, pelo que importa descortinar se os níveis de acessibilidade no contexto nacional são satisfatórios. É ainda importante fazer notar que apesar do referido aumento, tem sido possível não aumentar exponencialmente os valores da despesa pública com medicamentos, como já foi previamente tratado. (22) Do mesmo modo, pretende-se então
Psicossocial Financeira
30 defrontar a questão de quão impactante poderá ser o acesso de medicamentos na racionalidade terapêutica. Este é um problema concreto, não-empírico, cuja relevância humana e operativa é contemporânea. Carece de interesse quer pela comunidade científica e governos como pela sociedade em geral.
3.3. Indicadores
3.3.1. Acesso a medicamentos de elevado custo
O acesso a cuidados de saúde, quer por meio de conjunturas públicas governamentais quer por seguros de saúde privados, garantem segurança financeira contra patologias inesperadas ou crónicas. Portugal apresenta uma percentagem de população abrangida por seguro de 100%, acima da média da UE de 97,9%, e muito acima dos 90,9% dos Estados Unidos da América. No entanto, a percentagem de população abrangida por esses regimes não fornece um indicador completo de acessibilidade, uma vez que as gamas de serviços cobertos e o grau de comparticipação de custos aplicado a esses serviços também afetam o acesso aos cuidados. (45)
Especificamente, relativamente aos medicamentos, antes de perspetivar o que é um medicamento de alto custo, é importante uma compreensão breve de como são elaborados os preços e o grau de comparticipação dos medicamentos nas suas diferentes categorias, pois ambos os sistemas estão fortemente associados.
Em Portugal, a prática de atribuição de preços está relacionada quer com o circuito quer com o tipo de medicamento; mercados de ambulatório e de hospitalar. No mercado de ambulatório a formação de preços é variável e dependente do tipo de medicamento; medicamento de marca introduzidos pela primeira vez no mercado nacional, medicamento genérico e medicamento de importação paralela. Os medicamentos designados MSRM, apresentam por norma um regime de formação de preços que está definido por lei, integrando assim um sistema administrativo de controlo de preços. Em contrapartida os MNSRM ou Over the counter (OTC), se não comparticipados, incorrem num processo de formação de preço livre, ao longo de todo o seu circuito de comercialização, o qual é inteiramente pago pelo doente.
Todos os medicamentos em Portugal estão sujeitos a impostos sobre o valor acrescentado (IVA) de 6% independentemente de sua categoria legal. Além disso, é aplicado um imposto sobre vendas que correspondente a 0,4% do volume de vendas de cada
31 medicamento, calculada sobre um preço de venda ao público de referência, incluindo os vendidos no mercado hospitalar. Então a composição do preço dos medicamentos, nomeadamente do Preço de Venda ao Público (PVP), contempla os impostos supracitados, as margens de comercialização do distribuidor grossista e do retalhista e o Preço de Venda ao Armazenista (PVA).
A definição do PVA dos MSRM (exceto medicamentos sujeitos a receita médica restrita (MSRMR)) e MNSRM comparticipados a introduzir no mercado nacional é determinada tendo por base um modelo de referenciação externa ou de preço de referência externo (PRE). Este constitui um sistema de controlo de preços amplamente utilizado pela grande maioria do Estados Membros da UE e contribui para uma baixa generalizada do preço dos medicamentos.
Após a autorização de introdução do medicamento no mercado e a fixação de preço máximo do medicamento há uma segunda fase: A decisão de comparticipação. O detentor de AIM incorre num processo de submissão de um pedido de comparticipação ao INFARMED. Este processo negocial é visto como fundamental para a empresa que submete o pedido, dado que em Portugal, como o PIB per capita, já referido, é baixo comparativamente a outros países com maior poder de compra na UE, é considerado um risco para a empresa comercializar um medicamento no mercado sem assegurar a comparticipação pelo Estado. A decisão final dependente do valor terapêutico e económico acrescentado que o medicamento a introduzir no mercado possa trazer comparativamente às alternativas terapêuticas comparticipadas já existentes. O atual sistema jurídico associado à comparticipação de medicamentos está ancorado essencialmente num regime geral, subdividido em diferentes escalões e que se destina a todos os utentes do SNS. A listagem de grupos e subgrupos farmacoterapêuticos pertencentes aos diferentes escalões de comparticipação é fixada pelo Ministério da Saúde. O nível ou percentagem de pagamento pelo Estado tem em conta variáveis de carácter humano, clínico, social e económico e varia desde o Escalão A (90%), ao Escalão D (15%). Os medicamentos que são considerados essenciais para a sustentação da vida são comparticipados pelo Estado na totalidade (100%). Para além do regime geral, existe também um regime especial de comparticipação legalmente definido, que subsidia o preço dos medicamentos de pensionistas cujo rendimento total anual não exceda catorze vezes o salário mínimo nacional em vigor no ano civil transato e de doentes portadores de patologias ou de situações clínicas específicas. (46,47,48,49)
Adicionalmente, a taxa média de comparticipação do SNS tem vindo a crescer; em 2017 o valor situava-se em 63,9%, e em 2018 atingiu-se o valor mais elevado dos últimos 6 anos, resultando numa diminuição da proporção do copagamento a ser suportado pela população.
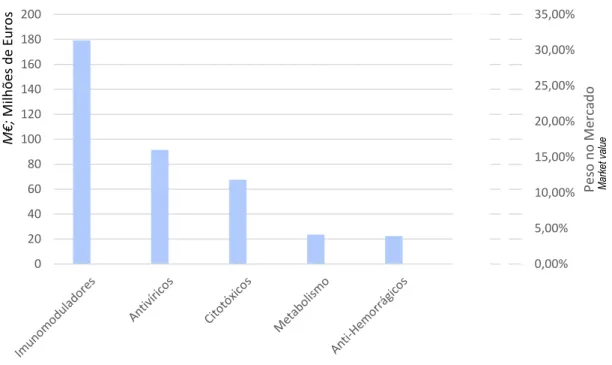
32 Em Portugal, os grupos terapêuticos que representam encargos mais elevados para o SNS (€) no período de janeiro a maio de 2019 são os Imunomoduladores e Antivíricos, seguidos por Citotóxicos. Estas três classes são responsáveis por 60,1% do peso total do mercado, cenário que se mantém mais ou menos constante ao longo dos anos mais recentes. Em seguida é ilustrado (Figura 4) os cinco principais grupos que representam custos mais elevados para o SNS, assim como o respetivo peso no mercado. (50)
Figura 4. Top 5 dos grupos terapêuticos com mais encargos (janeiro – maio 2019) em Milhões € Dados: INFARMED, I.P
Os imunomoduladores são o grupo que representa os custos gerais mais altos, com uma tendência crescente e variação homóloga de aproximadamente mais 15 milhões de euros. Ao modificarem a resposta imunológica, representam um papel fundamental na terapêutica anticancerígena, na transplantação e nas doenças autoimunes, especialmente na artrite reumatoide. Segundo um estudo, considerando apenas os custos diretos, o incremental cost-effectiveness ratio (ICER) dos inibidores do fator de necrose tumoral (TNFi) variou de 39.000 a 1 273.000 € / quality adjusted life year (QALY) ganho em comparação aos medicamentos modificadores de artrite (DMARDs clássicos) em pacientes naive a DMARD. (51) No entanto, outro estudo reporta que foram encontradas variações relativas aos países benchmark no acesso a medicamentos biológicos de doentes com artrite reumatoide, com Portugal a mostrar a menor prevalência, em proporção, de doentes tratados com medicamentos biológicos. Menor PIB per
0,00% 5,00% 10,00% 15,00% 20,00% 25,00% 30,00% 35,00% 0 20 40 60 80 100 120 140 160 180 200 Pes o n o Me rcad o M€; Milh õ es d e E u ro s
Top 5 of costs by pharmacotherapeutic group (January–May 2019), presented in M€.
Top 5 dos grupos terapêuticos com mais encargos (Janeiro – Maio 2019) em Milhões €.
Ma rk et va lu e