Universidade do Minho
Escola de Engenharia
Beatriz Alexandra Pinto dos Santos
Caracterização fenotípica de isolados de
com sangue humano
outubro de 2019 UMinho | 2019 Beatr iz Pint o Car act er ização f eno típica de isolados de após int er
ação com sangue humano
Staphylococcus epidermidis
após interação
St
aph
ylococcus epider
Beatriz Alexandra Pinto dos Santos
Caracterização fenotípica de isolados de
com sangue humano
Dissertação de Mestrado
Mestrado em Biotecnologia
Trabalho efetuado sob a orientação da
Doutora Ângela Maria Oliveira de Sousa França
e coorientação do
Doutor Nuno Miguel Dias Cerca
Universidade do Minho
Escola de Engenharia
outubro de 2019
DIREITOS DE AUTOR E CONDIÇÕES DE UTILIZAÇÃO DO TRABALHO POR TERCEIROS
Este é um trabalho académico que pode ser utilizado por terceiros desde que respeitadas as regras e boas práticas internacionalmente aceites, no que concerne aos direitos de autor e direitos conexos. Assim, o presente trabalho pode ser utilizado nos termos previstos na licença abaixo indicada.
Caso o utilizador necessite de permissão para poder fazer um uso do trabalho em condições não previstas no licenciamento indicado, deverá contactar o autor, através do RepositóriUM da Universidade do Minho.
Atribuição-NãoComercial-SemDerivações CC BY-NC-ND
iii
Agradecimentos
Em primeiro lugar, gostaria de expressar o meu profundo agradecimento à minha orientadora, Doutora Ângela França, pela sua disponibilidade constante, pelos conhecimentos transmitidos, pela paciência e pela ajuda incansável que foi essencial durante estes meses, e ao meu coorientador, Doutor Nuno Cerca, pela partilha de conhecimentos e orientação ao longo do trabalho.
A todos elementos do grupo NC agradeço pela integração, pela paciência para me ajudarem e esclarecerem todas as dúvidas intermináveis e pela boa disposição que transmitem. O impacto das pessoas nas experiências pelas quais passamos é o que faz, verdadeiramente, a diferença.
Aos amigos que, embora longe, conseguem encurtar essa distância com toda a preocupação, carinho e motivação que sempre demonstraram, principalmente à Morgane, por ser o mais próximo que eu já tive de uma irmã, e à Diana e à Joana, por toda a bondade, alegria e partilha que faz delas tão especiais. Também aos amigos de sempre que, muitas vezes sem darem por isso, me fizeram abstrair da vida a acontecer fora do Tabu. E, por fim, à Raquel, por ser a minha companheira durante todo o mestrado e pela ajuda durante todo este percurso.
Ao meu padrinho e tios, por toda a preocupação que sempre demonstraram, pela ajuda dada, muitas vezes sem pedir, e por serem o meu maior exemplo de força de vontade e resiliência. Obrigada por terem sido, desde sempre, a minha figura paternal e por terem acrescentado à família tantas pessoas incríveis. À minha avó, por ter sido a minha segunda mãe, por me ter ensinado tanto e pela ajuda que me permitiu chegar aqui. É impossível não sentir o quanto sou especial na sua vida. Também à Rute e família agradeço por todo o apoio, carinho e disponibilidade que sempre demostraram.
Por fim, à minha mãe. Não conseguirei jamais exprimir aquilo que tu significas para mim e o quanto agradeço por te ter. Obrigada por qualquer pedido meu nunca ser demais, por acreditares sempre nos meus sonhos e projetos e por me mostrares o quanto os tropeços da vida nos podem ensinar. Tu és a base de tudo aquilo que eu sou e vais ser sempre o acaso mais especial da minha vida.
iv
DECLARAÇÃO DE INTEGRIDADE
Declaro ter atuado com integridade na elaboração do presente trabalho académico e confirmo que não recorri à prática de plágio nem a qualquer forma de utilização indevida ou falsificação de informações ou resultados em nenhuma das etapas conducente à sua elaboração.
v
Caracterização fenotípica de isolados de Staphylococcus epidermidis após interação com sangue humano
Sumário
As infeções associadas aos cuidados de saúde afetam muitos pacientes diariamente. Staphylococcus epidermidis é uma das espécies mais frequentemente associadas com o surgimento destas infeções, estando particularmente relacionada com o uso de dispositivos médicos invasivos, devido à sua capacidade para aderir a estes e formar biofilmes. O diagnóstico destas infeções é normalmente feito através de hemoculturas. No entanto, devido à natureza comensal de S. epidermidis, é muito frequente ocorrerem contaminações da amostra durante a colheita, resultando em diagnósticos falsos positivos. Assim, é essencial encontrar marcadores que permitam distinguir entre infeções e contaminações. Para isso, nesta dissertação, células planctónicas e de biofilme, de 3 isolados clínicos e 3 comensais foram caracterizadas em relação à sua capacidade para i) sobreviver, ii) excretar proteases e quanto iii) à morfologia das colónias formadas após interação com sangue humano. Os resultados obtidos revelaram que a capacidade de sobrevivência das estirpes comensais e clínicas não é diferente quando crescem no estado planctónico ou em biofilme, observando-se, no geral, uma diminuição da concentração de células cultiváveis ao longo do tempo de incubação com sangue humano. Relativamente à capacidade proteolítica, nas estirpes clínicas esta foi variável. No entanto, nas estirpes comensais, a capacidade proteolítica alterou-se após interação com sangue humano. No que respeita à morfologia das colónias, observaram-se alterações na forma e/ou margem das colónias formadas pelas células planctónicas e de biofilme das estirpes clínicas. Nas estirpes comensais, as colónias permaneceram iguais até 24 h de incubação. No futuro, experiências com mais estirpes clínicas e comensais deverão ser efetuadas de modo a analisar, detalhadamente, o potencial destes parâmetros como marcadores na discriminação entre contaminações e verdadeiras infeções.
vi
Phenotypic characterization of Staphylococcus epidermidis isolates upon interaction with human blood
Abstract
Healthcare-associated infections affect several patients every day. Staphylococcus epidermidis is one of the species more frequently associated with the onset of these infections, being particularly related to the use of indwelling medical devices due to its capacity to adhere and form biofilms on medical devices. The diagnosis of these infections is performed by hemocultures. However, due to S. epidermidis commensal nature, some diagnostics are based on contaminated samples, resulting in false positives. Thus, the search for markers allowing the discrimination between infection and contamination is essential. Therefore, in this dissertation, planktonic and biofilm cells, from 3 clinical and 3 commensal isolates were characterized regarding their capacity to i) survive, ii) excrete proteases and the iii) alteration of colony morphology after interacting with human blood. The results obtained showed that the survival capacity of the clinical and commensal strains was not different when grown in planktonic or biofilm form. In general, there was a decrease in the concentration of culturable cells over the time of incubation with blood. Regarding the proteolytic activity, in clinical strains, this was variable. However, changes were observed in commensal strains after interacting with human blood. Finally, differences in the form and/or margin of the colonies formed by both planktonic and biofilm cells of the clinic strains were found. The morphology of the colonies formed by all commensal strains remained unchanged during the 24 h of incubation. In the future, assays with more clinic and commensal strains should be performed in order to analyse, in detail, the potential of these parameters to be used as markers to help discriminating between contaminations and true infections.
vii
Índice
Agradecimentos ...…...iii Sumário ... v Abstract ... vi Índice de figuras... ix Índice de tabelas ... xiLista de abreviaturas ... xii
1. Introdução ... 1
1.1. Infeções associadas aos cuidados de saúde ... 1
1.2. Infeções causadas por Staphylococcus epidermidis ... 2
1.3. Biofilmes de S. epidermidis ... 3
1.3.1. Adesão ... 4
1.3.2. Maturação ... 5
1.3.3. Dispersão ... 8
1.4. Diagnóstico das infeções causadas por S. epidermidis ... 8
1.5. Objetivo ... 11
2. Materiais e métodos ... 12
2.1. Declaração de ética e colheita de sangue humano ... 12
2.2. Bactérias e condições de crescimento ... 12
2.3. Avaliação da formação de biofilme ... 14
2.4. Preparação de placas de leite ... 14
2.5. Determinação da sobrevivência e capacidade proteolítica de isolados comensais e clínicos após interação com sangue humano... 15
2.6. Análise da morfologia das colónias dos isolados comensais e clínicos após interação com sangue humano ... 15
viii
2.7. Análise estatística ... 16
3. Resultados e discussão ... 16
3.1. Avaliação da capacidade de sobrevivência de S. epidermidis após interação com sangue humano ... 19 3.2. Avaliação da atividade proteolítica de S. epidermidis após interação com sangue
humano ... 22 3.3. Análise da morfologia das colónias de S. epidermidis após interação com sangue
humano ... 25
4. Conclusões e trabalho futuro ... 28 5. Bibliografia ... 31
ix
Índice de figuras
Figura 1. Imagem de S. epidermidis obtida através de microscopia eletrónica de varrimento (SEM). S. epidermidis está representado a verde e a roxo a matriz ... 3
Figura 2. Fases da formação de biofilmes. A formação de biofilmes compreende três fases: 1)
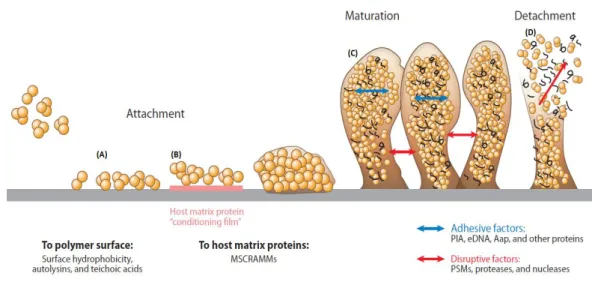
adesão, 2) maturação e 3) dispersão. Para além das superfícies bióticas, a adesão pode ocorrer em superfícies abióticas não revestidas (A) e abióticas revestidas por proteínas da matriz do hospedeiro (B), onde ocorrem interações entre a bactéria e a superfície ou proteínas do hospedeiro, respetivamente. Posteriormente, a maturação (C) está dependente das forças adesivas (setas azuis), que permitem a adesão das células, e das forças disruptivas (setas vermelhas) para a formação de canais por onde a água, nutrientes e também resíduos produzidos pelas células são transportados. Por fim, a dispersão das células para o meio envolvente (D) acontece devido à rutura das forças adesivas intercelulares. MSCRAMMs – componentes da superfície bacteriana reconhecedoras de moléculas adesivas da matriz, PIA – Polissacarídeo de adesão intercelular, eDNA – Ácido desoxirribonucleico extracelular (eADN), Aap – Proteína associada à acumulação, PSM – Modulinas solúveis em fenol ... 4
Figura 3. Sistema Agr em Staphylococcus. O sistema Agr atua como resposta à densidade celular.
AgrB está envolvido na secreção e processamento do AIP, cuja acumulação é detetada por AgrC. A ligação do AIP ao AgrC resulta na fosforilação do AgrA e, consequentemente, a expressão do locus agr a partir dos promotores P2 e P3 ... 7
Figura 4. Quantificação do total de biomassa (A) e do número de células cultiváveis (log10
UFC/mL) (B) nos biofilmes de 48 h formados por cada uma das estirpes clínicas (RP62A, MEX60, DEN69) e comensais (SECOM005A, SECOM020A.1, SECOM030A) em estudo. As
barras representam a média e o erro o desvio-padrão de três experiências independentes. Os resultados obtidos para os valores de biomassa e de células cultiváveis, em comparação com a estirpe RP62A, foram analisadas utilizando o teste t-Student com * a representar as diferenças significativas identificadas (p <0,05). ... 17
x
Figura 5. Avaliação da capacidade de sobrevivência de S. epidermidis em sangue humano. (A) RP62A, (B) MEX60, (C) DEN69, (D) SECOM005A, (E) SECOM020A.1, (F) SECOM030A.
As barras representam a média com o desvio-padrão de pelo menos duas experiências independentes. As diferenças estatísticas para os diferentes tempos de incubação (30, 90 e 180 min), em relação ao controlo (0 min), para as células planctónicas e de biofilme, foram determinadas utilizando o teste t-Student, com • a representar diferenças significativas (p <0,05). As diferenças estatísticas entre as células planctónicas e as de biofilme, para cada um dos tempos analisados, foi efetuada através do teste t-Student com * a representar diferenças estatísticas significativas (p <0,05). ... 20
Figura 6. Percentagem de células de S. epidermidis com e sem atividade proteolítica antes e após interação com sangue humano. (A) RP62A, (B) MEX60, (C) DEN69, (D) SECOM005A, (E) SECOM020A.1, (F) SECOM030A. As barras representam a média com o
desvio-padrão de pelo menos duas experiências independentes. As diferenças estatísticas para os diferentes tempos de incubação (30, 90 e 180 min), em relação ao controlo (0 min), para as células planctónicas e de biofilme, foram determinadas utilizando o teste t-Student, com • a representar diferenças significativas (p <0,05). As diferenças estatísticas entre as células planctónicas e de biofilme, para cada um dos tempos analisados, foi efetuada utilizando do teste t-Student com * a representar diferenças estatísticas significativas (p <0,05). ... 24
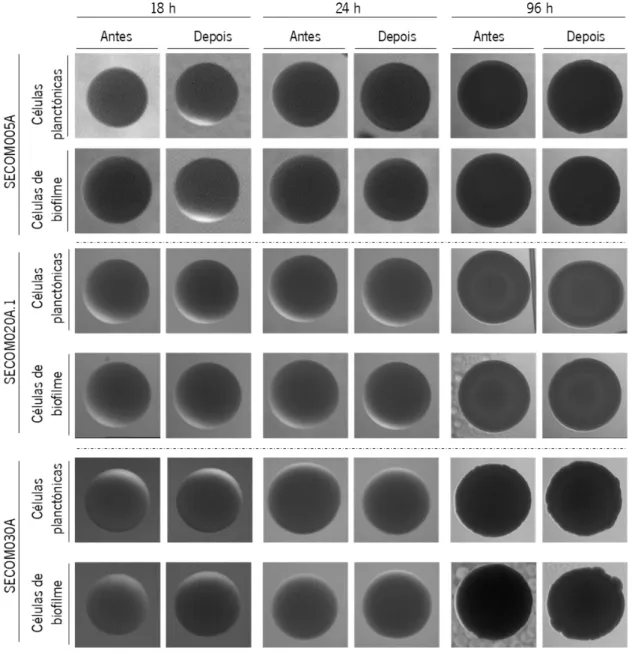
Figura 7. Evolução morfológica das colónias das células planctónicas e de biofilme, das estirpes clínicas, antes e após 180 min de incubação com sangue humano, após incubação da placa de TSA durante 18, 24 e 96 h a 37 °C. A morfologia de cada uma das estirpes foi
observada pelo menos duas vezes, contudo, esta é uma figura representativa. Antes – antes da incubação com sangue humano; Depois – 180 min após interação com sangue humano. ... 26
Figura 8. Evolução morfológica das colónias das células planctónicas e de biofilme, das estirpes comensais, antes e após 180 min de incubação com sangue humano, após incubação da placa de TSA durante 18, 24 e 96 h a 37 °C. A morfologia de cada uma das
estirpes foi observada pelo menos duas vezes, contudo, esta é uma figura representativa. Antes – antes da incubação com sangue humano; Depois – 180 min após interação com sangue humano. ... 27
xi
Índice de tabelas
Tabela 1. O risco de desenvolvimento de infeções nosocomiais relacionadas com o uso de dispositivos médicos associado a diferentes espécies bacterianas ... 2
xii
Lista de abreviaturas
Aap Proteína associada à acumulação
Agr Sistema do gene regulador acessório
AIP Péptido autoinduzido
Bap Proteína associada à formação de biofilme
CDC Centro para o Controlo e Prevenção de Doenças
CoNS Staphylococci coagulase-negativos
DO Densidade ótica
eADN ADN extracelular
Embp Proteína de ligação à matriz extracelular
FnbpA Proteínas de ligação ao fibrogénio A
FnbpB Proteínas de ligação ao fibrogénio B
HPLC Cromatografia líquida de alta eficiência
IACS Infeções associadas aos cuidados de saúde
ica Locus de adesão intercelular
MSCRAMMs Componentes da superfície bacteriana reconhecedoras de moléculas adesivas
da matriz
PIA Polissacarídeo de adesão intercelular
PNAG Poli-n-acetil-glucose-amina
PSM Modulinas solúveis em fenol
SEM Microscopia eletrónica de varrimento
TSA Caldo tríptico de soja suplementado com agar
TSB Caldo tríptico de soja
TSB0,4%G Caldo tríptico de soja suplementado com 0,4% de glucose
1
1. Introdução
1.1. Infeções associadas aos cuidados de saúde
As infeções associadas aos cuidados de saúde (IACS) podem ser definidas como infeções que ocorrem durante a estadia do paciente em hospitais, ou outras instituições de saúde, sendo que à data de admissão esta não estava presente nem em incubação (Horan et al., 2008). Encontram-se também incluídas nesta definição as infeções ocupacionais dos profissionais de saúde (World Health Organization, 2002). A aquisição destas infeções pode ser feita de forma direta, através do contacto com um paciente ou pessoal médico, ou de forma indireta, através de material médico, consumo de alimentos e contacto com superfícies contaminadas (Percival et al., 2015). Há diversos fatores extrínsecos que potenciam o aparecimento destas infeções, destacando-se os descuidos dos profissionais de saúde no manuseamento do material, o incorreto cumprimento dos protocolos de esterilização e o uso excessivo de agentes antimicrobianos (Revelas, 2012).
Estas infeções levam a um aumento da morbilidade, resultando em elevados custos para os pacientes bem como para os hospitais, uma vez que obriga a um prolongamento do internamento, com consequente aumento da utilização de meios de diagnóstico e fármacos para o tratamento destas infeções. Em alguns casos, estas infeções podem mesmo levar à morte do paciente (Currie et al., 2017; Direção-Geral da Saúde, 2017; Scott II, 2009).
Uma análise levada a cabo pela Organização Mundial de Saúde concluiu que, em países com capacidades financeiras superiores, 7,6% dos pacientes contrai uma IACS, sendo que este valor pode aumentar para 15,5% em países com capacidades financeiras inferiores (World Health Organization, 2011). Na Europa, o Centro Europeu de Prevenção e Controlo de Doenças concluiu que a prevalência das IACS é de 8,4% em pacientes que permanecem mais de dois dias na unidade de cuidados intensivos (European Centre for Diasease Prevention and Control, 2016). Por outro lado, um estudo feito nos EUA, segundo os critérios da Rede Nacional Americana de Segurança nos Cuidados de Saúde, demonstrou que 4% dos pacientes internados em unidades de cuidados intensivos sofre pelo menos de um tipo de IACS (Magill et al., 2014).
O crescente aumento das IACS tem conduzido a um incremento dos estudos relacionados com as espécies frequentemente associadas ao desenvolvimento destas infeções (Chessa et al., 2015). Os microrganismos pertencentes ao género Staphylococcus são um dos mais importantes
2
exemplos causadores de IACS da atualidade (Moraes et al., 2013), estando principalmente associados ao uso de dispositivos médicos invasivos (Tabela 1).
Tabela 1. O risco de desenvolvimento de infeções nosocomiais relacionadas com o uso de dispositivos médicos
associado a diferentes espécies bacterianas. Adaptado de Moraes et al. (2013).
MICRORGANISMOS RISCO DE INFEÇÃO (%)
Staphylococcus aureus 25
Staphylococcus epidermidis 35
Streptococcus/Enterococcus spp. 10-15
Enterobacteria/Pseudomonas aeruginosa 10-15
Proprionobacterium acnes >5
1.2. Infeções causadas por
Staphylococcus epidermidis
As bactérias do género Staphylococcus são bactérias Gram-positivas que se encontram na pele e nas membranas mucosas humanas saudáveis (Le et al., 2014). As espécies deste género são classificadas pela presença ou ausência da enzima coagulase (Le et al., 2014; Otto, 2009). Atualmente são conhecidas mais de 45 espécies pertencentes ao grupo dos coagulase-negativos (CoNS), destacando-se Staphylococcus epidermidis, uma vez que mais de 50% dos CoNS isolados em IACS pertencem a esta espécie (Otto, 2009; Piette e Verschraegen, 2009).
S. epidermidis tem um papel importante na manutenção da flora da pele saudável uma vez que este compete com microrganismos mais perigosos como, por exemplo, S. aureus, evitando a colonização da pele pelos mesmos. No entanto, nos últimos anos, S. epidermidis tem sido considerado um importante agente patogénico oportunista, uma vez que afeta essencialmente pacientes com o sistema imunitário fragilizado (Von Eiff et al., 2002). Curiosamente, as características que lhe permitem viver como comensal permitem-lhe, igualmente, singrar como agente patogénico (Otto, 2012a). Por essa razão, S. epidermidis é, atualmente, uma das maiores causas de infeções adquiridas no meio hospitalar, principalmente em pacientes com dispositivos médicos invasivos (Otto, 2009).
3
Figura 1. Imagem de S. epidermidis obtida através de microscopia eletrónica de varrimento (SEM).
S. epidermidis está representado a verde e a roxo a matriz. Crédito do Instituto Nacional de Alergias e Doenças
Infeciosas (EUA): https://www.niaid.nih.gov/sites/default/files/staphylococcus_epidermidis.jpg [Acedido a 4 de
agosto de 2019].
A forte relação desta espécie com o uso de dispositivos médicos invasivos deve-se à sua capacidade para aderir a superfícies e formar biofilmes (Mack et al., 2013). A capacidade de formação de biofilmes é considerada o maior fator de virulência desta espécie (Vuong e Otto, 2002), uma vez que confere às bactérias uma maior tolerância a antibióticos (Cerca et al., 2005b; Piette e Verschraegen, 2009) e aos componentes do sistema imunitário do hospedeiro (Cerca et al., 2005a). Assim, as infeções causadas por S. epidermidis para além de, por vezes, provocarem consequências fatais no paciente, implicam, frequentemente, a remoção e substituição do dispositivo médico colonizado, comprometendo a qualidade de vida dos pacientes (Joo e Otto, 2012). Para além disso, estas infeções levam a um aumento dos custos associados com os cuidados de saúde uma vez que é necessário efetuar diagnósticos e tratamentos adicionais. Estima-se que a formação de biofilmes em cateteres venosos seja responsável por mais de 80% das infeções da corrente sanguínea, tal como a bacteremia (Rickard et al., 2007)e septicémia (Cole et al., 2016). Devido ao importante papel que desempenham no desenvolvimento das infeções causadas por S. epidermidis, os mecanismos de formação de biofilme têm sido alvo de vários estudos nas últimas décadas.
1.3. Biofilmes de
S. epidermidis
Os biofilmes caracterizam-se pela formação de um aglomerado multicelular de microrganismos numa superfície (Costerton et al., 1995). Este aglomerado é rodeado por uma matriz
4
(Flemming et al., 2007), sendo que a sua composição depende de diversos fatores externos, tais como a disponibilidade de nutrientes (Wimpenny, 2000), as forças de tensão tangencial (Flemming e Wingender, 2010) e as condições do ambiente envolvente (Wimpenny, 2000). A matriz do biofilme de S. epidermidis é constituída por vários compostos, destacando-se o polissacarídeo de adesão intercelular (PIA), proteínas, lípidos e ácido desoxirribonucleico extracelular (eADN) (Joo e Otto, 2012), sendo que esta funciona como uma proteção física contra pressões externas (Flemming et al., 2007; Otto, 2012a). A formação de biofilmes divide-se em 3 fases: i) adesão, ii) maturação e iii) dispersão (O’Toole et al., 2000) (Figura 1).
Figura 2. Fases da formação de biofilmes. A formação de biofilmes compreende três fases: 1) adesão, 2) maturação e 3) dispersão. Para além das superfícies bióticas, a adesão pode ocorrer em superfícies abióticas não revestidas (A) e abióticas revestidas por proteínas da matriz do hospedeiro (B), onde ocorrem interações entre a bactéria e a superfície ou proteínas do hospedeiro, respetivamente. Posteriormente, a maturação (C) está dependente das forças adesivas (setas azuis), que permitem a adesão das células, e das forças disruptivas (setas vermelhas) para a formação de canais por onde a água, nutrientes e também resíduos produzidos pelas células são transportados. Por fim, a dispersão das células para o meio envolvente (D) acontece devido à rutura das forças adesivas intercelulares. MSCRAMMs – componentes da superfície bacteriana reconhecedoras de moléculas adesivas da matriz, PIA – Polissacarídeo de adesão intercelular, eDNA – Ácido desoxirribonucleico extracelular (eADN), Aap – Proteína associada à acumulação, PSM – Modulinas solúveis em fenol. Imagem retirada de (Otto, 2012b).
1.3.1. Adesão
A fase inicial da formação de biofilmes passa pela adesão da bactéria a uma superfície. Esta adesão pode ocorrer em diferentes superfícies, sejam estas abióticas ou bióticas (Otto, 2009). A adesão a superfícies abióticas é determinada, principalmente, por interações não específicas como interações hidrofóbicas ou electroestáticas, as quais estão dependentes, essencialmente, das características físico-químicas dos dispositivos e da hidrofobicidade da superfície das bactérias
5
(Vacheethasanee et al., 1998). No entanto, também se verificou que moléculas específicas da superfície da bactéria, tal como a proteína autolisina AtlE e os ácidos teicóicos, os quais são um componente característico da parede das bactérias Gram-positivas, podem estar envolvidos na adesão a superfícies abióticas (Gross et al., 2001; Hussain et al., 2001).
Por outro lado, no caso da adesão a superfícies bióticas ou a superfícies abióticas revestidas por proteínas da matriz do hospedeiro, as interações que ocorrem entre a bactéria e a superfície são específicas (Otto, 2012b; Patti et al., 1994). S. epidermidis expressa uma vasta gama de proteínas de superfície designadas de componentes da superfície bacteriana reconhecedoras de moléculas adesivas da matriz (MSCRAMMs). As MSCRAMMs têm a capacidade de interagir com as proteínas da matriz do hospedeiro (Patti et al., 1994) sendo, por isso, essenciais para a formação de biofilmes no contexto clínico (Le et al., 2014; Otto, 2012b).
1.3.2. Maturação
O processo da maturação caracteriza-se pela ação simultânea de forças adesivas e disruptivas que permitem, respetivamente, a agregação celular e a manutenção da estrutura característica do biofilme (Büttner et al., 2015). Este processo pode ser dividido em dois grandes grupos de processos: adesivos e disruptivos.
1.3.2.1. Forças adesivas
As forças adesivas, tal como o nome indica, constituem um passo importante na adesão das bactérias entre si (Otto, 2009). A molécula mais importante neste processo é a PIA, também conhecida como poli-n-acetil-glucose-amina (PNAG) (Mack et al., 1996), uma vez que esta molécula consegue, através de interações electroestáticas, manter as células juntas (Otto, 2012b). A sua produção surge como resultado dos produtos do locus de adesão intercelular (ica), que inclui os genes icaA, icaD, icaC e icaB (Heilmann et al., 1996), o qual é regulado por fatores ambientais e por proteínas reguladoras (Otto, 2008). As transferases IcaA e IcaD são responsáveis pela produção dos resíduos de N-acetil glucosamina (GlcNAc) e elongação do polissacarídeo, enquanto IcaC é responsável pela translocação da molécula para a superfície (Gerke et al., 1998). Por fim, a deacetilação dos resíduos de GlcNAc é levada a cabo pela enzima IcaB, que se localiza na superfície da bactéria. O processo de deacetilação é essencial para a ligação da molécula à superfície da bactéria (Vuong et al., 2004b), formação de
6
biofilme (Vuong et al., 2004b) e, também, para a evasão do sistema imunitário do hospedeiro (Vuong et al., 2004d). Paralelamente ao operão ica existe o gene regulador icaR que está envolvido na regulação da expressão do operão ica (Otto, 2012a).
Existem, contudo, algumas estirpes que não apresentam o operão ica, pelo que, consequentemente, não existe produção da PNAG (Kogan et al., 2006). Assim, embora a PNAG seja importante para a formação dos biofilmes de S. epidermidis, a sua presença não é indispensável, existindo outras moléculas que auxiliam a formação de biofilme tais como a proteína associada à acumulação (codificada pelo gene aap, do inglês accumulation-associated protein) (Hussain et al., 1997), a proteína associada à formação de biofilme (codificada pelo gene bap, do inglês biofilm-associated protein) (Cucarella et al., 2001), a proteína de ligação à matriz extracelular (codificada pelo gene embp, do inglês extracelular matrix binding protein) e as proteínas de ligação ao fibrinogénio (FnbpA e FnbpB, do inglês fibrinogen-binding protein) (Otto, 2012b). Para além destas proteínas, existem outras moléculas envolvidas na formação dos biofilmes de S. epidermidis, nomeadamente os ácidos teicóicos (Hussain et al., 2001). Juntamente com o eADN, resultante da lise de outras bactérias dentro do biofilme (Whitchurch et al., 2002), os ácidos teicóicos têm um papel muito importante devido à carga negativa que apresentam, pois permite-lhes interagir com moléculas da matriz com carga oposta, contribuindo para a manutenção da estrutura do biofilme (Otto, 2012b, 2008).
1.3.2.2. Forças disruptivas
As forças disruptivas são essenciais para a formação dos canais existentes nos biofilmes (O’Toole et al., 2000). É através destes canais que o fornecimento de nutrientes a todas as células acontece (Costerton et al., 1995; Otto, 2008) e é neles, também, que são depositados os resíduos resultantes da atividade natural das células (Sutherland, 2001). A estruturação do biofilme ocorre através da degradação enzimática dos componentes da matriz do biofilme, destacando-se a ação das proteases e das nucleases (Joo e Otto, 2012). A produção de várias destas proteases é controlada pelo sistema quorum sensing, que atua como resposta à densidade local (Nadell et al., 2008; Otto, 2012b). Em Staphylococcus, este sistema é denominado de sistema do gene regulador acessório (Agr) e consiste em duas unidades transcricionais divergentes: RNAII e RNAIII, cuja transcrição é controlada pelo promotor P2 e P3, respetivamente (Le e Otto, 2015) (Figura 3). O locus de RNAII contém 4 genes: agrD, agrB, agrC e agrA. AgrD é o péptido percursor do sinal quorum extracelular do sistema Agr, o péptido autoinduzido (AIP), o qual é modificado e, posteriormente, exportado para o meio extracelular
7
pela endopeptídase transmembranar AgrB. Já no meio extracelular, o AIP é detetado pela histina quinase AgrC e, quando estes se ligam, é iniciada a transdução do sinal e o regulador de resposta AgrA é fosforilado, o que resulta numa indução da transcrição dos promotores P2 e P3 (Le e Otto, 2015; Olson et al., 2014). Por outro lado, RNAIII, um pequeno ARN regulador, controla a expressão de genes sob a regulação deste sistema (Otto, 2004).
Figura 3. Sistema Agr em Staphylococcus. O sistema Agr atua como resposta à densidade celular. AgrB está
envolvido na secreção e processamento do AIP, cuja acumulação é detetada por AgrC. A ligação do AIP ao AgrC
resulta na fosforilação do AgrA e, consequentemente, a expressão do locus agr a partir dos promotores P2 e P3.
Imagem retirada de (Le et al., 2014).
Para além da ação das proteases e nucleases, a estruturação do biofilme é também influenciada pela presença de moléculas com propriedades surfactantes, as quais levam à rutura das interações não-covalentes entre as células do biofilme e as moléculas da matriz (Joo e Otto, 2012; Otto, 2012b). As modulinas solúveis em fenol (PSM, do inglês phenol-soluble modulins) são uma dessas moléculas, cuja produção é controlada pelo sistema quorum sensing Agr (Joo e Otto, 2012). Ao contrário do que foi verificado em culturas planctónicas, onde as PSM mais abundantes são as PSMγ (Joo e Otto, 2014), as mais representativas em biofilmes são as PSMβ, as quais têm como principal função a estruturação dos mesmos (Wang et al., 2011).
8
No entanto, curiosamente, a sua função é determinada pela concentração no meio. Quando este péptido se encontra em concentração moderada, é promovida a estruturação do biofilme, no entanto, se se encontrar numa concentração elevada, leva ao despreendimento de aglomerados de células (Le et al., 2014). Na ausência destas modulinas, os biofilmes tornam-se mais compactos, sem canais e perdem a capacidade para controlar a expansão do biofilme (Wang et al., 2011).
1.3.3. Dispersão
A última etapa do ciclo de vida dos biofilmes é a dispersão, a qual é caracterizada pela libertação de células do biofilme para o meio envolvente (Kaplan, 2010). Esta fase do ciclo de vida dos biofilmes é muito importante, pois o transporte das células libertadas do biofilme pela corrente sanguínea, ou linfa, poderá levar ao estabelecimento de biofilmes noutros locais podendo, ainda, causar o aparecimento de infeções agudas graves como septicémia (Otto, 2012b, 2008). No entanto, esta etapa é umas das fases menos estudada da formação de biofilme. Para que esta fase do ciclo aconteça é necessário que haja uma rutura das forças adesivas intercelulares o que permitirá, portanto, o desprendimento das células do biofilme (Le et al., 2014). Para além da ação de proteases e nucleases, as PSMs desempenham um papel importante neste processo devido à sua capacidade para romper as interações não-covalentes entre as macromoléculas que constituem a matriz e as células dos biofilmes (Le et al., 2014; Otto, 2012b). No entanto, as condições ambientais também podem ter influência neste processo. A dispersão de células poderá ocorrer quando existe uma depleção de nutrientes ou quando ocorrem alterações no pH ou na temperatura (Boles e Horswill, 2008). Contudo, este processo pode também acontecer após longos períodos de crescimento do biofilme, mesmo que este ainda se encontre sob as condições favoráveis ao seu crescimento (Yarwood et al., 2004). Adicionalmente, também o fluxo pode levar à dispersão do biofilme devido às forças mecânicas exercidas (França et al., 2016b; Otto, 2008).
1.4. Diagnóstico das infeções causadas por
S. epidermidis
O diagnóstico das infeções causadas por S. epidermidis constitui um importante desafio clínico devido à natureza comensal da bactéria (Le et al., 2014) e por estas apresentarem um quadro subclínico, mesmo nos casos em que a infeção evolui para um estado crónico (Von Eiff et al., 2002). O diagnóstico destas infeções é tradicionalmente realizado através de hemoculturas (Lee et al., 2007). No entanto, uma hemocultura positiva não indica necessariamente infeção, podendo ser apenas o
9
resultado de uma contaminação durante a colheita do sangue (Kleinschmidt et al., 2015). Ainda mais preocupante é o facto de um resultado negativo não querer dizer que não há infeção, adiando o tratamento do paciente e, consequentemente, a recuperação do mesmo (Zhang et al., 2011). De todos os diagnósticos realizados, estima-se que cerca de 40% destes estejam errados (Pien et al., 2010). Devido a esta problemática, muitos pacientes recebem tratamento desadequado. Há estudos que demonstram que até 30% dos pacientes tratados com vancomicina (antibiótico de escolha para o tratamento de infeções causadas por S. epidermidis) não necessitavam deste tratamento, uma vez que a decisão de tratamento baseou-se num diagnóstico falso positivo (Rahkonen et al., 2012).
Assim, é imperativo conseguir distinguir entre infeção e contaminação de modo a evitar diagnósticos incorretos, uma vez que estes não só acarretam custos importantes para os pacientes e os hospitais (Kleinschmidt et al., 2015), mas também levam ao aumento da grave problemática da resistência aos antibióticos (Rahkonen et al., 2012). De forma a melhorar o diagnóstico destas infeções, o Centro para o Controlo e Prevenção de Doenças (CDC) estabeleceu nas suas diretrizes dois critérios. O primeiro critério define que o paciente possui um agente patogénico reconhecido através de 2 ou mais culturas de sangue, com uma diferença de até 48 h, e que este não está associado a nenhuma outra infeção (Horan et al., 2008). O segundo critério pressupõe que o paciente possua pelo menos um sintoma, de entre febre, arrepios ou hipotensão, e que os sintomas e os resultados laboratoriais não estejam relacionados com outras infeções e contaminações comuns da pele (Horan et al., 2008). No entanto, estes critérios não são suficientes para obter um diagnóstico de infeção provocada por S. epidermidis. A confirmação do primeiro critério não garante a inexistência de contaminações e a não confirmação do segundo critério não implica a ausência de infeção, uma vez que o recurso exclusivo a estes dois critérios resulta numa baixa especificidade (Wohoush et al., 2011). No entanto, o recurso aos critérios do CDC e, simultaneamente, a identificação da espécie fornece um dos diagnósticos mais sensíveis e específicos. Contudo, este método de diagnóstico tem limitações uma vez que é mais caro, mais moroso e nem sempre viável no ambiente clínico (Wohoush et al., 2011). Consequentemente, muitos diagnósticos ainda continuam a ser baseados nos 4 critérios da síndrome da resposta inflamatória sistémica: 1) temperatura corporal anormal (inferior a 36 °C ou superior a 38 °C), 2) batimento cardíaco acelerado (mais de 90 batimentos por minuto), 3) taquipeneia resultante de uma taxa respiratória elevada (mais de 20 respirações por minuto ou hiperventilação) e 4) alteração na contagem de leucócitos (Bone et al., 1992). A presença de uma hemocultura positiva e a identificação de pelo menos 3 destes critérios aumenta a probabilidade de se tratar de uma infeção em mais de 70% (Elzi et al., 2012).
10
De forma a aumentar a especificidade e sensibilidade de diagnóstico, várias características genotípicas e fenotípicas de isolados comensais e clínicos têm vindo a ser estudadas, com o objetivo de encontrar diferenças que sirvam de marcadores para a distinção entre contaminação e infeção. Ao nível do genótipo, os esforços centram-se, maioritariamente, no estudo de genes específicos. O estudo dos genes bhp, atlE, fbe, embp e aap revelou-se insuficiente uma vez que foi incapaz de estabelecer uma associação entre a origem clínica e comensal da bactéria (Mekni et al., 2012). O mesmo foi observado na tentativa de associação dos genes icaA e aap e a capacidade de formação de biofilme (Freitas et al., 2018; Līduma et al., 2012). Embora os genes icaA, icaB e icaC tenham uma prevalência significativamente mais alta nas estirpes clínicas, não demonstram ser suficientemente discriminatórios (Mekni et al., 2012). No entanto, a presença do gene clpP, que parece promover a formação de biofilme e o crescimento da bactéria (Wang et al., 2007), ou a presença do gene mecA, que está fortemente relacionada com a formação de biofilme nas estirpes clínicas (Cafiso et al., 2004; Frebourg et al., 2000; Petrelli et al., 2006), está associada a um aumento da virulência de S. epidermidis. Também a presença da sequência de inserção 256, a qual provoca rearranjos no ADN (Ziebuhr et al., 2000), parece promover a formação de biofilme (Petrelli et al., 2006), podendo, assim, ser considerada como um marcador de virulência (Ziebuhr et al., 1999). Outros estudos centram-se na possibilidade de a sequenciação das diferentes estirpes de S. epidermidis poder constituir um fator decisivo na discriminação de isolados comensais e clínicos, tendo sido sugerido o gene fdh como um potencial marcador, ainda que estivesse presente em apenas 23% das estirpes comensais estudadas (Conlan et al., 2012). No entanto, o processo de sequenciação é ainda laborioso e dispendioso e, por isso, torna-se difícil de implementar no contexto hospitalar (Kleinschmidt et al., 2015).
No que refere ao fenótipo, a associação de características tais como resistência a antibióticos (Flores-páez et al., 2015), produção de hemolisinas (Barretti et al., 2009; Cunha et al., 2006), expressão da proteína de superfície I (Söderquist et al., 2009) e do ácido poliglutâmico (Kocianova et al., 2005), bem como a capacidade destas diferentes estirpes para formar biofilme (Freitas et al., 2018; Līduma et al., 2012; Mekni et al., 2012; Olson et al., 2014) foi também efetuada, não conseguindo, contudo, distinguir com elevada sensibilidade estirpes comensais de clínicas.
Embora se tenha conseguido estabelecer uma associação mais frequente de alguns destes genes ou características fenotípicas com estirpes invasivas de S. epidermidis, até agora, não foi possível estabelecer um método com sensibilidade suficiente para auxiliar os técnicos e os médicos a fazer um diagnóstico mais preciso das infeções causadas por S. epidermidis (Kleinschmidt et al.,
11
2015). Assim, a procura por novos marcadores é necessária e urgente. Apesar da formação de biofilmes ser o fator de virulência mais importante de S. epidermidis (Vuong e Otto, 2002), existem outros fatores que podem igualmente contribuir para a sua virulência. O sistema Agr é um desses exemplos, uma vez que permite que as células respondam às necessidades fisiológicas, sintetizando, entre outras, diversas enzimas, nomeadamente proteases (Le e Otto, 2015). Assim, a disfuncionalidade do sistema Agr, a qual acontece através de mutações no locus agr, particularmente no gene agrC (Villaruz et al., 2010), contribui, por um lado, para a formação de biofilmes mais coesos e espessos, devido à ausência da produção de proteases que degradam os componentes da matriz e de proteínas com características surfactantes como as PSM, que estão sob a sua regulação (Le e Otto, 2015). Por outro lado, contribui para a manutenção de um perfil menos inflamatório, pois as proteases com ação nas células do hospedeiro também deixam de ser produzias. Desta forma, a perda de funcionalidade deste sistema pode aumentar a capacidade de sobrevivência desta bactéria no hospedeiro e contribuir para a manutenção da infeção (Yarwood e Schlievert, 2003). Aliás, vários estudos reportaram uma maior prevalência de disfuncionalidade do sistema Agr em estirpes clínicas (Vuong et al., 2004c), estando estas particularmente associadas a infeções relacionadas com dispositivos médicos e infeções da corrente sanguínea (He et al., 2019). Adicionalmente, também o conhecimento da morfologia das colónias pode ser crucial para obter diagnósticos precisos, pois as mudanças na morfologia podem ser indicativas de alterações nas células. Estas alterações são igualmente significativas tendo em conta o modo de crescimento da bactéria, seja este em modo planctónico ou em biofilme (Sousa et al., 2013). Assim, embora o impacto das variações provocadas na forma, cor, textura e margem das colónias não tenha, ainda, sido explorado em S. epidermidis, o seu estudo poderá trazer benefícios no auxílio ao diagnóstico de infeções, tal como acontece atualmente com outras bactérias (Sousa et al., 2013).
O elevado número de infeções causadas por esta bactéria e a dificuldade em obter um diagnóstico preciso têm, portanto, desencadeado uma procura por marcadores que permitam distinguir, inequivocamente, uma infeção de uma simples contaminação da amostra.
1.5. Objetivo
Tendo em consideração a problemática existente em relação à obtenção de diagnósticos precisos em infeções provocadas por S. epidermidis, esta dissertação teve como objetivo tentar encontrar diferenças fenotípicas entre isolados comensais e clínicos que possam servir como
12
referência para estudos futuros e, eventualmente, auxiliar a identificação de marcadores que poderão ser utilizados para o desenvolvimento de novos testes de diagnóstico. Para tal, 3 isolados comensais e 3 isolados clínicos foram caracterizados, após interação com sangue humano, em relação à sua:
1) Capacidade para responder à atividade bactericida do sangue humano; 2) Capacidade para excretar proteases;
3) Morfologia das colónias.
Adicionalmente, células em estado planctónico e células de biofilmes foram analisadas de forma a tentar identificar características que possam estar associadas apenas a um dos fenótipos e que possam ajudar na distinção entre estirpes comensais e invasivas.
É importante referir que este estudo está integrado numa tese de doutoramento em execução, cujo objetivo é desenvolver um método de diagnóstico acessível e que concilie vários parâmetros de avaliação, de forma a aumentar a precisão e a sensibilidade do diagnóstico das infeções causadas por S. epidermidis.
2. Materiais e métodos
2.1. Declaração de ética e colheita de sangue humano
A colheita de sangue humano foi feita a voluntários adultos saudáveis de acordo com o protocolo aprovado pela Subcomissão de Ética para as Ciências da Vida e da Saúde da Universidade do Minho (SECVS 002/2014 (ADENDA)) e em conformidade com a declaração de Helsínquia e a convenção de Oviedo. O sangue foi recolhido para tubos revestidos com heparina de lítio (Vaccuette®, Greiner bio-one, Áustria) e utilizado num tempo máximo de até 30 min após a sua colheita.
2.2. Bactérias e condições de crescimento
Para este estudo, foram utilizados 3 isolados comensais e 3 clínicos de S. epidermidis, encontrando-se discriminado na Tabela 2 a lista dos mesmos e a respetiva origem. Para cada uma das estirpes, foi feito um crescimento inicial, a partir de um stock guardado a -80 °C, numa placa de
13
caldo tríptico de soja (TSB) (VWR, Pennsylvania, USA) suplementado com 1,5% de agar (Liofilchem, Roseto degli Abruzzi, Itália) (TSA).
Tabela 2. Lista de isolados comensais e clínicos usados nesta dissertação.
ISOLADO ORIGEM PAÍS REFERÊNCIA
MEX60 Desconhecida México (Cerca et al., 2013) DEN69 Desconhecida Dinamarca (Cerca et al., 2013) RP62A (ATCC®35988TM) Sepsis associada a cateter
intravenoso EUA (Christensen et al., 1982) SECOM005A
Comensal Portugal (Oliveira et al., 2015) SECOM020A.1
SECOM030A
Para a preparação das células planctónicas, uma colónia isolada foi transferida para 2,5 mL de TSB (Liofilchem), em matrazes de 10 mL, e incubada a 37 °C e a 120 rpm durante 12 h. Posteriormente, as células foram recolhidas por centrifugação (7 min a 16 000 g e 4 °C) e lavadas duas vezes com 1 mL de 0,9% NaCl. Esta suspensão foi sonicada duas vezes a uma amplitude de 33% durante 10 s (Processador Ultrassónico Modelo CP-750, Cole-Parmer, Illinois, USA) para desagregar as células, mas sem comprometer a sua viabilidade (Freitas et al., 2014). Finalmente, a densidade ótica a 640 nm (DO640nm)foi ajustada a 0,27, que corresponde a aproximadamente 1 × 108
Unidades Formadores de Colónias por mL (UFC/mL), e depois diluída em 0,9% NaCl até obter uma suspensão com 1 × 106 UFC/mL, a qual foi usada para as experiências de incubação com sangue
humano.
Para a formação de biofilmes, uma colónia isolada foi transferida para 2,5 mL de TSB (Liofilchem), em matrazes de 10 mL, e incubada a 37 °C e a 120 rpm durante 17 h. Posteriormente, esta cultura foi diluída em TSB de modo a obter uma suspensão com uma DO640nm de 0,27.
Adicionou-se 10 μL desta suspensão a 1 mL de meio TSB suplementado com 0,4% de glucoAdicionou-se (TSB0,4%G), para
promover a formação de biofilme, numa placa de 24 poços (Thermo Fisher Scientific, Massachussetts, USA) e incubou-se a placa a 37 °C, sem agitação. Após 24 h (± 1 h), o meio consumido foi cuidadosamente retirado e, de igual modo, adicionado 1 mL de TSB0,4%G. A placa foi posteriormente
incubada nas condições descritas anteriormente. Passadas mais 24 h (± 1 h), o meio consumido foi retirado cuidadosamente e os biofilmes foram lavados com 1 mL de 0,9% de NaCl (VWR) para remover
14
células planctónicas depositadas no biofilme. Posteriormente adicionou-se 1 mL de 0,9% de NaCl, rompeu-se cada um dos biofilmes com o auxílio de uma ponta e sonicou-se duas vezes, diretamente na placa, a uma amplitude de 33% durante 10 s. Os biofilmes de cada uma das estirpes (4 biofilmes por estirpe) foram misturados, de forma a reduzir a variabilidade inerente ao crescimento em biofilme (Sousa et al., 2014), e as células recolhidas por centrifugação (10 min a 7 000 g e a 4 °C). Finalmente, as células foram suspendidas em 1 mL de 0,9% NaCl e a DO640nm medida e ajustada a 2,7, de modo a
obter uma suspensão com uma concentração de aproximadamente 1 × 108 UFC/mL. Seguidamente,
a suspensão foi diluída de forma seriada, em 0,9% NaCl, até obter uma suspensão com aproximadamente 1 × 106 UFC/mL, a qual foi usada para as experiências de incubação com sangue
humano.
2.3. Avaliação da formação de biofilme
A capacidade de formação de biofilme pelas estirpes utilizadas nesta dissertação foi avaliada através da quantificação da biomassa, por densidade ótica, e através da quantificação do número de células cultiváveis, pela enumeração de UFC. Os biofilmes foram formados em placas de 24 poços, tal como descrito no procedimento anterior. Passadas 48 h de crescimento o meio consumido foi retirado cuidadosamente e os biofilmes lavados com 1 mL de 0,9% de NaCl (VWR). Posteriormente adicionou-se 1 mL de 0,9% de NaCl, rompeu-se cada um dos biofilmes com o auxílio de uma ponta e sonicou-se duas vezes, diretamente na placa, a uma amplitude de 33% durante 10 s. Os biofilmes foram recolhidos e a DO640nm da suspensãoregistada. Para que os valores de DO640nm estivessem dentro
da linearidade do espectrofotómetro as amostras foram previamente diluídas, 1:5, em 1 mL de 0.9% NaCl. Após medida a densidade ótica, o número de UFC foi determinado. Para tal, uma alíquota de 50 µL foi retirada da suspensão inicial e usada para fazer diluições decimais em 450 μL de 0.9% NaCl. No final, 10 μL de cada diluição foram plaqueados, em duplicado, em placas de TSA e incubadas a 37 °C durante 20 h.
2.4. Preparação de placas de leite
As placas de leite utilizadas para avaliar a capacidade proteolítica das estirpes antes e depois da interação com sangue humano foram preparadas misturando 2% de triptona (Liofilchem), 1% de extrato de levedura (Liofilchem), 1% de NaCl (VWR) e 3% de agar (Liofilchem), finalizando o processo na autoclave durante 15 min a 121 °C. Simultaneamente, e em separado, uma solução de 2% de leite
15
desnatado (Oxoid, Hampshire, UK) foi preparada e agitada durante 1 h, finalizado o processo na autoclave durante 5 min a 121 °C. Por fim, esta solução foi adicionada à primeira, em agitação e sob condições de esterilidade, e foram distribuídos 13 mL de meio por placas de petri de 90 mm.
2.5. Determinação da sobrevivência e capacidade proteolítica de isolados comensais e clínicos após interação com sangue humano
A capacidade de sobrevivência dos isolados comensais e clínicos, bem como a atividade proteolítica dos mesmos foi avaliada após interação com sangue humano, tal como descrito anteriormente (França et al., 2016b), com algumas alterações. Resumidamente, em tubos de 2 mL, misturou-se 450 μL de sangue humano com 50 μL de suspensão bacteriana com 1 × 106 UFC/mL,
de modo a obter uma concentração final de bactéria no sangue de 1 × 105 UFC/mL. Posteriormente
incubou-se esta mistura a 80 rpm e a 37 °C durante 180 min. Após 30, 90 e 180 min, o número de UFC foi determinado. Resumidamente, uma alíquota de 20 μL foi removida em cada tempo e diluições decimais seriadas foram preparadas em 180 μL de 0.9% NaCl. De seguida, 10 μL de cada diluição foram plaqueados, em duplicado, em placas de TSA e incubadas a 37 °C durante 18 h. O número de UFC/mL antes da incubação com sangue (0 min) foi determinado e utilizado como controlo.
A avaliação da capacidade proteolítica foi efetuada através de placa de leite desnatado, tal como descrito anteriormente (Vuong et al., 2000), após interação com o sangue humano. Assim, 10 μL de cada diluição foram plaqueados, em duplicado, em placas de leite e incubadas a 37 °C durante 18 h. O número de UFC/mL antes da incubação com sangue (0 min) foi determinado e utilizado como controlo. As colónias com degradação do meio ao seu redor foram consideradas colónias positivas para a atividade proteolítica.
2.6. Análise da morfologia das colónias dos isolados comensais e clínicos após interação com sangue humano
A morfologia das colónias formadas pelos vários isolados, após incubação com sangue humano, foi analisada em TSA, como descrito anteriormente (Silva et al., 2016; Sousa et al., 2013). Resumidamente, após 180 min de interação com sangue humano, uma alíquota de 20 µL foi retirada, diluída como descrito anteriormente e 10 µL de cada uma das diluições foram plaqueados, em duplicado, em placas de TSA, as quais foram incubadas a 37 °C por 18, 24 e 96 h. As colónias foram observadas através de uma lupa (Olympus SZ-CTV), fotografou-se com uma câmara CCD (AVC, D5CE,
16
Sony, Tóquio, Japão) e classificou-se de acordo com 4 parâmetros: forma, cor, textura e margem. A morfologia das colónias antes da incubação com sangue (0 min) foi avaliada como controlo.
2.7. Análise estatística
A significância estatística dos resultados obtidos foi analisada através do GraphPad Prism® versão 8 (GraphPad Software, Inc., San Diego, CA, USA). A análise das diferenças entre células planctónicas e de biofilme, em cada um dos tempos analisados, bem como a análise da diferença de cada uma das células ao longo do tempo foram feitas através do teste de T de Student. Todos os testes foram realizados com um nível de confiança de 95%.
3. Resultados e discussão
A natureza comensal e ubíqua de S. epidermidis na pele e mucosas humanas dificultam o diagnóstico de infeções provocadas por esta bactéria e acarreta custos clínicos e económicos que, em alguns casos, poderiam ser evitados (Dimick et al., 2001). Adicionalmente, a capacidade de S. epidermidis para formar biofilmes permite-lhe sobreviver e adaptar a ambientes com condições hostis (Otto, 2012b), tal como o ambiente encontrado no hospedeiro. Deste modo, nesta dissertação, foram caracterizadas não só células planctónicas, mas também células de biofilmes, de um conjunto de estirpes clínicas e comensais. Contudo, como nem todas as estirpes apresentam capacidade para formar biofilmes (Handke et al., 2004), em primeiro lugar, antes de proceder à caracterização fenotípica de cada uma das estirpes clínicas e comensais selecionadas após interação com sangue humano, estas foram avaliadas quanto à sua capacidade para formar biofilme, através da quantificação do total de biomassa (Figura 4A) e do número de células cultiváveis (Figura 4B).
A estirpe RP62A é uma estirpe frequentemente utilizada na comunidade científica estando, por isso, bastante bem caracterizada. Esta é considerada uma forte produtora de biofilme (Mack et al., 1996) e, por isso, é possível utilizá-la como referência para as restantes estirpes em estudo, no que respeita à capacidade de formação de biofilme. A média de densidade ótica a 640 nm (DO640nm)
obtida para a RP62A foi de 2,8 e, comparando com as restantes estirpes clínicas (MEX60 e DEN69), este valor é o mais elevado. Relativamente às estirpes comensais (SECOM005A, SECOM020A.1, SECOM030A), todas formam biofilmes fortes, sendo a estirpe SECOM020A.1 a que possui melhor
17
capacidade de entre todas as estirpes analisadas. Embora existam diversos estudos que associam uma capacidade superior para formar biofilmes com as estirpes clínicas (Mekni et al., 2012; Rohde et al., 2007), neste caso, todas as estirpes selecionadas, sejam de origem clínica ou comensal, formam biofilmes considerados fortes quando comparados com a estirpe RP62A. Devemos, contudo, considerar que foram avaliadas apenas três estirpes de cada um dos grupos (clínicas e comensais), pelo que não se podem tirar conclusões de representatividade epidemiológica. Relativamente à quantidade de células cultiváveis nos biofilmes formados, tanto nas estirpes clínicas como nas estirpes comensais, esta é superior a 8 log10 UFC/mL. No entanto, apesar de na estirpe SECOM020A.1 se
verificar uma DO640nm mais elevada, não se verifica uma quantificação de células igualmente superior.
Os valores elevados de densidade ótica nem sempre se refletem na quantidade de células cultiváveis existentes uma vez que, para além destas, a leitura da densidade ótica também inclui células mortas, células viáveis mas não cultiváveis (Zandri et al., 2012) e polissacarídeos, proteínas e outros constituintes da matriz (Sousa et al., 2009). Por outro lado, embora os biofilmes da estirpe MEX60 apresentem uma DO640nm 1,6 vezes inferior à da estirpe RP62A, os biofilmes formados por esta estirpe
contêm aproximadamente a mesma quantidade de células cultiváveis, o que sugere que os biofilmes formados pela MEX60 apresentam menos matriz.
Figura 4. Quantificação do total de biomassa (A) e do número de células cultiváveis (log10 UFC/mL)
(B) nos biofilmes de 48 h formados por cada uma das estirpes clínicas (RP62A, MEX60, DEN69) e comensais (SECOM005A, SECOM020A.1, SECOM030A) em estudo. As barras representam a média e o erro o desvio-padrão de três experiências independentes. Os resultados obtidos para os valores de biomassa e de
células cultiváveis, em comparação com a estirpe RP62A, foram analisadas utilizando o teste t-Student com * a
18
Após a confirmação da capacidade de formação de biofilme das estirpes em estudo, foi necessário avaliar a correlação entre DO640nm e o número de células cultiváveis de forma a conseguir,
nas experiências de co-incubação com sangue humano, usar o mesmo número inicial de células cultiváveis em todas as condições. Desta forma, a DO640nm de células planctónicas e de biofilmes, de
todas as estirpes, foi ajustada a 0,27 e o número de células cultiváveis determinado através da contagem do número de UFC/mL. No que respeita à comparação entre estirpes clínicas e comensais, dentro de cada um dos fenótipos, não se observaram diferenças significativas. Contudo, no que respeita à comparação entre fenótipos, grandes diferenças foram observadas. Para as células planctónicas, uma DO640nm de 0,27 correspondeu, aproximadamente, a 1 × 108 UFC/mL, enquanto
para as células dos biofilmes, correspondeu a, aproximadamente, 1 × 107 UFC/mL. Assim, para obter
a mesma quantidade de células cultiváveis, a DO640nm da suspensão com células dos biofilmes deverá
ser 10 vezes superior à suspensão de células planctónicas. Na formação de biofilme, principalmente na fase de maturação, o biofilme torna-se mais espesso devido aos componentes da matriz (Otto, 2012b) e, consequentemente, isto pode traduzir-se em um aumento da densidade ótica sem que haja um aumento concomitante de células, o que pode justificar a necessidade de ter uma DO 10 vezes superior nas células de biofilme, de modo a igualar o número de células cultiváveis. Esta observação pode ainda estar associada ao facto de no crescimento em biofilme haver um maior número de células viáveis mas não cultiváveis (Zandri et al., 2012), constituindo uma limitação da técnica usada para aferir a sobrevivência da bactéria. Uma forma de ultrapassar estes problemas seria ajustar os inóculos através de técnicas de coloração de células vivas e mortas, vulgarmente designadas de LIVE/DEAD, associadas a um microscópio ou citómetro de fluxo, de forma a permitir contar todas a células viáveis, o que inclui células cultiváveis e não cultiváveis. Nesse caso, contudo, também seria necessário analisar o resultado final através do mesmo método e não através da contagem de UFC, o que por si só tem várias limitações. No caso da utilização do citómetro de fluxo, não seria possível fazer a contagem precisa das células após interação com o sangue, pois este tem um limite de deteção de 105 células/mL que é exatamente o número de células incubado com o sangue humano. No caso do
microscópio de fluorescência, seria extremamente complicado identificar e contar as bactérias no meio das células sanguíneas uma vez que estas também ficariam coradas com os agentes intercalantes. Assim, embora com algumas limitações, o método de contagem de UFC foi o utilizado.
19
3.1. Avaliação da capacidade de sobrevivência de
S. epidermidis
após interação com sangue humanoQuando S. epidermidis entra em contacto com o sangue humano é confrontado com os mecanismos de defesa natural do hospedeiro. No entanto, esta espécie é capaz de superar a ação bactericida do sangue humano (França et al., 2014). Assim, a capacidade de sobrevivência em sangue humano de estirpes comensais e clínicas foi avaliada, tanto para células planctónicas como para células de biofilme (Figura 5). Este ensaio foi limitado até ao máximo de 180 min de incubação no sangue, devido à utilização de células de biofilmes. Isto é relevante porque está descrito que, uma vez quebrada a estrutura e o estímulo do crescimento em biofilme, o fenótipo das células do biofilme irá reverter para o fenótipo planctónico (Wang et al., 2011). Em 2014, Cerca e os seus colaboradores demonstraram que em S. epidermidis, no que refere à tolerância a antibióticos, em particular à vancomicina e penicilina, e à transcrição de genes associados à produção da PNAG e via das pentoses fosfato, esta reversão acontece, aproximadamente, após 90 min em crescimento planctónico (Cerca et al., 2014). No entanto, estas experiências foram efetuadas apenas numa estirpe (9142) e na ausência de fatores do hospedeiro. Assim, tendo em consideração que cada estirpe pode responder de forma diferente e como não sabemos de que forma a presença de fatores do hospedeiro podem influenciar a reversão de fenótipo, o período de análise foi alargado até 180 min. Esse período não foi, contudo, mais alargado pois experiências feitas por membros do grupo de investigação demonstraram que a viabilidade das células sanguíneas com capacidade fagocítica é significativamente afetada 4 h após a recolha do sangue, tendo consequências importantes nos resultados obtidos relativamente à capacidade de sobrevivência da bactéria (resultados não publicados). Adicionalmente, a utilização de uma concentração inicial de células cultiváveis de 105 UFC/mL foi escolhida de modo a melhor
mimetizar a concentração de bactéria normalmente encontrada em situação de infeção (Opota et al., 2015) e, deste modo, obter resultados mais relevantes do ponto de vista clínico.
20
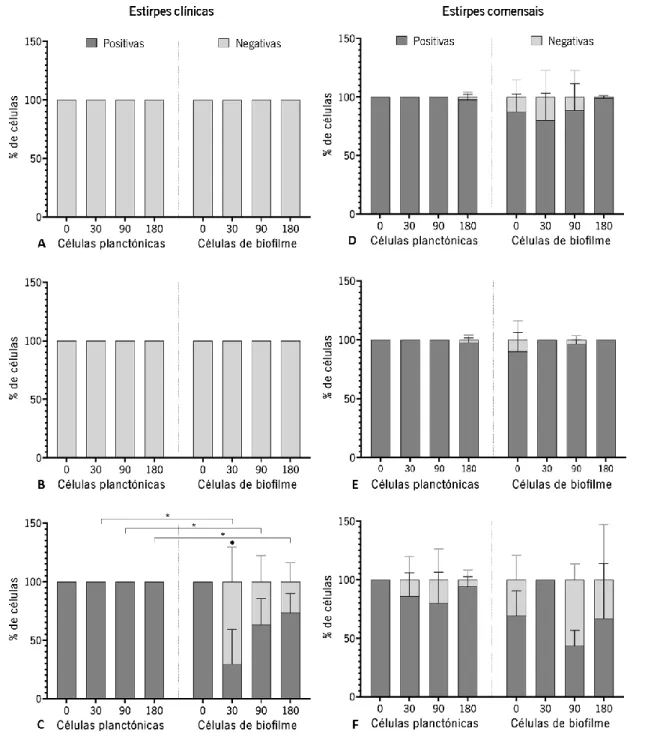
Figura 5. Avaliação da capacidade de sobrevivência de S. epidermidis em sangue humano. (A) RP62A,
(B) MEX60, (C) DEN69, (D) SECOM005A, (E) SECOM020A.1, (F) SECOM030A. As barras representam a média com o desvio-padrão de pelo menos duas experiências independentes. As diferenças estatísticas para os diferentes tempos de incubação (30, 90 e 180 min), em relação ao controlo (0 min), para as células planctónicas e
de biofilme, foram determinadas utilizando o teste t-Student, com • a representar diferenças significativas (p <0,05).
As diferenças estatísticas entre as células planctónicas e as de biofilme, para cada um dos tempos analisados, foi
21
De entre as estirpes clínicas estudadas, de uma forma geral, é visível uma diminuição gradual da concentração de bactéria, tanto para as células planctónicas como de biofilme, a partir dos 30 min de incubação com sangue humano, à exceção da estirpe DEN69, onde parece haver uma manutenção da concentração de células planctónicas ao longo do tempo. Relativamente à comparação entre fenótipos (planctónico versus biofilme) é possível verificar que nas estirpes RP62A e DEN69 há uma redução ligeiramente superior no número de células de biofilmes do que planctónicas ao longo dos tempos analisados, sendo, no entanto, a diferença entre células planctónicas e de biofilme apenas significativa (p = 0,0425) na estirpe DEN69, após 180 min de interação com sangue humano. O perfil contrário foi observado na estirpe MEX60, onde se observou uma maior redução no número de células planctónicas após 180 min de interação com sangue humano (p = 0,0341), levando a uma diferença estatisticamente significativa entre o resultado obtido para células planctónicas e para células de biofilme (p = 0,0261). Nas estirpes comensais também se observou uma manutenção da concentração de células, sejam elas planctónicas ou de biofilmes, até aos 90 (SECOM005A e 030A) ou 180 min (SECOM020A.1) de incubação com sangue humano, observando-se depois uma diminuição da carga bacteriana, atingindo valores estatisticamente significativos apenas aos 180 min de interação nas estirpes SECOM005A e SECOM030A (p = 0,0071 e p = 0,0037, respetivamente). Novamente, num dos casos há uma diminuição superior da quantidade de células planctónicas (SECOM005A) e noutro caso há uma diminuição superior nas células de biofilmes (SECOM030A).
Considerando a informação disponível na literatura, seria de esperar que as células dos biofilmes tivessem uma capacidade de sobrevivência superior às células planctónicas (Cerca et al., 2006). Contudo, um estudo in vivo, efetuado recentemente por membros do grupo de investigação, demonstrou que a PNAG parece ter um efeito pró-inflamatório, estimulando a ação de células imunitárias do hospedeiro e levando, consequentemente, a uma remoção mais rápida da circulação sanguínea das células com PNAG à superfície (Ferreirinha et al., 2016). Assumindo que as células dos biofilmes apresentam mais PNAG à superfície (Cerca et al., 2006), esta pode ser a razão pela qual as células dos biofilmes foram fagocitadas mais rapidamente do que as células planctónicas. Contudo, só usando uma estirpe mutante para a PNAG ou determinando a quantidade de PNAG na superfície das células é que se poderia tirar ilações precisas relativamente ao envolvimento desta molécula. Também a quantidade de PSM produzidas pode afetar a resposta das células imunitárias em circulação no sangue humano (Vuong et al., 2004a). Para além disso, uma vez que a análise da sobrevivência da bactéria foi efetuada através de culturabilidade, e não de viabilidade das células bacterianas, devemos considerar a possibilidade de que a diminuição do número de células cultiváveis
22
pode resultar da entrada das células em dormência, tal como já foi observado em biofilmes de S. epidermidis após interação com plasma humano (França e Cerca, 2016), e não de uma ativação superior das células fagocíticas.
Tendo em conta os resultados obtidos, a capacidade de sobrevivência das estirpes em estudo não foi influenciada pelo tipo de célula. Da mesma forma, também o facto de a estirpe ser de origem comensal ou clínica não permitiu estabelecer qualquer relação na sua capacidade de sobrevivência.
3.2. Avaliação da atividade proteolítica de
S. epidermidis
após interação com sangue humanoPara além da capacidade de formar biofilme, outros fatores podem igualmente contribuir para a virulência de S. epidermidis, destacando-se a secreção de proteases (Vuong et al., 2000), as quais podem contribuir para a destruição do tecido e proteínas do hospedeiro (Otto, 2012a), e de PSM com atividade citolítica (Bowden et al., 2005; Otto, 2009). Nesta espécie, a produção de PSM e de várias proteases é controlada pelo sistema Agr (Nadell et al., 2008), no entanto, existem estirpes que não possuem um sistema Agr funcional (Vuong et al., 2004c). A disfuncionalidade deste sistema pode ser positiva para a sobrevivência da bactéria uma vez que leva a uma resposta menos pró-inflamatória (Vuong et al., 2004a). Desta forma, é importante explorar esta característica e averiguar se esta poderá ser usada como marcador entre estirpes clínicas e comensais. Para tal, neste estudo, a análise da possível disfuncionalidade do sistema Agr das estirpes comensais e clínicas após interação com sangue humano foi feita através de placas de leite desnatado, tal como descrito anteriormente (Vuong et al., 2000). Como a perda de funcionalidade do sistema Agr leva à ausência da produção das proteases sob a sua regulação (Vuong et al., 2004c), espera-se uma ausência de atividade proteolítica em placas de leite.
Tal como se pode observar na Figura 6, das estirpes clínicas em estudo, a RP62A e MEX60 não apresentaram atividade proteolítica, mesmo antes de incubar com sangue humano, em nenhuma das experiências independentes realizadas, sugerindo, por isso, que estas estirpes possuem um sistema Agr não funcional. É também importante salientar que este perfil negativo não se alterou após a incubação com sangue humano. Pelo contrário, a estirpe DEN69, também de origem clínica, apresentou atividade proteolítica de 100% inicialmente. Entre as células planctónicas e células de biofilme, a diferença de atividade proteolítica, em cada um dos tempos analisados, é estatisticamente significativa após 30, 90 e 180 min de interação com sangue humano. Comparando, o tipo de célula