UNIVERSIDADE FEDERAL DA PARAIBA
CENTRO DE CIÊNCIAS DA SAÚDE
LABORATÓRIO DE TECNOLOGIA FARMACÊUTICA
“Prof. Delby Fernandes de Medeiros”
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS
NATURAIS E SINTÉTICOS BIOATIVOS
VÍTOR PRATES LORENZO
ESTUDO FITOQUÍMICO COM FINS FARMACOLÓGICOS
DA ALGA BENTÔNICA Caulerpa racemosa
VÍTOR PRATES LORENZO
ESTUDO FITOQUÍMICO COM FINS FARMACOLÓGICOS
DA ALGA BENTÔNICA Caulerpa racemosa
Dissertação apresentada à Coordenação do Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos do Laboratório de Tecnologia Farmacêutica, da Universidade Federal da Paraíba “Prof. Delby Fernandes de Medeiros”, em cumprimento às exigências para a obtenção do Grau de MESTRE EM PRODUTOS NATURAIS E SINTÉTICOS BIOATIVOS.
Área de Concentração: FARMACOQUÍMICA.
ORIENTADORA: Profª Drª Maria Célia de Oliveira Chaves
L869e Lorenzo, Vítor Prates.
Estudo fitoquímico com fins farmacológicos da alga bentônica Caulerpa racemosa / Vitor Prates Lorenzo. - - João Pessoa : [s.n.], 2010.
172 f. il.
Orientador: Maria Célia de Oliveira Chaves. Dissertação (Mestrado) – UFPB/CCS.
1.Produtos naturais. 2.Alga verde. 3.Caulerpa racemosa. 4.Fitoquímica. 5.Farmacologia.
VÍTOR PRATES LORENZO
ESTUDO FITOQUÍMICO COM FINS FARMACOLÓGICOS
DA ALGA BENTÔNICA Caulerpa racemosa
Aprovado em 27 de agosto de 2010
COMISSÃO EXAMINADORA
_____________________________________ Profª Drª Maria Célia de Oliveira Chaves
Orientadora
_____________________________________ Profª Drª Márcia Ortiz Mayo Marques
(Universidade de São Paulo) Examinadora externo
_____________________________________ Profª Drª Maria de Fátima Vanderlei de Souza
AGRADECIMENTOS
À Deus, pelo dom da vida e por estar sempre ao meu lado em todos os momentos, sendo o meu socorro nos períodos de tribulação. A Ele toda Honra e Glória para todo sempre.
A minha esposa Livya pelo incentivo desde a escolha por entrar no mestrado, pela compreensão durante minha ausência, pelo amor e companheirismo me auxiliando inclusive na bancada.
Ao meu pai Jorge e minha mãe Lenita pela dedicação, apoio e amor, estando sempre ao meu lado, quer vibrando com minhas conquistas ou chorando com minhas decepções; meus irmãos Alex e Everton pela preocupação, cuidado e companheirismo.
A minha família pelo suporte emocional, carinho, educação e apoio em todas as decisões de minha vida, amo todos vocês.
A Profª Drª Maria Célia de Oliveira Chaves pela amizade, ensinamentos e por ter me orientado e possibilitado realizar este grande sonho.
A Profa. Dra. Bárbara Viviana de Oliveira Santos, pela auxílio na bancada, pela amizade, atenção e grande estímulo na elaboração deste trabalho.
A Profa. Dra. Magna Suzana Alexandre Moreira e sua equipe pela realização dos ensaios farmacológicos.
Ao Prof. Dr. George Emmanuel de Miranda pela coleta e identificação da alga.
A Profa. Dra. Bagnólia Araújo pela atenção, amizade e zelo desde a graduação.
A Profa. Dra. Maria de Fátima Vanderlei pelos ensinamentos, conversas e experiência passadas durante nosso convívio.
Vicente Carlos pela amizade, atenção e obtenção dos espectros, continuaremos na caminha durante o doutorado.
Raimundo Nonato por resolver sempre com um sorriso todas as “broncas” cotidianas do laboratório; Tânia Maria Alves de Araújo, secretária do curso de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos pela atenção e presteza; a seu Bill pelos solventes; Vanderlei e Wellington pela dedicação; Maria da Glória pela atenção e amizade; equipe da limpeza, em especial ao amigo Dinho.
Aos nobres amigos do LTF Tiago Nogueira, Roosevelt Gomes, botafoguense Steno Lacerda, Wemerson, companheiro Marcelo Manso, Sócrates Golzio, Stanley Chavez, Rafael Rodrigues, Evandro.
A equipe da professora Célia: Robson, Rogério, Maisa, Jacqueline, Jeane, Harlei e Danielle pelo auxílio diário na bancada e pela experiência compartilhada.
À banca examinadora pela disponibilidade em contribuir com este trabalho.
Ao Prof. Dr. José Maria Barbosa Filho coordenador do projeto algas e demais professores do curso de pós-graduação por compartilhar do vasto conhecimento.
Aos amigos do laboratório de farmacoquímica.
A todos os meus colegas da turma de Mestrado pela boa convivência durante as disciplinas.
Aos amigos Thiago, Neta, Paulo, Camila, Rodrigo, Leleco, Dr. Levy, Janete.
Ao pessoal da Igreja Batista Gênesis pelas palavras de sabedoria e orações constantes.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa concedida.
MUITO OBRIGADO !!!!!!!!
SUMÁRIO
LISTA DE ABREVIATURAS E SIGLAS ... x
LISTA DE QUADROS ... xii
LISTA DE ESQUEMAS ... xiii
LISTA DE GRÁFICOS ... xiv
LISTA DE TABELAS ... xv
LISTA DE FIGURAS ... xvi
RESUMO ... xxii
ABSTRACT ... xxiii
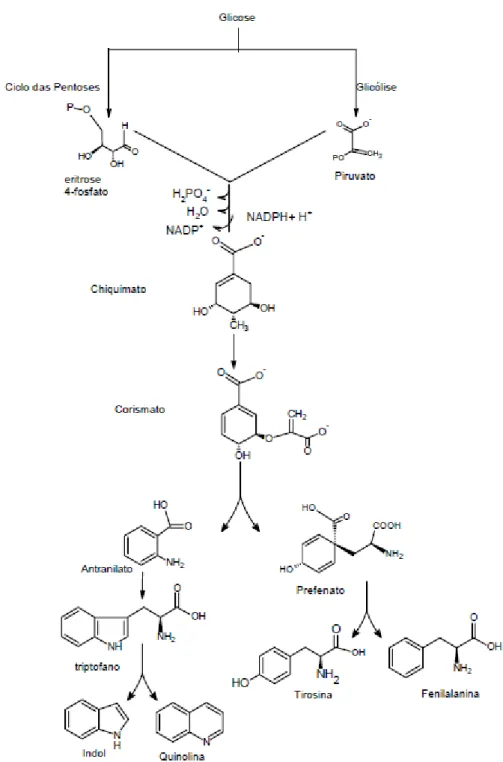
1. INTRODUÇÃO ... 2
2. OBJETIVOS ... 6
2.1 - Objetivo geral ... 6
2.2 – Objetivos específicos ... 6
3. FUNDAMENTAÇÃO TEÓRICA ... 8
3.1. - Considerações gerais sobre algas ... 8
3.1.1 - Importância das algas em diversas áreas ... 10
3.2 - Considerações sobre a família Caulerpaceae ... 12
3.3 - Considerações sobre o gênero Caulerpa J.V. Lamour. ... 13
3.3.1 - Importância econômica e ecológica do gênero ... 15
3.3.2 - Revisão fitoquímica e farmacológica do gênero Caulerpa ... 15
3.4 - Considerações sobre a Espécie Caulerpa racemosa (Forssk.) J.Agardh ... 19
3.4.1 - Levantamento fitoquímico e farmacológico da Caulerpa racemosa ... 20
3.4.2 - Posição sistemática de Caulerpa racemosa ... 22
3.5 - Considerações químicas e biossintéticas... 22
3.5.1 – Derivados porfirínicos ... 22
3.5.2 – Alcalóides indólicos ... 24
4. EXPERIMENTAL ... 28
4.1 - Levantamento bibliográfico ... 28
4.2 - Coleta do material botânico ... 28
4.3 - Processamento de Caulerpa racemosa ... 28
4.4 - Obtenção dos extratos de Caulerpa racemosa ... 28
4.6 - Fracionamento cromatográfico do extrato clorofórmico ... 30
4.7 - Caracterização estrutural dos constituintes químicos isolados de Caulerpa racemosa ... 32
4.7.1 - Ressonância Magnética Nuclear ... 32
5. RESULTADOS E DISCUSSÕES ... 35
5.1. Caracterização estrutural da substância Cr-1 ... 35
5.2. Caracterização estrutural da substância Cr-2 ... 47
5.3. Caracterização estrutural da substância Cr-3 ... 72
5.4. Caracterização estrutural da substância Cr-4 ... 96
5.5 Atividades antinociceptiva e antiinflamatória ... 114
6. CONCLUSÕES ... 120
7. REFERÊNCIAS ... 122
8. ANEXOS ... 129
LISTA DE ABREVIATURAS E SIGLAS
δ Deslocamento químico
AcOEt Acetato de etila
Act Acetona
CC Cromatografia em coluna
CCDA Cromatografia em camada delgada analítica
CCDP Cromatografia em camada delgada preparativa
CDCl3 Clorofórmio deuterado
COSY COrrelation SpectroscopY
Cr-1 Substância 1 isolada da espécie Caulerpa racemosa
Cr-2 Substância 2 isolada da espécie Caulerpa racemosa
Cr-3 Substância 3 isolada da espécie Caulerpa racemosa
Cr-4 Substância 4 isolada da espécie Caulerpa racemosa
d Dupleto
dd Duplodupleto
dl Duplo largo
dt Duplotripleto
EMBRAPA Empresa Brasileira de Pesquisa Agropecuária
Hex Hexano
HMBC Heteronuclear Multiple Bond Correlation
HMQC Heteronuclear Multiple Quantum Coherence
Hz Hertz (ciclos por segundo)
IV Infravermelho
LTF Laboratório de Tecnologia Farmacêutica
m Multipleto
MeOH Metanol
NAPRALERT NAtural PRoduct ALERT
nm Nanômetro
NOESY Nuclear Overhauser Effect SpectroscopY
ppm Partes por milhão
q Quarteto
RF Fator de retenção
RMN 1H Ressonância magnética nuclear de hidrogênio
s Simpleto
sept Septeto
sl Simpleto largo
t Tripleto
tl Tripleto largo
tq Tripleto de quartetos
LISTA DE QUADROS
Quadro 1: Distribuição dos pigmentos e produto de reserva em algumas
divisões de algas ... 9
Quadro 2: Principais tipos e empregos dos ficocolóides em diversos
gêneros de macroalgas ... 11
Quadro 3: Estruturas químicas de compostos isolados de espécies do
gênero Caulerpa ... 17
Quadro 4: Compostos identificados na espécie Caulerpa racemosa ... 21
Quadro 5: Sistemas de eluição utilizados na CC da fração 14/19, frações
LISTA DE ESQUEMAS
Esquema 1: Obtenção dos extratos hexânico, clorofórmico, acetato
e metanólico ... 29
Esquema 2: Etapas envolvidas no processo cromatográfico do extrato
LISTA DE GRÁFICOS
Gráfico 1 – Distribuição dos táxons de algas no litoral brasileiro ... 10
Gráfico 2 – Número de compostos químicos identificados no gênero
LISTA DE TABELAS
Tabela 1: Dados espectrais da substância Cr-1 ... 45
Tabela 2: Dados espectrais da substância Cr-2 ... 71
Tabela 3: Dados espectrais da substância Cr-3 ... 95
LISTA DE FIGURAS
Figura 1 – Evolução no isolamento de produtos naturais marinhos ... 3
Figura 2 – Aspecto geral de Caulerpa J. V. Lamour. mostrando partes do talo ... 14
Figura 3 – Distribuição do gênero Caulerpa no mundo ... 14
Figura 4 – Caulerpa racemosa em hábitat ... 19
Figura 5 – Caulerpa racemosa inteira ... 20
Figura 6 – Râmulo de Caulerpa racemosa ... 20
Figura 7 - Estrutura da porfirina ... 22
Figura 8 - Estrutura da clorofila a, enfatizando a presença da cadeia lateral e do átomo de magnésio ... 23
Figura 9 - Biossíntese da clorofila a e b ... 24
Figura 10 - Rota biossíntética dos alcalóides indólicos ... 25
Figura 11 - Estrutura básica dos alcalóides indólicos ... 26
Figura 12 - Espectro de Infravermelho (KBr, cm-1) de Cr-1 ... 35
Figura 13 – Multiplicidade dos hidrogênios aromáticos dos núcleos indólicos 36
Figura 14 – Espectro de RMN 1H (CDCl 3, 200 MHz) de Cr-1... 37
Figura 15 – Expansão do espectro de RMN 1H (CDCl 3, 200 MHz) de Cr-1 na região de 7,0 – 7,5 ppm... 38
Figura 16 - Espectro de RMN 13C - APT (CDCl3, 50 MHz) de Cr-1... 39
Figura 17 - Expansão do espectro de RMN 13C - APT (CDCl3, 50 MHz) de Cr-1 na região de 100,0 – 170,0 ppm... 40
Figura 18 - Espectro HMQC (CDCl3, 200 e 50 MHz) de Cr-1 ... 41
Figura 19 - Expansão do espectro HMQC (CDCl3, 200 e 50 MHz) de Cr-1 na região de (6,8 – 8,4 ppm) x (110,0 – 145,0 ppm)... 41
Figura 20 – Correlações espaciais observadas no espectro NOESY... 42
Figura 21 - Expansão do espectro NOESY (200 MHz, CDCl3) de Cr-1 na região de (7,0 – 9,5 ppm) x (7,0 – 9,5 ppm)...... 43
Figura 22 - Espectro HMBC (200 e 50 MHz, CDCl3) de Cr-1...... 44
Figura 23 - Expansão do espectro HMBC (200 e 50 MHz, CDCl3) de Cr-1 na região de (7,0 – 8,4 ppm) x (110,0 – 165,0 ppm)...... 45
Figura 24 - Expansão do espectro HMBC (200 e 50 MHz, CDCl3) de Cr-1 na região de (7,0 – -8,4 ppm) x (110,0 – 145,0 ppm)...... 45
Figura 26 – Estrutura do alcalóide bisindólico caulerpina... 46
Figura 27 - Espectro de Infravermelho (KBr, cm-1) de Cr-2 ... 48 Figura 28 - Derivado porfirínico a e derivado porfirínico b ... 49
Figura 29 - Espectro de RMN 1H (CDCl
3, 500 MHz) de Cr-2 ... 50 Figura 30 - Expansão do espectro de RMN 1H (CDCl
3, 500 MHz) de Cr-2
na região de 0,7 – 2,0 ppm ... 51
Figura 31 - Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cr-2
na região de 3,2 – 5,2 ppm ... 52
Figura 32 - Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cr-2
na região de 6,0 – 9,8 ppm ... 53
Figura 33 - Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cr-2
na região de -1,85 – -1,25 ppm ... 54
Figura 34 - Anel V com C-132 hidrogenado e Anel V com C-132
hidroxilado ... 55
Figura 35 - Cadeia fitílica ... 55
Figura 36 - Espectro de RMN 13C - APT (CDCl3, 125 MHz) de Cr-2 ... 56 Figura 37 - Expansão do espectro de RMN 13C - APT (CDCl
3, 125 MHz)
de Cr-2 na região de 90,0 – 190,0 ppm ... 57
Figura 38 - Expansão do espectro de RMN 13C - APT (CDCl3, 125 MHz)
de Cr-2 na região de 10,0 – 65,0 ppm ... 58
Figura 39 - Espectro HMQC (CDCl3, 500 e 125 MHz) de Cr-2 ... 59 Figura 40 - Expansão do espectro HMQC (CDCl3, 500 e 125 MHz) de
Cr-2 na região de (5,0 – 10,0 ppm) x (60,0 – 125,0 ppm) ... 59
Figura 41 - Expansão do espectro HMQC (CDCl3, 500 e 125 MHz) de
Cr-2 na região de (0,5 – 5,0 ppm) x (10,0 – 55,0 ppm) ... 62
Figura42 – Correlações observadas no espectro HMBC ... 61
Figura 43 - Espectro HMBC (500 e 125 MHz, CDCl3) de Cr-2 ... 61 Figura 44 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de
Cr-2 na região de (6,0 – 10,0 ppm) x (100,0 – 190,0 ppm) ... 62
Figura 45 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de
Cr-2 na região de (0,5 – 5,0 ppm) x (115,0 – 175,0 ppm) ... 62
Figura 46 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de
Figura 47 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de
Cr-2 na região de (-1,74– -1,56 ppm) x (130,0 – 144,0 ppm) ... 63
Figura 48 - Espectro COSY (500 MHz, CDCl3) de Cr-2 ... 64
Figura 49 - Expansão do espectro COSY (500 MHz, CDCl3) de Cr-2 na região de (0,5 – 5,5 ppm) x (0,5 – 5,5 ppm) ... 65
Figura 50 - Expansão do espectro COSY (500 MHz, CDCl3) de Cr-2 na região de (6,0 – 9,0 ppm) x (6,5 – 9,0 ppm) ... 66
Figura 51 - Espectro NOESY (500 MHz, CDCl3) de Cr-2 ... 67
Figura 52 - Expansão do espectro NOESY (500 MHz, CDCl3) de Cr-2 na região de (1,0 – 5,5 ppm) x (1,0 – 5,5 ppm) ... 68
Figura 53 - Expansão do espectro NOESY (500 MHz, CDCl3) de Cr-2 na região de (6,0 – 10,0 ppm) x (6,0 – 10,0 ppm) ... 69
Figura 54 – Correlações homonucleares COSY e NOESY observadas em Cr-2 ... 70
Figura 55 – Estrutura da feofitina A... 70
Figura 56 - Espectro de Infravermelho (KBr, cm-1) de Cr-3 ... 72
Figura 57 - Espectro de RMN 1H (500 MHz, CDCl3) de Cr-3 ... 73
Figura 58 - Expansão do espectro de RMN 1H (500 MHz, CDCl 3) de Cr-3 na região de 7,8 – 11,2 ppm ... 74
Figura 59 - Expansão do espectro de RMN 1H (500 MHz, CDCl 3) de Cr-3 na região de 4,0 – 6,5 ppm ... 75
Figura 60 - Expansão do espectro de RMN 1H (500 MHz, CDCl 3) de Cr-3 na região de 5,11 – 5,17 ppm ... 76
Figura 61 - Expansão do espectro de RMN 1H (500 MHz, CDCl 3) de Cr-3 na região de 2,0 – 4,0 ppm ... 77
Figura 62 - Expansão do espectro de RMN 1H (500 MHz, CDCl3) de Cr-3 na região de 1,4 – 2,0 ppm ... 78
Figura 63 - Expansão do espectro de RMN 1H (500 MHz, CDCl3) de Cr-3 na região de 0,7 – 1,4 ppm ... 79
Figura 64 - Expansão do espectro de RMN 1H (500 MHz, CDCl3) de Cr-3 na região de -1,8 – -1,25 ppm ... 80
Figura 65 - Espectro de RMN 13C - APT (125 MHz, CDCl3) de Cr-3 ... 81
Figura 67 - Expansão do espectro de RMN 13C - APT (125 MHz, CDCl 3)
de Cr-3 na região de 55,0 – 10,0 ppm ... 83
Figura 68 – Correlações observadas no espectro HMBC... 84
Figura 69 - Espectro HMQC (500 e 125 MHz, CDCl3) de Cr-3 ... 84
Figura 70 - Expansão do espectro HMQC (500 e 125 MHz, CDCl3) de Cr-3 na região de (0,5 – 11,0 ppm) x (60,0 – 125,0 ppm) ... 85
Figura 71 - Expansão do espectro HMQC (500 e 125 MHz, CDCl3) de Cr-3 na região de (0,0 – 5,5 ppm) x (10,0 – 55,0 ppm) ... 85
Figura 72 - Espectro HMBC (500 e 125 MHz, CDCl3) de Cr-3 ... 86
Figura 73 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de Cr-3 na região de (5,5 – 12,0 ppm) x (100,0 – 190,0 ppm) ... 86
Figura 74 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de Cr-3 na região de (-1,5 – 5,0 ppm) x (115,0 – 180,0 ppm) ... 87
Figura 75 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de Cr-3 na região de (0,0 – 5,0 ppm) x (10,0 – 55,0 ppm) ... 87
Figura 76 - Espectro COSY (500 MHz, CDCl3) de Cr-3 ... 88
Figura 77 - Expansão do espectro COSY (500 MHz, CDCl3) de Cr-3 na região de (0,5 – 5,5 ppm) x (0,5 – 5,5 ppm) ... 89
Figura 78 - Expansão do espectro COSY (500 MHz, CDCl3) de Cr-3 na região de (0,7 – 2,9 ppm) x (0,7 – 2,9 ppm) ... 90
Figura 79 - Espectro NOESY (500 MHz, CDCl3) de Cr-3 ... 91
Figura 80 - Expansão do espectro NOESY (500 MHz, CDCl3) de Cr-3 na região de (5,0 – 11,5 ppm) x (6,0 – 11,0 ppm) ... 92
Figura 81 - Expansão do espectro NOESY (500 MHz, CDCl3) de Cr-3 na região de (0,5 – 6,5 ppm) x (0,5 – 5,5 ppm) ...;... 93
Figura 83 – Correlações homonucleares observadas em Cr-3...... 94
Figura 84 – Estrutura da feofitina B...... 94
Figura 85 - Espectro de Infravermelho (KBr, cm-1) de Cr-4 ... 96
Figura 86 - Espectro de RMN 1H (CDCl 3, 500 MHz) de Cr-4 ... 97
Figura 87 - Expansão do espectro de RMN 1H (CDCl3, 500 MHz) de Cr-4 na região de 6,0 – 9,6 ppm ... 98
Figura 89 - Expansão do espectro de RMN 1H (CDCl
3, 500 MHz) de Cr-4
na região de 0,6 – 2,8 ppm ... 100
Figura 90 - Espectro de RMN 13C - APT (CDCl 3, 125 MHz) de Cr-4 ... 101
Figura 91 - Expansão do espectro de RMN 13C - APT (CDCl3, 125 MHz) Cr-4 na região de 95,0 – 190 ppm ... 102
Figura 92 - Expansão do espectro de RMN 13C - APT (CDCl3, 125 MHz) de Cr-4 na região de 10,0 – 67,0 ppm ... 103
Figura 93 - Espectro HMQC (CDCl3, 500 e 125 MHz) de Cr-4 ... 104
Figura 94 - Expansão do espectro HMQC (CDCl3, 500 e 125 MHz) de Cr-4 na região de (6,0 – 10,0 ppm) x (90,0 – 125,0 ppm) ... 104
Figura 95 - Expansão do espectro HMQC (CDCl3, 500 e 125 MHz) de Cr-4 na região de (1,0 – 5,0 ppm) x (10,0 – 65,0 ppm) ... 105
Figura 96 – Correlações observadas no espectro HMBC... 105
Figura 97 - Espectro HMBC (500 e 125 MHz, CDCl3) de Cr-4 ... 106
Figura 98 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de Cr-4 na região de (1,5 – 10,0 ppm) x (100,0 – 190,0 ppm) ... 106
Figura 99 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de Cr-4 na região de (1,5 – 4,5 ppm) x (126,0 – 156,0 ppm) ... 107
Figura 100 - Expansão do espectro HMBC (500 e 125 MHz, CDCl3) de Cr-4 na região de (0,5 – 4,5 ppm) x (15,0 – 65,0 ppm) ... 107
Figura 101 - Espectro COSY (500 MHz, CDCl3) de Cr-4 ... 108
Figura 102 - Expansão do espectro COSY (500 MHz, CDCl3) de Cr-4 na região de (1,0 – 4,5 ppm) x (1,0 – 5,0 ppm) ... 109
Figura 103 - Espectro NOESY (500 MHz, CDCl3) de Cr-4 ... 110
Figura 104 - Expansão do espectro NOESY (500 MHz, CDCl3) de Cr-4 na região de (3,0 – 9,6 ppm) x (3,0 – 9,6 ppm) ... 111
Figura 105 - Expansão do espectro NOESY (500 MHz, CDCl3) de Cr-4 na região de (1,0 – 4,6 ppm) x (1,0 – 4,6 ppm) ... 112
Figura 106 – Correlações homonucleares observadas em Cr-4 ... 113
Figura 107 – Estrutura do feoforbídeo A... 113
Figura 108 - Atividade antinociceptiva induzida por ácido acético ... 115
Figura 110 - Atividade antinociceptiva da caulerpina no teste de contração
com ácido acético, curva dose-resposta dipirona x caulerpina .. 117
Figura 111 - Atividade antinociceptiva da caulerpina no teste com formalina
(A) fase inicial e (B) fase tardia ... 117
Figura 112 - Modelo de edema de orelha induzido por capsaicina indo-
metacina x caulerpina ... 118
RESUMO
Caulerpa racemosa (Forssk.) J.Agardh é uma alga verde amplamente
distribuída pelo nordeste brasileiro, crescendo sobre a rocha ou associadas a outras algas. Estudos farmacológicos relataram que os seus extratos atuam com atividade antimicobiana e repelente. Levantamento bibliográfico relatou a presença de alcalóides, terpenóides, esteróides entre outras classes de metabólitos. Este estudo teve como objetivo contribuir com o conhecimento fitoquímico e farmacológico, realizando teste que demonstraram significativa atividade antinociceptiva e antiinflamatória. O material fresco foi extraído por maceração, conforme gradiente crescente de polaridade utilizando os solventes hexano, clorofórmio, acatato e metanol. O extrato clorofórmico foi cromatografado por técnicas convencionais de cromatrografia em coluna e camada delgada levando ao isolamento de quatro substâncias, sendo três relatados pela primeira vez na família Caulerpaceae. Os constituintes químicos isolados foram identificados através da análise de dados obtidos por métodos espectroscópicos como Infravermelho e Ressonância Magnética Nuclear de 1H, 13C unidimensionais e técnicas bidimensionais (COSY,
NOESY, HMQC e HMBC), além de comparação com dados descritos na literatura.
ABSTRACT
Caulerpa racemosa (Forssk.) J.Agardh is a green seaweed widely distributed
in Brazil northeast, living on rocks or in association with other seaweeds. Pharmacoligacal studies related the antimicrobial and repellent activities of the extract. The literature related the presence of alkaloids, terpenoids, steroids and some others class of metabolites. The purpose of this work is expand the phytochemical and pharmacoligacal, performing tests that related significant anti-inflammatory and antinociceptive action. The fresh sample was exhaustively extracted with hexane, chloroform, ethyl acetate and methanol in a crescent gradient of polarity. The chloroform extract was cromatographed by usual techniques leading to the isolament of four compounds, being three related at the first time in the family Caulerpaceae. The isolated constituent from methanolic extract were identified by spectroscopy analysis such as Infra Red, 1H and 13C NMR spectroscopy, two dimension techniques (COSY, NOESY, HSQC, HMBC) and comparison with literature data.
KEY MORDS: Green seaweeds; Caulerpa racemosa; Phytochemistry;
1. INTRODUÇÃO
Os produtos naturais são utilizados pela humanidade desde tempos imemoriais. A busca por alívio e cura de doenças pela ingestão de ervas e folhas talvez tenha sido uma das primeiras formas de utilização dos produtos naturais. A história do desenvolvimento das civilizações oriental e ocidental é rica em exemplos da utilização de recursos naturais na medicina, no controle de pragas e em mecanismos de defesa, merecendo destaque as civilizações egípcia, greco-romana e chinesa (VIEGAS-JR; BOLZANI; BARREIRO, 2006).
A utilização das plantas medicinais está em contínua expansão em nível mundial. Atualmente, os produtos naturais são responsáveis, direta ou indiretamente, por cerca de 40% de todos os fármacos disponíveis na terapêutica moderna e, se considerarmos os usados como antibióticos e antitumorais, esta porcentagem é de aproximadamente 70% (CALIXTO; YUNES, 2001). A crescente busca por agentes terapêuticos derivados de espécies vegetais justifica-se pelo surgimento de doenças ainda sem tratamento apropriado, e pelo crescimento do conhecimento científico a respeito dos fitoterápicos, como alternativas terapêuticas (GUERRA; NODARI, 2003).
Usando, copiando ou modificando as moléculas sintetizadas pelos seres vivos, o homem tem obtido inovações para o seu benefício em diversas áreas e, entre elas, a produção de fármacos. Os organismos terrestres (principalmente microrganismos e plantas) são os responsáveis por quase a totalidade dessas substâncias, enquanto que os organismos marinhos, apesar de promissores, passaram a ser investigados de maneira sistemática apenas recentemente (COSTA-LOTUFO; WILKE; JIMENEZ, 2009).
Figura 1 – evolução no isolamento de produtos naturais marinhos
Fonte – BLUNT et al., 2008
Uma revisão envolvendo pesquisas da Europa, Japão, Austrália e Estados Unidos (MAYER; LEHMANN, 2001), concluiu que produtos naturais marinhos provenientes de algas com atividade citotóxica estão entrando nas fases II e III de estudos clínicos, apesar da diminuição da produção científica referente à investigação química de novos produtos provenientes de algas marinhas (LHULLIER, 2005).
No Brasil, a pesquisa de produtos naturais marinhos iniciou por volta de 1962, no Instituto de Pesquisa Agrícola do Rio de Janeiro. Posteriormente, órgãos federais como a EMBRAPA e Fundação Oswaldo Cruz – FIOCRUZ começaram a desenvolver investigações científicas nesta área. Em 1976, após uma década de pesquisa em produtos naturais marinhos, a SARSA laboratórios farmacêuticos do Rio de Janeiro, formou uma equipe multidisciplinar com químicos, biólogos e farmacologistas que durante 5 anos realizaram um screening de mais de 500 extratos de esponjas, anêmonas do mar, estrelas do mar e várias algas (KELECOM, 1997).
sesquiterpenos, além de terpenos superiores, lipídeos, derivados da dibromotirosina, etc. (KELECOM, 1997).
Do ponto de vista de sua importância econômica as algas marinhas são utilizadas como alimentos para o homem e animais, e fornecem produtos imprescindíveis para a vida do homem moderno, com valores que ultrapassam alguns bilhões de dólares por ano. Por exemplo, o comércio de “nori” (gênero
Porphyra) foi responsável pela movimentação 1,8 bilhões de dólares (OLIVEIRA,
1997).
2. OBJETIVOS
2.1 - OBJETIVO GERAL
Realizar o estudo fitoquímico com fins farmacológico da clorófita Caulerpa racemosa, contribuindo para o conhecimento das algas do litoral nordestino.
2.2 - OBJETIVOS ESPECÍFICOS
Isolar constituintes químicos de Caulerpa racemosa.
Caracterizar os constituintes químicos isolados, utilizando infravermelho e técnicas espectroscópicas de RMN 1H e 13C uni e bidimensionais.
3. FUNDAMENTAÇÃO TEÓRICA
3.1 - Considerações Gerais Sobre Algas
O termo algas, lato sensu, compreende um agrupamento artificial de
organismos que têm muito pouca coisa em comum a não ser o fato de serem predominantemente aquáticos. Por esta razão são grupos polifiléticos e não constituem uma categoria taxonômica definida, mas sim um amontoado de categorias díspares, tão diversas que chegam a ser classificadas em 2 ou 3 reinos diferentes, tradicionalmente conhecidos como monera, protista e plantae, ou ainda com diferentes denominações em outros sistemas apoiados em dados de biologia molecular (SOGIN et al., 1989; BHATTACHARYA & MEDLIN, 1998).
As algas seriam os organismos mais antigos do planeta, havendo evidências de sua existência no período pré-cambriano (3,5 bilhões de anos, aproximadamente). As algas possivelmente foram as responsáveis pela produção e acúmulo de oxigênio na atmosfera primitiva e hoje se sabe que são organismos que deram origem a todos os outros vegetais existentes atualmente (HORTA, 2000).
Harvey (1836) classificou as algas conforme a pigmentação, sendo esta classificação utilizada até hoje. Dentre as linhagens eucarióticas destacam-se Chlorophyta (algas verdes), Rhodophyta (algas vermelhas) e Phaeophyta (algas pardas).
Filo Chlorophyta, composto pelas algas verdes, extremamente abundantes
nos ambientes aquáticos, onde é um dos mais importantes componentes do fitoplâncton; as algas verdes são responsáveis pela maior parte da produção de oxigênio molecular disponível no planeta a partir da fotossíntese. Habitando águas doces ou salgadas, solos úmidos ou troncos, estes organismos podem também estabelecer relações de mutualismo com outros seres vivos, como os fungos, formando os liquens. As algas verdes acumulam amido no interior de suas células, e contêm os pigmentos clorofilas a e b,
carotenos e xantofilas; a presença de clorofilas a e b sustenta a idéia de que
Filo Rhodophyta, composto pelas algas vermelhas, quase que
exclusivamente pluricelulares e marinhas (mais comuns em mares quentes), que vivem fixadas em um substrato; a principal característica é a presença do pigmento ficoeritrina em suas células, responsável pela coloração avermelhada destes organismos. As algas vermelhas possuem clorofilas a e d
e carotenóides, e armazenam amido como material de reserva (VIDOTTI; ROLLEMBERG, 2004).
Filo Phaeophyta, composto pelas algas pardas, organismos pluricelulares
predominantemente marinhos (mais comuns em mares frios), vivendo fixados em um substrato ou flutuando, formando imensas florestas submersas. As algas pardas são as maiores existentes, podendo atingir mais de 25 m. Nestes organismos são encontrados os pigmentos fucoxantina, clorofilas a e c e carotenóides e, como substâncias de reserva, óleos e polissacarídeo
(laminarina) (VIDOTTI; ROLLEMBERG, 2004).
Quadro 1: Distribuição dos pigmentos e produtos de reserva em algumas divisões de algas
DIVISÃO CLOROFILA PIGMENTO DE RESERVA PRODUTOS
Chlorophyta a, b carotenóides e xantofilas amido Rhodophyta a, d carotenóides amido Phaeophyta a, c fucoxantina polissacarídeo óleos e
Gráfico 1: Distribuição dos táxons de algas no litoral brasileiro. Fonte: FIGUEIREDO et al, 2008
3.1.1 - Importância das Algas em Diversas Áreas
Na vida marinha as algas são essenciais na produção de oxigênio que é dissolvido na água viabilizando a vida dos demais organismos aquáticos; servem de alimento para animais herbívoros e onívoros sendo essenciais para o equilíbrio das teias alimentares marítimas.
Algas marinhas vêm sendo utilizadas como alimento há mais de 10 mil anos no Japão. Através de análise química de várias algas, verificou-se a presença de proteínas, vitaminas (A, B1, B2, B6, B12 e C), sais minerais (cálcio, iodo e ferro) e uma grande quantidade de polissacarídeos (LHULLIER, 2005). Como exemplo tem-se a alga vermelha Porphyra spp. (nori) é utilizada na culinária no preparo de sushi.
Quadro 2: Principais tipos e empregos dos ficocolóides em diversos gêneros de macroalgas
TIPO DE
FICOCOLÓIDE SUBSTÂNCIA GÊNERO EMPREGO
Alginato polímeros do ácido L-glucurônico e D-manurônico
Macrocystis Laminaria Ascophyllum
Indústria têxtil, de tintas e cerveja
Carragenano polímeros de D-galactose
Chondrus Euchema Gigartina Iridaea Hypnea Indústria farmacêutica, cosmética, de tintas e
alimentícia
Ágar polissacarídeos de D- e L-galactose Gracilaria Gelidium Pterocladia
Indústria farmacêutica, cosmética, de tintas, alimentícia e de meios de cultura para biologia
molecular (agarose) (Fonte: LHULLIER, 2005)
No Brasil, a região costeira compreendida entre o estado do Ceará e o norte do estado do Rio de Janeiro abriga a flora algal mais diversificada do país. No tocante à exploração de espécies com fins comerciais, a atividade de maior porte corresponde à coleta de algas vermelhas (Gracilaria e Hypnea) no litoral do
nordeste, principalmente na costa entre os estados do Ceará e da Paraíba (VIDOTTI; ROLLEMBERG, 2004).
A análise fitoquímica com direcionamento na obtenção de novas moléculas bioativas, constitui um ramo de estudo das algas muito promissor e pouco explorado. Valendo mencionar que 13 novos fármacos relacionados a produtos naturais foram aprovados entre 2005 e 2007, sendo que cinco representam novas classes de fármacos, incluindo os produtos marinhos trabectedina (Yondelis®) e ziconotídeo (Prialt®) (COSTA-LOTUFO; WILKE; JIMENEZ, 2009).
Algumas atividades estão relacionadas, abaixo, algumas atividades farmacológicas referente a algas:
peltata, C. racemosa, Chaetomorpha linum, Codium decorticatum, Enteromorpha clathrata, Enteromorpha intestinalis (Clorofíceas), Sargassum serratifolium, S. wrightii, Dictyota dichotoma (Feoficeas) e Hypnea valentiae
(Rodofícea) (THANGAM & KATHIRESAN, 1991).
Antitumoral: atividade antitumoral da fucoidana proveniente de Macrocystes pyrifera, efeito sobre o sarcoma-180 de polissacarídeos de Sargassum fulvellum e Laminaria angustata (MAYER; HAMANN, 2005; YAMAMOTO et al., 1974). Atividades antiangiogênicas e antitumorais de polissacarídeos
isolados de Sargassum stenophyllum (DIAS et al., 2005).
Hemaglutinantes: atividade hemaglutinante do sistema ABO humano (FREITAS et al., 1997; NISHINO & NAGUMO 1991).
Antibacteriana: atividade antibacteriana de glicosídeos esteroidais isolados da alga verde Codium iyengarii Borgesen (ALI et al., 2002). Atividade
antibacteriana de extratos de Amansia multifida (LIMA-FILHO et al., 2002).
Atividades antibacterianas de algas verdes, vermelhas e pardas da costa mexicana (FREILE-PELEGRÍN & MORALES, 2004).
Antivirais: atividade antiviral de extratos brutos de algas marinhas tais como inibição do efeito citopático do vírus da imunodeficiência humana (HIV) (SEKINE et al., 1995), inibição da replicação do vírus Herpes simplex
(DAMONTE; MATULEWICZ; CEREZO, 1996, CARLUCCI et al., 1999, SANTOS et al., 1999) e vírus linfotrópico de célula T humana do tipo 1
(ROMANOS et al., 2002).
Atividade antinociceptiva: foi relatada significante atividade do extrato metanólico e das fases clorofórmica, acetato e n-butanólica de Caulepa racemosa (SOUZA et al.,2009a).
3.2 - Considerações Sobre a Família Caulerpaceae
celular, divide as Siphonales em Caulerpales e Eusiphonales (BRAYNER; PEREIRA; BANDEIRA-PEDROSA, 2008).
O gênero Caulerpa permaneceu, por quase dois séculos, desde a sua
validação por Kützing (1843), como o único gênero da família Caulerpaceae, porém Prud´homme van Reine & Lokhorst (1992) propuseram um novo gênero para esta família, nomeado Caulerpella. Este novo gênero se diferencia de Caulerpa, segundo
os autores, por apresentar reprodução não holocárpica, pois apresentava ramos especiais para a produção de células reprodutivas que eram separados do restante do talo por uma parede celular (BRAYNER; PEREIRA; BANDEIRA-PEDROSA, 2008).
A família Caulerpaceae abriga, atualmente, os gêneros Caulerpa e Caulerpella (BRAYNER; PEREIRA; BANDEIRA-PEDROSA, 2008). Por apresentar
apenas uma espécie, o gênero Caulerpella tem pouca contribuição nos estudos da
família Caulerpaceae, sendo o gênero Caulerpa amplamente estudado e
responsável pelos dados da família.
3.3 - Considerações Sobre o Gênero Caulerpa J.V. Lamour.
O gênero Caulerpa proposto por J.V. Lamouroux em 1809, definiu estas algas
como sendo formadas por tronco cilíndrico, horizontal, que originava rizóides para baixo e estruturas semelhantes a folhas para cima. O nome vem do grego e significa
Caulus “tronco” e erpos “crescer ao longo do solo” A primeira espécie foi descrita
antes, por Samuel Gottlieb Gmelin em 1768, para as Índias Orientais e foi identitificada como Fucus sertularioides S.G. Gmel., hoje Caulerpa sertularioides
(S.G. Gmel.) M. Howe” (BARATA, 2008).
O gênero Caulerpa é caracterizado por possuir espécies que apresentam talo
Figura 2: Aspecto geral de Caulerpa J.V. Lamour. mostrando partes do talo
(Fonte: BARATA, 2008)
O número de espécies de Caulerpa é um dado controverso e varia bastante
na literatura. Alguns autores consideraram 60 espécies, mas esse número pode variar de 70 espécies a até 80 espécies. Todas as espécies são marinhas, ocorrendo no médio e infralitoral, geralmente em regiões tropicais e subtropicais” (BARATA, 2008).
Figura 3: Distribuição do gênero Caulerpa no mundo
Fonte: http://www.discoverlife.org/mp/20m?kind=Caulerpa (acessado 27/01/2010)
observar que as espécies do gênero Caulerpa parecem preferir as águas quentes da
região tropical do país, sendo que a maioria das espécies se encontra concentrada nos estados da região nordeste (BARATA, 2008).
3.3.1 - Importância Econômica e Ecológica do Gênero
Espécies do gênero Caulerpa são comumente utilizadas na alimentação em
algumas localidades nas Filipinas. A forma mais comum é a utilização de Caulerpa racemosa, C. sertularoides e C. taxifolia C. Agardh em saladas, retiradas
diretamente do ambiente. Caulerpa lentilifera J. Agardh é também utilizada na
alimentação, mas é cultivada em pequena escala. Estas algas também são utilizadas por seus produtos naturais no tratamento de pressão alta e, também, como fontes de vitaminas e sais minerais (TRONO JR, 1999).
Algumas espécies de Caulerpa têm chamado atenção de cientistas e de
órgãos governamentais por estarem envolvidas em eventos de bioinvasão. Quando introduzidas, estas espécies podem apresentar características de organismos invasores, dominando o substrato e competindo com os organismos nativos. Elas apresentam uma grande capacidade de expansão, com crescimento por meio de uma rede de estolões e reprodução vegetativa por fragmentação. Possivelmente, não encontram predadores naturais ou condições ambientais que limitem a sua expansão nos locais onde foram introduzidas, o que leva a um crescimento progressivo e, muitas vezes, à redução ou perda da biodiversidade nativa local. Estes eventos de bioinvasão originados a partir da introdução de espécies exóticas têm preocupado, por todo o mundo, além de entidades governamentais e cientistas, também, pessoas que utilizam produtos retirados do mar (BARATA, 2008).
3.3.2 - Revisão Fitoquímica e Farmacológica do Gênero Caulerpa
Segundo levantamento realizado no banco de dados NAtural PRoducts ALERT (NAPRALERT) em abril de 2009, não são encontrados relatos, na literatura, do uso na medicina popular de espécies de Caulerpa. Vários estudos têm
demonstrado o potencial terapêutico das espécies de Caulerpa, isto é confirmado
antibacteriana (ALBUQUERQUE et al., 1983; SRIDHAR et AL., 1984; USMANGHANI et al., 1984; PEREZ et al., 1990), atividade antifúngica (ALBUQUERQUE et al., 1983; USMANGHANI et al., 1984; PEREZ et al., 1990), antiviral (PREMANTHAN et al., 1994 ; PREMANTHAN et al., 1995), atividade antitumoral (NAKAMURA et al., 1997), atividade repelente (THANGAM; KATHIRESAN, 1993), atividade anticrustáceo (ARA et al., 1999), entre outros.
Os dados fitoquímicos foram compilados em um gráfico demonstrando que os terpenóides apresentam maior prevalência nos relatos de compostos isolados (42,5%), seguido dos esteróides (23,75%).
8 19 5 9 34 5 0 5 10 15 20 25 30 35
Alcalóides Esteróides Fenilpropanóides Lipídios Terpenos Outros
COMPOSTOS QUÍMICOS IDENTIFICADOS NO GÊNERO CALUERPA
Gráfico 2 – Compostos químicos identificados no gênero Caulerpa
agrupados por classe
O quadro 3 (pág. 17) demonstra a estrutura química de alguns dos constituintes químicos presentes no gênero Caulerpa e a(s) espécie(s) de onde
foram isolados os metabólitos. Destacam-se o alcalóide indólico caulerpina (1)
Quadro 3: Estruturas químicas de compostos isolados de espécies do gênero Caulerpa
ESTRUTURAS QUÍMICAS ESPÉCIE(S)
Caulerpina (1)
C. Ashmeadii, C. Lamourouxii,
C. Lentillifera, C. Mexicana,
C. peltata, C. racemosa, C. sertulariodes.
Ácido caulerpínico (2)
Quadro 3: continuação
ESTRUTURAS QUÍMICAS ESPÉCIE(S)
Trifarina (5)
C. brownii, C. trifaria.
Colesterol (6)
C. racemosa, C. taxifolia.
β-sitosterol (7)
C. racemosa
Colestenol (8)
C. sertularioides
3.4 - Considerações Sobre a Espécie Caulerpa racemosa (Forssk.) J. Agardh
Espécimes são encontrados no médio litoral, crescendo sobre a rocha ou associadas a outras algas, apresentam talo verde claro, de consistência firme; ramos assimiladores longos, cobertos, total ou espaçadamente, por râmulos pedunculados, com ápice dilatado e globóide, ou podem ser curtíssimos, apresentando râmulos raros, algumas vezes sésseis.
Segundo levantamento realizado por BARATA (2008) esta macroalga é encontrada representada nos estados nordestinos do Piauí, Ceará, Rio Grande do Norte, Paraíba, Pernambuco, Alagoas e Bahia. Em nível mundial relata-se a sua existência no Oceano Pacífico Ocidental, Ilhas do Pacífico, Oceano Atlântico Ocidental, Ilhas do Atlântico, Oceano Índico, e Mar Mediterrâneo.
Figura 4 – Caulerpa racemosa em hábitat
Figura 5 – Caulerpa racemosa inteira
Fonte: http://www.algaebase.org/webpictures/Fig.88.jpg
Figura 6 – Râmulo de Caulerpa racemosa
Fonte: http://www.algaebase.org/search/images/detail/?img_id=36804&sk=0
3.4.1 - Levantamento Fitoquímico e Farmacológico da espécie Caulerpa
Na literatura são encontrados ensaios farmacológicos que incluem testes
antibacterianos, antifúngicos (PEREZ, 1990; ALBUQUERQUE, 1983;
USMANGHANI, 1984), antileveduriformes (PEREZ, 1990; ALBUQUERQUE, 1983) e antiviral (PREMANTHAN, 1995).
“THANGAM e KATHIRESAN (1993) relataram a atividade repelente contra o mosquito Aedes aegypti do extrato acetônico, fraca atividade citotóxica do extrato metanólico foi relatada por HARADA (1997) e segundo testes para medir a DL50
contra o microcrustáceo Artemia salina não apresentaram atividade significativa segundo estudos feitos por ARA” (1999).
A literatura relata o isolamento de diversos compostos de Caulepa racemosa,
os quais estão relacionados no quadro 4.
Quadro 4: compostos identificados na espécie Caulepa racemosa
CLASSE NOME DO COMPOSTO
Ácido sulfônico Ácido 3,3-dimetil propiônicosulfônio
Alcalóides
Ácido caulerpínico Caulerpicina Caulerpina
Ácido monometil éster caulerpínico Glicina-betaína
Taurobetaína
Benzenóide 1,5-difenil-penta-1,4-dieno
Esteróides Brassicasterol Diidro Brassicasterol Colesterol 24-metileno-colasterol Trans-22-deidro-colesterol Clerosterol Clionasterol Fucosterol Poriferasterol β-sitosterol Fenilpropanóides
Trans cinamil-1-fenil-2-propenil eter Cinamil-3-fenil-1-propenil eter Diidrocinamato de cinamil Éter cinamílico
Proteína beta-alanina
3.4.2 - Posição sistemática de Caulerpa racemosa
Domínio Eucariota
Reino Plantae
Subreino Viridaeplantae
Filo (Divisão) Chlorophyta
Classe Bryopsidophyceae
Ordem Bryopsidales
Família Caulerpaceae
Gênero Caulerpa (86 espécies)
Espécie (Forsskal) J. Agardh Caulerpa racemosa
3.5 – Considerações químicas e biossintéticas
3.5.1 – Derivados porfirínicos
As porfirinas compreendem um grande grupo de diversas entidades químicas que são constituídas essencialmente de quatro anéis pirrólicos ligados entre si por uma ponte metínica formando um grande macrociclo (SOARES, 2006), esses anéis são numerados de 1 a 4 ou “A” a “D”.
Figura 7 - Estrutura da porfirina
I
III IV
Nos vegetais, o núcleo porfirínico apresenta um átomo de magnésio central (Mg2+) sendo denominada clorofila, além disso possui uma cadeia lateral fitílica (do
álcool fitol) longa e apolar conferindo hidrofobicidade à molécula.
Figura 8 - Estrutura da clorofila a, enfatizando a presença da cadeia lateral e do
átomo de magnésio
A figura 9 (pág. 25) mostra a rota biossintética da clorofila a. No lado
esquerdo da figura observa-se a biossíntese do diterpeno fitol, este composto é um álcool primário que por esterificação se unirá ao clorofídeo a, formando a estrutura
final da clorofila a. O núcleo porfirínico é formado pela via Shemin (ALA –
5-aminolevulinato) e via C5 (ácido glutâmico). Inicialmente é formado o porfobilinogênio e quatro destas unidades se unem formando uroporfirinogênio III. A partir deste núcleo ocorre hidrogenação na dupla ligação e adição de um átomo de magnésio central produzindo clorofídeo a (SOUZA, 2009c).
As diferenças estruturais na série de clorofilas decorrem do grau de insaturação dos anéis e na composição das cadeias laterais anexadas aos anéis pirrólicos (SOARES, 2006). Como observado na figura a diferença entre a clorofila a
e a clorofila b está no grupo inserido no anel II. Na clorofila a observa-se um grupo
metil e na clorofila b um grupo aldeído.
Cadeia lateral
Figura 9 - Biossíntese da clorofila a e b (Fonte: SOUZA, 2009c)
3.5.2 – Alcalóides indólicos
ácido antranilato age como precursor do triptofano, que produz outro esqueleto de alcalóides, os quinolínicos (figura 10, pág. 26).
Figura 10 - Rota biossintética dos alcalóides indólicos Fonte: RAMOS, 2008
N
H
4. EXPERIMENTAL
4.1 - Levantamento bibliográfico
O levantamento bibliográfico para realização deste trabalho foi definido nos bancos de dados Chemical Abstracts, Biological Abstracts, NAPRALERT (Natural Products Alert) e Web of Science, bem como pesquisas na Internet e em anais de eventos cientificos nacionais e internacionais.
4.2 - Coleta do material botânico
O material botânico foi coletado e identificado pelo professor George Emmanuel Cavalcanti de Miranda na praia do Bessa, João Pessoa-PB (7o03´52´´S / 34º49´51´´) em junho de 2008, uma exsicata foi depositada no herbário Lauro Pires Xavier, na Universidade Federal da Paraíba sob o número JPB 13999.
4.3 - Processamento de Caulerpa racemosa
O material botânico de Caulerpa racemosa foi desidratado à temperatura
ambiente durante 72h, sendo então submetido à extração ao abrigo da luz, sem sofrer trituração por moinho mecânico.
4.4 - Obtenção dos extratos de Caulerpa racemosa
Esquema 1: Obtenção dos extratos hexânico, clorofórmico, acetato e metanólico
4.5 - Processos cromatográficos
As cromatografias em colunas foram desenvolvidas em colunas de vidro cilíndricas, com dimensões variando de acordo com a quantidade de amostra a ser cromatografada, utilizando-se como fase estacionária sílica gel 60 (Merck) 7734 (partículas com 0,063-0,2 mm, 70-230 mesh) e Sephadex LH-20 (AMERSHAM BIOSCIENCES).
Material Desidratado (2700g)
- Maceração com Hexano (três vezes) - Concentração em evaporador rotativo
Extrato Hexânico (3,0g) Material Desidratado I
- Maceração com CHCl3 (três vezes)
- Concentração em evaporador rotativo
Extrato Clorofórmico (7,6g) Material Desidratado II
Extrato Acetato (3,2g) Maceração com AcOEt (três vezes) -
Concentração em evaporador rotativo -
Extrato Metanólico (2,4g) Material Desidratado III
Como fase móvel foram utilizados solventes comerciais destilados.
A cromatografia em camada delgada analítica (CCDA) foi empregada para a análise e reunião das frações obtidas por cromatografia em coluna e para análise de pureza das substâncias isoladas.
A cromatografia em camada delgada preparativa (CCDP) foi empregada para o isolamento de constituintes químicos que apresentaram fatores de retenção (RF’s) diferentes. A recuperação das amostras separadas por CCDP foi feita por extração com sistema binário clorofórmio:metanol (7:3) seguida de filtração à pressão reduzida; sendo o filtrado concentrado em rotavapor.
As cromatografias em camada delgada analítica (CCDA) e preparativa (CCDP) foram feitas utilizando sílica gel 60, PF254 7749 (Merck) na espessura
0,25 e 1,0 mm respectivamente suspensa em água destilada (1:2), distribuída sobre placas de vidro por meio de um cursor “Quick fit”, secas ao ar e ativadas em estufa a 110ºC durante 2 horas. As substâncias em análise foram evidenciadas pelo uso de radiação ultravioleta (UV) sob os comprimentos de onda de 254 e 366 nm por meio de aparelho Mineralight, modelo UVGL-58, como também pela impregnação das placas em cubas de vidro saturadas por vapores de iodo.
O critério de pureza adotado foi a visualização, através do UV, de uma única mancha após eluição das placas analíticas em, no mínimo, três sistemas de eluentes, além da observação de seus espectros de RMN 1H e pontos de fusão (o critério de pureza adotado é que a diferença entre o ponto de fusão final e o ponto de fusão inicial não seja maior que 2ºC).
4.6 - Fracionamento cromatográfico do extrato clorofórmico
A fração 14/19 (1700mg) foi resubmetida à CC utilizando-se sílica como fase estacionário e diclorometano e acetato de etila como fase móvel (Quadro 5, pág 34). Após análise por CCDA, a subfração 5/6 (100mg) foi eluida em CCDP utilizando o sistema diclorometano:acetona (90:10), obtendo-se duas faixas que foram codificadas como Cr-2 (18mg) e Cr-3 (20mg). A subfração 14/20 (80mg) foi eluida em CCDP utlizando a mesma fase móvel da subfração 5/6, obtendo-se a substância
Cr-4 (15mg). As demais frações não foram analisadas por apresentarem perfil espectrométrico irrelevante para o estudo fitoquímico do gênero.
Esquema 2: Etapas envolvidas no processo cromatográfico do extrato clorofórmico
Extrato Clorofórmico (3,0g)
- CC (Sephadex) - MeOH:CHCl3 (1:1)
-CCDA
(sílica gel 60) CC - (gradiente crescente de polaridade) AcOEt:CH2Cl2 -
CCDA -
-CCDP
- CH2Cl2:Act (90:10 v/v)
Cr-3 Cr-2
Cr-1 1 2 3/4 5 6/9 10/11 12/13 14/19 20/23
1/4 5/6 7/8 9/11 12/13 14/20 21/25 26/29
-CCDP
- CH2Cl2:Act (90:10 v/v)
Quadro 5: Sistemas de eluição utilizados na CC da fração 14/19, frações coletadas e reunidas após análise em CCDA
ELUENTE FRAÇÕES OBTIDAS FRAÇÕES REUNIDAS
CHCl2 (100%) 1-3 1/4
CHCl2:AcOEt (95:5) 4-5 5/6
CHCl2:AcOEt (90:10) 6-8 7/8
CHCl2:AcOEt (80:20) 9-11 9/11
CHCl2:AcOEt (70:30) 12-14 12/13 - 14/20
CHCl2:AcOEt (50:50) 15-19
CHCl2:AcOEt (30:70) 20-24 21/25
AcOEt (100%) 25-29 26/29
4.7 Caracterização estrutural dos constituintes químicos isolados de Caulerpa
racemosa
A caracterização estrutural dos constituintes químicos isolados de Caulerpa racemosa. foi realizada por análises dos espectros obtidos através dos métodos
espectroscópicos no Infravermelho (IV) e também Ressonância Magnética Nuclear de Hidrogênio (RMN 1H) e Carbono 13 (RMN 13C), utilizando-se técnicas uni e bidimensionais (COSY, HMQC, HMBC e NOESY), além de comparações com modelos da literatura.
4.7.1 - Ressonância Magnética Nuclear
Os espectros de Ressonância Magnética Nuclear de 1H e 13C foram obtidos em espectrômetros Varian a 200 (1H) e 50 MHz (13C) e/ou Varian a 500 (1H) e 125 MHz (13C) do LTF/UFPB, otimizados para técnicas uni e bidimensionais. Os solventes empregados foram metanol deuterado (CD3OD) e clorofórmio deuterados
(ppm) e as constantes de acoplamento em Hz. As multiplicidades dos sinais em RMN 1H foram indicadas segundo a convenção: s (simpleto), sl (simpleto largo), d
(dupleto), dd (duplodupleto), dl (dupleto largo), t (tripleto), dt (duplo tripleto), tl
5. RESULTADOS E DISCUSSÕES
O estudo farmacoquímico do extrato clorofórmico de Caulerpa racemosa
resultou no isolamento de quatro substâncias codificadas com as iniciais da planta (Cr) seguidas de numeração 1 a 4 de acordo com a ordem em que foram isoladas.
5.1. Caracterização estrutural da substância Cr-1
A substância codificada como Cr-1 apresentou-se na forma de cristais
vermelho-alaranjado com ponto de fusão 316-318°C e massa de 150mg (correspondendo a 5% do extrato clorofórmico).
O espectro de absorção na região do infravermelho (Figura 12, pág. 35) revelou a presença de uma única banda na região 3381 cm-1 referente a amina secundária associado uma banda em 1265 cm-1 referente a estiramento da ligação C-N, referentes a presença do heteroátomo nitrogênio. A banda em 1687 cm-1 referente a estiramento da ligação C=O sugeriu que a carbonila do ácido carboxílico sob efeito de ressonância, deslocando o sinal para menores frequências. As bandas em 1323 e 1417 cm-1 referentes a estiramento C-O e deformação O-H corroboraram
para presença de ácido carboxílico (SILVERSTEIN et al., 2007; PAVIA et al., 2001).
O espectro de RMN 1H (200 MHz, CDCl
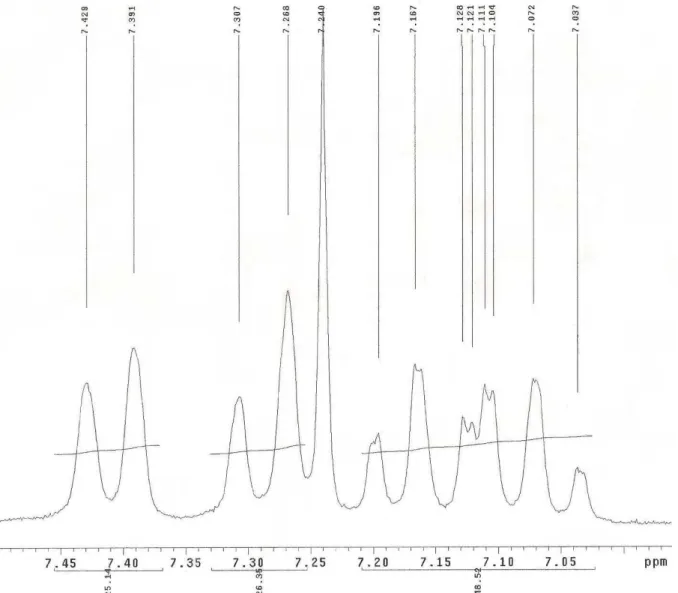
3) e suas expansões (Figura 14 e 15,
pág. 37 e 38) sugeriram a presença de um núcleo aromático orto disubstituído. Essa proposta foi fundamentada na presença de sinais em δH 7,00 a 7,50 e multiplicidade
(Figura 13, pág. 36) observada nesta região característica de núcleo aromático (SILVERSTEIN et al., 2007; PAVIA et al., 2001). Um singleto em δH 9,20 atribuído ao
hidrogênio ligado a nitrogênio sugeriu a presença de um alcalóide de núcleo indólico (GOVENKAR e WAHIDULLA, 2000; ANJANEYULU e MALLAVADHANI, 1991; ANJANEYULU et al., 1992). Análise do espectro de RMN 1H revelou ainda a presença de dois simpletos em δH 8,04 (1H) possivelmente de carbono metínico
ligado a carbonos não hidrogenados e δH 3,90 (3H) característico de metoxila
(SILVERSTEIN et al., 2007; PAVIA et al., 2001).
A figura 15, pág. 38 mostra a expansão da região referente aos hidrogênios do anel aromático com a presença de dois dupletos largos em δH 7,41 (J = 7,6 Hz,
1H) e 7,29 (J = 7,8 Hz, 1H) e dois duplos tripletos em δH 7,17 (J = 1,4 e 7,8 Hz, 1H) e
7,07 (J = 1,4 e 7,8 Hz, 1H) condizentes com a presença de anel aromático
disubstiuído em orto e, portanto, com o modelo proposto (Figura 13, pág. 38).
Figura 15 - Expansão do espectro de RMN 1H (CDCl3, 200 MHz) de Cr-1
na região de 7,0 – 7,5 ppm.
O espectro de RMN 13C-APT (50 MHz, CDCl3) de Cr-1 (Figura 16 e 17, pág.
39 e 40) apresentou 12 sinais, sendo seis para carbonos quaternários e metilênicos, e seis para carbonos metínicos e metílicos.
As informações sugeridas no espectro de RMN 1H foram todas confirmadas no espectro de RMN 13C-APT (50 MHz, CDCl3) de Cr-1 e sua expansão (Figura 16 e
17, pág. 39 e 40) ao mostrar um sinal em δC 52,5 atribuído à metoxila em δH 3,90
(3H); presença de sinais em δC 123,3; 120,7; 118,0 e 111,5 referentes a carbonos
monohidrogenados de anel aromático, além de um sinal em δC 142,8
correspondente ao carbono sp2 com hidrogênio olefínico absorvendo em δH 8,05 no
presença de uma carbonila de éster, plausível com a presença da metoxila indicada no espectro de RMN 1H (SILVERSTEIN et al., 2007; PAVIA et al., 2001).
Comparação dos dados encontrados com os da literatura (figura 25, pág. 46) (GOVENKAR e WAHIDULLA, 2000) permitiram identificar esta substância como sendo o alcalóide bisindólico caulerpina (figura 26, pág. 46), já isolado em Caulerpa racemosa. (GOVENKAR e WAHIDULLA, 2000; ANJANEYULU e MALLAVADHANI,
1991; ANJANEYULU et al., 1992)
Figura 17 - Expansão do espectro de RMN 13C - APT (CDCl
3, 50 MHz)
de Cr-1 na região de 100,0 – 170,0 ppm..
O espectro de correlação heteronuclear HMQC e sua expansão (figuras 18 e 19, pág. 41) demostrou correlações entre o singleto em δH 8,04 com o δC 142,8;
singleto referente a metoxila em δH 3,88 com o δC 52,5. Na região do núcleo
aromático observou-se as correlações entre os dupletos em δH 7,41 com o δC 118,0
e δH 7,29 com o δC 111,5 e os duplo tripletos em δH 7,17 com o δC 123,3 e δH 7,07
Figura 18 - Espectro HMQC (CDCl3, 200 e 50 MHz) de Cr-1
Figura 19 - Expansão do espectro HMQC (CDCl3, 200 e 50 MHz)
Os espectros de correlação homonuclear NOESY (Figura 21, pág. 43) permitiu atribuir os assinalamentos dos dupletos ao mostrar uma correlação espacial entre o simpleto referente ao hidrogênio ligado ao heteroátomo em δH 9,20 com o
dupleto em δH 7,29 e o simpleto em δH 8,04 com o dupleto em 7,41, o que permite
atribuir δH 7,29 e 7,41 para as posições 7 e 4 respectivamente.
Figura 20 – Correlações espaciais observadas no espectro NOESY. H
N
N H
O MeO
O OMe
7,41
Figura 21 - Expansão do espectro NOESY (200 MHz, CDCl3) de Cr-1
na região de (7,0 – 9,5 ppm) x (7,0 – 9,5 ppm)
O espectro de correlação heteronuclear HMBC (Figuras 22 a 24, pág. 44 e 45) a duas (J2) e três (J3) mostrou as seguintes correlações: δH 8,04 (H-9) com δC
166,6 (J3) atribuído à carbonila (C-10), com δC 132,8 (J3) atribuído ao carbono alfa
C-7a alfa ao nitrogênio por apresentar correlação com δH 7,41 (H-4) e δH 7,17 (H-6)
ambos (J3), o que permite atribuir δH 7,17 para a posição 6.
No núcleo aromático observou-se correlação do δH 7,41 (H-4) com δC 123,3
(C-6) e δH 7,17 (H-6) com δC 118,0 (C-4), assim como δH 7,29 (H-7) com δC 120,7
(C-5) e δH 7,07 (H-5) com δC 111,5 (C-7) todos com (J3). O C-3ª teve seu
deslocamento químico definido através da correlação δC 128,1 com δH 7,07 (H-5) e
δH 7,29 (H-7).
Figura 23 - Expansão do espectro HMBC (200 e 50 MHz, CDCl3)
de Cr-1 na região de (7,0 – -8,4 ppm) x (110,0 – 165,0 ppm)
Figura 24 - Expansão do espectro HMBC (200 e 50 MHz, CDCl3)
Figura 25 – Dados de referência da caulerpina.
Figura 26 – Estrutura da alcalóide bisindólico caulerpina 1 5 2 3 3a 4 6 7
7a 8 9
Tabela 1 - Dados espectrais de Cr-1.
RMN C
δC δH
1-NH - 9,20 (s ,1H)
2 132,8 -
3 112,4 -
3a 128,1 -
4 118,0 7,41 (dl, J= 7,6 Hz,1H)
5 120,7 7,07 (dt, J= 1,4 e 7,8 Hz,1H)
6 123,3 7,17 (dt, J= 1,4 e 7,8 Hz,1H)
7 111,5 7,29 (dl, J= 7,8 Hz,1H)
7a 137,7 -
8 125,4 -
9 142,8 8,04 (s ,1H)
10 166,6 -
11 52,5 3,88 (s ,3H)
1-NH’ - 9,20 (s ,1H)
2’ 132,8 -
3’ 112,4 -
3a' 128,1 -
4’ 118,0 7,41 (dl, J= 7,6 Hz,1H)
5’ 120,7 7,07 (dt, J= 1,4 e 7,8 Hz,1H)
6’ 123,3 7,17 (dt, J= 1,4 e 7,8 Hz,1H)
7’ 111,5 7,29 (dl, J= 7,8 Hz,1H)
7a' 137,7 -
8’ 125,4 -
9’ 142,8 8,04 (s ,1H)
10’ 166,6 -
11’ 52,5 3,88 (s ,3H)
5.2. Caracterização estrutural da substância Cr-2
A substância de código Cr-2 foi isolada como pó amorfo de cor escura com
massa de 18mg (correspondendo a 0,60% em peso do extrato clorofórmico) apresentando florescência na luz UV indicando a presença de cromóforo.
O espectro de IV (Figura 27, pág. 48) deste composto mostrou uma banda de absorção em 3402 cm-1 típico de deformação axial de N-H ou O-H, sugerindo a
presença de aminas e/ou hidroxilas, a absorção em 1377 cm-1 atribuído ao
característico de estiramento de CH2 e CH3, que foi indicativo da presença de
cadeias alifáticas (SILVERSTEIN et al., 2007; PAVIA et al., 2001).
Figura 27 - Espectro de Infravermelho (KBr, cm-1) de Cr-2.
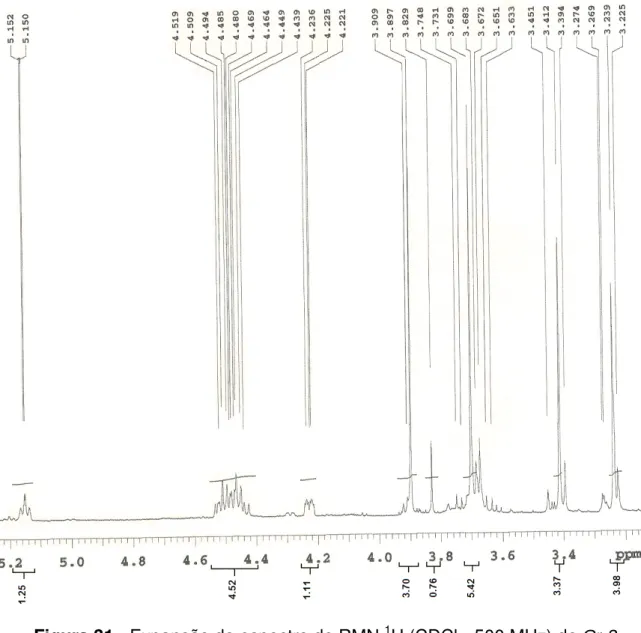
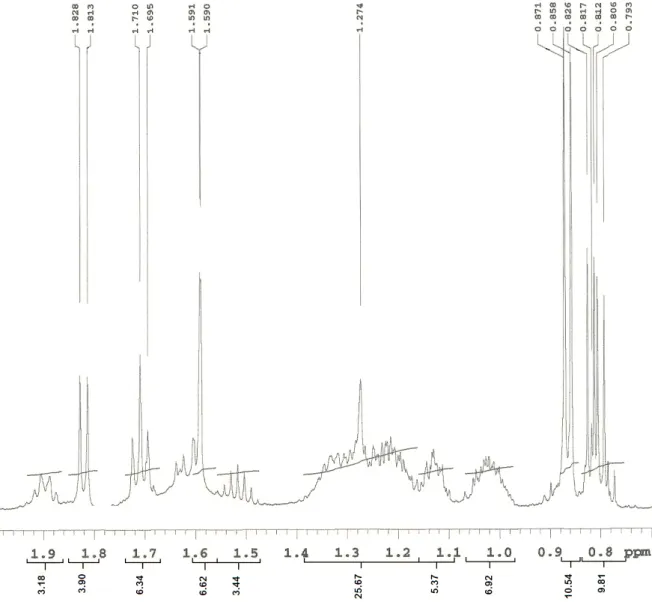
O espectro de RMN 1H (500 MHz, CDCl3) de Cr-2 e suas expansões (Figuras
29 a 33, pág. 50 a 54) apresentaram sinais característicos de compostos que possuem núcleo porfirínico: três simpletos referentes aos hidrogênios olefínicos H-10, H-5 e H-20 em δH 9,53, 9,39 e 8,57, respectivamente; um duplo-dupleto em δH
8,00 (J = 11,5 e 17,5 Hz) acoplando trans com um duplodupleto em δH 6,30 (J = 1,5
e 17,5 Hz) e cis com outro duplodupleto em δH 6,19 (J = 1,5 e 11,5 Hz), condizentes
aos hidrogênios vinílicos do grupo vinila terminal inserido na posição 3 (H-31, H-32 (E) e H-32
(Z), respectivamente); e três simpletos em δH 3,70, 3,41 e 3,24 referentes aos hidrogênios H-121, H-21 e H-71 de três metilas olefínicas, respectivamente (TOMAZ et al, 2008; MATSUO et al, 1996).
Um simpleto largo em δH -1,66 (Figura 33, pág. 54), correspondente a N-H
pirrólico protegido pelo efeito de anisotropia deste anel (SILVERSTEIN et al., 2007; PAVIA et al., 2001) indicou a ausência do átomo de magnésio central, o que permite sugerir que Cr-2 corresponde a um derivado da clorofila (OCAMPO, 2004; CHENG
et al, 2001).
A metila H-71 em δH 3,24 indicou que o composto em questão era derivado da