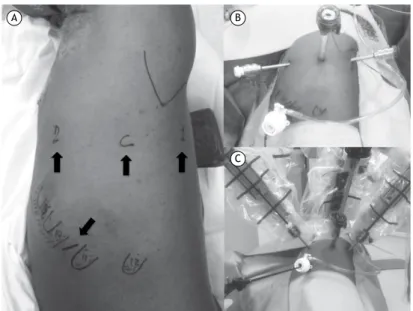
www.jbp.org.br
ISSN 1806-3713
Volume 42, Número 3 maio | junho
2016
DESTAQUE
V
olume 42, Númer
o 3
maio | junho
20
16
DPOC e doença
cardiovascular
Pneumotórax
espontâneo
ISSN 1806-3713
Publicação Bimestral J Bras Pneumol. v.42, número 3, p. 163-236 maio/junho 2016
Publicação Indexada em: Latindex, LILACS, Scielo Brazil, Scopus, Index Copernicus, ISI Web of Knowledge, MEDLINE e PubMed Central (PMC)
Disponível eletronicamente nas versões português e inglês: www.jornaldepneumologia.com.br e www.scielo.br/jbpneu
Associação Brasileira de Editores Científicos
I N T E R N A T I O N A L
EDITOR CHEFE
Rogerio Souza - Universidade de São Paulo, São Paulo - SP EDITORES EXECUTIVOS
Bruno Guedes Baldi - Universidade de São Paulo, São Paulo - SP
Caio Júlio Cesar dos Santos Fernandes - Universidade de São Paulo - São Paulo - SP Carlos Roberto Ribeiro de Carvalho - Universidade de São Paulo, São Paulo - SP Carlos Viana Poyares Jardim - Universidade de São Paulo, São Paulo - SP EDITORES ASSOCIADOS
Afrânio Lineu Kritski - Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ Álvaro A. Cruz - Universidade Federal da Bahia, Salvador, BA
Andre Luis Pereira de Albuquerque - Universidade de São Paulo - São Paulo - SP Ascedio Jose Rodrigues - Universidade de São Paulo - São Paulo - SP
Bruno Hochhegger - Universidade Federal do Rio Grande do Sul - Porto Alegre – RS Edson Marchiori - Universidade Federal Fluminense, Niterói - RJ
Fernanda Carvalho de Queiroz Mello - Universidade Federal do Rio de Janeiro - Rio de Janeiro - RJ Gilberto de Castro Junior - Universidade de São Paulo, São Paulo - SP
Giovanni Battista Migliori - Director WHO Collaborating Centre for TB and Lung Diseases, Fondazione S. Maugeri, Care and Research Institute, Tradate, Italy
Irma de Godoy - Universidade Estadual Paulista, Botucatu - SP
Marcelo Alcântara Holanda - Universidade Federal do Ceará - Fortaleza - CE Oliver Augusto Nascimento - Universidade Federal de São Paulo - São Paulo - SP Pedro Caruso - Universidade de São Paulo - São Paulo - SP
Pedro Rodrigues Genta - Universidade de São Paulo - São Paulo - SP
Renato Tetelbom Stein - Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre - RS Ricardo de Amorim Corrêa - Universidade Federal de Minas Gerais - Belo Horizonte - MG Ricardo Mingarini Terra - Universidade de São Paulo - São Paulo - SP
Simone Dal Corso - Universidade Nove de Julho - São Paulo - SP Ubiratan de Paula Santos - Universidade de São Paulo, São Paulo - SP Veronica Amado - Universidade de Brasília, Brasília - DF
CONSELHO EDITORIAL
Alberto Cukier - Universidade de São Paulo, São Paulo - SP Ana C. Krieger - New York School of Medicine, New York - USA
Ana Luiza Godoy Fernandes - Universidade Federal de São Paulo, São Paulo - SP Antonio Segorbe Luis - Universidade de Coimbra, Coimbra - Portugal
Brent Winston - Department of Critical Care Medicine, University of Calgary, Calgary - Canada Carlos Alberto de Assis Viegas - Universidade de Brasília, Brasília - DF
Carlos Alberto de Castro Pereira - Universidade Federal de São Paulo, São Paulo - SP Carlos M. Luna - Hospital de Clinicas, Universidad de Buenos Aires, Buenos Aires - Argentina Carmen Silvia Valente Barbas - Universidade de São Paulo, São Paulo - SP
Celso Ricardo Fernandes de Carvalho - Universidade de São Paulo, São Paulo - SP Chris T. Bolliger - University of Stellenbosch, Stellenbosch - South Africa Dany Jasinowodolinski - Universidade Federal de São Paulo, São Paulo - SP Denis Martinez - Universidade Federal do Rio Grande do Sul, Porto Alegre - RS Douglas Bradley - University of Toronto, Toronto, ON - Canadá
Emílio Pizzichini - Universidade Federal de Santa Catarina, Florianópolis - SC Fábio Biscegli Jatene - Universidade de São Paulo, São Paulo - SP
Frank McCormack - University of Cincinnati School of Medicine, Cincinnati, OH - USA Geraldo Lorenzi -Filho - Universidade de São Paulo, São Paulo - SP
Gustavo Rodrigo - Departamento de Emergencia, Hospital Central de las Fuerzas Armadas, Montevidéu - Uruguay Ilma Aparecida Paschoal - Universidade de Campinas, Campinas - SP
Isabela C. Silva - Vancouver General Hospital, Vancouver, BC - Canadá J. Randall Curtis - University of Washington, Seattle, Wa - USA John J. Godleski - Harvard Medical School, Boston, MA - USA José Alberto Neder - Universidade Federal de São Paulo, São Paulo - SP José Antonio Baddini Martinez - Universidade de São Paulo, Ribeirão Preto - SP José Dirceu Ribeiro - Universidade de Campinas, Campinas - SP
José Miguel Chatkin - Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre - RS José Roberto de Brito Jardim - Universidade Federal de São Paulo, São Paulo - SP José Roberto Lapa e Silva - Universidade Federal do Rio de Janeiro, Rio de Janeiro - RJ Kevin Leslie - Mayo Clinic College of Medicine, Rochester, MN - USA
Luiz Eduardo Nery - Universidade Federal de São Paulo, São Paulo - SP Marc Miravitlles - Hospital Clinic, Barcelona - España
Marisa Dolhnikoff - Universidade de São Paulo, São Paulo - SP
Marli Maria Knorst - Universidade Federal do Rio Grande do Sul, Porto Alegre - RS Mauro Musa Zamboni - Instituto Nacional do Câncer, Rio de Janeiro - RJ Nestor Muller - Vancouver General Hospital, Vancouver, BC - Canadá Noé Zamel - University of Toronto, Toronto, ON - Canadá Paul Noble - Duke University, Durham, NC - USA
Paulo Francisco Guerreiro Cardoso - Universidade de São Paulo, São Paulo - SP Paulo Pego Fernandes - Universidade de São Paulo, São Paulo - SP
Peter J. Barnes - National Heart and Lung Institute, Imperial College, London - UK Renato Sotto - Mayor - Hospital Santa Maria, Lisboa - Portugal
Richard W. Light - Vanderbili University, Nashville, TN, USA Rik Gosselink - University Hospitals Leuven - Bélgica Robert Skomro - University of Saskatoon, Saskatoon - Canadá Rubin Tuder - University of Colorado, Denver, CO - USA
Sérgio Saldanha Menna - Barreto - Universidade Federal do Rio Grande do Sul, Porto Alegre - RS Sonia Buist - Oregon Health & Science University, Portland, OR - USA
Talmadge King Jr. - University of California, San Francisco, CA - USA
ISSN 1806-3713
E
x
p
e
d
ie
n
te
SOCIEDADE BRASILEIRA DE PNEUMOLOGIA E TISIOLOGIA
Secretaria:SCS Quadra 01, Bloco K, Asa Sul, salas 203/204. Edifício Denasa, CEP 70398- 900 Brasília - DF, Brasil.
Telefone (55) (61) 3245- 1030/ 0800 616218. Site: www.sbpt.org.br. E- mail: sbpt@sbpt.org.br
O Jornal Brasileiro de Pneumologia ISSN 1806-3713, é uma publicação bimestral da Sociedade Brasileira de Pneumologia e Tisiologia. Os conceitos e opiniões emitidos nos artigos são de inteira responsabilidade de seus autores. Permitida a reprodução total ou parcial dos artigos, desde que mencionada a fonte.
Diretoria da SBPT (Biênio 2015-2016):
Presidente: Dr. Renato Maciel - MG
Secretário-Geral: Dr. Paulo Henrique Ramos Feitosa - DF
Diretor de Defesa Proissional: Dr. Jose Eduardo Delini Cançado - SP
Diretor Financeiro: Dr. Saulo Maia Davila Melo - SE Diretor Cientíico: Miguel Abidon Aide - RJ
Diretor de Ensino e Exercício Proissional: Clystenes Odyr Soares Silva - SP Diretor de Comunicação: Simone Chaves Fagondes - RS
Presidente do Congresso SBPT 2016: Marcus Barreto Conde - RJ
Presidente Eleito (Biênio 2017/2018): Fernando Luiz Cavalcanti Lundgren - PE Presidente do Conselho Deliberativo: Jairo Sponholz Araújo - PR
CONSELHO FISCAL (Biênio 2015-2016)
Efetivos: Clóvis Botelho - MT, Benedito Francisco Cabral Júnior - DF, Rafael de Castro Martins - ES Membros Suplentes: Maurício Meireles Góes - MG, Alina Faria França de Oliveira - PE, Paulo Cesar de Oliveira - MG
COORDENADORES DOS DEPARTAMENTOS DA SBPT:
Ações Programáticas – Alcindo Cerci Neto - PR Cirurgia Torácica – Darcy Ribeiro Pinto Filho - RS
Distúrbios Respiratórios do Sono – Marcelo Fouad Rabahi - GO Endoscopia Respiratória – Mauro Musa Zamboni - RJ
Função Pulmonar – João Marcos Salge - SP Imagem – Bruno Hochhegger - RS
Patologia Pulmonar – Ester Nei Aparecida Martins Coletta - SP Pesquisa Clínica – Oliver Augusto Nascimento - SP
Pneumologia Pediátrica – Paulo Cesar Kussek - PR Residência Médica – Alberto Cukier - SP
COORDENADORES DAS COMISSÕES CIENTÍFICAS DA SBPT:
Asma – Emilio Pizzichini - SC
Câncer Pulmonar – Teresa Yae Takagaki - SP
Circulação Pulmonar – Carlos Viana Poyares Jardim - SP Doença Pulmonar Avançada – Dagoberto Vanoni de Godoy - RS Doenças Intersticiais – José Antônio Baddini Martinez - SP
Doenças Respiratórias Ambientais e Ocupacionais – Ana Paula Scalia Carneiro - MG DPOC – Roberto Stirbulov - SP
Epidemiologia – Frederico Leon Arrabal Fernandes - SP Fibrose Cística – Marcelo Bicalho de Fuccio - MG Infecções Respiratórias e Micoses – Mauro Gomes - SP Pleura – Roberta Karla Barbosa de Sales - SP
Relações Internacionais – José Roberto de Brito Jardim - SP Tabagismo – Luiz Carlos Corrêa da Silva - RS
Terapia Intensiva – Marco Antônio Soares Reis - MG Tuberculose – Fernanda Carvalho de Queiroz Mello - RJ
SECRETARIA ADMINISTRATIVA DO JORNAL BRASILEIRO DE PNEUMOLOGIA
Endereço: SCS Quadra 01, Bloco K, Asa Sul, salas 203/204. Edifício Denasa, CEP 70398-900 - Brasília - DF, Brasil. Telefone (55) (61) 3245-1030/ 0800 616218.
Assistente Editorial: Luana Maria Bernardes Campos. E-mail: jpneumo@jornaldepneumologia.com.br Tiragem: 3500 exemplares | Tamanho:18 × 26,5 cm Distribuição: Gratuita para sócios da SBPT e bibliotecas Impresso em papel livre de ácidos
ISSN 1806-3713
Publicação Bimestral J Bras Pneumol. v.42, número 3, p. 163-236 maio/junho 2016
Su
m
á
ri
o
EDITORIAL
163 - Corticosteroides para prevenir lesão pulmonar induzida por ventilação mecânica?
Marcelo Alcantara Holanda
EDUCAÇÃO CONTINUADA: IMAGEM
164 - Nódulos múltiplos calciicados
Edson Marchiori, Gláucia Zanetti, Bruno Hochhegger
EDUCAÇÃO CONTINUADA: METODOLOGIA CIENTÍFICA
165 - Escolhendo sabiamente entre ensaios clínicos randomizados e desenhos observacionais em estudos sobre intervenções
Juliana Carvalho Ferreira, Cecilia Maria Patino
ARTIGO ORIGINAL
166 - Pré-tratamento com dexametasona atenua a lesão pulmonar induzida por ventilação mecânica em modelo experimental
Fernando Fonseca dos Reis, Maycon de Moura Reboredo, Leda Marília Fonseca Lucinda, Aydra Mendes Almeida Bianchi, Maria Aparecida Esteves Rabelo,
Lídia Maria Carneiro da Fonseca, Júlio César Abreu de Oliveira, Bruno Valle Pinheiro
174 - Avaliação da resposta ao broncodilatador em pacientes pediátricos com bronquiolite obliterante pós-infecciosa: uso de diferentes critérios de identiicação de reversibilidade das vias aéreas
Rita Mattiello, Paula Cristina Vidal, Edgar Enrique Sarria, Paulo Márcio Pitrez, Renato Tetelbom Stein, Helena Teresinha Mocelin, Gilberto Bueno Fischer, Marcus Herbert Jones, Leonardo Araújo Pinto
179 - Fatores de risco de doença cardiovascular em pacientes com DPOC: DPOC leve/ moderada versus DPOC grave/muito grave
Laura Miranda de Oliveira Caram, Renata Ferrari, Cristiane Roberta Naves, Liana Sousa Coelho, Simone Alves do Vale, Suzana Erico Tanni, Irma Godoy
185 - Lobectomia pulmonar robótica para tratamento do câncer de pulmão e de metástases pulmonares: implantação do programa e experiência inicial
Ricardo Mingarini Terra, Pedro Henrique Xavier Nabuco de Araujo,
Leticia Leone Lauricella, José Ribas Milanez de Campos, Herbert Felix Costa, Paulo Manuel Pego-Fernandes
191 - Procedimentos diagnósticos broncoscópicos e exames microbiológicos para a
conirmação de tuberculose endobrônquica
Abdullah Şimşek, İlhami Yapıcı, Mesiha Babalık, Zekiye Şimşek, Mustafa Kolsuz
196 - Viabilidade do teste de velocidade de marcha em idosos hospitalizados Bruno Prata Martinez, Anne Karine Menezes Santos Batista, Isis Resende Ramos, Júlio Cesar Dantas, Isabela Barboza Gomes, Luiz Alberto Forgiarini Jr,
ISSN 1806-3713
Publicação Bimestral J Bras Pneumol. v.42, número 3, p. 163-236 maio/junho 2016
Su
m
á
ri
o
203 - Utilidade da avaliação de bactérias revestidas por anticorpos em aspirados traqueais para o diagnóstico de pneumonia associada à ventilação mecânica: um estudo caso-controle
Otavio Tavares Ranzani, Daniel Neves Forte, Antonio Carlos Forte, Igor Mimica, Wilma Carvalho Neves Forte
COMUNICAÇÃO BREVE
211 - Análise da estabilidade da expressão de genes de referência no ventrículo
cardíaco esquerdo de ratos submetidos à hipóxia intermitente crônica
Guilherme Silva Julian, Renato Watanabe de Oliveira, Sergio Tuik, Jair Ribeiro Chagas
ARTIGO ESPECIAL
215 - Ressecção pulmonar anatômica por videotoracoscopia: experiência brasileira
(VATS Brasil)
Ricardo Mingarini Terra, Thamara Kazantzis, Darcy Ribeiro Pinto-Filho,
Spencer Marcantonio Camargo, Francisco Martins-Neto, Anderson Nassar Guimarães, Carlos Alberto Araújo, Luis Carlos Losso, Mario Claudio Ghefter, Nuno Ferreira de Lima, Antero Gomes-Neto, Flávio Brito-Filho, Rui Haddad, Maurício Guidi Saueressig, Alexandre Marcelo Rodrigues Lima, Rafael Pontes de Siqueira,
Astunaldo Júnior de Macedo e Pinho, Fernando Vannucci
ENSAIO PICTÓRICO
222 - A etiologia do pneumotórax espontâneo primário Roberto de Menezes Lyra
IMAGENS EM PNEUMOLOGIA
227 - Implicações de um brônquio traqueal em um paciente com timoma Luis Gorospe, Ana Paz Valdebenito-Montecino, Ana Patricia Ovejero-Díaz
RELATO DE CASO
228 - Impacto do tratamento de longo prazo com corticosteroides e broncodilatadores inalatórios na função pulmonar em um paciente com bronquiolite obliterante pós-infecciosa
Cecilia Calabrese, Nadia Corcione, Gaetano Rea, Francesco Stefanelli, Ilernando Meoli, Alessandro Vatrella
CARTA AO EDITOR
232 - Sinal do halo invertido em infecções fúngicas invasivas Edson Marchiori, Bruno Hochhegger, Gláucia Zanetti
233 - Um velho fator de risco para DPOC: descanse em paz, 15% Paulo César Rodrigues Pinto Corrêa
CORRESPONDÊNCIA
235 - Terapia inalatória em ventilação mecânica
Ângelo Roncalli Miranda Rocha, Caio Henrique Veloso da Costa
236 - Resposta dos autores
ISSN 1806-3713 © 2016 Sociedade Brasileira de Pneumologia e Tisiologia
http://dx.doi.org/10.1590/S1806-37562016000300001
Corticosteroides para prevenir lesão
pulmonar induzida por ventilação mecânica?
Marcelo Alcantara Holanda11. Departamento de Medicina Clínica, Universidade Federal do Ceará, Fortaleza (CE) Brasil.
Numerosas terapias farmacológicas para a síndrome da angústia respiratória aguda (SARA) falharam em
demonstrar benefícios em ensaios clínicos multicêntricos. (1)
Como a inlamação desregulada é uma característica proeminente da SARA, os corticosteroides sistêmicos representariam uma terapia potencialmente benéica.(2)
Meta-análises sobre o uso de corticoterapia na SARA produziram conclusões inconsistentes. Isso principal-mente porque a SARA é uma doença heterogênea com etiologias e evoluções clínicas diversas. Outros fatores incluem diferentes medidas de desfecho e o fato de que os pacientes são geralmente incluídos no prazo de 48 h após preencherem os critérios para o diagnóstico de SARA, enquanto já sob ventilação mecânica, o que poderia atrasar o início do tratamento por vários dias após o aparecimento da lesão pulmonar.(2)
No presente número do JBP, Reis et al.(3) publicam um
estudo experimental muito bem delineado que avalia os efeitos do pré-tratamento com dexametasona na lesão pulmonar induzida por ventilação mecânica (LPIVM), um aspecto reconhecidamente importante da isiopatologia da SARA. A LPIVM em modelo experimental foi induzida em ratos Wistar por ventilação mecânica com volume corrente elevado. Os ratos foram divididos em dois grupos de acordo com a administração prévia de dexametasona ou solução salina, por via intraperitoneal, 30 min antes da indução da LPIVM. O principal resultado do estudo
foi que a administração de dexametasona foi capaz de atenuar a resposta inlamatória causada pela LPIVM, medida por um escore histopatológico de lesão pulmonar, pela contagem de leucócitos e neutróilos no LBA e pela avaliação de seu impacto na oxigenação 4 h e 24 h após a injúria inicial (ventilação com dano). Uma limitação da investigação é a falta de dados sobre os mecanismos moleculares envolvidos na atenuação induzida pela dexametasona na LPIVM em modelo experimental.(4)
Os corticosteroides continuam sendo um dos mais estudados tratamentos farmacológicos para SARA. Uma publicação recente mostrou que a corticoterapia por curto período com baixas doses pode ter impacto na sobrevida na SARA por aspiração.(5) É plausível que o momento (proilático ou após a injúria inicial), a dose e a duração da terapia, assim como a etiologia da lesão pulmonar, sejam todos fatores importantes na determinação da resposta de pacientes com SARA à administração de corticosteroides sistêmicos. Futuros ensaios clínicos devem levar todas essas questões em consideração. A controvérsia em relação aos possíveis benefícios dessa classe de medicamentos na SARA permanece viva. O
trabalho de Reis et al.(3) gera ainda mais interesse nas
abordagens farmacológicas para prevenir ou tratar a LPIVM, em especial no papel dos corticosteroides nessa lesão, principalmente como medida preventiva em pacientes com risco para SARA.
REFERÊNCIAS
1. Levitt JE, Matthay MA. Clinical review: Early treatment of acute lung injury--paradigm shift toward prevention and treatment prior to respiratory failure. Crit Care. 2012;16(3):223. http://dx.doi.org/10.1186/ cc11144
2. Ruan SY, Lin HH, Huang CT, Kuo PH, Wu HD, Yu CJ. Exploring the heterogeneity of effects of corticosteroids on acute respiratory distress syndrome: a systematic review and meta-analysis. Crit Care. 2014;18(2):R63. http://dx.doi.org/10.1186/cc13819
3. Reis FF, Reboredo MM, Lucinda LM, Bianchi AM, Rabelo MA, Fonseca LM, et al. Dexamethasone pre-treatment attenuates experimental
ventilator-induced lung injury. J Bras Pulmonol. 2016;42(3):166-173.
4. Hegeman MA, Hennus MP, Cobelens PM, Kavelaars A, Jansen NJ, et
al. Dexamethasone attenuates VEGF expression and inlammation but
not barrier dysfunction in a murine model of ventilator–induced lung injury. PLoS One. 2013;8(2): e57374. http://dx.doi.org/10.1371/journal. pone.0057374
5. Zhao JN, Liu Y, Li HC. Corticosteroids in treatment of aspiration-related acute respiratory distress syndrome: results of a retrospective cohort study. BMC Pulm Med. 2016;16:29. http://dx.doi.org/10.1186/s12890-016-0194-4
J Bras Pneumol. 2016;42(3):163-163
163
http://dx.doi.org/10.1590/S1806-37562016000000094
Nódulos múltiplos calciicados
Edson Marchiori1,2, Gláucia Zanetti2,3, Bruno Hochhegger4,51. Universidade Federal Fluminense, Niterói (RJ) Brasil. 2. Universidade Federal do Rio de Janeiro, Rio de Janeiro (RJ) Brasil. 3. Faculdade de Medicina de Petrópolis, Petrópolis (RJ) Brasil. 4. Santa Casa de Misericórdia de Porto Alegre, Porto Alegre (RS) Brasil.
5. Universidade Federal de Ciências da Saúde de Porto Alegre, Porto Alegre (RS) Brasil.
Paciente masculino, 22 anos, com diagnóstico prévio de osteossarcoma na perna direita, amputada em 2011. O paciente apresentava múltiplos nódulos pulmonares com calciicações (Figura 1). O diagnóstico inal foi de metástases calciicadas de osteossarcoma.
Nódulos pulmonares múltiplos podem ter inúmeras etiologias. Contudo, quando essas lesões apresentam calciicações, as possibilidades diagnósticas reduzem-se de forma considerável. Metástases calciicadas, amiloi -dose, granulomas hialinizantes, hemangioendotelioma epitelioide, nódulos reumatoides e condromas múltiplos podem ser listados como as principais causas do padrão de massas e/ou nódulos múltiplos, de tamanhos variados e com calciicações. Os tumores que mais comumente originam metástases calciicadas são os sarcomas, especialmente os osteossarcomas, os sinoviossarcomas e os condrossarcomas, assim como os carcinomas, particularmente os adenocarcinomas mucinosos e os papilares.
A amiloidose, na sua forma nodular, é mais comum em pacientes acima de 60 anos, sendo esses em geral assintomáticos. Os nódulos crescem lentamente, por anos, e não regridem. O diagnóstico deinitivo é histopatológico, feito pelo encontro de amiloide, que se cora pelo vermelho Congo e mostra birrefringência verde à luz polarizada. Granulomas hialinizantes são lesões pulmonares ibrosantes raras, em geral associadas a fenômenos autoimunes relacionados principalmente à exposição a antígenos micobacterianos ou fúngicos. Essas lesões podem se manter estáveis ou crescer lentamente durante anos. Hemangioendotelioma epi-telioide é uma neoplasia pulmonar rara, multifocal, de origem endotelial. É considerado um sarcoma de baixa agressividade. Embora, em geral, não mostre crescimento, eventualmente cresce lentamente, podendo causar insuiciência respiratória. Além disso, pode desenvolver calciicação de até 10-20 anos após o diagnóstico. Nódulos necrobióticos podem se desenvolver em pacientes com pneumoconioses associadas à artrite reumatoide. O aparecimento desses nódulos caracteriza a síndrome
de Caplan. Calciicação em condromas pulmonares é
um achado radiológico comum. A associação desses condromas com tumores do estroma gastrointestinal e paragangliomas extra-adrenais é conhecida como tríade de Carney. Em todas essas doenças os pacientes podem ser assintomáticos ou apresentar sintomas torácicos inespecíicos. Dessa forma, frequentemente surgem como achados radiológicos incidentais. A associação entre os achados clínicos e radiológicos pode melhorar signiicativamente a precisão do diagnóstico; no entanto, na maioria dos casos, a biópsia pulmonar com estudos imuno-histoquímicos é necessária para estabelecer o diagnóstico correto. No caso do paciente em questão, a história de ressecção prévia de osteossarcoma associada à presença de nódulos pulmonares calciicados levou ao diagnóstico inal de metástases de osteossarcoma. Esse diagnóstico ica facilitado porque, na grande maioria dos casos, o tumor ósseo primário já é conhecido antes do aparecimento das metástases.
Figura 1. Corte coronal de TC com janela para mediastino evidenciando múltiplos nódulos e massas, de tamanhos variados, parcialmente calciicados, em ambos os pulmões.
LEITURA RECOMENDADA
1. Webb WR, Muller NL, Naidich DP, editors. High-resolution CT of the lung. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2008.
J Bras Pneumol. 2016;42(3):164-164
ISSN 1806-3713 © 2016 Sociedade Brasileira de Pneumologia e Tisiologia
http://dx.doi.org/10.1590/S1806-37562016000000152
Escolhendo sabiamente entre ensaios clínicos
randomizados e desenhos observacionais em
estudos sobre intervenções
Juliana Carvalho Ferreira1,2, Cecilia Maria Patino2,3
1. Divisão de Pneumologia, Instituto do Coração – InCor – Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo (SP) Brasil. 2. Methods in Epidemiologic, Clinical and Operations Research–MECOR–program, American Thoracic Society/Asociación Latinoamericana del Tórax.
3. Department of Preventive Medicine, Keck School of Medicine, University of Southern California, Los Angeles (CA) USA.
Ensaios clínicos randomizados (ECR) são o padrão ouro para avaliar a eicácia de intervenções, pois evitam as principais fontes de viés por meio da randomização dos participantes para tratamento ou controle. Essa característica do desenho do estudo faz dos ECR o tipo mais bem classiicado de estudo dentro do sistema de avaliação cuja estrutura é a Medicina Baseada em Evidências. No entanto, nem todas as perguntas sobre intervenções relativas à saúde podem ser respondidas por meio de um ECR. Estudos observacionais podem ser mais apropriados para estudar certos aspectos das intervenções e, assim, complementar os ECR.
Em algumas situações, não é viável ou ético randomizar pacientes para receber um tratamento — uma intervenção cirúrgica, por exemplo — se os cirurgiões estiverem se sentindo desconfortáveis em realizar um procedimento com o qual não estejam familiarizados. Além disso, estudos observacionais são mais adequados para avaliar a incidência de eventos adversos de intervenções, pois seus critérios de inclusão e exclusão são menos rigorosos, o que permite a inclusão de um espectro mais amplo da população-alvo. Embora os ECR geralmente sejam a melhor opção para testar a eicácia (o efeito da intervenção em condições ideais), os estudos observacionais constituem uma opção valiosa para avaliar a efetividade (o efeito de uma intervenção na vida real).
Algumas das vantagens dos estudos observacionais são: eles são geralmente menos caros que os ECR, não apresentam os obstáculos éticos dos ECR relacionados a divisão dos participantes em grupos tratamento ou controle e raramente envolvem o uso de placebos (Tabela 1).
ESCOLHENDO SABIAMENTE
A escolha entre um estudo observacional e um ECR deve se basear na pergunta especíica do estudo. Desenhos observacionais são apropriados quando é razoável supor que as características que inluenciam o clínico a escolher uma determinada intervenção não estão relacionadas com o desfecho do estudo. Por exemplo, em uma comparação entre radiocirurgia e resseção pulmonar cirúrgica quanto ao impacto na sobrevida de pacientes com câncer de pulmão, um estudo observacional não seria apropriado, pois a escolha entre radiocirurgia e resseção pulmonar é inluenciada pelo
tamanho do tumor e performance status do paciente, que
também inluenciam a sobrevida independentemente da opção de tratamento. Em contraste, estudos observacionais são frequentemente usados para estudar a efetividade da
vacinação para proteger contra doenças infecciosas, pois as características que inluenciam a decisão de se vacinar não são os principais determinantes do risco de ser infectado.
MINIMIZANDO O VIÉS
Ao realizar estudos observacionais para testar inter-venções, o investigador tem de delinear estratégias para minimizar o viés resultante de desequilíbrios entre os grupos intervenção e controle no tocante a fatores de risco conlitantes (fatores de confusão). Na fase de desenho do estudo, uma estratégia típica é medir fatores de confusão conhecidos no início e depois fazer ajustes relativos a esses fatores durante a fase de análise por meio de modelos multivariados. Outra estratégia é combinar variáveis de confusão relacionadas com a intervenção e criar uma nova variável, chamada escore de propensão, que pode ser usada, por exemplo, para parear os participantes no início do estudo ou fazer ajustes relativos aos fatores de confusão durante a análise. No entanto, a eiciência desses métodos é limitada a fatores de confusão conhecidos e medidos de forma adequada.
INDO ALÉM DO DESENHO DO ESTUDO Ao avaliar a literatura médica, os clínicos devem considerar não só o desenho (ECR ou observacional), mas também a qualidade de um determinado estudo. Tanto os ECR como os estudos observacionais contribuem para o avanço do conhecimento na área da saúde, o que pode orientar a tomada de decisão clínica e políticas de saúde pública.
Tabela 1. Comparação entre ensaios clínicos randomizados e estudos observacionais.
Aspecto ECR Estudos
observacionais
Randomização Sim Não
Risco de viés de seleção Baixo Pode ser alto Risco de desequilíbrio de
fatores de risco basais
Baixo Alto
Custo ++++ ++
Complexidade ++++ ++
Duração ++ ++++
Apropriado para avaliar a
eicácia
++++ ++ a +++
Apropriado para avaliar a efetividade
+ ++++
Apropriado para identiicar
eventos adversos
++ a +++ ++++
ECR: ensaios clínicos randomizados.
LEITURA RECOMENDADA
1. Concato, J, Shah N, Horwitz RI. Randomized, controlled trials, observational studies, and the hierarchy of research designs. N Engl J Med. 2000:342(25):1887-92. http://dx.doi.org/10.1056/ NEJM200006223422507
2. Black N. Why we need observational studies to evaluate the effectiveness of health care. BMJ. 1996;312(7040):1215-8. http://dx.doi. org/10.1136/bmj.312.7040.1215
J Bras Pneumol. 2016;42(3):165-165
165
http://dx.doi.org/10.1590/S1806-37562015000000350
RESUMO
Objetivo: Avaliar os efeitos da administração de dexametasona antes da indução de
lesão pulmonar induzida por ventilação mecânica (LPIVM) na evolução temporal dessa lesão. Métodos: Ratos Wistar foram alocados em um dos três grupos: administração de dexametasona LPIVM (grupo dexametasona); administração de salina pré-LPIVM (grupo controle); e somente ventilação (grupo sham). A pré-LPIVM foi realizada por ventilação com volume corrente alto. Os animais dos grupos dexametasona e controle foram sacriicados em 0, 4, 24 e 168 h após LPIVM. Analisamos gasometria arterial, edema pulmonar, contagens de células (totais e diferenciais) no lavado broncoalveolar e histologia de tecido pulmonar. Resultados: Em 0, 4 e 24 h após LPIVM, os escores de lesão pulmonar aguda (LPA) foram maiores no grupo controle que no grupo sham (p < 0,05). A administração de dexametasona antes da LPIVM reduziu a gravidade da lesão pulmonar. Em 4 e 24 h após a indução, o escore de LPA no grupo dexametasona não foi signiicativamente diferente daquele observado no grupo sham e foi menor que o observado no grupo controle (p < 0,05). As contagens de neutróilos no lavado broncoalveolar estavam aumentadas nos grupos controle e dexametasona, com pico em 4 h após LPIVM (p < 0,05). Entretanto, as contagens de neutróilos foram menores no grupo dexametasona que no grupo controle em 4 e 24 h após LPIVM (p < 0,05). O pré-tratamento com dexametasona também impediu o comprometimento da oxigenação após a indução visto no grupo controle. Conclusões: A administração de dexametasona antes de LPIVM atenua os efeitos da lesão em ratos Wistar. Os mecanismos moleculares dessa lesão e o possível papel clínico dos corticosteroides na LPIVM ainda precisam ser elucidados.
Descritores: Lesão pulmonar induzida por ventilação mecânica; Dexametasona; Síndrome
do desconforto respiratório do adulto.
Pré-tratamento com dexametasona atenua
a lesão pulmonar induzida por ventilação
mecânica em modelo experimental
Fernando Fonseca dos Reis1,2, Maycon de Moura Reboredo1,2, Leda Marília Fonseca Lucinda1,2, Aydra Mendes Almeida Bianchi1,2, Maria Aparecida Esteves Rabelo1, Lídia Maria Carneiro da Fonseca1,2, Júlio César Abreu de Oliveira1, Bruno Valle Pinheiro1,2
Endereço para correspondência:
Fernando Fonseca dos Reis. Laboratório de Pesquisa Pulmonar, Universidade Federal de Juiz de Fora, Avenida Eugênio do Nascimento, s/n, Dom Bosco, CEP 36038-330, Juiz de Fora, MG, Brasil.
Tel.: 55 32 99977-6584. E-mail: fernandocajuri@yahoo.com.br
Apoio inanceiro: Este estudo recebeu apoio inanceiro por meio de bolsas concedidas pela Rede Mineira de Ensaios Toxicológicos e Farmacológicos de Produtos
Terapêuticos (Rede Mineira TOXIFAR), pela Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e pelo Centro de Biologia da Reprodução da Universidade Federal de Juiz de Fora.
INTRODUÇÃO
Embora necessária em vários tipos de insuiciência respiratória, a ventilação mecânica (VM) pode ser prejudicial, especialmente se seus parâmetros forem ajustados incorretamente, pois isso pode resultar na chamada lesão pulmonar induzida por VM (LPIVM).(1) A LPIVM pode também piorar uma lesão pulmonar já estabelecida, como a síndrome do desconforto respiratório agudo (SDRA), e atrasar sua cura.(2) A relevância clínica da LPIVM foi determinada por estudos com pacientes com SDRA, em que se constatou que o uso de parâmetros protetores durante a VM, principalmente a limitação do volume corrente e da pressão de platô, diminui a
mortalidade.(3,4) Além disso, estudos com pacientes com
risco de SDRA mostraram que essas mesmas medidas diminuem a ocorrência da síndrome e são atualmente
recomendadas para esses pacientes.(5,6)
A LPIVM ocorre quando a pressão transpulmonar (isto é, a diferença entre a pressão no alvéolo e a pressão no espaço pleural) ultrapassa níveis seguros e gera volumes correntes elevados. As estruturas pulmonares expostas a essa pressão elevada reagem gerando forças com a mesma intensidade, o que resulta em estresse pulmonar. O volume corrente elevado causa a deformação do alvéolo, cuja descrição é a alteração do valor inicial de uma dimensão linear, o que resulta em tensão pulmonar.(7,8) A LPIVM pode ocorrer mesmo que os níveis de estresse e tensão estejam menores que o necessário para romper estruturas alveolares, porém suicientemente elevados para liberar citocinas pró-inlamatórias e recrutar neutróilos, resultando em lesão pulmonar inlamatória.(9) Essa reação biológica à lesão mecânica é denominada biotrauma, e estudos vêm sendo realizados a im de determinar os mecanismos envolvidos e testar estratégias (ventilatórias
1. Laboratório de Pesquisa em Pneumologia, Universidade Federal de Juiz de Fora, Juiz de Fora (MG) Brasil.
2. Centro de Biologia da Reprodução, Universidade Federal de Juiz de Fora, Juiz de Fora (MG) Brasil.
Recebido: 17 janeiro 2016.
Aprovado: 9 maio 2016.
Trabalho realizado na Universidade Federal de Juiz de Fora, Juiz de Fora (MG) Brasil.
J Bras Pneumol. 2016;42(3):166-173
Reis FF, Reboredo MM, Lucinda LMF, Bianchi AMA, Rabelo MAE, Fonseca LMC, Oliveira JCA, Pinheiro BV
e farmacológicas) que possam evitar ou atenuar a LPIVM.(10,11)
Os glicocorticoides exercem efeitos anti-inlamatórios por meio da ligação a seus receptores no citoplasma, formando complexos de glicocorticoides e receptores que migram para o núcleo celular, onde inibem as taxas de transcrição de muitos elementos inlamatórios,
inclusive do fator nuclear kappa B.(12) Isso diminui a
produção de citocinas pró-inlamatórias, tais como TNF-α, IL-1α, IL-1β, IL-2, IL-3, IL-5, IL-6, IL-8, IL-12, IFN-γ e GM-CSF.(13) Por meio da modulação dessas citocinas, os glicocorticoides podem não só suprimir o recrutamento e a ativação de granulócitos, mas também preservar a integridade da barreira alveolocapilar e controlar a permeabilidade vascular. Os glicocorticoides podem também inibir a proliferação de ibroblastos e a deposição de colágeno, as quais são características importantes nas fases avançadas da SDRA.(14,15)
Apesar dos efeitos potencialmente benéicos dos glicocorticoides contra os mecanismos envolvidos na SDRA e na LPIVM, ainda se debate a utilidade clínica dos mesmos em casos de SDRA e LPIVM.(16-20) Por exemplo, no contexto especíico dos efeitos dos glicocorticoides na mortalidade, algumas meta-análises mostraram
que os glicocorticoides reduzem a mortalidade,(17,19)
ao passo que outras não conseguiram demonstrar um efeito convincente do tratamento com glicocorticoides na SDRA.(20) Esses resultados dissonantes podem ser atribuídos ao fato de que ainda não se deiniu a melhor dose de corticosteroides, bem como o melhor
momento de início da terapia.(21)
Estudos com modelos experimentais de LPIVM obtiveram resultados promissores com glucocorticoides. No entanto, esses estudos avaliaram o efeito da dexametasona apenas na fase aguda da LPIVM. (22-25) Portanto, o objetivo deste estudo foi avaliar os efeitos que a administração de dexametasona antes da indução de LPIVM tem na evolução temporal da lesão. Levantamos a hipótese de que o pré-tratamento com dexametasona não só atenuaria a LPIVM na fase aguda, mas também aceleraria o processo de cura em seguida.
MÉTODOS
Preparação dos animais
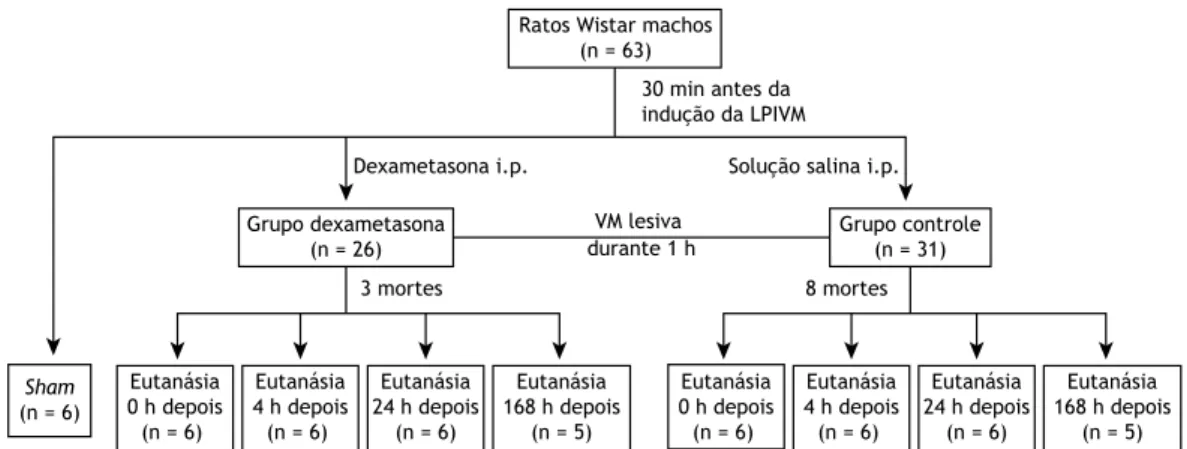
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa Animal da Universidade Federal de Juiz de Fora, no estado de Minas Gerais, Brasil. Os animais foram tratados de acordo com as diretrizes do Conselho Nacional de Controle de Experimentação Animal. Sessenta e três ratos Wistar machos adultos (média de peso: 286 ± 15 g) foram obtidos junto ao biotério do Centro de Biologia da Reprodução da Universidade Federal de Juiz de Fora. Durante a semana anterior ao experimento, grupos de três animais foram alojados em gaiolas de plástico transparente, com tampas de arame de aço inoxidável e fundo coberto de aparas de pinho, em prateleiras fechadas e ventiladas, em ambiente com temperatura controlada, em ciclo claro-escuro de 12 h. Os ratos foram alimentados com ração-padrão (média de 25 g/dia) e água potável à vontade.
Protocolo experimental
Os animais foram divididos em três grupos (Figura 1): dexametasona, formado por ratos que receberam uma injeção intraperitoneal de dexametasona (6 mg/kg) 30 min antes da indução da LPIVM(24,25); controle, formado por ratos que receberam uma injeção intraperitoneal do mesmo volume de solução salina, também 30 min antes da indução da LPIVM e sham, formado por ratos que não receberam nem dexametasona, nem solução salina, foram submetidos a ventilação normal (não lesiva) durante 10 min e foram submetidos aos mesmos procedimentos experimentais realizados nos dois primeiros grupos.
Os ratos foram anestesiados com injeções intrape -ritoneais de xilazina (8 mg/kg) e cetamina (80 mg/ kg). Após a conirmação da profundidade do plano anestésico por meio de pinçamento de uma das pata, os animais foram intubados com um cateter intravenoso calibre 16 e receberam VM no modo controlado por volume com um ventilador para animais de pequeno porte (Inspira ASV; Harvard Apparatus, Holliston, MA, EUA). Para induzir a LPIVM (nos ratos dos grupos dexametasona e controle), os parâmetros ventilatórios foram deinidos da seguinte forma: volume corrente = 35 ml/kg; frequência respiratória = 18 ciclos/min; relação inspiração/expiração = 1:2; FiO2 = 1; positive
end-expiratory pressure (PEEP, pressão expiratória inal
positiva) = 0 cmH2O. Após 1 h dessa VM lesiva, os animais foram extubados e mantidos em observação até que se recuperassem da anestesia.
Após a indução da LPIVM, os animais dos grupos dexametasona e controle foram sacriicados (n = 23 em cada grupo): imediatamente após a indução (0 h, n = 6 em cada grupo); 4 h após a indução (n = 6 em cada grupo); 24 h após a indução (n = 6 em cada grupo) e 168 h (7 dias) após a indução (n = 5 em cada grupo). Em cada um desses momentos, os animais foram novamente anestesiados com injeções intraperitoneais de xilazina (8 mg/kg) e cetamina (80 mg/kg); em seguida, foi realizada uma traqueostomia cirúrgica e foi inserida uma cânula calibre 14. Um cateter arterial foi inserido na carótida esquerda para obter amostras de sangue para a gasometria arterial (ABL90 FLEX; Radiometer, Copenhagen, Dinamarca). Os ratos foram então paralisados com uma injeção intra-arterial de rocurônio (1 mg/kg) e submetidos a VM com os seguintes parâmetros: volume corrente = 6 ml/kg; frequência respiratória = 80 ciclos/min; relação inspiração/expiração = 1:2; FiO2 = 1; PEEP =
2 cmH2O. Após 10 min de ventilação, foi realizada uma
gasometria arterial. Subsequentemente, foi realizada uma laparotomia; os animais foram sacriicados por meio de exsanguinação e seção do diafragma. A traqueia foi pinçada no im da expiração, com PEEP de 2 cmH2O, e os pulmões foram extraídos para análise posterior. Os
animais do grupo sham (n = 6) não foram sacriicados.
Medições
As amostras de sangue para a gasometria arterial foram obtidas após 10 min de ventilação protetora,
167
Pré-tratamento com dexametasona atenua a lesão pulmonar induzida por ventilação mecânica em modelo experimental
imediatamente antes da eutanásia. Os pulmões foram removidos em bloco, e, em seguida, os lobos inferiores direitos foram separados, ixados em formaldeído tamponado a 10% e processados para inclusão em paraina. Os espécimes foram cortados (em seções de 4 µm de espessura) e corados com hematoxilina-eosina. Os exames morfológicos foram realizados por um investigador que desconhecia os grupos, por meio de um microscópio de luz convencional (Carl Zeiss, Hallbergmoos, Alemanha).
A pontuação relativa à lesão pulmonar aguda, que foi o desfecho primário, foi determinada por meio de um sistema de pontuação ponderada, conforme já se
descreveu.(26) Em resumo, pontos foram atribuídos
de forma independente a 20 campos aleatórios com aumento de 400×. Valores de 0, 1 e 2 foram usados para representar a gravidade baseada nos seguintes achados: neutróilos no espaço alveolar, neutróilos no espaço intersticial, membranas hialinas, detritos proteicos nos espaços aéreos e espessamento dos septos alveolares. Para gerar uma pontuação relativa à lesão pulmonar aguda, a soma das cinco variáveis
foi ponderada de acordo com a relevância atribuída a cada uma delas. A pontuação resultante foi um valor contínuo entre 0 (normal) e 1 (a lesão mais grave). Além disso, a extensão de cada componente da pontuação relativa à lesão pulmonar aguda foi calculada com base na soma dos valores de gravidade (0, 1 ou 2) para os 20 campos analisados.
Para obter uma amostra de lavado broncoalveolar, o pulmão esquerdo foi lavado três vezes por meio de um tubo traqueal com 4 ml de PBS contendo 10 nM de EDTA. Cada amostra foi centrifugada durante 10 min a 1.500 rpm para separar os componentes celulares dos não celulares. As amostras foram diluídas em solução de Türk (ácido acético a 2%), e os leucócitos totais foram determinados em uma câmara de Neubauer por meio de microscopia de luz. O sedimento celular foi ressuspenso em PBS e corado com May-Grünwald-Giemsa para as contagens diferenciais de células, as quais foram realizadas com um mínimo de 300 células. A relação entre o peso úmido e o peso seco do pulmão (relação peso pulmonar úmido/seco) foi determinada no
lobo superior direito, conforme já se descreveu.(27) Em
Ratos Wistar machos (n = 63)
30 min antes da indução da LPIVM
Dexametasona i.p. Solução salina i.p.
Grupo dexametasona (n = 26)
VM lesiva durante 1 h
Grupo controle (n = 31)
3 mortes 8 mortes
Sham
(n = 6)
Eutanásia 168 h depois
(n = 5) Eutanásia
0 h depois (n = 6)
Eutanásia 4 h depois (n = 6)
Eutanásia 24 h depois
(n = 6)
Eutanásia 168 h depois
(n = 5) Eutanásia
0 h depois (n = 6)
Eutanásia 4 h depois (n = 6)
Eutanásia 24 h depois
(n = 6)
P
ro
b
a
b
il
id
a
d
e
c
u
m
u
la
ti
va
d
e
s
o
b
re
vi
vê
n
ci
a
0 5 10 15 20
Horas 1,0
0,8
0,6
0,4
0,2
0,0
Dexametasona
Controle
p = 0,19
Figura 1. Fluxograma esquemático do desenho do estudo. LPIVM: lesão pulmonar induzida por ventilação mecânica;
e VM: ventilação mecânica.
Figura 2. Comparação com o teste de log-rank da probabilidade de sobrevivência nas primeiras 24 h após a indução
Reis FF, Reboredo MM, Lucinda LMF, Bianchi AMA, Rabelo MAE, Fonseca LMC, Oliveira JCA, Pinheiro BV
resumo, o lobo superior direito foi isolado e pesado (peso úmido) em uma balança de precisão (Ohaus Adventurer; Toledo do Brasil, São Bernardo do Campo, Brasil). Em seguida, foi secado em um forno de micro-ondas em baixa potência (200 W) durante 5 min. O processo de secagem foi repetido até que a diferença entre duas medições consecutivas fosse de menos de 0,002 g. O último peso determinado foi considerado o peso seco.
Análise estatística
A normalidade da distribuição dos dados foi testada por meio do teste de Kolmogorov-Smirnov. Os valores foram expressos em forma de média ± desvio-padrão ou mediana (intervalo interquartil), conforme o caso. Os dados relativos a cada grupo foram analisados por meio de ANOVA seguida de teste de Dunnett ou teste de Kruskal-Wallis seguido de teste de Mann-Whitney, conforme o caso. Os ajustes para medidas repetidas foram realizados com a correção de Bonferroni. As comparações entre os grupos dexametasona e controle em cada momento foram feitas por meio de teste t não pareado ou teste de Mann-Whitney, conforme o caso. O teste de log-rank foi usado para comparar os grupos dexametasona e controle quanto à Análise de sobrevida. Valores de p < 0,05 foram considerados signiicativos. Todas as análises estatísticas foram realizadas com o
programa Statistical Package for the Social Sciences,
versão 17.0 (SPSS Inc., Chicago, IL, EUA).
RESULTADOS
Sobrevivência
Como a Análise de sobrevida não foi inicialmente um objetivo deste estudo, os animais não foram acompanhados durante um período pré-determinado especiicamente para o estudo desse desfecho. No
entanto, algumas mortes foram observadas nos grupos dexametasona e controle durante o período entre a recuperação da anestesia pós-indução e o momento da eutanásia. Dos 26 animais do grupo dexametasona, 3 (12%) morreram; dos 31 animais do grupo controle, 8 (26%) morreram (p = 0,19). Dessas 11 mortes, 10 ocorreram nas primeiras 6 h depois da indução da LPIVM, e uma ocorreu mais de 6 h, porém menos de 24 h depois da indução da LPIVM (Figura 2).
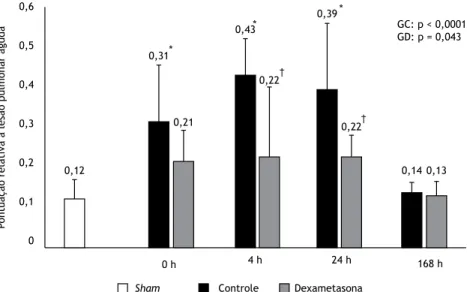
Histologia pulmonar e LBA
Às 0 h, 4 h e 24 h depois da LPIVM, os ratos do grupo controle apresentaram maior lesão pulmonar — segundo a pontuação relativa à lesão pulmonar aguda — do que
os do grupo sham. Às 168 h, a média da pontuação
do grupo controle havia diminuído e não era diferente
da observada no grupo sham. Não houve diferenças
signiicativas entre o grupo dexametasona e o grupo
sham quanto à pontuação relativa à lesão pulmonar
aguda em nenhum dos momentos avaliados. A lesão pulmonar foi signiicativamente menor no grupo dexametasona do que no grupo controle 4 h e 24 h depois da LPIVM (Figura 3).
Na análise de cada componente da pontuação relativa à lesão pulmonar aguda, os animais do grupo controle apresentaram um maior número de neutróilos inters
-ticiais do que os do grupo sham 0 h, 4 h e 24 h depois
da LPIVM; o maior número de neutróilos intersticiais foi observado 4 h depois da LPIVM. Essa iniltração de neutróilos não foi observada nos animais do grupo dexametasona, que apresentaram menor número de neutróilos intersticiais em comparação com os do grupo controle 4 h e 24 h depois da LPIVM. Houve iniltração neutrofílica alveolar no grupo controle, porém não no grupo sham, 4 h e 24 h depois da LPIVM. Essa
iniltração foi inibida pela dexametasona: os animais do grupo dexametasona apresentaram menor número de
0,6
0,5
0,4
0,3
0,2
0,1
0
0 h 4 h 24 h 168 h
†
†
GC: p < 0,0001 GD: p = 0,043
Dexametasona Controle
Sham
P
o
n
tu
a
çã
o
r
e
la
ti
va
à
l
e
sã
o
p
u
lm
o
n
a
r
a
gu
d
a
0,12
0,31
0,21
0,43
0,22 0,39
0,22
0,14 0,13 *
*
*
Figura 3. Pontuação relativa à lesão pulmonar aguda, por grupo, bem como por momento após a indução da lesão pulmonar induzida por ventilação mecânica no grupo dexametasona (GD) e no grupo controle (GC). Dados expressos em forma de média ± dp. Os valores de p indicam a signiicância global das diferenças entre os momentos e dentro de cada grupo (ANOVA de uma via). *p < 0,05 vs. grupo sham. †p < 0,05 vs. controle no mesmo momento.
169
Pré-tratamento com dexametasona atenua a lesão pulmonar induzida por ventilação mecânica em modelo experimental
neutróilos alveolares 4 h e 24 h depois da LPIVM do que os animais do grupo controle. Além disso, debris proteicos foram mais frequentemente observados nos
ratos do grupo controle do que nos do grupo sham 0
h e 24 h depois da LPIVM (Tabela 1).
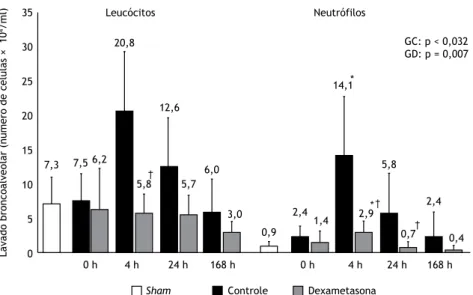
No grupo controle, o número de neutróilos no lavado broncoalveolar aumentou após a LPIVM. O maior número foi observado 4 h depois da LPIVM; porém, 24 h e 168 h depois, a contagem de neutróilos no lavado broncoalveolar no grupo controle retornara a níveis que não eram estatisticamente diferentes dos
observados no grupo sham. No grupo dexametasona,
a contagem de neutróilos no lavado broncoalveolar também aumentou após a LPIVM, embora menos, e foi menor no grupo dexametasona que no grupo controle 4 h e 24 h depois da LPIVM. Em comparação com os ratos do grupo controle, os do grupo dexametasona apresentaram menor número de leucócitos no lavado broncoalveolar 4 h depois da LPIVM (Figura 4).
Gasometria arterial
Imediatamente após a LPIVM (0 h após a indução), a
PaO2 no grupo controle foi menor do que a observada no
grupo sham, embora tenha melhorado progressivamente
em cada momento subsequente. Essa deiciência de oxigenação não foi observada no grupo dexametasona (Tabela 2).
Relação peso pulmonar úmido/seco
Não foram encontradas diferenças entre os grupos dexametasona e controle quanto à relação peso pulmonar úmido/seco.
DISCUSSÃO
O principal achado deste estudo foi o fato de que a dexametasona foi capaz de reduzir a resposta inlamatória causada pela LPIVM e, consequentemente, reduzir a lesão pulmonar aguda, além de atenuar os efeitos da lesão na oxigenação. Demonstramos também que LPIVM ocorreu logo após a VM lesiva e melhorou progressivamente após a suspensão do insulto, melhora essa que se manteve durante todo o período de observação.
Nesse modelo de LPIVM, a VM com volumes correntes elevados resultou em lesão pulmonar imediata, caracterizada por elevada pontuação relativa à lesão pulmonar aguda após 1 h dessa ventilação lesiva. A pontuação manteve-se elevada 4 h e 24 h depois da ventilação. Porém, no máximo 168 h depois, já havia se normalizado. Esses achados estão de acordo com os de estudos anteriores, que mostraram que a VM com volumes correntes elevados pode resultar em LPIVM nos primeiros 60-90 min. Nesses estudos, as alterações histológicas foram maiores nas primeiras 48 h após o
insulto e normalizaram-se dentro de 7-14 dias.(23,28)
Estudamos não só a evolução temporal da LPIVM, mas também o impacto que a administração de um anti-in -lamatório tem nessa lesão. A decisão de administrar dexametasona 30 min antes da VM lesiva baseou-se em estudos experimentais anteriores, nos quais foram demonstrados seus efeitos anti-inlamatórios na LPIVM.(24,25) No presente estudo, a pontuação relativa à lesão pulmonar aguda dos animais que receberam
dexametasona e a dos animais do grupo sham foi
comparável em todos os momentos analisados. Além
Tabela 1. Pontuação relativa à lesão pulmonar aguda, por componente, em ratos submetidos a 10 min de ventilação mecânica protetora (grupo sham) ou 1 h de ventilação mecânica lesiva (grupos dexametasona e controle, avaliados
ao longo do tempo).a Componente
Grupo
Momento pb
0 h 4 h 24 h 168 h
Neutróilos intersticiais
Controle Dexametasona Sham
22,8 ± 6,9* 15,8 ± 6,6 12,3 ± 4,3
35,0 ± 5,2* 15,8 ± 8,4†
-30,3 ± 9,0* 18,2 ± 7,2†
-18,0 ± 3,3 16,8 ± 4,3
-< 0,0001 NS Neutróilos alveolares Controle Dexametasona Sham 5,5 (9,5) 4 (7,5) 0,5 (2,5) 11,5 (4,8)* 2 (6,5)†
-11 (14,3)* 3 (4)†
-1 (0,5) 1 (1) -0,001 NS Membranas hialinas Controle Dexametasona Sham 0 (1) 0 (1,3) 0 (0) 0 (0,3) 0 (0,5) -0 (1,3) 0 (0,8) -0 (-0) 0 (0) -NS NS Detritos proteicos Controle Dexametasona Sham 15 (18,3)* 12,5 (7)* 2 (4,3) 9,5 (12,3) 4 (6) -13 (-13,3)* 9,5 (10,3) -0 (-0) 0 (1) -0,001 0,01 Espessamento septal Controle Dexametasona Sham
14,5 ± 10,9 12,0 ± 5,5 10,0 ± 7,5
20,0 ± 6,7 18,7 ± 7,8
-16,8 ± 10,0 16,5 ± 5,5
-3,2 ± 2,3 3,2 ± 3,7
-NS NS
Reis FF, Reboredo MM, Lucinda LMF, Bianchi AMA, Rabelo MAE, Fonseca LMC, Oliveira JCA, Pinheiro BV
disso, a pontuação relativa à lesão pulmonar aguda foi menor no grupo dexametasona que no grupo controle 4 h e 24 h depois da VM lesiva. Essa lesão pulmonar mais leve relacionou-se com melhor oxigenação no im da VM. Embora nem as vias inlamatórias envolvidas na LPIVM nem o impacto da administração de corticosteroides tenham sido avaliados, a lesão pulmonar mais leve e a menor disfunção pulmonar observadas nos animais tratados com dexametasona estão em conformidade com o que já se sabe sobre a isiopatologia da LPIVM. Demonstrou-se que a VM com
volumes correntes elevados promove a quimiotaxia e ativação de neutróilos nos pulmões, por meio de pelo menos dois mecanismos diferentes: ativação do fator de transcrição fator nuclear kappa B, que media a liberação de certas citocinas pró-inlamatórias, tais como TNF-α, IL-6 e IL-8(23); e regulação positiva de CD11b/CD18 induzida pela deformação de neutróilos à medida que passam através dos capilares pulmonares comprimidos por alvéolos hiperinlados pelos volumes
correntes elevados.(29) Os corticosteroides conseguem
inibir ambas as vias, reduzindo assim o inluxo de
Figura 4. Leucócitos e neutróilos (número de células × 104/ml) no lavado broncoalveolar, por grupo, bem como por momento após a indução da lesão pulmonar induzida por ventilação mecânica no grupo dexametasona (GD) e no grupo controle (GC). Os valores de p indicam a signiicância global das diferenças entre os momentos e dentro de cada grupo (ANOVA de uma via). *p < 0,05 vs. grupo sham. †p < 0,05 vs. controle no mesmo momento.
Tabela 2. Gasometria arterial em ratos submetidos a 10 min de ventilação mecânica protetora (grupo sham) ou 1 h de ventilação mecânica lesiva, além da relação peso pulmonar úmido/seco nestes últimos (grupos dexametasona e controle), os quais foram avaliados ao longo do tempo.a
Variável Grupo
Momento p
0 h 4 h 24 h 168 h
PaO2 (mmHg) Controle Dexametasona Sham
222 ± 98* 279 ± 76 388 ± 26
274 ± 87 313 ± 131
-387 ± 31 388 ± 71
-335 ± 71 385 ± 21
-0.003 NS
PaCO2 (mmHg) Controle Dexametasona Sham
52 ± 9 51 ± 6 51 ± 12
49 ± 6 44 ± 4
-54 ± 6 52 ± 10
-57 ± 10 51 ± 12
-NS NS pH Controle Dexametasona Sham
7.25 ± 0.05 7.26 ± 0.02 7.30 ± 0.08
7.28 ± 0.05 7.26 ± 0.04
-7.27 ± 0.04 7.27 ± 0.06
-7.26 ± 0.09 7.27 ± 0.05
-NS NS
HCO3 (mEq/l) Controle Dexametasona Sham
22.6 ± 1.3 21.7 ± 2.5 21.9 ± 1.0
23.0 ± 3.3 19.3 ± 2.6
-23.0 ± 2.0 22.2 ± 2.2
-24.1 ± 2.7 24.3 ± 2.6
-NS NS
Relação PP U/S Controle Dexametasona
4.9 ± 0.2 4.9 ± 0.3
4.8 ± 0.7 4.7 ± 0.4
4.5 ± 0.2 4.4 ± 0.1
4.5 ± 0.1 4.9 ± 0.5
NS NS NS: não signiicativo; e PP U/S: peso pulmonar úmido/seco. aDados expressos em forma de média ± dp. bSigniicância global das diferenças entre os momentos em cada grupo (ANOVA de uma via).
*p < 0,05 vs. grupo sham (teste de Dunnett).
35 30 25 20 15 10 5 0
4 h 0 h 4 h 24 h 168 h
†
† GC: p < 0,032 GD: p = 0,007
Dexametasona Controle Sham La va d o b ro n co a lv e o la r (n ú m e ro d e c é lu la s × 1 0 4/ m l) 7,3 0 h 7,5 6,2 168 h 6,0 3,0 † 20,8 5,8 24 h 12,6 5,7 * * 0,9 2,4 1,4 14,1 2,9 5,8 0,7 2,4 0,4 Leucócitos Neutrófilos 171
Pré-tratamento com dexametasona atenua a lesão pulmonar induzida por ventilação mecânica em modelo experimental
neutróilos nos pulmões e sua ativação, inibindo ou minimizando assim a lesão que induzem.(25,30) Esses efeitos dos corticosteroides poderiam explicar nossos achados, que mostraram que os animais tratados apresentaram menor número de neutróilos no lavado broncoalveolar, além de menor iniltração intersticial/ alveolar de neutróilos e, consequentemente, lesão pulmonar mais leve.
A maioria dos estudos experimentais dos efeitos dos corticosteroides na LPIVM foi realizada na fase aguda da lesão e mostrou que esses agentes anti-inlamatórios são capazes de diminuir a liberação de citocinas locais/ sistêmicas, a iniltração de neutróilos nos pulmões, as alterações histológicas e o comprometimento funcional induzidos pela LPIVM.(23,25,28,29) No presente estudo, mostramos que, além desses benefícios agudos, a dexametasona manteve reduzidas a inlamação e a lesão pulmonar durante todo o período de recuperação após a LPIVM.
Em outro modelo experimental de LPIVM, Hegeman
et al.(22) mostraram que a dexametasona inibe o
inluxo de neutróilos e a expressão de mediadores inlamatórios, além de prevenir a expressão do fator de crescimento endotelial vascular nos pulmões. Os autores constataram que essa expressão relaciona-se com vazamento vascular e regulação da permeabilidade vascular. No entanto, não observaram nenhum efeito protetor da dexametasona contra a disfunção da barreira alveolocapilar; os autores constataram que o tratamento com glicocorticoides não teve nenhum efeito nos níveis de proteína no lavado broncoalveolar ou na relação peso pulmonar úmido/seco.(22) No tocante à relação peso pulmonar úmido/seco, o mesmo resultado foi observado em nosso estudo. Demonstrou-se que a dexametasona pode aumentar a água extravascular pulmonar em animais expostos a hiperóxia, contrabalançando seus efeitos positivos na lesão pulmonar de modo que o efeito global é neutro ou mesmo deletério.(31)
Observamos uma taxa de mortalidade menor nos animais tratados com dexametasona do que nos do grupo controle, embora a diferença não tenha sido estatisticamente signiicativa. Isso pode ter ocorrido porque o número de animais estudados foi insuiciente, já que a sobrevivência não foi um desfecho planejado. O desenho do estudo não nos permite determinar a causa da morte dos 11 animais. Não obstante, como essas mortes ocorreram nas primeiras horas após a indução da LPIVM, período durante o qual os níveis de inlamação e lesão pulmonar foram mais altos, pode-se supor que se relacionaram com a lesão pulmonar. Também se pode
inferir que a dexametasona teve um efeito positivo na sobrevivência. Outra hipótese possível, baseada nos resultados de outros estudos, é que a LPIVM pode ter gerado uma resposta inlamatória sistêmica, com instabilidade hemodinâmica, que pode ter melhorado por meio da administração da dexametasona. (32) Esse efeito hemodinâmico foi demonstrado por Nin et al.,(25) os quais mostraram, em outro modelo experimental de LPIVM, que a administração de dexametasona atenuou a lesão pulmonar e evitou a instabilidade hemodinâmica observadas nos animais que não receberam pré-tratamento.
Escolhemos submeter os ratos a VM com volume corrente de 35 ml/kg com base em estudos anteriores que usaram os mesmos parâmetros para estudar a LPIVM e os efeitos de estratégias terapêuticas.(25,33,34) Embora esse volume corrente possa parecer bastante distante daquele que se emprega na prática clínica, deve-se ter em mente que, na SDRA, a área alveolar disponível para a ventilação é altamente limitada (o conceito do “pulmão de bebê”), e o volume corrente (que é definido de acordo com o peso corporal ideal) que chega a essas áreas disponíveis pode ser
extremamente elevado.(35)
Nosso estudo tem algumas limitações que devem ser consideradas. As análises realizadas nos diferentes momentos foram realizadas apenas com os animais sobreviventes, o que constitui um viés. Os resultados obtidos em cada momento nos grupos dexametasona e controle foram comparados com os obtidos no
grupo sham, no qual os animais receberam ventilação
durante apenas 10 min com estratégia protetora. Uma comparação mais precisa teria incluído a intubação e a extubação dos animais do grupo sham, com eutanásia nos mesmos momentos que nos demais grupos.
O desenho deste estudo, com LPIVM seguida de extubação e observação durante certo período de tempo, não necessariamente se correlaciona com a prática clínica. No entanto, aumenta a compreensão do curso da LPIVM e de como o uso de corticoster -oides pode alterar esse curso. Embora tenhamos demonstrado a evolução temporal da LPIVM e sua natureza inlamatória, principalmente por meio da demonstração da capacidade da dexametasona de atenuar a lesão, não avaliamos as vias envolvidas. Em suma, descrevemos aqui o curso da LPIVM induzida por volumes correntes elevados e demonstramos que o pré-tratamento com dexametasona é capaz de atenuar a LPIVM em ratos Wistar. Os mecanismos moleculares e o possível papel clínico da corticoterapia na LPIVM ainda precisam ser elucidados.
REFERÊNCIAS
1. Dreyfuss D, Saumon G. Ventilator-induced lung injury: lessons from experimental studies. Am J Respir Crit Care Med. 1998;157(1):294-323. http://dx.doi.org/10.1164/ajrccm.157.1.9604014
2. Pinhu L, Whitehead T, Evans T, Grifiths M. Ventilator-associated lung
injury. Lancet. 2003;361(9354):332-40. http://dx.doi.org/10.1016/ S0140-6736(03)12329-X
3. Ventilation with lower tidal volumes as compared with traditional
tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. N Engl J Med. 2000;342(18):1301-8. http://dx.doi.org/10.1056/ NEJM200005043421801
Reis FF, Reboredo MM, Lucinda LMF, Bianchi AMA, Rabelo MAE, Fonseca LMC, Oliveira JCA, Pinheiro BV
N Engl J Med. 1998;338(6):347-54. http://dx.doi.org/10.1056/ NEJM199802053380602
5. Serpa Neto A, Simonis FD, Schultz MJ. How to ventilate patients without acute respiratory distress syndrome? Curr Opin Crit Care. 2015;21(1):65-73. http://dx.doi.org/10.1097/ MCC.0000000000000165
6. Mechanical Ventilation Committee of the Brazilian Intensive Care Medicine Association; Commission of Intensive Therapy of the Brazilian Thoracic Society. Brazilian recommendations of mechanical ventilation 2013. Part I. J Bras Pneumol. 2014;40(4):327-63. http:// dx.doi.org/10.1590/S1806-37132014000400002
7. Gattinoni L, Protti A, Caironi P, Carlesso E. Ventilator-induced lung injury: the anatomical and physiological framework. Crit Care Med. 2010;38(10 Suppl):S539-48. http://dx.doi.org/10.1097/ CCM.0b013e3181f1fcf7
8. Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med. 2013;369(22):2126-36. http://dx.doi.org/10.1056/NEJMra1208707
9. Tremblay LN, Slutsky AS. Ventilator-induced injury: from barotrauma to biotrauma. Proc Assoc Am Physicians. 1998;110(6):482-8.
10. De Prost N, Dreyfuss D. How to prevent ventilator-induced lung injury? Minerva Anestesiol. 2012;78(9):1054-66.
11. Uhlig S, Uhlig U. Pharmacological interventions in ventilator-induced lung injury. Trends Pharmacol Sci. 2004;25(11):592-600. http://dx.doi. org/10.1016/j.tips.2004.09.002
12. Barnes PJ. Corticosteroid effects on cell signalling. Eur Respir J. 2006;27(2):413-26. http://dx.doi.org/10.1183/09031936.06.0012540 4
13. Rhen T, Cidlowski JA. Antiinlammatory action of
glucocorticoids--new mechanisms for old drugs. N Engl J Med. 2005;353(16):1711-23. http://dx.doi.org/10.1056/NEJMra050541
14. Sessler CN, Gay PC. Are corticosteroids useful in late-stage acute respiratory distress syndrome? Respir Care. 2010;55(1):43-55.
15. Thompson BT. Glucocorticoids and acute lung injury. Crit Care Med. 2003;31(4 Suppl):S253-7. http://dx.doi.org/10.1097/01. CCM.0000057900.19201.55
16. Agarwal R, Nath A, Aggarwal AN, Gupta D. Do glucocorticoids decrease mortality in acute respiratory distress syndrome? A meta-analysis. Respirology. 2007;12(4):585-90. http://dx.doi.org/10.1111/ j.1440-1843.2007.01060.x
17. Lamontagne F, Briel M, Guyatt GH, Cook DJ, Bhatnagar N, Meade M. Corticosteroid therapy for acute lung injury, acute respiratory distress syndrome, and severe pneumonia: a meta-analysis of randomized controlled trials. J Crit Care. 2010;25(3):420-35. http:// dx.doi.org/10.1016/j.jcrc.2009.08.009
18. Meduri GU, Marik PE, Chrousos GP, Pastores SM, Arlt W, Beishuizen A, et al. Steroid treatment in ARDS: a critical appraisal of the ARDS network trial and the recent literature. Intensive Care Med. 2008;34(1):61-9. http://dx.doi.org/10.1007/s00134-007-0933-3
19. Tang BM, Craig JC, Eslick GD, Seppelt I, McLean AS. Use of corticosteroids in acute lung injury and acute respiratory distress syndrome: a systematic review and meta-analysis. Crit Care Med. 2009;37(5):1594-603. http://dx.doi.org/10.1097/ CCM.0b013e31819fb507
20. Peter JV, John P, Graham PL, Moran JL, George IA, Bersten A. Corticosteroids in the prevention and treatment of acute respiratory distress syndrome (ARDS) in adults: meta-analysis. BMJ. 2008;336(7651):1006-9. http://dx.doi.org/10.1136/ bmj.39537.939039.BE
21. Steinberg KP, Hudson LD, Goodman RB, Hough CL, Lanken PN, Hyzy
R, et al. Eficacy and safety of corticosteroids for persistent acute
respiratory distress syndrome. N Engl J Med. 2006;354(16):1671-84. http://dx.doi.org/10.1056/NEJMoa051693
22. Hegeman MA, Hennus MP, Cobelens PM, Kavelaars A, Jansen NJ, Schultz MJ, et al. Dexamethasone attenuates VEGF expression
and inlammation but not barrier dysfunction in a murine model of
ventilator-induced lung injury. PLoS One. 2013;8(2):e57374. http:// dx.doi.org/10.1371/journal.pone.0057374
23. Nin N, Lorente JA, de Paula M, El Assar M, Vallejo S, Peñuelas O, et al. Rats surviving injurious mechanical ventilation show reversible
pulmonary, vascular and inlammatory changes. Intensive Care Med.
2008;34(5):948-56. http://dx.doi.org/10.1007/s00134-007-0959-6
24. Nin N, Lorente JA, Fernández-Segoviano P, De Paula M, Ferruelo A, Esteban A. High-tidal volume ventilation aggravates sepsis-induced multiorgan dysfunction in a dexamethasone-inhibitable manner. Shock. 2009;31(4):429-34. http://dx.doi.org/10.1097/ SHK.0b013e318188b720
25. Nin N, Peñuelas O, de Paula M, Lorente JA, Fernández-Segoviano P, Esteban A. Ventilation-induced lung injury in rats is associated
with organ injury and systemic inlammation that is attenuated by
dexamethasone. Crit Care Med. 2006;34(4):1093-8. http://dx.doi. org/10.1097/01.CCM.0000205663.92384.E7
26. Matute-Bello G, Downey G, Moore BB, Groshong SD, Matthay MA,
Slutsky AS, et al. An oficial American Thoracic Society workshop
report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 2011;44(5):725-38. http:// dx.doi.org/10.1165/rcmb.2009-0210ST
27. Peterson BT, Brooks JA, Zack AG. Use of microwave oven for determination of postmortem water volume of lungs. J Appl Physiol Respir Environ Exerc Physiol. 1982;52(6):1661-3.
28. Curley GF, Contreras M, Higgins B, O’Kane C, McAuley DF,
O’Toole D, et al. Evolution of the inlammatory and ibroproliferative
responses during resolution and repair after ventilator-induced lung injury in the rat. Anesthesiology. 2011;115(5):1022-32. http://dx.doi. org/10.1097/ALN.0b013e31823422c9
29. Ohta N, Shimaoka M, Imanaka H, Nishimura M, Taenaka N, Kiyono H, et al. Glucocorticoid suppresses neutrophil activation in ventilator-induced lung injury. Crit Care Med. 2001;29(5):1012-6. http://dx.doi. org/10.1097/00003246-200105000-00027
30. Held HD, Boettcher S, Hamann L, Uhlig S. Ventilation-induced chemokine and cytokine release is associated with activation of nuclear factor-kappaB and is blocked by steroids. Am J Respir Crit Care Med. 2001;163(3 Pt 1):711-6. http://dx.doi.org/10.1164/ ajrccm.163.3.2003001
31. Ramsay PL, Smith CV, Geske RS, Montgomery CA, Welty SE.
Dexamethasone enhancement of hyperoxic lung inlammation in rats
independent of adhesion molecule expression. Biochem Pharmacol. 1998;56(2):259-68. http://dx.doi.org/10.1016/S0006-2952(98)00138-5
32. Imai Y, Parodo J, Kajikawa O, de Perrot M, Fischer S, Edwards V, et al. Injurious mechanical ventilation and end-organ epithelial cell apoptosis and organ dysfunction in an experimental model of acute respiratory distress syndrome. JAMA. 2003;289(16):2104-12. http:// dx.doi.org/10.1001/jama.289.16.2104
33. Dreyfuss D, Basset G, Soler P, Saumon G. Intermittent
positive-pressure hyperventilation with high inlation positive-pressures produces
pulmonary microvascular injury in rats. Am Rev Respir Dis. 1985;132(4):880-4.
34. Eyal FG, Hamm CR, Parker JC. Reduction in alveolar macrophages attenuates acute ventilator induced lung injury in rats. Intensive Care Med. 2007;33(7):1212-8. http://dx.doi.org/10.1007/s00134-007-0651-x
35. Gattinoni L, Pesenti A. The concept of “baby lung”. Intensive Care Med. 2005;31(6):776-84. http://dx.doi.org/10.1007/s00134-005-2627-z
173