DEPARTAMENTO DE PATOLOGIA E MEDICINA LEGAL PROGRAMA DE PÓS GRADUAÇÃO EM MICROBIOLOGIA MÉDICA
FREQUÊNCIA DO VÍRUS EPSTEIN-BARR (EBV) EM PACIENTES
COM CÂNCER DE MAMA DO SERVIÇO DE MASTOLOGIA DE UM
HOSPITAL DO ESTADO DO CEARÁ.
EMANUELE SILVA DE OLIVEIRA
1 EMANUELE SILVA DE OLIVEIRA
FREQUÊNCIA DO VÍRUS EPSTEIN-BARR (EBV) EM PACIENTES COM CÂNCER DE MAMA DO SERVIÇO DE MASTOLOGIA DE UM HOSPITAL DO ESTADO DO
CEARÁ.
Dissertação apresentada ao Programa de Pós-Graduação em Microbiologia Médica da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Mestre em Microbiologia Médica.
Orientadora: Profa Dra Sílvia Helena Barem Rabenhorst.
2 EMANUELE SILVA DE OLIVEIRA
FREQUÊNCIA DO VÍRUS EPSTEIN-BARR (EBV) EM PACIENTES COM CÂNCER DE MAMA DO SERVIÇO DE MASTOLOGIA DE UM HOSPITAL DO ESTADO DO
CEARÁ.
Dissertação apresentada ao Programa de Pós-Graduação em Microbiologia Médica da Universidade Federal do Ceará, como requisito parcial à obtenção do título de Mestre em Microbiologia Médica.
Aprovada em 26 / 01 / 2015
Banca examinadora
____________________________________________________________ Profa Dra Sílvia Helena Barem Rabenhorst (Orientadora)
Universidade Federal do Ceará - UFC
____________________________________________________________ Dra Márcia Valéria Pitombeira Ferreira
Universidade Federal do Ceará - UFC
____________________________________________________________ Dr Renato Luiz Maia Nogueira
Universidade Federal do Ceará - UFC
____________________________________________________________ Dr Sérgio Ferreira Juaçaba
3 À minha família, em especial, às mulheres da minha vida: minha avó Julina e minha mãe...
4 AGRADECIMENTOS
A Deus, pela sua presença, pelo seu amor que me conforta em todos os momentos, por me fazer forte quando eu não tive outra alternativa e por me capacitar permitindo que eu alcance etapas cada vez mais desafiadoras no caminho do crescimento profissional.
A minha família pelos exemplos de trabalho, bom humor e força representados por aqueles que foram diretamente responsáveis pela minha formação: meus tios e tias (Ananias, Paulinho, Eliane, Mary e Marlene). A meu pai pela serenidade e ouvidos dispostos a saber como foi o meu dia. A minha mãe pelo exemplo de dedicação, esforço e competência e por me oferecer um porto seguro diante de qualquer situação. A minha avó Julina pelo amor
“roxo”, pelas eternas demonstrações de carinho e pelos melhores cheiros e abraços. A professora Dra. Sílvia Helena Barem Rabenhorst, pela orientação, pela fé na nossa capacidade, pelo carinho e cuidado de mãe (“carões” e puxões de orelha também!) e pela
incansável busca de extrair o que nós temos de melhor.
Aos amigos do Laboratório, pelo apoio, ensinamentos, parcerias, “cafés da tarde” e convivência sempre agradável. Àqueles presentes no início que me guiaram pelos primeiros passos: Markênia, Denise e Patrícia. A Virllane, com quem convivi por pouco tempo, mas o suficiente para cativar-me. A Débora, Isabelle, Eliane, Isaac e Ana Paula pela cumplicidade, palavras incentivadoras, risos garantidos e abraços apertados.
Aos amigos mais ou menos próximos que fizeram e fazem parte da minha vida e contribuíram para o que eu sou hoje, ainda que distantes, a minha sincera gratidão.
A minha amiga de qualquer hora e qualquer lugar, Sâmia que me inspira e me incentiva a cada nova meta e que nunca deixou de me fazer sentir amada em cada dia de aniversário (sendo tentativa de festa surpresa ou estando apenas nós duas diante de um bolo sobre a mesa
ao som da cantoria de “parabéns pra você”), em cada réveillon (que não me foi permitido passar em casa dormindo), a cada surpresa diante de um postal enviado de algum lugar do mundo dizendo que lembrou de mim ou em tantas outras demonstrações de carinho.
Aos participantes da banca, pela presteza em aceitar o convite, pela cuidadosa leitura e pelas valiosas contribuições.
Ao programa de Pós Graduação em Microbiologia Médica representado pelos professores e demais funcionários pelo empenho na formação científica dos pós graduandos.
5 "Se as coisas são inatingíveis... ora! Não é motivo para não querê-las... Que tristes os caminhos, se não fora
A presença distante das estrelas!"
6 RESUMO
O câncer de mama representa a maior causa de mortalidade por câncer entre as mulheres em todo o mundo. Apesar de possuir bom prognóstico quando diagnosticado e tratado adequadamente, as taxas de mortalidade continuam elevadas no Brasil. A etiologia do câncer de mama é multifatorial e alguns fatores de risco são descritos, como: idade, história familiar e pessoal de câncer, fatores ligados a aspectos endócrinos, entre outros. Entretanto, em 50 a 80% dos casos, nenhum desses fatores é identificado, sugerindo a existência de outros. Estudos apontam a associação do câncer de mama com o Vírus Epstein-Barr (EBV), entretanto, os estudos são controversos. Assim, o presente estudo teve como objetivo verificar a presença de EBV, utilizando a técnica de Hibridação in situ, em 75 pacientes diagnosticadas com carcinoma mamário invasivo, provenientes do Ambulatório de Mastologia da Maternidade Escola Assis Chateaubriand. Para a classificação molecular, os marcadores RE,
8 ABSTRACT
Breast cancer is the leading cause of cancer death among women worldwide. Despite having good prognosis when diagnosed and treated properly, breast cancer mortality rates remain high in Brazil. The etiology of breast cancer is multifactorial and some risk factors are described, such as age, family and personal history of cancer, factors linked to endocrine aspects, among others. However, by 50 to 80% of cases none of these factors is identified, suggesting the existence of another one. Studies point to an association of breast cancer with the Epstein-Barr Virus (EBV), but the studies are controversial. Thus, this study aimed to verify the presence of EBV, using in situ hybridization in 75 patients diagnosed with invasive breast carcinoma, from the Mastology Clinic of the Maternity School Assis Chateaubriand. For molecular classification, ER, PR, HER2, Ki67, TP53, CK5/6 and CK8/18 markers were detected by immunohistochemistry. In this study, the median age of patients was 55 years, of
10 LISTA DE FIGURAS
Figura 01 - Estimativas para o ano de 2014 do número de casos novos de câncer de mama e distribuição proporcional entre os dez tipos de câncer mais incidentes estimados para 2014... 15 Figura 02 – Genoma do Vírus Epstein-Barr... 32
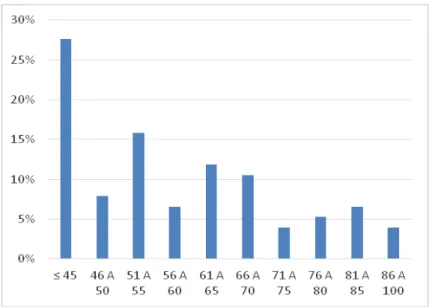
Figura complementar A - Percentual de casos de câncer de mama estudados
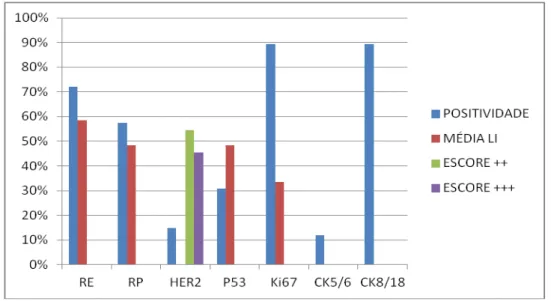
distribuídos segundo a faixa etária das pacientes (n=75)... 76 Figura complementar B - Frequência da expressão das proteínas celulares RE, RP,
11 LISTA DE TABELAS
Tabela 01 – Classificação histológica do carcinoma mamário invasivo... 16
Tabela 02 – Definição do TNM patológico... 22
Tabela 03 - Estadiamento TNM para câncer de mama... 26
Tabela 04 – Técnicas de detecção do EBV em amostras de tumores mamários... 28
Tabela 05 - Expressão de genes latentes do EBV quanto aos tipos de latência e tecido associado... 33
Tabela 06 - Regiões celulares de expressão dos alvos das técnicas empregadas e os respectivos clones dos anticorpos... 41
Tabela 07 - Critérios de positividade definidos para as proteínas detectadas por imunohistoquímica... 42
Tabela complementar A - Percentual de casos de carcinoma mamário estudados, distribuídos quanto à gestação e presença de fatores de risco (história prévia de câncer, história familiar, tabagismo e etilismo... 76
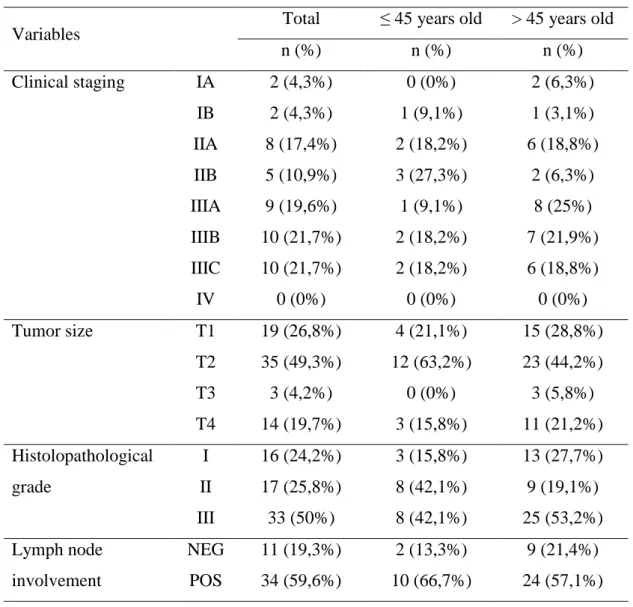
Tabela complementar B - Características imunohistoquímicas de carcinomas de mama em pacientes ≤ 45 anos e > 45 anos.... 77
12 SUMÁRIO
1. Introdução... 1.1. Câncer de mama...
1.1.1. Epidemiologia do câncer de mama... 1.1.2. Características histopatológicas do câncer de mama... 1.1.2.1. Classificação histológica... 1.1.2.2. Fatores prognósticos... 1.1.3. Etiologia do câncer de mama... 1.1.4. Os vírus e o câncer de mama... 1.2. Vírus Epstein-Barr (EBV)...
1.2.1. Histórico... 1.2.2. Características do vírus Epstein-Barr...
1.2.3. Técnicas de detecção do EBV... 1.2.4. EBV em tumores sólidos... 1.3. Justificativa do estudo... 1.4. Hipótese... 14 14 14 15 15 22 27 27 29 29 31 34 35 36 36 2. Objetivos...
2.1. Objetivo geral... 2.2. Objetivos específicos...
37 37 37 3. Material e métodos...
3.1. Casuística... 3.2. Aspectos éticos... 3.3. Instrumentos e procedimentos de coleta de dados... 3.4. Hibridação in situ... 3.5. Imunohistoquímica... 3.6. Critérios para análise das lâminas... 3.7. Análise estatística...
38 38 38 39 39 40 41 43 4. Referências bibliográficas... 44
Apêndices... Apêndice I - Low frequency of virus Epstein-Barr (EBV) in Breast Cancer in
patients from Ceara –Brazil………
58
13 Apêndice II - Molecular characterization of Breast Cancer in Brazilian Northeast
women... Apêndice III – Tabelas e figuras complementares... Apêndice IV - Parecer do Comitê de Ética em pesquisa da Maternidade Escola Assis Chateaubriand (MEAC)... Apêndice V - Ficha de coleta de dados socioepidemiológicos...
65 76
14 1. INTRODUÇÃO
1.1 Câncer de mama
1.1.1 Epidemiologia do câncer de mama
O câncer de mama (CM) representa a maior causa de mortalidade por câncer entre as mulheres em todo o mundo. Foram estimadas cerca de 520 mil mortes para o ano de 2012. É a segunda causa de morte por câncer nos países desenvolvidos (depois do câncer de pulmão) e a maior causa nos países em desenvolvimento. Nos últimos 40 anos, a sobrevida vem aumentando nos países desenvolvidos (85% em cinco anos), mas permanece com valores entre 50 a 60% nos países em desenvolvimento. Apesar de ser considerado de bom prognóstico quando diagnosticado e tratado adequadamente, as taxas de mortalidade por
câncer de mama continuam elevadas no Brasil, provavelmente devido ao fato de a doença ainda ser diagnosticada em estágios avançados (INCA, 2014).
No Brasil, o exame clínico das mamas anualmente a partir dos 40 anos e a mamografia bienal para mulheres entre 50 a 69 anos é a estratégia recomendada para a detecção precoce da doença em mulheres com risco padrão. Para aquelas que pertencem a grupos de risco elevado (com história familiar de câncer de mama em parentes de primeiro grau), recomenda-se o exame clínico da mama e a mamografia, anualmente, a partir de 35 anos (INCA, 2014).
Cerca de 1,67 milhões de casos novos desta neoplasia foram esperados para o ano de 2012 em todo o mundo, representando 25% de todos os tipos de câncer diagnosticados nas mulheres. Suas taxas de incidência variam entre as diferentes regiões do mundo, com as maiores taxas em 2012 na Europa Ocidental (96/100 mil) e as menores taxas na África Central e na Ásia Oriental (27/100 mil) (INCA, 2014).
15 Figura 01 - Estimativas para o ano de 2014 do número de casos novos de câncer de mama e distribuição proporcional entre os dez tipos de câncer mais incidentes estimados em 2014.
Fonte: Instituto Nacional de Câncer – INCA, 2014.
1.1.2 Características histopatológicas do câncer de mama
O curso clínico do câncer de mama e a sobrevida são elementos variáveis de paciente para paciente. Esta variação é determinada por uma série complexa de fatores, tais como a diferença na velocidade de duplicação do tumor, o seu potencial de metastatização e outros mecanismos ainda não completamente compreendidos, relacionados com a condição imunológica, hormonal e nutricional da paciente (Clark, 1996; Abreu e Koifman, 2002).
1.1.2.1 Classificação histológica
16 Tabela 01 - Classificação histológica do carcinoma mamário invasivo.
Classificação histológica do carcinoma mamário invasivo Carcinoma invasivo de tipo não especial
Carcinoma lobular invasivo
Carcinoma tubular Carcinoma cribiforme
Carcinoma com características medulares Carcinoma metaplásico
Carcinoma com diferenciação apócrina Carcinoma adenóide cístico
Carcinoma mucoepidermóide Carcinoma polimorfo
Carcinoma mucinoso e carcinoma com células em anel de sinete Carcinoma com características neuroendócrinas
Carcinoma papilífero invasivo Carcinoma micropapilífero invasor Carcinoma secretor
Carcinoma oncolítico Carcinoma sebáceo
Carcinoma rico em lipídeos
Carcinoma de células claras rico em glicogênio Carcinoma de células acinares
(Geyer e de Nigro, 2013).
Usualmente identificado como carcinoma ductal invasivo (CDI), o carcinoma mamário invasivo de tipo não especial corresponde a cerca de 70% dos casos, sendo definido
como uma neoplasia epitelial mamária invasiva que não preenche critério para nenhum tipo especial (Geyer e de Nigro, 2013). Alguns tumores exibem características peculiares que
17 (CLI) é o mais prevalente (aproximadamente 15%). Não é incomum uma mesma neoplasia apresentar áreas com diferentes morfologias, sendo consideradas neoplasias de padrão misto. Além da subjetividade dos critérios diagnósticos, ao aplicá-la, cerca de 85% dos casos acabam por pertencer às duas categorias principais de CDI ou CLI. Dentro da mesma categoria histológica, a avaliação imunohistoquímica para receptor de estrógeno (RE), receptor de progesterona (RP) e receptor de fator de crescimento epidérmico 2 (HER2) passam a ter um papel fundamental para aumentar o valor discriminatório entre os casos (Geyer e de Nigro, 2013).
O carcinoma invasivo do tipo não especial e o carcinoma lobular invasivo são as formas mais comuns de carcinomas de mama. Pacientes portadoras de carcinoma invasivo do tipo não especial apresentam normalmente um maior comprometimento de linfonodos e um pior prognóstico que aquele verificado nos pacientes com tipos menos frequentes de carcinoma invasivo de mama (Reinfuss et al. 1995; Diab et al., 1999). Embora nos primeiros
cinco anos, pacientes com carcinoma invasivo do tipo não especial apresentem maior taxa de recorrência em relação a pacientes com carcinoma lobular invasivo, as curvas de sobrevida tendem a se igualar aos dez anos de seguimento (Geyer e de Nigro, 2013).
Os tumores malignos de mama do tipo carcinoma tubular estão entre aqueles que apresentam o melhor prognóstico. O carcinoma tubular apresenta excelente prognóstico, mesmo nas pacientes com comprometimento de linfonodos, estando a sobrevida muito próxima daquela verificada na população geral (Abreu e Koifman, 2002).
É na correta identificação dos tipos histológicos especiais, os quais refletem características biológicas e clínicas bastante homogêneas, que reside a maior importância da tipagem histológica (Ellis et al., 2003; Viale, 2012).
Alguns marcadores têm sido considerado clássicos para o estabelecimento do prognóstico dos tumores mamários por imunohistoquímica, como os receptores de estrógeno e progesterona (RE e RP) e o receptor de fator de crescimento epidérmico 2 (HER2).
18 de expressão de RE e resposta à terapia endócrina (Viale et al., 2007). O Early Breast Câncer Trialists’ Collaborative Group relatou que os níveis mais elevados de RE foram associados a um menor risco de recorrência quando receberam tamoxifeno adjuvante (Buitrago et al., 2011).
A expressão do Receptor de Progesterona (RP) é dependente da presença de RE. Tumores que expressam RP, mas não o RE, são incomuns e representam 1% dos casos de câncer de mama. Por isso, tumores com expressão de RP e falta de expressão de RE devem passar por um novo teste para confirmar os resultados para o RE e eliminar a possibilidade de falso negativo. Nesses casos de expressão apenas de RP, foram descritos benefícios limitados com uso de tamoxifeno, por isto a terapia endócrina é ainda amplamente recomendada. Há evidências de que no câncer de mama metastático a resposta ao tratamento antiestrogênio é melhor entre pacientes com tumores que expressam tanto RE como RP versus aqueles que apenas mostram positividade para RE, mas falta a expressão de RP (Buitrago et al., 2011).
O receptor do fator de crescimento epidérmico humano 2 (HER2) pertence à família dos receptores de crescimento. A sua expressão tem sido associada a maior agressividade biológica do tumor e à resistência a alguns tipos de tratamento (Ferrero et al., 2000). O HER2 codifica uma proteína de membrana das células tumorais que faz com que estas se desenvolvam mais rápido e aumentem a sua duplicação, tornando os tumores mais agressivos (Slamon et al., 1987; Di Fiore et al., 1987). Diversos estudos têm sugerido que existe uma relação entre o estado HER2 e a resistência hormonal (Benz et al., 1992; Fernandez et al., 1997). A presença do HER2 está associado a maior risco de recidiva tumoral (Press et al., 1997) e desempenha um papel fundamental na carcinogênese (Slamon et al., 1987; Di Fiore et al., 1987). O HER2 é amplificado em 15% a 25% dos casos de câncer de mama humano (Konecny et al., 2003). Amplificação do HER2 ou superexpressão são reconhecidas como importantes marcadores de doença agressiva e são os alvos moleculares para terapias específicas, como trastuzumab e lapatinib (Piccart-Gebhart et al., 2005).
Outros marcadores têm sido vistos como emergentes para contribuir com o conhecimento sobre o prognóstico dos tumores mamários, como o Ki67.
19 andrógenos (Rakha et al., 2007), receptor de crescimento epitelial EGFR (HER-1) (Hoadley et al, 2007; Cheang et al, 2008) e Ciclina D1 (Reis-Filho et al, 2006).
O gene TP53 é um gene regulador chave do ciclo celular, que quando sofre mutações leva ao desenvolvimento de neoplasias, atuando como gene supressor tumoral em condições normais (Hollstein et al., 1991). É um dos genes responsáveis pela integridade do genoma, ativado pelo surgimento de DNA alterado. Sua ativação produz uma proteína que estimula a síntese de outras proteínas que inibem a replicação celular e estimulam as enzimas de reparo do DNA. Caso o reparo no DNA seja completo, o TP53 é inativado e a célula retorna ao estado normal. Caso o reparo não ocorra, a célula permanece impedida de se replicar e é induzida a apoptose (Lopes et al., 2002).
Ki67 é uma proteína nuclear que não é expressa nas células em repouso (G0), mas pode ser detectada nas outras fases G1 a M do ciclo celular. Sua utilização como um marcador de proliferação celular mostrou que o percentual de células positivas para Ki67 pode ser
usado para estratificar pacientes de bom prognóstico ou grupos de mal prognóstico (Buitrago et al., 2011). O Ki67 pode ser considerado como um fator de proliferação facilmente avaliado e reprodutível e pode ser uma alternativa ou complemento ao grau histológico como uma ferramenta de prognóstico e para a seleção de tratamento adjuvante. Foi demonstrado o valor prognóstico de Ki67 em pacientes com câncer de mama e linfonodos negativos, mas também revela que o impacto prognóstico é restrito a tumores RE positivos e grau histológico 2. Embora existam outros marcadores de proliferação celular, o Ki67 tem preço mais acessível, é facilmente avaliado e reprodutível (Marie et al., 2010).
As citoqueratinas humanas (CKs) são uma família de proteínas codificadas por diferentes genes que são expressos em vários tipos de células e estão relacionadas à regulação do desenvolvimento e diferenciação celular. Existe uma relação entre o peso molecular da citoqueratina e o tipo de epitélio onde está expressa. Assim, as de baixo peso molecular estão em epitélios simples e as de alto peso molecular em epitélios estratificados (Ribeiro-Silva et al., 2005).
20 de tumores, muitos destes vêm sendo estudados isoladamente ou em pequenos grupos quanto ao seu papel na carcinogênese, assim como a sua implicação como fatores prognósticos.
Com os avanços na área de biologia molecular foi possível identificar perfis genômicos importantes para a classificação clínica e biológica dos tumores de mama (Pollack et al., 2002; Sorlie et al., 2003; Buitrago et al., 2011). As associações da caracterização fenotípica com o perfil obtido pelas análises de microarray revelaram distintos subtipos que foram associados com sobrevida. Dentro deste contexto, cinco grandes grupos de carcinomas de mama invasivos foram identificados: luminal A, luminal B, HER2+, basal símile, e normal símile (Yersal e Barutca, 2014).
Aproximadamente 75% dos carcinomas mamários são positivos para RE e/ou RP. Os tumores RE positivos expressam RE, RP e outros genes que codificam proteínas de células epiteliais luminais, então, eles são caracterizados como subtipo luminal. Foram identificadas duas subclasses dentro desse grupo: luminal A e luminal B (Yersal e Barutca, 2014).
O subtipo luminal A é o subtipo mais comum e representa 50 a 60% de todos os carcinomas mamários. Esses tumores normalmente têm baixo grau histológico, pouco pleomorfismo nuclear e baixa atividade mitótica, representando tumores de bom prognóstico. O grupo é caracterizado pelos elevados níveis de expressão de RE e baixos níveis de expressão de genes relacionados à proliferação celular. É caracterizado pela expressão de citoqueratinas epiteliais luminais (CK8/18) e outros marcadores luminais associados. O subtipo luminal A é definido então, como tumores RE e/ou RP positivos, HER2 negativos e com baixos níveis de
expressão de Ki67 (≤ 14%) (Carey et al., 2006; Guarneri et al., 2009; Carey et al., 2010; Kennecke et al., 2010; Yersal e Barutca, 2014).
21 O receptor de fator de crescimento epidérmico 2 é um membro da família de quatro tirosinas quinases de membrana. Os tumores HER2 positivos representam 15 a 20% dos tumores mamários. A positividade para o HER2 representa comportamento clínico e biológico mais agressivo. Esses tumores são caracterizados pela alta expressão do gene HER2. Morfologicamente, esses tumores são altamente proliferativos, 75% tem altos graus histológico e nuclear e mais de 40% tem mutação no gene TP53. Aproximadamente metade dos tumores HER2 positivos é também positivo para o RE, mas eles geralmente expressam esse marcador em baixos níveis (Tsutsui et al., 2003; Gutierrez et al., 2011; Yersal e Barutca, 2014).
O subtipo basal símile representa de 8 a 37% de todos os carcinomas mamários. São associados com altos graus histológico e nuclear, pouca formação de túbulos e presença de zonas centrais necróticas ou fibróticas, bem como elevados níveis mitóticos e índices proliferativos. Boa parte desses tumores são invasivos, com comportamento clínico agressivo e com elevadas taxas de metástase para o cérebro e para os pulmões. Os tumores que fazem parte desse grupo
expressam elevados níveis de marcadores epiteliais basais, como CK5, CK14, CK17 e laminina e não expressam RE, RP e HER2, sendo referidos portanto, como triplo negativos. Esses tumores frequentemente apresentam mutações no gene TP53, evidências de instabilidade genômica e inativação de retinoblastoma (Rb) (Yersal e Barutca, 2014).
É importante ressaltar que os termos “triplo negativo” e ”basal símile” não são
completamente sinônimos. O termo triplo negativo refere-se a tumores mamários que não expressam RE, RP e HER2 utilizando-se da imunohistoquímica para detecção. Esse fenótipo triplo negativo, atualmente, é um subtipo confiável na prática clínica (Kreike et al., 2007).
Microarray e análises imunohistoquímicas demonstram que o subtipo basal símile constitui aproximadamente 75% dos cânceres de mama relacionados ao BRCA1. Esses cânceres frequentemente expressam fenótipo triplo negativo e são frequentemente positivos para Ki67, citoqueratinas basais, TP53, EGFR e E-caderina (Kreike et al., 2007; Rakha et al., 2009; Ignatiadis et al., 2009; Yersal e Barutca, 2014).
22 As implicações da classificação molecular na terapêutica do câncer de mama têm sido aceitas por vários painéis internacionais. Em 2011 e, mais recentemente, em 2013, especialistas concordaram que as decisões terapêuticas devem ser feitas com base no reconhecimento dos subtipos moleculares (Goldhirsch et al., 2013).
1.1.2.2. Fatores prognósticos
Fatores prognósticos são parâmetros possíveis de serem mensurados no momento do diagnóstico e que servem como preditores da sobrevida do paciente (tabela 02) (INCA, 2014). Certos aspectos anatômicos, como o tamanho do tumor primário e as condições dos linfonodos, são fatores importantes na avaliação prognóstica (Andreopoulou et al., 2008; Jemal et al., 2009; Buitrago et al., 2011), assim como características histológicas e biológicas, como grau nuclear, grau histológico, dosagem de receptores hormonais e outros fatores
avaliados por imunohistoquíca são também determinantes para o prognóstico da evolução da doença (Buitrago et al., 2011).
Tabela 02 – Definição do TNM patológico.
pT - Tumor primário
Ptx Não avaliável
pT0 Nenhuma evidência do tumor primário pTis Carcinoma in situ
Tis CDIS (Carcinoma ductal in situ) Tis CLIS (Carcinoma lobular in situ)
Tis Paget (Doença de Paget do mamilo sem carcinoma invasivo ou in situ na mama)
pT1 Tumor ≤ 2 cm
pT1mi Microinvasão (foco ou focos ≤ 0,1 cm) pT1a > 0,1 cm e ≤ 0,5 cm
pT1b > 0,5 cm e ≤ 1 cm pT1c >1 cm e ≤ 2 cm
pT2 Tumor > 2cm e ≤ 5 cm pT3 Tumor > 5 cm
23 Continuação
Continua pT4 Tumor de qualquer tamanho com invasão da parede torácica e/ou pele (com
ulceração ou nódulos)
pT4a Extensão da parede torácica (invasão de costelas, músculos intercostais e músculo serrátil anterior); a invasão de músculo peitoral isoladamente não está incluída
pT4b Edema (incluindo peau d’orange), ulceração ou nódulos-satélite ipsilaterais na pele da mama
pT4c Presença de ambos pT4a e pT4b pT4d Carcinoma inflamatório
pN – Linfonodos regionais (requer excisão com avaliação histológica de pelo menos o nível I axilar (6 ou mais linfonodos)
pNX Linfonodos regionais não avaliados
pN0 Ausência de metástases ao exame histológico de rotina
pN0 (i+) Presença de células tumorais isoladas (CTI), detectadas por HE ou por exame imunohistoquímico (menor ou igual a 0,2 mm ou até 200 células em uma única secção histológica completa do linfonodo)
pN0 (i-) Pesquisa imunohistoquímica negativa para células neoplásicas isoladas pN0 (mol+) Pesquisa molecular (geralmente RT-PCR) para células tumorais positivas, mas
sem nenhuma célula detectada nos cortes corados pelo HE ou imunohistoquímica
pN0 (mol-) Pesquisa molecular para células neoplásicas isoladas negativa pN1 Metástase em 1 a 3 linfonodos axilares ipsilaterais e/ou linfonodos da cadeia
mamária interna pela biópsia do linfonodo-sentinela, mas não detectável clinicamente
pN1mi Micrometástase (> 0,2 mm e/ou mais de 200 células, porém ≤ 2 mm)
pN1a Metástases em 1 a 3 linfonodos axilares, incluindo pelo menos um foco > 0,2 mm pN1b Linfonodo da cadeia mamária interna com micrometástase ou macrometástase
detectada pelo linfonodo-sentinela, mas não detectável clinicamente
24 Continuação pN2 Metástases em 4 a 9 linfonodos ou em linfonodo da cadeia mamária interna
clinicamente aparente, na ausência de metástase axilar
pN2a Metástases em 4 a 9 linfonodos axilares, pelo menos uma metástase > 2 mm
pN2b Metástases em linfonodos da cadeia mamária interna detectadas clinicamente, na ausência de comprometimento axilar
pN3 Metástases em 10 ou mais linfonodos axilares ou em linfonodos infraclaviculares (nível III) ou em linfonodos da cadeia mamária interna ipsilateral clinicamente aparentes, na presença de 1 ou mais linfonodos axilares positivos; ou em mais de 3 linfonodos axilares com metástase microscópica (macrometástase ou micrometástase) nos linfonodos da cadeia mamária interna ipsilateral, clinicamente inaparente; ou em linfonodo supraclavicular ipsilateral
pN3a Metástases em 10 ou mais linfonodos axilares, pelo menos uma metástase > 2 mm ou metástase em linfonodo infraclavicular (nível III)
pN3b Metástases em linfonodos da cadeia mamária interna ipsilateral detectadas clinicamente na presença de um ou mais linfonodos axilares positivos; ou metástases em mais de 3 linfonodos axilares associados com doença microscópica (macrometástase ou micrometástase) em linfonodo sentinela da cadeia mamária interna, mas não clinicamente aparente
pN3c Metástases em linfonodo(s) supraclavicular(es) ipsilateral (is)
pM – Metástases à distância
pMX Não avaliadas
pM0 Ausência de metástases à distância pM1 Metástase à distância
Retirado de Manual de padronização de laudos histopatológicos (Bacchi, et. al., 2013).
Um mesmo marcador poderá ser considerado como preditivo, quando fornecer
25 O tamanho do tumor e o estado de linfonodos são os fatores mais importantes, tanto que constituem a base do estadiamento TNM estabelecido e promulgado pela União Internacional Contra o Câncer (Carter et al., 1989; Abreu e Koifman, 2002). O tamanho do tumor está diretamente relacionado ao risco de recidiva, sendo que, nos casos de pacientes com ausência de comprometimento metastático dos linfonodos, o tamanho do tumor torna-se o melhor preditor desta recidiva (Abreu e Koifman, 2002). Sabe-se que pacientes com tumores menores de 1,0 cm têm entre 10% a 20% de possibilidade de comprometimento linfonodal e que pacientes com tumores menores de 1,0 cm com linfonodos negativos têm uma sobrevida livre de doença em 10 anos de cerca de 90% (Rosen et al., 1993; Leitner et al., 1995; Buitrago et al., 2011). O estado dos linfonodos é importante no câncer de mama como indicador de sobrevida livre da doença (Cady et al., 1997; Leitner et al., 1995; Buitrago et al., 2011). Cerca de 20% a 30% dos pacientes com linfonodos negativos irá desenvolver recidiva no prazo de 10 anos, em comparação com cerca de 70% dos pacientes com comprometimento
de linfonodos axilares (Fisher et al., 1993; Veronesi et al., 1993; Buitrago et al., 2011).
O estadiamento tumoral pode ser clínico e patológico. O primeiro é realizado com base na extensão do tumor, que é estabelecida através de exame físico auxiliado por exames radiológicos, macroscópicos e histológicos. O patológico deve ser efetuado pela avaliação macro e microscópica do espécime clínico proveniente de ressecção cirúrgica, visando analisar a extensão da invasão do tumor no tecido, possível acometimento de estruturas adjacentes, presença de linfonodos comprometidos e a presença de metástase a distância,
26 Tabela 03 – Estadiamento TNM para câncer de mama.
Estadiamento Combinações TNM
0 Tis N0 M0
IA T1 N0 M0
IB T0, T1 N1 mi M0
IIA T0, T1 N1 M0
T2 N0 M0
IIB T2 N1 M0
T3 N0 M0
IIIA T0, T1, T2 N2 M0
T3 N1, N2 M0
IIIB T4 N0, N1, N2 M0
IIIC Qualquer T N3 M0
IV Qualquer T Qualquer N M1
Retirado de Manual de padronização de laudos histopatológicos (Bacchi et. al., 2013).
27 1.1.3 Etiologia do câncer de mama
A exemplo de outros tipos, a etiologia do câncer de mama é multifatorial e alguns fatores de risco são descritos, como: idade, história familiar, história pessoal de câncer, entre outros (Leon et al.; 2009). De acordo com o INCA, 2014, ainda acrescentam-se fatores ligados a aspectos endócrinos e genéticos, relacionados à vida reprodutiva da mulher, etilismo, exposição a radiações ionizantes em idade inferior a 40 anos, obesidade, sedentarismo e alta densidade do tecido mamário.
Segundo o INCA (2014), a idade é um dos mais importantes fatores de risco. As taxas de incidência aumentam rapidamente até os 50 anos e após essa idade, esse aumento ocorre mais lentamente, reforçando a participação dos hormônios femininos na etiologia da doença (80% dos casos ocorrem após os 50 anos). A história familiar de câncer de mama está associada a um aumento no risco relativo de cerca de duas a três vezes para o
desenvolvimento da neoplasia. Alterações genéticas (em BRCA1 e BRCA2) aumentam o risco de desenvolver a doença, embora essas mutações sejam raras e contribuam para uma pequena parcela de casos de câncer de mama (90% dos casos ocorrem em mulheres sem história familiar). Amamentação, prática de atividade física e alimentação saudável estão associadas a um menor risco de desenvolver o câncer de mama (cerca de 30% dos casos podem ser evitados por medidas deste tipo).
Entretanto, em 50 a 80% dos casos, não se identifica nenhum desses fatores de risco, o que sugere a existência de outros fatores envolvidos (Leon et al.; 2009). Dentro deste contexto, alguns estudos sugerem a associação de infecções virais no desenvolvimento do câncer de mama. Para ser considerado um vírus oncogênico no tecido mamário, o vírus deve estar presente em amostras de câncer de mama e em alguns tecidos normais e pré-cancerosos (Leon et al.; 2009).
1.1.4 Os vírus e o câncer de mama
28 esta relação ainda não está bem esclarecida (Huo et al., 2012 e Leon et al.,2009). Os estudos relativos à presença de EBV e HPV em amostras de câncer de mama apresentam resultados controversos.
O EBV foi o primeiro vírus humano a ser diretamente implicado na carcinogênese. Apesar de infectar mais de 90% da população do mundo, a maioria dos seres humanos coexiste com o vírus sem sequelas graves e apenas uma pequena proporção irá desenvolver tumores tais como Linfoma de Burkitt, câncer de nasofaringe, Linfoma de Hodgkin e cânceres associados com imunodeficiência (Thompson et al., 2004; Lima et al., 2006). Estudos de associação deste herpesvírus com o câncer de mama são inconsistentes, pois as frequências encontradas para este vírus são divergentes (de 0% a 100% dos tumores) (Gristein et al.,2002; Glaser et al.,2004; Thompson et al., 2004; Kalkan et al., 2005; Preciado et al.,2005; Murray et al., 2006; De Paoli et al.,2007; Fawzy et al., 2008; He et al., 2009; Lorenzetti et al., 2010; Hachana et al., 2011; Kadivar et al.,2011; Khan et al.,2011; Mazouni
et al., 2011; Baltzell et al.,2012; Huo et al., 2012).
Uma justificativa para as diferentes frequências observadas para o EBV nos tumores mamários são as diferentes técnicas utilizadas para a detecção do vírus, como demonstrado na tabela 04.
Tabela 04 – Técnicas de detecção do EBV em amostras de tumores mamários.
Frequência Local Técnica Autore(s)
0% Califórnia Hibridação Glaser et al., 1998
0% Itália Hibridação e Imunohistoquímica Dadmanesh et al., 2001
0% Estados Unidos Hibridação e Imunohistoquímica Deshpande et al., 2002
0% Tunísia Hibridação e Imunohistoquímica Trabelsi et al., 2008
0% Estados Unidos PCR Perrigoue et al., 2005
31% Argentina Hibridação Lorenzetti et al., 2010
31,8% PCR e Hibridação Fina et al., 2001
47,5% Emirados Hibridação e Imunohistoquímica Khan et al. 2011
51% França PCR e Imunohistoquímica Bonnet et al., 1999
68% Austrália PCR e Imunohistoquímica Glenn et al., 2012
29 Outra das explicações para as diferentes frequências encontradas seria que diferentes populações podem ter diferentes susceptibilidades aos EBVs, predispondo o desenvolvimento de tumores, como demonstrado por variações geográficas e imunológicas na prevalência destes cânceres (Thompson et al.; 2004). Kadivar e colaboradores (2011) não detectaram o vírus EBV em nenhum dos casos estudados em pacientes iranianas com CM. Em contrapartida, Fawzy e colaboradores (2008) encontraram frequência de 25% para o EBV nas amostras de tecido de tumor mamário em pacientes egípcias. Hachana e colaboradores (2011) documentaram a prevalência de 27% do vírus em amostras de pacientes tunisianas, já Lorenzetti e colaboradores (2010) e Preciado e colaboradores (2005) documentaram frequências de 31% e 35% do EBV, respectivamente, em pacientes argentinas.
É possível que as variações de prevalência do EBV nas amostras de câncer de mama sejam consequência de uma dificuldade de detecção dos vírus nesse tipo de tecido, diferente da facilidade de detecção dos mesmos em outros tipos de cânceres (Heng et al.,2009).
1.2 Vírus Epstein-Barr (EBV)
1.2.1 Histórico
Apenas a partir do início do século XX, a participação dos vírus no desenvolvimento de neoplasias começou a ser aceita, pois alguns pesquisadores começaram a sugerir a possibilidade de agentes virais estarem envolvidos no surgimento de tumores. Gerou-se certa polêmica, pois isto implicava na possibilidade de transmissão do agente causador da doença (Epstein, 2001). Em um dos primeiros e mais significativos estudos, Ellermann e Bang (1908) estudando leucemia de galinhas, perceberam que podiam induzir o desenvolvimento da doença em animais sadios através da inoculação de um filtrado cell-free obtido de células tumorais. Seus achados não foram vistos com muito interesse na época, mas nos anos seguintes, diversos autores realizaram pesquisas sob a participação de vírus em neoplasias de vários animais. Por volta da década de 1950, novos estudos confirmaram os achados prévios, derrubando um dogma ao confirmar que os vírus exerciam papel no desenvolvimento de neoplasias (Epstein, 2001).
30 observar a presença de partículas virais, semelhantes aos membros da família Herpesvirus, sendo posteriormente chamado de Vírus Epstein-Barr (EBV) em homenagem aos seus descobridores. Pouco tempo após a demonstração da associação do EBV com o linfoma de Burkitt, vários laboratórios conduziram estudos com o referido vírus. Em 1967, no laboratório de Werner e Brigitte Henle na Filadélfia – EUA, durante análises de soros de pacientes para rastreamento de anticorpos contra o EBV, constatou que após o desenvolvimento de mononucleose infecciosa (MI), seu soro antes usado como controle negativo, havia se tornado positivo para anticorpos contra o EBV (Epstein, 2001). Com base nesse evento, Henle et al. (1968) desenvolveram um estudo utilizando o banco de soros da Universidade de Yale e logo verificaram que todos os pacientes com história de mononucleose infecciosa apresentavam elevados títulos de anticorpos contra o vírus, sugerindo assim, uma relação causal entre o EBV com a referida afecção. Essa relação foi confirmada pelo estudo de Evans et al. (1968). Adicionalmente, todos os pacientes com linfoma de Burkitt estudados por Henle et al. (1968),
também apresentaram elevados títulos de anticorpos.
Em 1966, MacMahon já sugeria que a Doença de Hodgkin (DH) deveria ser causada por algum agente infeccioso. Contudo, foram Levine e colaboradores (1971) que relataram as primeiras evidências do envolvimento do EBV no desenvolvimento da DH ao constatar elevados títulos de anticorpos contra antígenos do EBV em pacientes com esse tipo de linfoma.
Em 1973, Reedman e Klein demonstraram em células infectadas pelo EBV, o antígeno nuclear do EBV (EBNA), sendo esta, a primeira proteína do EBV associada com o desenvolvimento de neoplasias. Logo, alguns estudos relataram a presença do EBNA em desordens linfoproliferativas em pacientes imunossuprimidos. Durante a década de 1980, com o surgimento de novas terapias imunossupressoras destinadas a pacientes transplantados e o aumento dos casos da Síndrome da Imunodeficiência Adquirida (AIDS), os casos de doenças linfoproliferativas associadas ao EBV também aumentaram (Okano, 2000).
Os avanços das técnicas imunológicas e moleculares de detecção viral têm possibilitado compreender melhor o papel do EBV em diversas doenças associadas, assim como verificar novas associações.
31 1.2.2 Características do vírus Epstein-Barr
O Vírus Epstein-Barr é um membro da subfamília gama-Herpervírus (Kieff, 2001). Mede aproximadamente 150 nm de diâmetro, apresenta um cerne constituído de DNA linear de fita dupla com cerca de 172 Kpb, envolto por um capsídeo icosadeltaédrico formado por 162 capsômeros e revestido por um envoltório glicoprotéico (Hsieh et al., 1999). Existem dois subtipos virais chamados: tipo 1 e tipo 2, que diferem um do outro em apenas poucos genes (Kieff, 2001).
O Genoma do EBV foi delimitado em regiões estabelecidas com base na posição dos fragmentos no mapa de restrição da endonuclease BamHI (Bacillus amyloliquefaciens H), nomeados em ordem alfabética de acordo com o tamanho, sendo o fragmento BamHI A o maior entre eles (Arrand et al., 1981). Foi verificado que o genoma viral apresenta regiões de
repetição cuja função não é bem esclarecida. Ambas as extremidades da forma linear do genoma apresentam uma sequência de repetição de 500 pb cada, denominada repetição terminal. O EBV apresenta também, quatro sequências de repetição interna (IR 1-4), de 3 Kpb cada. Demonstrou-se que na região BamHI C do genoma viral está localizada uma sequência denominada OriP (Origem da Replicação Plasmidial) (Kieff, 2001). Essa região contém dois elementos chamados de FR (Family of Repeats), que inclui 20 repetições em 30 pb em sequência; e DS (Dyad Symmetry), constituído de quatro repetições (Ambinder et al., 1991).
32 Figura 02 – Genoma do Vírus Epstein-Barr.
Fonte: Young e Murray, 2003.
No estado epissomal o vírus é descrito como latente, sendo replicado apenas durante a mitose da célula hospedeira. Apesar de seu genoma poder codificar cerca de 100 genes,
33 Da observação de que os genes latentes virais não são expressos concomitantemente nas diversas células de tecidos ou linhagens tumorais EBV positivas, foi proposta a existência de quatro tipos de latência com padrões distintos de expressão, descritos na tabela 05.
Tabela 05: Expressão de genes latentes do EBV quanto aos tipos de latência e tecido associado.
TIPO DE
LATÊNCIA TECIDO ASSOCIADO
GENES EXPRESSOS PELO EBV
EBNA-1 -2 -3A -3B -3C LP LMP1 LMP2A LMP2B EBERs BARF0 BARF1
I Linfoma de Burkitt + - - - + + -
Carcinoma gástrico + - - - +/- - + + +
II Carcinoma de
nasofaringe + - - - + + + + + +
DH; Linfoma de células
T + - - - + + + + + -
III DLPT; Linfoma-AIDS* + + + + + + + + + + + -
IV Linf. B circulantes** +/- - - + - +
Outros Hepatocarcinoma + - - - +
Câncer de mama + - +/-
Leiomiossarcoma*** + - +
CCEO - + + +
*Linfoma não-Hodgkin associado a AIDS
**Linfócitos B circulantes de indivíduos sadios portadores ***Leiomiossarcoma em indivíduos imunocomprometidos DH, Doença de Hodgkin
DLPT, Doença linfoproliferativa pós-transplante
CCEO, Carcinoma de célula escamosa oral
(Lima, 2006)
34 uma célula infectada por 1.000.000 de linfócitos B circulantes (Ohga et al., 2002). Também é possível verificar uma mudança no padrão de expressão de proteínas latentes, assumindo o padrão de latência tipo IV, caracterizado por uma mínima expressão de genes latentes, o que possivelmente contribui para o escape do sistema imune (Hsieh et al., 1999).
Durante o ciclo lítico, as primeiras proteínas a serem observadas, denominadas proteínas precoces imediatas, são codificadas pelos genes BZLF1 (ZEBRA) e BRLF1 (Gulley, 2001). A proteína codificada pelo BZLF1 pode regular negativamente o promotor Cp e, consequentemente, a expressão de EBNAs, favorecendo a transição do estado latente para o lítico. Os produtos dos dois referidos genes regulam a expressão dos genes precoces BHLF1 e BSMLF1, que estão associados à transativação de outros genes precoces. A maioria dos outros genes precoces está relacionada com a replicação do DNA, incluindo a DNA polimerase viral (BALF5), uma proteína de ligação ao DNA (BALF2), timidina quinase (BXLF1), uma exonuclease alcalina (BGLF5) e ribonucleotídeo redutase (BORF2 e BaRF1)
(Ambinder e Mann, 1994; Kieff, 2001). Posteriormente, verifica-se a expressão de genes tardios, que consistem principalmente de proteínas estruturais do vírus ou proteínas envolvidas na penetração celular e formação do envelope (Kieff, 2001).
O EBV usa suas proteínas virais, ações que imitam diversos fatores de crescimento, fatores de transcrição e fatores antiapoptóticos para usurpar o controle das vias celulares que regulam diversas funções celulares homeostáticas (Thompson et al., 2004).
Atualmente, de acordo com a International Agency from Research on Cancer, o EBV é classificado como um agente carcinógeno do grupo I (IARC, 1997). Contudo, os mecanismos oncogênicos empregados pelo EBV ainda não estão totalmente elucidados. Tem sido sugerido que os efeitos tumorigênicos estejam relacionados com a expressão de seus genes latentes que, por sua vez, podem atuar sobre mecanismos de proliferação e morte celular.
1.2.3 Técnicas de detecção do EBV
35 in situ (HIS), utilizando sondas complementares tanto à sequencia do genoma viral, quanto a segmentos de RNAm viral, imunohistoquímica, imunofluorescência, Western blotting e Southern blot (Tsuchiya, 2002; Ambinder e Mann, 1994; Sugawara et al., 1999).
É importante ressaltar que a hibridação in situ utilizando sondas específicas para os
EBERs é considerada “padrão ouro” na detecção do vírus, pois o alvo da técnica é expresso
em elevada quantidade e em diversos tecidos. Além disso, permite ao investigador identificar quais células abrigam o EBV no contexto histopatológico ou citopatológico. O que não é possível utilizando outras técnicas tais como PCR ou RT-PCR, que segundo Gulley (2001), podem amplificar sequências nucleotídicas oriundas de outras células, tais como linfócitos infectados infiltrados no tecido.
1.2.4 EBV em tumores sólidos
Os relatos da presença do vírus em neoplasias sólidas tem se tornado cada vez mais frequentes. O carcinoma de nasofaringe foi a primeira neoplasia de origem epitelial a ser associada ao EBV (Wolf et al., 1973) e, desde então, tem sido vastamente estudado no mundo. O vírus também tem sido descrito em carcinoma linfoepitelial pulmonar, leiomiossarcomas em pacientes imunossuprimidos, câncer testicular, câncer prostático, carcinomas de glândula salivar, de glândula lacrimal, intracervical, gástrico, hepatocelular e de mama, embora este último permaneça controverso (Thompson et al., 2004; Lima e Rabenhorst, 2006).
36 1.3 Justificativa do estudo
Relatórios de serviço mostram que a grande maioria das pacientes do ambulatório de Mastologia da Maternidade Escola Assis Chateaubriand (Fortaleza, Ceará) possui câncer de mama avançado. Observa-se também a presença da doença em um número significante de mulheres jovens.
Dados sobre a prevalência do EBV e sobre o perfil molecular das mulheres com câncer de mama invasivo, levando em consideração os fatores prognósticos estabelecidos, idade, outros marcadores moleculares, sobrevida e resposta terapêutica são de grande valia para a caracterização das pacientes com câncer de mama do estado do Ceará. Esta contribuição é importante para uma melhor compreensão da doença no meio cearense e soma dados aos estudos nacionais e mundiais sobre a frequência do EBV e sobre os subtipos moleculares desta neoplasia.
A importância dessa classificação molecular dos tumores mamários deve-se ao seu potencial na identificação de um prognóstico mais preciso e no estabelecimento de intervenções terapêuticas adequadas. Outro aspecto relevante é o fato de que quatro dos marcadores propostos (RE, RP, HER2 e Ki67) já são requeridos para a rotina diagnóstica financiada pelo SUS para a indicação de terapia específica. Desta forma, acredita-se que a adição de marcadores complementares de alto valor prognóstico não terá grandes dificuldades de implantação.
1.4 Hipótese
37 2. OBJETIVOS
2.1 Objetivo geral
Verificar a presença do Vírus Epstein-Barr (EBV) em cânceres de mama de pacientes do serviço de Mastologia da Maternidade Escola Assis Chateaubriand no estado do Ceará, no
período de 2009 a 2010, através da técnica de Hibridação in situ correlacionando com a presença das proteínas celulares RE, RP, HER2, Ki67, TP53, CK5/6 e CK8/18.
2.2 Objetivos específicos
Detectar a presença do vírus EBV em pacientes com câncer de mama utilizando a técnica de Hibridação in situ;
Caracterizar os padrões histopatológicos dos tumores;
Verificar a expressão das proteínas celulares RE, RP, HER2, Ki67, TP53, CK5/6 e CK8/18 demonstradas através da técnica de imunohistoquímica, correlacionando com os dados clínicos e histológicos;
38 3. MATERIAL E MÉTODOS
3.1 Casuística
Foram obtidos tumores mamários provenientes de 75 pacientes submetidas à mastectomia radical, quadrantectomia, biópsia ou excérese de nódulos mamários provenientes do Ambulatório de Mastologia da Maternidade Escola Assis Chateaubriand (MEAC) localizada em Fortaleza, Ceará registrados no arquivo do Laboratório de Patologia do Departamento de Patologia da Universidade Federal do Ceará (UFC).
De todos os casos, foram obtidos espécimes clínicos previamente fixados em formalina e subsequentemente incluídos em blocos de parafina oriundos do serviço de Patologia da UFC.
Foram admitidos como critérios de inclusão: (1) diagnóstico de carcinoma mamário
invasivo, (2) existência de mais de um bloco contendo amostra tumoral, (3) representatividade de células tumorais no bloco de escolha, (4) bom estado de conservação do material (5) disponibilidade de prontuários contendo informações relevantes ao estudo. O Ambulatório de Mastologia da MEAC atende a cerca de 150 pacientes com câncer de mama anualmente, mas durante a coleta das amostras para este estudo, nos deparamos com certos desafios como a dificuldade de acesso à informação nos prontuários e aos blocos de parafina.
Foram realizados cortes histológicos de 4 µm de espessura, corados com Hematoxilina-Eosina (HE), estes foram reavaliados pela patologista da equipe para confirmação dos laudos e da graduação histológica e para a verificação da presença do tumor, bem como o seu estado de conservação. Somente após este processo, os espécimes foram submetidos às técnicas de Hibridação in situ e Imunohistoquímica.
3.2 Aspectos éticos
39 3.3 Instrumentos e procedimentos para a coleta de dados
Os dados sócio-epidemiológicos e clínicos foram registrados em fichas contendo as informações obtidas através de consulta de prontuários (Apêndice B). Os dados histopatológicos, tais como subtipo tumoral, grau de diferenciação, extensão da lesão e acometimento de linfonodos foram extraídos dos laudos patológicos presentes nos respectivos prontuários. Dados relacionados à presença de metástases à distância não puderam ser avaliados em nenhum dos casos.
3.4 Hibridação in situ
O método utilizado neste estudo foi adaptado do descrito por Bacchi et al. (1996). A sonda utilizada, descrita por Shibata et al. (1991), apresenta uma sequência oligonucleotídica
de 30 pb biotinilada na extremidade 3’ (5’–
AGACACCGTCCTCACCACCCGGGACTTGTA–3’) complementar ao RNA viral EBER1. Sucintamente, o método consiste nos seguintes passos:
1. Cortes histológicos de 4 µm foram fixados em lâminas de vidro limpas e tratadas com silano a 4%;
2. Passagem das lâminas em estufa pré-aquecida a 60º C durante 180 minutos; 3. Desparafinização e hidratação em gradiente xileno-álcool-água;
4. Bloqueio da peroxidase endógena em peróxido de hidrogênio a 3% por 20 minutos;
5. Digestão enzimática com Proteinase K (concentração final de 0,02 µg/µ L) por 9 minutos;
6. Lavagem em água com DEPC 0,1%; 7. Desidratação em gradiente de água-álcool;
40 9. Incubação com solução de hibridação (Solução de Denhardt [2X]; Formamida [50%]; Sulfato de Dextrano [2%]; NaH2PO4 [0,002 M]); sonda na concentração 0,3 ng/µ L) por 16 horas em estufa a 37ºC;
10. Incubação com Streptoavidina primária (GenPoint - DakoCytomation®) (diluição 1:400) por 15 minutos a 37ºC;
11. Biotinil-Tiramida (GenPoint - DakoCytomation®) por 15 minutos a 37ºC e 12. Strepto-Peroxidase – secundária (GenPoint - DakoCytomation®) por 15 minutos a
37º C;
13. Revelação com o cromógeno DAB líquido (3,3’-diaminobenzide)
(DakoCytomation®) preparado conforme as recomendações do fabricante; 14. Contra-coloração com Hematoxilina de Carazzi;
15. Desidratação em gradiente de água-álcool-xileno;
16. Montagem das lâminas com lamínulas e Bálsamo de Canadá.
Em cada bateria de reação, foi adicionado como controle positivo, um caso de adenocarcinoma gástrico sabidamente positivo pelo EBV.
3.5 Imunohistoquímica
Realizou-se o método imunohistoquímico da estreptoavidina-biotina-peroxidase adaptado de Hsu et al. (1981) para a detecção das proteínas celulares RE, RP, HER2, Ki67, TP53, CK5/6 e CK8/18 conforme descrito a seguir:
1. Cortes histológicos de 4 µm foram fixados em lâminas de vidro limpas e tratadas com silano a 4%;
2. Passagem das lâminas em estufa pré-aquecida a 60ºC durante 180 minutos; 3. Desparafinização e hidratação em gradiente xileno-álcool-água;
4. Recuperação antigênica em panela pressurizada (Pascal - DakoCytomation®) utilizando tampão Citrato 10 mM pH=6,0 (120º C, 18 psi) por 3 minutos e 40 segundos;
5. Bloqueio da peroxidase endógena em peróxido de hidrogênio a 3% por 10 minutos;
41 Bioscience®, diluição 1:80; Ki67 - Spring Bioscience®, diluição 1:80; TP53 - Spring Bioscience®, diluição 1:50; CK5/6 Biocare medical®, diluição 1:70 e CK8/18 Biocare medical®, diluição 1:150) em geladeira (4 a 8ºC) por 16 horas; 7. Detecção pelo sistema LSAB/HRP seguindo as recomendações do fabricante
(tabela 06);
8. Revelação com o cromógeno DAB líquido (3,3’-diaminobenzide)
(DakoCytomation®) preparado conforme as recomendações do fabricante; 9. Contra-coloração com Hematoxilina de Carazzi;
10. Desidratação em gradiente de água-álcool-xileno;
11. Montagem das lâminas com lamínulas e Bálsamo de Canadá.
Em cada bateria de imunohistoquímica foi incluído um espécime clínico sabidamente positivo para cada proteína como controle positivo das reações.
3.6 Critérios para Análise das lâminas
Admitiu-se como marcação, a presença de uma coloração marrom característica, adquirida pelo cromógeno após oxidação, situadas nas regiões celulares previstas para cada alvo avaliado (tabela 06) em contraste com o azul/violeta conferido pela hematoxilina constatada por microscopia óptica.
Tabela 06: Regiões celulares de expressão dos alvos das técnicas empregadas e os respectivos clones dos anticorpos e kits de detecção.
Técnica Alvo Região celular de expressão
Clone Kit de detecção
Hibridação in situ EBER1 Nuclear - GenPoint
Imunohistoquímica RE Nuclear SP1 Match 4
RP Nuclear SP42 Match 4
HER2 Membranar SP3 Match 4
Ki67 Nuclear SP6 DBS
TP53 Nuclear SP5 DBS
42 Continuação
Técnica Alvo Região celular de
expressão
Clone Kit de detecção
Imunohistoquímica CK5/6 Citoplasmática CK5/6.007 Match 4
CK8/18 Citoplasmática 5D3 Easy path
GenPoint - DakoCytomation®; Match 4 - Universal HRP-polymer detection (Biocare Medical®); DBS - Universal HRP immunostaining kit (Diagnostic BioSystems®); Easy Path
– Sistema de detecção ultra estreptavidina (Erviegas®).
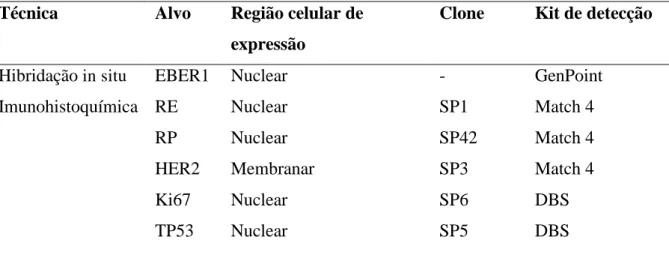
No caso da Hibridação in situ, considerou-se positivo qualquer marcação nuclear em células tumorais, independente do percentual de células marcadas.
Quanto à imunohistoquímica, o índice de marcação LI (do inglês, Labelling índex) foi estimado através da contagem manual utilizando microscopia óptica (Landberg e Ross, 1993). Foram selecionados campos aleatórios com representativa quantidade de células tumorais. Um mínimo de 300 células foi contado e o índice de marcação foi calculado com base na seguinte fórmula:
LI = (Total de células marcadas) / (Total de células contadas) X 100
Os critérios de positividade definidos para as diferentes proteínas detectadas foram estabelecidos de acordo com a tabela 07.
Tabela 07: Critérios de positividade definidos para as proteínas detectadas por imunohistoquímica.
Proteína Negativo Positivo
RE Nenhuma coloração ou menos de 1% dos núcleos das células neoplásicas corados.
Coloração nuclear em 1% ou mais dos núcleos das células neoplásicas.
RP Nenhuma coloração ou menos de 1% dos
núcleos das células neoplásicas corados.
Coloração nuclear em 1% ou mais dos
núcleos das células neoplásicas.
43 Continuação
Proteína Negativo Positivo
HER2 Escore 0 ausência de reatividade ou
reatividade em ≤ 10% das células
tumorais.
Escore + Reatividade fraca em > 10% das células tumorais, mas a coloração é incompleta, só parte da membrana é positiva.
Escore ++ Reatividade fraca ou moderada, mas completa em > 10% das células tumorais ou há coloração intensa,
circunferencial ≤ 30% das células
tumorais.
Escore +++ Mais de 30% das células tumorais mostram coloração intensa, circunferencial, homogênea.
Ki67 Nenhuma coloração ou menos de 1% dos núcleos das células neoplásicas corados.
Coloração nuclear em 1% ou mais dos núcleos das células neoplásicas.
TP53 Nenhuma coloração nuclear ou menos de 30% das células neoplásicas coradas.
Marcação nuclear em ≥ 30% das células
neoplásicas.
CK5/6 Nenhuma coloração membranosa ou citoplasmática ou menos de 25% das células neoplásicas coradas.
Marcação membranosa ou citoplasmática em mais de 25% das células neoplásicas.
CK8/18 Nenhuma coloração membranosa ou citoplasmática ou menos de 25% das células neoplásicas coradas.
Marcação membranosa ou citoplasmática em mais de 25% das células neoplásicas.
(Subhawong et. al., 2009; Bacchi et. al., 2013)
3.7 Análise estatística
Os dados sócio-epidemiológicos e clínicos, assim como os resultados das técnicas de hibridação in situ e imunohistoquímica foram demonstrados através de gráficos e tabelas com o auxílio do programa Microsoft Excel® 2007. A correlação das variáveis observadas foi realizada através do programa estatístico EPINFO® versão 6.04d e SPSS® 17.0, utilizando-se
44 4. REFERÊNCIAS BIBLIOGRÁFICAS
Abreu E, Koifman S. Fatores prognósticos no câncer da mama feminina. Revista brasileira de cancerologia. v. 48, p. 113 – 131, 2002.
Ambinder RF, Mann RB. Detection and characterization of Epstein-Barr virus in clinical specimens. Am. J. Pathol., v. 145, n. 2, p. 239-252, 1994.
Ambinder RF et al. Functional Domains of Epstein-Barr Virus Nuclear Antigen EBNA-1. Journal of Virology, v. 65, n. 3, p. 1466-1478, 1991.
Andreopoulou E, Hortobagyi GN. Prognostic Factors in Metastatic Breast Câncer: Successes and Challenges Toward Individualized Therapy. J Clin. Oncol., v. 26, p. 3660–3662, 2008.
Arrand JR et al. Molecular cloning of the complete Epstein-Barr virus genome as a set of overlapping restriction endonuclease fragments. Nucleic Acids Research, v. 9, n. 13, 1981.
Bacchi CE et al. AIDS-related lymphoma in Brazil. Histopatology, immunophenotype and associated with Epstein-Barr Virus. Am. J. Clin. Pathol., v. 105, p. 230-237,1996.
Bacchi CE, Melo CRA, Franco MF, Neto RA. Manual de padronização de laudos histopatológicos. Sociedade Brasileira de Patologia, 4 ed. São Paulo: Manole, 2013.
Baltzell K, Buehring GC, Krishnamurthy S, Kuerer H, Shen HM, Sison JD. Epstein-Barr virus is seldom found in mammary epithelium of breast cancer tissue using in situ molecular methods. Breast Cancer Res Treat., v. 132, n. 1, p. 267-74, 2012.
45 Bonnet M, Guinebretiere J-M, Kremmer E, Grunewald V, Benhamou E et al. Detection of Epstein-Barr virus in invasive breast cancer. J Natl Cancer Inst., v. 91, p. 1376 – 1381, 1999.
Buitrago F, Uemura G, Sena MCF. Fatores prognósticos em câncer de mama Com. Ciências Saúde, v. 22, p.69-82, 2011.
Cady B. Use of primary breast carcinoma characteristics to predict lymph node metastases. Câncer, v. 79, p. 1856–1861. 1997.
Callan MFC. The immune response to Epstein-Barr virus. Microbes and Infection, v. 6, p. 937-945, 2004.
Carey LA, Perou CM, Livasy CA, Dressler LG, Cowan D, Conway K, Karaca G, Troester
MA, Tse CK, Edmiston S, Deming SL, Geradts J, Cheang MC, Nielsen TO, Moorman PG, Earp HS, Millikan RC. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study. JAMA, v. 295, p. 2492-2502, 2006.
Carey LA. Through a glass darkly: advances in understanding breast cancer biology. 2000-2010. Clin Breast Cancer, v. 10, p. 188-195, 2000-2010.
Carter CL, Allen C, Henson DE. Relation of tumor size, lymph node status and survival in 24740 breast cancer cases. Cancer, v. 63, p. 181-187, 1989.
Cheang MC, Voduc D, Bajdik C, Leung S, McKinney S, Chia SK, Perou CM, Nielsen TO. Basal-like breast cancer defined by five biomarkers has superior prognostic value than triple-negative phenotype. Clin Cancer Res., v. 14, p. 1368-1376, 2008.
46 Clark GM. Prognostic and predictive factors. In: Harris JR, Lippman ME, Morrow M, Hellman S, editors. Diseases of breast, 5th ed., Philadelphia: Lippincott-Raven, p. 461-70, 1996.
Creighton CJ. The molecular profile of luminal B breast cancer. Biologics, v. 6, p. 289-297, 2012.
Dadmanesh F, Peterse JL, Sapino A, Fonelli A, Eusebi V. Lymphoepithelioma-like carcinoma of the breast: lack of evidence of Epstein-Barr virus infection. Histopathol., n. 38, p. 54-61, 2001.
De Paoli P, Pratesi C, Bortolin MT. The Epstein Barr Virus DNA Levels As A Tumor Marker In EBV-Associated Cancers. J Cancer Res Clin Oncol., v. 133, p. 11, p. 809-15, 2007.
Deshpande CG, Badve S, Kidwai N, Longnecker R. Lack of expression of the Epstein-Barr Virus (EBV) gene products, EBERs, EBNA1, LMP1, and LMP2A, in breast cancer cells. Lab Invest., v. 82, p.1193-1199, 2002.
Di Fiore PP, Pierce JH, Fleming TP, Hazan R, Ullrich A. King CR, Schlessinger J, Aaronson SA. Overexpression of the human EGF receptor confers an EGF-dependent transformed phenotype to NIH 3T3 cells. Cell, v. 51, p. 1063-1070, 1987.
Diab SG, Clark GM, Osborne CK, Libby A, Allred DC, Elledge M. Tumor characteristics and clinical outcome of tubular and mucinous breast carcinomas. J Clin Oncol., v. 17, p. 1442 - 1448, 1999.
Dolcetti R, Masucci MG. Epstein-Barr vírus: Induction and controlo of cell transformation. Journal of Cellular Physiology, v. 196, p. 207-218, 2003.
47 Ellerman V, Bang O. Experimentelle leukÌmie beihÏhnern. Zentralbl. Bakt. Abt. I (Orig.), v. 46, p. 595-609, 1908.
Ellis I et al. Tavassoli F.A., Devilee P. (Eds.): World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of the Breast and Female Genital Organs. IARC Press: Lyon, 2003.
Elston CW, Ellis IO. Pathological prognostic factors in breast câncer I. The value of histological grade in breast câncer: experience from a large study with long-term follow-up. Histopathology, v. 19, p. 403-410, 1991.
Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Prognostic Markers in Triple-Negative Breast Cancer. Cancer, v. 109, n. 1, 2007.
Epstein MA, Achong BG, Barr YM. Virus particles in cultured lymphoblasts from Burkitt’s
lymphoma. Lancet, p. 702-703, 1964.
Epstein MA. Historical background. Phil. Trans. R. Soc. Lond B., v. 356, p. 413-420, 2001.
Evans AS, Niderman JC, Mccollum RW. Seroepidemiologic studies of infectious mononucleosis with EB vírus. New England Journal of Medicine, v. 279, p. 1121-1127, 1968.
Fawzy S, Sallam M, Awad NM. Detection of Epstein-Barr Virus In Breast Carcinoma In Egyptian Women. Clin Biochem., v. 41, n. 7-8, p. 486 – 492, 2008.
Fernandez MJ, Farina GJ, Arangoncillo BP. Immunohistochemical expression of p-53 and c-ERβ-2 in breast carcinoma: relation with epide- miologic factors, histologic featuresand prognosis. Gen & Diagnostic Pathol., v. 142, p. 289-96,1997.
48 Fina F, Romain S, Ouafik L, Palmari J, Ben Ayed F et al. Frequency and genome load of Epstein-Barr virus in 509 breast cancers from different geographical areas. Br J Cancer., v. 84, p. 783 – 790, 2001.
Fisher ER, Anderson S, Redmond C, Fisher B. Pathologic findings from the National Surgical Adjuvant Breast Project Protocol B-06: 10-year pathologic and clinical prognostic discriminants. Câncer, v. 71, p.. 2507–2514, 1993.
Geyer FC, Rodrigues DN, Weigelt B, Reis-Filho JS. Molecular classification of estrogen receptor-positive/luminal breast cancers. Adv Anat Pathol., v. 19, p. 39-53, 2012.
Geyer FC, de Nigro MV. Tipos histológicos especiais de câncer de mama. Onco&, 2013.
Glaser SL, Ambinder RF, DiGiuseppe JA, Horn-Ross PL, Hsu JL. Absence of Epstein-Barr virus EBER-1 transcripts in an epidemiologically diverse group of breast cancers. Int J Cancer, v. 75, p. 555-558, 1998.
Glaser SL, Hsu JL, Gulley ML. Epstein-Barr virus and breast cancer: state of the evidence for viral carcinogenesis. Cancer Epidemiol Biomarkers Prev., v. 13, n. 5, p. 688 – 697, 2004.
Glenn WK, Heng B, Delprado W, Lacopetta B, Whitaker NJ, Lawson JS, Epstein-Barr virus, human papillomavirus and mouse mammary tumour virus as multiple viruses in breast cancer. PloS One, v. 7, n. 11, 2012.
Grinstein S, Preciado MV, Gattuso P, Chabay PA, Warren WH et al. Demonstration of Epstein-Barr virus in carcinomas of various sites. Cancer Res., v. 62, p. 4876-4878, 2002.

![Figure 1 – EBV-positive cases. [a] and [b] Breast carcinoma: nuclear staining in a few tumor cells (arrows); [c] Positive control (400X).](https://thumb-eu.123doks.com/thumbv2/123dok_br/15316166.552209/61.892.113.833.849.1020/figure-positive-breast-carcinoma-nuclear-staining-positive-control.webp)