UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA
DEPARTAMENTO DE FISIOLOGIA E FARMACOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM FARMACOLOGIA
JOÃO JOSÉ FERREIRA EVANGELISTA
AVALIAÇÃO FARMACOLÓGICA DA DETOMIDINA NO TRATO REPRODUTIVO DE ÉGUAS (Equus caballus)
FORTALEZA
JOÃO JOSÉ FERREIRA EVANGELISTA
AVALIAÇÃO FARMACOLÓGICA DA DETOMIDINA NO TRATO REPRODUTIVO DE ÉGUAS (Equus caballus)
Tese de Doutorado submetida à Coordenação do Programa de
pós-graduação em Farmacologia do
Departamento de Fisiologia e Farmacologia da Universidade Federal do Ceará, como requisito para obtenção do título de Doutor em Farmacologia.
Área de concentração: Farmacologia
Orientadora: Profa. Dra. Maria Elisabete Amaral de Moraes
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
E92a Evangelista, João José Ferreira.
Avaliação farmacológica da detomidina no trato reprodutivo de éguas (Equus caballus)./ João José Ferreira Evangelista. – 2015.
86f: il. color.
Tese (doutorado) – Universidade Federal do Ceará, Faculdade de Medicina, Departamento de Fisiologia e Farmacologia, Programa de Pós-Graduação em Farmacologia, Doutorado em Farmacologia, Fortaleza, 2015.
Área de Concentração: Farmacologia.
Orientação: Prova. Dra. Maria Elisabete Amaral de Moraes.
1. Égua. 2. Útero. 3. Efeito Doppler. 4. Adrenérgicos. I. Título.
JOÃO JOSÉ FERREIRA EVANGELISTA
AVALIAÇÃO FARMACOLÓGICA DA DETOMIDINA NO TRATO REPRODUTIVO DE ÉGUAS (Equus caballus)
Tese de Doutorado apresentada ao Programa de Pós-graduação em Farmacologia do Departamento de Fisiologia e Farmacologia da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Farmacologia.
Área de concentração: Farmacologia
Aprovada em: 22/12/2015
AGRADECIMENTOS
A Deus, por estar comigo em todos os momentos.
Ao meu Pai e Mestre Dr. Sérgio Evangelista, um grande exemplo de homem, íntegro e um grande profissional. Obrigado por estar do meu lado e vibrar por mais esta nova conquista.
A minha Mãe Zélia, guerreira em todos os sentidos, obrigado por me ajudar e estar do meu lado nas minhas derrotas e comemorar sempre os momentos de alegrias.
A minha esposa Janaina, que está e sempre estará ao meu lado de forma incondicional. Obrigado por me fazer erguer nas minhas derrotas e vibrar comigo nos momentos de alegrias e conquistas.
Ao meu filhão João Filho pela demonstração de uma Vida cheia de energia, e que tudo na vida vale a pena ser vivido, peço desculpas pela ausência em momentos difíceis e importantes, obrigado por você existir.
Aos meus irmãos Serginho, Neusa, Patrícia e Ricardo, obrigado pela motivação e companheirismo em todos os momentos.
Às minhas queridas Avós Lídia (in memorian) e Neusa (in memorian), obrigado por
seus exemplos de vida, sempre valorizando a educação e o conhecimento.
Aos meus queridos Avôs João Evangelista (in memorian) e José Ferreira, dois
grandes exemplos de vida que sempre estarão presentes no meu caminho profissional e nas minhas conquistas, que são homenageados na composição do meu nome. Ao Sr. José Ferreira, meu padrinho, nascido em 1913, que me presenteia diariamente com exemplo de valorização da vida e como vivê-la.
Ao meu Sogro Chico Monteiro (in memorian), pelo exemplo de vida e um grande
profissional que lutou pela vida, sempre sentindo com sua partida.
A minha Sogra Helena Serra Azul, exemplo de mulher e pesquisadora, sempre presente e prestativa, com sua bondade e generosidade.
Professora Dra. Maria Elisabete Amaral de Moraes, pela orientação desta Tese, também orientadora no Mestrado, obrigado pela paciência e disponibilidade sempre em me ajudar em todos os momentos, que transcende a atividade didática profissional.
Ao professor Dr. Marco Antonio Alvarenga, no apoio desta Tese e pela oportunidade que foi me dada para conhecer um grande profissional na área da Veterinária.
Ao Dr. Assis Roberto de Bem (in memorian), pelo exemplo de vida e eterna gratidão
nos incentivos de sempre aliar a atividade profissional com a pesquisa científica e pelos conhecimentos cedidos para minha vida pessoal e profissional.
Ao amigo Regivaldo Vieira de Souza, por sempre participar de momentos importantes na minha vida profissional.
Ao professor Dr. Rômulo Vieira, sempre solícito a ajudar, tendo sido fundamental na concretização de importante parceria para realização desta Tese.
Ao amigo Antonio Felipe de Souza, na confiança depositada e pela nova amizade criada.
A todos os professores do Programa de Pós-Graduação do Departamento de Fisiologia e Farmacologia da Universidade Federal do Ceará, pelos ensinamentos a mim emitidos.
A CAPES pelo apoio econômico.
A todos da biblioteca, em especial para Rosane Maria Costa e Maria Naires Alves de Sousapela competência na orientação da normalização desta Tese.
RESUMO
A Detomidina é um agonista de receptores α2-adrenérgico, derivado imidazólico alcalóide, disponível sobre a fórmula de cloridrato, apresenta relação de seletividade
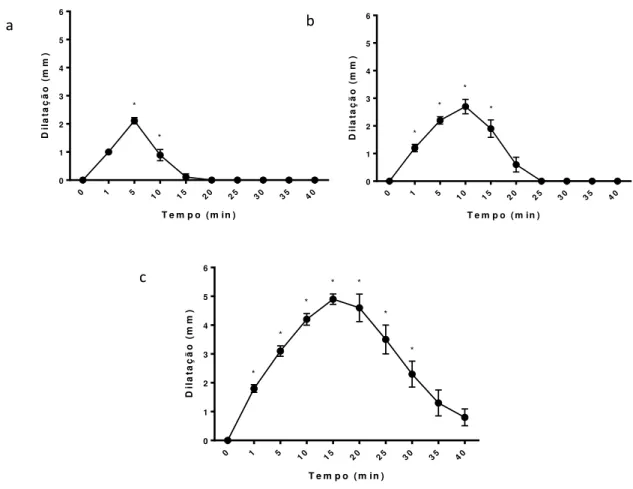
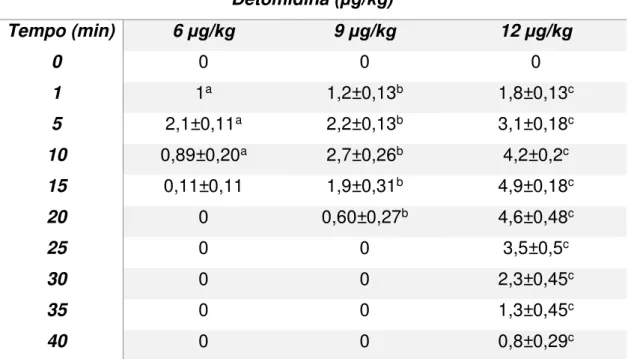
entre receptor α2/α1 de 260/1. O experimento foi conduzido para investigar a interferência da detomidina sobre o trato reprodutivo equino. Foram utilizadas vinte e cinco éguas sem raça definida (SRD), não prenhes, com idade entre 4 a 10 anos e peso de 350 a 450 Kg. As 25 éguas foram divididas de forma aleatória em 5 grupos, sendo que 3 grupos foram submetidos respectivamente a doses de 6, 9 e 12µg/kg de detomidina.Nos outros dois grupos, um deles foi aplicado Ioimbina em dose 0,10mg/Kg com antecedência de 20 minutos da aplicação de 6µg/kg de detomidina e o outro grupo controle. Foram realizadas ultrassonográfias no modo B e Doppler do trato reprodutivo de éguas. O índice de pulsatilidade (IP), resistência (IR) e pulso arterial uterino direito (PAUD), bem como a avaliação subjetiva do útero e mesométrio de suprimento sanguíneo, não apresentaram diferença significativa (P<0,05) quando comparado aos animais submetidos à detomidina 6µg/Kg, frente aos aplicados a mesma dose, mas que tinham sidos bloqueados com a ioimbina 10µg/Kg. A detomidina nas doses 6, 9 e 12µg/Kg, interferiu na dinâmica da cérvix uterina, proporcionando dilatação temporária, com diferenças significativas e magnitude
máxima de resposta ao tempo, 2,1±0,11mm (P˂0,0001) aos 5 minutos, 2,7±0,26
(P>0,0001) aos 10 minutos e 4,9±0,18mm (P>0,0001) aos 15 minutos, respectivamente. Na via Epidural na dose 6µg/Kg de detomidina, quando comparada a dilatação cervical ocorrida com a mesma dose na via IV, demonstrou diferença significativa nos tempos 5 (P>0,0001), 15 (P>0,0001), 20 (P>0,0001) e 25 (P>0,0001) minutos. Quando a resposta cervical com uso de detomidina na dose 6µg/Kg via intramuscular comparada com a IV, ocorreu diferença significativa nos tempos 5 (P>0,0001), 15 (P>0,0001), 20 (P>0,0001) e 25 (P>0,0001) minutos. Concluímos que, a detomidina nas doses de 6 (via intravenosa, intramuscular e epidural), 9 e 12µg/Kg (intravenosa) promoveram dilatação cervical temporária em éguas.
ABSTRACT
Pharmacological Evaluation of Detomidine on Mares Reproductive tract (Equus caballus)
The Detomidine is an agonist of α2-adrenergic receptors, derived imidazole alkaloid,
available on the hydrochloride formula, is related to selectivity between receptor α2/α1
of 260/1. The experiment was conducted to investigate the interference of detomidine on equine reproductive tract. Twenty-five mares were used mongrel, not pregnant, aged between 4-10 years old and weighing 350-450kg. The 25 mares were divided randomly into 5 groups, with 3 groups were submitted at doses of the detomidineof 6,
9 and 12μg/kg,respectively. In the other two groups, one applied yohimbine dose of
0.10 mg/kg 20 minutes prior to the application of 6μg/kg detomidine and in control
group. All they were made sonographic evaluations in B mode and Doppler of the reproductive tract of mares. The pulsatility index (PI), resistance index (RI) and uterine blood right wrist (UBRW) and the subjective evaluation of the uterus and mesometriumblood supply, showed no significant difference (P<0.05) when compared
to animals treated with detomidine 6μg/kg compared to the same dose applied, but
had blocked by yohimbine of 10mg/kg. The doses of detomidine in the 6, 9 and 12μg/kg
interfered with the dynamics of the uterine cervix, providing temporary expansion, with significant differences in maximum magnitude of the response time, 2.1 ± 0,11mm (P>0.0001) to 5 minutes, 2.7 ± 0.26 (P>0.0001) after 10 minutes and 4.9 ± 0.18 mm (P>0.0001) after 15 minutes, respectively. In epidural detomidinedose of
6μg/kg,comparing the cervical dilatation, occurred with the same dose in the IV route
showed a significant difference in 5 (P>0.0001), 15 (P>0.0001), 20 (P>0.0001) and 25 (P>0.0001) minutes. When the use of detomidine in cervical response withthe
intramuscularlydose of 6μg/kg comparing to RI, there was a significant difference in 5
(P<0.0001), 15 (P>0.0001), 20 (P>0.0001) and 25 (P>0.0001) minutes. We concluded that, the detomidinedoses of 6 (intravenous, intramuscular and epidural), 9 and 12µg/kg (intravenous) promoted temporary cervical dilation in mares.
LISTA DE FIGURAS
Figura 1 Estruturas do aparelho reprodutivo da égua, vista dorso-ventral 26
Figura 2 Estruturas do aparelho reprodutivo da égua, vista latero-medial. 27
Figura 3 Fórmula estrutural do cloridrato de detomidina 38
Figura 4 Estrutura tridimensional do cloridrato de detomidina 38 Figura 5 Mapa do Ceará (figura maior) com destaque do município de
Itaitinga (em vermelho) e mapa do Brasil (figura menor) com destaque do estado do Ceará (em vermelho circundado em quadrado)
52
Figura 6 Imagem das éguas no piquete. 54
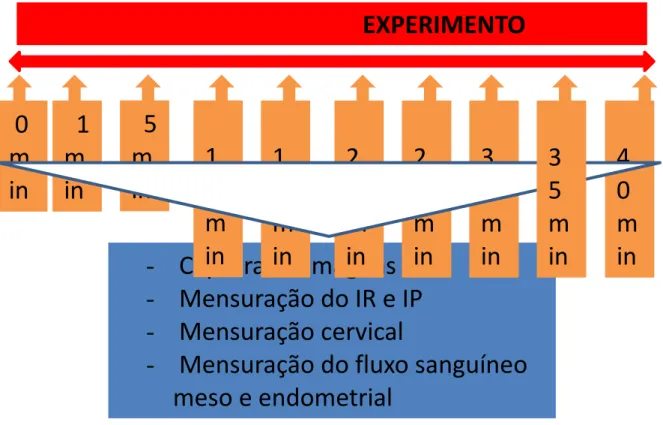
Figura 7 Organograma das atividades desenvolvidas com os animais. 55
Figura 8 Painel a - Posicionamento do transdutor ultrassonografico com
Doppler 55
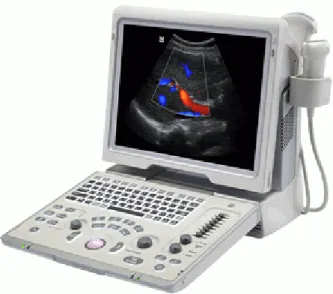
Figura 9 Aparelho de ultrassonografia, modelo Z5, marca MINDRAY 56
Figura 10 Organograma do experimento, com atividades e momentos 57 Figura 11 Dilatação cervical com a aplicação das doses 6, 9, e 12µg/Kg de
detomidina, na via de aplicação intravenosa, sendo (a) 6 μg/kg; (b) řμg/kg; (c) 12 μg/kg
64
Figura 12 Dilatação cervical com a aplicação das doses 6, 9, e 12µg/Kg de
detomidina, na via de aplicação intravenosa. 66
Figura 13 Imagens ultrassonográficas da cérvix uterina de égua, Modo-B. 68
Figura 14 Dilatação cervical com a aplicação da dose 6µg/Kg de detomidina, nas vias de aplicação intravenosa, epidural e intramuscular. 70
Figura 15 Índice de pulsatilidade (IP) da artéria uterina direita com aplicação
de 6µg/Kg de detomidina por via intramuscular. 72
Figura 16 Índice de resistência (IR) da artéria uterina direita com aplicação de
6µg/Kg de detomidina por via intramuscular. 73
Figura 17 Pulso da artéria uterina direita com aplicação de 6µg/Kg de
detomidina por via intramuscular. 75
Figura 18 Diâmetro do corno uterino direito com aplicação de 6µg/Kg de
Figura 19 Avaliação subjetiva do mesométrio do corno uterino direito com aplicação de 6µg/Kg de detomidina por via intramuscular. 78
LISTA DE TABELAS
Tabela 1 Dilatação cervical com a aplicação das doses 6, 9, e 12µg/Kg de
detomidina, na via de aplicação intravenosa. 65
Tabela 2 Dilatação cervical com a aplicação da dose 6µg/Kg de detomidina, nas vias de aplicação intravenosa, epidural e intramuscular. 69
Tabela 3 Índice de pulsatilidade (IP) da artéria uterina direita com aplicação
de 6µg/Kg de detomidina por via intramuscular. 71
Tabela 4 Índice de resistência (IR) da artéria uterina direita com aplicação de
6µg/Kg de detomidina por via intramuscular. 73
Tabela 5 Pulso da artéria uterina direita com aplicação de 6µg/Kg de
detomidina por via intramuscular. 74
Tabela 6 Diâmetro do corno uterino direito com aplicação de 6µg/Kg de
LISTA DE ABREVEATURAS
AIED Artéria Ilíaca Externa Direita AS Sinoatrial
ASMT N-Acetilserotonina O-Metiltransferase
ASVE Avaliação Subjetiva dos Vasos Endometriais ASVM Avaliação Subjetiva dos Vasos Mesometriais AUD Artéria Uterina Direita
Aumb Artéria Umbilical AV Atrioventricular
BFV Volume de Fluxo Sanguíneo CE Coletas de Embriões
CL Corpo Lúteo
CUD Corno Uterino Direito DC Dilatação Cervical
DCI Artéria Circunflexa Profunda DCUD Diâmetro do Corno Uterino Direito DET Detomidina
DEX Dexmedetomidina
DUC Depuração Uterina Retardada
E Estrógenos
EI Artéria Ilíaca Externa ET Embriões Transferidos FSH Folículo Estimulante
GnRH Hormônio Liberador de Gonadotrofina
ICSI Injeção Intracitoplasmática de Espermatozóides IM Via Intramuscular
IP Índice de Pulsatilidade IR Indice de Resistência IV Via Intravenosa
P4 Progesterona
PAUD Pulso da Artéria Uterina Direita PAUD Pulso da Artéria Uterina Direita SDR Sem Raça Definida
SNC Sistema Nevorso Central SOV Superovulação
TAMV Velocidade Média De Tempo Máximo TE Transferência de Embriões
UA Artéria Uterina UA Artéria Uterina
US Ultrassom
α2-AR Receptor Agonista Α2-Adrenérgico
LISTA DE SÍMBOLOS
Ca Cálcio
Α Alfa
SUMÁRIO
1 INTRODUÇÃO ... 16
2 REVISÃO ... 21
2.1 Reprodução eqüina... 21
2.1.1 Ciclo estral ... 21
2.1.2 Sazonalidade... 22
2.2 Anatomia reprodutiva... 24
2.2.1 Colo do útero ou cervix... 24
2.2.2 Útero... 25
2.2.3 Oviduto ... 27
2.2.4 Infundíbulo (fímbrias)... 27
2.2.5 Ovário... 27
2.2.6 Ligamento largo... 28
2.3 Receptores adrenérgicos... 28
2.4 Agentes agonistas e antagonistas... 29
2.5 Detomidina……….……….. 31
2.5.2 Contraindicações... 33
2.5.3 Efeitos colaterais... 33
2.5.4 Dosagem e administração... 35
2.5.5 Farmacinética... 36
2.6 Ioimbina... 41
2.7 Perfusão vascular uterina... 42
2.8 Ultrassom... 45
3 JUSTIFICATIVA... 49
4 RELEVÂNCIA... 50
5 OBJETIVOS... 51
5.1 Objetivo Geral... 51
5.2 Objetivos Específicos... 51
6 MATERIAIS E MÉTODOS... 52
6.1 Delineamento experimental... 52
6.1.1 Local do experimento... 52
6.1.3 Manejo alimentar... 53
6.1.4 Contenção... 54
6.1.5 Manejo reprodutivo... 54
6.1.6 Aparelho de Ultrassom... 56
6.1.7 Avaliação da dilatação cervical... 56
6.1.8 Mensuração do corno uterino direito... 57
6.1.9 Avaliação do fluxo sanguíneo com Doppler... 58
6.1.10 Avaliação subjetiva dos vasos mesometriais... 59
6.1.11 Avaliação subjetiva dos vasos endometriais... 59
6.1.12 Grupos experimentais... 60
6.1.12.1 Avaliação da dilatação cervical (DC)... 60
6.1.12.2 Mensuração do diâmetro do corno uterino direito (DCUD)... 61
6.1.12.3 Obtenção do IR, IP e Pulso da artéria uterina direita (IR/IP/PAUD)... 61
6.1.12.4 Avaliação subjetiva dos vasos mesometriais... 62
6.1.12.5 Avaliação subjetiva dos vasos endometriais... 62
6.3 Analise estatística... 63
7 RESULTADOS E DICUSSÕES... 64
8 CONSIDERAÇÕES FINAIS... 80
9 CONCLUSÃO... 81
1 INTRODUÇÃO
A vida entre humanos e cavalos vem sendo escrita por milhares de anos. No início apenas como uma fonte de alimento, os ancestrais do cavalo moderno foram caçados como qualquer outro animal selvagem. Com o tempo, veio o processo de domesticação iniciada pelos nômades, que começaram a criar cavalos da mesma forma que faziam com cabras e outros animais. Finalmente, entretanto, foi como meio de transporte que o cavalo realmente começou a fazer parte de nossas vidas. O homem aprendeu a montar. Suas vidas foram transformadas. Os cavalos tornaram-se peças principais no transporte, permanecendo assim até o século 20. A domesticação, associada ao crescimento da população humana, sinalizou o fim do verdadeiro cavalo selvagem. Hoje, mesmo aqueles cavalos que vivem em rebanhos nas poucas áreas de pastagens restantes, não são verdadeiramente selvagens, pois todos foram manejados pelo homem de um jeito ou de outro. Os cavalos possuem muito do comportamento instintivo que lhes permitiram existirem sem a intervenção humana e será necessário entendê-los melhor se quisermos continuar essa parceria.
Ao contrário da maior parte dos animais, a origem e a evolução do cavalo teve reconstituição facilitada pela descoberta de inúmeros registros fósseis. De acordo com estes registros, o ancestral do cavalo surgiu no Continente Americano durante a Era Cenozóica - mais precisamente, no Período Eoceno – há cerca de 60 milhões. Este primeiro antepassado do cavalo moderno, denominado Eohippus, media apenas 35 cm de altura e possuía o dorso arqueado (LIMA et al, 2006).
Então, a história da família dos cavalos tornou-se algo mais complexo, com o desenvolvimento de várias subfamílias. Eventualmente, entretanto, estas se extinguiram e foi o Pliohippus que promoveu a ligação na corrente do Eohippus até o moderno Equus. O Pliohippus evoluiu entre 10 a 5 milhões de anos atrás e tinha pernas longas com um único casco. Seu sucessor direto, Equus, o gênero do cavalo moderno, finalmente emergiu a milhões de anos atrás.
de 4 milhões de anos atrás e se espalhou para a Eurásia (presumivelmente, atravessando o estreito de Bering) 2 a 3 milhões de anos atrás. Na sequência dessa emigração original, havia oeste migrações adicionais para a Ásia e retornar migrações para a América do Norte, bem como várias extinções de espécies de Equus na América do Norte. Os últimos cavalos pré-históricos norte-americanos morreram entre 13.000 e 11.000 anos atrás, no final do Pleistoceno, mas então Equus se espalhou para Ásia, Europa e África (KIRKPATRICK; FAZIO, 2008).
Em torno de 9.000 a.C., durante o final da Era do Gelo, desfez-se a ligação por terra entre a Ásia e a América (na região do atual Estreito de Bering), e os cavalos na América ficaram isolados dos demais cavalos do mundo. Por causas ainda desconhecidas, há 8.000 anos os cavalos foram extintos no continente americano (LIMA et al, 2006).
Oficialmente, a chegada de cavalos no Brasil só foi registrada em 1549. Naquele ano, Tomé de Souza (primeiro governador-geral) mandou vir alguns animais, de Cabo Verde para a Bahia, na caravela Galga. Assim, nos primeiros anos da Colônia, a sua criação (junto com o gado bovino) foi iniciada formalmente e que seria fundamental para a formação do Brasil (LIMA et al, 2006).
O Brasil possui o maior rebanho de equinos na América Latina e o terceiro mundial. Somados aos muares (mulas) e asininos (asnos) são 8 milhões de cabeças, movimentando R$ 7,3 bilhões, somente com a produção de cavalos.O rebanho envolve mais de 30 segmentos, distribuídos entre insumos, criação e destinação final e compõe a base do chamado Complexo do Agronegócio Cavalo, responsável pela geração de 3,2 milhões de empregos diretos e indiretos.Quando o assunto é exportação de cavalos vivos, os números são significativos: a expansão alcançou 524% entre 1997 e 2009, passando de US$ 702,8 mil para US$ 4,4 milhões. A maior população brasileira de equinos encontra-se na região Sudeste, logo em seguida aparecem as regiões Nordeste, Centro-Oeste, Sul e Norte. Destaque para o Nordeste, que além de equinos, concentra maior registro de asininos e muares (BRASIL, 2015).
O efetivo de equinos foi de 5,312 milhões de cabeças em 2013. O maior número de animais foi observado no Estado de Minas Gerais (14,3%), seguido pelos Estados do Rio Grande do Sul (10,1%) e Bahia (9,1%). Não se observou grande concentração desse efetivo entre os principais municípios produtores, estando os maiores rebanhos
localizados em Corumbá (MS), Sant’Ana do Livramento e Uruguaiana, os dois últimos
do Estado do Rio Grande do Sul. Em termos regionais, o efetivo de equinos estava localizado nas Regiões Sudeste (24,4%), Nordeste (23,4%), Centro-Oeste (18,7%) e Sul (18,2%). Os rebanhos cresceram, sobremaneira, nos Estados do Rio Grande do Sul (14,2%) e Tocantins (22,4%) em relação a 2012. Observaram-se, no entanto, reduções significativas nos Estados de Mato Grosso (23,2%), Minas Gerais (3,4%), Bahia (6,3%), entre outros (IBGE 2014).
Usado unicamente como meio de transporte durante muitos anos, os equídeos têm conquistado outras áreas de atuação, com forte tendência para lazer, esportes e até terapia. Uma de suas principais funções, contudo, continua sendo o trabalho diário nas atividades agropecuárias, onde aproximadamente cinco milhões de animais são utilizados, principalmente, para o manejo do gado bovino (BRASIL, 2015).
A técnica de transferência de embriões (TE) não-cirúrgica em éguas foi descrita pela primeira vez por OGURI & TSUTSUMI em 1972. Desde então, ela é utilizada comercialmente em diversos países, sendo uma das principais biotécnicas da reprodução assistida de equinos. Dentre as diversas vantagens de seu emprego, pode-se citar a utilização de doadoras jovens, o aumento da produtividade égua/ano, a obtenção de produtos de éguas incapazes de conduzir a gestação a termo por problemas adquiridos e a possibilidade de manter éguas de desempenho em atividade ao longo do ano. Com o intuito de aproveitar ao máximo o potencial de animais de alto valor genético, a TE vem sendo associada a outras técnicas de reprodução assistida como a criopreservação de embriões, superovulação (SOV), injeção intracitoplasmática de espermatozóides (ICSI) e até clonagem (Ferreira; Meira, 2011).
O número total de coletas de embriões (CE) equinos no mundo diminuiu de 41,652 em 2010 para 40.833 em 2011. No entanto, deve notar-se que os EUA não relataram dados de coleta durante durante dois anos consecutivos, por isso seus dados são os mesmos para 2010 e 2009. Com base em embriões transferidos (ET), os três principais países que realizaram transferências em 2011 são: Brasil (13.600), Argentina (7500), e os EUA (6100). O Brasil aumentou seus números em cerca de 1600, para 2011, e a Argentina diminuiu 831. O Canadá teve aumento de 42 em relação a 2010, passando para 73 em2011. México informou 11 CE e 8 ET em 2011. Uruguai se referiram 3 CE,mas não houve transferências, esses embriões foram exportados. Da Oceania, a Nova Zelândia relatou 50 CEe 50 transferências. Austrália informou 1356 CE e 950 transferências em 2011. A França foi o líder europeu em 2011 com 376 transferência de embriões seguida pela Itália com 168, e no Reino Unido, com 110 transferências. Hungria e Portugal transferiram 5 e 8 embriões, respectivamente. Pelo segundo ano consecutivo não houve atividade informada da Ásia, como também a África não tinha dados para relatar em 2011. O único país que relatou transferências com embriões congelado em 2011 foi o Brasil, com 25 transferências (IETS, 2012).
embriões eqüinos, dificultando a obtenção de tais dados. Nem todos os proprietários declaram que os potros foram obtidos com a transferência de embrião, esta falta de informação parte desde as fazendas de criação como tambem dos que fazem a técnica. Suspeita-se que podem ter havido 15.000 transferências de embriões nos EUA e 3.000 na Europa, sem o repasse destas informações (IETS, 2013).
O Brasil em 2013, teve aumento numérico de 2.780 nas coletas de embriões, passando ao total de 24.880. A produção de embrião tambem foi aumentada para 19.680, com acrescimo de 2.880 em relação ano ano anterior. (IETS, 2014). Os dados refletem que a atividade de produção de embriões no Brasil, tem destaque no cenário global como tambem está em ascensão.
2 REVISÃO
2.1 Reprodução equina
O ciclo estral equino é geralmente descrito como uma combinação de uma fase folicular, ou estro, e uma fase lútea, ou diestro. A endocrinologia do ciclo estral envolve um equilíbrio entre hormônios produzidos pela glândula pineal, hipotálamo, hipófise, ovários e endométrio (SATUÉ; GARDÓN, 2013).
O ciclo estral é definido como o intervalo de tempo entre duas ovulações. O intervalo aproximado varia entre 18 e 22 dias, considerando-se em média um período de 21 dias. Atualmente o ciclo estral consiste em duas etapas claramente diferenciadas: estro ou fase folicular e diestro ou fase lútea (LEY, 2006; SENDEL, 2010; SATUÉ; GARDÓN, 2013). Estas fases são caracterizadas por modificações internas dos órgãos sexuais e do sistema glandular bem como alterações comportamentais (SATUÉ; GARDÓN, 2013).
O estro geralmente dura 6 dias, mas pode ser de somente 4 dias, podendo chegar a 10 dias, dependendo da égua (LEY, 2006; SENDEL, 2010), entretanto a duração do estro pode variar de 3 a 9 dias (SATUÉ; GARDÓN, 2013).
O hormônio liberador de gonadotrofina (GnRH) atua no sistema vascular hipotalâmico-pituitário, em seguida, transportado para o adenohipófise onde os hormonios folículo estimulante (FSH) e hormônio luteinizante (LH) são sintetizados. As gonadotrofinas são transportados através do sangue para o ovário, onde exercem especificamente as suas funções. O FSH atua sobre as células da granulosa do folículo, estimulando o crescimento, maturação folicular e a biossíntese de estrógeno. Nas células da teca, o LH está envolvido na maturação do oócito, ovulação, implantação e manutenção de corpo lúteo (CL), bem como desenvolvimento e na síntese de progesterona (P4). Ambos os esteróides ovarianos controlam o eixo hipotálamo-hipófise por mecanismos de feedback que determinam o ciclo estral na égua (SATUÉ; GARDÓN, 2013).
2010), na região nordeste do Brasil não ocorre sazonalidade na reprodução dos equinos por conta da luminosidade.
A ovulação, libertação do ovócito do ovário, pode ocorrer a qualquer momento durante a fase de estro. No entanto, se produz normalmente 24-48 h antes do final do período de estro. Idealmente, para maximizar a chance de concepção, a inseminação deve ocorrer 12 horas antes da ovulação (LEY, 2006; SENDEL, 2010).
A regulação das ondas e a seleção folicular envolvem interações entre gonadotrofinas circulantes específicas e fatores intra-foliculares, garantindo que cada folículo é devidamente estimulado a crescer ou regredir em qualquer fase de desenvolvimento. Do ponto de vista experimental, a ocorrência de uma onda é definida como o crescimento folicular ou aparecimento simultâneo de um número variável de folículos abaixo de 6 a 13 mm de diâmetro. No égua, estas ondas foliculares são classificados de acordo com a sua capacidade para desenvolver o folículo dominante (ondas primárias) ou, em contraste, apenas gerar pequenos folículos (ondas menores). Assim, as ondas principais ou superiores originam vários folículos subordinados e um folículo dominante, enquanto que as ondas menores, os
folículos não são maiores do que 30 mm de diâmetro e em seguida regridem (SATUÉ;
GARDÓN, 2013).
2.1.2 Sazonalidade
A duração do dia é o fator determinante primário para a controlar a sazonalidade nas regiões temperadas do mundo, enquanto que animais próximos da linha do Equador tendem a perder a maior parte, se não toda, da sazonalidade. A ciclicidade das éguas ocorrem nos dias longos com 15 a 16 horas de luz (LEY, 2006).
Os fotorreceptores da retina capturam as informações de quantidade de luz como estímulo e transformam em impulsos nervosos. Este impulso nervoso é transportado através do nervo óptico até ao núcleo supraquiasmático e depois para o gânglio cervical superior. Este último gânglio tem terminações neuronais adrenérgicas que alcançam a glândula pineal, onde o neurotransmissor serotonina é liberada. Através de N-acetil-serotonina, a serotonina é transformada em N-acetilserotonina, também chamada normelatonina. Normelatonina em conjunto com o N-acetilserotonina O-metiltransferase (ASMT) envolvida na síntese de melatonina. A melatonina é liberada durante as horas de escuridão, seguindo um padrão de secreção inversamente proporcional à quantidade de horas do dia. Como resultado do aumento da exposição ao fotoperíodo na primavera e no verão, a secreção de melatonina decresce, que por sua vez estimula a liberação do fator liberador de gonadotrofinas (GnRH) no hipotálamo (SATUÉ; GARDÓN, 2013).
Os primeiros ciclos estrais em cada estação reprodutiva anual são frequentemente erráticos e prolongados, tempo no qual estas éguas podem ficar em cio durante 20-30 dias ou mais. Durante o final de março, abril e maio, a maioria das éguas apresentam receptividade sexual, e do final de abril até agosto, a maioria das éguas dará um ciclo normalmente (SENDEL, 2010) para animais do hemisfério norte.
Para Ley (2006), considerando as 4 estações do ano, o início da atividade reprodutiva normal das éguas ocorre ao final da primavera e verão. Ao longo do ano, a maioria das éguas passará do anestro, no inverno, para um período transicional, para depois se tornar poliéstrica estacional; daí para um período transicional no outono e de voltar ao anestro no inverno.
Nos hemisférios norte e sul, o ciclo estral na maioria das éguas começa a normalizar no final de abril ou início de maio e se estendem até agosto (SENDEL, 2010). Na região nordeste do Brasil não ocorre sazonalidade na reprodução dos equinos por conta da luminosidade.
a secreção de hormônio luteinizante (LH), predominantemente, enquanto aqueles que ocorrem a cada 6 horas estimulam a secreção de hormônio folículo estimulante (FSH) . Os pulsos de alta freqüência de GnRH (2 pulsos por hora) durante o estro favorecem um aumento de LH e declínio de FSH, enquanto que freqüência reduzida de pulsos (2 por dia), leva um aumento de FSH e diminuição de LH. Estes eventos endócrinos permitem o aparecimento de ondas foliculares, síntese de estrógenos e ovulação durante o estro e a formação do corpo lúteo com produção de progesterona durante o diestro (SATUÉ; GARDÓN, 2013).
2.2 Anatomia reprodutiva
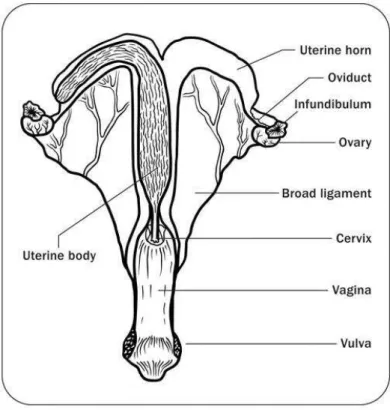
O trato reprodutivo das éguas pode ser dividido de forma didática nas seguintes partes: cérvix uterina, útero, ovidutos, tubas uterinas, fimbrias, ovários e ligamento largo.
2.2.1 Colo do útero ou cervix
A cérvix uterina é uma estrutura de aproximadamente 10 cm de comprimento segundo Sendel (2010), ou de 5 a 7,5cm segundo Ley (2006). Está localizada entre a vagina e o útero. É o canal de comunicação entre o útero o trato urogenital e quando fechado, serve para manter um ambiente estéril no útero. Ela relaxa quando a égua está no cio e fecha quando não está no cio ou prenhe (SENDEL, 2010).
A cérvix uterina é a extensão muscular constrita de paredes espessadas do corpo uterino. Sua extremidade distal se projeta caudalmente para dentro da vagina anterior. A mucosa cervical é mais pálida que a uterina, contem células ciliadas secretoras de muco. A parede cervical contém quantidade significativa de tecido conjuntivo colagenoso e um esficter de musculo liso derivado da camada mais interna do miométrio (LEY, 2006).
2.2.2 Útero
Para Sendel (2010), o útero tem um corpo uterino grande, apenas anterior para o colo e dois cornos uterinos relativamente curtos que terminam no oviduto. O corpo do útero é onde a maior parte do desenvolvimento embrionário ocorre. Ele também produz hormônios e é o receptáculo do sémen, durante a cópula.
O útero está dividido em corpo e cornos, em formato de ¨T¨. O corpo é cilindrico e está parcialmente situado na cavidade abdominal e a restante na pelvica, sendo cilindrico e tem comprimento de 18 a 20cm. Os cornos uterinos estão locaizados totalmente na cavidade abdominal, tem comprimento de 20 a 25cm e no estado não gravídico costumam serem simétricos (LEY, 2006). Para Silva et al. (2005),
o útero equino tem forma de Y e o comprimento de cada corno uterino é equivalente ao comprimento do corpo uterino.
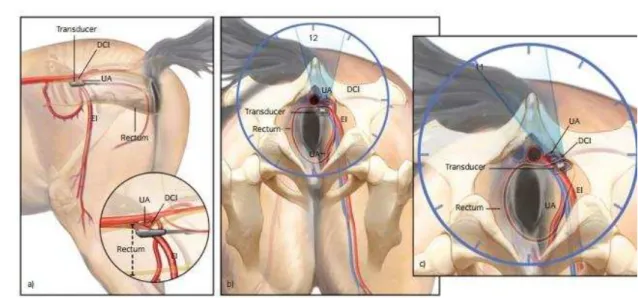
A vascularização uterina é feita pelas artérias e veias uterinas, ramo uterino da artéria e veia ováricas. As artérias uterinas originam-se das artérias vaginais correspondentes e entram no mesométrio ao nível da cérvice. Divergem para os cornos uterinos em direção à extremidade cranial dos mesmos, onde se anastomosam com a artéria ovariana. A artéria uterina ramifica-se na parede do útero e no mesométrio e seus ramos suprem ambos os lados dos cornos uterinos. O ramo mais caudal da artéria uterina anastomosa-se com a artéria vaginal (BARBOSA, 2013).
O suprimento vascular dos cornos uterinos de cada lado se origina de três fontes: ramo uterino da arteria vaginal, ou arteria uterina caudal (da artéria ilíaca externa) e ramo uterino da artéria (da artéria ilíaca externa); e ramo uterino da artéria ovariana ou artéria cranial. A principal drenagem venosa do útero é feita através do ramo uterino da veia ovariana. O útero não recebe inervação sensitiva (LEY, 2006).
O mesométrio continua com o perimétrio da superfície livre, ou não fixada, dos cornos uterinos. A dupla camada de peritônio envolve vasos sanguíneos, nervos, tecido conjuntivo, vasos linfáticos, tecido colagenoso frouxo, tecido adiposo e camadas de de músculo liso que continuam com a camada mais externa, longitudinal, de musculatura lisa do miométrio (LEY, 2006).
Figura 02: Estruturas do aparelho reprodutivo da égua, vista latero-medial. Adaptado, fonte: Sendel 2010.
Os nervos simpáticos penetram no miométrio e endométrio. A fonte da vasculatura vem através do ligamento largo (ANS 3319C).
2.2.3 Oviduto
Cada oviduto (salpinge, tuba uterina ou trompa de falópio), direito e esquerdo, é dividido em três partes: istmo, ampola e infundíbulo. Um fenomeno incomum em éguas é a retenção de de ovócitos no oviduto (LEY, 2006). As tubas, são duas estruturas, uma no lado direito e outra no esquerdo.
2.2.4 Infundíbulo (fímbrias)
As fímbrias, são duas estruturas bilaterais, uma no lado direito e outra no esquerdo, localizam-se na porção cranial do oviduto, servem para captar o ovócito no momento da ovulação e transportá-lo para o oviduto, servindo como uma "luva coletora" (SENDEL, 2010).
2.2.5 Ovário
Os ovários estão totalmente suspensos dentro da cavidade abdominal e são livres para serem passivamente movimentados dentro do abdome, em extensão limitada. Tipicamente com forma de feijão, tem comprimento de 70 a 80 cm e 40 a 60 de largura (LEY, 2006).
2.2.6 Ligamento largo
2.3 Receptores adrenérgicos
Os receptores adrenégicos estão divididos em dois tipos, os α-adrenégicos
(com os subtipos α1 e α2) e os β-adrenérgicos (com os subtipos β1, β2 e β3). Os
receptores α1 e α2-adrenégicos são constituídos, cada um, de outras subclasses, que se expressam em diferentes locais. Cada uma dessas classes está associada a um sistema específico de segundos mensageiros. Por exemplo, os receptores α 1-adrenégicos estão acoplados a fosfolipase C e produzem seus efeitos principalmente através da liberação de Ca2+ intracelular. Os receptores α2-adrenégicos estão negativamente acoplados à adenilato ciclase e reduzem a formação de monofosfato cíclico de adenosina (cAMP), alem de inibirem os canais de cálcio (RANG et al., 2004).
Os receptores α-adrenégicos foram identificados numa variedade de tecidos, ao se medir a ligação de compostos antagonistas marcados com isótopos radioativos, que são considerados como tendo grande afinidade por esses receptores, como, por exemplo a diidroergocriptina (α1 e α2), a prazosina (α1) e a ioimbina (α2) (KATZUNG, 2005).
2.4 Agentes agonistas e antagonistas adrenérgicos
O uso do receptor agonista α2-adrenérgico (α2-AR) em medicina veterinária foi primeiramente relatado por Clark e Hall em 1960, avaliando os efeitos sedativos da xilazina em equinos e bovinos. Outros agonistas α2-AR, tais como a detomidina (DET), romifidina, medetomidine (MED) e dexmedetomidina (DEX) foram introduzidas posteriormente, se tornando uma ferramenta vital para os médicos veterinários em
excelente escolha para sedação de curta duração e analgesia, podendo utilizar a via epidural (SANCHEZ; ROBERTSON,2014).
As principais ações de todos os agonistas alfa 2 adrenoceptores são semelhantes, na medida em que eles produzem uma redução da frequência cardíaca, alterando o ritmo cardíaco, uma hipertensão inicial seguida por uma hipotensão prolongada, uma diminuição no débito cardíaco e depressão respiratória (ENGLAND; CLARKE, 1996).
Os fármacos α2-agonistas são analgésicos potentes que também induzem mudanças fisiológicas e comportamentais tais como: hipertensão arterial, bradicardia, bloqueio atrioventricular, sedação excessiva e ataxia, o que pode potencialmente limitar a sua utilização como analgésicos sistêmicos em alguns casos clínicos. Da mesma forma, outras vias de administração e os benefícios dos α2-agonistas são reconhecidos na literatura animal, humana e de animais de laboratório, podem ser úteis no paciente equino (VALVERDE, 2010).
A disfunção miometrial em éguas susceptíveis pode estar relacionada com números reduzidos de receptores α-adrenérgicos, a falta de responsividade destes receptores, ou a uma deficiência na transdução do sinal, já que foi demonstrado que a estimulação de receptores α2–adrenérgicos, resulta na contração do miométrio em éguas resistentes, mas não nas suscetíveis. Agonistas α1 e α2-adrenérgicos melhoram a contratilidade uterina após tratamento com oxitocina apenas em éguas resistente. Uma deficiência no miométrio em receptores de ocitocina é improvável, porque a depuração uterina e pressão intra-uterina são semelhantes em éguas resistentes e suscetíveis após a aplicação de ocitocina (BRITO; BARTH, 2003).
Reitzensteinat et al. (2002) demonstraram que a detomidina potencializa a
ação miocontrátil da ocitocina no útero de éguas.
O útero é ricamente inervado com receptores adrenérgicos e α2-agonistas como a xilazina ou detomidina parecem interagir com estes receptores da musculatura uterina causando aumento de pressão (REITZENSTEINAT et al., 2002).
se torna significativamente aumentado em éguas prenhes, em contraste com as não prenhes, enquanto o índice de resistência (IR) é diminuído, e aumenta o fluxo snguíneo com a idade gestacional. Éguas mais jovens apresentaram maior fluxo sanguíneo uterino que passou de 0,28ml/min/kg no dia 14 para 27,7ml/min/kg, sendo maior do que em éguas mais velhas, tanto no dia 14 e durante a prenhez. Esses dados sugeriram que as éguas mais velhas têm fraco desenvolvimento microvilus placentário, o que pode contribuir para o nascimento de potro com peso reduzido, frequentemente observado em éguas mais velhas (KELLEY, 2013).
A primeira avaliação da hemodinâmica ovariana foi relatada em 2002 a partir de dados coletados das artérias ovarianas direita e esquerda . Em contraste às artérias uterinas, artérias ovarianas revelaram significativas diferenças entre os lados no fornecimento de sangue . Valores do índice de pulsatilidade (IP) foram significativamente inferiores na artéria ipsilateral do ovário para o corpo lúteo . Neste lado, a resistência ao fluxo de sangue diminuiu após uma curta subida até D6 e depois aumenta novamente até o fim do diestro (IGNACIO et al., 2011).
Williams et al. (1976) estudaram a ação dos receptores α-adrenégicos
presentes na musculatura lisa do útero de coelhas, através do uso de um potente antagonista, a[3H] Diidroergocriptina, sendo esta ligação rápida e reversível. Barbas
et al. (2001), encontraram ação de fármacos α agonista sobre a atividade cervical de
ovelha quando associado com prostaglandina E.
O efeitos do estrogênio e progesterona sobre os receptores alfa-adrenérgicos presentes no útero, foram investigados por estudos de ligação ao receptor direto, para isso foram utilizadas coelhas imaturas sensibilizadas com estrógeno ou não. O antagonista alfa adrenérgico, [3H] di-hidroergocriptina, foi utilizado para avaliar diretamente o número e afinidade dos receptores nas membranas. Quando o tecido foi exposto a concentrados de progesterona, houve redução estatiticamente significativa nos locais de ligação de receptores α-adrenégicos (Williams et al., 1977).
(α) quanto beta (β) adrenoreceptores, mediando, respectivamente, resposta excitatória e inibidoria às catecolaminas. A improtância das propriedades farmacológicas e fisiológicas dos receptores beta uterinos são bem conhecidas, devido à vasta utilização terapêutica de agonistas J3-2 (MARNET et al., 1987)
2.5 Detomidina
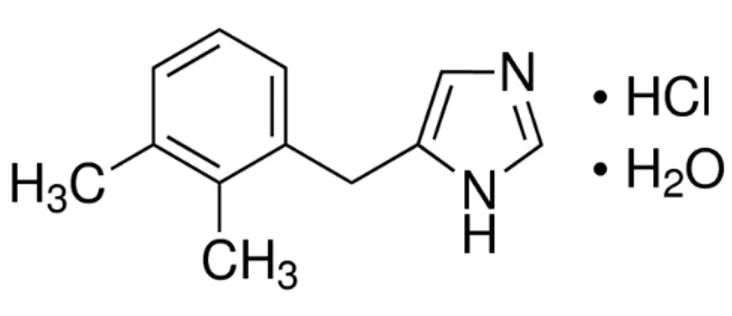
Cloridrato de Detomidina é um α2-adrenoceptor agonista sintético com propriedades sedativas e analgésicas. O nome químico é imidazol 1H4-[(2,3-dimetilfenil) metil]-cloridrato, e o nome genérico é cloridrato de detomidina. É uma substancia branca cristalina, solúvel em água, tendo um peso molecular de 222,7. A fórmula molecular é C12H14N2•HCl.
A detomidina é um derivado lipofílico do imidazole, ligeiramente básico. Quando administrado, desenvolve hipotensão e bradicardia. Apresenta-se uma especificidade seletiva na proporção de 260/1 para receptores α2/α1 respectivamente (BELDA et al.,
2005), produz sedação profunda e longa agindo por redução de noradrenalina e dopamina na região central do Sistema Nervoso Central (REHMAN et al., 2013).
Detomidina é um sedativo e analgésico não narcótico, é um potente agonista
do adrenorreceptor α2 que produz sedação e analgesia superficial e visceral, a qual é dependente da dose, na sua profundidade e duração. Letargia profunda, um característico abaixamento da cabeça com sensibilidade reduzida a estímulos ambientais (sons, etc.) são vistos com detomidina. Um curto período com falta de coordenação é caracteristicamente seguida pela imobilidade e uma posição firme dos membros dianteiros. O efeito analgésico é mais facilmente visto como um aumento no limiar da dor à superfície do corpo.
Ohnesorge et al. (1991) relataram estudo feito com o uso de detomidina com a
administração, o intervalo de tempo entre o tratamento e controle e o grau de agitação, antes do tratamento, mas não por sexo.
Nenhum efeito sobre o tempo de coagulação sanguínea ou outros parâmetros hematológicos foi encontrado em doses de 20 ou 40 mcg / kg de peso corporal. Respostas respiratórias incluem um retardamento inicial de respiração dentro de poucos segundos a 1-2 minutos após a administração, retornando ao normal no prazo de 5 minutos.
2.5.1 Indicações
A detomidina é indicada no uso como um sedativo e um analgésico (OHNESORGE et al., 1991; ENGLAND, CLARKE, 1996; VALVERDE,2010; PAPICK,
2012) para facilitar os procedimentos cirúrgicos, diagnóstico menores em cavalos adultos e animais de um ano. Ela é útíl para pré-medicação e marcadamente potencializa os efeitos de outros agentes sedativos/analgésicos (ENGLAND; CLARKE, 1996). Tem sido usada com sucesso para acalmar cavalos rebeldes (BELDA et al., 2005), para proporcionar alívio da dor abdominal, a fim de
facilitar a broncoscopia, lavado bronco-alveolar, entubação nasogástrica, palpações retais não reprodutivas, a sutura de lacerações na pele, e castrações.
A alta concentração da detomidina nas apresentações comerciais permite a administração rápida intramuscular por causa do baixo volume injetado. A dose, em eqüinos, varia no intervalo 0,01-0,04 mg/kg IM. Na administração IV, a dose de 0,02 mg/kg induzem efeitos semelhantes aos da xilazina (1,1 mg / kg), embora os seus efeitos se estendam a 45 minutos. Combinação com opióide permite doses reduzidas (BELDA et al., 2005).
incluem redução transitória no ceco, do cólon e do fluxo sanguíneo no jejuno (REHMAN et al., 2013).
Éguas submetidas a ovarioectomia laparoscópica, sedadas utilizando a via intravenosa ou epidural, apresentaram respostas hormonais e comportamentais semelhantes aos estímulos dolorosos durante a cirurgia, sem haver diferença significativa entre as vias adotadas (VIRGIN et al., 2010).
2.5.2 Contraindicações
Cloridrato de detomidina não deve ser usado em cavalos com pré-existência de bloqueio atrioventricular (AV) ou sinoatrial (AS), com insuficiência coronariana grave, doença cerebrovascular, doença respiratória, ou insuficiência renal crônica. Sulfonamidas não devem ser utilizadas em cavalos anestesiados ou sedados como potencialmente pode ocorrer arritmias fatais (HSU, 2015).
2.5.3 Efeitos adversos
Cavalos tratados com detomidina apresentam Bradicardia rotineiramente, ocorrendo um minuto após a injeção. A relação entre a hipertensão e bradicardia é consistente como uma resposta adaptativa dos barorreceptores ao aumento da pressão e inconsistente com uma bradicardia induzida por droga principal. Piloereção, sudorese, salivação, tremores musculares e leve são freqüentemente vistos após a administração. Bloqueio atrioventricular parcial e sinoatrial pode ocorrer com a diminuição da freqüência cardíaca e respiratória. Micção normalmente ocorre durante a recuperação em cerca de 45-60 minutos após o tratamento, dependendo da dosagem. Incoordenação é normalmente vista apenas durante os primeiros 3-5 minutos após a injeção (PAPICK, 2012).
Ativação de receptores periféricos α2-adrenérgicos com o uso de detomidina
centralmente no resultado de tônus simpático em reduções da freqüência cardíaca
(FC) (PAKKANEN et al. 2015).
Em comparação com muitas outras espécies animais, a taxa de complicações totais em anestesia geral equina é alta. Uma causa importante para estas complicações é a depressão cardiovascular causada pela anestesia geral. Para além
dos efeitos cardiovasculares dos agonistas α2-adrenoceptores, agentes anestésicos
voláteis, também podem resultar em depressão cardiovascular significativa, reduzindo tanto a contratilidade do miocárdio como a resistência vascular periférica. A hipotensão resultante pode comprometer a perfusão muscular durante a anestesia, portanto, resultar em miopatia e neuropatia, prejudicando assim a recuperação e
aumentando a morbidade e mortalidade (PAKKANEN et al. 2015).
Devido à continuação da descida da cabeça durante a sedação, descargas nasais, ocasionalmente, edema da cabeça e do rosto pode ser visto. Segurando a cabeça em uma posição ligeiramente elevada geralmente impede estes efeitos.
Outros efeitos observados com a utilização dos agentes α2agonistas são: prolapso peniano, ataxia, ptose labial, abaixamento da cabeça, anorexia, glicosúria, diminuição da motilidade intestinal, aumento da tonicidade uterina, diminuição do hematócrito e relativo aumento da glicose sangüínea, estes dois últimos, respectivamente, por vasodilatação esplênica e por inibição da secreção de insulina mediada pela estimulação dos α2adrenoceptores (FANTONI et al., 1999). A diurese
ocorre como conseqüência da hiperglicemia produzida pelos α2agonistas (PAPICK, 2012).
Cloridrato de detomidina é bem tolerada em cavalos com dose de até 200 mcg / kg de peso corporal (10 vezes a dose baixa e 5 vezes a dose elevada). Em estudos de segurança em cavalos, cloridrato de detomidina a 400 mcg / kg de peso corporal, administrada diariamente durante 3 dias consecutivos produziu focos microscópicos de necrose miocárdica em 1 de 8 cavalos. Para Riviere e Papich, pode ser utilizado 1,0mg/kg de detomidina por via IM ou IV em cavalos.
Para Hsu (2013), cavalos tratados durante 03 dias consecutivos na dose 400ug/Kg, podem ocorrer necrose do miocárdio.
2.5.4 Dosagem e administração
Segundo Papick (2012), a detomidina para sedação pode ser administrada IV
ou IM às alíquotas de 20 ou 40 mcg/kg de peso corporal (0,2 ou 0,4 mL de Dormosedan® por 100 kg), dependendo da profundidade e duração da sedação necessária. O início dos efeitos sedativos deve ser alcançado dentro de 2-4 minutos após a administração IV e 3-5 minutos após a administração IM. Na dose de 20µg/kg, proporcionará 30-90 minutos de sedação e 40µg/kg, proporcionará cerca de 90 minutos a 2 horas de sedação.
A detomidina pode ser administrada por via intramuscular ou intravenosa, produzindo efeitos sedativo (WANAMAKER; MASSEY, 2014), relaxante muscular e analgésico, assim como pelas vias epidural ou subaracnoidea, para promover analgesia regional ou segmentária. É utilizada na medicação pré-anestésica, pois resulta em sedação dose-dependente (TRABACH et al., 2011).
Detomidina na dose 20mcg/Kg geralmente começa a ter efeito em 2-4 minutos e fornecer 30-45 minutos de analgesia. Na dose de 40 mcg/Kg também vai começar a ter efeito em 2-4 minutos e fornecer 45-75 minutos de analgesia.
Segundo Wanamaker e Massey (2014), mesmo cavalos fortemente sedados com a detomidina, podem responder ao estímulo com coices.
bisnaga de 3mL (PAPICK, 2012). Para Riviere e Papich, a dose da solução para uso oral pode conter 60ug/Kg.
2.5.5 Farmacocinética
Detomidina é um potente não-narcótico α2-agonista do adrenoceptor que produz um efeito de sedação em inibir a transmissão de impulsos nervosos mediada por noradrenalina. A pressão arterial é inicialmente aumentada devido à vasoconstrição periférica, posteriormente retorna para níveis normais normais ou ligeiramente abaixo. Vasoconstrição pode ser vista nas membranas e mucosas, que podem apresentar-se pálidas ou ligeiramente cianóticas. Esta resposta vasopressora inicial é acompanhado por uma diminuição compensatória na freqüência cardíaca mediada por barorreceptores vagal. O pulso periférico pode sentir-se fraco e uma alteração transiente na condutividade do músculo cardíaco pode ocorrer, tal como evidenciado no bloqueio atrioventricular. Outras arritmias podem ocorrer.
A detomidina também diminui a taxa respiratória e diminui a temperatura corpórea, podendo causar depressão da motilidade gastrointestinal, devido à diminuição da atividade do músculo liso, aumenta os níveis de glicose no sangue devido à inibição da liberação de insulina, e aumenta a produção de urina de 2 a 4 horas após o tratamento. Em alguns cavalos, provoca sudorese, salivação e leves tremores musculares podem ser vistos. Por causa da contínua descida da cabeça durante a sedação, descargas de muco nariz com inchaço ocasional da cabeça, particularmente em torno dos olhos, podem ser visto.
Para Hsu (2013) a meia vida da detomidina é de 1,2 horas quando administrada IV e 1,8 horas quando a aplicação é IM. O metabolismo de ácido carboxílico detomidina e hidroxidetomidine glucuronido e a excreção, posteriormente, para a urina parece ser a principal via de eliminação.
Efeito de primeira passagem resulta em uma porção muito pequena de droga atingindo circulação sistêmica se for ingerido. A sedação alcançada com o detomidina gel é atribuível à absorção sublingual do medicamento. As concentrações de pico ocorrem cerca de 1,83 horas após administração sublingual do gel. As concentrações de pico observadas após a administração do gel são cerca de 40% dos valores observados após a injeção intramuscular da solução de detomidina. A biodisponibilidade absoluta de detomidina em gel é de 22%.
Araujo et al. (2009) relatam que os efeitos sistémicos da detomidina são:
diminuição na frequência cardíaca; aumento do tempo da sístole, diástole, ou ambos; diminuição no volume de fluxo de sanguíneo e redução da velocidade do fluxo de sangue dentro da artéria ilíaca interna em estudo feitos com éguas. No entanto, o efeito da detomidina sobre a perfusão vascular local dos ovários e endométrio não foi detectada, concluindo que este sedativo não afetou a perfusão vascular nos órgãos reprodutores. Este sedativo pode ser utilizado em avaliações de cor Doppler experimentais e clínicas de perfusão vascular do corpo lúteo e endométrio.
Figura 03: Fórmula estrutural do cloridrato de detomidina
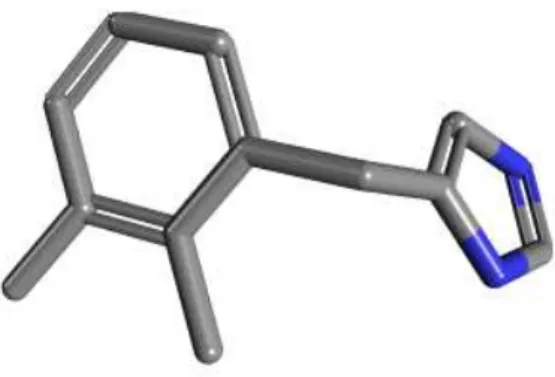
Figura 04: Estrutura tridimensional do cloridrato de detomidina
Fonte: http://pubchem.ncbi.nlm.nih.gov/com
uterotônico de ocitocina em éguas normais mas não em éguas com DUC. Os dados sugerem que as éguas com DUC têm um defeito na sinalização mioelétrica e uma redução na força contráctil do músculo uterino (REITZENSTEIN et al., 2002).
Na histereoscopia em éguas, a maioria dos profissionais tem protocolo de sedação próprio, a utilização do cloridrato de detomidina na dose de 0,006-0,01 mg / kg (IV), variação esta, dependendo do tamanho e temperamento da égua (BRINSKO, 2014).
O efeito de três sedativos α2-agonistas, detomidina (0,04 mg / kg), romifidina (0,08 mg / kg), xilazina (1,1 mg / kg) e o placebo (NaCl), sobre a pressão intra-uterina foi investigada com um modelo de balão intra-uterina em quatro éguas Warmblood não-gestantes. Aumentos dentro de 6.0 (+/- 2.2) min para pressão média de 9,80 (+/- 3,74), 6,88 (+/- 3,95) e 13,95 (+/- 5,19) mmHg foram registrados para detomidina, romifidina e xilazina, respectivamente. Placebo não teve efeito significativo. A duração média do aumento de pressão foi de 30,0 (+/- 5,10), 17,67 (+/- 9,87) e 19,50 (+/- 13,78) min para detomidina, Romifidina e xilazina, respectivamente. Não houve diferença significativa no grau e duração da sedação entre os três grupos de tratamento. Os α 2-agonistas exercem um aumento de pressão acentuada no útero, sem diferenças estatisticamente significativas em grau e duração entre as três substâncias. Com doses equipotentes nenhuma diferença na duração e grau de sedação pode ser calculada (SCHATZMANN et al., 1994).
A detomidina foi administrada ao longo de 10 gestações em oito éguas. Uma injeção intravenosa de 20µg/Kg de peso corporal foi dada semanalmente a partir do dia 14 até o dia 60 de gestação e, posteriormente, de quatro em quatro semanas até o parto . Embora estes dados tenham sido baseados em um pequeno número de éguas, eles não sugerem que a administração repetida de detomidina provoque efeitos adversos específicos sobre as prenhezes (KATILA; OIJALA, 1988).
Jedruch et al. (1989) estudaram a ação da detomidina na atividade elétrica
µg/Kg, não teve qualquer efeito sobre esta atividade. Os resultados sugerem que a detomidina nas doses de 20, 40 e 60 µg/Kg podem ser administradas para éguas durante o último trimestre de gravidez, sem o risco de aborto induzido por um aumento da atividade elétrica uterina.
As investigações sobre a presença dos receptores α2-adrenérgicos no miométrio de ovelhas, foram realizadas através da utilização de dois medicamentos, detomidina e xilazina. Detomidina aplicada às ovelhas sensibilizadas com estrógeno, resultou em intensificação da atividade mioelétrica uterina. No registro eletrouterográfico, a freqüência da descarga aumentou, enquanto os intervalos entre ciclos de descarga se reduziram. A duração da reação oscila entre 3 e 5,5 minutos. Depois do bloqueio dos receptores α2-adrenérgicos com ioimbina, um agonista seletivo, a detomidina não afetou o exame eletrouterográfico (DEJNEKA et al., 1998).
Ambos os subtipos de receptores adrenérgicos α1 e α2, ocorrem no útero de ovelhas, sensibilizados com estilbestrol durante o anestro. A estimulação dos receptores α1 ou α2 adrenérgicos causa aumento da atividade mioelétrica no útero (DEJNEKA et al., 1998).
Depois de bloquear os receptores α2 adrenérgicos com ioimbina, não houve reação característica após a aplicação de xilazina. Xilazina aplicada a ovelha sensibilizadas, da mesma forma que com a detomidina, resultou em aumento da atividade mioelétrica uterina. No registro eletrouterográfico, a frequência das descargas também aumentou e a duração da reação foi de 4 a 6 minutos, dependendo da dose (DEJNEKA et al., 1998).
A administração de atipamezole e tolazolina não antagonizam completamente os efeitos de detomidina em equinos, mas o decurso de tempo para a recuperação é encurtado (HUBBELL & MUIR, 2006).
A ioimbina (17a-hidroxiioimban-16a- acido carboxílico metilester) é um antagonista adrenérgico de receptores α2, encontrada na casca da árvore
Pausinystalia. Este fármaco atua como antagonista competitivo, irreversível,
apresentando dissociação lenta do receptor α2 (HOFFMAN et al., 1996).
Na medicina veterinária, a ioimbina tem sido utilizada como antagonista competitivo dos agonistas α2-adrenérgicos em equinos, cães, gatos, bovinos, ovelhas, animais silvestres e pequenos roedores. Nesses animais, a ioimbina tem sido utilizada em intoxicações causadas por xilazina, detomidina, romifidina e amitraz, revertendo de forma parcial ou total a ação desses fármacos, antagonizando seus efeitos sedativos e outros efeitos indesejáveis (ANDRADE, 2004).
O antagonismo nos receptores α2-adrenérgicos aumenta a liberação de noradrenalina nas terminações nervosas do sistema nervoso autônomo simpático, proporcionando o incremento na atividade deste sistema. Portanto, as ações da
ioimbina otimizam o sistema cardiovascular devido à estimulação dos receptores α no
coração e nos vasos periféricos, com consequente aumento da frequência cardíaca e da pressão arterial (ADAMS, 1992; ANDRADE, 2004).
A dose de ioimbina indicada para equinos é de 0,075-0,15mg/kg e tempo médio de ação de 106 minutos. As alterações observadas com a utilização deste fármaco incluem midríase, taquicardia, agitação, tremores musculares, aumento da ansiedade e salivação (VOLMER et al., 1994).
Um dos avanços mais importantes em anestesia veterinária na última década, tem sido a síntese de antagonistas para reversão de sedativos. Adquire especial relevância, a aplicação clínica de α2-antagonistas, tais como a ioimbina (BELDA et al., 2005).
A ioimbina é um eficaz α2-antagonista, pode causar uma hipertensão transitória, excitação do SNC, tremores musculares, salivação, aumento da frequência respiratória e mucosa hiperêmica. Reverte a analgesia induzida por α2-agonista em uso simples ou de combinações com quetamina, opióides ou outros tranqüilizantes
(BELDA et al., 2005).
A avaliação hemodinâmica do útero pode ser feita por dados espectrais coletados de vasos de grande porte, como da artéria uterina e as suas ramificações, ou a partir de avaliações subjetivas ou objetivas de endométrio, miométrio e mesométrio, que fornecem dados referentes a alterações locais e específicas da área avaliada (IGNACIO et al.,2011).
Ignacio et al.(2011), observaram que as diferenças do indice de resistência
(IR) não foram relacionados para o lado da ovulação. Mais tarde estudos confirmaram estas descobertas, não havendo diferença de perfusão entre as grandes artérias uterinas e também entre vasos do mesométrio anexo do corno ipsi e contralateral em relação à ovulação.
Entretanto, diferenças no fluxo uterino de sangue são observados durante o ciclo estral. Éguas não inseminadas, apresentam aumento da perfusão vascular (redução do índice de resistência - RI) no D5 (D0 = ovulação) que foi relacionada com a importância de um fornecimento de sangue elevada no momento da entrada do embrião no útero. Cerca de dois ou três dias antes da ovulação e no D0 ,um aumento na perfusão (redução do IR) seguida por redução (aumento no IR) até que foram detectadas as ovulações, provavelmente devido o aumento e diminuição nos níveis de estrogênio (efeito vasodilatador sobre os vasos uterinos) durante estes dias. Uma redução de perfusão também foi detectada no D15 (final do diestro) não relacionada com os níveis de estrogênio, mas por outros compostos vasoativos que podem estar a atuar. Portanto, alterações na perfusão uterina são correlacionadas com concentrações plasmáticas de estrogênio durante o estro, mas não durante o diestro (IGNACIO et al.,2011).
Em 2005, Silva et al., descreveram um avaliação subjetiva do endométrio e
miométrio e uma avaliação objetiva de dados espectrais recolhidos a partir de vasos do anexo mesométrio para avaliar alterações uterinas vasculares de perfusão.
precoces em cada égua. O fluxo sanguíneo foi expresso como a velocidade média de tempo máximo (TAMV) e o índice de resistência (RI). Em todas as gravidezes a vesícula embrionária pode ser detectado pela primeira vez no dia 11 (o dia da ovulação: Dia 0). Não há diferenças nos valores médios TAMV e Ri de ambas as artérias uterinas foram observadas em comparação com as correspondentes dias do ciclo estral, até o dia 11 de gravidez (P> 0,05). A partir do dia 11 em diante, os valores médios TAMV foram maiores e os valores médios do RI inferior a éguas gestantes do que em éguas cíclicas (P <0,05). Durante o ciclo estral valores TAMV e RI não diferiu entre o artérias uterinas esquerda (P> 0,05) e direito. A partir Dias 15 e 29 da gravidez, valores TAMV foram consistentemente mais elevados e IR com valores menores na artéria uterina homolateral ao concepto e eles tiveram um aumento mais distinta e declínio, respectivamente, em comparação com a artéria contralateral uterino (P <0,05). As estimativas dos componentes de variância para o efeito de égua em valores TAMV RI e durante a gravidez foram de 60 e 53%, respectivamente, e para o efeito de dia de gravidez, que eram 29 e 34%, respectivamente (P<0,0001). Não houve diferenças significativas entre as duas gestações com relação ao fluxo sangüíneo (P> 0,05). Os resultados mostram que os aumentos de fornecimento de sangue uterina em éguas durante a segunda semana de gravidez em comparação com éguas cíclicas. Além disso, há variações individuais no fluxo sanguíneo entre éguas (BOLLWEIN et al., 2003).
O fluxo sanguíneo uterino e ovariano foi investigado em quatro éguas, durante dois ciclos consecutivos, utilizando ultrassonografia transretal com Doppler colorido . As artérias uterinas e ovarianas de ambos os lados foram digitalizadas para obter ondas de velocidade do fluxo sanguíneo . O índice de pulsatilidade (IP) refletiu o fluxo sanguíneo. Havia tendências temporais significativas em valores de IP de todos os navios uterinas e sangue de ovário durante o ciclo estral (P < 0,05). Valores do IP não diferiu entre as artérias uterinas ipsi- e contralateral ao corpo lúteo ou folículo ovulatório (BOLLWEIN et al., 2003).
em níveis de estrógenos (E) totais. O aumento do fluxo sanguíneo parece estar relacionado com a eficácia da resposta à estimulação do ovário (WITT et al., 2012).
De acordo com Silva et al. (2005), éguas não-gestantes apresentam
vascularidade endometrial baixa e constante durante os 15 primeiros dias pós-ovulação (FERREIRA; MEIRA, 2011).
Ferreira et al. (2008) relataram que a perfusão vascular do útero (todas as
camadas combinados) foi estimada subjetivamente por um operador a partir das seções transversais de um corno, usando a função de Power Doppler. As configurações de ultra-som seguintes foram utilizados: limite de faixa de velocidade, 6,22 cm / s; Filtro de fluxo, 3; e taxa de quadros, 6 Hz. Só os sinais de cor que aparecem como estando dentro dos limites do útero foram consideradas. A perfusão vascular uterino foi estimado subjetivamente usando a percentagem de tecido uterino com sinais de cor de fluxo sanguíneo durante tempo real cross-secção do útero em um período contínuo de 1 min. Várias seções transversais foram visualizadas por causa dos movimentos de animais e uterinas e a variação resultante a partir de ângulos de insonação. Em éguas sem cistos (controles), foram utilizados regiões dos segmentos médio de chifres esquerda e direita.
O índice de pulsatilidade relaciona as velocidades sistólica e diastólica à velocidade média durante o ciclo cardíaco. É definido pela fórmula: IP = S – D /M (IP = índice de pulsatilidade; S = pico sistólico; D = pico diastólico; M = média das velocidades de fluxo durante o ciclo cardíaco) (BARBOSA, 2013).
2.8 Ultrassom
Ginther e Pierson (1984) demonstraram que a tecnologia de ultrassons proporciona uma forma não invasiva de acesso no útero de éguas para avaliar a fisiologia, alterações morfológicas e para detectar e estudar certos processos patológicos.
A espécie equina foi uma das mais utilizadas pelos pesquisadores pioneiros no desenvolvimento da ultrassonografia transretal para o exame in vivo do trato
reprodutivo. No início dos anos 80, essa técnica revolucionou o diagnóstico e o monitoramento de eventos reprodutivos biológicos e patológicos em programas de reprodução assistida (FERREIRA; MEIRA, 2011).
Em 1842, o pesquisador austríaco Johann Christian Doppler descreveu o efeito Doppler como a alteração na frequência de uma onda emitida ou refletida por um objeto que se encontra em movimento em relação ao observador. Seguindo este princípio, a ultrassonografia Doppler baseia-se na movimentação das hemácias em relação ao transdutor, de forma que alterações de velocidade e sentido do fluxo sanguíneo são representados por imagens com específicas cores e tonalidades (FERREIRA; MEIRA, 2011).