UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA
CURSO DE PÓS–GRADUAÇÃO EM QUÍMICA
LEÔNCIO MESQUITA DE SOUSA
ESTUDO FITOQUÍMICO DE
Macroptilium lathyroides
(L.) Urb. (FABACEAE)
ESTUDO FITOQUÍMICO DE
Macroptilium lathyroides
(l.) Urb. (FABACEAE)
Dissertação submetida à Coordenação do Programa de Pós-Graduação em Química, da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Mestre em Química.
Área de Concentração: Química Orgânica.
Orientador: Profa. Dra. Gilvandete Maria Pinheiro Santiago
S697e Sousa, Leôncio Mesquita de
Estudo fitoquímico de Macroptilium lathyroides (l.) Urb. (Fabaceae) / Leôncio Mesquita de Sousa. – 2011.
111 f. : il. color., enc.
Orientador: Profa. Dra. Gilvandete Maria Pinheiro Santiago Área de concentração: Química Orgânica
Dissertação (Mestrado) – Universidade Federal do Ceará, Centro de Ciências. Depto. de Química Orgânica e Inorgânica, Fortaleza, 2011.
1. Química vegetal 2. Macroptilium lathyroides 3. Plantas - Análise 4. Esteróides 5. Fabaceae I. Santiago, Gilvandete Maria Pinheiro (Orient.) II. Universidade Federal do Ceará – Programa de Pós-Graduação em Química III. Título
ESTUDO FITOQUÍMICO DE
À DEUS pelo dom da vida e pela concretização desse sonho.
Aos meus pais, Manoel Lino de Sousa e Maria Mesquita de Sousa por todos os
ensinamentos e sacrifícios que por mim fizeram para que eu me tornasse a pessoa que sou. E
aos meus irmãos Luzira Sandra, Zelândia e Leondino Cesar que sempre me apoiaram e me
estimularam.
Aos meus sobrinhos Cesar Filho, Liviane, Luana e Layana que me proporcionaram
muitos momentos de alegria e descontração.
A todos os meus professores, em particular, ao professor Manoel Andrade Neto, pelo
exemplo e apoio dados desde a preparação para o vestibular, nunca deixando de nos
acompanhar.
Aos meus colegas de faculdade pela convivência e a amizade. E aos meus
companheiros precistas pelo aprendizado e a cooperação.
Aos colegas e amigos de laboratório, Roberto Wagner e Michele Asley, pelo
companheirismo e atenção na rotina laboratorial.
À Professora Gilvandete Maria Pinheiro Santiago, um agradecimento cheio de carinho
e admiração. Sua orientação foi indispensável para a concretização deste trabalho,
transmitindo sempre sabedoria e conhecimento.
O carinho, o apoio e a ajuda que estas pessoas proporcionaram serão sempre
lembrados e farão parte do registro da minha história.
"As plantas brasileiras não curam, fazem milagres.”
Uma das práticas mais antigas no tratamento e na cura das enfermidades é sem
dúvida nenhuma, o uso dos produtos naturais, especialmente, os de origem vegetal. Até o
século XIX, os recursos terapêuticos eram predominantemente constituídos pela utilização de
partes das plantas e extratos vegetais. Com o avanço dos instrumentos científicos e
tecnológicos se estabeleceu a tendência de utilização das substâncias ativas presentes nas
plantas. Realizou-se a investigação fitoquímica dos galhos e talos e das raízes de
Macroptilium lathyroides. Esta espécie está inserida na subfamília Papilionoideae da família
Fabaceae. Do extrato em hexano dos talos e galhos foi isolada a mistura dos esteróides
sitosterol e estigmasterol (ML-1). Do extrato em hexano das raízes foram isolados a
lasiodiplodina (ML-2) e a mistura dos esteróides 6β-hidroxi-estigmast-4-en-3-ona e 6β -hidroxi-estigmast-4,22-dien-3-ona (ML-3) e do extrato em acetato de etila das raízes foram
isolados de-O-metil-lasiodiplodina (ML-4) e 4',5,7-triidroxiisoflavona (ML-5). Os compostos
isolados foram identificados através dos métodos espectroscópicos (IV, EM, RMN 1H e RMN 13
C), incluindo técnicas bidimensionais (HMBC, HSQC e COSY) e comparação com dados
da literatura. Os extratos obtidos foram avaliados quanto à atividade larvicida sobre Aedes
aegypti, mostrando-se, portanto, inativos. Este é o primeiro relato do estudo fitoquímico de
Macroptilium lathyroides, bem como da investigação da atividade larvicida dos extratos
obtidos.
Palavras-chave: Fabaceae; Papilionoideae; Macroptilium lathyroides; esteróides;
One of the oldest practices in the treatment and cure of diseases is undoubtedly the use of
natural products, especially those of vegetable origin. Until the nineteenth century, the
therapeutic resources were predominantly constituted by the use of plant parts and plant
extracts. With the advancement of scientific and technological instruments that set the trend
for the use of active substances in plants. In this work we present the phytochemical
investigation of the branches and stems, and roots of Macroptilium lathyroides. This species
is placed in the subfamily Papilionoideae of the Fabaceae family. The mixture of steroids
sitosterol and stigmasterol (ML-1) was isolated from hexane extract of stems and branches.
Lasiodiplodina (ML-2) and the mixture of steroid 6β-hydroxy-4-stigmasta en-3-one and 6β -hydroxy-4-stigmasta 4,22-dien-3-one (ML -3) were isolated from hexane extract of the roots
and from the ethyl acetate extract of the roots were isolated de-O-methyl-lasiodiplodina
(ML-4) and 4 ',5,7-triidroxiisoflavona (ML-5). The isolated compounds were identified by
spectroscopic methods (IR, MS, 1H and 13C NMR), including two-dimensional techniques
(HMBC, HSQC, COSY), and comparison with spectral data in the literature. The extracts
were evaluated for larvicidal activity against Aedes aegypti, showing, therefore, inactive. This
is the first report on the phytochemical study of Macroptilium lathyroides, as well as research
larvicidal activity of the extracts.
Keywords: Fabaceae, Papilionoideae; Macroptilium lathyroides; steroids; lasiodiplodina;
Tabela 01 - Flavonóides e esteróides isolados de espécies da subfamília
Faboideae... 25
Tabela 02 - Estrutura dos flavonóides e esteróides isolados de espécies da subfamília
Faboideae... 27
Tabela 03 - Comparação dos dados de RMN 13C – BB (125 MHz, CDCl3) de ML-1 com
os dos esteróides sitosterol e estigmasterol descritos na literatura
(FACUNDO et al., 2008)... 35
Tabela 04 - Dados de deslocamentos químicos (δ) de carbono-13 para ML-2, obtidos
por comparação entre os espectros de RMN 13C – BB e de RMN 13C –
DEPT 135°... 39
Tabela 05 - Dados de RMN 1H e 13C de ML-2 dispostos segundo as correlações obtidas
através dos espectros HSQC e HMBC e comparação com deslocamentos
químicos de RMN 1H e 13C da (R)-lasiodiplodina registrado na literatura
(LI et al., 2005)... 44
Tabela 06 - Dados de deslocamentos químicos (δ) de carbono-13 para ML-3, obtidos por comparação entre os espectros de RMN 13C – BB e de RMN 13C –
DEPT 135°... 50
Tabela 07 - Dados espectroscópicos de ML-3a comparados com dados da literatura
descritos na literatura (CORREIA; DAVID; DAVID, 2003) para 6β -hidroxi-estigmast-4-en-3-ona... 55
Tabela 08 - Dados espectroscópicos de ML-3b comparados com dados da literatura
descritos na literatura (ASHA et al., 2004) para 6β -hidroxi-estigmast-4,22-dien-3-ona... 56
Tabela 09 - Dados de deslocamentos químicos (δ) de carbono-13 para ML-4, obtidos
por comparação entre os espectros de RMN 13C – BB e de RMN 13C –
DEPT 135°... 62
Tabela 10 - Dados espectroscópicos de ML-4 comparados com os dados descritos na
literatura (RUDIYANSYAH; GARSON, 2006) para a
de-O-metil-lasiodiplodina... 67
Tabela 11 - Dados de deslocamentos químicos (δ) de carbono-13 para ML-6, obtidos
literatura (DEMUNER, et al., 2003) para a genisteína... 75
Tabela 13 - Dados referentes ao fracionamento cromatográfico de EHGTML... 83
Tabela 14 - Frações resultantes do fracionamento cromatográfico de EHGTML... 84
Tabela 15 - Dados referentes ao fracionamento cromatográfico de EHGTML (15-31)... 85
Tabela 16 - Frações resultantes ao fracionamento cromatográfico de EHGTML (15-31).. 86
Tabela 17 - Dados referentes ao fracionamento cromatográfico de EHRML... 88
Tabela 18 - Frações resultantes ao fracionamento cromatográfico de EHRML... 89
Tabela 19 - Dados referentes ao fracionamento cromatográfico de EHRML (475-569).... 90
Tabela 20 - Frações resultantes do tratamento cromatográfico de EHRML (475-569)... 90
Tabela 21 - Dados referentes ao tratamento cromatográfico de EHML (42 -159)... 91
Tabela 22 - Frações resultantes do tratamento cromatográfico de EHRML (42-159)... 91
Tabela 23 - Dados referentes ao tratamento cromatográfico de EHML (39-112)... 92
Tabela 24 - Frações resultantes do tratamento cromatográfico de EHRML (39-112)... 92
Tabela 25 - Dados referentes ao fracionamento cromatográfico de EARML... 93
Tabela 26 - Frações resultantes do fracionamento cromatográfico de EARML... 93
Tabela 27 - Dados referentes ao fracionamento cromatográfico de EARML (11-14)... 94
Tabela 28 - Frações resultantes do fracionamento cromatográfico de EARML (11-14)... 94
Tabela 29 - Dados referentes ao fracionamento cromatográfico de EARML (17-48)... 95
Tabela 30 - Frações resultantes do fracionamento cromatográfico de EARML (17-48)... 95
Tabela 31 - Dados referentes ao tratamento cromatográfico de EARML (60-80)... 96
Tabela 32 - Frações resultantes do tratamento cromatográfico de EARML (60-80)... 96
Tabela 33 - Dados referentes ao tratamento cromatográfico de EARML (15-16)... 97
Tabela 34 - Frações resultantes do tratamento cromatográfico de EARML (15-16)... 97
Tabela 35 - Dados referentes ao tratamento cromatográfico de EARML (265-310)... 98
Figura 01 - Foto de Macroptilium lathyroides em Pentecoste – CE... 24
Figura 02 - Estruturas do sitosterol e do estigmasterol... 34
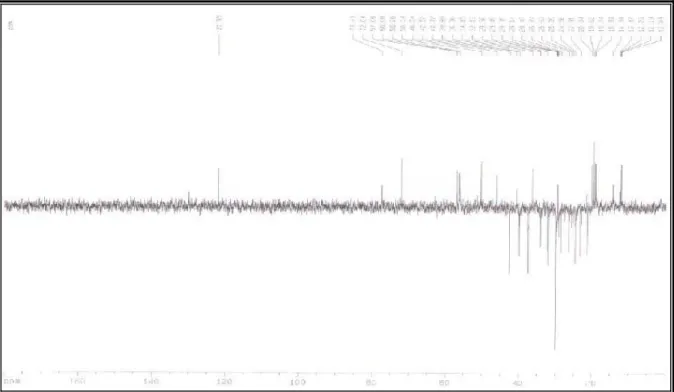
Figura 03 - Espectro de RMN 1H (500 MHz; CDCl3) de ML-1... 36
Figura 04 - Espectro de RMN 13C – BB (125 MHz, CDCl3) de ML-1... 36
Figura 05 - Espectro de RMN 13C – DEPT 135° (125 MHz, CDCl3) de ML-1... 37
Figura 06 - Estrutura da Lasiodiplodina... 43
Figura 07 - Fragmentos propostos para os principais picos observados no espectro de massas de ML-2... 43
Figura 08 - Estrutura da (R)-lasiodiplodina... 44
Figura 09 - Espectro na região do IV de ML-2 (em KBr)... 45
Figura 10 - Espectro de massa (i.e. 70 eV) de ML-2... 45
Figura 11 - Espectro de RMN 1H (500 MHz, CDCl3) de ML-2... 46
Figura 12 - Espectro de RMN 13C – BB (125 MHz, CDCl3) de ML-2... 46
Figura 13 - Espectro de RMN 13C – DEPT 135o (CDCl3) de ML-2... 47
Figura 14 - Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de ML-2... 47
Figura 15 - Espectro bidimensional de correlação heteronuclear 1H x 13C-HMBC de ML-2... 48
Figura 16 - Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de ML-2... 48
Figura 17 - 6β-Hidroxi-estigmast-4-en-3-ona e 6β-hidroxi-estigmast-4,22-dien-3-ona…. 54 Figura 18 - Espectro na região do IV (em KBr) de ML-3... 57
Figura 19 - Espectro de massa (i.e. 70 eV) de ML-3... 57
Figura 20 - Espectro de RMN 1H (500 MHz, CDCl3) de ML-3... 58
Figura 21 - Espectro de RMN 13C – BB (125 MHz, CDCl3) de ML-3... 58
Figura 22 - Espectro de RMN 13C – DEPT 135o (125 MHz, CDCl3) de ML-3... 59
Figura 23 - Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de ML-2... 59
Figura 24 - Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de ML-3... 60
Figura 27 - Espectro na região do IV (em KBr, cm-1) de ML-4... 67
Figura 28 - Espectro de RMN 1H (δ, 500 MHz, CDCl3) de ML-4... 68
Figura 29 - Espectro de RMN 13C (δ, 125 MHz, CDCl3) de ML-4... 68
Figura 30 - Espectro de RMN 13C DEPT 135° (δ, 125 MHz, CDCl3) de ML-4... 69
Figura 31 - Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de ML-4... 69
Figura 32 - Espectro bidimensional de correlação heteronuclear 1H x 13C-HMBC de ML-4... 70
Figura 33 - Espectro bidimensional de correlação homonuclear 1H x 1H – COSY de ML-4... 70
Figura 34 - Estrutura da genisteína (4',5,7-triidroxiisoflavona)... 75
Figura 35 - Espectro na região do IV (em KBr, cm-1) de ML-5... 76
Figura 36 - Espectro de RMN 1H (500 MHz, CD3OD) de ML-5... 76
Figura 37 - Espectro de RMN 13C (25 MHz, CD3OD) de ML-5... 77
Figura 38 - Espectro bidimensional de correlação heteronuclear 1H x 13C – HSQC de ML-5... 77
Fluxograma 01 - Obtenção dos extratos em hexano, acetato de etila e metanol dos talos
e galhos de Macroptilium lathyroides e isolamento de ML-1... 87
Fluxograma 02 - Obtenção dos extratos em hexano, acetato de etila e metanol das raízes
de Macroptilium lathyroides e isolamento de ML-2, ML-3, ML-4 e
LISTA DE SIGLAS E AVREVIATURAS
BB – Broad Band
c – Concentração
CCD – Cromatografia em camada delgada
CENAUREMN – Centro Nordestino de Aplicação e Uso da Ressonância Magnética
Nuclear
CDCl3 – Clorofórmio deuterado
CHCl3 – Clorofórmio
COSY – Correlation Spectroscopy
d – Dubleto
DMSO-d6– Dimetilsulfóxido deuterado
dd – Duplo dubleto
DEPT – Distortionlesss Enhancement by Polarization Transfer
EABA – Extrato em acetato de etila de B. acuruana
EM – Espectrometria de massa
EHGTML – Extrato em hexano dos galhos e talos de M. lathyroides
EAGTML – Extrato em acetato dos galhos e talos de M. lathyroides
EEGTML – Extrato em etanol dos galhos e talos de M. lathyroides
EHRML – Extrato em hexano das raízes de M. lathyroides
EARML – Extrato em acetato das raízes de M. lathyroides
EERML – Extrato em etanol das raízes de M. lathyroides
eV – Elétrons volts
HMBC – Heteronuclear Multiple Bond Connectivity
HSQC – Heteronuclear Single Quantum Coherence
IV – Infravermelho
J – Constante de acoplamento
L – Comprimento
m – Multipleto
MeOH-d4– Metanol deuterado
MeOH – Metanol
MHz - Megahertz
multip – Multiplicidade
RMN 1H – Ressonância Magnética Nuclear de Hidrogênio
RMN 13C – Ressonância Magnética Nuclear de Carbono-13
s – Singleto
sl – Singleto largo
t – Tripleto
LISTA DE SÍMBOLOS
α - Alfa
β -Beta
δ - Deslocamento químico
Φ - Diâmetro
1 INTRODUÇÃO... 19
2 CONSIDERAÇÕES BOTÂNICAS... 22
2.1. Considerações botânicas sobre a família Fabaceae... 22
2.2. Considerações botânicas sobre a subfamília Faboideae... 23
2.3. Considerações botânicas sobre o gênero Macroptilium... 23
2.4. Considerações botânicas sobre a espécie Macroptilium lathyroides (L.) Urb... 23
3 LEVANTAMENTO BIBLIOGRÁFICO... 25
3.1. Levantamento bibliográfico sobre a subfamília Faboideae (Papilionoideae)... 25
4 RESULTADOS E DISCUSSÃO 32 4.1 Estruturas das substâncias isoladas de Macroptiliumlathyroides... 32
4.2 Determinação estrutural dos metabólitos secundários isolados de Macroptilium lathyroides... 33
4.2.1 Determinação estrutural de ML-1... 33
4.2.2 Determinação estrutural de ML-2... 38
4.2.3 Determinação estrutural de ML-3... 49
4.2.4 Determinação estrutural de ML-4... 61
4.2.5 Determinação estrutural de ML-5... 71
4.3 Avaliação do potencial larvicida dos extratos sobre Aedes aegypti... 79
5 PROCEDIMENTO EXPERIMENTAL... 80
5.1. Material vegetal... 80
5.2. Métodos analíticos... 80
5.2.1. Métodos cromatográficos... 80
5.3. Métodos Espectrométricos... 81
5.3.1. Espectroscopia na região do infravermelho (IV)... 81
5.3.2. Espectroscopia de ressonância magnética nuclear (RMN)... 81
5.3.3. Espectrometria de massa (EM)... 82
5.4.2. Determinação da rotação óptica específica [α]D20... 82
5.5. Estudo dos constituintes fixos de Macroptilium lathyroides... 83
5.5.1. Obtenção dos extratos em hexano, em acetato de etila e em etanol dos galhos e talos de Macroptilium lathyroides... 83
5.5.1.1. Fracionamento cromatográfico de EHGTML... 83
5.5.1.1.1. Tratamento cromatográfico de EHML (15-31) e isolamento de ML-1... 84
5.5.2. Obtenção dos extratos em hexano, em acetato de etila e em etanol das raízes de Macroptilium lathyroides... 88
5.5.2.1. Fracionamento cromatográfico de EHRML... 88
5.5.2.1.1. Fracionamento cromatográfico de EHRML (475-569)... 89
5.5.2.1.1.1. Tratamento cromatográfico de EHRML (42-159) e isolamento de ML-2... 90
5.5.2.1.1.1.1. Tratamento cromatográfico de EHRML (39-112) e isolamento de ML-3... 91
5.5.2.2. Fracionamento cromatográfico de EARML... 92
5.5.2.2.1. Fracionamento cromatográfico de EARML (11-14)... 93
5.5.2.2.1.1. Fracionamento cromatográfico de EARML (17-48)... 94
5.5.2.2.1.1.1. Tratamento cromatográfico de EARML (60-80) e isolamento de ML-4... 95
5.5.2.2.2. Fracionamento cromatográfico de EARML (15-16)... 96
5.5.2.2.2.1. Tratamento cromatográfico de EARML (185-213) e isolamento de ML-5... 97
5.6 Biensaios sobre larvas de Aedes aegypti... 100
6 CONSIDERAÇÕES FINAIS... 101
7 CONSTANTES FÍSICAS E DADOS ESPECTROSCÓPICOS... 102
1 INTRODUÇÃO
Uma das práticas mais antigas no tratamento e na cura das enfermidades é sem
dúvida nenhuma, o uso dos produtos naturais, especialmente, os de origem vegetal. Nesse
contexto, as plantas foram um dos primeiros recursos terapêuticos utilizados pela humanidade
(TOMAZZONI; NEGRELLE; CENTA, 2006).
As antigas civilizações utilizavam algumas plantas como alimento e outras com
fins terapêuticos. As experiências com ervas tiveram sucessos e fracassos, sendo que, muitas
vezes, estas curavam e em outras matavam ou produziam efeitos colaterais severos
(TOMAZZONI; NEGRELLE; CENTA, 2006). Dessa forma, os recursos vegetais utilizados
de maneira empírica foram, mundialmente, as principais alternativas na busca do acesso aos
cuidados básicos de saúde (FOGLIO et al., 2006).
Até o século XIX, os recursos terapêuticos eram predominantemente constituídos
pela utilização de partes das plantas e extratos vegetais. Com o avanço dos instrumentos
científicos e tecnológicos se estabeleceu a tendência de utilização das substâncias ativas
presentes nas plantas, cujas descobertas propiciaram uma revolução cientifica e tecnológica,
enriquecendo rapidamente o arsenal terapêutico (ESTEVAM, 2006).
Diante deste contexto, as plantas medicinais continuam sendo usadas em todo o
mundo para o tratamento de doenças e, a partir delas, novas drogas são desenvolvidas através
da pesquisa de seus constituintes, na busca de minimizar os efeitos colaterais (DREYFUS;
CHAPELA; GULLO, 1994; PHILLIPSON, 2001). Com o advento da Química de Produtos
Naturais, as plantas começaram a ser objetos de estudos, com a finalidade de utilização das
suas substâncias ativas isoladas (metabólitos secundários) para aperfeiçoar o processo de cura
das enfermidades (FOGLIO et al., 2006).
O estudo dos constituintes de plantas tem sido o principal objetivo da Química de
Produtos Naturais. A busca por compostos que possuam algum tipo de atividade seja esta
biológica ou farmacológica, tem sido nos últimos anos, de interesse de pesquisadores e
indústrias, na esperança do seu uso como, por exemplo, em medicamentos.
Os recentes avanços na Química de Produtos Naturais têm contribuído para um
conhecimento mais acurado da composição química das plantas, e permitem revelar a
bioatividade de muitas substâncias naturais, pela descoberta desses metabólitos ativos
isolados e identificados, possibilitando desta forma a validação do uso terapêutico das plantas
Capítulo 1 – Introdução
Deste modo, os estudos são necessários a fim de possibilitar à população uma
melhor qualidade de vida e evitar alguns problemas como a utilização errada de espécies
vegetais, dosagens incorretas, ausência de um controle que possa garantir segurança e
qualidade no uso dos fitoterápicos (CALIXTO, 2000).
No Brasil, propriedades biológicas de grande interesse medicinal têm sido
reveladas em estudos com espécies vegetais pertencentes à família Fabaceae, as quais são
adaptadas ao clima tropical (ANTUNES et al., 2001). Ainda no século XIX, Von Martius
definiu bem a capacidade das plantas medicinais brasileiras, com a célebre frase: "as plantas
medicinais brasileiras não curam apenas, fazem milagres" (BORRÁS, 2003). Do exposto
associado ao fato de o Brasil ser detentor da maior biodiversidade do Planeta, evidencia a
vocação científica para a área mais antiga da Química: a Química dos Produtos Naturais
(PINTO et al., 2002).
Todo esse conjunto de fatos apresentados justifica a necessidade de aprofundar os
estudos com os recursos naturais brasileiros, especialmente com as plantas tidas como
medicinais. Em vista disso, cabe ressaltar que, dentre as diversas plantas medicinais
brasileiras utilizadas na terapêutica popular, destacam-se espécies da família Fabaceae, como
por exemplo, Clitoria ternatea L., Pterodon pubenscens Benth, Butea frondosa Koen, que por
apresentarem propriedades biológicas notáveis, motivaram o estudo de uma espécie vegetal
pertencente a essa família.
De maneira indireta, este tipo de cultura medicinal desperta o interesse de
pesquisadores em estudos envolvendo áreas multidisciplinares, como por exemplo, botânica,
farmacologia e fitoquímica, que juntas enriquecem os conhecimentos sobre a inesgotável
fonte medicinal natural: a flora mundial.
O objetivo deste trabalho foi realizar o estudo químico, o qual compreende o
isolamento, a purificação e determinação da estrutura molecular dos metabólitos secundários,
da espécie Macroptilium lathyroides (L.) Urb. (Fabaceae), utilizando técnicas cromatográficas
e espectrométricas.
Com base em levantamento bibliográfico realizado no Sci Finder® SchoolTM para
a espécie Macroptilium lathyroides (L.) Urb (Fabaceae), nenhum estudo fitoquímico foi
encontrado. A ausência de relatos na literatura sobre a composição química de Macroptilium
lathyroides (Fig. 1, p. 24) e sabendo-se que esta espécie pertence à família Fabaceae, rica em
flavonóides, alcalóides, terpenóides e esteróides (SILVA, 2007), nos serviram como estímulo
sobre Aedes aegypti, buscando encontrar compostos que possam ser utilizados como
larvicidas.
Este trabalho encontra-se dividido em oito capítulos: Introdução (Capítulo 1);
Considerações Botânicas (Capítulo 2); Levantamento Bibliográfico (Capítulo 3), Resultados e
Discussão (Capítulo 4); Procedimento Experimental (Capítulo 5); Considerações Finais
Capítulo 2 – Considerações Botânicas
2 CONSIDERAÇÕES BOTÂNICAS
2.1 Considerações botânicas sobre a família Fabaceae
A família Fabaceae (Leguminosae) constitui uma das três maiores famílias entre
as angiospermas, juntamente com Orchidaceae e Asteraceae (JUDD et al., 2009). É uma das
maiores dicotiledôneas composta por três subfamílias: Faboideae (ou Papilionoideae),
Caesalpinioideae (ou Caesalpiniaceae) e Mimosoideae (ou Mimosaceae), compreendendo
cerca de 730 gêneros e 19.300 espécies (LEWIS et al., 2005). Uma característica típica dessa
família é apresentar o fruto do tipo legume, também conhecido como vagem, podendo haver
exceções.
A família está distribuída nas regiões tropicais, subtropicais e temperada do globo.
As espécies pertencentes a esta família são particularmente ricas em flavonóides, alcalóides,
terpenóides e esteróides. Os taninos têm freqüência muito baixa se comparada aos flavonóides
isoflavonóides (SILVA et al., 2007).
De modo geral, as espécies da família Fabaceae caracterizam-se pelo hábito
bastante variado, desde minúsculas ervas, arbustos, subarbustos, trepadeiras até gigantescas
árvores. Vegetando-se nos mais variados ambientes, como campos, matas, desertos, neves,
brejos, nas diferentes latitudes e altitudes (BARROSO, 1991; BARROSO et al., 1999).
Esta família é considerada a maior no Brasil, com 3.200 espécies e 176 gêneros,
dos quais 31 são endêmicos, e está representada em todos os biomas brasileiros, sempre com
um conjunto de espécies e gêneros endêmicos. Dentre as espécies florestais nativas,
destacam-se gêneros como: Dalbergia (jacarandá-da-bahia e violeta), Dipteryx (baru e
cumaru-ferro), Erytrina (corticeiras ou suinãs) e Machaerium (jacarandás) (GIULIETTI et al.,
2005).
Do ponto de vista ecológico, as espécies pertencentes à família Fabaceae constam
do elemento principal de diferentes formações vegetais, desde os picos das serras
montanhosas até o litoral arenoso, e da floresta úmida tropical até desertos, havendo até
espécies aquáticas. A maioria das espécies apresenta nódulos radiculares associados a
bactérias fixadoras de nitrogênio (Rhizobium), sendo grandes fornecedoras de adubos
naturais, o que pode minimizar impactos ambientais e viabilizar reflorestamentos por
2.2 Considerações botânicas sobre a subfamília Faboideae
Papilionoideae ou Faboideae é a maior subfamília de Leguminosae apresentando
cerca de 500 gêneros e 13.800 espécies (LEWIS et al., 2005). Suas folhas são
predominantemente trifolioladas, com exceções das primárias que são simples, sendo rara
com um ou mais do que três folíolos. As flores são hermafroditas, fortemente zigomorfas, em
geral vistosas. Já o caule é, também, extremamente variado. O fruto característico é uma
vagem ou legume, raramente indeiscente (BARROSO, 1991; BARROSO et al., 1999).
As sementes e frutos de muitos gêneros de Papilionoideae são ricas em proteínas,
vitaminas, carboidratos e minerais, constituindo importante fonte de alimento para homens e
animais. As leguminosas como feijão (Phaseolus), soja (Glycine), grão-de-bico (Vicia),
amendoim (Arachis) e ervilha (Pisum), são apenas algumas dos exemplares desses recursos
alimentícios (RIBEIRO et al., 1999).
2.3 Considerações botânicas sobre o gênero Macroptilium
O gênero Macroptilium originalmente considerado como uma seção de Phaseolus,
sendo elevado ao status genérico por Urbano a partir de 1928, que considerou diferenças
morfológicas e distribuição geográfica restrita ao continente americano (MATOS; ARTILES,
2005). Macroptilium (Benth.) Urb. é monofilético (ESPERT, DREWES, BURGHARDT,
2007).
As plantas pertencentes ao gênero Macroptilium (Benth.) Urb. compreendem
cerca de 20 espécies de distribuição restrita às Américas. Algumas espécies deste gênero são
usadas como forrageiras, adubo verde e na medicina (BARBOSA-FEVEREIRO, 1986). Este
gênero, até o momento, foi tema de poucas pesquisas no Brasil.
2.4 Considerações botânicas sobre a espécie Macroptilium lathyroides (L.) Urb.
Macroptilium lathyroides (L.) Urb. é uma leguminosa originária da parte tropical da América do Sul e foi introduzida na Índia tropical e subtropical, Austrália, África e Sudeste da
América do Norte. Essa espécie é uma trepadeira, pertencente à família das leguminosas, subfamília
papilionoídea, sendo considerada uma planta nativa das Guianas, Brasil e Paraguai, cultivada como
Capítulo 2 – Considerações Botânicas
M. lathyroides é uma planta anual ou bianual, com altura de 60 a 80 cm, de caules eretos que crescendo junto com gramíneas de porte alto, pode adquirir o hábito de enrolamento e alcançar
150 cm de altura. Tal espécie possui caules eretos e flores vermelho-violáceas ou azul-violáceas.
Também é conhecida pelos nomes de feijão-de-pombinha e feijão-de-rola, tem hábito de crescimento
indeterminado, apresenta intensa deiscência de vagens maduras e é uma planta indiferente ao
fotoperíodo (FERREIRA, 2002).
Leguminosas forrageiras originárias de regiões de clima tropical e subtropical têm
sido recomendadas para melhorar a qualidade nutritiva das pastagens. Macroptilium
lathyroides é uma boa produtora de matéria seca, pouco exigente em fertilidade, que pode se
regenerar pelo banco de sementes do solo (FEREIRA; MONKS; AFFONSO, 2001) e
adaptada à precipitação anual de 475 a 3000 mm ou mais. A Figura 01 mostra a foto de um
espécime de Macroptilium lathyroides em Pentecoste – CE.
3 LEVANTAMENTO BIBLIOGRÁFICO
3.1 Levantamento bibliográfico sobre a subfamília Faboideae (Papilionoideae)
Neste levantamento bibliográfico são destacados os esteróides e flavonóides
dentre os metabólitos secundários isolados em espécies de vegetais pertencentes à subfamília
Faboideae. Os dados fornecidos foram coletados de artigos publicados até junho de 2011,
através de pesquisas realizadas no Sci Finder® ScholarTM e são mostrados na Tabela 01.
Nessa mesma pesquisa não foram encontrados registros sobre a ocorrência dos
metabólitos secundários da classe das lactonas macrocíclicas, tais como lasiodiplodina e
de-O-metil-lasiodiplodina na subfamília Faboideae. Sobre a espécie em estudo foi encontrada
uma publicação sobre a existência de antocianinas no extrato bruto das pétalas de suas flores
(RAMOS; CAVALHEIRO; CAVALHEIRO, 2006) e outra sobre a identificação dos
flavonóides, quercetina e canferol, nas suas flores e folhas (WILLIAMS; ONYILAGHA;
HARBORNE, 1995).
Tabela 01: Flavonóides e esteróides isolados de espécies da subfamília Faboideae
Espécie Compostos Isolados Referência
Desacil-gladiatose A-Canferol (1)
Ateleia chicoasensis
3-[(O-6-deoxi-α-L-manopiranosil-(1→ 6)-O-[β-D-glicopiranosil-(1→2)]-β -D-galactopiranosil)oxi7-[(6-deoxiα -L- manopiranosil)oxy]-5-hidroxi-2-(4- hidroxi-3-metoxifenil)-4H-1-Benzopiran-4-ona (2)
VEITCH et al., 2005
Versulina (3) Violantina (4)
Cadia ellisiana
7-O-β-Neohesperidose- Apigenina (5)
PARIS; FAUGERAS; PELTIER, 1974
Formononetina (6) Epicatequina (7) Ononina (8) Afromosina (9)
Epigallocatequina (10) Sissotrina (11)
Hedysarum kirghisorum
Plumbocatequina A (12)
LIU et al., 2005
Capítulo 3 – Levantamento Bibliográfico
Tabela 01: Continuação
Espécie Compostos Isolados Referência
Tefrosina (13)
cis-12a-Hidroxirotenona (14) Rotenona (15)
Villosinol (16) Flavona (17) Maackiaina (18)
Obovatina-Metil-Éter (19) Candidona (20)
(S)-Isoglabracromeno (21)
Lonchocarpus aff.
fluvialis
1-(1,3-benzodioxol-5-il)-2-(1,1-dimetil-2- propen-1-il)-3-(4-metoxi-5-benzofuranil)-1,3-Propanediona (22)
BLATT at al., 2002
2,3-diidro-5,7-diidroxi-6-(3-metil-2-buten-1-il)-2-fenil-4H-1-Benzopiran-4-ona (23)
Lonchocarpus haberi
2,3-diidro-5,7-diidroxi-8-(3-metil-2-buten-1-il)-2-fenil-4H-1-Benzopiran-4-ona (24)
VOGLER et al., 2006
Sophoretina (25)
Pentaacetato de Patuletina (26) Gossipitrina (27)
Quercimeritrina (28) Petuletina (29) Cosmosiina (30) Patulitrina (31) Nephrocizina (32)
3'-O-Metil-quercetina (33) Acetato de quercetina (34)
Matricaria chamomilla
Hexaacetato de Luteolosídeo (35)
HOERHAMMER; WAGNER; SALFNER, 1963
Isoquercetrina (36)
3-O-ramnose-Canferol (37) Cloreto de Cianina (38)
3,5-di-O-Glicose-Malvidina (39)
Millettia zechaina
Pelargonidina (40)
PERVEZ; OGBEIDE, 1990
Sitosterol (41)
Ononis natrix
Estigmasterol (42)
GORUNOVIC; ABDEL-GAWAD, 1974
3-O-Glicose-Sitosterol (43) 3-O-Glicose-Estigmasterol(44)
Isowighteona (45)
Sophoraisoflavanona A (46) Sophoraflavanona G (47)
Sophora pachycarpa
Alopecurona A (48)
EMAMI et al., 2007
Tipuana tipu Sitosterol (41) PEREIRA; DE
Capítulo 3 – Levantamento Bibliográfico HO O OH O OH OH OH O 29 O O OH O OH OH O HO HO HO OH 30 O O OH O OH OH OH O HO HO HO OH O 31 O O OH O OH OH O HO HO HO OH 32 HO O OH O OH OH O 33 AcO O OAc O OAc OAc OAc 34 O O O OAc OAc O OH AcO AcO AcO OAc 35 O HO OH O OH OH O O OH OH OH OH 36 O HO OH O OH O O OH OH OH 37 O O O OH OH HO + O O OH HO HO HO HO HO OH
HO
.
ClO O O OH O HO + O O OH OH HO HO HO HO OH
HO .Cl
Capítulo 4 – Resultados e Discussão ML-1 ML-2 ML-4 ML-3 ML-5 4 RESULTADOS E DISCUSSÃO
4.1 Estruturas das substâncias isoladas de Macroptiliumlathyroides
1 2 3 4 5 6 7 8 14 15 16 17 20 21 22 23 24 25 26 27 29 28 13 18 12 11 9 10 19
HO Δ 5 − Sitosterol
Δ 5,22 − Εstigmasterol
4.2 Determinação estrutural dos metabólitos secundários isolados de Macroptilium lathyroides
4.2.1 Determinação estrutural de ML-1
O tratamento cromatográfico da fração (15-31) do extrato em hexano dos galhos e
talos de M. lathyroides (EHGTML, item 5.5.1.1.1, p. 84), resultou no isolamento de 117,1 mg
de um sólido cristalino em forma de agulhas, incolor, solúvel em clorofórmio, com ponto de
fusão na faixa entre 142,9 a 144,8 °C. O referido composto por análise em CCD mostrou uma
mancha de coloração azulada após revelação com solução de vanilina em ácido perclórico e
etanol e foi denominado de ML-1.
No espectro de RMN 1H (500 MHz, CDCl3, Fig. 03, p. 36) de ML-1, destaca-se a
presença de um sinal em δ 5,35 (sl, 1H, H-6), sugerindo a presença de hidrogênio olefínico,
outro sinal em δ 3,53 (septeto, 1H, H-3) relativo ao hidrogênio ligado ao carbono carbinólico.
Foi observado também neste espectro, um grande número de sinais na região entre δ 0,5 – 2,5,
os quais foram atribuídos a átomos de hidrogênio metínicos, metilênicos e metílicos ligados a
carbonos sp3 de esqueletos esteroídicos ou triterpênicos. Observou-se ainda dois duplos
dubletos em δ 5,15 (dd, J = 15,1 e 8,5 Hz, H-22) e δ 5,02 (dd, J = 15,1 e 8,7 Hz, H-23),
atribuídos aos hidrogênios olefínicos, presente na cadeia lateral do estigmasterol.
O espectro de RMN 13C – BB (125 MHz, CDCl3, Fig. 04, p. 36) de ML-1
apresentou 36 linhas espectrais. Os sinais em δ 140,97 e δ 121,95 foram atribuídos aos átomos
de carbono da ligação dupla entre C-5 e C-6, enquanto o sinal em δ 72,02 foi atribuído ao
carbono carbinólico C-3, comum aos esteróides sitosterol e estigmasterol. Os sinais em δ
138,54 e δ 129,49 foram atribuídos aos carbonos C-22 e C-23 do estigmasterol. A
comparação dos espectros de RMN 13C – BB e RMN 13C – DEPT 135o (125 MHz, CDCl3,
Fig. 05, p. 37) permitiu concluir o padrão de hidrogenação dos sinais de carbonos olefínicos
em δ 140,97 (C-5), 121,95 (C-6), 138,54 (C-22) e 129,49 (C-23).
A análise dos dados espectroscópicos obtidos e a comparação com dados descritos
na literatura (FACUNDO et al., 2008) (Tab. 03, p. 35), permitiram identificar ML-1 como a
Capítulo 4 – Resultados e Discussão 1 2 3 4 5 6 7 8 14 15 16 17 20 21 22 23 24 25 26 27 29 28 13 18 12 11 9 10 19
HO Δ 5 − Sitosterol
Δ 5,22 − Εstigmasterol
Figura 02 – Estruturas do sitosterol e do estigmasterol
As percentagens aproximadas dos dois constituintes na mistura foram calculadas
com base na integração dos sinais correspondentes aos átomos de hidrogênio H-6 (intensidade
relativa: 1,00 para os dois esteróides) e H-22 e H-23 (intensidade média relativa: 0,685 para
estigmasterol). A metade de 0,685 (0,685/2=0,3425) representou um hidrogênio da molécula
do estigmasterol. Subtraindo-se este valor 0,3425 de 1,00 (H-6 dos dois esteróides) obteve-se
a intensidade 0,6575 correspondente a um hidrogênio da molécula de sitosterol. As
intensidades relativas 0,3425 (1H de estigmasterol) e 0,6575 (1H de sitosterol) permitiram
sugerir que a mistura [1,00 (mistura dos dois esteróides)=100%] contêm 34,25% de
estigmasterol e 65,75% de sitosterol (GOULART et al., 1993).
Em levantamento bibliográfico (GALOTTA; BOAVENTURA, 2005) pode ser
verificado que o sitosterol apresenta-se, em geral, distribuído em todas as partes das plantas e,
quando isolado em mistura com o estigmasterol, está praticamente sempre em maior
proporção.
No entanto, observa-se que dificilmente se consegue isolar, de fonte vegetal ou
animal, um esteróide em forma pura, devido à semelhança química e física destas substâncias.
No caso vegetal, em geral ocorre uma mistura de esteróides, a mais freqüente constituída
Tabela 03 – Comparação dos dados de RMN 13C – BB (125 MHz, CDCl3) de ML-1 com os dos esteróides sitosterol e estigmasterol descritos na literatura (FACUNDO et al., 2008).
Sitosterol (CDCl3) Estigmasterol (CDCl3)
ML-1 Literatura ML-1 Literatura
C DEPT δC(ppm) δC(ppm) δC(ppm) δC(ppm)
1 CH2 37,47 37,2 37,47 37,2
2 CH2 32,13 29,7 32,13 29,7
3 CH 72,04 71,8 72,04 71,8
4 CH 42,50 39,8 42,5 39,6
5 C 140,97 140,7 140,97 140,7
6 CH 121,95 121,7 121,95 121,7
7 CH2 32,13 31,6 32,13 31,6
8 CH 32,13 31,9 32,13 31,9
9 CH 50,34 50,1 50,4 50,1
10 C 36,36 36,8 36,36 33,9
11 CH2 20,04 21,1 20,04 21,1
12 CH2 39,89 39,8 39,9 39,8
13 C 42,50 42,3 42,5 42,3
14 CH 57,08 56, 8 57,08 56,7
15 CH2 24,58 24,4 24,58 24,3
16 CH2 28,47 28,9 29,14 28,2
17 CH 56,26 56,1 56,26 56,9
18 CH3 12,08 11,9 12,19 12,1
19 CH3 19,62 18,9 19,62 12,2
20 CH 36,36 36,1 40,72 40,5
21 CH3 18,99 18,8 20,04 21,2
22 CH2/ CH 34,15 33,7 138,54 138,3
23 CH2/ CH 26,27 26,1 129,49 129,3
24 CH 46,04 45,8 50,34 50,1
25 CH 29,35 29,1 32,13 31,9
26 CH3 19.62 19,4 20,04 21,2
27 CH3 19,24 19,0 19,24 19,8
28 CH2 22,91 23,1 25,63 25,4
Capítulo 4 – Resultados e Discussão
Figura 03 – Espectro de RMN 1H (500 MHz, CDCl3) de ML-1
Capítulo 4 – Resultados e Discussão
4.2.2 Determinação estrutural de ML-2
O tratamento cromatográfico da fração (42-159), proveniente do extrato em
hexano das raízes de M. lathyroides (EHRML, item 5.5.2.1.1.1, p. 90), resultou no isolamento
de 82,8 mg de um sólido incolor de aspecto cristalino, em forma de agulhas, solúvel em
clorofórmio, com ponto de fusão na faixa entre 182,4-183,9 °C e [α]D20 = +10o (c = 0,005, CH2Cl2), denominado ML-2. A análise dessa substância por CCD mostrou uma mancha com
coloração avermelhada após revelação com solução de vanilina em ácido perclórico e etanol.
O espectro de absorção na região do infravermelho (IV) (Fig. 09, p. 45) de ML-2
apresentou uma banda intensa em 3392 cm-1, correspondente à deformação axial de O─H, caracterizando a presença de hidroxila; uma pequena banda de absorção em 3100 cm-1,
associada à deformação axial de C─H de aromático e duas bandas intensas em 2930 e 2860 cm-1, indicativas de deformação axial de C─H para carbono sp3; uma banda intensa centrada em 1693 cm-1, relacionada à deformação axial de ligação C═O, sugerindo a presença de carbonila conjugada; outra banda fina e intensa em 1608 cm-1, característica de deformação
axial de C═Carom; banda fina em 1165 cm-1 de deformação axial de C─O de fenol e outra
banda fina em 1094 cm-1 de deformação axial C─O alifático (SILVERSTEIN; WEBSTER;
KIEMLE; 2007).
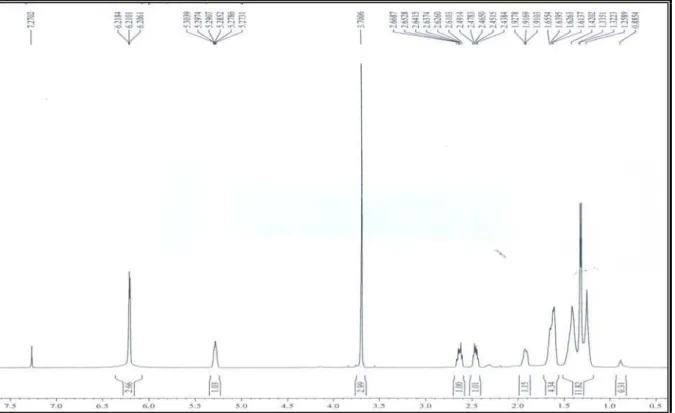
O espectro de RMN 1H (500 MHz, CDCl3, Fig. 11, p. 46) de ML-2 apresentou
sinais em δ 6,21 (sl, H-11 e H-13) com integração para dois átomos de hidrogênio, sugerindo
a presença de um sistema aromático tetrasubstituído; um sinal em δ 5,29 (m, H) com
integração para um átomo de hidrogênio; um sinal simples e intenso em δ 3,70 (s, 3H),
atribuído a átomos de hidrogênio de uma metoxila; um dubleto em δ 1,33 (d, J = 6,4 Hz, 3H),
atribuído a átomos de hidrogênio de um grupamento metila ligado a carbono metínico. Além
destes, o espectro apresentou sinais múltiplos na região entre δ 0,89 e 2,67 atribuídos a
átomos de hidrogênio metilênicos e metínicos.
No espectro de RMN 13C – BB (125 MHz, CDCl3, Fig. 12, p. 46) foram
observadas 17 linhas espectrais. A análise comparativa com o espectro de RMN 13C – DEPT
135° (Fig. 13, p. 47), permitiu atribuir o sinal em δ 169,39 (C-1) ao átomo de carbono de um
grupo C=O conjugado, confirmando a sugestão feita pela análise do espectro na região do
infravermelho. Dois sinais em δ 158,16 e δ 157,92, foram atribuídos a carbonos sp2
oxigenados e não hidrogenados; dois sinais em δ 143,21 e δ 117,56, foram associados a
foram relacionados a carbonos sp2 monoidrogenados; dois sinais em δ 72,65 e δ 56,01, foram
atribuídos a carbonos sp3 oxigenados, sendo o último desses, atribuído a grupo metoxila.
Observou-se ainda, sete sinais entre δ 21,56 e 32,58 relacionados a carbonos metilênicos
(CH2) e por fim, um sinal em δ 19,72 atribuído a carbono metílico (CH3) (Tabela 04).
Tabela 04 – Dados de deslocamentos químicos (δ) de carbono-13 para ML-2, obtidos por comparação entre os espectros de RMN 13C – BB e de RMN 13C – DEPT 135°.
C CH CH2 CH3
169,39 (C=O) 108,58 32,58 56,01
158,16 (C-O) 97,22 30,63 19,72
157,92 (C-O) 72,65 (C-O) 30,26
143,21 26,61 117,56 25,69 24,40 21,58
5 C 3 CH 7 CH2 2 CH3
Fórmula molecular: C17H24O4
O espectro de massas obtido por impacto eletrônico a 70 eV (Fig. 10, p. 45)
forneceu um pico correspondente ao seu íon molecular com razão massa/carga (m/z) igual a
292 Daltons, compatível com a fórmula molecular C17H24O4, conforme dedução feita através
das análise dos espectros de RMN 1H e 13C e IV, com IDH igual a 6.
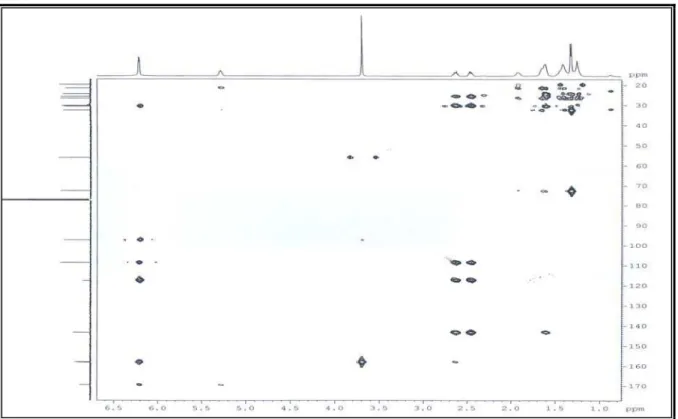
A análise do espectro de bidimensional de correlação heteronuclear 1H x 13C –
HSQC (Fig. 14, p. 47) de ML-2 permitiu associar inequivocamente todos os sinais de
hidrogênios a seus respectivos átomos de carbono, como pode ser observado na Tabela 05 (p.
44).
No espectro de HSQC foi possível observar a correlação entre o sinal dos
hidrogênios em δ 6,21 (sl, H-11 e H-13) e os sinais de carbonos em δ 108,53 (C-11) e em δ
97,22 (C-13), respectivamente. Observou-se ainda a correlação do sinal em δ 3,70 (s, 3H),
indicativo de metoxila ligada a anel aromático, com o sinal de carbono em δ 56,01.
Na análise do espectro de HSQC (Fig. 14, p. 47) também foi possível observar a
correlação entre os sinais de átomos de hidrogênio metilícos em δ 1,33 (d, 3H) com o sinal de
carbono em δ 19,72 (C-16); do sinal de hidrogênio em δ 5,29 (m, 1H) com sinal de carbono
oxigenado em δ 72, 65 (C-3), sendo este sinal típico de carbono carbinólico.
No espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC (Fig.
15, p. 47), foram observadas para cada um desses átomos de hidrogênios em δ 6,21 (H-13) as
Capítulo 4 – Resultados e Discussão
158,16 (C-12) e δ 157,92 (C-14) e a três ligações (3JCH) com os carbonos em δ 117,56 (C-15)
e em δ 108,58 (C-11). Por outro lado, o sinal δ 6,21 (H-11) apresentou correlação a duas
ligações (2JCH) com o carbono em δ 158,16 (C-12) e a três ligações (3JCH) com os carbonos
em δ 117,56 (C-15), δ 97,22 (C-13) e δ 30,63 (C-10), confirmando a posição meta dos
hidrogênios, e também corroborando para a presença de um anel tetrasubstituído.
Essas sugestões foram confirmadas pela correlação a três ligações (3JCH) entre o
sinal de hidrogênio em δ 3,70 e o átomo de carbono em δ 157,92 (C-14). Estas análises feitas
nos espectros até o momento, sugerem a proposta de um composto aromático
1,2,3,5-tetrasubstituído e infere o seguinte fragmento parcial para a substância em questão:
6,21
6,21 97,22
108,58 117,56
30,63 157,92
158,16
3,70
H
OCH3
H
HO
6,21
6,21 97,22
108,58 117,56 157,92
158,16
3,70
H
OCH3
H
HO
Subestruturas, com correlações 1H x 13C, para H-11 e H-13
Essas análises confirmam também que tanto a metoxila, assim como um dos
hidrogênios aromáticos estariam próximos ao carbono em δ 157,92 (C-14) e o outro
hidrogênio em δ 6,21 estaria em posição orto ao carbono metilênico benzílico em δ 30,63
(C-10). Este sinal, atribuído a carbono (CH2) foi confirmado pelo espectro de RMN 13C – DEPT
135° (Fig. 13, p. 47).
No espectro de HSQC (Fig. 14, p. 47), os dois multipletos em δ 2,64 (m, 1H) e δ
2,47 (m, 1H) mostraram correlação com o sinal do carbono em δ 30,63 (C-10). O espectro de
HMBC (Fig. 15, p. 48) corrobora na identificação destes como átomos de hidrogênios
benzílicos através das correlações a duas ligações (2JCH) destes com o sinal do átomo de
carbono em δ 143,22 (C-16) e a três ligações (3JCH) com os sinais dos átomos de carbono em
δ 117,56 (C-15) e δ 108,58 (C-11). Esses sinais de hidrogênios apresentam ainda correlações a duas ligações (2JCH) com o carbono com sinal em δ 30,26 (C-9) e a três ligações (3JCH) com
6,21
6,21 97,22
108,58 117,56
30,63 157,92
158,16
3,70
25,69 30,26 143,21
H OCH3 H HO O H H
159,39
2,64
2,47
Subestrutura, com correlações 1H x 13C, para H-10 e H-11
O espectro de HMBC apresentou ainda as correlações de longo alcance em forma
de um W a quatro ligações (4JCH) entre os hidrogênios com sinal em δ 6,21 com o sinal de
carbono em δ 169,39 (C-1). Esses dados, em conjunto com os que já foram discutidos,
sugeriram que o grupo C=O estivesse também ligado diretamente ao anel aromático:
6,21
6,21 97,22
108,58 117,56
30,63 157,92
158,16
3,70
143,21
H O C H3 H
H O
O
159,39
Subestrutura, com correlações 1H x 13C, para H-11 e H-13
O espectro bidimensional de correlação homonuclear 1H x 1H – COSY (Fig. 16,
p. 48) revelou as correlações do sinal dos átomos de hidrogênio metílicos em δ 1,33 (3H-17)
com o sinal de hidrogênio em δ 5,29 (1H-3). No espectro de HMBC (Fig. 15, p. 47) observou
as correlações a duas ligações (2JCH) entre o sinal do átomo de hidrogênio em δ 1,33 (d, 3H)
com sinal de carbono em δ 72,67 (C-3) e a três ligações (3JCH) com o átomo de carbono em δ
Capítulo 4 – Resultados e Discussão
32,58 72,67
1,33
O
H
CH
319,72 5,29
32,58 72,67
1,33
O
H
CH
3
19,72
5,29
Subestrutura, com correlações 1H x 1H/13C para H-3 e 3H-17
No espectro de HMBC, permitiu-se verificar a correlação a três ligações (3JCH) do
sinal do átomo de hidrogênio em δ 5,29 (m, H-3) com o carbono C=O em δ 169,39 (C-1) e ao
carbono metilênico em δ 21,58 (C-5). A discussão até esta altura permite indicar que
possivelmente um heteroátomo estaria ligando as duas partes da molécula:
6,21
6,21 97,22
108,58 117,56
30,63 157,92
158,16
3,70 O
159,39
21,58 32,58 72,58 5,29
1,33
CH3
19,72
H OCH3 H HO O H
30,26 25,69
Subestrutura, com correlações 1H x 13C, para H-3
A análise dos dados espectroscópicos obtidos e a comparação com dados descritos
na literatura (LI et al., 2005) (Tab. 05, p. 44), foi possível concluir que ML-2 trata-se do
macrolídeo denominado lasiodiplodina (Fig. 06, p. 43), substância que foi isolada pela
primeira vez do fungo Lasiodiplodia theobromae (ALDRIDGE et al., 1971). Essa lactona
macrocíclica foi isolada de Euphorbia splendens (Euphorbiaceae) (LEET et al., 1982), de
Euphorbia fidjiana (Euphorbiaceae) (CAMBIE et al., 1991), de Annona dioica (Anonaceae)
(DOS SANTOS; MORAIS; BRAZ-FILHO, 2003), de Erycibe expansa (Convolvulaceae)
(MATSUDA et al., 2007), de Ficus nervosa (Moraceae) (CHEN et al., 2010) e de
literatura sobre o isolamento da lasiodiplodina, um potente agente antileucêmico
(BRAZ-FILHO, 2010), na família Fabaceae e no gênero Macroptilium.
O
O
OMe
HO
15 14 13 12 11 16 10 9 8 7 6 5 4 3 1 17Figura 06 – Estrutura da lasiodiplodina
A Figura 07 mostra os fragmentos em m/z 182, 163 e 138 Daltons observados no
espectro de massas (i.e., 70 eV) de ML-2.
O O OMe
HO
C17H24O4
m/z 292
OH O OMe
HO
o
m/z 182
OMe
HO
m/z 138 CO2
O OMe
O CH
2
m/z 163
Figura 07 – Fragmentos propostos para os principais picos observados no espectro de massas de ML-2.
A determinação da configuração do átomo de carbono C-3 de ML-2 foi realizada
através da comparação de seu respectivo valor de rotação óptica específica com os valores
descritos na literatura para ambos os enanciômeros da lasiodiplodina obtidos por síntese.
Dessa forma, pode-se concluir que o átomo de carbono (C-3) de ML-2 apresenta configuração
Capítulo 4 – Resultados e Discussão 17 1 3 4 5 6 7 8 9 10 16 11 12 13 14 15 O HO O O H
Figura 08 – Estrutura da (R)-lasiodiplodina
Tabela 05 – Dados de RMN 1H e 13C de ML-2 dispostos segundo as correlações obtidas através dos espectros HSQC e HMBC e comparação com deslocamentos químicos de RMN 1
H e 13C da (R)-lasiodiplodina registrado na literatura (LI et al., 2005).
HSQC HMBC Lasiodiplodina (CDCl3)
δC (ppm)
δH
(ppm, multip., J Hz) 2
JCH 3JCH δC (ppm)
δH
(ppm, multip., J Hz) C
1 169,39 - H-3 167,4
12 158,16 - H-11 H-13 157,8
14 157,92 - H-13 MeO-14 157,8
15 117,56 - H-13; H-11;
2H-10 118,9
16 143,21 - 2H-10 2H-9 142,9
CH
3 72,65 5,29 (m) 3H-3; 2H-4 3H-16 72,1 5,30 (m)
11 108,58 6,21 (sl) H-13; 2H-10 108,3 6,25 (d, 2,2)
13 97,22 6,21 (sl) H-11 96,8 6,22 (d, 2,2)
CH2
4 32,58 1,91 (m); 1,64 (m) 2H-4 3H-16 32,4 1,25- 193 (m)
5 21,58 1,66; 1,41 2H-4 H-3 21,3 1,25- 193 (m)
6 24,40 1,63; 1,23 2H-7; 2H-6 2H-8; 2H-3 24,2 1,25- 193 (m)
7 26,61 1,42 2H-8; 2H-6 2H-5 26,5 1,25- 193 (m)
8 25,69 1,40; 1,26 2H-7 2H-10 25,5 1,25- 193 (m)
9 30,26 1,64 2H-10 30,1 1,25- 193 (m)
10 30,63 2,64 (m); 2,47 (m) 2H-9 H-11 30,4 2,63 (m); 2,46 (m)
CH3
17 19,72 1,33 (d. 6,2) 19,5 1,34 (d, 6,5)
Figura 09 – Espectro na região do IV (em KBr) de ML-2
Capítulo 4 – Resultados e Discussão
Figura 11 – Espectro de RMN 1H (500 MHz, CDCl3) de ML-2
Figura 13 – Espectro de RMN 13C – DEPT 135o (CDCl3) de ML-2
Capítulo 4 – Resultados e Discussão
Figura 15 – Espectro bidimensional de correlação heteronuclear 1H x 13C-HMBC de ML-2
4.2.3 Determinação estrutural de ML-3
Do tratamento cromatográfico da fração (39-112) do extrato em hexano das raízes
de M. lathyroides (EHRML, item 5.5.2.1.1.1.1, p. 91), resultou no isolamento de 8,0 mg de
um sólido cristalino em forma de agulhas, incolor, solúvel em clorofórmio, com ponto de
fusão na faixa entre 203 a 205 °C. O referido composto por análise em CCD mostrou uma
mancha de coloração azulada após revelação com solução de vanilina em ácido perclórico e
etanol e foi denominado de ML-3.
O espectro de absorção na região do infravermelho (IV) (Fig. 18, p. 57) de ML-3
apresentou uma banda larga em 3448 cm-1, característica de deformação axial ligação de
O─H; duas bandas em 2957 e 2868 cm-1, relativas às deformações axiais de C─H de
alifáticos; uma absorção intensa e centrada em 1690 cm-1, associada à presença de
deformação axial de ligação C═O em sistema α,β-insaturado (CORREIA: DAVID; DAVID, 2003). Também foram observadas absorções das deformações angulares de CH2 e CH3 em
1466 cm-1 e 1385 cm-1, respectivamente (SILVERSTEIN; WEBSTER; KIEMLE; 2007).
O espectro de RMN 1H (500 MHz, CDCl3, Fig. 20, p. 58) de ML-3, apresentou
sinais múltiplos na região entre δ 0,75-2,52, sugerindo a presença de átomos de hidrogênio
metílicos, metilênicos e metínicos ligados a carbono sp3 de esqueletos esteroídicos ou
triterpênicos. Foram observados ainda sinais relativos a hidrogênios ligados a carbono sp2 em
δ 5,82 (s, H-4); dois duplos dubletos em δ 5,15 (dd, J = 15,1 e 8,6 Hz, H-22) e
δ 5,03 (dd, J =15,1 e 8,6 Hz, H-23), sugestivo para uma ligação dupla de configuração
E (J = 15,1 Hz); um sinal de hidrogênio provavelmente ligado a carbono carbinólico em
δ 4,35 (d, J = 2,6 Hz, H-6) e dois multipletos em δ 2,53 (m, 1H) e δ2,40 (m, 1H).
O espectro de RMN 13C – BB (125 MHz, CDCl3, Fig. 21, p. 58) de ML-3
apresentou 50 linhas espectrais, das quais 44 foram identificadas, sugerindo, dessa forma,
uma mistura binária. O sinal em δ 200,68 (C-3), foi atribuído a carbono carbonílico de cetona
α,β-insaturada, conforme já sugerido no espectro na região do infravermelho. Essa atribuição foi confirmada pela presença de dois sinais de carbonos de uma ligação dupla trissubstituída
em δ 168,72 (C-5) e δ 126,55 (C-4). Esses dados bem como, a confirmação do sistema
metínico carbinólico pelo sinal em δ 73,51 (C-6), sugeriram a estrutura de um ceto-álcool
Capítulo 4 – Resultados e Discussão
A análise comparativa dos dados de RMN 13C – BB com os obtidos no espectro
de RMN 13C – DEPT 135° (Fig. 22, p. 59) de ML-3 revelou a presença de seis absorções
atribuídas a átomos de carbonos não hidrogenados; dezessete absorções de carbonos
metínicos; quatorze absorções de carbonos metilênicos e oito absorções de carbonos
metílicos. Os deslocamentos químicos dos átomos de carbono de ML-3 juntamente com seus
respectivos padrões de hidrogenação são mostrados na Tabela 06.
Tabela 06 – Dados de deslocamentos químicos (δ) de carbono-13 para ML-3, obtidos por comparação entre os espectros de RMN 13C – BB e de RMN 13C – DEPT 135°.
C CH CH2 CH3
200,68 138,35 39,82 21,42
168,72 129,69 39,73 21,41
168,69 126,55 37,32 21,32 42,73 73,51 34,49 20,05
42,62 56,28 34,12 19,73
38,22 56,22 28,78 18,95
56,17 28,76 12,47
56,11 28,41 12,42
53,87 26,30
53,84 24,44
51,47 24,38
46,05 23,30
40,70 25,63
36,34 21,19
32,10 29,95
4 C/4 C 9 CH/11CH 10 CH2/8 CH2 6 CH3/6 CH3
Fórmulas moleculares: C29H48O2 e C29H46O2
O espectro de massas (Fig. 19, p. 57) apresentou pico íon molecular em m/z igual
a 428 daltons, estando compatível com as fórmulas moleculares C29H48O2.
A análise do espectro de bidimensional de correlação heteronuclear 1H x 13C –
HSQC (Fig. 23, p. 59) permitiu associar de forma inequívoca todos os sinais dos hidrogênios
a seus respectivos átomos de carbonos de ML-3, como podem ser observados nas Tabelas 07
(p. 55) e 08 (p. 56), respectivamente.
A análise do espectro bidimensional de correlação heteronuclear 1H x 13C –
HSQC (Fig. 23, p. 59) permitiu associar o sinal de hidrogênio em δ 5,82 (sl, 1H) ao sinal de
carbono olefínico em δ 126,55 (C-4); o hidrogênio em δ 4,35 (1H) com o carbono em δ 73,51
Ainda no espectro de HSQC foram observadas as correlações referentes aos
grupamentos metila, sendo, portanto, observadas as correlações entre o sinal em δ 0,75 (s,
3H) e o carbono em δ 12,42 (C-18); entre o sinal em δ 0,93 (d, J = 6,5 Hz, 3H) e o carbono em δ 18,95 (C-21); entre o sinal em δ 1,03 (d, J = 6,6 Hz, 3H) e os átomos de carbono em δ
21,41 (26) e δ 21,32 (27), e por último o sinal do hidrogênio em δ 0,81 (t, J = 7,6 Hz, 3H) ao
carbono em δ 12,42 (C-29).
O espectro 1H x 1H – COSY (Fig. 24, p. 60) mostrou a correlação entre o
hidrogênio em δ 5,82 (H-4) e o hidrogênio ligado ao carbono oxigenado em δ 4,35 (H-6).
O espectro bidimensional de correlação heteronuclear 1H x 13C – HMBC (Fig. 25,
p. 60), revelou claramente a correlação entre o sinal do hidrogênio em δ 5,82 (H-4) com o
carbono metínico carbinólico em δ 73,51 (3J) (C-6). Esta informação foi confirmada através
da correlação entre o hidrogênio em δ 4,35 (H-6) ligado ao carbono carbinólico e o carbono
metínico insaturado em δ 126,55 (3J) (C-4).
Analisando o mesmo espectro pôde-se verificar as correlações entre os
hidrogênios do grupamento metila em δ 1,38 (3H-19) com o carbono quaternário em δ 38,22
(2J) (C-10), com o carbono insaturado em δ 168,69 (3J) (C-5), ainda com os carbonos em δ
53,84 (3J) (C-9) e em δ 37,32 (3J) (C-1), respectivamente. Os dados espectrais discutidos
permitiram sugerir o seguinte fragmento estrutural para ML-3 (p. 52):
O
H OH
H
1,38
5,82 4,35 37,32
73,51 53,84 38,22 168,69 126,55
Subestruturas, com correlações 1H x 13C, para H-4, H-6 e 3H-19
No espectro de HMBC (Fig. 25, p. 60) observaram-se também as correlações
entre os hidrogênios dos grupamentos metila, sendo, portanto, observadas as correlações entre
o sinal em δ 0,75 (3H-18) e o carbono quaternário em δ 42,62 (2J) (C-13), e os carbonos em δ
39,73 (3J) (C-12), δ 56,11 (3J) (C-14), δ 56,22 (3J) (C-17), respectivamente. O hidrogênio em
Capítulo 4 – Resultados e Discussão
átomos de carbonos em δ 56,22 (3J) (C-17), δ 34,12 (3J) (C-22) e δ 138,35 (3J) (C-22). Estas
últimas correlações dão formas para uma proposta de dois fragmentos estruturais denominado
de ML-3a e ML-3b, respectivamente:
1,38
5,81 4,35 37,32
73,51 53,84 38,22
126,55 168,69
O
H OH
H
0,75 0,93
42,62 56,11
56,22 36,34 34,12
39,73
1,38
5,81 4,35 37,32
73,51 53,84 38,22
126,55 168,69
O
H OH
H
0,75 0,93
42,73 56,17
56,28 36,34
138,35
39,73
Subestruturas, com correlações 1H x 13C, para 3H-18 e 3H-21 em ML-3a e ML-3b
No espectro de HSQC (Fig. 23, p. 59), os sinais dos hidrogênios olefínicos em δ
5,15 (dd, J = 15,1 e 8,6 Hz, H-22) e δ 5,03 (dd, J = 15,1 e 8,6 Hz, H-23) correlacionam-se
com os carbonos em δ 138,35 (C-22) e δ 129,69 (C-23), respectivamente. Na análise do
HMBC observaram-se ainda as correlações entre o hidrogênio ligado ao carbono olefínico em
δ 5,15 (H-22) e o carbono em δ 129,69 (2J) (C-23) e o carbono em δ 51,47 (3J) (C-24). Observaram-se ainda a correlação do outro hidrogênio ligado ao carbono olefínico em δ 5,03
(H-23) e os átomos de carbonos em δ 138,35 (2J) (22), 51,47 (2J) (C-24) e 40,70 (3J) (C-25),
respectivamente:
1,38
5,81 4,35 37,32
73,51 53,84 38,22 126,55
0,75 0,93
42,73 56,17
56,28 36,34 39,73
168,69 O
H OH H
H H
1,03 1,03 0,81
40,70 129,69
51,47 25,63 138,35
5,15
5,03
No espectro de HMBC (Fig. 25, p. 60) observaram-se ainda as correlações de
outros grupamentos metila. Neste espectro, o sinal dos hidrogênios da metila em δ 1,03
correlacionou-se com os carbonos em δ 29,95 (2J) (C-25); e o sinal dos hidrogênios da metila
em δ 0,81 com os átomos de carbonos em δ 46,05 (3J):
1,38
5,82 4,35 37,32
73,51 53,84 38,22 126,55
0,75 0,93
42,73 56,17
56,28 36,34 39,73
168,69 O
H OH H
1,03 1,03 0,81
29,95 46,05 23,30 34,12
Correlações 1H x 13C, para 3H-26, 3H-27 e 3H-29 em ML-3a
Baseados na análise dos dados espectroscópicos obtidos e na comparação com
dados descritos na literatura (CORREIA; DAVID; DAVID, 2003; ASHA et al., 2004),
permitiram identificar ML-3, como sendo uma mistura esteroidal constituída pela ML-3a 6β -hidroxi-estigmast-4-en-3-ona e ML-3b 6β-hidroxi-estigmast-4,22-dien-3-ona (Fig. 17, p. 54).
Capítulo 4 – Resultados e Discussão
O
H OH
H 1
2
3 4
5 6
7 8 9
10 11
12
13
14 15
16 17 18
19
20
21 22
23
24
25
26 27 28
29
Figura 17 – 6β-hidroxi-estigmast-4-en-3-ona e 6β-hidroxi-estigmast-4,22-dien-3-ona
Os dados de RMN 1H e RMN 13C de ML-3, assim como os descritos na literatura
(CORREIA; DAVID; DAVID, 2003) para 6β-hidroxi-estigmast-4-en-3-ona e (ASHA et al., 2004) para 6β-hidroxi-estigmast-4,22-dien-3-ona estão descritos nas Tabela 07 (p. 55) e
Tabela 07 – Dados espectroscópicos de ML-3a comparados com dados da literatura descritos na literatura (CORREIA; DAVID; DAVID, 2003) para 6β-hidroxi-estigmast-4-en-3-ona.
HSQC HMBC Literatura (CDCl3)
δC
(ppm)
δH
(ppm, multip., J Hz)
2
JCH 3JCH (ppm)δC (ppm, multip., δH J Hz)
C
3 200,68 200,11
5 168,69 3H-19 168,55
10 38,22 3H-19 37,97
13 42,62 3H-18 42,49
CH
4 126,55 5,82 (s) H-6 126,26 5,82 (s)
6 73,51 4,35 H-4 73,22 4,34 (m)
8 32,10 29,70
9 53,84 3H-19 53,61
14 56,11 3H-18 55,87
17 56,22 3H-18, 3H-21 56,05
20 36,34 3H-21 36,08
24 46,05 3H-29 45,81
25 29,95 3H-26, 3H-27 29,15
CH2
1 37,32 3H-19 37,06
2 34,49 34,22
7 38,76 38,56
11 21,19 20,95
12 39,73 3H-18 39,58
15 24,38 24,12
16 28,41 28,14
22 34,12 3H-21 33,88
23 26,30 26,09
28 23,30 23,06
CH3
18 12,42 0,75 (s) 11,98 0,75 (s)
19 19,73 1,38 (s) 19,46 1,38 (s)
21 18,95 0,93 (d, 6,5) 18,70 0,93 (d, 6,5)
26 21,41 1,03 (d, 6,6) 19,77 0,84 (d, 6,1)
27 21,32 1,03 (d, 6,6) 19,00 0,82 (d, 6,1)