Programa de Pós-Graduação em Biotecnologia
Rafaela Leite Martins
Importância das reservas energéticas para a resposta ao estresse ácido em
Saccharomyces
Importância das reservas energéticas para a resposta ao estresse ácido em
Saccharomyces
Dissertação de Mestrado
Orientador: Prof. Dr. Ieso de Miranda Castro Co-orientadora: Dra. Ana Paula do Carmo
Dissertação apresentada ao programa de pós-graduação do Núcleo de Pesquisas Em Ciências Biológicas da Universidade Federal de Ouro Preto, como parte integrante dos requisitos para obtenção do título de Mestre em Biotecnologia, área de concentração Biotecnologia Aplicada a Processos e ao Tratamento de Doenças.
ii Laboratório de Biologia Celular e Molecular da Universidade Federal de Ouro Preto
Apoio Financeiro:
Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - CAPES
iii
Dedicatória
iv
Prefácio
“Apenas duas coisas são infinitas: o Universo e a estupidez humana.
E eu ainda não estou certo, sobre a primeira.”
v
Agradecimentos
Ao Dr. Ieso de Miranda Castro pela oportunidade, incentivo, apoio e ensinamentos. À Dr. Ana Paula do Carmo pela co-orientação, pelo apoio nos experimentos e pelos ensinamentos.
Ao Dr. Júlio César também pelo apoio nos experimentos e pelos ensinamentos. À Maria José Trópia pela ajuda experimental, apoio e carinho.
À Débora Mara Albuquerque pela grande colaboração experimental e disponibilidade. À equipe do LBCM pela acolhida, cuidado, trocas de experiências, colaborações e por tornar os dias de trabalho agradáveis e alegres.
Ao laboratório de imunoparasitologia pela disponibilização do sonicador. A CAPES, a FAPEMIG e a UFOP pelo financiamento.
Agradecimentos especiais
Agradeço a Deus por me iluminar todos os dias e me dar forças, paciência, saúde para que eu pudesse ter finalizado este trabalho e por colocar pessoas tão especiais e maravilhosas em minha vida.
À minha mãe Joaquina Leite Martins e meu pai Paulo Martins de Carvalho pelo grande apoio em todos os anseios profissionais e pessoais, pelo zelo, carinho, amor e orações. Ao meu noivo João Renato da Cruz Rosa por estar ao meu lado em todos os momentos, pelo apoio e incentivo às minhas buscas profissionais, pela paciência na distância, pela confiança, pelo cuidado, carinho e amor.
Às minhas irmãs Manuela Leite Martins e Franciele Leite Martins por me incentivarem e me apoiarem sempre e pelo amor de irmãos.
Ao meu sobrinho João Gabriel pela alegria transmitida no seu sorriso inocente.
Às minhas tias Lucimara Leite, Geralda Leite e Solange Rosa e todos da minha grande e linda família Leite e Rosa por sempre me apoiar, incentivar e cuidar.
vi Aos meus amigos de Bocaiuva e Montes Claros que mesmo longe, nunca me deixaram “sozinha”e sempre me apoiaram e me alegraram. E por cuidarem de mim nos momentos que mais precisei.
Aos amigos conquistados em Ouro Preto que tornaram meus dias inefáveis, zelaram por mim e me acolheram em todas as horas: Maurício Azevedo, Júlio César, Ana Paula do Carmo, Diogo Dias (longas datas), Thalita Araújo, Cyntia Ferreira, Zé Zorel, Bruna Diniz, Daniela Antunes, Pauline Martins, Débora Mara, Heloá Teixeira, Marcos Palitin, Lígia, Luís Eduardo da Conceição, Bruno Motta, Karoline Duarte, Anna Clara, Karina Silva, Gleise Leal (Gatona) e Filipe.
A todos que direta ou indiretamente me ajudaram.
vii ÍNDICE
Dedicatória ... iii
Prefácio ... iv
Agradecimentos ... v
Lista de Figuras ... ...ix
Lista de Tabela ... xi
Lista de Siglas e Abreviatura ... xii
Resumo ... xiv
Abstract ... xv
1. Introdução ... 2
1.1 Saccharomyces cerevisiae ... 2
1.2. Estresse ácido e homeostase iônica... 3
1.3. Estresse térmico e estresse térmico subletal...7
1.4. Mecanismos envolvidos na resposta ao estresse ácido – Reservas energéticas... 9
1.4.1. ATP (Adenosina 5 - trifosfato) ... 9
1.4.2. Trealose e Glicogênio ... 11
1.5. Outros genes de respostas a estresses em geral...16
2.Objetivos ... 19
2.1. Objetivo geral ... 19
2.2. Objetivos específicos ... 19
3. Materiais e Métodos ... 22
3.1. Micro-organismos ... 22
3.2. Condições de cultivo ... 23
3.3. Choque ácido ... 23
3.4. Avaliação da viabilidade celular ... 23
3.5. Determinação de peso seco ... 24
3.6. Determinação dos níveis ATP ... 24
viii
3.8. Choque térmico subletal - resposta adaptativa... 25
3.9. Medida da atividade enzimática das trealases neutra e ácida ... 26
3.10. Dosagem de glicose ... 27
3.11. Dosagem de proteínas ... 27
3.12. Análise estatística ... 28
4. Resultados e Discussão ... 30
4.1. Efeito do pH ácido em linhagens de S. cerevisiae ... 30
4.2. Níveis intracelulares de ATP em linhagens de S. cerevisiae sob condição de estresse ácido ... 32
4.3. Níveis intracelulares de trealose e glicogênio em linhagens de S. cerevisiae submetidas à condição de estresse ácido ... 35
4.4. Níveis intracelulares de trealose e glicogênio em células de S. cerevisiae W303 submetidas a tratamento térmico subletal de 41ºC por 2 horas e ao choque ácido .... 38
4.5. Medida da atividade enzimática das trealases neutra e ácida em células de S. cerevisiae W303 submetidas a tratamento térmico subletal de 41ºC por 2 horas e ao choque ácido ... 41
4.6. Efeito do pH ácido em células mutantes nos genes TPS1, NTH1, NTH2 e ATH1 ... 44
5.Conclusão ... 47
6.Perspectivas ... 49
7.Comentário Final ... 51
8.Referências Bibliográficas ... 53
9. Anexos ... 72
9.1. Curva padrão de glicose ... 72
ix
Lista de Figuras
Figura 1: Vias de transporte para a manutenção da homeostase iônica em
S.cerevisiae... 7 Figura 2: Modelos para proteção de proteínas exercida pela trealose... 13 Figura 3: Taxa de viabilidade celular (%) de S. boulardii, S. cerevisiae LBCM 479 (ena 1-4 ), S. cerevisiae UFMG 905 e S. cerevisiae W303 cultivadas em meio YPD (2%) (D.O.600nm 1.0) e submetidas à condição de estresse ácido (HCl pH 2.0
+ 86 mM NaCl)... 30 Figura 4: Níveis de ATP (mM) em S. boulardii, S. cerevisiae LBCM 479 (ena 1-4 ), S. cerevisiae UFMG 905 e S. cerevisiae W303 cultivadas em meio YPD (2%) (D.O.600nm 1.0) e submetidas à condição de estresse ácido (HCl pH 2.0 + 86 mM
NaCl)... 33 Figura 5: Níveis de trealose (A) e glicogênio (B) em S. boulardii, S. cerevisiae LBCM 479 (ena 1-4 ), S. cerevisiae UFMG 905 e S. cerevisiae W303 cultivadas em meio YPD (2%) (D.O.600nm 1.0) e submetidas à condição de estresse ácido
(HCl pH 2.0 + 86 mM NaCl)... 36 Figura 6: Resposta adaptativa. Níveis de trealose (A e B) e glicogênio (C e D) em células de S. cerevisiae W303 cultivadas em meio YPD (2%) até a fase exponencial (D.O.600nm 1,0) e fase estacionária (D.O.600nm 2,5-3,5) expostas ao
estresse ácido (A e C), à temperatura subletal de 41ºC/2h e à condição de estresse ácido (HCl pH 2.0 + 86 mM NaCl) (B e D)... 39 Figura 7: Taxa de viabilidade celular (%) em células de S. cerevisiae W303 cultivadas em meio YPD (2%) até a fase exponencial (D.O.600nm 1,0) e fase
estacionária (D.O.600nm 2,5-3,5) expostas ao estresse ácido, à temperatura subletal
de 41ºC/2h e à condição de estresse ácido (HCl pH 2.0 + 86 mM NaCl)... 40 Figura 8: Atividade enzimática das trealases neutra e ácida em células de S. cerevisiae W303 cultivadas em meio YPD (2%) até a fase exponencial (D.O.600nm
1,0) e fase estacionária (D.O.600nm 2,5-3,5) expostas ao estresse ácido, à
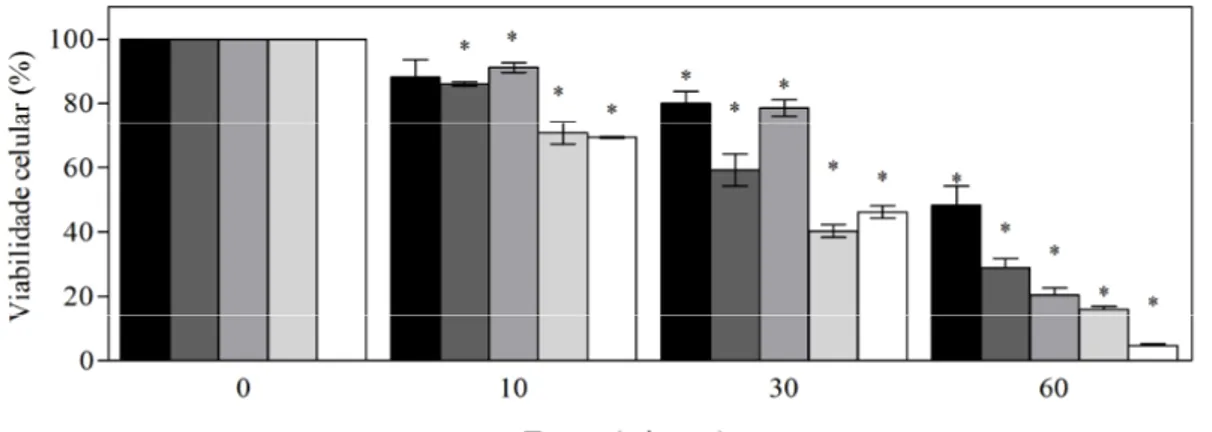
x mM NaCl)... 43 Figura 9: Taxa de viabilidade celular (%) em BY4741 e nos mutantes tps1 , ath1 , nth2 e nth1 , cultivadas em meio YPD (2%) (D.O.600nm 1.0) expostas à
xi
Lista de Tabela
xii
Lista de Siglas e Abreviatura
AMP: monofosfato de adenosina
AMPc: adenosina 3’, 5’- monofosfato cíclico AMPK: proteína quinase dependente de AMP ANOVA: análise de variância
ATH1: gene que codifica a trealase ácida ATP: Trifosfato de adenosina
BSA: albumina sérica bovina
Cfu(s): unidade formadora de colônia (s) DO: densidade óptica
ENA1: gene que codifica a bomba de Na+/K+ de membrana plasmática Ena1p Fig.: figura
GDB1: gene que codifica a enzima desramificadora – degradação do glicogênio GPH1: gene que codifica a enzima glicogênio fosforilase
HOG: alta osmolaridade do glicerol ou high osmolarity glycerol HSE: elementos de choque térmico
HSF: fator de transcrição de choque térmico HSP: Proteínas de choque térmico
Kha1p: canal antiporter de K+/H+ Mes: ácido 2-morfolino-etanosulfônico
NHA1: gene que codifica o canal antiporter Nha1p de membrana citoplasmática Na+K+/H+
NHX1: gene que codifica o canal antiporter Nhx1p de membrana pré-vacuolar Na+K+/H+
Nsc1p: canal retificador de cátions
NTH1/NTH2: gene que codifica as trealases neutras PKA: proteína quinase A
PMA1: gene que codifica a H+-ATPase de membrana citoplasmática PMSF: fluoreto de fenilmetil sulfonil
xiii STRE: elementos de resposta a estresses
TE: Tris-EDTA Tok1p: canal de K+
TPS: trealose-6-fosfato sintase/fosfatase Trk1/Trk2p: transportadores de K+e Na+ UDP-glicose: uridina difosfato glicose
xiv
Resumo
Em processos fermentativos, as células de leveduras são expostas a alterações ambientais, tais como alterações nos níveis de nutrientes, temperatura, pH, concentração de etanol, concentração de O2, e outras mudanças. A capacidade de responder às
xv
Abstract
In fermentative processes, yeast cells are exposed to environmental changes such as, variations in nutrients levels, temperature, pH, ethanol concentration, O2 concentration,
2
1. Introdução
1.1 Saccharomyces cerevisiae
Saccharomyces cerevisiae é uma levedura unicelular, pertencente ao filo Ascomicota, classe Saccharomycetes, ordem Saccharomycetales e à família Saccharomycetaceae (Bisby et al., 2012). Morfologicamente, suas células podem ser esféricas, cilíndricas ou elipsoidais, ocorrendo isoladas, em pares ou em cadeias. (Pelczar, et al., 1997). Reproduzem-se assexuadamente por brotamento quando há disponibilidade de nutrientes, porém, quando os nutrientes são escassos, a reprodução é de forma sexuada, na qual células diplóides sofrem meiose e esporos haplóides são formados (Shimoda, 2004). Por ser um eucarioto unicelular, de rápido crescimento celular e de fácil manipulação genética, é bastante utilizada como organismo modelo em diversos estudos fisiológicos e bioquímicos (Nasheuer et al., 2002; Brocard-Masson e Dumas, 2006; Biddick eYoung, 2009; Karathia et al., 2011).
São anaeróbios facultativos, sendo a fermentação a via preferencial durante crescimento em glicose (Sherman, 2002). As células de S. cerevisiae convertem a glicose em alguns subprodutos como o etanol e o CO2 por meio do metabolismo
fermentativo. A maioria dos subprodutos gerados pela fermentação é de interesse comercial e é por isso que essa levedura é largamente utilizada na produção de etanol, bebidas alcoólicas, nas indústrias alimentícias, bem como nos cuidados de saúde.
A sequência gênica de um organismo possibilita identificar a organização do genoma e determinar características e variações gênicas. O primeiro eucarioto a ter o seu genoma totalmente sequenciado foi a Saccharomyces cerevisiae. A disponibilização do genoma completo dessa levedura facilitou sobremaneira os estudos de clonagem e expressão gênica, permitindo uma melhor compreensão de funções celulares diversas devido à rapidez na identificação e caracterização dos genes (Hughes et al., 2004; Jones, et al., 2008).
3 várias enzimas envolvidas na glicólise e gliconeogênese, de forma que, a via glicolítica é ativada e a gliconeogênese é reprimida pela inibição da transcrição de genes necessários para o catabolismo e de genes envolvidos na codificação de componentes da cadeia transportadora de elétrons, impedindo o metabolismo respiratório e levando as células a realizarem o metabolismo fermentativo mesmo na presença de oxigênio (Kruckeberg et al., 1998; Broach, 2012). Modificações transcricionais de genes relacionados ao metabolismo celular de S. cerevisiae pode ter efeitos favoráveis na indústria biotecnológica, a fim de obter produtos de valor comercial como, por exemplo, o etanol.
Com a ampla utilização de leveduras nos vários ramos da biotecnologia, estudos bioquímicos, gênicos, proteômicos, dentre outros, são essenciais para o esclarecimento de mecanismos envolvidos em respostas a estresses celulares, com o objetivo de utilizar estas informações a favor da otimização de processos industriais que envolvem estes micro-organismos.
1.2. Estresse ácido e homeostase iônica
De uma forma geral, as leveduras tem seu ambiente modificado em decorrência de fatores variados como temperatura, concentração de solutos, agentes químicos, disponibilidade de água, pH, níveis de nutrientes e outros. A capacidade de desenvolver respostas rápidas são importantes para que as mesmas possam sobreviver a tais mudanças, que muitas vezes geram estresses e podem comprometer suas funções celulares normais (Causton et al., 2001).
Vários estresses têm sido relatados e estudados em S. cerevisiae, assim como mecanismos de respostas celulares desencadeadas nestas situações.
4 44,3% dos micro-organismos contaminantes dependendo do tempo e do tratamento ácido. O reciclo celular pode estabilizar o processo fermentativo, pois, há uma diminuição das perturbações provenientes dos efeitos de contaminações por outras microbiotas além de tornar as células adaptadas ao meio (Belter et al., 1988).
Na indústria farmacêutica, a levedura Saccharomyces boulardii é utilizada como probiótico. Probióticos podem ser definidos como micro-organismos vivos que, quando ingeridos em concentrações adequadas, exercem efeitos benéficos à saúde do hospedeiro (World Health Organization, 2001). Entretanto, para que essas funções benéficas sejam exercidas, as leveduras precisam resistir ao pH baixo do trato intestinal que é extremamente ácido, devido à presença do HCl (ácido clorídrico) como componente desse ambiente.
S. boulardii é capaz de atingir e colonizar transitoriamente o cólon intestinal, reduzindo, ainda, a concentração de bactérias enteropatogênicas por meio da competição por receptores nesse local. Essas características, juntamente com outras já cientificamente demonstradas, fazem com que esse micro-organismo seja escolhido como probiótico por propiciar atividades benéficas à saúde do hospedeiro (Boddy et al., 1991; Berg et al., 1993, Elmer et al., 1996; Neves et al., 2002). Brandão et al. (1998) demonstraram que S. boulardii é capaz de neutralizar a ação da toxina do cólera quando esta se liga à superfície celular destas leveduras.
Foi sugerido por Fietto et al. (2004) diferenças quanto à fisiologia e o metabolismo de S. boulardii e S. cerevisiae. Como exemplos, S. boulardii suporta melhor diferentes condições de estresses e apresenta uma atividade metabólica mais acelerada em comparação com S. cerevisiae. Algumas características, como resistência ao estresse ácido, devem ser levadas em consideração para a escolha de um probiótico.
Em S. cerevisiae, o pH baixo afeta a organização da parede celular devido à desnaturação de proteínas gerando, a partir daí, outras disfunções celulares que podem diminuir a capacidade fermentativa e causar morte (Malakar et al., 2006).
5 acéticos são produzidos por bactérias quando essas consomem sacarose (Hesse et al., 2002; Porro et al., 2002).
A presença de micro-organismos competidores no meio também leva à acidificação externa, pois, há um aumento da produção de ácidos orgânicos. A competição por nutrientes pode diminuir a viabilidade celular do agente introduzido no meio de fermentação. Essa situação geralmente ocorre em processos de produção de etanol com a utilização da cana-de-açúcar como matéria-prima, que contêm uma carga microbiana alta e, ao entrar no processo fermentativo, essa microbiota compete com as leveduras (Nobre, 2005).
A utilização de ácidos orgânicos fracos como, por exemplo, o ácido sórbico, benzóico, propiônico, acético, dentre outros, como conservantes de alimentos tem por objetivo inibir o crescimento microbiano. Porém, na indústria alimentícia a resistência a esses agentes tem sido um problema, pois muitos micro-organismos como as leveduras do gênero S. cerevisiae possuem mecanismos de eliminação ácida (Cheng et al., 1999; Piper et al., 2001; .Mira et al., 2010).
Em S. cerevisiae, o mecanismo primário de resposta a estresse ácido se deve ao funcionamento da H+-ATPase da membrana plasmática (Pma1p) que é a proteína estrutural mais abundante na membrana plasmática, perfazendo de 10 a 20% do total de proteínas presentes na membrana (Serrano et al., 1986), e ao funcionamento da H+ -ATPase da membrana vacuolar (V--ATPase). Através do bombeamento de prótons para fora da célula realizado pela Pma1p e da compartimentalização vacuolar pela V-ATPase, às expensas de ATP, essas enzimas contribuem para manter o equilíbrio entre pH interno e externo (Rao et al., 1992; Portillo, 2000).
A função da H+-ATPase da membrana plasmática é gerar um gradiente eletroquímico de prótons que, por sua vez, energiza transportadores secundários importantes para a captação de nutrientes e íons, o que contribui para manutenção da homeostase de pH e iônica da célula. Esse equilíbrio é essencial para a funcionalidade celular.
6 Na figura 1 pode-se visualizar o modelo dos transportadores de íons primário (Pma1) e secundários, Ena1, Nha1, Kha1, Tok1, Trk1/Trk2, Nhx1, Nsc1 e a Vma1 (ATPase vacuolar) em S. cerevisiae. A extrusão de íons Na+ é de responsabilidade da Ena1p que é uma bomba de sódio, cuja atividade também depende de ATP assim como a Pma1p e V-ATPase. Em estresses do tipo alcalino, por íons Na+ e íons Li+, a expressão do gene ENA1 é induzida. Em S. cerevisiae o transportador Ena1p não apresenta especificidade pelo íon Na+ , já que outros íons monovalentes como o K+, podem também ser bombeados para fora da célula (Garciadeblas et al., 1993; Benito et al., 1997).
O transportador Nha1p, em S. cerevisiae, é necessário para mediar o transporte de Na+ /K+ principalmente em pHs externos mais ácidos, trocando estes íons por H+. É interessante que o gene NHA1 parece ser constitutivamente expresso em baixos níveis, ou seja, mudanças de pH ou outros estresses não influenciam sua expressão como ocorre com o gene ENA1 (Prior et al., 1996; Bañuelos et al., 1998; Sychrová et al., 1999).
Na membrana vacuolar estão localizados os tranportadores Nhx1p e a ATPase Vma, que compartimentalizam íons Na+ e prótons (H+), respectivamente, sendo praticamente dependentes do pH para exercerem sua função. A indução do gene NHX1 é por estresse salino e a enzima V-ATPase que é constituída por um complexo de proteínas periféricas contendo sítios de ligação de ATP, tem suas subunidades montadas e desmontadas de acordo com sinais citosólicos (Nass e Rao, 1998; Nass e Rao, 1999; Darley et al., 2000; Kane e Parra, 2000; Brett et al., 2005; Pardo et al., 2006; Cagnac et al., 2010).
7
Figura 1: Vias de transporte para a manutenção da homeostase iônica em S.cerevisiae. H+
-ATPase de membrana plasmática (Pma1) gera o gradiente eletroquímico de prótons e energiza os transportadores secundários; H+-ATPase vacuolar (Vma) compartimentaliza H+; bomba de sódio (Ena1) bombeia para fora da célula Na+/K+; antiporter de Na+/H+ (Nha1); antiporter de K+/H+ (Kha1); transportadores de Na+/K+ para o citoplasma (Trk1/Trk2); canal de K+ (Tok1); retificador de cátions não seletivo (Nsc1); compartimentalizador de Na+ (Nhx1), troca esse íon por H+. Fonte: Wadskog e Adler, 2003.
Em decorrência aos estresses sofridos, células de vida livre precisam desenvolver respostas rápidas, fundamentais para a reparação e proteção celular (Ruis e Schüller, 1995; Swan e Watson, 1998; Estruch, 2000). Estas respostas compreendem respostas bioquímicas e modulação na expressão gênica (Birch e Walker, 2000).
1.3. Estresse térmico e estresse térmico subletal
8 1994; Ribeiro et al., 1997; Soto et al., 1999; Mahmud et al., 2010; Benjaphokee et al., 2012).
A termotolerância, indicada como a capacidade das células suportarem uma elevação súbita de temperatura, pode ser adquirida quando estas células são expostas a uma pré-condição de tratamento térmico não letal (subletal), tornando-as mais resistentes a uma posterior elevação térmica. Células de S. cerevisiae quando cultivadas em condições normais de temperatura e, depois submetidas a 40°C por determinado tempo, demonstraram bastante resistência quando foram submetidas posteriormente a temperaturas mais elevadas ou mesmo quando retornaram à tempertatura normal de crescimento, após o pré-tratamento, o que seria letal para as mesmas antes destas adquirirem a termotolerância (De Virgilio et al.,1991; Mahmud et al., 2010).
HSPs (proteínas de choque térmico) são induzidas durante choque térmico. Em S. cerevisiae, a hsp104, é necessária para aquisição de termotolerância, sendo que em condições normais de crescimento não foi relatado a sua indução (Sanchez et al., 1992). As HSPs atuam como chaperonas de forma a auxiliar no “folding” e “refolding” de proteínas, evitando a desnaturação e agregação de proteínas desnaturadas (Beckmann et al., 1990). Foi relatado que o choque térmico pode ativar também os fatores de transcrição Msn2/Msn4 que regulam a transcrição de genes envolvidos também em resposta a outros tipos de estresses, além do estresse por choque térmico (Estruch, 2000).
9 1.4. Mecanismos envolvidos na resposta ao estresse ácido – Reservas energéticas
Para manter as atividades metabólicas normais, as células de levedura necessitam de ambiente intracelular e extracelular equilibrado e de uma série de fatores que podem influenciar no seu ciclo de vida. Flutuações ocorridas no meio extracelular influenciam o ambiente interno culminando em modificações fisiológicas como na redução de atividades enzimáticas, interrupção do fluxo metabólico, mudança nos gradientes químicos e danos de estruturas celulares, gerando certa instabilidade celular.
As leveduras crescem bem em pHs ligeiramente ácidos e geralmente respondem a uma situação de estresse através de respostas moleculares rápidas que são desencadeadas para reparar danos. Respostas a estresses podem ser caracterizadas pela síntese de proteínas específicas, como as HSPs, por ativação da H+-ATPase, aumento da síntese e/ou degradação de trealose e glicogênio, síntese de glicerol e outros (Hohmann e Mager, 1997; Birch e Walker, 2000; Gash, 2003). As reservas energéticas, ATP, trealose e glicogênio, podem ter papel importante nestas respostas a estresses.
1.4.1. ATP (Adenosina 5 - trifosfato)
O ATP é uma molécula presente em todas as células vivas que exerce várias funções celulares, como a participação em processos de sinalização celular e em reações metabólicas, por exemplo, (Fellin e Carmignoto, 2004; Bell et al., 2009).
A demanda e a oferta dessa molécula podem afetar alguns processos importantes como, o transporte ativo, “folding” de proteínas, morfologia celular, transdução de sinais, resposta a estresses, entre outros (Kragol et al., 2001; Hamilton et al., 2002; Yuroff et al., 2003; Klipp et al., 2005; Watanabe et al., 2005; Boldogh e Pon, 2006; Milgrom et al., 2007; Romero et. al., 2007), porque ela pode ser utilizada tanto como substrato como produto, ativador e/ou inibidor de vias metabólicas (Nelson e Cox, 2004).
10 Em situações de estresses, mecanismos de resposta são ativados nas células a fim de auxiliar a adaptação ao novo ambiente. Em S. cerevisiae, um mecanismo importante e que necessita de ATP para a sua ativação e funcionamento, é a atividade das H+-ATPases que estão localizadas na membrana plasmática (Pma1p) e vacuolar (V-ATPase) das células, codificadas pelo gene PMA1 e VMA1, respectivamente (Venema e Palmgren, 1995; Causton et al., 2001; Hamilton et al., 2002). A atividade da H+ -ATPase pode sofrer alterações de acordo com as condições de crescimento e, neste caso, a glicose e o pH ácido são responsáveis por sua regulação, sendo a glicose, estimuladora da expressão e do aumento da atividade catalítica desta enzima. O pH ácido, em leveduras, diminui o pH citosólico que, por sua vez, promove também a ativação desta enzima (Tuduri et al.,1985; Lentzen et al., 1987; Ramos et al., 1992; Rao et al., 1993).
A ativação e regulação das H+-ATPases pelo pH ácido tem por objetivo manter o pH intracelular em torno da neutralidade, manter a homeostase iônica, além de gerar um gradiente eletroquímico que é importante para energizar transportadores secundários (Fig.1). É sabido que o gradiente transmembranar é a força motriz na captação de nutrientes e produção de ATP e que, além disso, os transportadores secundários, energizados por este gradiente, estão envolvidos em processos de manutenção do volume celular, manutenção do pH intracelular e composição iônica, como citado, e em extrusão de substâncias tóxicas, conjunto de funções que auxiliam na viabilidade celular (André, 1995; Ambesi et al., 2000; Morsomme et al., 2000; Portillo, 2000).
11 1.4.2. Trealose e Glicogênio
Trealose ( -D-glicopiranosil -D-glicopiranosideo) é um dissacarídeo não redutor encontrado em diversos organismos como fungos, bactérias, algas, insetos, plantas, invertebrados e leveduras. Tem sido relatado o acúmulo deste açúcar em condições ambientais adversas tais como em situações de estresses (Gaff, 1971; Elbein, 1974; Thevelein, 1984; Zentella et al., 1999; Chen et al., 2002; Schluepmann et al., 2004).
A síntese deste dissacarídeo ocorre a partir da UDP-glicose (uridina difosfato glicose) pelo complexo trealose-6-fosfato sintase/fosfatase (TPS) (Bell et al., 1998).
Em períodos de crescimento reduzido, em fungos, verificou-se a ocorrência da síntese de trealose comparando sua intensidade com processos de diferenciação e esporulação (Thevelein, 1984).
Outra função tem sido atribuída à trealose além de seu papel de reserva de energia, que é a de proteção celular, especialmente em condições de estresses, cuja ação é prevenir a desnaturação de proteínas e estabilizar membranas (Singer e Lindquist, 1998). Esta função protetora da trealose tem sido estudada e caracterizada desde 1984 através de simulações de diversas situações de estresses celulares (Crowe et al., 1984). Estresses por congelamento, osmótico, desidratação, térmico, ácido, dentre outros tem sido descritos, com foco no comportamento de síntese e degradação da trealose nestas situações. Teorias foram propostas para explicar o mecanismo de como ela pode preservar membranas e proteínas, sendo elas a de vitrificação, exclusão preferencial e substituição de água (Crowe et al., 1984, 1996, 1998; Sola-Penna e Fernandes, 1998; Jain e Roy, 2010).
12 trealose e a formação de cristais de gelo pode ser evitada (Sola-Penna e Fernandes, 1998; Roy e Gupta, 2004; Kilburn et al., 2006; Jair e Roy, 2010).
A água pode proteger a estrutura tridimensional de proteínas através de ligações de hidrogênio com seus resíduos hidrofílicos. A trealose também pode fazer estas ligações, de forma a substituir a água quando esta estiver escassa ou em falta total. Desta forma, a estrutura das proteínas pode ser preservada (Lee et al., 1986; Crowe et al., 1984, 1996, 1998).
13
Figura 2: Modelos para proteção de proteínas exercida pela trealose. Vitrificação -
aprisionamento das proteínas na sua conformação nativa em uma espécie de líquido viscoso formado pela trealose impedindo a desnaturação dessas proteínas; Substituição de água - a trealose faz ligações do tipo pontes de hidrogênio com as proteínas preservando a estrutura tridimensional dessas proteínas; Exclusão preferencial - interação da trealose com moléculas de água em torno das proteínas criando o efeito de crioproteção. Adaptado de Chiu et al., 2011.
A redução da taxa específica de crescimento em S. cerevisiae está correlacionada com alto teor de trealose, pois, em baixas concentrações de açúcar, estas células podem acumular trealose ainda por algumas horas. (Küenzi e Flechter, 1972; Grba et al., 1975). Esta propriedade é utilizada por produtores de fermento comercial de panificação, com o objetivo de aumentar o conteúdo de trealose nas células em até 20% de seu peso seco (Gélinas et. al., 1989, Reed e Nagodawithana, 1991; Degree, 1993).
14 seu pH ótimo de atividade é neutro (Souza e Panek, 1968; Jules et al., 2004, Parrou et al., 2005; Huang et al., 2007).
A trealase neutra hidrolisa trealose intracelular em condições normais de crescimento e também em condições de diferentes estresses (San Miguel e Argüelles, 1994). Sua atividade é regulada/ativada por fosforilação por meio da proteína quinase dependente de AMPc (Thevelein, 1984). Segundo Zahringer et al. (2000), a atividade da trealase neutra em parte depende da interação dos fatores de transcrição Msn2p/Msn4p com sequências presentes no promotor de STREs (elementos de resposta a estresses). O gene NTH2 também codifica uma trealase neutra que possui cerca de 77% de identidade com o gene NTH1, porém, o seu papel ainda não foi esclarecido (Nwaka et al., 1995 a, b). Jules et al. (2008) avaliaram células de levedura com mutação no gene NTH1 e observaram que na ausência desta trealase ocorreu mobilização de trealose, sugerindo que esta mobilização pode ter sido realizada pelas outras 2 trealases (Ath1 e Nth2).
A trealase ácida parece não ser alterada durante períodos de mobilização de trealose, caracterizando uma atividade constitutiva (Thevelein, 1984). De forma contraditória, San Miguel e Argüeles (1994) descreveu a atividade desta enzima apenas nas fases respiratória e estacionária e elevação da atividade quando os níveis de trealose são altos. E a atividade da trealase neutra na fase exponencial quando os níveis de trealose são mais baixos.
Outro carboidrato de reserva em leveduras é o glicogênio, um biopolímero de alta massa molecular, encontrado em animais e leveduras. Este polissacarídeo é pouco solúvel, bastante ramificado e constituído exclusivamente por monômeros de glicose unidos entre si por ligações -1,4 e -1,6 nas ramificações.
15 A evidência de que a principal função do glicogênio é fornecer energia para as atividades celulares, quando há escassez de nutrientes, foi fornecida após estudos utilizando células mutantes com deficiência respiratória (Chester, 1964; Chester, 1968; Thompson-Jaeger et al., 1991; Cannon et al., 1994). Entretanto, Enjalbert et al. (2000) verificaram que células com esta mesma deficiência respiratória, acumularam mais glicogênio durante a fase de crescimento fermentativo em glicose, mas que sua mobilização foi mais rápida nas células selvagens do que nas mutantes, quando a glicose começou a faltar. Isso se deve, provavelmente, à inativação da enzima glicogênio sintase e ativação da enzima glicogênio fosforilase na linhagem selvagem, sendo esta última, responsável pela degradação do polissacarídeo.
A degradação do glicogênio tem a ação conjunta das enzimas glicogênio fosforilase (Gph1p), e da enzima desramificadora (Gdb1p), codificadas pelos genes GPH1 e GDB1, respectivamente (Hwang e Fletterick, 1986).
Sugere-se que a ativação das enzimas de degradação da trealose e do glicogênio e inativação das respectivas enzimas responsáveis pela síntese, são iniciadas quando a glicose induz a ativação da via PKA dependente de AMPc e os nutrientes estimulam uma atividade prolongada desta via que controla processos fundamentais, como o crescimento celular, morfogênese, proliferação e respostas ao estresse (Becker et al., 1982; Thevelein, 1984; François et al., 1988; François et al., 1991; Durnez et al., 1994).
16 1.5. Outros genes de resposta a estresses em geral
Jejum prolongado, carências nutricionais, limitações de glicose e de outras fontes de carbono, também geram estresses para as células de levedura, influenciando diretamente no metabolismo celular e no seu ciclo de vida. A entrada na fase estacionária de crescimento está diretamente relacionada às condições nutricionais. Em S. cerevisiae, uma proteína desempenha um papel importante no controle metabólico, a proteína quinase Snf1, membro da família SNF1/AMPK (Hardie et al.,1998; Kahn et al., 2005). Esta proteína é necessária para uma adaptação à condição de limitação de glicose auxiliando na utilização de outras fontes de carbono que não a preferencial. Ela é ativada nesta situação de limitação e também em outros estresses, e exerce papel em processos celulares de desenvolvimento, como na esporulação (Carlson et al., 1981; Woods et al., 1994; Wilson et al., 1996; Gancedo, 1998; Carlson, 1999; Ashrafi et al., 2000; McCartney. e Schmidt, 2001).
Snf1 está também envolvida nas respostas celulares cujos fatores estressantes incluem o íon sódio, pH alcalino, choque térmico e estresse oxidativo, afetando processos regulatórios por mecanismos variáveis (Thompson-Jaeger et al., 1991; Hong e Carlson, 2007; Casamayor et al.; 2012).
17 al., 1998; McCartney. e Schmidt, 2001; Scott et al., 2002; Young et al., 2003; Hedbacker e Carlson, 2008; Hardie et al., 2007, 2011a e b).
Dados da literatura demonstram o comportamento celular de S. cerevisiae frente a estresses ácidos. Notavelmente foi verificado quão amplo é caracterizado o estresse por ácidos orgânicos principalmente no que diz respeito ao uso de ácidos orgânicos fracos como conservantes de alimentos, a produção de ácidos orgânicos por bactérias e fungos filamentosos assim como a competição intra- e inter-espécies de micro-organismos em processos fermentativos que leva à acidificação do meio externo (Porro et al., 2002; Mira et al., 2010).
As situações de reciclagem celular na indústria de bebidas e de combustíveis, as quais ocorrem pela lavagem das células com ácidos inorgânicos fortes como o ácido sulfúrico, e posterior reutilização das células em novos processos fermentativos e a resistência probiótica à passagem pelo trato intestinal, tendo o ácido clorídrico como componente desse ambiente, consistem em estresses ácidos inorgânicos. Esse estresse é pouco estudado apesar de constituir um importante processo de estabilização dos processos fermentativos em escala industrial pela redução microbiana contaminante, adaptação e resistência celular que são fatores de grande relevância para a biotecnologia. (Fietto et al., 2004; Souza e Mutton, 2004; Basso et al., 2008).
19
2. Objetivos
2.1. Objetivo geral
Investigar a importância das reservas energéticas, ATP, trealose e glicogênio, na resposta ao estresse ácido inorgânico em Scerevisiae.
2.2. Objetivos específicos
• Analisar e comparar o efeito do pH ácido (HCl pH 2,0 + 86 mM de NaCl) sobre a viabilidade celular de diferentes linhagens de S. cerevisiae;
• Analisar o conteúdo e a mobilização de ATP em diferentes linhagens de S. cerevisiae ao longo do tempo de exposição à condição de estresse ácido HCl pH 2,0 + 86 mM de NaCl;
• Analisar o conteúdo e a mobilização de trealose e glicogênio em diferentes linhagens de S. cerevisiae, ao longo do tempo de exposição à condição de estresse ácido HCl pH 2,0 + 86 mM de NaCl;
• Analisar o conteúdo e a mobilização de trealose e glicogênio em células de S. cerevisiae W303, ao longo do tempo de exposição à condição de estresse ácido HCl pH 2,0 + 86 mM de NaCl, antes e depois de um tratamento térmico subletal (41°C/2h), nas fases de crescimento exponencial e estacionária;
22
3. Materiais e Métodos
3.1. Micro-organismos
Tabela 1: Linhagens de Saccharomyces cerevisiae Linhagens de
leveduras Genótipo Fonte
S.boulardii Cepa selvagem FLORATIL®, Merck S.A.
W303 Matα leu2-3,112 ura3-1 trp1-1 his3-1,15 ade2-1 can1-100 GAL mal SUC2
Johan M. Thevelein. Katholieke Universiteit
Leuven, Belgium.
UFMG 905 S. cerevisiae – selvagem
Carlos A. Rosa. Universidade Federal
de Minas Gerais
LBCM 479 W303 Mat ena1:: HIS3:: ena4 Hana Sychrová
BY4741 MATa; his3 1; leu2 0; met15 0; ura3 0 Euroscarf
nth1 BY4741; Mat a; his3 1; leu2 0; met15 0;
ura3 0; YDR001c::kanMX4 Euroscarf
nth2 BY4741; Mat a; his3 1; leu2 0; met15 0;
ura3 0; YBR001c::kanMX4 Euroscarf
ath1 BY4741; Mat a; his3 1; leu2 0; met15 0;
ura3 0; YPR026w::kanMX4 Euroscarf
tps1 BY4741; Mat a; his3 1; leu2 0; met15 0;
23 3.2. Condições de cultivo
Inicialmente, as linhagens de leveduras listadas na Tabela 1, foram cultivadas em 5 ml de meio YP [1% (w/v) de extrato de levedura, 2% (w/v) de peptona] contendo 2% de glicose (w/v) (YPD), em um shaker (200 rpm), a 30ºC, overnight. As células foram tranferidas para um erlemmeyer contendo 100 mL de meio YPD 2% (D.O.600nm
inicial de 0,2) e crescidas até atingir a D.O.600nm = 1,0 para a fase exponencial e
D.O.600nm = 2,5-3,5 para a fase estacionária.
3.3. Choque ácido
A cultura de 100 mL de células cultivadas em meio YPD (2%) até as fases exponencial e estacionária foi centrifugada a 2885g/5min./4ºC e lavada 2x com YP. Para a amostra controle (0 minutos), foi retirada uma alíquota de 10 mL e o restante da cultura foi ressuspendida, no mesmo volume, em solução de HCl pH2.0 + 86 mM NaCl, transferida para um erlemmeyer e deixada sob agitação em banho-maria a 30ºC. Nos tempos 10, 30, 60 minutos, foram coletadas alíquotas de 10 mL, que foram lavadas 2x com YP para então serem submetidas a análises posteriores.
3.4. Avaliação da viabilidade celular
24 3.5. Determinação de peso seco
Alíquotas de 10 mL (ou 6 mL das culturas), usadas para dosagens de trealose e glicogênio (ou de ATP – 6mL), foram coletadas, filtradas a vácuo em membranas pré pesadas, lavadas com água Milli-Q e submetidas à temperatura de 80°C, por 24 horas. O peso seco foi dado pela diferença de peso das membranas com células em relação às sem células. O resultado foi expresso em g/mL de suspensão.
3.6. Determinação dos níveis ATP
Os níveis celulares de ATP foram determinados pelo método luciferina-luciferase (Loo et al., 2010), com modificações. As alíquotas de 6 mL dos tempos 0, 10, 30 e 60 minutos expostas ao estresse ácido, cuja cultura foi até a D.O600 nm = 1,0, foram
filtradas a vácuo em membrana de 25 mm de diâmetro e poro de 0,75 µm e lavadas com solução de metanol 1:1, gelada. Posteriormente, realizou-se a lise celular da membrana que recebeu o filtrado, através de maceração em graal previamente gelado, com 1,5 mL de solução de ácido perclórico (HClO4) 1,2 M, 1,5 mL de água Milli-Q e nitrogênio
25 3.7. Determinação dos níveis de trealose e glicogênio
A metodologia utilizada para dosar trealose e glicogênio foi a descrita por Parrou e François (1997), com modificações. As alíquotas controle (0 minutos) e tempos 10, 30 e 60 minutos expostas ao estresse ácido, cuja cultura foi até a D.O600 nm =
1,0 foram centrifugadas a 2885g/5min./4ºC. Após centrifugação, as células foram ressuspensas em 0,25 mL de solução de carbonato de sódio 0,25 M, 0,15 mL de solução de ácido acético 1 M e 0,6 mL de solução de acetato de sódio 0,2 M pH 5,2 e a suspensão foi transferida para tubos previamente gelados contendo pérolas de vidro. Procedeu-se o rompimento das células por agitação em vortex por 6 ciclos de 1 minuto deixando em banho de gelo imediatamente após cada ciclo de agitação. Após a lise celular, centrifugou-se a suspensão a 16000g por 3 minutos. O extrato livre de células foi dividido em 2 frações de 500 µL cada. Uma das frações foi incubada com 10 µL de trealase (3,2 U/mg proteínas) (Neves et al., 1994) a 37ºC, e a outra parte foi incubada com 1,85 µL de amiloglicosidase (0,600 U/mg proteínas) (Sigma-Aldrich) a 57ºC, ambas por 24 horas e em banho-maria, sob agitação. Determinou-se o conteúdo de glicose nos extratos pelo método de glicose-oxidase peroxidase Os níveis de trealose e glicogênio foram expressos em mg de glicose liberada/g peso seco-1 da suspensão. Os experimentos foram realizados em triplicata.
3.8. Choque térmico subletal - resposta adaptativa
Após o cultivo da S. cerevisiae W303, da BY4741 e da mutante snf1 , atingir a DO600nm = 1,0 para a fase exponencial e DO600nm = 2,5-3,5 para a fase estacionária e
26 horas de incubação a 41°C (choque térmico subletal), aplicou-se a metodologia do choque ácido também para estas frações. As alíquotas retiradas em cada tempo (0, 10, 30, 60 minutos) foram lavadas com YP e ressuspensas em 0,25 mL de solução de carbonato de sódio 0,25 M, 0,15 mL de solução de ácido acético 1 M e 0,6 mL de solução de acetato de sódio 0,2 M pH 5,2 e procedeu-se com a metodologia de lise celular e incubação descrita no procedimento anterior.
3.9. Medida da atividade enzimática das trealases neutra e ácida
Para medida da atividade enzimática das trealases neutra e ácida, adotou-se medotologia proposta por (Argüeles et al., 1990), modificada. Para avaliar a atividade enzimática das trealases, as células de S. cerevisiae W303, de BY4741 e do mutante snf1 foram cultivadas em 200 mL de meio YPD 2%, a 30ºC em shaker até a DO600nm =
1.0, correspondente à fase exponencial e DO600nm = 2,5-3,5 correspondente à fase
estacionária, Após atingir a D.O., as células foram centrifugadas a 2885g/5min/4ºC, lavadas 2x com meio YP. Metade da suspensão foi ressuspendida no mesmo volume de YP e incubada, sob agitação (200rpm), a 41ºC/2h (choque térmico subletal) e a outra metade foi ressuspensa no mesmo volume de tampão Mes (Ácido 2-morfolino Etanosulfônico) 10 mM pH 7,0, gelado, e incubada por 10 minutos, sob agitação, em banho-maria a 30ºC. Lavou-se em água destilada gelada e ressuspendeu-se em solução de HCl pH 2,0 + 86 mM de NaCl após a retirada da alíquota controle. Nos tempos 0, 10, 30, 60 minutos, foram coletadas alíquotas de 5 mL (~90 mg de células). As alíquotas foram lavadas 2x com água destilada gelada. Após lavagem, ressuspendeu-se cada amostra em tampão Mes 10 mM pH 7,0 + PMSF 0,5 mM, transferiu-se para tubos previamente gelados contendo pérolas de vidro e agitou-se em vortex por 6 ciclos de 30 segundos deixando em banho de gelo imediatamente após cada ciclo de agitação. Após a lise celular, os extratos foram centrifugados a 16000g por 3 minutos. Proteínas totais nos extratos foram dosadas pelo método de Lowry et al. (1951).
Ensaios de atividade trealásica - Incubou-se 50 µL do extrato enzimático com 200 µL de 200 mM de trealose preparada em 50 mM de Mes pH 7,0 + 125µM de CaCl2
27 contendo 1mM de EDTA (pH final 4,66) para avaliar a atividade da trealase ácida. As suspensões foram incubadas a 30ºC por 30 minutos e a reação foi interrompida por incubação em banho-maria a 100ºC por 5 minutos.
Dosou-se glicose nas amostras pelo método de glicose-oxidase peroxidase. A atividade específica foi expressa em nmol de glicose liberada por min/mg proteína.
3.10. Dosagem de glicose
Para dosar glicose nos extratos, uma curva padrão foi construída (ver anexo), cujas concentrações de glicose foram de 0,01 a 0,08 mg por 100 mL. De cada extrato, foi retirada uma alíquota de 10 µL a qual foi diluída em água Milli-Q para um volume final de 125 µL. A suspensão foi homogeneizada. Adicionou-se 1 mL de solução de glicose-oxidase-peroxidase mais ortodianisine dihydrocloride na proporção de 100:1 e procedeu-se a homogeneização. Em seguida, a suspensão foi incubada a 37°C por 10 minutos em banho-maria, após este período de incubação, a reação foi interrompida com 0,5 mL de solução de ácido sulfúrico (H2SO4) 56%. As amostras foram lidas em
espectrofotômetro (Thermo Scientific, Biomate 3), a 505 nm. Os dados foram utilizados
3.11. Dosagem de proteínas
Para dosar proteínas nas amostras, utilizou-se a metodologia de Lowry et al. (1951) com algumas modificações. Para a construção da curva padrão (em anexo) as concentrações de 25, 50, 75, 100, 150, 200, 250 e 350 µg/mL de BSA (soro albumina bovina) foram utilizadas. Para análise de proteínas totais nas amostras, alíquota de 10 µL dos extratos livre de células foram diluídas para 200 mL com água Milli-Q, em duplicata, e homogeneizadas. Adicionou-se 1 mL de solução A+B (A=20 g de Na2CO3
em NAOH 0,1 N; B=200 mg de tartarato duplo de sódio e potássio + 1,14% de CuSO4
28 3.12. Análise estatística
30
4. Resultados e Discussão
4.1. Efeito do pH ácido em linhagens de S. cerevisiae
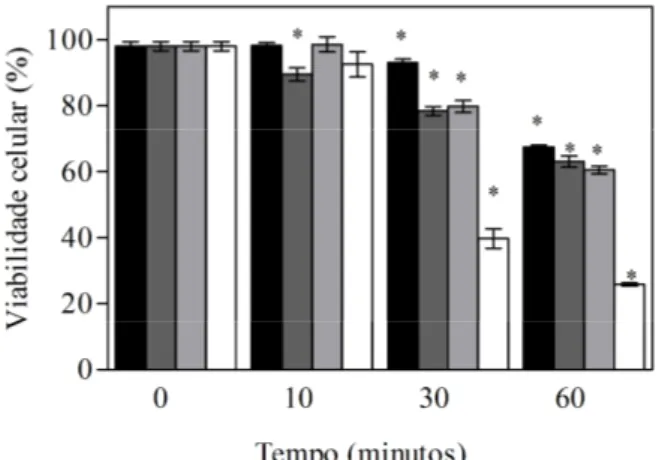
A figura 3 mostra os dados de viabilidade celular das linhagens S. cerevisiae var. boulardii, S. cerevisiae UFMG 905, S. cerevisiae LBCM 479 (ena 1-4 ) e S. cerevisiae W303, após 0, 10, 30 e 60 minutos de exposição à condição de pH ácido (HCl pH 2,0 + 86 mM de NaCl).
Observa-se que, após exposição das células ao pH 2.0, as linhagens apresentam valores de sobrevivência bem próximos aos das células não estressadas exceto a W303, que se mostrou mais sensível a essa condição de estresse por ácido inorgânico. S. boulardii, UFMG 905 e LBCM 479 (ena1-4 ), após 60 minutos de exposição apresentaram maior taxa de sobrevivência, em torno de 70%, enquanto a linhagem W303 apresentou uma viabilidade de aproximadamente, 26%. Dessa forma, altas taxas de viabilidade celular podem sugerir maior tolerância dessas linhagens à condição de estresse ácido avaliada no presente estudo.
Figura 3: Taxa de viabilidade celular (%) de Saccharomyces boulardii ( ), Saccharomyces
cerevisiae LBCM 479 (ena 1-4 ) ( ), Saccharomyces cerevisiae UFMG 905 ( ) e
31 S. cerevisiae W303 tem mostrado alta sensibilidade também a ácidos fracos. Dados de Giannattasio et al. (2005) demonstram que em 80 mM de ácido acético em um tempo de 90 minutos, a viabilidade de W303 decresce de 60% para 30%.
Em trabalhos realizados no nosso laboratório, as linhagens W303 e S. boulardii apresentaram resultados de viabilidade celular semelhantes aos encontrados neste trabalho (Fietto et al., 2004). Resultados de sobrevivência a diferentes estresses, assim como dados de transporte e crescimento, levaram os autores concluírem que apesar da S. boulardii ser semelhante geneticamente à S. cerevisiae, eles apresentam diferenças fisiológicas e metabólicas marcantes.
Em outro estudo (Sant Ana et al., 2009), também em nosso laboratório, utilizando a linhagem W303, a viabilidade celular foi avaliada em pH 2,0 e pH 2,0 + 86 mM NaCl. Na primeira condição, praticamente 100% da população de células de W303 morre após 60 minutos de exposição ao estresse, enquanto que, na segunda condição, essa taxa de morte foi de, aproximadamente, 75% para o mesmo período de tempo. Assim, os autores atribuem a maior sobrevivência dessas células ao papel protetor dos íons sódio, que é um componente natural do suco gástrico, na resposta ao estresse ácido. Para confirmar tais inferências, linhagens com deleção nos genes ENA1-4 também foram avaliadas, uma vez que estas bombas de sódio são importantes para a homeostase de sódio em S. cerevisiae.
Nossos dados (Fig.3) confirmam dados prévios de viabilidade da cepa LBCM 479 (ena 1-4 ) exposta ao estresse ácido em presença de 86 mM de NaCl, e mostram ainda que a cepa selvagem UFMG 905, isolada de um processo de produção de cachaça de uma pequena destilaria da cidade de Germana (MG) (Oliveira et al.,2004) é também uma cepa com boa resistência ao pH ácido.
32 4.2. Níveis intracelulares de ATP em linhagens de S. cerevisiae sob condição de estresse ácido
A figura 4 mostra os níveis intracelulares de ATP encontrados nas diferentes linhagens ao longo do período de exposição ao estresse ácido. Os dados apresentados demonstraram um consumo de ATP ao longo da exposição ao ácido inorgânico.
O nível inicial de ATP parece ser mais elevado na linhagem selvagem UFMG 905 quando comparado às demais linhagens. Observa-se, ainda, que o consumo desta reserva energética ao longo do tempo é coerente com as altas taxas de viabilidade celular apresentadas na figura 3 para essa mesma levedura. Acredita-se que esse comportamento se deve a uma capacidade elevada de bombear prótons, característica possivelmente inerente à linhagem selvagem. O consumo de ATP ao longo do tempo de exposição em W303 e S. boulardii são bastante similares, entretanto quando correlacionamos o consumo de ATP com os dados de viabilidade (Fig.4 e Fig.3, respectivamente), observamos que a linhagem W303 é muito mais sensível ao estresse ácido apesar do consumo semelhante de ATP.
Quando analisamos o consumo de ATP na linhagem ena1-4 , observamos um decréscimo dos níveis de ATP inferior ao das outras linhagens. Embora o perfil de consumo de ATP tenha sido semelhante entre as linhagens durante a exposição ao ácido, e que este consumo seja importante para o bombeamento de prótons, acredita-se que pode estar havendo síntese de ATP a partir das reservas energéticas trealose e glicogênio, e que essa síntese ocorra simultaneamente ao consumo de ATP, necessário para bombear prótons para o meio extracelular. Todavia, pode-se observar que as taxas de consumo e síntese de ATP podem variar entre linhagens distintas.
33
Figura 4: Níveis de ATP (mM) em Saccharomyces boulardii ( ), Saccharomyces cerevisiae
LBCM 479 (ena 1-4 ) ( ), Saccharomyces cerevisiae UFMG 905 ( ) e Saccharomyces cerevisiae W303 ( ) cultivadas em meio YPD (2%) (D.O.600nm 1.0) e submetidas à condição de estresse ácido (HCl pH 2.0 + 86 mM NaCl). Os resultados estão apresentados como média ± desvio padrão. Diferenças estatísticas (p<0,05) estão representadas pelo símbolo (*) em relação ao tempo 0 de cada linhagem.
Em S. cerevisiae níveis intracelulares de ATP podem variar em função de modificações do fluxo glicolítico o que depende do tipo de metabolismo que as células apresentam. Como podem apresentar tanto o metabolismo fermentativo quanto o respiratório, em fontes de carbono fermentáveis e em presença de açúcares não fermentáveis, respectivamente, e ainda podem apresentar o metabolismo diáuxico, a flexibilidade metabólica verificada nestas células faz com diferentes níveis de ATP sejam encontrados em cada um desses metabolismos (Larsson et al., 1993; Porro et al., 1994; Daran-Lapujade et al., 2007).
34 Ser-899 e Glu-901, considerados sítios putativos de fosforilação. A dupla fosforilação elimina o efeito inibitório exercido pelo domínio C-terminal e o ATP pode ser hidrolisado para que a H+-ATPase mantenha sua atividade (Chang e Slayman, 1991; Eraso e Portillo, 1994; Portillo, 2000). A inativação do domínio autoinibitório pode contribuir para a ativação da H+-ATPase por acidificação externa (Benito et al., 1992).
A acidificação do meio desencadeia uma série de problemas, entre eles a diminuição do crescimento celular, da síntese de metabólicos, porém, esta acidificação também induz respostas adaptativas e tanto a produção de ácidos orgânicos como o funcionamento da H+-ATPase provocam redução do pH do caldo fermentativo. Portanto, vários estudos tem avaliado diferentes estratégias com a finalidade de favorecer a manutenção do equilíbrio do pH intracelular em células de leveduras comumente utilizadas na indústria de alimentos e bebidas, incluindo a adição de bases ao meio de cultivo ou ainda técnicas de manipulação gênica (Patnaik et al., 2002; Cánovas et al., 2007; Sánchez et al., 2008; Yáñez et al., 2008; Wei et al., 2008).
A importância da atividade da H+-ATPase se deve ao papel que esta exerce no estabelecimento de um gradiente eletroquímico de prótons, capaz de dirigir o transporte secundário de nutrientes através da membrana plasmática (Rao et al., 1992). Por outro lado a extrusão de prótons (H+), dependente da hidrólise de ATP, contribui para a manutenção do pH interno. Morsomme et al. (2000) demonstraram que até 20% do pool de ATP celular é consumido pela H+-ATPase da membrana plasmática para sua atividade e funcionalidade.
35 (Holyoak et al., 1996; Viegas et al., 1998; Portillo, 2000; Bobik et al., 2010; Takahashi et al., 2012).
Tem sido sugerido que o ácido fraco ativa a PMA1 in vivo. Mutantes pma1-205 mostraram maior sensibilidade ao ácido sórbico que sua cepa parental, dado que a atividade da H+-ATPase destes mutantes é 50% menor do que a linhagem parental. Os níveis de ATP foram reduzidos na linhagem selvagem e no mutante, de forma coerente com uma possível atividade destas enzimas. Foi demostrado também que mutações em enzimas importantes da via glicolítica, cuja capacidade celular de geração de ATP foi reduzida, foram mais sensíveis ao ácido (Holyoak et al., 1996), sugerindo a idéia de que uma quantidade suficiente de ATP é necessária para conduzir a ativação e manutenção do funcionamento da H+-ATPase.
Dessa forma, o aumento da oferta de ATP intracelular pode ser uma maneira eficaz de melhorar o desempenho do crescimento de células em condições ácidas, principalmente porque o ATP pode servir como substrato para as H+-ATPases. Essa oferta pode ser pela adição de um substrato como fonte de energia auxiliar, como o citrato, relatado ser co-substrato que melhora a geração de ATP em eucariotos (Sanchez et al., 2008; Zhou et al., 2009; Zhou et al., 2010).
As reservas de trealose e glicogênio também foram medidas nas mesmas condições de estresse já descritas a fim de verificar a participação da mobilização destas na tolerância ao pH ácido.
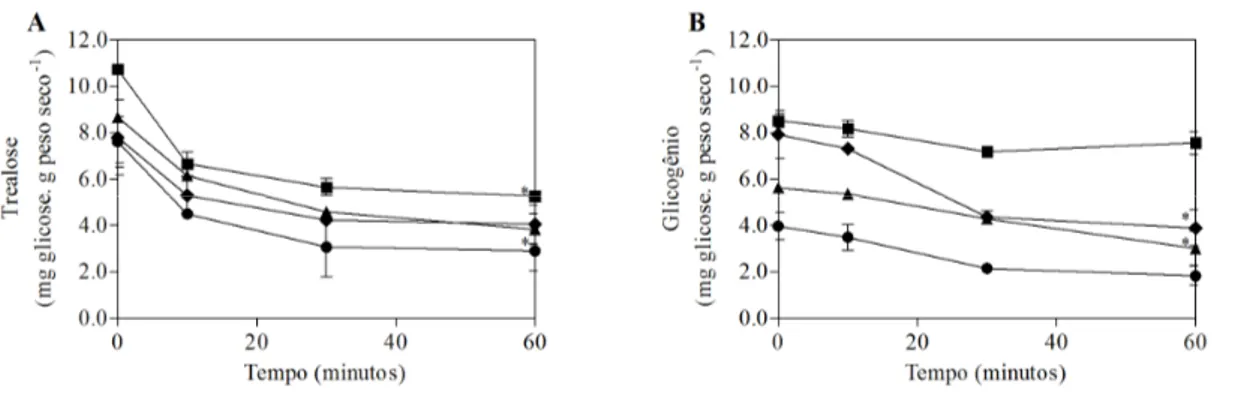
4.3. Níveis intracelulares de trealose e glicogênio em linhagens de S. cerevisiae submetidas à condição de estresse ácido
A figura 5 representa os níveis intracelulares de trealose (A) e glicogênio (B) presente em células de Saccharomyces cultivadas até a fase exponencial de crescimento. Observa-se que os níveis iniciais de trealose são mais elevados do que os de glicogênio, e que este dissacarídeo é consumido ao longo da exposição ao estresse ácido. Esse comportamento foi observado em todas as linhagens de leveduras avaliadas neste estudo.
1-36 4 , aproximadamente 50% do conteúdo da reserva de glicogênio foi consumido ao longo da exposição ao ácido. Por outro lado, os níveis dessa reserva energética mantiveram-se praticamente constantes ao longo da exposição ao ácido em W303. A possível não ativação da H+-ATPase e a ausência de consumo de glicogênio nesta linhagem podem estar associados a uma menor viabilidade, ao longo da exposição ao pH ácido.
Figura 5: Níveis de trealose (A) e glicogênio (B) em Saccharomyces boulardii ( ),
Saccharomyces cerevisiae LBCM 479 (ena 1-4 ) ( ), Saccharomyces cerevisiae UFMG 905
( ) e Saccharomyces cerevisiae W303 ( ) cultivadas em meio YPD (2%) (D.O.600nm 1.0) e submetidas à condição de estresse ácido (HCl pH 2.0 + 86 mM NaCl). Os resultados estão apresentados como média ± desvio padrão. Diferenças estatísticas (p<0,05) estão representadas pelo símbolo (*) em relação ao tempo 0 de cada linhagem.
Os dados de conteúdo de trealose e sua rápida mobilização sugerem que esta mobilização pode ser importante para as linhagens que obtiveram maior tolerância à condição de estresse (Fig.3). A trealose pode ter papel importante na proteção das células contra os vários danos causados pelo baixo pH, atuando tanto como fonte de energia como também prevenindo a desnaturação de proteínas.
37 de etanol em células de S. cerevisiae, foi verificado que este dissacarídeo pode ter efeito positivo sobre a viabilidade celular através da proteção e estabilização de membrana visto que, o etanol em excesso pode comprometer a integridade da membrana plasmática (Bandara et al., 2009). Em condição de estresse osmótico, Hounsa et al. (1998) também relataram o papel de proteção da trealose em S. cerevisiae.
O mecanismo de como a trealose pode proteger as células contra danos causados por estresses foi proposto por vários estudiosos e implica em 3 hipóteses distintas: a de vitrificação, a de substituição de água e a de exclusão preferencial. Todos os mecanismos têm por objetivo proteger as proteínas contra desnaturação, preservando suas estruturas e ainda estabilizando membranas (Crowe et al., 1984, 1996, 1998; Jain e Roy, 2010).
Trevisol et al. (2011) utilizaram mutantes defeituosos no transporte, síntese e degradação de trealose a fim de verificar a função do dissacarídeo no melhoramento da eficiência em fermentação alcoólica. Os autores concluíram que mutações nos genes envolvidos no metabolismo deste açúcar são prejudiciais para a viabilidade celular e que a trealose melhora a capacidade fermentativa das leveduras, ao evitar os danos provenientes do estresse oxidativo às proteínas, além de estender o tempo de vida das células e aumentar a produção de etanol.
38 4.4. Níveis intracelulares de trealose e glicogênio em células de S. cerevisiae W303 submetidas a tratamento térmico subletal de 41ºC por 2 horas e ao choque ácido
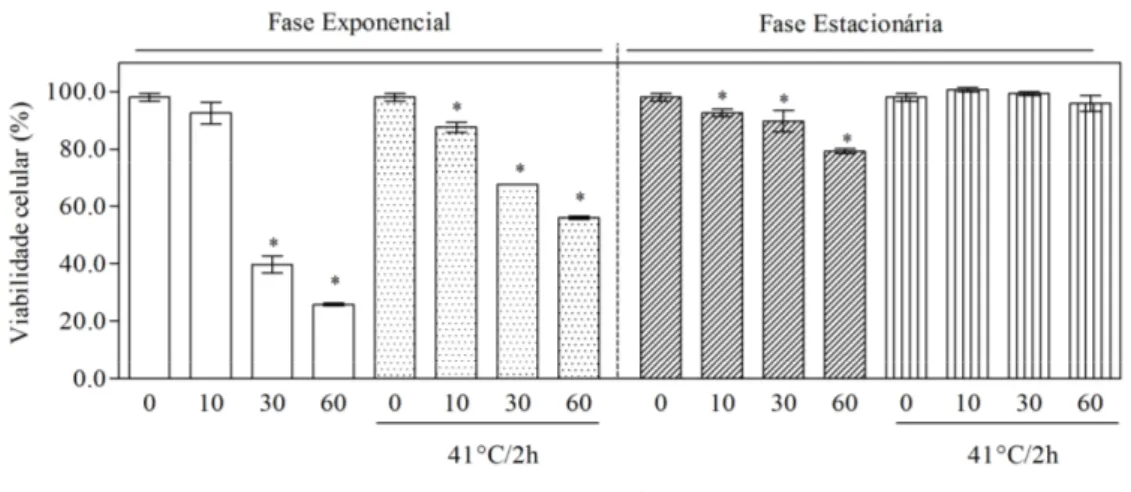
A aplicação de um tratamento subletal prévio pode aumentar a resistência das células a estresses subsequentes (Paiva e Panek, 1996). Com base nessa informação, células da linhagem W303 foram submetidas a um tratamento térmico subletal antes do choque ácido, a fim de verificar o acúmulo e a mobilização da trealose e a viabilidade celular depois desta pré-adaptação. A escolha da linhagem W303 se deve ao fato da mesma ter apresentado baixa resistência ao estresse ácido.
A figura 6 mostra os níveis de trealose e glicogênio medidos em células de W303 nas fases exponencial e estacionária de crescimento, antes e após tratamento térmico subletal, e sob a condição de estresse ácido (HCl pH 2,0 + 86 mM de NaCl). Pode-se observar que o conteúdo de trealose, expresso em mg de glicose/mg de proteína é maior na fase estacionária e que o tratamento térmico induz o acúmulo de trealose nas duas fases de crescimento.
É visível a mobilização desta reserva ao longo do tempo de exposição ao ácido em todas as situações, isto é, células controle e expostas a estresse ácido, células exponenciais e estacionárias submetidas a estresse, e estas mesmas células expostas a um estresse de temperatura subletal.
39
Figura 6: Níveis de trealose (A e B) e glicogênio (C e D) em células de Saccharomyces
cerevisiae W303 expostas ao estresse ácido (A e C), à temperatura subletal de 41ºC/2h e à
condição de estresse ácido (HCl pH 2.0 + 86 mM NaCl) (B e D). As células foram cultivadas em meio YPD (2%) até a fase exponencial (D.O.600nm 1,0) ( ) e estacionária (D.O.600nm 2,5-3,5) ( ) de crescimento. Os resultados estão apresentados como média ± desvio padrão. Diferenças estatísticas (p<0,05) estão representadas pelo símbolo (*) em relação ao tempo 0 de cada condição.
Como mencionado anteriormente, células na fase estacionária acumulam mais trealose do que na fase exponencial, cujo conteúdo é relativamente baixo (Nwaka et al., 1995a) e este acúmulo pode contribuir para uma maior viabilidade celular, em condições de estresse, conforme verificado abaixo (Fig.7).
40 Percebe-se que a pré-adaptação térmica, além de aumentar os níveis de trealose, confere maior resistência às células quando submetidas ao estresse em ambas as fases. E como já foi demonstrado anteriormente o conteúdo de trealose é maior na fase estacionária (Nwaka et al., 1995a). Observa-se também uma maior viabilidade das células nesta mesma fase, ao longo da exposição ao estresse.
O acúmulo de trealose parece ser induzido fortemente pelo choque térmico. Segundo De Virgílio et al. (1991), essa indução pode estar relacionada com mudanças na atividade da enzima responsável pela síntese do dissacarídeo. Entretanto, quando células retornam à condição normal de crescimento, a trealose que foi acumulada é mobilizada através da ativação das trealases responsáveis pela degradação, de forma que esta reserva auxilia na retomada do crescimento e também colabora para uma melhor resistência a estresses (Neves e François, 1992).
Figura 7: Taxa de viabilidade celular (%) em células de Saccharomyces cerevisiae W303
41 Neves e François (1992) observaram um rápido acúmulo de trealose após elevação da temperatura de cultivo de células de S. cerevisiae de 28 para 40ºC. Os autores propuseram que este aumento súbito de temperatura pode ter acarretado em mudanças nas propriedades cinéticas das enzimas de síntese e degradação de trealose induzidas pelo choque térmico. Células de S. cerevisiae capazes de superexpressar os genes TPS1 e TPS2, responsáveis pela síntese de trealose, e com mutação das trealases neutra (Nth1/Nth2) e ácida (Ath1), acumulam grande quantidade do dissacarídeo, principalmente, quando adaptadas a 41,5ºC. A trealose acumulada pode auxiliar na resistência a múltiplos estresses (Mahmud et al., 2010).
Tem sido relatado que em outros micro-organismos o conteúdo de trealose não parece ser elevado após choque térmico. Barros (2011) submeteu células de C. glabrata a uma temperatura de 40°C por 60 minutos e verificou que não ocorreu acúmulo de trealose, divergindo com dados da literatura para S. cerevisiae.
A maior viabilidade celular apresentada após choque térmico, neste estudo, pode ser também devido à indução de genes envolvidos na resposta a estresses em geral, neste caso, a indução de genes responsáveis pela adaptação à escassez de nutrientes na fase estacionária. Não se pode descartar também a importância do acúmulo de trealose induzido por temperaturas não letais e por outros estresses, com papel na prevenção de danos celulares diminuindo a taxa de morte celular.
4.5. Medida da atividade enzimática das trealases neutra e ácida em células de S.
cerevisiae W303 submetidas a tratamento térmico subletal de 41ºC por 2 horas e ao choque ácido
A figura 8 mostra a atividade enzimática das trealases neutra e ácida em células de W303 submetidas ao choque ácido, antes e após o tratamento térmico subletal, nas fases exponencial e estacionária de crescimento.
42 apresentado, nota-se que o choque subletal confere à célula uma maior resistência ao estresse ácido (Fig.7).
43
Figura 8: Atividade enzimática das trealases neutra e ácida em células de Saccharomyces
cerevisiae W303 cultivadas em meio YPD (2%) até a fase exponencial (D.O.600nm 1,0) e fase estacionária (D.O.600nm 2,5-3,5) expostas ao estresse ácido ( / ), à temperatura subletal de 41ºC/2h e à condição de estresse ácido (HCl pH 2.0 + 86 mM NaCl) ( / ). Os resultados estão apresentados como média ± desvio padrão. Diferenças estatísticas (p<0,05) estão representadas pelo símbolo (*) em relação ao tempo 0 de cada condição