REDEMAT
R
EDET
EMÁTICA EME
NGENHARIA DEM
ATERIAISUFOP – CETEC – UEMG
Dissertação de Mestrado
“Estudo da biolixiviação e da lixiviação química de um
concentrado sulfetado de zinco”
Autor: Pablo dos Santos Pina
Orientador: Prof. Versiane Albis Leão
Co-Orientador: Prof. Carlos Antônio da Silva
Abril de 2006
REDE TEMÁTICA EM ENGENHARIA DE MATERIAIS – REDEMAT PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA DE MATERIAIS
“Estudo da biolixiviação e da lixiviação química de um concentrado sulfetado
de zinco”
AUTOR: PABLO DOS SANTOS PINA
ORIENTADOR: PROF. VERSIANE ALBIS LEÃO
Co-ORIENTADOR: PROF. CARLOS ANTÔNIO DA SILVA
Ouro Preto, abril de 2006
Dissertação apresentada ao
Programa de Pós-Graduação
da
Rede Temática em
AGRADECIMENTOS
Gostaria de agradecer aos professores Versiane Albis Leão e Carlos Antônio da Silva pela dedicação, pelos conselhos e pela paciência durante a realização deste trabalho;
Ao professor Jean Frenay pelos conselhos e também por ter acreditado no potencial do NVMM;
A toda a equipe do Núcleo de Valorização de Materiais Minerais (NVMM) que de forma direta ou indireta participaram da elaboração desta dissertação;
A Sílvia Nicolato Medírcio pelo apoio e paciência durante esta etapa;
Ao professor Luis Cláudio Cândido por ter disponibilizado a utilização do microscópio ótico;
Ao laboratório de hidrometalurgia do DEMET/UFMG pelas análises de enxofre e pelas análises granulométricas.
Ao laboratório de microscopia do DEGEO/UFOP pelas análises de MEV/EDS.
A Votorantim Metais, na pessoa do amigo Adelson Dias, por ter fornecido gentilmente o concentrado sulfetado de zinco empregado neste estudo;
Ao CNPq pela concessão da bolsa de estudo, sem a qual este trabalho não poderia ser realizado;
Aos meus pais e familiares pelo amor e pela confiança;
RESUMO
A biolixiviação é uma tecnologia já consolidada na indústria mínero-metalúrgica e é aplicada com sucesso no tratamento de minérios refratários de ouro e na recuperação de cobre contido em minérios marginais e rejeitos. Entretanto, os processos biotecnológicos possuem uma cinética mais lenta, quando comparados a processos químicos tradicionalmente empregados no processamento de sulfetos metálicos (lixiviação direta e lixiviação sob pressão). A biolixiviação pode ser associada aos processos de lixiviação direta (LD) e lixiviação sob pressão (LSP) reduzindo o consumo de oxigênio e aumentando a capacidade de produção dos reatores. Neste trabalho, foram estudadas: a biolixiviação, em presença de microrganismos mesófilos e acidófilos (Acidithiobacillus sp.), e a lixiviação química de um concentrado
sulfetado de zinco. Durante os ensaios de biolixiviação foram avaliados os efeitos do pH (entre 1,50 e 2,50), da concentração de íon ferroso (entre 0 e 5g/L) e da concentração de íon férrico (entre 0 e 5g/L) tanto sobre o percentual de extração de zinco quanto sobre a velocidade de crescimento do microrganismo. A concentração de íon ferroso em solução, acima de 2g/L, provocou uma fraca influência sobre o crescimento do microorganismo e a velocidade de dissolução do zinco. A adição de íon férrico no início dos ensaios, em uma faixa de concentrações variando entre 1 e 5g/L, aumenta o percentual de extração do metal e não interfere no crescimento do microorganismo, sendo, portanto, benéfica ao processo de biolixiviação. A cepa empregada neste trabalho foi capaz de oxidar todo o enxofre elementar produzido durante a dissolução do sulfeto de zinco. O processo de biolixiviação provoca um aumento da superfície específica do sólido, bem como do volume total de poros e da área dos microporos. Este também provoca uma elevação do d50 (tamanho da malha na qual 50% das
partículas do sólido passam) e do dM (diâmetro médio) até um grau de oxidação biológica do
sulfeto de 50%.
ABSTRACT
Bioleaching is a consolidated technology in the mining industry, which has already been successfully applied for the treatment of refractory gold and copper ores. Currently, it has also been studied the possibility its application to treat other sulfides such as those containing zinc, nickel and cobalt. Although bioleaching is slow compared to chemical leaching it can be associated to direct leaching (DL) or pressure leaching (PL) processes so that the consumption of oxidants is reduced and productivity is increased. In this work, the bioleaching with a acidophilic, mesophilic microorganism (Acidithiobacillus sp.) as well as the kinetics of
chemical leaching of a zinc sulfide concentrate were studied. In the bioleaching experiments it has been assessed the effects of pH, ferrous and ferric iron concentrations in the rate of zinc dissolution and bacterial growth rate. The best pH for bioleaching is in the 1.75-2.00 range and the presence of ferrous iron either increases or has no effect on zinc dissolution. Moreover, ferric ion has a strong influence in zinc extraction, increasing the rate of dissolution without affecting bacterial growth, therefore having a beneficial effect in the metal extraction. The microorganism employed in this work was able to oxidize all the elemental sulfur produced during the sulfide bioleaching, which resulted in the increase on surface porosity of the concentrate. Moreover, the particle size distribution was changed (d50 is
SUMÁRIO
1. INTRODUÇÃO 1
2. RELEVÂNCIA E OBJETIVOS 4
3. REVISÃO BIBLIOGRAFICA 6
3.1. Microrganismos empregados em biolixiviação e mecanismos envolvidos na biolixiviação de sulfetos metálicos 6
3.2 Biolixiviação de sulfetos de zinco (ZnS) 10
3.3 Lixiviação química de sulfetos de zinco (ZnS) em meio ácido contendo sulfato e cloreto férrico 19
4. METODOLOGIA 27
4.1 Ensaios de biolixiviação 27
4.2 Ensaios de lixiviação química 28
4.2.1 Preparação do concentrado parcialmente biolixiviado 29
4.2.2 Caracterização morfológica 29
4.2.3 Caracterização granulométrica 30
4.2.4 Análises químicas 30
5. RESULTADOS E DISCUSSÃO 31
5.1 Ensaios de biolixiviação 31
5.2 Ensaios de lixiviação química 48
6. CONCLUSÕES 67
7. SUGESTÕES PARA TRABALHOS FUTUROS 69
8. REFERÊNCIAS BIBLIOGRÁFICAS 70
LISTA DE FIGURAS
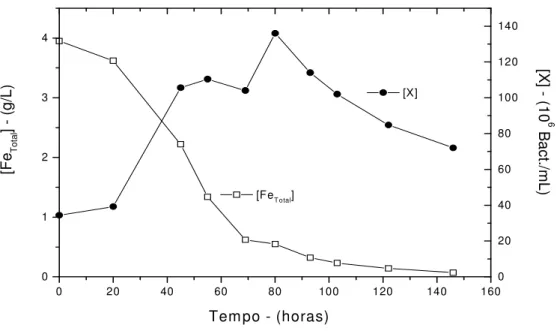
Figura 5.1 - Evolução do percentual de extração de zinco com o tempo, em função do pH. Condições experimentais: 4g/L Fe(II), 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 32
Figura 5.2 - Evolução da concentração bacteriana com o tempo, em função do pH. Condições experimentais: 4g/L Fe(II), 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 33
Figura 5.3 - Evolução da concentração de ferro total com o tempo, em função do pH. Condições experimentais: 4g/L Fe(II), 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 33
Figura 5.4 - Evolução da concentração de ferro total e da concentração bacteriana com o tempo. Condições experimentais: pH 2,50, 4g/L Fe(II), 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 34
Figura 5.5 - Ln ([X]) versus t. Condições experimentais: pH 1,75, 1%sólido, 10% inoculo, 0g/L Fe(II) e meio Norris 36
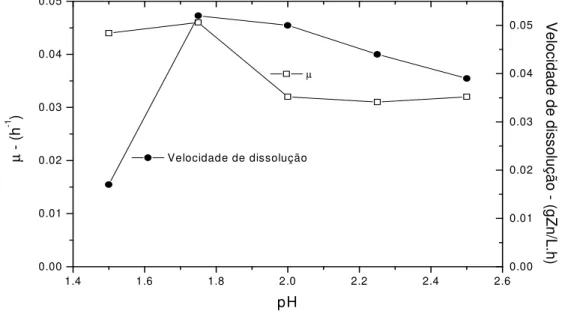
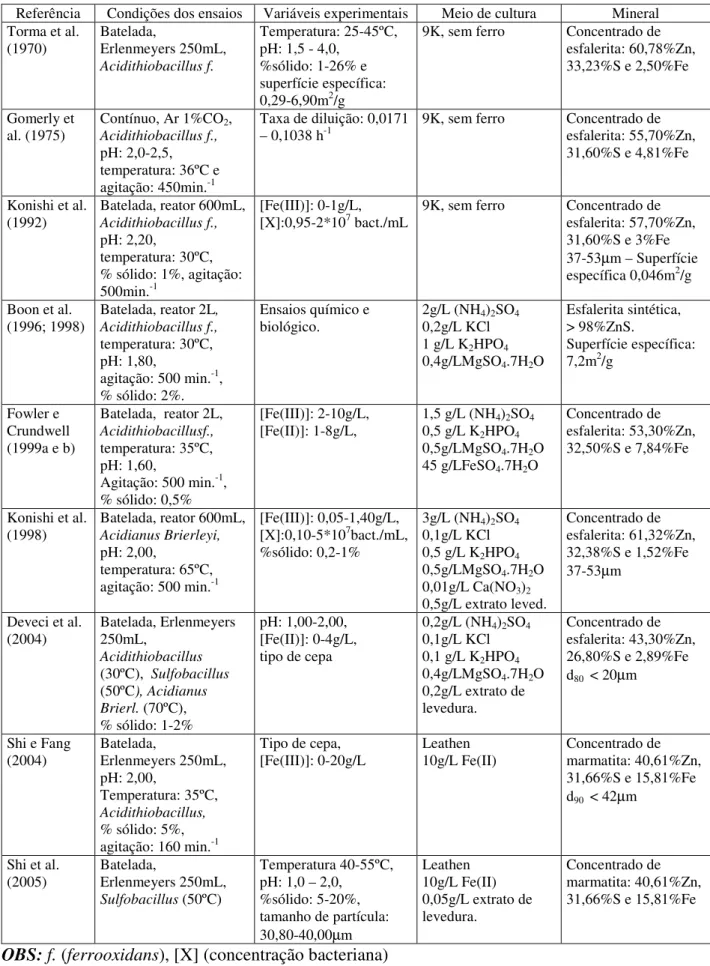
Figura 5.6 - Evolução da velocidade de dissolução de zinco e da velocidade específica de crescimento bacteriano (µ), em função do pH. Condições experimentais: 4g/L Fe(II), 1%
sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 37
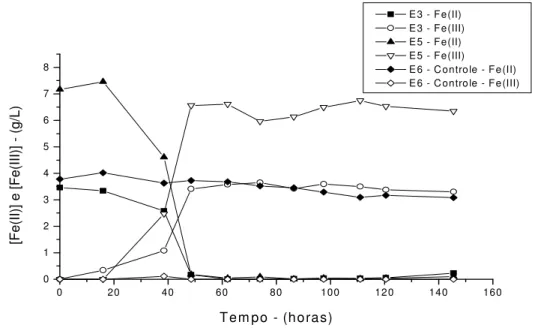
Figura 5.7 - Variação da concentração de íon ferroso e férrico com o tempo em presença e ausência de bactéria 38
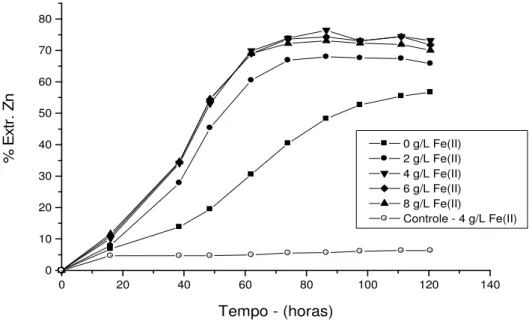
Figura 5.8 - Evolução do percentual de extração de zinco com o tempo, em função da concentração inicial de ferro ferroso. Condições experimentais: pH 1,75, 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 40
Figura 5.9 - Evolução da concentração bacteriana com o tempo, em função da concentração inicial de ferro ferroso. Condições experimentais: pH 1,75, 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 40
Figura 5.10 - Evolução da velocidade de dissolução de zinco e da velocidade específica de crescimento bacteriano em função da concentração inicial de íon ferros. Condições
experimentais: pH 1,75, 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 41
Figura 5.12 - Evolução do percentual de extração de zinco com o tempo, em função da concentração inicial de ferro ferroso e ferro férrico. Condições experimentais: pH 1,75, 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 43
Figura 5.13 – Evolução da concentração bacteriana com o tempo, em função da concentração inicial de ferro ferroso e ferro férrico. Condições experimentais: pH 1,75, 1% sólidos, meio Norris, agitação 200min.-1 e temperatura 33ºC 44
Figura 5.14 - Evolução do percentual de extração de zinco com a concentração inicial em íon férrico, em função do tempo. Condições experimentais: pH 1,75, 1% sólidos, meio Norris, agitação 200min.-1, temperatura 33ºC e sem adição de ferro ferroso 44
Figura 5.15 - Evolução da superfície do concentrado em função do grau de oxidação biológica. 5.15.a concentrado C2, 5.15.b grau de oxidação 25%, 5.15.c grau de oxidação 50%, e 5.15.d grau de oxidação 75% 46
Figura 5.16 - Concentrado biolixiviado com grau de oxidação biológica de 25% 48
Figura 5.17 - Evolução da concentração de zinco com o tempo, em função da velocidade de agitação. Condições experimentais: 0,5% sólidos (C2), temperatura 50ºC, 1,00 mol/L H2SO4 e
0,50 mol/L Fe(III) 49
Figura 5.18 - Evolução da concentração de zinco com o tempo, em função da temperatura. Condições experimentais: 0,5% sólidos (C2), 480 min.-1, 1,00 mol/L H2SO4 e 0,50 mol/L
Fe(III) 50
Figura 5.19 - Evolução da concentração de zinco com o tempo em função da concentração inicial de íon férrico. Condições experimentais: 0,5% sólidos (C2), 480 min.-1, 1,00 mol/L H2SO4 e 50ºC 51
Figura 5.20 - Evolução da concentração de zinco com o tempo em função da temperatura. Condições experimentais: 0,5% sólidos (Bio 25%), 480 min.-1, 1,00 mol/L H2SO4 e 0,50
mol/L Fe(III) 52
Figura 5.21 - Evolução da concentração de zinco com o tempo em função da temperatura. Condições experimentais: 0,5% sólidos (Bio 50%), 480 min.-1, 1,00 mol/L H2SO4 e 0,50
mol/L Fe(III) 52
Figura 5.22 - Evolução da concentração de zinco com o tempo em função da concentração inicial de íon férrico. Condições experimentais: 0,5% sólidos (Bio 25%), 480 min.-1, 1,00 mol/L H2SO4 e 70ºC 53
Figura 5.23 - Evolução da concentração de zinco com o tempo em função da concentração inicial de íon férrico. Condições experimentais: 0,5% sólidos (Bio 50%), 480 min.-1, 1,00 mol/L H2SO4 e 70ºC 53
Figura 5.24 - Evolução da extração de zinco com o tempo em função do percentual de extração biológica de zinco. Condições experimentais: 0,5% sólidos, 480min.-1, 1,00mol/L H2SO4, 0,50mol/L Fe(III) e 80ºC 58
Figura 5.25 - Evolução da superfície do concentrado em função do percentual de lixiviação. 5.25.a concentrado C2, 5.25.b 30% extração de zinco, 5.25.c 50% extração de zinco e 5.25.d 70% extração de zinco 60
Figura 5.26 - Concentração de zinco versus tempo. Condições experimentais: 40ºC, 0,5% sólidos, 480min.-1, 0,5mol/L Fe(III) e 1,0mol/L H2SO4 62
Figura 5.27 - Gráfico de Arrhenius. Condições experimentais: 0,5% sólidos, 480 min.-1, 1,00 mol/L H2SO4 e 0,50 mol/L Fe(III) 64
Figura 5.28 - Log V0 versus Log [Fe(III)]. Condições experimentais: 0,5% sólidos,
LISTA DE TABELAS
Tabela 3.1 – Condições experimentais empregadas nos ensaios de biolixiviação da
esfalerita 18
Tabela 3.2 – Condições experimentais empregadas nos ensaios de lixiviação química da esfalerita 25
Tabela 3.3 – Modelos empregados para descrever a cinética de dissolução de ZnS 26
Tabela 4.1 – Análise química do concentrado de esfalerita (C1) 28
Tabela 4.2 – Análise química do concentrado de esfalerita (C2) e do concentrado biolixiviado (Bio 25% e Bio 50%) 30
Tabela 5.1 – Área superficial, porosidade e distribuição granulométrica do concentrado C2 e do material biolixiviado 47
Tabela 5.2 – Valores de KRQe KD em função da temperatura 56
Tabela 5.3 – Energia de ativação 56
Tabela 5.4 – Valores de K1 e K2 obtidos por regressão não-linear (Origin 4.1TM) 63
Capitulo 1 - Introdução.
O zinco é um metal branco que se cristaliza no sistema hexagonal. Este metal é utilizado principalmente na indústria da construção civil, galvanização e na produção de ligas metálicas empregadas em “pressure die-casting” (Feneau, 2002).
A esfalerita (ZnS), também denominada de blenda, é o mineral mais abundante contendo zinco. O metal é extraído, a partir de concentrados contendo esfalerita, segundo duas rotas. Uma é a rota hidrometalúrgica (ustulação/lixiviação/ purificação/eletrodeposição), que responde por cerca de 85% da produção mundial do metal (Feneau, 2002).
Durante a etapa de ustulação, que precede a lixiviação, o concentrado sulfetado é submetido a um processo térmico de oxidação (realizado à temperatura de aproximadamente 950°C). Este pode ser representado da seguinte forma:
2ZnS + 3O2 2ZnO + 2SO2 (1.1)
Como está mostrado na equação (1.1), para cada mol de sulfeto oxidado, ocorre a formação de um mol de SO2. Este último necessita ser transformado em ácido sulfúrico e não pode ser
diretamente liberado na atmosfera, devido a sua elevada toxidade. Durante a ustulação também ocorre a geração de grande quantidade de material particulado.
O surgimento de leis ambientais mais rigorosas do ponto de vista da emissão de efluentes industriais e o crescente empobrecimento das reservas minerais estão impulsionando a indústria mínero-metalúrgica a procurar processos mais “amigáveis” ambientalmente e também mais robustos.
Um processo alternativo às rotas tradicionalmente empregadas na indústria de zinco (hidrometalúrgica e pirometalúrgica) é a lixiviação direta do concentrado sulfetado em soluções ácidas de sulfato férrico. Segundo Dutrizac e MacDonald (1978), a reação de lixiviação do sulfeto de zinco pelo íon férrico pode ser representada da seguinte forma:
ZnS + 2Fe+3 Zn+2 + 2Fe+2 + S0 (1.2)
Em meio ácido o sulfeto de zinco também pode reagir com os íons H+, e esta reação pode ser representada da seguinte forma (Dutrizac e MacDonald, 1978):
ZnS + 2H+ Zn+2 + H2S (1.3)
O processo de lixiviação direta é conduzido à temperatura de aproximadamente 95ºC e a pressão atmosférica. Este utiliza oxigênio como agente oxidante do íon ferroso, que é produzido durante a oxidação do sulfeto pelo íon férrico. A reação de oxidação do íon ferroso pode ser representada da seguinte forma:
4Fe+2 + O2 + 4H+ 4Fe+3 + 2H2O (1.4)
Este processo é menos nocivo ao meio ambiente quando comparado às rotas de produção que empregam ustulação, uma vez que, são produzidos efluentes líquidos e sólidos, que são tratados mais facilmente que efluentes gasosos. Além disso, o processo de lixiviação direta pode ser empregado, economicamente, para o tratamento de sulfetos com elevado teor de ferro e com baixo teor em zinco. O enxofre elementar, que é um subproduto do processo de lixiviação direta, pode ser vendido ou então empregado na própria usina para produção de ácido.
oxidar ferro ferroso, enxofre elementar e compostos reduzidos de enxofre, catalisando, desta forma, a reação de dissolução de diversos sulfetos metálicos. Esta técnica é aplicada com sucesso no pré-tratamento de minérios refratários de ouro, na extração de cobre a partir de rejeitos e minérios marginais, na extração de urânio e tem um grande potencial para aplicação na extração de outros metais como zinco, cobalto e níquel (Nemati et al., 1998).
A biolixiviação de concentrados de esfalerita se apresenta como uma das mais promissoras tecnologias para extração de zinco. Esta tecnologia possui inúmeras vantagens do ponto de vista ambiental e tecnológico, quando comparada aos processos tradicionalmente utilizados na extração do metal, a partir de seus sulfetos:
- O concentrado sulfetado pode ser diretamente lixiviado em presença do microrganismo, eliminando desta forma a etapa de ustulação, que é potencialmente geradora de graves problemas ambientais. Os sulfetos são diretamente oxidados a enxofre elementar e/ou a sulfato, dependendo de sua estrutura eletrônica e, desta maneira, não ocorre a formação de SO2.
- Esta tecnologia pode ser aplicada para o tratamento de minerais complexos e com baixo teor de metal, aumentando desta forma a vida útil dos depósitos.
- O processo pode ser conduzido em reatores agitados para o tratamento de concentrados, a uma temperatura variando entre 30 e 80°C, dependendo dos microrganismos empregados, ou em pilhas, para o tratamento de rejeitos ou minérios marginais.
- O custo das instalações e a sua complexidade operacional são muito menores, quando comparados a outros processos de lixiviação empregados no processamento de sulfetos metálicos, como por exemplo, lixiviação sob pressão.
Capitulo 2 – Relevância e Objetivos.
A rota hidrometalúrgica é responsável por cerca de 85% da produção mundial de zinco, a partir da utilização de concentrados sulfetados. Esta rota de produção pode simplificadamente ser dividida em 4 operações unitárias: ustulação, lixiviação, purificação e eletrodeposição. A etapa de ustulação é potencialmente nociva ao meio ambiente, uma vez que, grande quantidade de material particulado e SO2 são produzidos, o que exige normalmente uma
instalação de lavagem dos gases, e produção de ácido sulfúrico. Além disto, a rota hidrometalúrgica perde eficiência quando empregada para tratar sulfetos com elevado teor em ferro, devido à formação de ferrita de zinco (ZnO.Fe2O3).
O crescente empobrecimento das reservas minerais e a constante preocupação com a preservação do meio ambiente estão impulsionando a indústria mínero-metalúrgica a buscar processos mais “amigáveis” do ponto de vista ambiental e também mais robustos.
A lixiviação direta dos sulfetos em presença de íon férrico e a pressão atmosférica é uma das alternativas para o processamento de zinco a partir de concentrados sulfetados. Este processo é menos nocivo ao meio ambiente, uma vez que, são produzidos efluentes líquidos e sólidos, que são tratados mais facilmente que efluentes gasosos, além de ser adequado para o tratamento de concentrados com elevados teores em ferro.
A biolixiviação também surge como uma alternativa para o tratamento de sulfetos de zinco, uma vez que, o sulfeto é oxidado a sulfato e não ocorre, portanto, a formação de SO2. Este
processo também é adequado para o tratamento de concentrados com baixo teor em zinco e elevadas concentrações em ferro. Além disto, a biolixiviação pode ser associada ao processo de lixiviação direta, reduzindo o consumo de oxigênio, o que em algumas situações pode ser proibitivo para implantação deste processo, devido ao custo elevado do gás. Esta associação implicaria em uma redução direta do custo de produção do metal.
Os ensaios de biolixiviação foram conduzidos visando-se determinar o efeito do pH da suspensão e da concentração de íons ferroso e férrico sobre a velocidade de dissolução do sulfeto de zinco, bem como, da velocidade específica de crescimento bacteriana (µ).
Capítulo 3 - Revisão bibliográfica.
Este capítulo apresenta uma revisão crítica dos mais importantes trabalhos relacionados à biolixiviação e à lixiviação química de sulfeto de zinco (ZnS). Visando-se facilitar a compreensão e a distribuição do texto, as condições experimentais (temperatura, velocidade de agitação, concentração de reagentes, percentual de sólido e outras.) serão apresentadas na forma de tabelas. Os modelos empregados para descrever a cinética de dissolução da esfalerita nos ensaios de lixiviação química também são discutidos na seção 3.3.
3.1 - Microrganismos empregados em biolixiviação e mecanismos envolvidos na biolixiviação de sulfetos metálicos.
Os microrganismos que possuem a capacidade de oxidar ferro ferroso, enxofre elementar e compostos reduzidos de enxofre apresentam uma importante função nos processos biohidrometalúrgicos, pois podem catalisar a reação de dissolução de sulfetos metálicos. Outros microrganismos podem produzir ácidos orgânicos que são empregados na lixiviação de diversos minerais (não apenas minerais sulfetados) e também existem microrganismos que são utilizados para acumular e/ou precipitar íons metálicos em solução.
Os microrganismos envolvidos no processo de oxidação de sulfetos metálicos são geralmente dos gêneros Thiobacillus, Leptospirillum, Sulfolobus, Sulfobacillus e Acidianus (Karavaiko et
al., 1988). No contexto deste trabalho, atenção especial será dada aos microrganismos do gênero Acidithiobacillus. A partir do ano de 2000 o termo Thiobacillus foi alterado para Acidithiobacillus. Portanto, artigos publicados anteriormente a esta data ainda utilizam o
termo Thiobacillus para denominar os microrganismos do gênero Acidithiobacillus. Os
microrganismos do gênero Acidithiobacillus são altamente polimórficos e a grande maioria
apresenta forma de bastão (diâmetro entre 0,3 e 0,5µm e comprimento entre 1,0 e 2,0µm). Segundo a literatura, estes também podem ser encontrados sobre a forma esférica e oval. Por outro lado, são raramente observados em cadeias. Os microrganismos do gênero
(Rossi, 1990). Estes microrganismos são geralmente encontrados em drenagem ácida de mina (DAM), minas de sulfetos metálicos e de carvão. Os microrganismos do gênero
Acidithiobacillus apresentam as seguintes características (Nemati et al., 1998):
Quimiolitotróficos - possuem a capacidade de obter a energia necessária para manutenção de
suas funções vitais a partir da oxidação de compostos inorgânicos, notadamente, o íon ferroso, sulfetos metálicos e compostos reduzidos de enxofre.
Autotróficos - utilizam CO2 como fonte de carbono para síntese de material celular.
Aeróbicos - utilizam oxigênio como aceptor final de elétrons.
Mesófilos - são capazes de crescer em um intervalo de temperatura variando entre 20 e 40ºC,
sendo que a temperatura ótima de crescimento é função do pH, e está geralmente em torno de 33ºC.
Acidófilos - são capazes de se desenvolver em ambientes com o pH variando entre 1,50 e 6,00
e possuem um pH ótimo de crescimento em torno de 2,00.
Uma das particularidades essenciais, apresentada por estes microrganismos é a sua grande resistência a concentrações elevadas de íons metálicos, o que torna possível a sua aplicação nos processos de biolixiviação de sulfetos metálicos.
O processamento de minerais sulfetados utilizando microrganismos é uma alternativa viável para extração de metais, a partir de concentrados sulfetados. A compreensão dos mecanismos envolvidos na biolixiviação de sulfetos é, portanto, de extremo interesse e importância para o desenvolvimento e a otimização de processos industriais de biolixiviação, uma vez que, levaria à construção de modelos que permitiriam prever com maior precisão à velocidade de dissolução destes minerais, dependendo das condições em que o processo é conduzido.
Vários trabalhos consistentes foram realizados, na tentativa de determinar quais os sub-processos relevantes envolvidos na biolixiviação de sulfetos metálicos, principalmente
literatura não apresenta um ponto de vista comum sobre qual é a função desempenhada pelo microrganismo nestes processos (Boon, 1996).
Diversos autores (Boon, 1996, Sand et al., 2001, Fowler e Crundwell, 1999a;b) discutem a possibilidade de dois mecanismos atuarem durante a biolixiviação de sulfetos metálicos. No primeiro, denominado “mecanismo direto”, o microrganismo aderido à superfície do mineral realiza a dissolução do mesmo, por meio de reações envolvendo enzimas produzidas pela bactéria. Portanto, uma alta taxa de dissolução está associada a uma elevada concentração de microrganismos na superfície do mineral. Quando ocorre a formação de enxofre elementar, o microrganismo também deve oxidar este último, impedindo, que se forme uma barreira para a difusão do agente oxidante até a superfície do mineral, onde ocorre a reação de oxidação.
O outro mecanismo discutido é denominado “mecanismo indireto”. Neste, o mineral é atacado quimicamente pelo íon férrico presente na solução e por prótons (H+), dependendo da sua composição química. Durante a oxidação do mineral, o íon férrico é transformado em íon ferroso. A função do microrganismo, neste caso, é oxidar o íon ferroso a íon férrico, regenerando, desta forma, o agente oxidante.
Baseado na estrutura eletrônica apresentada por diferentes sulfetos metálicos, Sand et al. (2001) propuseram um refinamento para o mecanismo indireto e explicaram a formação de enxofre elementar em detrimento de sulfato durante a dissolução de certos sulfetos metálicos. Sulfetos como a pirita (FeS2), a molibidenita (MoS2) e a tungstenita (WS2) são oxidados
formando sulfato. Por outro lado, sulfetos metálicos como a esfalerita (ZnS) e a galena (PbS) produzem enxofre elementar como produto da reação de oxidação, preferencialmente a sulfato.
A pirita (FeS2) apresenta as bandas de valência e de condução formadas por orbitais
moleculares pertencentes ao orbital híbrido sp3 do enxofre, e aos orbitais 3d, 4s e 4p do ferro. Este sulfeto apresenta um “gap” energético de aproximadamente 1eV (Eg = Ec – Ev, onde Ec é
a energia da banda de condução e Ev é a energia da banda de valência), determinado a partir
da diferença energética entre orbitais moleculares σ* e t2g. O orbital t2g é um orbital molecular
formado e o microrganismo possui a função de oxidar o íon ferroso a íon férrico, regenerando o agente oxidante, durante o processo de biolixiviação da pirita.
A esfalerita apresenta a banda de valência e a banda de condução formada por orbitais moleculares 3p e 3s do íon ligante (S-2) e por orbitais moleculares 4p e 4s do íon metálico, Zn+2. Este sulfeto pode ter as suas ligações moleculares rompidas ou enfraquecidas pelo íon férrico ou por prótons (H+). O principal componente intermediário formado neste caso é o polisulfato (H2Sn) que é posteriormente transformado em enxofre elementar. Neste caso, o
microrganismo deve oxidar ambos os substratos, ferro ferroso e enxofre elementar.
O primeiro mecanismo de oxidação dos sulfetos é denominado de “tiosulfato” e o segundo de “polisulfato” (Sand et al., 2001). Como foi visto, para o caso da esfalerita ocorre a produção de enxofre elementar e ferro ferroso, como produto da oxidação do mineral pelo íon férrico. Portanto, é de grande interesse, neste caso, empregar microrganismos que possuam a capacidade de oxidar ambos os substratos.
As reações envolvidas durante a biolixiviação da esfalerita, segundo Boon et al. (1993), são apresentadas a seguir:
ZnS + 2O2 ZnSO4 (mecanismo direto) (3.1)
ZnS + 2Fe+3 Zn+2 + S° + 2Fe+2 (mecanismo indireto) (3.2)
2Fe+2 + 1/2O2 + 2H+ 2Fe+3 + H2O (mecanismo indireto) (3.3)
3.2 - Biolixiviação de sulfetos de zinco (ZnS).
Torma et al. (1970) estudaram a biolixiviação de um concentrado de esfalerita em presença de
Acidithiobacillus ferrooxidans (A.f. ). Os ensaios foram realizados em batelada, em meio 9K
sem adição de ferro. Os autores estudaram o efeito do pH, da superfície específica do mineral, da temperatura e da densidade de polpa sobre a velocidade de dissolução do sulfeto. Torma et al. (1970) encontraram que a temperatura ótima para lixiviação de esfalerita em presença de
A.f. é aproximadamente 35°C. A energia de ativação para o processo foi 13,24Kcal/mol. Este
elevado valor indica que provavelmente a etapa controladora do processo é a reação química. Os autores também verificaram que a velocidade de extração do metal permaneceu constante (aproximadamente 0,37g/L.h) em uma faixa de pH variando entre 2,00 e 3,00 e que esta era diretamente proporcional à densidade de polpa, para uma densidade de polpa variando de 1 até 15%. Para valores de densidade de polpa superiores a 20%, os autores observaram uma sensível redução na velocidade de dissolução do mineral. Isto pode ter sido causado pela limitação na transferência de O2 ou CO2 da fase gasosa para a solução, devido à elevada
concentração de sólidos, o que justificaria desta forma, a redução da velocidade de oxidação observada pelos autores. Para valores de superfície específica superiores a 3m2/g, a velocidade de dissolução do mineral mostrou-se independente desta variável. Entretanto, para valores inferiores a 1,5m2/g, a velocidade de dissolução era diretamente proporcional a superfície específica do mineral. O melhor resultado de extração, aproximadamente 0,52g/L.h, foi obtido nos ensaios realizados a temperatura de 35°C, pH 2,30, densidade de polpa de 16% e superfície específica do sólido igual a 1,2m2/g. Os autores argumentaram que a dissolução do mineral era devida ao ataque pelo microrganismo, uma vez que, os ensaios foram realizados em meio 9K sem a adição de ferro. Portanto, neste caso o mecanismo direto deveria ser atuante. Entretanto, como o mineral empregado nos ensaios continha cerca de 2,5%Fe, inicialmente, é evidente que à medida que o mineral era lixiviado, ocorria à liberação do ferro contido no mesmo para a solução e este deveria influenciar, de alguma forma, a velocidade de dissolução do mineral.
Gomerly et al. (1975) examinaram a cinética de dissolução de um concentrado de esfalerita em sistema contínuo e em presença de Acidithiobacillus ferrooxidans. Os ensaios foram
constante entre 2,00 e 2,50 e a temperatura também foi mantida constante em 35°C. Os autores verificaram que o percentual de extração do metal era função da taxa de diluição e da superfície específica do mineral, o que está de acordo com os resultados obtidos anteriormente por Torma et al. (1970). Uma redução na taxa de diluição provocou uma elevação no percentual de extração do metal. O mesmo efeito é observado quando a superfície específica do mineral aumentou. Gomerly et al. (1975) conseguiram atingir uma extração de 71,9% do metal, utilizando uma taxa de diluição de 0,0171h-1, o que corresponde a um tempo de residência de 58,45 horas. A partir destes resultados, os autores concluíram que o mecanismo direto era atuante durante a biolixiviação da esfalerita. Entretanto, da mesma forma que Torma et al. (1970), estes utilizaram um concentrado contendo 4,81%Fe, que era liberado em solução à medida que a dissolução do mineral prosseguia.
Konishi et al. (1992) estudaram a cinética de biolixiviação e de lixiviação química de um concentrado de esfalerita em presença de Acidithiobacillus ferrooxidans. Os ensaios foram
Os autores propuseram um modelo baseado nas isotermas de adsorção de Langmuir, que permitia conhecer a concentração de células livres em solução e aderidas à superfície do sólido em um dado instante da lixiviação. Este modelo utiliza, como parâmetros chave, os valores da velocidade de crescimento específica (µa) e o coeficiente de rendimento (Ya) das
células aderidas à superfície do mineral. O modelo proposto pelos autores foi capaz de descrever os resultados experimentais de forma satisfatória e é apresentado a seguir:
(
)
230 1 α
θ
µ −
=
V W X dt
dX
v a a
T (3.5)
= T a
Y V W dt
dX dt
d 0
/
α
(3.6)
(
am a)
amV = X −X X
θ
eXa =KaXamXL(
1+KaXL)
(3.7)onde:
XT = concentração total de microrganismo (bact./m3)
Xa = concentração de microrganismo aderida à superfície do sólido (bact./m2)
Xam = concentração máxima de microrganismos aderidos à superfície do sólido (bact./m2)
XL = concentração de microrganismo em solução (bact./m3)
µa = velocidade específica de crescimento do microrganismo aderido ao sólido (dia-1)
v
θ
= fração de sítios de adsorção não ocupadosW0 = massa inicial de sólido (kg)
V = volume (m3)
α = percentual de extração de metal
Ya = coeficiente de rendimento do microrganismo aderido ao sólido (bact./kg)
Boon et al. (1996; 1998) também estudaram a cinética de biolixiviação e lixiviação química de esfalerita sintética. Os ensaios de biolixiviação foram conduzidos em presença de
Acidithiobacillus ferrooxidans. Os ensaios foram realizados em batelada; o pH da solução foi
dissolução do sulfeto. Para manter os valores do potencial redox em ambos os ensaios iguais, os autores adicionaram peróxido de hidrogênio nos ensaios de lixiviação química. Boon et al. (1996; 1998) verificaram que a velocidade de dissolução do mineral era semelhante em ambos os ensaios, químico e biológico, e concluíram que o mecanismo direto não era relevante nas condições em que os ensaios foram realizados. Portanto, a única função do microrganismo, durante a biolixiviação da esfalerita, era de regenerar o agente oxidante. Os autores obtiveram um rendimento de extração de 30% em um período de 24 horas e também observaram que a capacidade de oxidação do íon ferroso por Acidithiobacillus ferrooxidans era reduzida em
cerca de nove vezes em presença de enxofre elementar. Portanto, em meio contendo ambos os substratos, Acidithiobacillus ferrooxidans optava por oxidar o enxofre elementar em
detrimento do ferro ferroso. Como conseqüência, ocorria uma redução na velocidade de oxidação do mineral, uma vez que, o microrganismo deixava de regenerar o agente oxidante. A elevada concentração inicial de íon férrico utilizada pelos autores e o reduzido tempo em que os dados foram coletados poderiam ter grande influência sobre os resultados apresentados e, portanto, sobre as conclusões tomadas neste trabalho. A literatura mostra que a presença de elevada concentração de íon férrico pode inibir a capacidade de Acidithiobacillus ferrooxidans em oxidar ferro ferroso (Nemati et al., 1998). Portanto, o efeito de inibição da
atividade do microrganismo observado pelos autores poderia ser devido à concentração de íon férrico em solução e não à presença de enxofre elementar como sugerido por Boon et al. (1996; 1998).
Fowler e Crundwell (1999a) utilizaram um reator eletroquímico para estudar a cinética de lixiviação química e biológica da esfalerita, mantendo a relação entre Fe+3/Fe+2 igual em ambos os ensaios (químico e biológico). Todos os ensaios foram conduzidos em batelada e os experimentos de biolixiviação foram realizados em presença de Acidithiobacillus ferrooxidans. O pH da solução e a temperatura foram mantidos constantes em 1,60 e 35°C,
extraído em um período de aproximadamente 100 horas, nos ensaios de lixiviação química e biológica realizados com uma concentração de 10g/L de Fe+3. Entretanto, nos ensaios realizados com elevada concentração de íon ferroso, a velocidade de oxidação do mineral em presença de microrganismo era mais elevada que a velocidade de dissolução química. Os autores observaram que nas primeiras 12 horas de ensaios, a velocidade de lixiviação era a mesma em presença e ausência de bactéria. Entretanto, com o decorrer do tempo de lixiviação a velocidade de oxidação biológica do sulfeto mostrava-se mais elevada que a velocidade de dissolução química. Estes concluíram que a velocidade de dissolução, nos ensaios em presença de microrganismos, era mais elevada, devido ao fato do microrganismo oxidar a camada de enxofre elementar que se forma sobre a partícula de esfalerita. Fowler e Crundwell (1999a) sugeriram também que, nestas condições, a velocidade de dissolução é controlada pela reação química na superfície do mineral, nos ensaios em presença de microrganismo e pela difusão de produtos e reagentes na camada de enxofre elementar no caso de lixiviação química. Esta hipótese foi comprovada em um trabalho posterior a partir da análise por microscopia de varredura (MEV) do material lixiviado quimicamente e biologicamente (Fowler e Crundwell, 1999b). Nas amostras de material biolixiviado, a superfície do sólido estava recoberta por grande quantidade de microrganismos e não se observou a presença de enxofre elementar. Entretanto, no material lixiviado quimicamente, a superfície das partículas de esfalerita estava totalmente recoberta por uma camada de enxofre elementar. Como pode ser visto, mesmo que o microrganismo não aumente a taxa de extração do metal devido a um ataque direto, ele possui uma importante função que é oxidar a camada de enxofre elementar formada sobre a partícula mineral, além de regenerar o agente oxidante. Resultados semelhantes aos obtidos por Fowler e Crundwell (1999a e b) foram observados por Driessens et al. (1999), que utilizaram a mesma técnica para estudar a lixiviação química e biológica da esfalerita, empregando também Acidithiobacillus ferrooxidans.
Konishi et al. (1998) também estudaram a cinética de biolixiviação de um concentrado sulfetado de zinco, em presença de um microrganismo termófilo extremo, Acidianus brierleyi.
Os ensaios foram realizados em batelada, em um reator de mistura perfeita. Ensaios de lixiviação química em condições semelhantes aos ensaios biológicos também foram realizados. Nos ensaios de biolixiviação, o pH da solução foi mantido constante em 2,00 e a temperatura, em 65°C. Estes também estudaram a cinética de adesão do microrganismo à superfície das partículas de esfalerita. Como no caso de Acidithiobacillus ferrooxidans, os
contato entre o microrganismo e o sólido e que a cinética de adesão poderia ser descrita a partir da utilização de isotermas de adsorção de Langmuir. A partir da comparação dos resultados de extração obtidos em um determinado intervalo de tempo, os autores encontraram que o percentual de extração de zinco em presença de Acidianus brierleyi era
sete vezes maior do que em presença de Acidithiobacillus ferrooxidans. Para um período de 7
dias, os autores obtiveram um percentual de extração de zinco de 80%, em presença
Acidianus brierleyi e de apenas 13% em presença de Acidithiobacillus ferrooxidans, em
ensaios conduzidos sem a adição de ferro ao sistema. Konishi et al. (1998) observaram que a adição de ferro férrico em uma concentração superior a 0,1g/L provoca uma sensível redução na velocidade de dissolução da esfalerita, o que foi explicado pelos autores, como sendo devido à formação de uma camada de jarosita sobre a superfície do mineral. É conhecido que a concentração de íon férrico, o pH da solução e a temperatura desempenham um importante papel durante a formação de jarosita e que uma elevação na temperatura e no valor do pH favorecem a formação deste precipitado.
Konishi et al. (1998) utilizaram o mesmo modelo, proposto anteriormente para descrever os resultados de biolixiviação da esfalerita em presença de Acidithiobacillus ferrooxidans, para
descrever os resultados obtidos utilizando Acidianus brierleyi. Estes verificaram que o
concentração inicial de íon ferroso adicionada ao sistema. Deveci et al. (2004) observaram um pH ótimo para realização dos ensaios de biolixiviação de 1,00, 1,60 e 1,80 para os microrganismos termófilos, termófilos moderados e mesófilos, respectivamente. Deve-se notar que um aumento da temperatura provocou uma redução no valor do pH ótimo de biolixiviação. Esta redução no valor do pH ótimo é essencial para realização dos ensaios de biolixiviação a temperaturas superiores a 50ºC, devido ao favorecimento da cinética de formação de jarosita com o aumento da temperatura (Dutrizac, 1995). Os autores atribuíram a maior capacidade de lixiviação dos microrganismos termófilos moderados à sua habilidade para oxidar o íon ferroso e à temperatura ótima de crescimento dos mesmos (50ºC). Apesar dos microrganismos termófilos possuírem uma temperatura ótima de crescimento mais elevada, estes não foram capazes de oxidar rapidamente o íon ferroso. Desta forma, o potencial redox da solução (Eh) permaneceu baixo e conseqüentemente a velocidade de dissolução do mineral sofreu uma redução, de acordo com o mecanismo indireto.
Shi e Fang (2004) conduziram ensaios de biolixiviação (Acidithiobacillus ferrooxidans) e
lixiviação química de um concentrado de marmatita. Os ensaios foram realizados em batelada à temperatura de 35ºC e pH 2,00. Os autores estudaram o efeito da adaptação do microrganismo sobre o percentual de extração de zinco, nos ensaios de biolixiviação e da concentração de íon férrico nos ensaios de lixiviação química. Shi e Fang (2004) verificaram que a adaptação do microrganismo ao sulfeto era fundamental para obter-se elevados percentuais de extração do metal. A cepa previamente adaptada ao concentrado alcançou um percentual de extração de aproximadamente 100%, em um período de 10 dias. A cepa original e o ensaio controle (sem a presença de microrganismo) alcançaram, no mesmo intervalo de tempo, percentuais de extração de zinco de 40% e 20%, respectivamente. Nos ensaios de lixiviação química os autores observaram que um aumento na concentração de íon férrico provocava uma elevação acentuada no percentual de extração do metal. Análises do resíduo da biolixiviação por MEV e EDS mostraram a formação de uma camada de enxofre elementar e jarosita sobre a superfície das partículas. Isto indica que apesar da cepa de bactéria empregada nos ensaios possuir a capacidade de oxidar enxofre elementar esta não conseguiu oxidar todo enxofre formado durante a oxidação do sulfeto.
Em um outro trabalho Shi et al. (2005) estudaram a biolixiviação de um concentrado de marmatita em presença de microrganismos termófilos moderados do gênero Sulfobacillus. Os
percentual de sólidos e da granulometria do material sobre o percentual de extração de zinco. Os autores determinaram o pH ótimo para realização dos ensaios de biolixiviação como sendo 1,50. Este valor de pH está de acordo com o valor observado por Deveci et al. (2004). Os ensaios realizados em pH 2,00 apresentaram uma elevada formação de jarosita e conseqüente redução no percentual de extração do metal. Shi et al. (2005) encontraram que a temperatura ótima para lixiviação de esfalerita em presença de Sulfobacillus era aproximadamente 50°C.
A elevação da temperatura acima de 55ºC provocou uma acentuada redução no percentual de extração do metal. O mesmo efeito foi verificado para o percentual de sólidos. Nos ensaios conduzidos com 5% de sólidos, um percentual de extração de 100% foi alcançado em 10 dias. Para os ensaios realizados com 10%, 15% e 20% sólidos os percentuais de extração alcançados, no mesmo período, foram aproximadamente 85%, 65% e 50%, respectivamente. Os autores não observaram qualquer alteração no percentual de extração com a variação da granulometria do concentrado. Comparando os resultados obtidos com Sulfobacillus e Acidithiobacillus ferrooxidans, os microrganismos termófilos moderados se mostraram mais
efetivos. Este resultado está de acordo com os resultados obtidos previamente por Deveci et al. (2004). Análise do resíduo da biolixiviação por MEV e EDS também indicaram a presença de uma camada de enxofre elementar sobre a superfície do sólido. Isto implica que o microrganismo não conseguiu oxidar todo enxofre formado durante a oxidação do sulfeto, apesar de ser capaz de oxidar enxofre elementar.
Tabela 3.1 – Condições experimentais empregadas nos ensaios de biolixiviação da esfalerita.
Referência Condições dos ensaios Variáveis experimentais Meio de cultura Mineral
Torma et al. (1970)
Batelada,
Erlenmeyers 250mL,
Acidithiobacillus f.
Temperatura: 25-45ºC, pH: 1,5 - 4,0, %sólido: 1-26% e superfície específica: 0,29-6,90m2/g
9K, sem ferro Concentrado de
esfalerita: 60,78%Zn, 33,23%S e 2,50%Fe
Gomerly et
al. (1975) Contínuo, Ar 1%COAcidithiobacillus f., 2,
pH: 2,0-2,5, temperatura: 36ºC e agitação: 450min.-1
Taxa de diluição: 0,0171
– 0,1038 h-1 9K, sem ferro Concentrado de esfalerita: 55,70%Zn,
31,60%S e 4,81%Fe
Konishi et al. (1992)
Batelada, reator 600mL,
Acidithiobacillus f.,
pH: 2,20,
temperatura: 30ºC, % sólido: 1%, agitação: 500min.-1
[Fe(III)]: 0-1g/L, [X]:0,95-2*107 bact./mL
9K, sem ferro Concentrado de
esfalerita: 57,70%Zn, 31,60%S e 3%Fe 37-53µm – Superfície específica 0,046m2/g
Boon et al.
(1996; 1998) Batelada, reator 2L
, Acidithiobacillus f.,
temperatura: 30ºC, pH: 1,80,
agitação: 500 min.-1,
% sólido: 2%.
Ensaios químico e
biológico. 2g/L (NH0,2g/L KCl 4)2SO4 1 g/L K2HPO4
0,4g/LMgSO4.7H2O
Esfalerita sintética, > 98%ZnS.
Superfície específica: 7,2m2/g
Fowler e Crundwell (1999a e b)
Batelada, reator 2L,
Acidithiobacillusf.,
temperatura: 35ºC, pH: 1,60,
Agitação: 500 min.-1,
% sólido: 0,5%
[Fe(III)]: 2-10g/L,
[Fe(II)]: 1-8g/L, 1,5 g/L (NH0,5 g/L K2HPO4)2SO4 4
0,5g/LMgSO4.7H2O
45 g/LFeSO4.7H2O
Concentrado de esfalerita: 53,30%Zn, 32,50%S e 7,84%Fe
Konishi et al.
(1998) Batelada, reator 600mL, Acidianus Brierleyi,
pH: 2,00,
temperatura: 65ºC, agitação: 500 min.-1
[Fe(III)]: 0,05-1,40g/L, [X]:0,10-5*107bact./mL,
%sólido: 0,2-1%
3g/L (NH4)2SO4
0,1g/L KCl 0,5 g/L K2HPO4
0,5g/LMgSO4.7H2O
0,01g/L Ca(NO3)2
0,5g/L extrato leved.
Concentrado de esfalerita: 61,32%Zn, 32,38%S e 1,52%Fe 37-53µm
Deveci et al.
(2004) Batelada, Erlenmeyers 250mL,
Acidithiobacillus
(30ºC), Sulfobacillus
(50ºC), Acidianus
Brierl. (70ºC),
% sólido: 1-2%
pH: 1,00-2,00, [Fe(II)]: 0-4g/L, tipo de cepa
0,2g/L (NH4)2SO4
0,1g/L KCl 0,1 g/L K2HPO4
0,4g/LMgSO4.7H2O
0,2g/L extrato de levedura.
Concentrado de esfalerita: 43,30%Zn, 26,80%S e 2,89%Fe d80 < 20µm
Shi e Fang
(2004) Batelada, Erlenmeyers 250mL, pH: 2,00,
Temperatura: 35ºC, Acidithiobacillus,
% sólido: 5%, agitação: 160 min.-1
Tipo de cepa,
[Fe(III)]: 0-20g/L Leathen 10g/L Fe(II) Concentrado de marmatita: 40,61%Zn, 31,66%S e 15,81%Fe d90 < 42µm
Shi et al.
(2005) Batelada, Erlenmeyers 250mL,
Sulfobacillus (50ºC)
Temperatura 40-55ºC, pH: 1,0 – 2,0, %sólido: 5-20%, tamanho de partícula: 30,80-40,00µm
Leathen 10g/L Fe(II) 0,05g/L extrato de levedura.
Concentrado de marmatita: 40,61%Zn, 31,66%S e 15,81%Fe
3.3 – Lixiviação química de sulfetos de zinco (ZnS) em meio ácido contendo sulfato e cloreto férrico.
Vários pesquisadores realizaram ensaios de lixiviação química de esfalerita em meio contendo principalmente sulfato ou cloreto férrico como agente oxidante. Estes estudaram, sobretudo, o efeito da temperatura, da granulometria das partículas e da concentração de reagentes sobre a cinética de dissolução do sulfeto. A maioria dos autores observou a formação de enxofre elementar sobre a superfície do mineral, independentemente da natureza da solução lixiviante empregada. Entretanto, não existe um consenso na literatura se a formação de enxofre elementar provoca uma barreira para a difusão de reagentes e produtos. Elevados valores de energia de ativação foram determinados, variando entre 7,50 e 21,50Kcal/mol, o que indica, em um primeiro momento, que a etapa controladora é a reação química na superfície do sulfeto em detrimento ao transporte de massa. Não existe referência sobre a formação de jarosita durante os ensaios de lixiviação química e logicamente não se comenta sobre a possibilidade de limitação na difusão de reagentes e produtos devido a este precipitado. A não formação de jarosita se deve em parte, ao valor extremamente reduzido de pH em que os ensaios de lixiviação química são conduzidos, aproximadamente pH 0,50.
Crundwell (1988) examinou a cinética de dissolução de 5 diferentes amostras de esfalerita em solução contendo cloreto férrico como agente oxidante, a uma concentração de 0,2mol/L. O teor de ferro nas 5 amostras de esfalerita variava entre 0,55 e 8,6% Fe. O autor encontrou que a velocidade de dissolução do mineral variava linearmente com a concentração de ferro contido no mesmo. Crundwell (1988) calculou a energia de ativação para o processo e encontrou valores entre 7,58 e 14,23Kcal/mol. O autor também observou que ocorria uma redução no valor da energia de ativação à medida que o teor de ferro contido no mineral aumentava. Concluiu então que a taxa de dissolução é controlada pela transferência de carga na superfície do mineral.
em ambos os sistemas (cloreto e sulfato) e verificaram que a velocidade de dissolução da esfalerita era linearmente dependente da concentração de ferro contida na sua estrutura cristalina, o que esta de acordo com os resultados obtidos por Crundwell (1988). Os autores também verificaram um aumento na velocidade de dissolução do mineral em função da elevação da temperatura, independente da concentração de ferro na esfalerita. Palencia Perez e Dutrizac (1991) calcularam a energia de ativação para o processo de dissolução do mineral que variou entre 9,81 e 17,22Kcal/mol (meio contendo sulfato) e 9,33 e 19,38Kcal/mol (meio contendo cloreto). Os autores também verificaram que ocorre uma redução no valor da energia de ativação com a elevação do teor de ferro na esfalerita. A partir dos elevados valores de energia de ativação encontrados e da observação de uma cinética de dissolução linear os autores concluíram que a reação de oxidação da esfalerita é limitada pela transferência de carga na superfície do mineral.
Rath et al. (1980) estudaram a cinética de lixiviação de esfalerita sintética em presença de cloreto férrico como agente lixiviante e avaliaram o efeito da temperatura e da concentração de íon férrico sobre a cinética de dissolução do sólido. Rath et al. (1980) verificaram que uma elevação na temperatura e na concentração de íon férrico provocava um aumento na velocidade de dissolução do sulfeto. A ordem da reação com respeito à concentração de íon férrico era de 1,37. Diferentemente de Crundwell (1988), Palencia Perez e Dutrizac (1991) os autores observaram uma cinética de dissolução parabólica para este mineral e determinaram a energia de ativação para o processo como sendo 21,53Kcal/mol. Para explicar o comportamento parabólico, os autores sugeriram que ocorria a formação de uma camada de enxofre elementar sobre a superfície do mineral durante a sua dissolução e que esta camada atuaria como uma barreira para a difusão de reagentes e produtos. Portanto, a etapa controladora do processo de dissolução da esfalerita seria a difusão do íon férrico através desta camada de enxofre elementar. Entretanto, os autores não explicaram o elevado valor de energia de ativação encontrado, o que sugere que a etapa controladora é a reação química na superfície do mineral em detrimento ao transporte do reagente oxidante.
o processo de dissolução foi de 13,88Kcal/mol. O valor da energia de ativação e da ordem de reação determinados neste trabalho são inferiores aos obtidos por Rath et al. (1980), além do que, ocorre também uma mudança no comportamento cinético. Estas alterações podem estar relacionadas com a concentração de ferro presente em ambas as amostras de esfalerita utilizadas nos dois trabalhos. No primeiro foi utilizada uma amostra de esfalerita sintética que não continha ferro em sua composição. Enquanto, no segundo trabalho, os autores utilizaram uma amostra de esfalerita contendo um elevado teor de ferro (11%Fe).
Verbaan e Crundwell (1986) também estudaram a cinética de lixiviação de sulfeto de zinco. Os autores observaram que a velocidade de dissolução da esfalerita era proporcional à superfície específica do concentrado e que uma elevação na concentração de íon férrico provocava um aumento na velocidade de dissolução do sulfeto, em meio contendo sulfato. Entretanto, os autores não determinaram a ordem da reação com respeito à concentração de íon férrico. Verbaan e Crundwell (1986) encontraram uma energia de ativação para o processo igual a 18,90Kcal/mol. O elevado valor de energia de ativação encontrado sugere que a taxa de dissolução é controlada pela reação química na superfície do mineral. Os autores propuseram um modelo eletroquímico que descreveu de maneira satisfatória os resultados experimentais obtidos.
Bobeck e Su (1985) examinaram a cinética de dissolução do sulfeto de zinco (ZnS) em meio contendo cloreto férrico como agente oxidante. Os autores avaliaram o efeito da concentração de íons férrico, da temperatura, da velocidade de agitação e do tamanho de partícula sobre a cinética de dissolução de 3 diferentes concentrados de esfalerita. Os autores verificaram que acima de uma velocidade de agitação de 300min.-1 a cinética de dissolução da esfalerita era independente desta variável, indicando que a difusão de produtos/reagentes através da camada limite de solução não era a etapa controladora do processo. Estes também verificaram que a temperatura tem um forte efeito sobre o percentual de extração de zinco. A energia de ativação encontrada foi 11,24 Kcal/mol. Bobeck e Su (1985) também observaram que um aumento na concentração do agente oxidante provocava uma elevação na velocidade de lixiviação para concentração de íon férrico até 0,10mol/L. Acima deste valor, a velocidade de dissolução era independente da concentração do oxidante. Para valores de concentração de íon férrico inferiores a 0,10mol/L a ordem de reação com respeito à concentração do oxidante era 1,00. Os autores também verificaram que, durante a etapa inicial de dissolução (aproximadamente 50% de extração), a velocidade de lixiviação do mineral apresentava uma cinética linear e era, portanto, controlada pela reação química na superfície do mineral. Entretanto, durante o estágio final de oxidação (a partir de aproximadamente 60% de extração de zinco), a etapa controladora do processo passava a ser a difusão do íon férrico através da camada de enxofre elementar, formada na superfície do mineral. Bobeck e Su (1985) propuseram um modelo topoquímico baseado em um controle misto para descrever a cinética de dissolução da esfalerita.
de íon férrico e concentrações de ácido entre 1 e 3 mol/L, a velocidade de dissolução do sulfeto era similar na presença ou ausência do oxidante. Para concentração de ácido acima de 3 mol/L, a velocidade de dissolução independe da presença do oxidante (ensaio realizado com 0,10mol/L FeCl3). Neste caso, o sulfeto é solubilizado segundo a reação apresentada a seguir:
ZnS + 2HCl ZnCl2 + H2S (3.8)
Dutrizac e MacDonald (1978) observaram que cerca de 85 a 95% do sulfeto era oxidado a enxofre elementar e apenas uma pequena parcela era transformada em sulfato. Apesar da constatação da formação da camada de enxofre elementar sobre as partículas de esfalerita (microscopia ótica), os autores observaram que cinética de dissolução do sulfeto era linear e seguia o modelo topoquímico com a etapa controladora do processo sendo a reação de oxidação na superfície das partículas de esfalerita.
Babu et al. (2002) estudaram a cinética de oxidação de um concentrado de esfalerita em presença de persulfato de amônio, de sódio e de potássio como agentes oxidantes. Os autores avaliaram os efeitos da concentração de ácido sulfúrico e do oxidante, da temperatura e do tamanho de partícula sobre a velocidade de lixiviação do sólido. Babu et al. (2002) observaram que a adição de 5% (V/V) de ácido sulfúrico aumentava o percentual de extração de zinco em cerca de 20%. O percentual de extração também aumentava com a redução do tamanho das partículas. Babu et al. (2002) verificaram que a cinética de dissolução do concentrado apresenta um comportamento parabólico e concluíram que a etapa controladora do processo era a difusão do agente oxidante através da camada de enxofre elementar, formada sobre a partícula de esfalerita com o decorrer do processo de dissolução. Análises do material lixiviado por MEV e EDS confirmaram a presença de enxofre elementar sobre as partículas e suportaram a hipótese de controle por difusão. Os autores encontraram uma energia de ativação para o processo de 9,81Kcal/mol. Estes também observaram que o persulfato de amônio é mais efetivo que o persulfato de potássio ou de sódio e obtiveram 96% de extração de zinco, em 6 horas.
Tabela 3.2 – Condições experimentais empregadas nos ensaios de lixiviação química da esfalerita.
Referência Condições experimentais Mineral Resultados
Crundwell (1988)
0,2 mol/L FeCl3;
0,3 mol/L HCl; 2 mol/L NaCl;
temperatura: 45,65 e 85ºC; partícula: 45-69µm.
Concentrado de esfalerita: 51-66 % Zn 29-32% S 0,55-8,60 % Fe
Energia ativação: 7,58-14,23 Kcal/mol Etapa controladora: reação química na superfície do sólido.
Palencia Perez e Dutrizac (1991)
0,3 mol/L FeCl3 – HCl;
0,3mol/L Fe(SO4)1,5 - H2SO4;
temperatura: 20-90ºC; pH: 0,50;
partícula: 75-104µm; superfície específica (BET): 0,048 - 0,106 m2/g;
volume: 3L; agitação: 400min.-1
Cristais de esfalerita: 54,30-66,60 % Zn 32,70-36,20% S 0,04-14,70 % Fe
Energia ativação: 9,81-17,22 Kcal/mol; constante de velocidade: 0,38 - 4,33 gg-1m-2h-1- meio sulfato.
Energia ativação: 9,33-19,38 Kcal/mol; constante de velocidade: 0,26 - 9,73 gg-1m-2h-1- meio cloreto.
Etapa controladora: reação química na superfície do sólido.
Rath et al. (1980) 0,2 - 0,8 mol/L FeCl3;
temperatura: 30 - 70ºC; partícula < 75µm;
volume: 200mL; agitação: 200 min.-1
Esfalerita sintética Energia ativação: 21,5Kcal/mol; Ordem da reação Fe (III): 1,37;
Etapa controladora: difusão de íon férrico através da camada de enxofre elementar
Verbaan e Crundwell (1986)
0,02 - 1 mol/L FeCl3;
temperatura: 25 - 85ºC; superfície específica (BET): 0,702 – 1,91 m2/g;
volume: 10L.
Concentrado de esfalerita: 50,90 % Zn 30,80 % S 9,10 % Fe
Energia ativação: 18,90 Kcal/mol
Rath et al. (1988) 0,1 – 1,0 mol/L FeCl3;
temperatura: 30 - 60ºC; partícula: 20 - 250µm.
Concentrado de esfalerita: 50 % Zn 37 % S 11 % Fe
Energia ativação: 13,88 Kcal/mol; Ordem da reação Fe (III): 0,62; Etapa controladora: reação química na superfície do sólido
Venkataswamy e Khangaonkar (1980)
1 - 4,0 mol/L FeCl3;
temperatura: 106ºC; partícula: 72 - 200µm.
Concentrado de esfalerita: 57,50 % Zn 30 % S 2 % Fe
Formação de enxofre elementar seguida de redução no percentual de extração de zinco.
Bobeck e Su
(1985) 0,001 - 1 mol/L FeCltemperatura: 45 - 90ºC; 3; partícula: 75 - 500µm; volume: 500mL; agitação: 10 - 600 min.-1
Concentrado de esfalerita: 44,33 - 61 % Zn 5,17 - 8,06 % Fe
Energia ativação: 11,22 Kcal/mol; Ordem da reação Fe (III): 1,00;
Concentração crítica de oxidante: 0,1 mol/L; Etapa controladora: reação química na superfície do sólido, fase inicial, e difusão na camada de enxofre na fase final do processo de dissolução.
Babu et al. (2002)
temperatura: 35 - 80ºC; partícula: 45 - 150µm; volume: 200mL
Concentrado de esfalerita:
49,50 % Zn, 31,37 % S, 9,53 % Fe
Energia ativação: 9,81 Kcal/mol; Etapa controladora: difusão do agente oxidante através da camada de enxofre elementar.
Dutrizac e MacDonald (1978)
0,001 - 3 mol/L FeCl3;
0,1 - 5 mol/L HCl; temperatura: 25 - 100ºC; partícula: 150 - 210µm.
Cristais de esfalerita:
67,08 % Zn, 32,73 % S, 0,08 % Fe
Energia ativação: 10 Kcal/mol; Ordem da reação Fe (III): 0,36; Etapa controladora: reação química na superfície do sólido.
Jin et al. (1984) 0,05 - 2 mol/L FeCl3;
temperatura: 27 - 93ºC; partícula: 44 - 125µm; volume: 1000mL; agitação: 250 – 900min.-1
Concentrado de esfalerita: 61,50 % Zn 3,40 % Fe
Energia ativação: 13,97 Kcal/mol; Ordem da reação Fe (III): 0,50;
Tabela 3.3 – Modelos empregados para descrever a cinética de dissolução de ZnS.
Autores Modelos Parametros
Bobeck e Su (1985)
(
−)
+ − −(
−)
=kst− 3 2 3 1 1 3 2 1 1
1 α β α α k(min.mol) s = 0,015-0,054 -1
β=1,8 - 4,82
Rath et al. (1988)
(
)
[
]
e td Fe k RT E s atv − + = − − 0 62 , 0 3 3 1 1
1
α
kEsatv = 4,3m/s =58kJ/mol Verbaan eCrundwell
(1986)
[
]
Eh RT E e M M A ke dt ZnS d act 3 , 17 3 2 0 0 =
− ks=6,505 mol/m
2/s
Eatv=79,4kJ/mol
Jin et al. (1984)
(
)
[
]
e tr Fe k RT E s atv − + = − − 0 50 , 0 3 3 1 1
1
α
kEsatv = 1,48m/s =58,4kJ/molOnde:
= fração reagida; = constante; t = tempo; T = temperatura;
R = constante dos gases ideais, d0 = diâmetro inicial;
r0 = raio inicial das partículas;
M = massa molar no tempo t; M0 = massa molar inicial;
A0 = área inicial das partículas;
Capítulo 4 – Metodologia.
4.1 – Ensaios de biolixiviação.
Os ensaios de biolixiviação foram conduzidos com microrganismos do gênero
Acidithiobacillus. Estes microrganismos foram isolados na mina de sulfetos de Morro Agudo
(Votorantim Metais) e cultivados em presença de sulfeto de zinco por cerca de 3 anos (Daman et al., 2002).
Os experimentos de biolixiviação foram realizados em batelada, em erlenmeyers de 250mL contendo 100mL de solução, com um percentual de sólidos de 1% (p/v) e volume de inóculo de 10% (v/v). Os frascos foram agitados a uma velocidade de 200min.-1, em um agitador orbital, e mantidos a temperatura de 33ºC, em uma sala climatizada. Foi empregado o meio de cultura Norris que contém os seguintes elementos: (NH4)2SO4: 0,20g/L; MgSO4.7H2O:
0,40g/L e K2HPO4: 0,10g/L. Todos os sais empregados na preparação das soluções utilizadas
nos ensaios eram de qualidade analítica (marca Synth).
Foram avaliados o efeito do pH da suspensão, entre 1,50 e 2,50; da concentração de ferro ferroso, entre 0 e 8g/L e da concentração de íon férrico, entre 0 e 5g/L, sobre o percentual de extração do metal e sobre a cinética de crescimento do microrganismo.
O pH da solução foi ajustado, quando necessário, pela adição de solução 1mol/L de H2SO4 e
6mol/L NaOH. As perdas por evaporação foram compensadas pela adição de água destilada. Timol foi usado como bactericida nos ensaios utilizados como controle (em ausência de microrganismos).
potássio em um equipamento Schott titroline alpha. A concentração em Fe(III) foi determinada por diferença entre a concentração em ferro total e a concentração em Fe(II).
A concentração bacteriana em solução foi determinada utilizando uma câmara de Neubauer com auxílio de um microscópio com capacidade de aumento de até 1000 vezes (marca Leica).
O concentrado (C1) utilizado nos ensaios apresentava uma granulometria 100% inferior a 45µm (325 mesh Tyler). O concentrado sulfetado foi gentilmente fornecido pela Votorantim Metais (VM). A tabela 4.1 apresenta a análise química do concentrado de esfalerita utilizado durante os ensaios de biolixiviação (análises fornecidas pela Votorantim Metais).
Tabela 4.1 – Análise química do concentrado de esfalerita (C1).
%Zn %S %Fe %Cd %Cu %Co %Pb
48,13 31,02 12,12 0,21 0,95 0,002 1,28
4.2 – Ensaios de lixiviação química.
Os ensaios de lixiviação química foram realizados em um reator de vidro borossilicato encamisado, com volume de útil de 200mL. O volume de solução utilizado foi de 120mL, o percentual de sólidos de 0,50% (p/v) e a temperatura do reator foi ajustada a partir da circulação de água, aquecida à temperatura desejada, com auxilio de um banho termostático com bomba de circulação externa (Nova Ética modelo 500/3D). A suspensão foi agitada com auxílio de um agitador magnético. A concentração de ácido sulfúrico (H2SO4) foi mantida
constante em 1mol/L em todos os ensaios. O concentrado C2 utilizado nos ensaios apresentava uma granulometria 100% inferior a 45µm (325 mesh Tyler). Este último também foi gentilmente fornecido pela Votorantim Metais.
concentrado de esfalerita. A fonte de íon férrico empregada foi sulfato férrico (Fe2(SO4)3.5H2O), marca Synth.
4.2.1 – Preparação do concentrado parcialmente biolixiviado.
O concentrado sulfetado parcialmente biolixiviado (Bio 25% e Bio 50%) empregado nos ensaios de lixiviação química foi obtido em ensaios de biolixiviação conduzidos em batelada, utilizando a metodologia descrita na seção 4.1. As únicas diferenças foram o percentual de sólido em suspensão, que foi elevado de 1% para 10% (p/v) e o concentrado sulfetado empregado, que neste caso, foi o concentrado C2, cuja composição química é descrita no item 4.2.4.
4.2.2 – Caracterização morfológica.
Análises por MEV e EDS (equipamento JEOL JSM 5510) foram realizadas com o concentrado C2, com o resíduo da lixiviação química e com o material parcialmente biolixiviado, visando-se determinar a evolução da morfologia do sólido e possíveis produtos gerados durante a solubilização do sulfeto.

![Figura 5.2 – Evolução da concentração bacteriana ([X]) com o tempo, em função do pH](https://thumb-eu.123doks.com/thumbv2/123dok_br/15749097.637674/43.892.214.724.132.459/figura-evolução-da-concentração-bacteriana-com-tempo-função.webp)