Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 61349-61356. aug. 2020. ISSN 2525-8761
Avaliação da atividade xilanase de cultivos de fungos mesófilo e termófilo
utilizando resíduos e subprodutos agrícolas
Evaluation of the xylanase activity of cultures of mesophilic and thermophilic
fungi using agricultural residues and by-products
DOI:10.34117/bjdv6n8-524
Recebimento dos originais: 25/07/2020 Aceitação para publicação: 24/08/2020
Renata Kaori Pritsch
Acadêmica do Curso de Odontologia do Centro de Ciências Biológicas Instituição: Universidade Estadual do Oeste do Paraná
Endereço: Rua Universitária, 2069 - Cascavel, PR, 85814-110, Brasil E-mail: renatapritsch@hotmail.com
Andreza Gambelli Lucas Costa Nascimento
Mestranda pelo Programa de Pós-Graduação em Ciências Farmacêuticas – Unioeste Instituição: Universidade Estadual do Oeste do Paraná
Endereço: Rua Universitária, 2069 - Cascavel, PR, 85814-110, Brasil E-mail: andreza.agl@gmail.com
Jorge William Fischdick Bittencourt
Mestre pelo Programa de Pós-Graduação em Ciências Farmacêuticas – Unioeste Instituição: Universidade Estadual do Oeste do Paraná
Endereço: Rua Universitária, 2069 - Cascavel, PR, 85814-110, Brasil E-mail: jwfbit@hotmail.com
Leticia Mara Rasbold
Mestra pelo Programa de Pós-Graduação em Ciências Farmacêuticas – Unioeste Instituição: Universidade Estadual do Oeste do Paraná
Endereço: Rua Universitária, 2069 - Cascavel, PR, 85814-110, Brasil E-mail: lee.rasbold@gmail.com
José Luis da Conceição Silva
Doutor em Ciências Biológicas Universidade Estadual de Maringá Programa de Pós-Graduação em Ciências Farmacêuticas,
Universidade Estadual do Oeste do Paraná
Endereço: Rua Universitária, 2069 - Cascavel, PR, 85814-110, Brasil E-mail: jose.silva3@unioeste.br
Alexandre Maller
Doutor em Bioquímica pela Universidade de São Paulo
Instituição: Programa de Pós-Graduação em Ciências Farmacêuticas, Universidade Estadual do Oeste do Paraná
Endereço: Rua Universitária, 2069 - Cascavel, PR, 85814-110, Brasil E-mail: alexandre.maller@unioeste.br
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 61349-61356. aug. 2020. ISSN 2525-8761 Rita de Cássia Garcia Simão
Doutora em Bioquímica pela Universidade de São Paulo Instituição: Programa de Pós-Graduação em Ciências Farmacêuticas,
Universidade Estadual do Oeste do Paraná
Endereço: Rua Universitária, 2069 - Cascavel, PR, 85814-110, Brasil E-mail: rita.simao@unioeste.br
Marina Kimiko Kadowaki
Doutora em Bioquímica pela Universidade de São Paulo Instituição: Programa de Pós-Graduação em Ciências Farmacêuticas,
Universidade Estadual do Oeste do Paraná
Endereço: Rua Universitária, 2069 - Cascavel, PR, 85814-110, Brasil E-mail: marina.kadowaki@unioeste.br
RESUMO
Os fungos são microrganismos que possuem alta capacidade de degradar material orgânico na natureza por ação de várias enzimas secretadas. Nesse contexto, o presente trabalho teve como objetivo avaliar a influência dos resíduos agroindustriais como fontes alternativas de carbono na produção de xilanase por fungo mesófilo Penicillium crustosum e termófilo PA2S7T em cultivos líquidos. Dentre as três fontes de carbono testadas, a palha de milho foi o melhor indutor de xilanase para o fungo P. crustosum com valores de 25,45 U/ml e 19,35 U/ml em condições de cultivo estacionário e agitado, respectivamente. Porém, para o isolado termófilo PA2S7T o subproduto agrícola fibra/farelo de trigo aumentou a produção da xilanase com o valor de 26 U/ml em condições estacionárias de cultivo. Portanto, os dois fungos apresentaram habilidade na produção da xilanase utilizando os resíduos ou subprodutos agroindustriais como fontes alternativas de carbono para sintetizar e secretar essa enzima de grande interesse biotecnológico.
Palavras-chave: Fungo, resíduos agroindustriais, sistema xilanolítico ABSTRACT
Fungi are microorganisms that have a high capacity to degrade organic material in nature by the action of several secreted enzymes. In this context, this study aimed to evaluate the influence of agro-industrial wastes as alternative sources of carbon in the production of xylanase from mesophilic fungus Penicillium crustosum and thermophilic PA2S7T in liquid cultures. Among the three carbon sources tested, corn straw was the best xylanase inducer for the fungus P. crustosum with values of 25.45 U/ml and 19.35 U/ml in stationary and agitated cultivation conditions, respectively. However, for the thermophilic isolate PA2S7T, the agricultural by-product fiber/wheat bran increased xylanase production to 26 U/ml under stationary growing conditions. Therefore, the two fungi showed ability in the production of xylanase using agro-industrial residues or by-products as alternative sources of carbon to synthesize and secrete this enzyme of great biotechnological interest.
Keywords: Fungus, agro-industrial residues, xylanolitic system
1 INTRODUÇÃO
Com a crescente industrialização da agricultura, cada vez mais resíduos de origem vegetal são gerados no momento da colheita ou após processamento industrial. Nestes resíduos agrícolas são
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 61349-61356. aug. 2020. ISSN 2525-8761
encontradas ainda grandes quantidades de biomassa hemicelulósica, que é formada por vários polímeros de carboidratos como xilana, galactana, entre outros (Nascimento et al, 2020). A xilana é encontrada nos mais diversos resíduos agroindustriais como por exemplo, no sorgo, no bagaço-de-cana, no bagaço de cevada, na palha de milho, farelo de arroz e trigo (Kumar et. al, 2017).
A utilização desses resíduos como substrato indutor de enzimas de microrganismos, é visto como um precursor de uma tecnologia mais limpa (Kumar et. al., 2017; Shrivastava et. al., 2016), e uma alternativa positiva na aplicação dos compostos gerados após colheita.
O sistema xilanolítico é compreendido de uma gama de enzimas tais como a endo 1,4 β-xylanase (EC 3.2.1.8), β-xilosidase (EC 3.2.1.37), a α-L- arabinofuranosidase (EC 3.2.1.55), a α-D-glucuronidase (EC 3.2.1.139) entre outras, porém somente as enzimas comumente denominadas apenas de “xilanase” são responsáveis por clivar de forma randomizada as ligações glicosídicas internas da cadeia principal do xilano, obtendo como produto açúcares redutores chamados de xilo – oligossacarídeos de tamanhos variáveis (Heinen et al, 2017). As xilanases fúngicas geralmente pertencem à família das glicosil hidrolase (GH) 10 e 11 e possuem diversas aplicações industriais, tais como: clarificação de sucos e vinhos, melhoramento da digestibilidade de ração de animais monogástricos, no biobranqueamento de polpas de celulose, na indústria de panificação e na bioconversão de resíduos lignocelulósicos em produtos fermentescíveis (Juturu et al, 2012; Geetha et al, 2017).
Estas enzimas são produzidas por vários micro-organismos tais como em bactérias e fungos (Alves-Prado, 2010; Maity et al., 2012), leveduras (Zhao et al., 2011), entre outros. Dentre esses micro-organismos, destacam-se os fungos, pois as enzimas produzidas por eles possuem vantagens com relação às enzimas produzidas por bactérias por serem secretadas no meio extracelular e em maior quantidade (Polizeli et al., 2005). Dentro desse contexto, os fungos mesófilo Penicillium crustosum e o isolado termófilo PA2S7T previamente isolados do bioma da Mata Atlântica do Oeste do Paraná, foram objetos desse estudo para produção de xilanases utilizando resíduos agroindustriais como fontes alternativas de carbono em cultivo líquido.
2 MATERIAL E MÉTODOS
2.1 MANUTENÇÃO DA LINHAGEM FÚNGICA E CONDIÇÕES DE CULTIVO EM MEIO LÍQUIDO
As linhagens dos fungos P. crustosum e PA2S7T foram cultivadas em ágar-batata-dextrose, incubadas por 6 dias em estufa a 28ºC para o fungo mesófilo P. crustosum e a 40ºC para o isolado termófilo PA2S7TS. Suspensão dos conídios (107 esporos/mL) foi inoculado em meio líquido Czapek
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 61349-61356. aug. 2020. ISSN 2525-8761
suplementado com 2% (p/v) com as fontes palha de milho, fibra/farelo de trigo e bagaço de cana, em seguida incubados a 28°C/40ºC em incubadora BOD por 6 dias em condições estacionárias ou em incubadora do tipo SHAKER por 4 dias sob agitação de 120 rpm a 28ºC. Após o crescimento dos cultivos, as culturas foram filtradas à vácuo, onde foram obtidos um filtrado livre de células.
2.2 DOSAGEM ENZIMÁTICA
A atividade de xilanase foi determinada através da quantificação de açúcares redutores pelo método de Miller (1959). Para a reação foram utilizados 300 μL de xilano de beechwood 1% (em tampão fosfato de sódio 50 mM, pH 6,0), incubado com 300 μL de extrato enzimático a 50°C. Nos tempos 0, 5, 10 e 15 minutos; alíquotas de 100 µL foram retiradas e a reação interrompida com adição de 100µL de solução de ácido 3,5-dinitrossalicílico. As leituras espectrofotométricas foram realizadas a 540 nm, utilizando-se como padrão xilose. A unidade de atividade enzimática foi definida como sendo a quantidade de enzima capaz de liberar 1 micromol de açúcar redutor por minuto.
2.3 DOSAGEM PROTEICA
As proteínas foram dosadas pelo método de Bradford (1976) utilizando albumina de soro bovino (BSA) como padrão, sendo as leituras espectrofotométricas realizadas a 595 nm. A unidade foi definida como mg de proteína por mL.
3 RESULTADOS E DISCUSSÃO
3.1 ANÁLISE DA PRODUÇÃO DE XILANASE POR P. crustosum e isolado PA2S7T UTILIZANDO RESÍDUOS AGROINDUSTRIAIS EM CONDIÇÕES ESTACIONÁRIAS
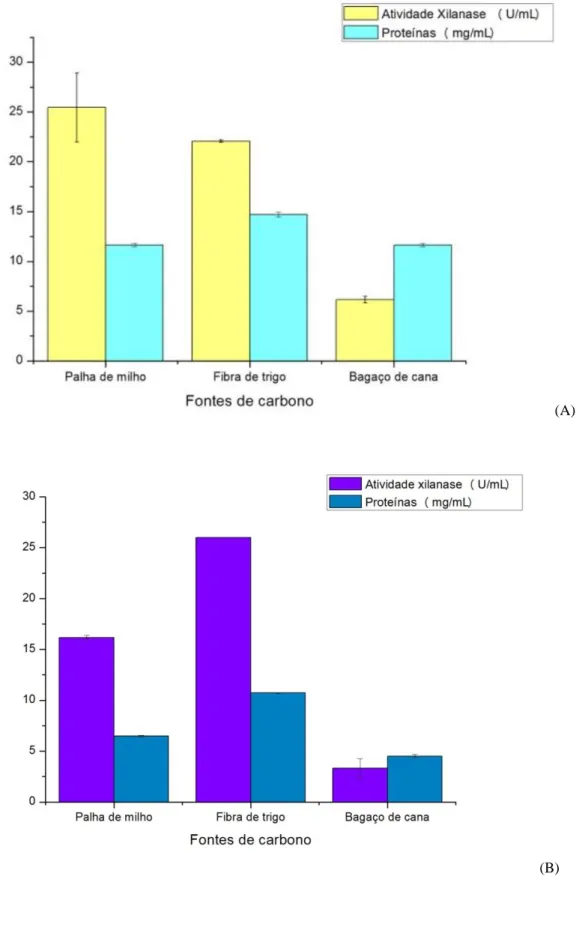
Pode-se observar que a palha de milho foi o melhor indutor para produção de xilanase para o P. crustosum (25,45 U/mL); porém, observando a quantidade de proteína, a fibra de trigo apresentou o maior valor (14,7 mg/mL) enquanto a palha de milho e bagaço de cana apresentaram valores iguais (Figura 1A). Entretanto, como mostrado na Figura 1B, o comportamento de produção da xilanase pelo isolado PA2S7T foi diferente em relação ao P. crustosum, sendo a fonte de carbono fibra de trigo o melhor indutor de atividade enzimática com 26 U/mL e em quantidade de proteína (10,72 mg/mL).
Em relação à atividade xilanásica, Silva et al. (2016) em estudo prévio encontrou valores similares em cultivo com fungo P. crustosum suplementado com palha de milho (atividade de 26,8 U/mL). Knob et al. (2013) reportaram atividades xilanolíticas com o fungo Penicillium glabrum utilizando farelo de trigo e bagaço de cana, com 20,54 U/mL e 8,34 U/mL, respectivamente.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 61349-61356. aug. 2020. ISSN 2525-8761
Figura 1 – Produção de xilanase e sua relação proteica utilizando diferentes fontes de carbono do fungo P. crustosum em cultivo com condições estacionárias (A) e do isolado fúngico PA2S7T (B)
(A)
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 61349-61356. aug. 2020. ISSN 2525-8761
3.2 ANÁLISE DA PRODUÇÃO DE XILANASE POR P. crustosum UTILIZANDO RESÍDUOS E SUBPRODUTO AGROINDUSTRIAIS EM CONDIÇÕES AGITADAS
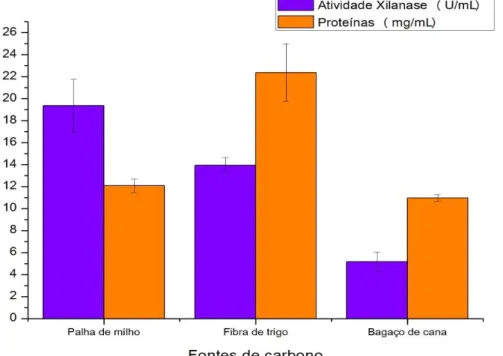
A fonte de carbono que mais se destacou no cultivo líquido em condições agitadas foi também a palha de milho com atividade xilanásica de 19,35 U/mL. Porém, a fibra ou farelo de trigo proporcionou maiores valores na produção proteica (24,15 mg/mL), como demonstrado na Figura 2. Em estudos reportados na literatura sobre atividades xilanásicas extracelulares suplementados com farelo de trigo como fonte de carbono, foram encontrados valores de 7,5 U/mL para Penicillium sclerotiorum (Knob & Carmona, 2008) e 6,47 U/mL para Penicillium chrysogenum (Okafor et al., 2007).
Figura 2 - Influência das fontes de carbono na produção de xilanase extracelular e intracelular e sua relação proteica do fungo P. crustosum em condições agitadas (120 rpm) por 4 dias a 28ºC
4 CONCLUSÃO
Pode-se concluir que tanto o fungo mesófilo P. crustosum quanto o isolado termófilo PA2S7T apresentaram-se como bons produtores de enzima xilanase induzidas por palha de milho e fibra/farelo de trigo, respectivamente. Entretanto, o cultivo líquido estacionário mostrou ser um processo mais eficaz, em relação ao cultivo em condição agitada, suplementados com resíduos agroindustriais como fontes alternativas de carbono. Contudo este uso dos resíduos ou subprodutos agrícolas como indutor de enzima fúngica são de grande relevância, pois contribui para o desenvolvimento de uma tecnologia sustentável e ambiental.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 61349-61356. aug. 2020. ISSN 2525-8761 AGRADECIMENTOS
R K. Pritsch, J.W.F. Bittencourt e L. M. Rasbold agradecem a Unioeste, Capes e Fundação Araucária pelas bolsas de estudo e auxílios financeiros para a execução deste trabalho.
REFERÊNCIAS
Alves-Prado, H.F., Pavezzi, F.C., Leite, R.S.R., Oliveira, V.M. de, Sette, L.D. & Dasilva, R. (2010). Screening and Production Study of Microbial Xylanase Producers from Brazilian Cerrado. Applied Biochemistry and Biotechnology 161, 333-346.
Bradford, M.M. (1976). Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Analytical Biochemistry 72, 248-254.
Geetha, K.; Gunasekaran, P. (2017) Purification of Endoxylanase from Bacillus pumilus B20 for Production of Prebiotic Xylooligosaccharide Syrup; An In vitro Study. Iranian Journal of Biotechnology, v. 15, n. 4, p. 232–240.
Heinen, P.R., Betini, J.H.A., Polizeli, Maria L.T.M. (2017). Xylanases Reference Module in Life Sciences. Elsevier.
Knob A., Beitel S.M., Fortkamp D., Terrasan C.R.F. & Almeida A.F. (2013). Production, Purification, and Characterization of a Major Penicillium glabrum Xylanase Using Brewer’s Spent Grain as Substrate. BioMed Research International. Article 8.
Knob A. & Carmona E.C. (2008) Xylanase Production by Penicillium sclerotiorum and its Characterization. World Applied Sciences Journal 4, 277-283.
Kumar, V.; Chhabra, D.; Shukla, P. (2017). Xylanase production from Thermomyces lanuginosus VAPS-24 using low cost agro-industrial residues via hybrid optimization tools and its potential use for saccharification. Bioresource Technology, v. 243, p. 1009–1019.
Juturu, V.; Wu, J. C. (2012) Microbial xylanases: Engineering, production and industrial applications. Biotechnology Advances, v. 30, n. 6, p. 1219–1227.
Maity, C., Ghosh, K., Halder, S.K., Jana, A., Adak, A., Mohapatra, P.K.D., Pati, B.R. & Mondal, K.C. (2012). Xylanase Isozymes from the newly Isolated Bacillus sp. CKBx1D and optimization of its deinking potentiality. Applied Biochemistry and Biotechnology 167, 1208-1219.
Miller, G.L. (1959). Use of dinitrosalicylic acid for determination of reducing sugar. Analytical Chemistry 31, 424-426.
Nascimento, A. G. L. C., Della Torre, C. L., Kadowaki, M. K. (2020). Uma abordagem sobre produção de xilanases pelo fungo Thermomyces lanuginosus utilizando resíduos agroindustriais como indutor. Pesquisa Científica e Tecnológica em Microbiologia 2. Ed. Athena. Cap. 16, 166-176.
Braz. J. of Develop.,Curitiba, v. 6, n. 8, p. 61349-61356. aug. 2020. ISSN 2525-8761
Okafor U.A., Emezue T.N., Okochi V.I., Onyegeme-Okerenta B.M. & Nwodo-Cjinedu S. (2007). Xylanase production by Penicillium chrysogenum (PCL501) fermented on cellulosic wastes. African Journal of Biochemistry Research 1, 48-53.
Polizeli, M.L.T.M., Rizzatti, A.C.S., Monti, R., Terenzi, H.F., Jorge, J.A. & Amorim, D.S. (2005). Xylanases from fungi: properties and industrial applications. Applied Microbiology and Biotechnology 67, 577-591.
Shrivastava, S., Kumar, V., Baweja, M., Shukla, P. (2016). Enhanced xylanase production from Thermomyces lanuginosus NCIM 1374/ DSM 28966 using statistical analysis. Journal of Pure and Applied Microbiology. v. 10, n.3.
Silva N.F.S., Simões M.R., Knob A., Moraes S.S., Henn C., Silva J.L.C., Simão R.C.G., Maller A. & Kadowaki M.K. (2016). Improvement in the bleaching of kraft pulp with xylanase from Penicillium crustosum FP 11 isolated from the Atlantic forest. Biocatalysis and Biotransformation 34, 119-127. Zhao, N., Guo, R.F., Yu, H.W., Ke, X.J., Jia, Y.M. & Bai,Y. (2011). Expression and characterization of a thermostable xylanase gene xynA from a thermophilic fungus in Pichia pastoris. Agricultural Sciences in China 10, 343-350.