Disciplina: Ligações Químicas
Prof. Dalmo Mandelli
Simetria Molecular
Parte 2
Tabela de caracteres e os símbolos de simetria
A análise sistemática das propriedades de simetria das moléculas
é feita usando-se as tabelas de caracteres.
Shriver e Atkins, Química Inorgânica, 4ª Ed.
O fluxograma ao lado nos ofereceu uma boa maneira uma identificação de grupos de pontos utilizando certos elementos de simetria
diagnósticos,
No entanto pode ser necessário estabelecer se alguns elementos de simetria adicionais são
apresentados ou não por uma molécula em um dado grupo de pontos.
Cada grupo de pontos tem uma tabela de caracteres
associada e aquela para o grupo de pontos C2v é
apresentada à seguir
Exemplo: H
2O
As entradas na parte principal da tabela são os chamados caracteres, (chi).
Cada caractere mostra como um objeto ou função matemática, tal como um orbital atômico, é afetado pela correspondente operação de simetria do grupo .
1 permanece inalterado -1 troca de sinal.
Uma classe é um grupo especifico de operações de simetria de um mesmo tipo geral.
Duas rotações ternárias em torno de um eixo (no sentido horário e/ou anti-horário) formam uma classe.
Número total de operações de simetria ou ordem do grupo pontual em questão
Uma classe é um grupo especifico de operações de simetria de um mesmo tipo geral.
Duas rotações ternárias em torno de um eixo (no sentido horário e anti-horário) formam uma classe.
Cada linha de caracteres se refere a uma representação irredutível particular de um grupo, a qual tem um significado técnico na teoria de grupo.
O símbolo na primeira coluna é a simetria (essencialmente, um rótulo como ou )
daquela representação irredutível e, no caso de orbitais, fornece informações sobre a degenerescência:
A , B (a,b) não-degenerados E (e) duplamente degenerados T (t) triplamente degenerados
Por convenção os tipos de simetria são escritos em letras maiúsculas (por ex: A1 , E), mas os orbitais aos quais eles são aplicados são rotulados com letras minúsculas em itálico.
Os caracteres na coluna da operação identidade E fornecem a degenerescência dos orbitais.
1 não-degenerados
Grupo pontual C2v
As operações de simetria são E, C2 (um eixo de rotação binário em torno do eixo z) e as duas reflexões (v e v’), em cada um dos planos
verticais, definidos aqui como xz e yz,
respectivamente), totalizando quatro operações de simetria.
Exemplo: H
2O
Exemplo: H
2O
Grupo pontual C2v
As operações de simetria são E, C2 (um eixo de rotação binário em torno do eixo z) e as duas reflexões (v e v’), em cada um dos planos verticais, definidos aqui como xz e yz,
respectivamente), totalizando quatro operações de simetria.
Exemplo: H
2O
Grupo pontual C2v
As operações de simetria são E, C2 (um eixo de rotação binário em torno do eixo z) e as duas reflexões (v e v’), em cada um dos planos verticais, definidos aqui como xz e yz,
respectivamente), totalizando quatro operações de simetria.
Orbital 2pz no átomo de oxigênio:
Este orbital é proporcional a zf(r) e suas propriedades de simetria são as da própria função z.
Todos os caracteres são +1, uma vez que a função z, assim como o Opz, fica inalterada para todas as operações do grupo de pontos.
Assim, o orbital O2pz é totalmente simétrico sob todas as operações do grupo de pontos C2v, e, portanto, tem a simetria A1.
Exemplo: H
2O
z
y
Orbital 2py no átomo de oxigênio:
Este orbital é proporcional a yf(r) e suas propriedades de simetria são as da própria função y.
O caractere deste orbital para o C2 é -1 que significa simplesmente que a função y,
assim como o Opy muda de sinal sob uma rotação binária.
O orbital Opy também muda de sinal (e, portanto, tem caractere -1) quando refletido no plano zx, mas fica inalterado (caractere +1) quando refletido no plano yz.
Assim, os caracteres do orbital O2py são (1, -1, -1, 1) e, portanto, a simetria é B2.
Exemplo: H
2O
Orbital 2s no átomo de oxigênio:
Também é totalmente simétrico (assim como em todos os grupos de pontos), tendo assim a
simetria A1.
Exemplo: H
2O
A
1
a função a qual se refere é simétrica em relação à rotação em torno do eixo binário.
a função à qual ele se refere é simétrica com relação à reflexão no plano vertical principal (para a H2O este plano é o que contém todos os três átomos, yz).
A
2
a função à qual ele se refere é muda de sinal com relação à reflexão no plano vertical principal (para a H2O este plano é o que contém todos os três átomos, yz).
Em sistemas pertencentes ao grupo pontual C2v as letras e índices são usados para rotular simetrias da seguinte forma:
Grupo pontual C3v
As operações de simetria são E, 2C3 (um eixo de rotação ternário em torno do eixo
z) e três reflexões v, cortando as ligações N-H, totalizando seis operações de
Grupo pontual C3v
As operações de simetria são E, 2C3 (um eixo de rotação ternário em torno do eixo
z) e três reflexões v, cortando as
ligações N-H, totalizando seis operações de simetria.
Grupo pontual C3v
As operações de simetria são E, 2C3 (um eixo de rotação ternário em torno do eixo
z) e três reflexões v, cortando as ligações N-H, totalizando seis operações de
Uma molécula de NH3 tem uma simetria maior do que a da H2O.
Para H2O, h =4 e para NH3, h = 6.
Para moléculas altamente simétricas, h é
grande.
Por exemplo, h = 48 para o grupo de pontos Oh.
Enquanto o orbital N2pz é único (ele tem
simetria A1), os dois orbitais restantes N2px
e N2py pertencem à mesma representação de simetria E.
Em outras palavras, eles são degenerados (eles tem as mesmas características de simetria e logo tem a mesma energia).
Em geral, E sempre indica uma dupla degenerescência e T indica uma
Exemplo: NH
3Enquanto o orbital N2pz é único (ele tem simetria A1), os dois orbitais restantes N2px
e N2py pertencem à mesma representação de simetria E.
Em outras palavras, eles são degenerados
(eles tem as mesmas características de simetria e logo tem a mesma energia).
Em geral, E sempre indica uma dupla degenerescência e T indica uma
Os caracteres na coluna da operação identidade E fornecem a degenerescência dos orbitais.
Em sistemas pertencentes ao grupo pontual C3v as letras e índices são usados para rotular simetrias da seguinte forma:
A1 ou A2 (ou B etc.) se refere a uma representação irredutível não-degenerada que tem um caractere 1 na coluna E.
Os caracteres na coluna da operação identidade E fornecem a degenerescência dos orbitais.
Em sistemas pertencentes ao grupo pontual C3v as letras e índices são usados para rotular simetrias da seguinte forma:
A1 ou A2 (ou B etc.) se refere a uma representação irredutível não-degenerada que tem um
caractere 1 na coluna E.
Os caracteres na coluna da operação identidade E fornecem a degenerescência dos orbitais.
Em sistemas pertencentes ao grupo pontual C3v as letras e índices são usados para rotular simetrias da seguinte forma:
A1 ou A2 (ou B etc.) se refere a uma representação irredutível não-degenerada que tem um caractere 1 na coluna E.
Representações irredutíveis degeneradas também contém valores zero para algumas operações.
Uso de Matrizes: Propriedades e Representações de Grupos
Todos os grupos matemáticos, incluindo os grupos de pontos, devem ter certas propriedades.
Vamos usar o NH3, do grupo C3v como exemplo.
1) Propriedade do grupo:
Cada grupo deve conter uma operação de identidade que comute (em outras palavras,
EA = AE) com todos
os outros membros do grupo e deixe-os inalterados (EA =AE =A).
Exemplo:
Moléculas C3v (e todas as moléculas) contém a operação de identidade E.
2) Propriedade do grupo:
Cada operação deve ter um inverso que, quando combinado com a operação, produza a operação de identidade (às vezes, uma operação de simetria pode ser sua própria inversa). NOTA: por convenção, podemos realizar operações de simetria sequencial da
direita para a esquerda.
Exemplo:
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
C32C
3=E(C3 e C32 são inversas entre si)
3) Propriedade do grupo:
O produto de qualquer das operações do grupo também deve ser um membro do grupo. Isso inclui o produto de qualquer operação consigo própria.
.
Exemplo:
vC3tem o mesmo efeito global que v", portanto, escrevemos vC3 = v".
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
4) Propriedade do grupo:
A propriedade associativa da combinação deve ser válida
A(BC) = (AB)C.
Exemplo:
C3(v v) = (C3v )v
Matrizes
Informações importantes sobre os aspectos de simetria dos grupos de pontos estão resumidas nas tabelas de caracteres, descritas anteriormente.
Para entender a construção e a utilização das tabelas de caracteres, deve-se considerar as propriedades das matrizes, que são a base para as tabelas.
Uma matriz é um arranjo ordenado de números, tais como:
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Para multiplicar as matrizes, o número de colunas verticais da primeira matriz deve ser igual ao número de linhas horizontais da segunda matriz.
Para encontrar o produto, adicionar, termo a termo, os produtos de cada linha
da primeira matriz para cada coluna da segunda (cada termo em uma linha deve ser multiplicado pelo seu termo correspondente na coluna apropriada da segunda matriz).
http://www.somatematica.com.br/emedio/matrizes/matrizes4.php
B.A
=
Representação de Grupo de Pontos
Operação de simetria: representação de grupo de pontos
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Consideremos como as operações de simetria do grupo de pontos C2v transformam um
conjunto de coordenadas x, y e z.
A molécula de água possui simetria C2v.
Tem um eixo C2 através do oxigênio e no plano da molécula, sem eixos C2 perpendiculares e nenhum plano especular horizontal.
Mas possui dois planos especulares verticais.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
O eixo z é geralmente escolhido como o eixo de simetria de rotação mais para H2O, este é o eixo
único de rotação.
Os outros eixos são arbitrários.
Usaremos o plano xz (v) como o plano da molécula
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Esse conjunto de eixos é escolhido para obedecer a regra da mão direita (o polegar e os dois primeiros
dedos da mão direita ficam perpendicularmente uns aos outros e são denominados x, y e z, respectivamente).
Exemplo: H
2O
Cada operação de simetria pode ser expressa como uma matriz de transformação:
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Exemplo: H2O
As novas coordenadas dadas por:
Matriz de transformação para C2
C2: Gire um ponto com coordenadas (x, y, z) sobre o eixo C2(z).
Ex: considere como as matrizes de transformação podem ser usadas representar as operações da simetria do grupo de pontos C2v
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
v (xz): Refletir um ponto com coordenadas (x, y, z) no plano xz.
Matriz de Transformação para v (xz)
A equação da matriz é:
após v (xz) Coordenadas
do Sistema
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Coordenadas do Sistema
C2 v (xz) v (yz)
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Matrizes de transformação para as quatro operações de simetria do grupo C2v
Este conjunto de matrizes é chamado
“Matriz Representação”,
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Matrizes de transformação para as quatro operações de simetria do grupo C2v
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Esta representação é um conjunto de matrizes, cada qual correspondendo a uma operação no grupo.
Essas matrizes se combinam da mesma forma que as operações em si.
Conjunto de matrizes chamado Matrizes de
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Por exemplo, multiplicar duas das matrizes é equivalente
à realização das duas operações correspondentes e resulta em uma matriz que transforma diretamente as coordenadas, como faz a combinação de operações de simetria.
Lembrando que as operações são realizadas da esquerda para direita
Assim C2 x v (xz) significa aplicar um v seguido de C2
Conjunto de matrizes chamado Matrizes de
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
C2 x v (xz) significa v seguido de C2
Conjunto de matrizes chamado Matrizes de
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Conjunto de matrizes chamado Matrizes de
Representação do grupo C2v
Coordenadas do Sistema
C2 v (xz) v (yz)
As matrizes da matriz
representação do grupo C2v
descrevem as demais operações do Grupo.
As operações C2 e v (yz) trocam H1 e H2, enquanto E e v (xz) deixam
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Caracteres
O caractere, definido apenas para uma matriz quadrada, é o traço da matriz, ou a soma dos números na diagonal da parte superior esquerda para a inferior direita.
Para o eixo C2 do grupo de pontos C2v temos o caractere -1, obtido da seguinte forma:
(-1) + (-1) + (+1) = -1
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Para o grupo de pontos C2v os
seguintes caracteres são obtidos a partir das matrizes ao lado:
Esse conjunto de caracteres também forma uma representação, uma versão abreviada da Matriz Representação.
Essa representação é chamada de representação redutível, uma combinação de representações irredutíveis mais fundamentais.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Representações Redutíveis e Irredutíveis
Cada matriz de transformação no conjunto C2v pode ser "diagonalizada em bloco“
Assim, podem ser dividida em matrizes menores na diagonal, com todos os outros elementos da matriz iguais a zero.
Todos os elementos diferentes de zero se tornam matrizes 1 x 1 ao longo da diagonal principal.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Quando as matrizes são diagonalizadas em bloco desta forma, as coordenadas x, y e z também são diagonalizadas em bloco.
Como resultado, as coordenadas x, y e z são‘ independentes umas das outras.
Os elementos de matriz nas posições 1,1 (numerados como linha e coluna) descrevem os resultados das operações de simetria na coordenada x
Da mesma forma 2,2 para y e 3,3 para z. Com estes valores montamos a seguinte tabela.
x
y
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
x
y
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Os quatro elementos para x formam uma representação do grupo, aqueles para y
formam uma segunda representação e os para z uma terceira representação.
Essas representações irredutíveis do grupo de pontos C2v adiciona elementos para compor a representação redutível .
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Os caracteres dessas três representações irredutíveis somados em cada operação (coluna) compõem os caracteres da representação redutível .
Da mesma forma a combinação de todas as matrizes para as coordenadas x, y e z compõem as matrizes da representação redutível.
Por exemplo, a soma dos três
caracteres para x, y e z, no âmbito da operação C2, é -1, o caractere para
sob essa mesma operação.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
O conjunto de matrizes 3 x 3 obtidas para H2O é chamado de matriz representação redutível, porque é a soma das representações irredutíveis (as matrizes 1 x 1
diagonalizadas em bloco), que não podem ser reduzidas a componentes menores.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
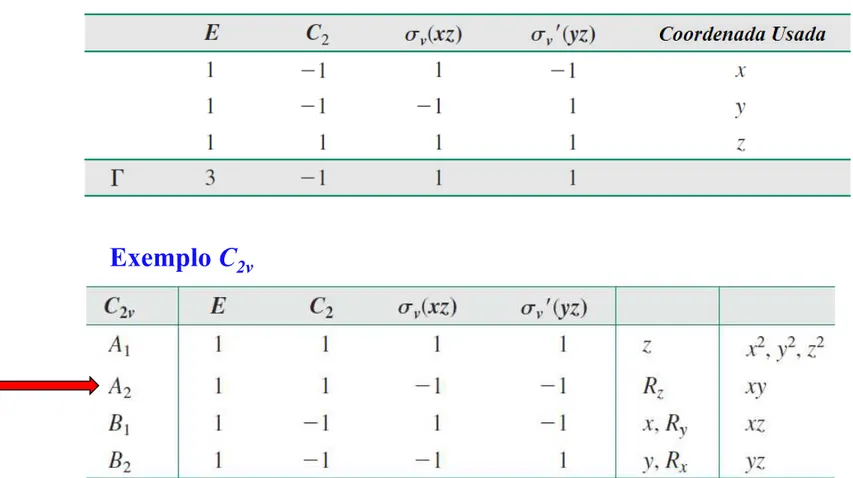
Tabela de Caracteres
Três das representações para C2v denominadas A1, B1 e B2, já foram determinadas.
A quarta, chamada A2, pode ser encontrada usando-se as propriedades de grupo descritas à seguir.
Algumas destas propriedades foram vistas anteriormente, sem a ênfase de matrizes.
Um conjunto completo de representações irredutíveis para um grupo de pontos é chamado de tabela de caracteres para esse grupo.
A tabela de caracteres para cada grupo de pontos é exclusiva; as tabelas de caracteres para grupos de pontos comuns se encontram na literatura.
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Tabela de Caracteres
Três das representações para C2v denominadas A1, B1 e B2, já foram determinadas.
A quarta, chamada A2, pode ser encontrada usando-se as propriedades de grupo descritas à seguir.
Exemplo C2v
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Propriedades de caracteres das representações irredutíveis em grupos de pontos
Propriedade 1
O número total de operações de simetria no grupo é chamado de ordem do grupo (h).
Para determinar a ordem de um grupo, simplesmente some o número total de operações de simetria, enumeradas na linha superior da tabela de caracteres.
Exemplo C2v
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Propriedade 2
As operações de simetria são organizadas em classes.
Todas as operações em uma classe têm caracteres idênticos aos de suas matrizes de transformação e são agrupadas na mesma coluna nas tabelas dos caracteres.
Exemplo C2v
Cada operação de simetria está em uma classe separada; por conseguinte, há quatro colunas na tabela de caracteres
Matriz de Transformação
para C2
4 classes
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Propriedades de caracteres das representações irredutíveis em grupos de pontos
Propriedade 3
O número de representações irredutíveis é igual ao número de classes.
Assim as tabelas de caracteres têm o mesmo número de linhas e colunas (são quadradas).
Exemplo C2v
Quatro operações de simetria
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Propriedades de caracteres das representações irredutíveis em grupos de pontos
Propriedade 4
A soma dos quadrados das dimensões (caracteres E) de cada uma das representações irredutíveis é igual à ordem do grupo
Exemplo C2v
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Propriedades de caracteres das representações irredutíveis em grupos de pontos
Propriedade 5
Para qualquer representação irredutível, a soma dos quadrados dos caracteres multiplicada pelo número de operações na classe é igual à ordem do grupo
Exemplo C2v
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Propriedades de caracteres das representações irredutíveis em grupos de pontos
Propriedade 6
Representações irredutíveis são ortogonais entre si.
A soma dos produtos dos caracteres, multiplicados juntos para cada classe, para qualquer par de representações irredutíveis é zero.
Exemplo C2v
B1 e B2 são ortogonais
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Propriedades de caracteres das representações irredutíveis em grupos de pontos
Propriedade 7
Todos os grupos incluem uma representação totalmente simétrica, com caracteres 1 para todas as operações.
Exemplo C2v
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
Os marcadores usados com as tabelas de caracteres são
x, y, z transformações das coordenadas x, y, z ou combinações
Rx, Ry, Rz rotação sobre os eixos x, y e z
R qualquer operação de simetria, como C2 ou v (xz)
o caractere de uma operação
i e j designação de representações diferentes, como A1 ou A2
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
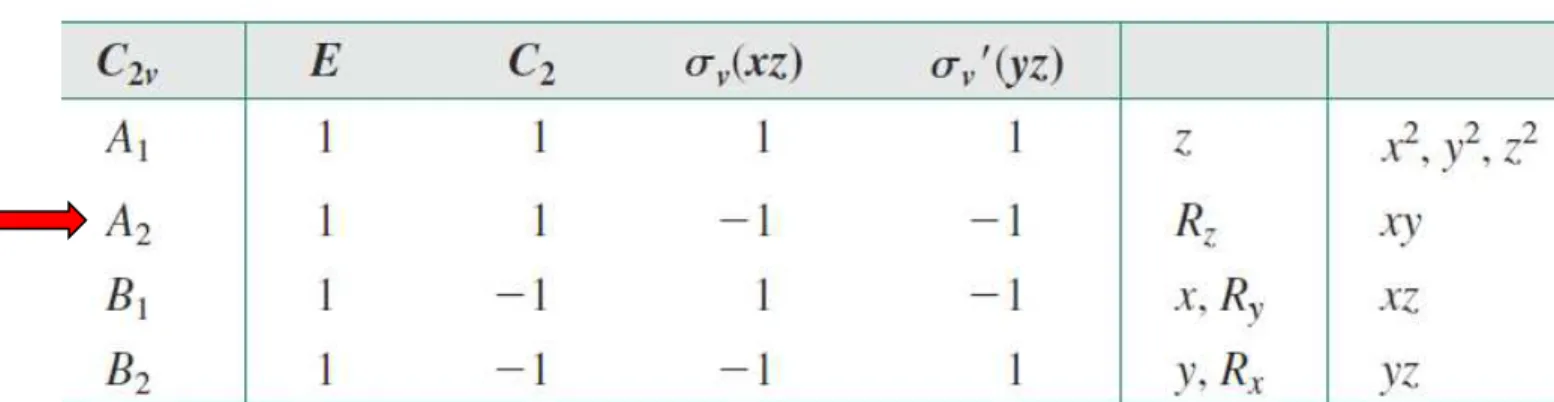
A representação de A2 do grupo C2v agora pode ser explicada.
A tabela de caracteres tem quatro colunas; tem quatro classes de operações de simetria (Propriedade 2).
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
A representação de A2 do grupo C2v agora pode ser explicada.
A tabela de caracteres quatro colunas; tem quatro classes de operações de simetria (Propriedade 2).
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
A representação A2 do grupo C2v agora pode ser explicada.
A tabela de caracteres quatro colunas; tem quatro classes de operações de simetria (Propriedade 2).
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
A soma dos produtos dos caracteres de quaisquer duas representações deve ser igual a zero (ortogonalidade, Propriedade 6).
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
A soma dos produtos dos caracteres de qualquer duas representações deve ser igual a zero (ortogonalidade, Propriedade 6).
Para a igualdade ser zero, um produto de A1 e a representação desconhecida (neste caso A2) deve ter o valor 1 para dois dos caracteres (E e C2) e -1 para os outros dois [v (xz) e v (yz)].
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
O caractere para a operação de identidade E desta nova representação deve ser 1 [(E) = 1] para que a soma dos quadrados desses caracteres seja igual a 4 (exigido pela Propriedade 4).
Propriedade 4
A tabela de caracteres completa para C2v com as representações irredutíveis na ordem comumente usada, é
Como duas representações não podem ser idênticas, A2 deve ter (E) = (C2) = 1
e (xz) = (yz) = -1. Essa representação também é ortogonal a B1 e B2 , como exigido.
Propriedade 4
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Fluxograma de
Fluxograma de representação: H2O (C2v)
Operações de simetria
Matriz de representações redutíveis
Matriz de caracteres de representações
Representações irredutíveis
Tabela de caracteres
R. S. Mulliken, J. Chem. Phys., 1955, 23, 1997; 1956, 24, 1118
Satisfactory standardization of notation for diatomic molecules and their spectra already exists. The problem of standardization for polyatomic molecules is
much more complicated, because of the greater number of degrees of freedom for rotation and vibration, and because of the considerable variety of types of symmetry, or symmetry groups, to which polyatomic molecules belong, as contrasted with only two types (Cv and Dh) for diatomic molecules
R. S. Mulliken, J. Chem. Phys., 1955, 23, 1997; 1956, 24, 1118
As representações irredutíveis recebem rótulos de acordo com as seguintes regras, nas quais o termo simétrico significa um caractere de 1 e assimétrico de -1
a) as letras são atribuídas de acordo com a dimensão da representação irredutível (o caractere para a operação de identidade).
Dimensão Rótulo de Simetria
1 A se a representação for simétrica à
operação de rotação principal ((Cn) = 1)
B se a representação for assimétrica à
operação de rotação principal ((Cn) = -1) obs.
2 E
3 T
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 5ª Ed.
Algumas informações extras sobre as tabelas de caracteres
Obs: em alguns casos, como Dnd (n = par) e S2n, o eixo de maior ordem é um S2n. Esse eixo tem
Dimensão Rótulo de Simetria
1 A se a representação for simétrica à
operação de rotação principal ((Cn) = 1)
B se a representação for assimétrica à
operação de rotação principal ((Cn) = -1) obs.
2 E
3 T
G. Miesler, P. Fischer e D. Tarr, Quimica Inorgânica, 4ª Ed., p.98-100
Algumas informações extras sobre as tabelas de caracteres
b) 1 subscrito indica uma representação simétrica para um eixo de rotação C2
perpendicular ao eixo principal, e 2 subscrito indica uma representação
assimétrica para o C2.
c) g subscrito (gerade) indica representações simétricas para inversão, e u subscrito
(ungerade) indica representações assimétricas para inversão.
d) Apóstrofos únicos são simétricos para h e apóstrofos duplos são assimétricos
Aplicações da simetria
As aplicações importantes da simetria em química inorgânica incluem a construção e a classificação dos orbitais moleculares e a interpretação dos dados espectroscópicos usados na determinação das estruturas.
Entretanto, há várias aplicações mais simples, sendo uma o uso da teoria de grupo para decidir se uma molécula é polar ou quiral.
Em muitos casos, a resposta pode ser óbvia e não precisamos usar a teoria de grupo.
Moléculas polares
Uma molécula polar é uma molécula que tem um momento de dipolo elétrico
permanente.
Uma molécula não pode ser polar se ela possuir um centro de inversão.
A inversão implica que uma molécula tem distribuição de carga idêntica em todos os pontos opostos diametralmente ao centro, o que elimina a possibilidade de um momento de dipolo.
Pela mesma razão, um momento de dipolo não pode encontrar-se perpendicular a qualquer plano de reflexão ou eixo de rotação que a molécula possua.
Por exemplo, um plano de reflexão obriga a existência de átomos idênticos nos dois lados do plano, de forma que não pode haver momento de dipolo através do plano.
Da mesma forma, a existência de um eixo de simetria implica a presença de átomos idênticos nos pontos relacionados pela rotação correspondente, o que elimina a
Em resumo:
1) Uma molécula não pode ser polar se ela tiver um centro de inversão.
2) Uma molécula não pode ter um momento de dipolo elétrico perpendicular a qualquer plano de reflexão.
Moleculas quirais
Uma molécula não pode ser quiral se ela possuir um eixo de rotação impróprio
.
Uma molécula quiral (termo grego para "mão") é uma molécula que não pode ser sobreposta sobre a sua própria imagem de reflexão.
A mão é quiral no sentido de que a imagem de reflexão da mão esquerda é a mão direita, e as duas mãos não podem ser sobrepostas.
Uma molécula quiral e sua imagem de reflexão são chamadas de enantiômeros (termo grego para "ambos").
Pares enantioméricos de moléculas giram o plano de polarização da luz de quantidades iguais em direções opostas.
Uma molécula quiral não pode possuir um eixo de rotação impróprio,
S
n.Um plano de reflexão é um eixo de rotação impróprio
S
1 e um centro de inversão e equivalente a um eixoS
2.
Portanto, moléculas com um plano de reflexão ou um centro de inversão possuem eixos de rotação impróprios e não podem ser quirais.
S
4S
1Grupos nos quais o Sn está presente incluem Dnh (o qual inclui Sn), Dnd e alguns dos grupos cúbicos (especificamente, Td e Oh).
Portanto, moléculas tais como CH4 ou Ni(CO)4, que pertencem ao grupo Td,
não são quirais.
Dizer que um átomo de carbono "tetraédrico" leva à atividade óptica (como no CHClFBr) serve para lembrar que a teoria de grupo é mais na sua terminologia do que a designação casual.
Desta forma, a CHBrClF pertence ao grupo C1, não ao grupo Td.
Quando avaliamos a quiralidade, é importante estar alerta para os eixos de rotação impróprios que podem não ser imediatamente aparentes.
Moléculas sem um plano de reflexão ao centro de inversão (e, portanto, sem eixos S1 ou S2) são geralmente quirais, mas importante verificar se um eixo de rotação impróprio de ordem superior também não está presente.
Por exemplo, o íon de amônio
Espectroscopia Vibracional
Catherine Housecroft, Química Inorgânica, 4ª Ed.
As espectroscopias no infravermelho (IV) e são ramos da espectroscopia vibracional. Para ambas é importante saber:
Quais são os possíveis modos vibracionais para algumas moléculas simples?
Esses modos são ativos no infravermelho (IV) e/ou no Raman? (isto é, se as absorções correspondentes aos modos vibracionais são observadas nos espectros de IV e/ou de Raman).
Como podemos relacionar os modos vibracionais de uma molécula à sua simetria pelo uso da tabela de caracteres?
Quantos modos vibracionais existem para uma dada espécie molecular?
http://fptchlx02.tu-graz.ac.at/quanten/qmmodenE.html
"Grau de liberdade" significa um modo único de uma molécula para aumentar sua energia cinética.
Existem graus de liberdade de translação, de rotação e de vibração.
Cada molécula tem 3N graus de liberdade, onde N é o número de átomos nesta molécula.
http://fptchlx02.tu-graz.ac.at/quanten/qmmodenE.html
Uma molécula, por exemplo, tem três graus (tipos) de translação, correspondendo às três dimensões no espaço.
Se a molécula se dissocia, cada um dos fragmentos pode mover-se independentemente, de modo que cada um dos fragmentos tem três graus de translação.
Se houver dois fragmentos, a soma dos graus de liberdade de translação é seis.
Do mesmo modo, o número total de graus de liberdade de rotação irá mudar, e o número total de graus de liberdade vibracionais tem de diminuir para manter a soma total de 3N constante.
http://fptchlx02.tu-graz.ac.at/quanten/qmmodenE.html
A soma de 3N graus de liberdade é fácil de entender: se a molécula se dissocia completamente em N átomos individuais, cada um desses átomos tem três graus de liberdade para a
translação, mas nenhuma chance de executar rotações ou vibrações, uma vez que esses movimentos requerem ligações químicas entre os átomos.
O número total de 3N graus de liberdade se decompõe da seguinte forma:
Moléculas não lineares têm
3 graus de liberdade de translação, 3 graus de liberdade de rotação, e 3N-6 graus de liberdade de vibração;
Moléculas lineares têm
3 graus de liberdade de translação, 2 graus de liberdade de rotação, e 3N-5 graus de liberdade de vibração.
http://fptchlx02.tu-graz.ac.at/quanten/qmmodenE.html
Ex. do CO
2Molécula linear (D∞h) com quatro modos normais de vibração.
Catherine Housecroft, Química Inorgânica, 4ª Ed.
(a) o átomo de carbono permanece estacionário. As vibrações (a) e (d) são modos de estiramento.
O modo de flexão (ou deformação) (b) ocorre no plano do papel
A flexão (ou deformação) (c) ocorre em um plano perpendicular ao do papel. Os sinais + indicam movimento na direção do leitor.
Exercícios propostos
1. Utilizando o modelo RPECV como ajuda, desenhe as estruturas do CF4, XeF4 e SF4. Identifique o grupo de pontos de cada molécula. Mostre que o número de graus de liberdade vibracional é independente da simetria molecular.
Exercícios propostos
1. Utilizando o modelo RPECV como ajuda, desenhe as estruturas do CF4, XeF4 e SF4. Identifique o grupo de pontos de cada molécula. Mostre que o número de graus de liberdade vibracional é independente da simetria molecular.
[Resp. : Td,; D4h ; C2v]
Exercícios propostos
2. Por que o CO2 e o SO2 têm um número diferente de graus de liberdade vibracionaI?
Exercícios propostos
3. Quantos graus de liberdade vibracional cada um dos seguintes possui: SiCl4, BrF3, POCl3?
Exercícios propostos
3. Quantos graus de liberdade vibracional cada um dos seguintes possui: SiCl4, BrF3, POCl3?
[Resp.: 9; 6; 9]
Regras de seleção para um modo de vibração ativo no infravermelho ou Raman
Infravermelho
Nem todos os modos de vibração de uma molécula particular dão origem a bandas de absorção observáveis no IV.
Regra de seleção:
Para um modo vibracional ser ativo no infravermelho (IV), ele tem que dar origem a uma variação no momento de dipolo elétrico molecular.
Raman:
Regra de seleção:
Para um modo vibracional ser ativo no Raman, ele tem que dar origem a uma variação na polarizabilidade da molécula.
Polarizabilidade é a facilidade com que é distorcida a nuvem eletrônica associada à molécula.
Moléculas com um centro de simetria (por exemplo, o CO2 linear e o SF6 octaédrico) estão sujeitas à regra de exclusão mútua.
Para moléculas centros simétricas, a regra de exclusão mútua afirma que vibrações que são ativas no IV são inativas no Raman, e vice-versa.
IV e Raman
Portanto a presença de um centro de simetria em uma molécula é facilmente determinada por comparação de seus espectros IV e Raman.
Daremos ênfase no estudo das absorções fundamentais, sendo essas os aspectos dominantes dos espectros de IV
Moléculas triatômicas lineares (D∞h ou C∞v) e angulares (C2v)
CO2 como exemplo para ilustrar o efeito da simetria molecular nos momentos de dipolo molecular, e, dessa forma, nos modos de vibração ativos no infravermelho
Molécula linear, as duas distâncias de ligação C-O são iguais (116 pm)
A molécula é descrita como "simétrica". Rigorosamente, o CO2 possui simetria D∞he portanto é apolar.
Número de graus de liberdade vibracionais para o CO2 = 3n – 5 = 9 - 5
Estiramento assimétrico e a flexão levam a variação do momento de dipolo com o raio (gerado de modo transiente assim que ocorre a vibração)
Estiramento simétrico não leva a variação do momento de dipolo com o raio
Ex. do SO
2Molécula angular (C2v).
Número de graus de liberdade vibracionais para o SO2 = 3n – 6 = 9 - 6
Os três modos de vibração são compostos de dois modos de estiramento (simétrico e assimétrico) e um modo de flexão.
Os três modos normais de vibração do SO2 dão, todos eles, origem a uma variação do momento de dipolo molecular e são, portanto, ativos no IV
Uma comparação desses resultados para o CO2 e o SO2 ilustra que a espectroscopia vibracional pode ser empregada para determinar se uma espécie X3 ou XY2 é linear ou angular.
As moléculas lineares do tipo geral XYZ (OCS ou o HCN) possuem simetria C∞v
Seus espectros no IV tem quatro modos vibracionais, que aparecem com três absorções; os modos de estiramento simétrico, estiramento assimétrico e flexão (dois degenerados) são todos ativos no IV
As absorções observadas no espectro IV podem ser atribuídas ao estiramento X-Y, ao estiramento Y- Z e à flexão XYZ.
Por exemplo, as absorções em 3311, 2097 e 712 cm-1 no espectro IV do HCN são atribuídas ao estiramento H-C, ao estiramento C=N e à flexão HCN,
respectivamente.
Um modo de estiramento é representado pelo símbolo , enquanto uma flexão (deformação) é denotada por .
Exercício - Espectros no infravermelho de moléculas triatômicas
Exercício - Espectros no infravermelho de moléculas triatômicas
O espectro no IV do SnCl2 exibe absorções em 352, 334 e 120 cm-1. Que forma esses dados sugerem para a molécula, e esse resultado é consistente com o modelo RPECV?
Para o SnCl2 linear (D∞h), o estiramento assimétrico e a flexão são ativos no IV, mas o estiramento simétrico é inativo no IV (não ocorre variação do momento de dipolo
molecular).
Para o SnCl2 angular, (C2v) os modos de estiramento simétrico, estiramento assimétrico e de geometria em tesoura são todos ativos no IV
Eixo z coincide com o eixo C2, e a molécula se localiza no plano yz.
Moléculas angulares XY2: utilizando a tabela de caracteres de C2v
A molécula de SO2 pertence ao grupo de pontos C2v
Vamos olhar novamente os três modos normais de vibração do SO2, mas, desta vez, usaremos a tabela de caracteres de C2v para determinar:
• se os modos de vibração envolvem estiramento ou flexão; • os identificadores de simetria dos modos vibracionais; • que modos de vibração são ativos no IV e/ou no Raman.
Vibrações que envolvem estiramento de ligação no SO2.
Quantas ligações são deixadas inalteradas por cada operação de simetria?
Operador E e reflexão através do plano v (yz) deixa ambas as ligações S-O inalteradas.
Rotação em torno do eixo C2 e reflexão através do plano v (xz)
afeta ambas as ligações.
Esses resultados podem ser resumidos na linha de caracteres apresentados a seguir.
2 - "duas ligações inalteradas“ 0 - "sem ligações inalteradas".
Trata-se de uma representação redutível e pode ser reescrita na forma do somatório das linhas de caracteres a partir da tabela de caracteres de C2v
A inspeção da tabela de caracteres revela que o somatório das duas linhas de
Trata-se de uma representação redutível e pode ser reescrita na forma do somatório das linhas de caracteres a partir da tabela de caracteres de C2v
A inspeção da tabela de caracteres revela que o somatório das duas linhas de
caracteres para as representações A1 e B2 corresponde ao resultado da representação redutível acima.
Este resultado nos diz que há dois modos de estiramento não degenerados, um de simetria A1 e um de simetria B2.
Para uma molécula angular XY2, trata-se simplesmente de relacionar esses
identificadores a representações esquemáticas dos modos de estiramento, pois só pode haver duas opções: estiramento de ligações em fase ou fora de fase.
Para atribuir um identificador de simetria a cada modo vibracional, temos que considerar o efeito que cada operação de simetria do grupo de pontos C2v tem nesses vetores.
Para o estiramento simétrico (1) da molécula de SO2 os vetores são deixados inalterados pelo operador E e pela rotação em torno do eixo C2.
Também não há nenhuma variação dos vetores quando a molécula é refletida através do plano v (xz) ou v (yz) .
Se utilizarmos a notação de que "1“ significa "sem variação", então, os
resultados podem ser resumidos como mostrado.
Para atribuir um identificador de simetria a cada modo vibracional, temos que
considerar o efeito que cada operação de simetria do grupo de pontos C2v tem
nesses vetores.
Para o estiramento simétrico (1) da molécula de SO2 os vetores são deixados inalterados pelo operador E e pela rotação em torno do eixo C2.
Também não há nenhuma variação dos vetores quando a molécula é refletida através do plano v (xz) ou v (yz) .
Se utilizarmos a notação de que "1“ significa "sem variação", então, os
resultados podem ser resumidos como mostrado
acima
.Há uma correspondência com a linha para o tipo de simetria A1, e, dessa
maneira, o estiramento simétrico recebe o identificador de simetria A1.
1
2
3Agora consideramos o modo de estiramento assimétrico (3)
Os vetores ficam inalterados pelas operações de E e de v (yz), mas suas direções são alteradas pela rotação em torno do eixo C2 e pela reflexão através do plano v (xz)
Usando a notação de que "1" significa "sem variação", e "- 1" significa "uma
Isso corresponde ao tipo de
simetria B2 na tabela de caracteres de C2v, e, assim, o modo de
SO2 tem um total de (3n - 6) = 3 graus de liberdade vibracional.
Dois deles forma associados aos modos de estiramento.
O terceiro deve surgir de um modo de flexão (ou geometria em tesoura).
O modo de flexão (2) ) pode ser definido em termos de variações do ângulo da ligação O-S-O.
Para atribuir um identificador de simetria a esse modo de vibração, consideramos o efeito que cada operação de simetria do grupo de pontos C2v tem sobre o ângulo de ligação.
Cada uma das operações de E, C2 , v (xz), v (yz) deixa o ângulo inalterado e, portanto, podemos escrever:
1
2
3Isso nos permite atribuir simetria A1
Como podemos usar uma tabela de caracteres para determinar se um modo particular de vibração é ativo no IV ou no Raman?
Não vamos detalhar as origens desses termos, mas nos concentrar unicamente nas informações que eles fornecem:
Se o identificador de simetria (por exemplo, A1, B1, E) de um modo normal de
vibração está associado a x, y ou z na tabela de caracteres, então, o modo é ativo no IV.
A molécula de SO2 tem modos normais A1 e B2 de vibração.
Na tabela de caracteres de C2v, as colunas da direita para a representação A1 contêm funções z e também x2, y2, z2.
Dessa maneira, os modos A1 são ativos tanto no IV quanto no Raman.
De modo semelhante, as colunas da direita para a representação B2 contêm funções y e
A molécula triatômica angular mais comum é a H2O .
SO2 e H2O pertencem ao grupo de pontos C2v e possuem três modos de vibração, todos eles ativos no IV e no Raman.
Espectros de IV calculado da H2O em fase gás e IV de amostra real em fase líquida
H
2O
(g)Espectro de IV CALCULADO da H2O em fase gás. (Um espectro experimental também mostraria estrutura fina rotacional.)
Espectro de IV da água líquida
É largo e as duas absorções em torno de 3700 cm-1 não são resolvidas. O alargamento surge da presença de ligação hidrogênio entre as moléculas de água.
Além disso, os números de onda vibracional nos espectros na fase líquida e gás são deslocados um em relação ao outro.
H
2O
(g)Os orbitais moleculares de moléculas poliatômicas diatômicas e lineares são classificados como , , e assim por diante.
Esta notação se refere as simetrias dos orbitais em relação às rotações em torno do eixo principal da molécula (eixo internuclear).
As mesmas designações podem ser usadas para especificar os orbitais de moléculas poliatômicas nao-lineares, observando-se a simetria local com relação ao eixo de uma dada ligação.
Assim podemos falar, por exemplo, de orbitais e em moléculas mais
complexas, tais como o benzeno.
Um orbital não muda de sinal sob uma rotação através de qualquer ângulo em torno do eixo
internuclear.
Os rótulos e são baseados na simetria rotacional dos orbitais em relação a um eixo internuclear.
Os rótulos mais elaborados a, a1, e, eg que são usados para designar orbitais
moleculares em moléculas não-lineares, são baseados no comportamento dos orbitais submetidos a todas as operações de simetria do grupo de pontos em questão.
O rótulo é atribuído consultando-se a tabela de caracteres do grupo, uma tabela que lista os diferentes tipos de simetria possíveis para um grupo de pontos.