I would like to thank my two PhD supervisors, Jacqueline Cherfils and Mahel Zeghouf, for their welcome in the laboratory, for their support during these four years, for their advice, for the trust they had in me, for all the productive scientific discussions. Thank you for your help, your patience and for all those nights at the synchrotron. I would like to thank all the members of team 10, Julie, Mélanie, Aline, Philippe, Annélie and Paola our sweet neighbors.
To Lydia, my compatriot, that you are, and for all the good times we had in the lab and during our trips to Paris. Many thanks to Corine and Tracy, for all the M9 media you have created for me and everyone else. Véronique, for all the BRAG2 constructs and mutants you made for me and our musical discussions.
Jozsef, for your kindness and for all the interesting museums we visited with the girls.
Des interrupteurs moléculaires de la signalisation cellulaire
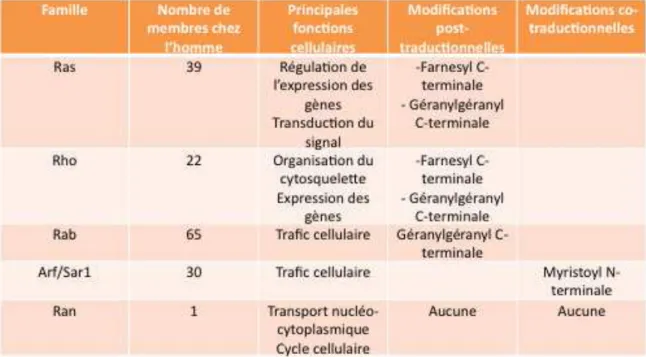
Les petites protéines G (pour protéines de liaison au GTP) existent dans trois branches principales de la vie, avec une proportion élevée chez les eucaryotes. Dans les années 1980, ces protéines virales se sont révélées être des protéines monomères d’un poids moléculaire de 20 à 30 kDa qui se lient aux nucléotides GDP et GTP et ont des fonctions de signalisation médiées par ces nucléotides (Shih et al. 1980). Cela a été suivi par la découverte d'un gène homologue de Ras, Rho, chez Aplysia en 1985 (Madaule et Axel 1985) et la découverte de nombreuses autres petites protéines G (pour revue (Takai et al. 2001)).
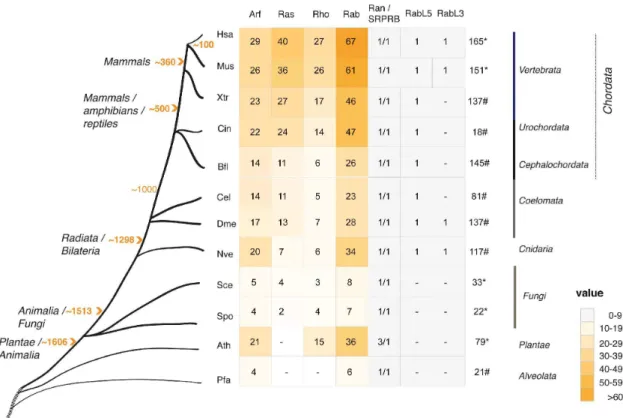
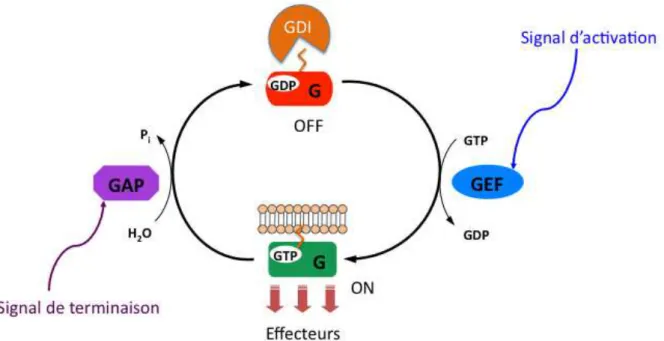
À ce jour, les petites protéines G ont été structurellement et fonctionnellement classées en cinq familles : les familles Ras, Rho, Rab, Sar1/Arf et Ran et constituent une superfamille comprenant 167 membres chez l'homme, dont 10 non classés (pour revue ( Rojas et al. 2012) (Tableau 1). Switches moléculaires de la signalisation cellulaire Les petites protéines G sont souvent décrites comme des switchs moléculaires. L'hydrolyse du GTP par les petites protéines G s'effectue à son tour à l'aide de régulateurs appelés GAP (GTPase-activating proteins) qu'elles favoriser une hydrolyse intrinsèque très lente du GTP (Figure 2).
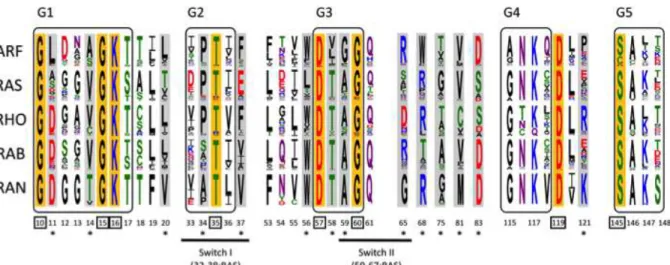
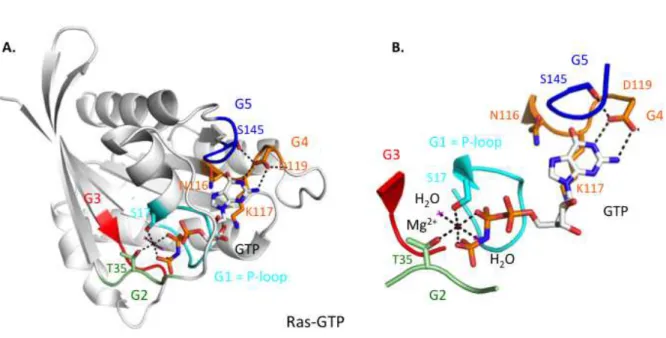
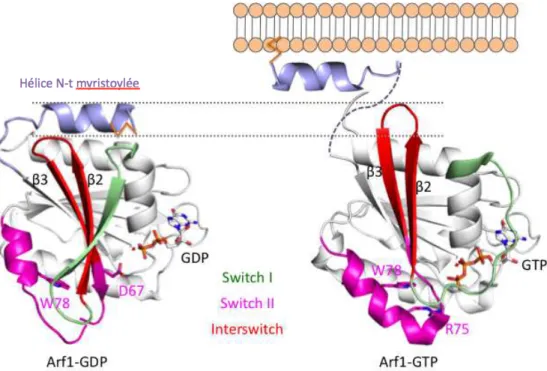
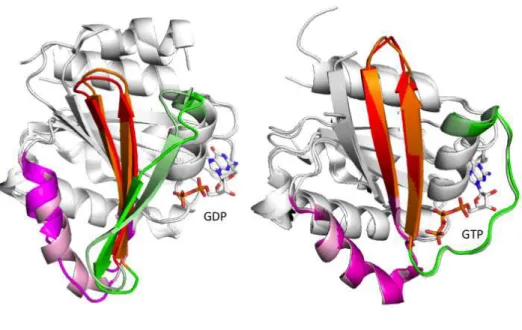
Les régions Switch 1 et/ou Switch 2 sont impliquées dans la plupart, sinon la totalité, des interactions que les petites protéines G établissent avec leurs partenaires cellulaires.
Switch structuraux
Les ArfGEFs!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! "1 !
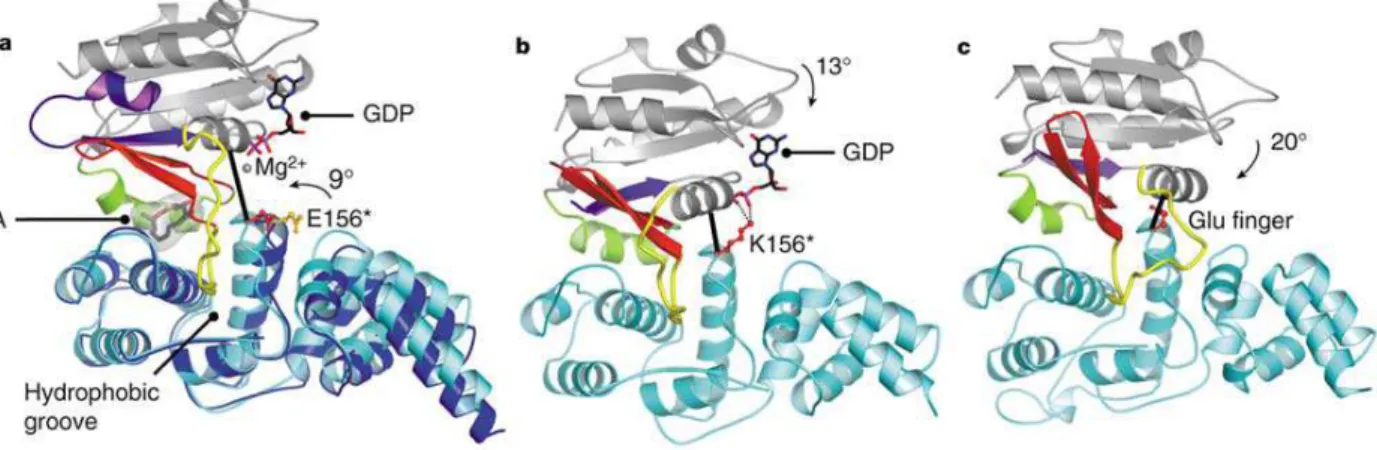
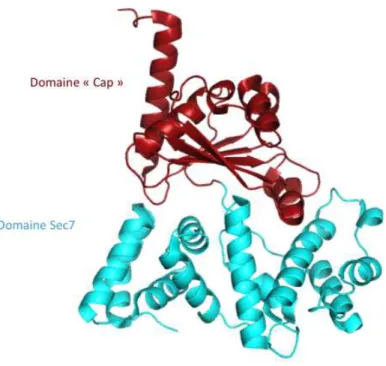
De plus, ce domaine Sec7 est une cible de la toxine fongique Brefeldin A (BFA), un médicament qui inhibe la sécrétion en inhibant l'activation d'Arf1 (Misumi et al. 1986) (voir § III.E.1). Inhibition du retournement d'interswitch par BFA dans le complexe Arf1-GDP-Mg2+/BFA/ARNO, avec ARNO non lié en bleu foncé superposé par son extrémité C-terminale. Inhibition de la dissociation du PIB par mutation du doigt catalytique dans le complexe de pré-dissociation (17 $) Arf1- GDP/ARNOE156K.
La réaction d'échange, stimulée par les GEF, est initiée par la formation d'un complexe de faible affinité entre la forme GDP de la protéine G et le GEF, qui est converti en un complexe nucléotidique vide de haute affinité lors de la dissociation du GDP- de. L'entrée d'excès de GTP dans la cellule entraîne la dissociation du GEF et de la forme active de la protéine G. Le « doigt catalytique » du domaine Sec7 va alors déplacer le GDP par répulsion de charge (Renault et al. 2003), avant le vide. Le site nucléotidique est stabilisé par un pont salin qu'il forme avec la lysine invariante du cycle de la protéine G P (Mossessova et al. 1998).
Ce mécanisme sophistiqué, dans lequel les membranes agissent comme cofacteurs de la réaction d'échange, garantit que la forme active Arf-GTP est fortement attachée aux membranes où elle peut remplir ses fonctions dans le trafic cellulaire.
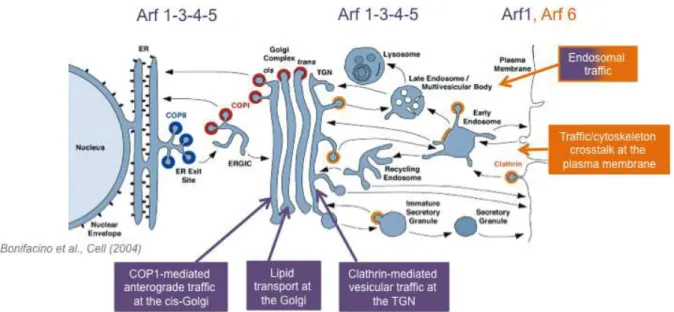
Organisation et fonctions cellulaires des ArfsGEFs
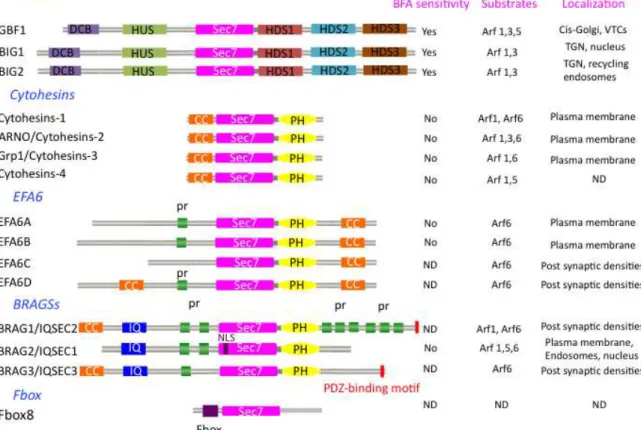
Le domaine PH des cytohésines est également impliqué dans un mécanisme d'autoinhibition de leur domaine Sec7 (DiNitto et al. 2007) (voir plus loin § III.D). De plus, il a été démontré que BIG1 interagit avec un membre de la famille des kinésines 21A (KIF21A), jouant ainsi un rôle dans le processus de transport cellulaire (Shen et al. 2008). Chez les mammifères, la famille EFA6 comprend quatre protéines d'épissage alternatives : EFA6A, EFA6B, EFA6C et EFA6D (Derrien et al. 2002).
Ceci est cohérent avec le fait que l'EFA6 est principalement localisé dans la membrane plasmique ((Macia et al. 2008); (Derrien et al. 2002)). En effet, l'EFA6A est principalement exprimé dans le cerveau, avec des transcrits mineurs exprimés dans les tissus intestinaux (Derrien et al. 2002). En effet, EFA6A et EFA6D coprécipitent avec des marqueurs de densité postsynaptique, suggérant qu'ils sont concentrés dans les synapses ( Sakagami et al. 2006 ).
Ce mécanisme n'est pas encore bien compris, mais ne dépend pas de l'activité d'échange et nécessite plutôt la bobine enroulée C-terminale ( Derrien et al. 2002 ).
Régulation des ArfGEFs
Actuellement, une auto-inhibition a été décrite pour la famille des cytohésines dans les ArfGEF (DiNitto et al. 2007). Une fois que le PH est attaché à la membrane, un mouvement de la région auto-inhibitrice s'ensuit (Stalder et al. 2011). De plus, des tests fonctionnels indiquent que LM11 inhibe l'activation des Arfs de classes I et II, mais pas Arf6 (Viaud et al. 2007).
D'autres inhibiteurs, découverts par criblage phénotypique (Exo2, GolgicideA et LG186) ont été initialement testés sur de grands ArfGEF, mais également sur ARNO et BRAG2 (Boal et al. 2010). Il a un léger effet sur l'activité de BIG1 in vitro, alors qu'il n'a aucun effet significatif sur ARNO et un faible effet sur BRAG2 (Boal et al. 2010). Cette molécule se lie au domaine Sec7 des cytohésines et inhibe l'échange GDP/GTP (Hafner et al. 2006).
In BRAG2 and BRAG3, some predictions identified one coiled-coil at the C-terminus (for review (Casanova 2007)), and nuclear localization signal (NLS) motifs were also predicted for BRAG2 (Dunphy et al. 2006).
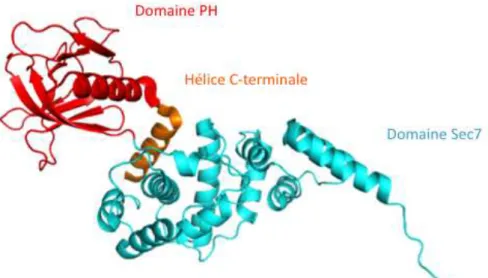
BRAGs are ArfGEFs
Localization of BRAGs
Another group also found endogenous BRAG1 in the PSD of excitatory synapses of mouse brains by immunohistochemistry (Sakagami et al. 2008). The same group found endogenous BRAG3 at postsynaptic specializations of inhibitory synapses in mouse brain by immunohistochemistry (Fukaya et al. 2011). BRAG2 was also shown to be concentrated in synaptic vesicles and PSD fraction of mouse brain by cell fractionation (Scholz et al. 2010).
Another group observed these punctate clusters of BRAG2 in the cytoplasm and perinuclear region in PMA-differentiated human macrophage- and monocyte-like U937 cells by immunofluorescence microscopy (Someya et al. 2010). By cell fractionation, it was also found that a part of endogenous BRAG2 is also associated with the nucleus (Dunphy et al. 2006). Indeed, BRAG2 activity increased in a PI concentration-dependent manner (Sakurai et al. 2011).
Another recent study showed that PIP2 binding to the PH domain of BRAG2 appears to modify BRAG2 activity (Jian et al. 2012).
Cellular functions of BRAGs
Using yeast two-hybrid analyses, Scholz and colleagues showed that a fragment encompassing the Sec7 and PH domains of BRAG2 can bind to the dephosphorylated GluA2 subunit of the AMPA receptor (Scholz et al. 2010). Transfected and endogenous BRAG2 was shown to directly interact with the AMPAR subunit at synapses by yeast two-hybrid experiments, GST pull-down assays, and immunoprecipitation (Scholz et al. 2010). Thus, these experiments show that BRAG2 is a regulator of Arf6 activation in a signaling cascade involved in complement receptor and Fc# receptor-mediated phagocytosis (Someya et al. 2010).
They also showed by GGA3-GST pull down assays that this cell-to-cell fusion is mediated by Arf6 activation in BRAG2-depleted cells (Pajcini et al. 2008). The role of BRAG2 in LTD (Scholz et al. 2010) also leads to the same conclusion. This therefore suggests that the apoptotic function of BRAG2 was independent of its GEF activity (Someya et al. 2006).
All these experiments together suggest that BRAG2-Arf6-AMAP1-cortactin pathway is activated by VEGFR2 to promote angiogenesis (Hashimoto et al. 2011).
BRAGs and Pathologies
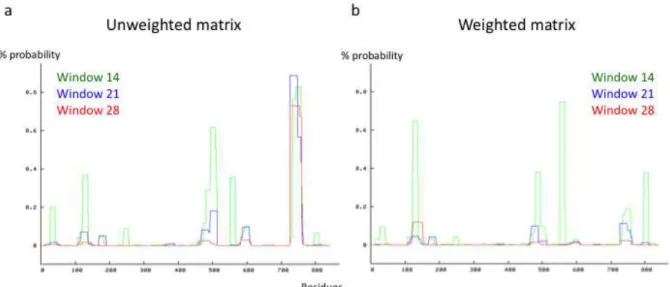
It is interesting to highlight that the helices of the Sec7 domain (residues 390 to 591) were approximately well predicted compared to the crystal structure, except for helix 8 (residues 518 to 524), which was not predicted (Figure 19 , Appendix 2). The experiments are described in the first column in the order in which the components of the reactions were added. Synchrotron Radiation SAXS Analysis of Arf6-GDPFLandΔ13Arf6-GDP. a) Fit of the experimental SAXS data of Arf6-GDPFL (black) with the scattering curves calculated from either the crystal structure of Arf6-GDPFL (red), the crystal structure of Δ13Arf6-GDP (blue), or Arf6-GDPFL without the N-terminal helix (Arf6-GDPFL-Δ13; green).
Hydrodynamic radii were calculated using the program HYDROPRO.34 The structure of the Sec7 domain of EFA6 was modeled after the ARNO structure (PDB entry 1R8S) using the Phyre server.35. Specificities for the small G proteins ARF1 and ARF6 of the guanine nucleotide exchange factors ARNO and EFA6.J. 34;A glutamine finger in the guanine nucleotide exchange factor ARNO displaces Mg2+ and the beta-phosphate to destabilize GDP at ARF1." EMBO J 17.
34;GBF1: A novel Golgi-associated BFA-resistant guanine nucleotide exchange factor exhibiting specificity for ADP-ribosylation factor 5." J Cell Biol. 34;SynArfGEF is a guanine nucleotide exchange factor for Arf6 and is localized mainly in the post-synaptic specializations of inhibitory synapses." J Neurochem. 34; Structural basis for ARF GTPase activation: mechanisms of guanine nucleotide exchange and GTP-myristoyl exchange." Cell.
34;The Arl4 family of small G proteins can recruit the cytohesin Arf6 exchange factors to the plasma membrane." 34;The PH domain of the Arf exchange factor Brag2 is an allosteric binding site." J Biol Chem. 34; Purification of a protein cofactor required for ADP-ribosylation of the stimulatory regulatory component of adenylate cyclase by cholera toxin." J Biol Chem.
34; Small G protein specificities of the guanine nucleotide exchange factors ARNO and EFA6 ARF1 and ARF6." J Biol Chem 276. 34; The pleckstrin homology domain of the Arf6-specific exchange factor EFA6 localizes to the plasma membrane by interacting with phosphatidylinositol 4,5-bisphosphate and F- actin." J Biol Chem. 34; The structure of Arf6-GDP suggests a basis for the specificity of guanine nucleotide exchange factors." Nat Struct Biol 7.
34;Structure of the guanine nucleotide exchange factor Sec7 domain of human arno and analysis of the interaction with ARF GTPase." Cell 92. 34;The domain architecture of large guanine nucleotide exchange factors for the small GTP-binding protein Arf." BMC Genomics 6(1): 20. 34;Mutations in the guanine nucleotide exchange factor gene IQSEC2 cause nonsyndromic intellectual disability.” Nat Genet.