Développement d'un test de l'activité kinase de la protéine DYRK1A et de sa régulation épigénétique. Développement d'un test de l'activité kinase de la protéine DYRK1A : candidate au retard mental et à la dégénérescence du syndrome de Down.
Liste des abréviations 1
3GSU (CGA) Sous-unité Alpha des hormones glycoprotéiques (LH, FSH, TSH) 3MSH Sous-unité Alpha de la lignée gonadotrope murine MSH 3T3-1.
Listes des figures 2
DYRK1A 2.1
ISL1 2.2
Développement d'un test d'activité de la protéine kinase DYRK1A : un candidat pour le retard mental et.
Mise au point d’un dosage de l’activité kinase de la protéine DYRK1A : un candidat pour le retard mental et
Introduction générale 1
Un peu d’histoire : du concept de « l’idiotie » à la définition même 1.1
Epidémiologie, phénotypes et pathologies associées
Epidémiologie et étiologie de la Trisomie 21
Phénotypes et pathologies associées
La protrusion de la langue et de l'abdomen, ainsi que l'affaissement de la voûte plantaire, sont les conséquences d'une hypotonicité musculaire. Les troubles de la reproduction, le développement du système reproducteur et la fertilité sont également des caractéristiques courantes des personnes atteintes du syndrome de Down.
Le QI et les malformations cranio-faciales 1.2.3
Selon les observations recueillies, il y aurait une réduction de près de 25 % du poids et du volume du cerveau (pour revue par Delabar et al, 2006). Parmi les malformations cranio-faciales les plus courantes, la brachycéphalie est détectée chez près de 90 % des personnes atteintes du syndrome de Down (pour revue par Delabar et al, 2006).
Le vieillissement et la maladie d’Alzheimer 1.2.4
Le volume du cervelet est réduit de 30 %, l'hippocampe, l'amygdale, les lobes temporaux et le lobe frontal présentent également une réduction de volume (Pinter et al, 2001a/b ; pour revue Lubec et al, 2002), puis on constatez une augmentation de la matière grise dans le cortex cérébral et le cortex entorhinal de l'hippocampe (White et al, 2003; Teipel et al, 2004). À cela s’associent une réduction du nombre de neurones dans certaines parties du cerveau, notamment le cervelet, l’hippocampe et le cortex frontal, un manque de myélinisation des axones, une réduction de la taille des dendrites et du nombre d’épines dendritiques. (Wisniewski et al, 1990 ; Koo et al, 1992 ; Golden et al, 1994 ; Takashima et al, 1994 ; Guidi et al, 2008).
Le chromosome 21 1.3
24 Chez les personnes trisomiques de plus de 35 ans, on observe des modifications neurohistopathologiques similaires à celles observées chez les patients atteints de maladie d'Alzheimer sporadique de plus de 60 ans : même répartition des plaques amyloïdes et des dégénérescences neurofibrillaires, même marquage des lésions par immunohistochimie. De plus, le métabolisme de l'APP, tel que mesuré dans le plasma par les taux de peptides Abeta40 et Abeta42, est altéré chez les très jeunes patients (huit ans et plus) (Mehta et al, 2003).
Sa structure 1.3.1
Bien que la duplication du gène APP semble suffisante pour permettre l'expression de la maladie d'Alzheimer (Rovelet-Lecrux et al, 2006), d'autres gènes du chromosome 21 associés à l'APP pourraient être impliqués dans ce processus. Régions synténiques entre le chromosome humain 21 et les chromosomes de souris (MMU) 10, 16 et 17 (adapté d'Antonarakis et al, 2004).
Gènes candidats ? Pourquoi pas ! 1.3.2
Les modèles d’études murins 1.3.3
Lorsqu'un phénotype est présent dans tgYAC152F7 et absent dans tgYAC141G6, on peut supposer que c'est le gène DYRK1A qui est à l'origine ou la combinaison de la surexpression de ce gène et d'un autre gène porté par This. Il existe plusieurs types de constructions (ADNc, gène) utilisées pour créer ces modèles permettant d'attribuer un phénotype à la surexpression d'un seul gène.
Les kinases 1.1
Les déficits cognitifs, notamment la mémoire spatiale, qui nécessitent l'intégration d'informations visuelles et spatiales, sans altération de la mémoire de travail, contrairement à Ts65Dn, sont décrits dans TgDyrk1A et révèlent un profil de dysfonctionnement de l'hippocampe et du cortex préfrontal (Altafaj et al, 2001). Dans Dyrk1A+/- et Dyrk1A-/-, les résultats montrent clairement un défaut de développement du système nerveux central, une réduction du nombre de neuroblastes et une dérégulation de la différenciation neuronale (Fotaki et al, 2002).
Généralités sur les kinases 1.1.1
Protéines tyrosine kinases (PTK), (environ 20 % des kinases), qui phosphorylent les résidus tyrosine d'une séquence consensus d'un substrat protéique. Ce sont des protéines à double spécificité capables de phosphoryler les résidus Ser/Thr mais aussi Tyr.
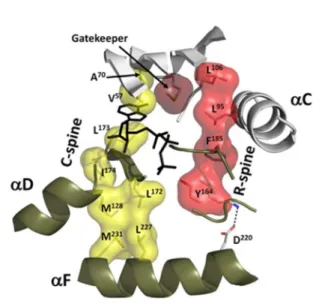
Structures générales des kinases 1.1.2
Structure tridimensionnelle d'une protéine kinase de la famille ePK et de son domaine catalytique (d'après Kornev et Taylor, 2010). Structure tridimensionnelle du lobe C et des piliers C et R d'une protéine kinase de la famille ePK (d'après Kornev et Taylor, 2010).
Rôles dans le système nerveux 1.1.3
La protéine DYRK1A 1.2
Gène 1.2.1
Expression 1.2.2
Chez la souris adulte, l'expression de Dyrk1A est détectée dans le cerveau antérieur, le cerveau moyen et le cerveau postérieur, en particulier dans le cervelet et la matière grise de la moelle épinière (Marti et al, 2003). Chez la souris, au cours du développement embryonnaire, Dyrk1A est fortement exprimé dans le cerveau, en particulier dans le cortex cérébral, l'hippocampe, l'hypothalamus, le mésencéphale et la moelle épinière.
Structure 1.2.3
Il est intéressant de noter que DYRK1A, malgré son expression omniprésente à l'échelle mondiale, est fortement exprimée dans l'hippocampe, le cervelet, le thalamus et la substance noire des personnes âgées (Wegiel et al, 2004 ; pour revue Wegiel et al, 2011). Chez les patients atteints de la maladie d'Alzheimer, l'expression de DYRK1A est identifiée par des études in vitro, in vivo et post mortem.
Fonctions 1.2.4
Globalement, DYRK1A joue un rôle dans le maintien de l’activité neuronale chez l’adulte, ainsi que dans la consolidation de la mémoire et de l’apprentissage. Les souris transgéniques BAC DYRK1A présentent un déficit de mémoire, de LTP et de LTD dans l'hippocampe.
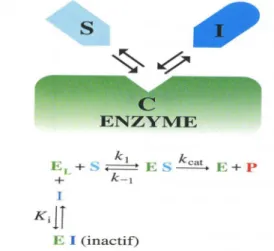
Propriétés enzymatique 1.2.5
Régulation 1.2.6
Site d'autophosphorylation de Dyrk1A (adapté de Becker et Sippl, 2010 L'autophosphorylation de DYRK1A est constitutive, se produisant lors de la synthèse protéique. Une interaction avec la protéine 14.3.3 permet de moduler l'activité de DYRK1A en augmentant son activité catalytique sans compromettre TF321. ( Alvarez et al , 2007).
Tests d’activité de DYRK1A 1.3
Ce sont ces interactions qui vont réguler l'activité de DYRK1A et donc certaines de ses fonctions qui sont le dosage des gènes et les activités dépendantes (Arron et al, 2006 ; Gwack et al, 2006). La présence d'un élément potentiellement déstabilisant dans le 3'UTR "AUUUA" de l'ARNm de DYRK1A et la région PEST de la protéine DYRK1A confortent l'hypothèse selon laquelle l'expression de DYRK1A pourrait subir des changements rapides in vivo (Kentrup et al, 1996).
Test radioactif 1.3.1
Dans les lignées de neuroblastome SH-SY5Y, une augmentation du niveau d'ARNm de DYRK1A est induite par le peptide A2 (Kimura et al, 2007). Cette technique, qui apparaît très sensible, est une méthode de choix pour la détermination de l'activité kinase et a fortiori celle de DYRK1A.
Test ELISA 1.3.2
L'identification de ces séquences a été réalisée par alignement de séquences et/ou utilisation de modèles structurels. Elle est cependant très contraignante du fait de la nécessité de disposer de locaux dédiés à l'utilisation de la radioactivité et de personnel formé.
Test IMAP™ (Molecular Devices) 1.3.3
Projet : développement d'un nouveau test DYRK1A par HPLC/UFLC pour tester de nouvelles molécules à visée thérapeutique.
Mise au point d’un nouveau test kinase 1.1
Test de nouveaux inhibiteurs in vitro et ex vivo 1.2
Matériels et méthodes 2
Expression et purification de la DYRK1A de rat recombinante 2.1
Sous clonage 2.1.1
Les clones recombinants sont sélectionnés après préparation des plasmides (kit QIAprep Miniprep1 QIAGEN) et vérification de la présence de l'insert par digestion enzymatique. pET28 a été cloné de manière similaire dans un vecteur pour fournir une étiquette ou « étiquette » de 6 histidines à l'extrémité N-terminale de la protéine, y compris l'ADNc.
Culture 2.1.2
L'étape suivante de ligature implique 50 ng de vecteur et 300 ng d'insert dans un volume total de 15 µl contenant le tampon de ligature et la ligase (Biolabs).
Extraction, purification 2.1.3
La protéine purifiée est ensuite dialysée contre un tampon Tris-HCl 25 mM pH 7,5, EDTA 1 mM, puis stockée à -80°C en présence de glycérol (10% final). His-DYRK1A est ensuite élué à l'aide d'un tampon de lyse contenant 300 mM d'imidazole (concentration finale).
Electrophorèse sur gel de polyacrylamide en présence de SDS 2.1.4
Mais le lysat est incubé pendant 2 heures à 4°C avec 1,5 ml de résine nickel-agarose en présence d'une concentration finale d'imidazole 10 mM. La résine est ensuite placée dans une petite colonne et lavée successivement avec du tampon de lyse contenant 0,2% de Triton X-100 puis avec du tampon de lyse contenant 30 mM d'imidazole (concentration finale).
Immunoélectrotransfert (Western-blot) 2.1.5
HPLC 2.2
Principe de l’HPLC 2.2.1
Analyses qualitatives 2.2.2
Analyses quantitatives 2.2.3
Le matériel 2.2.4
62 - Un injecteur automatique : le système d'injection est constitué d'une pompe doseuse haute résolution et d'un système d'injection directe permettant de ne perdre aucun échantillon et d'utiliser de petits volumes (de 0,5 µl à 100 µl) à raison de 10s par 10 µl d'injection. Le détecteur UV-visible permet de mesurer en temps réel le spectre d'absorption allant de 190 à 900 nm en sortie de colonne.
Les colonnes 2.2.5
Détecteurs : deux types de détecteurs composent le LC-20A : un détecteur à réseau de photodiodes UV-visible (PDA).
Protocole de dosage par HPLC 2.3
Dosage de l’activité 2.3.1
Méthode HPLC 2.3.2
Inhibition de l’activité DYRK1A 2.4
Protocole 2.4.1
Modèle mathématiques 2.4.2
Résultats 3
Production des enzymes recombinantes 3.1
Sous clonage 3.1.1
Culture et extraction 3.1.2
L'utilisation d'anticorps anti-6xHis (1/10000ème) (Figure 17A) et anti-DYRK1A (1/2000ème) (Figure 17B) révèle la présence d'une bande unique et de poids moléculaire correspondant à celui des protéines recombinantes, ainsi confirmant la pureté de la préparation et l’identité de la protéine produite. En revanche, la préparation des protéines recombinantes de forme complète s'est révélée plus compliquée que prévu, notamment en raison de la présence de nombreux contaminants.
Test d’activité de DYRK1A
Mise au point 3.2.1
Pour mesurer les vitesses de réaction dans des conditions stables (vitesses initiales, vi), il est nécessaire que la formation du produit soit un processus linéaire dans le temps. La figure 20 représente la superposition des chromatogrammes issus de la réaction enzymatique à différents temps (0 à 15 minutes).
Détermination des paramètres cinétiques apparents 3.2.2
La pente de cette droite permet de calculer la constante de vitesse observée (kobs) de la réaction qui dépend des conditions expérimentales. Vi en fonction de la concentration en peptide (abscisse) et en ATP (courbes indépendantes de 50 à 400 µM). Vi en fonction de la concentration en ATP (abscisse) et en peptide (courbes indépendantes de 5 à 30 µM).
Inhibition de DYRK1A 3.3
L'Harmine 3.3.1
Les vrais paramètres cinétiques (Tableau ci-dessus) sont calculés à partir de la relation de Michaelis Menten pour un mécanisme ordonné (Cf. Introduction). Activité normalisée de DYRK1A en fonction de la concentration d'Harmine (abscisse) pour deux concentrations d'ATP (courbes indépendantes 50 et 1000 µM).
Criblage d'inhibiteurs 3.3.2
80 Les résultats obtenus sont, d'un point de vue qualitatif, exactement les mêmes qu'avec l'harmine : inhibition réversible de type compétitif vis-à-vis de l'ATP et non compétitif vis-à-vis du peptide. En revanche, d'un point de vue quantitatif, nous avons obtenu des valeurs d'IA plus faibles, c'est-à-dire que les inhibiteurs testés ont une meilleure affinité pour DYRK1A que l'harmine (entre un facteur 13 à 100).
Tests in vivo de l'activité endogène DYRK1A 3.4
Mise au point du dosage 3.4.1
Tests des inhibiteurs dans un contexte cellulaire 3.4.2
Discussion générale, conclusion générale et perspectifs 4
Il se lie à la poche de liaison de l'ATP et établit des liaisons hydrogène avec Lys188 et Leu241. L'inhibition de DYRK1A par INDY est comparable à celle de l'harmine, dont elle peut se substituer.
Bibliographie 5
Magnetic resonance imaging evaluation of delayed myelination in Down syndrome: a case report and review of the literature. Moore CS (2006) Postnatal mortality and cardiac abnormalities in the Ts65Dn Down Syndrome mouse model.
Régulations épigénétiques de l'expression du gène codant ISL1, un facteur essentiel à la différenciation du
GnRH
Plus tard, environ 10,5 jours après le développement (E10.5), l'expression du gène se limite aux cellules peuplant la partie ventrale de l'hypophyse et, chez l'adulte, elle est exprimée dans les cellules gonadotropes. manière exclusive. Les mécanismes contrôlant l’expression de ce gène à ces différents stades de développement reflètent probablement différentes facettes de la régulation génétique et épigénétique.
Le complexe hypothalamo-hypophysaire 1.1
L'axe hypothalamo-hypophysaire chez les mammifères L'axe hypothalamo-hypophysaire est constitué de l'hypothalamus et de l'hypophyse. L'hypophyse antérieure ou adénohypophyse est divisée en trois régions : la pars intermedia, dans laquelle se trouvent la majorité des cellules mélanotropes qui produisent la MSH et les endorphines, la pars tuberalis et la pars distalis, où se trouvent les cinq autres types de cellules hypophysaires : les cellules gonadotropes produisent et libèrent de la LH et de la FSH, les cellules corticotropes produisent et libèrent de l'ACTH, les cellules lactotropes produisent et libèrent de la prolactine, les cellules somatotropes produisent et libèrent de la GH et les cellules thyréotropes produisent et libèrent de la TSH.
Anatomie fonctionnelle de l'hypophyse 1.1.1
Le lobe postérieur ou pars nervosa est relié à l'hypothalamus au moyen de l'éminence médiane et de la tige infundibulaire ou hypophyse. Ces hormones sont synthétisées par les neurones des noyaux supraoptique (SON) et paraventriculaire (PVN) de l'hypothalamus (Okado et al, 1980 ; Kioussi et al, 1999).
Mise en évidence du contrôle neuro-hormonal 1.1.2
Découverte des neurohormones hypothalamiques 1.1.3
L'hypophyse, une invention évolutive des Vertébrés 1.1.4
La LH et la FSH sont synthétisées et libérées en fonction de la fréquence et de l'amplitude des impulsions de GnRH. Chez l'homme, la LH stimule la production de testostérone par les cellules interstitielles du testicule, les cellules de Leydig.
La GnRH 1.2
Les neurones à GnRH 1.2.1
La pulsatilité de la GnRH et ses conséquences 1.2.2
Les régulations de la GnRH 1.2.3
Le récepteur de la GnRH (GnRHR)
Séquence et structure du GnRHR
Cette structure est stabilisée par deux ponts disulfure : le premier est situé entre la première boucle extracellulaire (Cys114 chez l'homme) et la deuxième boucle extracellulaire (Cys195 chez l'homme) et l'autre entre l'extrémité N-terminale (Cys14 chez l'homme) et la seconde. . boucle extracellulaire (Cys199 chez l'homme) (Kakar et al, 1992; Cook et Eidne, 1997; pour revue Millar et al, 2004). Ainsi, la lysine en position 191 serait impliquée dans l'internalisation du récepteur (Arora et al, 1999) et l'asparagine en position 18 chez l'homme porte le site de glycosylation (Davidson et al, 1995).
Les voies de signalisation couplées au récepteur de la GnRH 1.3.2
L'internalisation du GnRHR chez les mammifères est quantitativement inférieure à celle des récepteurs classiques de la même famille. Ainsi, une fréquence lente des impulsions de GnRH favorise la transcription des sous-gènes.
La mise en évidence de la présence du GnRHR extra-hypophysaire 1.3.3
En revanche, des impulsions rapides et régulières, par exemple toutes les 30 minutes, stimulent la transcription des sous-unités 1 et 2 de la LH (Dalkin et al, 1989 ; Burger et al, 2002).
Le gène du récepteur de la GnRH 1.4
Structure générale du gène humain et des rongeurs 1.4.1
Les promoteurs du Gnrhr 1.4.2
ISL1 et LHX3, des protéines LIM-HD essentielles à l’expression du 1.4.3
En revanche, les protéines LIM-HD agissent indépendamment de SF1 pour induire l'expression de Gnrhr à E13.5. L'interdépendance fonctionnelle entre les protéines LIM-HD et SF1 est établie entre E13.5 et E15.5, garantissant la spécification de la lignée (Granger et al, 2006).
ISL1, une protéine LIM à homéodomaine parmi d'autres ? 1.5
Chez la drosophile, ISL1 est exprimé dans les motoneurones et est nécessaire à l'extension des axones vers leurs cibles appropriées (Thor et Thomas, 1997). ISL1 est exprimé dans les noyaux cérébraux impliqués dans le contrôle autonome et endocrinien et dans le contrôle du rythme circadien, suggérant un rôle pour ISL1 dans la spécification et le maintien des propriétés physiologiques neuronales et endocriniennes de différents types de cellules (Thor et al, 1991).
Les protéines LIM 1.5.1
ISL1 est un marqueur précoce des cellules souches cardiaques et est exprimé dans le mésoderme cardiogénique et l'endoderme pharyngé (Xuan et al, 2000; Cai et al, 2003; SunY et al, 2007). Enfin, les protéines de classe 4 qui, en plus de ces caractéristiques, présentent un motif catalytique comme les LIM kinases.
Les protéines LIM à homéodomaine (LIM-HD) 1.5.2
Il existe 12 protéines LIM-HD et elles sont organisées en 6 paires de gènes paralogues. Les protéines homéodomaines LIM sont constituées de deux domaines LIM situés à l'extrémité N-terminale et d'un homéodomaine situé à l'extrémité C-terminale.
ISL1 est impliquée dans plusieurs processus développementaux 1.5.3
L'expression de Shh est détectée à partir du stade E8 le long de l'ectoderme buccal sauf au niveau de l'invagination de la poche de Rathke. Dans les cellules gonadotropes L2T2, la surexpression de Isl1 augmente significativement la synthèse et la sécrétion de FSH, mais pas celle de LH.
Les mécanismes génétiques et épigénétiques potentiellement 1.6
Modifications épigénétiques 1.6.1
143 se liant aux résidus modifiés qui affectent la transcription des gènes, la réparation de l'ADN, la réplication et la condensation de la chromatine (Liu et al, 2005 ; pour la revue Li et al, 2007 ; pour la revue Kouzarides, 2007 ; pour la revue Berger, 2007). La méthylation de l'ADN (A) est l'ajout d'un groupe méthyle au carbone 5 de la cytosine.
Les outils utilisés 1.7
Les lignées cellulaires 1.7.1
Des souris transgéniques ont été créées en intégrant dans leur génome une construction comprenant la séquence codante de l'antigène T du virus SV40 sous le contrôle du promoteur de la sous-unité 1 humaine (Windle et al, 1990). Ces cellules présentent les caractéristiques des cellules gonadotropes matures qui expriment la GnRHR à leur surface et répondent aux impulsions de GnRH en sécrétant des gonadotrophines.
Objectifs 1.8
Les anticorps 2.1
Culture cellulaire 2.2
Etudes de l’activité du promoteur : enzymes de restriction et 2.3
La séquence montre les emplacements des enzymes de restriction par rapport au site d'initiation de la transcription (signalé SST+1), les amorces 5' et 3' utilisées pour intégrer la séquence dans le vecteur. La séquence surlignée en bleu turquoise est celle du premier exon, la séquence en italique/gras délimite l'îlot CpG.
Transfection transitoire 2.4
Extraction de protéines nucléaires et western blot 2.5
Extractions nucléaires des cellules en culture 2.5.1
Les westerns blot 2.5.2
Après transfert, les membranes sont incubées dans une solution bloquante TBS-Tween à 0,1% [TBS : 50 mM Tris (pH 7,5) ; 150 mM NaCl] contenant 5% de lait pendant 1 heure à température ambiante, ils sont ensuite incubés avec l'anticorps primaire dilué dans du TBS-Tween 0,1% - 5% de lait à 4°C pendant une nuit sous agitation. Les résultats sont analysés en utilisant la β-actine comme protéine de référence, le programme Adobe Photoshop pour produire des montages d'images Western blot et le programme Image J pour les estimations densitométriques.
Immunoprécipitation de chromatine (ChIP) 2.6
Le Cross-linking 2.6.1
L’extraction des noyaux 2.6.2
L’immunoprécipitation 2.6.3
Les solutions de chromatine (350 µl/anticorps) sont pré-incubées avec les billes d'agarose couplées à la protéine A pendant 30 minutes à 4°C sous agitation puis centrifugées. Le deuxième jour, les solutions de chromatine immunoprécipitées sont incubées en présence des billes d'agarose couplées à la protéine A pendant 2 heures à 4°C sous agitation pour capturer les anticorps avec les complexes protéine/ADN qu'ils ont capturés.
Le lavage des billes 2.6.4
Ils sont immédiatement bouchés pour retenir le tampon d'élution dans la colonne et permettre 2 heures d'incubation. Les tubes sont centrifugés après 2 heures et 2 µl de protéinase K à 20 mg/ml sont ajoutés dans chaque tube.
Extractions des ADN 2.6.5
Analyses de la méthylation 2.7
La deuxième multiplication s'effectue avec 4 cycles supplémentaires, les températures sont les mêmes, seul le nombre de cycles change. Après arrêt de la migration, une deuxième amplification est placée sur le même gel, dans les puits correspondant à chaque ADN, la migration de cette deuxième couche dure 10 minutes et enfin une troisième amplification est placée suivant la même procédure.
La PCR en temps réel 2.7.2
Détermination des intensités de fluorescence 2.7.3
Extraction d’ADN génomique 2.8
Immunohistologie 2.9
De nombreux exemples illustrent la diversité des sites d’initiation de la transcription d’un même gène dans différents tissus. Afin d'isoler et d'analyser le promoteur, il est donc indispensable de connaître le site d'initiation de la transcription dans les tissus d'intérêt, ici les cellules gonadotropes.
Détermination du site d’initiation de la transcription du gène Isl1 3.1
Le séquençage a confirmé que le site d'initiation de la transcription du gène Isl1 dans les cellules gonadotropes est identique à celui décrit dans Ensembl (//www.ensembl.org/index.html). Le site d’initiation de la transcription du gène Isl1 de souris est situé dans le premier exon.
Etude de l’activité du promoteur
Activité ubiquiste du promoteur d'Isl1 dans différentes lignées 3.2.1
Par ailleurs, des études ChIP-on-Chip, menées dans le cadre d'un autre projet de laboratoire sur le facteur forkhead FOXL2, nous ont amené à tester l'implication possible de ce facteur dans l'activité du promoteur Isl1 (résultats non publiés). En parallèle des approches de transfection transitoire, nous avons vérifié la présence in vivo de FOXL2 dans les cellules gonadotropes hypophysaires.
Pour confirmer ces données, nous avons testé plusieurs constructions représentant des promoteurs portant différentes délétions. Dans ces approches ChIP-on-Chip, la chromatine isolée des cellules gonadotropes 1T3-1 a été immunoprécipitée avec un anticorps anti-FOXL2, puis analysée sur une puce promotrice, révélant le promoteur Isl1 comme l'une des cibles majeures de ce facteur de transcription.
Ces résultats suggèrent plusieurs hypothèses : 1 - l'expression de Isl1 est ubiquitaire, 2 - tous les éléments présents dans le promoteur de 5 kb ne sont pas suffisants pour une expression cellulaire spécifique, 3 - d'autres mécanismes, notamment épigénétiques (modifications de l'ADN et/ou des histones).
Etude du promoteur du gène Isl1 par « délétion » de différents fragments en présence ou non de FOXL2 dans les cellules gonadotropes 3T3-1. L'activité luciférase a été mesurée 40 h après la co-transfection en présence ou en absence de FOXL2 et ISL1.
Analyse de l'expression du gène endogène codant ISL1 3.3
Mesures du niveau relatif d'ARNm codé par Isl1 (A) et par Gnrhr (B) dans les lignées hypophysaires 1T3-1, L2T2, GH3B6 et AtT20, dans la lignée hypothalamique GT1-7, dans la lignée neuronale PC12, dans la lignée gonadique mLTC1 et dans la lignée rétinienne RGC5. En revanche, ces deux bandes ne sont pas détectées dans les cellules des lignées hypophysaires GH3B6 et AtT20.
Modifications épigénétiques d'Isl1 dans les différentes lignées 3.4
Etudes comparées des promoteurs 3.4.1
A : Fréquence (en pourcentage) de chaque base présente dans les 2 kb en amont du site d'initiation du promoteur de chaque gène. B : fréquence CpG (rapport des CpG observés aux CpG attendus) dans les 2 kb en amont du site d’initiation du promoteur de chaque gène.
Modifications des histones 3.4.2
Ceci est parfaitement corrélé à la présence de K4Me3 et d’ARN Pol II. Dans les cellules GT1-7, aucun marqueur n'est détecté et l'ARN Pol II est absent.