Je tiens à remercier Pascal Fries de m'avoir initié aux mesures et aux différentes interprétations de la relaxation. Merci également à Zohra pour sa disponibilité et son efficacité dans le traitement de toutes les questions administratives.
De ce fait, leur visualisation n’est possible que si la technique d’imagerie utilisée présente une sensibilité élevée. Les techniques d’imagerie couplant l’IRM à la luminescence permettraient donc d’observer à la fois l’anatomie et la fonction ou l’activité d’une structure.
Les chélates de Gd(III) comme agents de contraste 25
Nous présenterons ensuite la technique d'imagerie par résonance magnétique dans son intégralité, et plus en détail, les principaux produits de contraste commerciaux actuellement utilisés. Enfin, nous présenterons les avantages des complexes de lanthanides pour l'imagerie optique, ainsi que quelques exemples d'applications.
Les lanthanides
- Définition
- Propriétés fondamentales des Ln(III)
- Propriétés magnétiques du Gd(III)
- Propriétés spectroscopiques des Ln(III)
Ainsi, contrairement aux métaux d, les niveaux d’énergie des complexes Ln(III) sont très proches de ceux de l’ion libre. La nature non directionnelle de l’interaction métal-ligand se traduit par une faible préférence stéréochimique en matière de coordination.

L’Imagerie par Résonance Magnétique (IRM)
- Principe
- Relaxation et relaxivité
- Les agents de contraste commerciaux
- Les agents de type T 1
- Les chélates de Gd(III) comme agents de contraste
- Du Gd-aqua aux complexes de Gd(III)
- Description théorique de la relaxivité
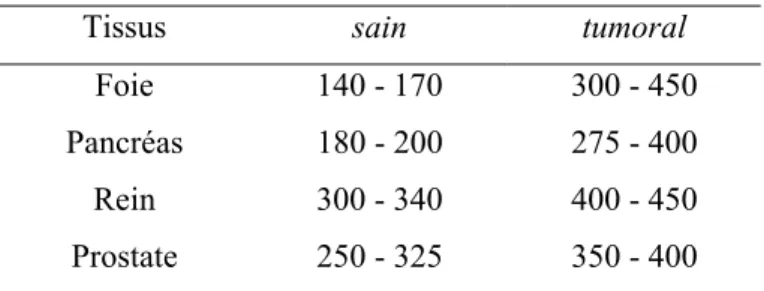
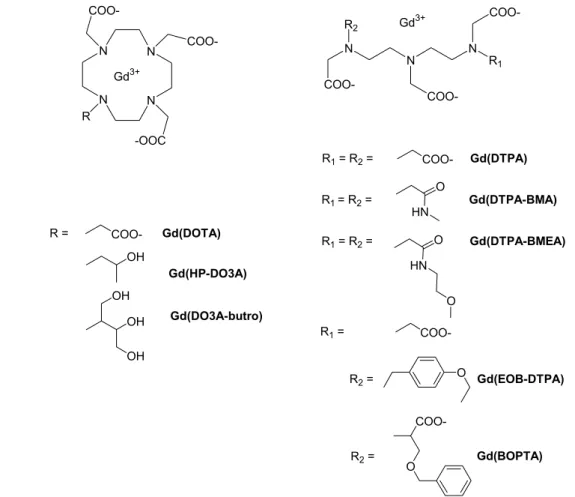
La biodistribution d'un produit de contraste dépend essentiellement de sa taille et de son caractère lipophile. Un agent de contraste à base de Mn(II) a également été approuvé cliniquement : le complexe [Mn(H2DPDP)]2- présenté sur la figure I .
Ligand
Pm fraction molaire des molécules de solvant dans la première sphère de coordination ; - q nombre de molécules d'eau attachées au centre métallique. T1m Temps de relaxation longitudinale du proton d'une molécule d'eau sous l'hypothèse d'une coordination infinie de cette molécule d'eau.
Ligand r GdH τ R
Paramètres influençant la relaxivité de sphère interne Nous avons vu que de nombreux paramètres influencent la relaxivité et que leur contribution est
Par exemple, une diminution de 0,1 Å de la distance correspond à une augmentation de 20 % de la relaxivité. Cependant, nous avons vu en introduction que T1m dépend également du taux d'échange d'eau et d'autres paramètres (rotation, relaxation électronique).

Nouvelle génération d’agents de contraste
L'ajustement simultané d'autres paramètres (vitesse des échanges d'eau dans la sphère interne, relaxation électronique) est donc indispensable pour augmenter encore la relaxation. Peters et ses collègues ont montré que la relaxivité était limitée par le taux de diffusion des molécules d'eau de l'intérieur de la cavité vers l'extérieur [53].
Exemples d’agents de contraste spécifiques ou bio activables
- Ciblage de cellules
Les agents de contraste activés par des enzymes permettent de déterminer sa localisation et de mesurer l'activité enzymatique. L'activation des produits de contraste par changement de pH semble être une méthode raisonnable pour mettre en évidence les tumeurs.
Des chromophores organiques aux complexes de Ln(III) luminescents
- Définitions
- Fluorescence et phosphorescence
- Rendement quantique
- Les chromophores organiques : une luminescence éphémère
- Les ions Ln(III) : le concept de luminescence en temps résolu
La fluorescence est le résultat de l'émission d'un photon associé au transfert de spin de l'état singulet S10 vers un niveau vibrationnel excité de l'état fondamental (S0*). Ensuite, leurs bandes d’émission et d’absorption sont larges, ce qui rend difficile l’utilisation simultanée de différents marqueurs.

Fluorescence
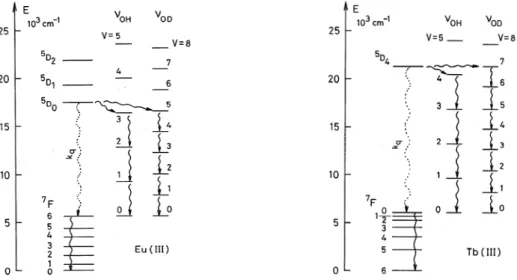
Premièrement, leur décalage de Stokes, ce qui signifie que la différence entre la longueur d'onde d'excitation et la longueur d'onde d'émission est faible, et provoque un filtrage entre la lumière incidente diffusée (à la longueur d'onde d'excitation du système) et le signal d'émission gênant. Ainsi, leur utilisation permet de s'affranchir de la luminescence intrinsèque du milieu biologique grâce à la méthode de luminescence résolue en temps (Fig. I. 29).
Phosphorescence
En effet, ils peuvent facilement se lier à toutes sortes de biomolécules comme les oligonucléotides, les peptides, les saccharides. De nombreux exemples de sondes et d'applications associées peuvent être trouvés dans le Hanbook of Fluorescence publié par Invitrogen[73].
Le grand nombre de fluorophores commerciaux et leur facilité d'utilisation en chimie organique rendent ces composés attractifs pour la réalisation de sondes optiques. Cependant, l'utilisation de ces marqueurs est limitée par leurs propriétés optiques qui ne sont pas toujours adaptées aux applications recherchées.
Les complexes des Ln(III) luminescents
- Les différentes voies de sensibilisation - L’effet d’antenne
Le transfert à travers les bandes de transfert de charge ligand-métal (LMCT) ou métal-ligand (MLCT) permet également la sensibilisation aux métaux. Les bandes de transfert de charge sont ainsi impliquées dans des processus de désactivation électrique non radiatifs tels que le transfert d'électrons photo-induit (PET).
Yb III
- Conception de chélates de Ln(III) luminescents
Dans le cas d'un mécanisme purement dipolaire, l'efficacité du transfert peut être estimée à partir de l'équation simplifiée suivante. Ce processus, principalement observé dans le cas de Eu(III), est favorisé par la présence de groupes donneurs d'électrons (tels que les amines) sur le ligand [83, 84].
- Sondes luminescentes
- Tests immunologiques
- Imagerie
- Sondes « bimodales »
- Contexte et objectifs du travail
En effet, ce sont les propriétés de la sphère de coordination qui déterminent l'efficacité des complexes et nous avons vu que les exigences diffèrent selon que le complexe est utilisé pour l'IRM ou la luminescence. Enfin, le chapitre IV sera consacré aux propriétés de luminescence dans le visible des complexes à ligands dérivés du picolinate (Eu(III), Tb(III)) et à l'étude de la luminescence des complexes [Ln(thqtcn)] dans le proche avenir. infrarouge (Ln = Yb, Nd, Er).

Bibliographie
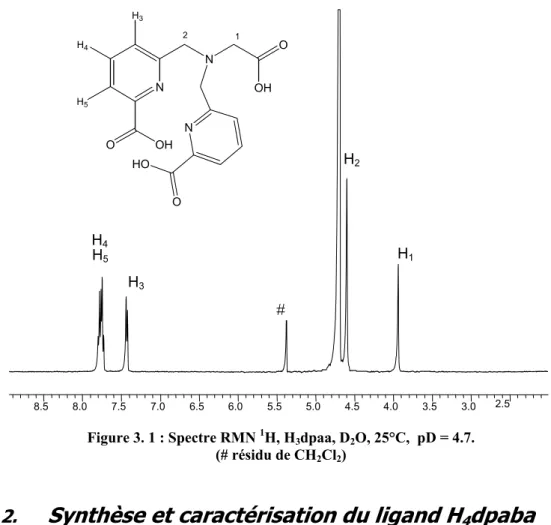
Ligands tripodes à pivot amine centrale 99 1. Synthèse et caractérisation du ligand H 3 dpaa 99
Conception des ligands
De nombreux exemples d'utilisation de cycles fonctionnalisés, de type DOTA4 ou DO3A3, ont été vus en introduction. Parmi eux, les polyaminocarboxylates linéaires dérivés de l'EDTA4- ou du DTPA5- ont été largement étudiés pour le développement d'agents de contraste.[14] Le principal inconvénient de ces systèmes est leur faible symétrie et leur grande flexibilité. Les motifs utilisés pour la chimie de coordination des lanthanides (III) ont été empruntés à la chimie des métaux de transition.
Le motif tren a été largement utilisé pour la complexation des métaux de transition[16-19], puis pour celle du Ln(III). Raymond a développé une série de ligands dérivés du tren-Me-3,2-hopo-ligand dont les complexes Gd(III) possèdent des propriétés de relaxation intéressantes.[15,20] Le principal avantage du motif tren réside dans la facilité de synthèse de ligands. et dans son adaptabilité. Ils sont utilisés depuis longtemps pour la complexation de métaux de transition tels que Cu(I)[22, 23] et Fe(II)[24] en vue de développer des modèles fonctionnels et structurels des sites actifs de métalloprotéines ou d'enzymes.
Wenk en 1967.[25] Les premiers tests utilisant le ligand tpa pour la complexation des lanthanides ont été réalisés en laboratoire. Des complexes stables 1:1 dans le méthanol ont été obtenus ; cependant, ils sont partiellement dissous dans l'eau.[26] Pour augmenter la stabilité du complexe, le ligand H3tpaa a été synthétisé et les complexes Gd(III) associés possèdent des propriétés de relaxation intéressantes.[27] Enfin, nous avons vu en introduction que le ligand 1,4,7-triazacyclononane ainsi que ses dérivés s'avèrent également être de bons ligands pour les métaux de transition et sont utilisés pour le développement de mimétiques de sites actifs de métalloprotéines.[28, 29] Dans . en particulier, la structure et les propriétés complexes de.

Ligands tripodes à pivot 1,4,7-triazacyclononane
- Synthèse et caractérisation des ligands à motif picolinate
- Etude bibliographique : réaction de bisubstitution
- Synthèse et caractérisation des ligands H 3 bpatcn, H 3 ebpatcn, H 4 pbpatcn et H 3 mpatcn
- Synthèse et caractérisation des ligands à motif hydroxyquinoléine
- Synthèse et caractérisation du ligand H 3 thqtcn
- Synthèse et caractérisation du ligand H 6 thqtcn-SO 3
Moore et al. [49] par réaction du tacn avec un excès de trifluoroacétate d'éthyle (Figure II. 10). Ils ont obtenu le composé tBu2NO2A par substitution nucléophile de l'ester bromoacétate de ter-butyle sur le tacn avec un rendement de 50 % (Figure II. 15). Les conditions réactionnelles ont été étudiées pour optimiser le rendement de bisubstitution d'une part et améliorer la reproductibilité de la synthèse d'autre part.
Après saponification des esters dans une solution eau/éthanol KOH, le ligand H3bpatcn est obtenu avec un rendement de 71% par cristallisation dans l'eau à pH 1,5 (Figure II. 18). Aime n'a obtenu qu'un rendement de 5 % pour la synthèse du ligand PCP2A par cette méthode.[75] Les deux ligands sont représentés sur la figure II. Le phosphite de tri-tert-butyle a été préalablement obtenu avec un rendement de 92% selon le mode opératoire décrit par H.
Ensuite, l'hydrolyse des esters dans une solution aqueuse de HCl 6 M suivie d'une purification par HPLC conduit au ligand H3mpatcn avec un rendement de 35 % (Figure II. 26). Le ligand H6thqtcn-SO3 a ainsi été synthétisé de manière similaire à partir du ligand H3thqtcn et est obtenu avec un rendement de 82% par précipitation dans l'éthanol (Figure II. 31).
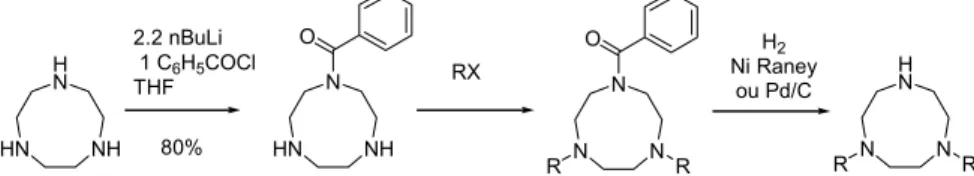
Ligands tripodes à pivot amine centrale
- Synthèse et caractérisation du ligand H 3 dpaa
- Synthèse et caractérisation du ligand H 4 dpaba
De la même manière, la réaction du dérivé chloré 3 avec l'ester méthylique de l'acide L-aspartique permet d'obtenir l'ester 14 avec un rendement de 78 %. Par cette méthode, le ligand H4dpaba est obtenu après cristallisation dans l'eau (pH 1,6), avec un rendement de 32% (Figure II. 35).
Chélates de Gd(III) mono-aqua
- Synthèse des complexes
- Etudes structurales en solution
- Etudes par RMN 1 H
- Détermination du nombre de molécules d’eau coordinées Nous avons vu que le nombre de molécules d’eau en première sphère de coordination pouvait être
- Protonation des ligands et stabilité des complexes
- Etude de la relaxivité
- Relaxivité du complexe [Gd(bpatcn)(H 2 O)]
- Relaxivité des complexes [Gd(ebpatcn)(H 2 O)] et [Gd(pbpatcn)(H 2 O)] -
Les effets de relaxation électronique sont d'autant plus importants que le champ est faible (T1e est proportionnel à B0²). Cette valeur sera vérifiée par la mesure de la relaxivité du complexe Gd(III) dans l'eau (voir § I.3.). Cependant, une diminution de la stabilité du complexe [Gd(ebpatcn)(H2O)] par rapport à son analogue [Gd(bpatcn)(H2O)] est attendue.
Une variation de 10 % de la valeur du paramètre b n'affecte le temps de relaxation électronique que de 5 %. Le profil de variation du taux de relaxation électronique longitudinal 1/T1e est représenté sur la figure III. Le taux d'échange des complexes a été déterminé à partir de la mesure des temps de relaxation.
32 : Taux de relaxation longitudinale (en rouge) et transversale (en bleu) du 17O en fonction de la température. Dans le cas du complexe [Gd(pbpatcn)(H2O)]-, les mesures RMN 1H ont indiqué une grande rigidité de la sphère de coordination.
![Figure III. 3 : Complexes mono-aqua analogues du [Gd(tpatcn)] étudiés ici.](https://thumb-eu.123doks.com/thumbv2/1bibliocom/464423.69927/116.892.253.636.452.548/figure-iii-complexes-mono-aqua-analogues-tpatcn-étudiés.webp)
Chélates de Gd(III) bis- et tris-aqua
- Synthèse et structure des complexes à l’état solide
- Complexe de Gd(III) avec le ligand dpaa 3-
- Etudes structurales en solution
- Etudes par RMN 1 H
- Détermination du nombre de molécules d’eau coordinées De même que pour les complexes décrits précédemment, le nombre de molécules d’eau dans la
- Etude de la relaxivité
- Nouvelle méthode de détermination rapide de k ex et τ R
- Relaxivité des complexes [Gd(dpaa)(H 2 O) 3 ], [Gd(dpaa) 2 (H 2 O)] 3- et [Gd(dpaba)(H 2 O) 2 ] -
- Relaxivité du complexe [Gd(mpatcn)(H 2 O) 2 ]
- Interactions avec les anions endogènes
- Interaction avec l’albumine sérique
- Relaxivité dans le sérum
La durée de vie observée indique la présence de trois molécules d'eau dans la sphère de coordination des complexes [Ln(dpaa)] (Ln = Eu, Tb et par extension Gd). Nous verrons ensuite que la relaxivité du complexe [Gd(dpaa)2]3- est cohérente avec la présence d'une molécule d'eau dans sa première sphère de coordination (§ II.3.2.). La relaxation de la sphère interne r1IS indique la présence d'une molécule d'eau dans la sphère de coordination du complexe.
La relaxivité de la sphère interne r1IS est cohérente avec les mesures de luminescence et la présence de deux molécules d'eau dans la sphère de coordination du complexe. La relaxivité des protons HOD d'une solution du complexe [Gd(mpatcn)(D2O)2] à 45 MHz et 25°C est cohérente avec la présence de deux molécules d'eau dans la première sphère de coordination. Pour les complexes [Gd(dpaba)(H2O)2] et [Gd(mpatcn)(H2O)2], une légère diminution de la relaxivité est observée, cohérente avec le déplacement d'une molécule d'eau.
Cela conduit à un ralentissement de la vitesse d'échange des molécules d'eau dans la première sphère de coordination. Cependant, une diminution de la relaxation est observée aux champs moyens (10 - 30 MHz), ce qui est cohérent avec le lent taux d'échange des molécules d'eau dans la première sphère de coordination. Ce résultat est cohérent avec l'échange rapide de molécules d'eau dans la sphère de coordination du complexe [Gd(ebpatcn)(H2O)].
Le nombre de molécules d'eau dans la première sphère de coordination du complexe libre a été déterminé au paragraphe II.2.2.

Complexes luminescents émettant dans le proche infrarouge 211 1. Exemples de complexes avec les ions Yb(III), Nd(III) et Er(III) 211


![Figure I. 21 : Exemples de nouveaux matériaux pour l’IRM : A) nanotube de carbone « monocouche », [54]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/464423.69927/47.892.154.739.507.957/figure-exemples-nouveaux-matériaux-irm-nanotube-carbone-monocouche.webp)

![Figure I. 38 : Premiers complexes d’Eu(III) commerciaux : à gauche, crypate d’Eu(III) avec le ligand TSP ; [95] à droite, complexe avec le ligand TMT](https://thumb-eu.123doks.com/thumbv2/1bibliocom/464423.69927/64.892.189.669.135.344/figure-premiers-complexes-commerciaux-gauche-crypate-ligand-complexe.webp)
