Je tiens à le remercier de m'avoir permis d'effectuer ce travail au sein de son unité. Je tiens à remercier M. Ali Ladram, Maître de Conférences à l'Université Paris VI, d'avoir accepté de faire partie de ce jury et de m'avoir soutenu tout au long de ma thèse. Je le remercie également de toujours m'avoir accordé de son temps et d'avoir veillé au bon déroulement de ce travail.
Je la remercie également pour sa contribution à ces travaux de recherche et pour avoir partagé avec moi son expérience en purification et spectrométrie de masse et pour tous les conseils scientifiques qu'elle m'a partagés.
La classe IIa 37
La classe IId : les bactériocines linéaires, non modifiées, non « pediocin-like » 70
Matériels et méthodes
Half maximal inhibitory concentration », Concentration maximale inhibitrice à 50 %
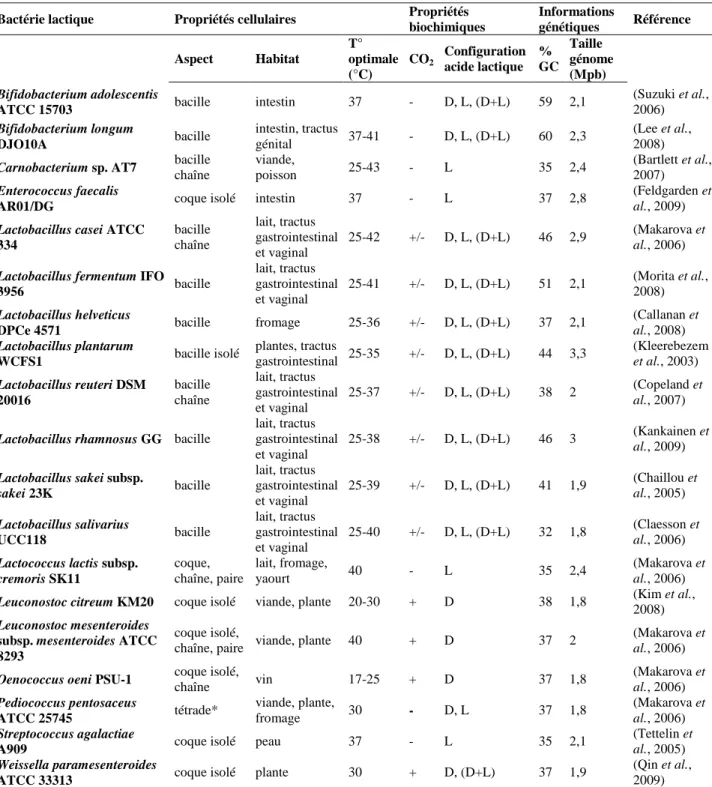
- Les bactéries lactiques
- Les peptides antimicrobiens produits par les bactéries à Gram positif
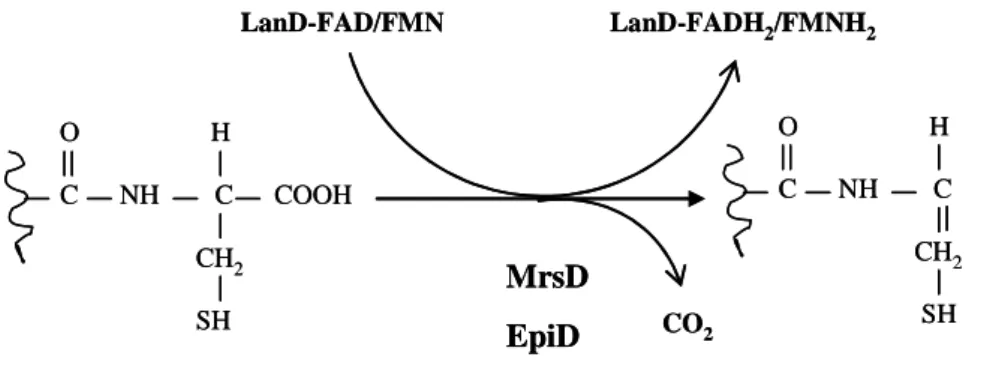
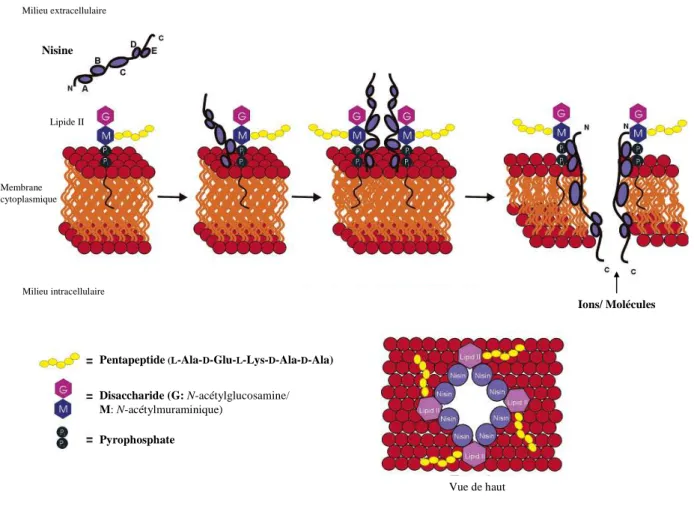
- Les bactériocines de classes I : les lantibiotiques
- Les bactériocines de classe II
- Les applications des bactériocines
- Méthodes bactériologiques
- Méthodes de biologie moléculaire
- MALDI-TOF
- Publication
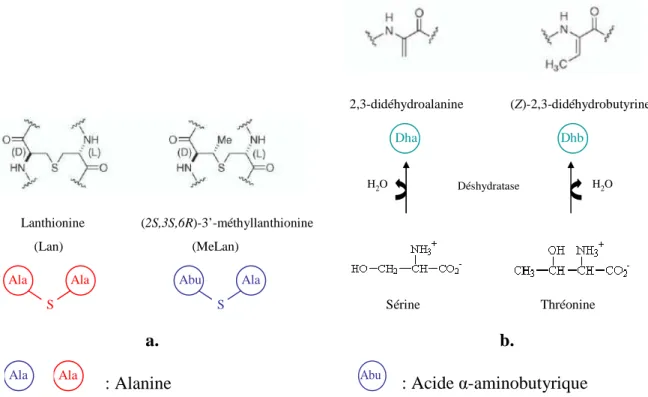
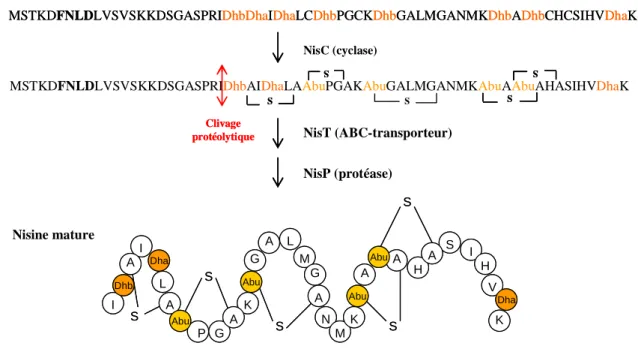
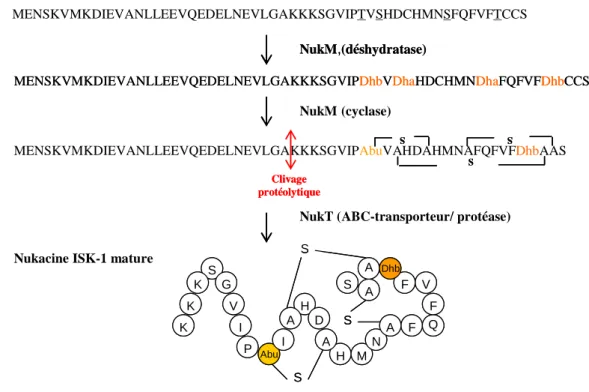
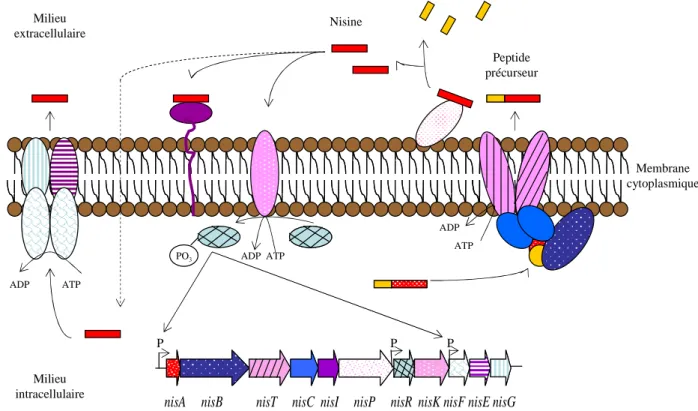
De plus, SpaR (LanR) et SpaK (LanK), impliqués dans la régulation de la biosynthèse de la subtiline, seraient fortement dépendants de σH (Stein et al., 2002). Le groupe impliqué dans l'exportation de la bactériocine contient des gènes codant pour un transporteur ABC (D), une protéine accessoire (E) et parfois une protéine de fonction inconnue (C) (Nes et al., 1996). Cela serait probablement dû à la flexibilité de la queue C-terminale des protéines immunitaires (Johnsen et al., 2005b).
Enfin, le gène as-48B sera impliqué dans la maturation de la bactériocine (Martinez-Bueno et al., 1998) (Figure I. 36).
Many food-approved microorganisms are used to produce a variety of fermented foods, including lactic acid bacteria (LAB). LAB inhibit food spoilage bacteria by producing lactic acid and growth-inhibiting peptides called bacteriocins. Many LAB-producing antimicrobial compounds have been isolated from this beverage, such as Leuconostoc, which produces peptides active against Listeria, a pathogen responsible for animal and human disease.
We isolated here a bacteriocin-producing bacterium from boza, which we identified as Leuconostoc pseudomesenteroides KM432Bz. The plasmid-located gene cluster encoding a precursor, an immunity protein, an ATP-dependent transporter and an accessory factor involved in bacteriocin biosynthesis was identified and analyzed. Leucocin KM432Bz inhibits the growth of related species as well as pathogens such as Listeria, Enterococcus and Streptococcus species with minimal inhibitory concentrations included in the 0.75-2.5 µM range.
Antimicrobial assay on mutated σ54 Listeria monocytogenes was performed using leucocin KM432Bz to confirm that σ54 is required for its mode of action. Keywords: boza, antimicrobial peptide, lactic acid bacteria, leucocin KM432Bz, Leuconostoc pseudomesenteroides, biosynthesis gene cluster.
Highlights
Introduction
It is produced from fermented grains, such as corn, wheat or millet, with lactic acid bacteria of the genera Lactobacillus, Lactococcus, Leuconostoc and Pediococcus (Gotcheva et al., 2000; Hancioğlu et al., 1997; Kabadjova et al., 2000). ). Due to its popularity, a number of studies on boza have been conducted and many lactic acid bacteria have been isolated and described (Kabadjova et al., 2000, Todorov et al., 2004b, von Mollendorff et al., 2006). In one study, as many as 33 strains isolated from boza showed antibacterial activity against several Gram-positive bacteria, including the food pathogens Listeria innocua, and Gram-negative bacteria such as Escherichia coli (Kabadjova et al., 2000).
Another study reports the probiotic properties of eight strains isolated from boza, including survival in conditions simulating the digestive tract and production of antibacterial and antiviral compounds (Todorov et al., 2008). Bacteriocins are defined as ribosomally synthesized antimicrobial peptides produced by bacteria (Cotter et al., 2005, Tagg et al., 1976) and exhibiting antagonism against phylogenetically related species (Jack et al., 1995). Bacteriocins have been isolated from different food matrices such as fermented products, vegetables, fruits, meat and fish, and have mostly been studied among lactic acid bacteria.
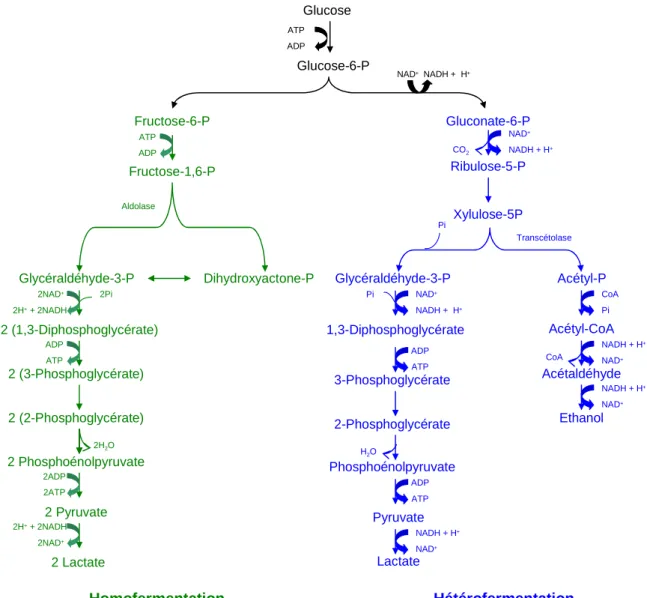
Potential biotechnological applications of bacteriocins produced by lactic acid bacteria include their use as natural food preservatives (Abee et al., 1995, Settanni et al., 2008, Stiles, 1996). Bacteriocins can be divided into two main classes based on genetic and biochemical characteristics (Cotter et al., 2005). Gene clusters encoding bacteriocin synthesis generally include a structural gene, gene(s) involved in the immunity of the producer strain, gene(s) encoding transport proteins, and gene(s) required for -e) for production regulation (Ennahar et al., 2000). , Klaenhammer, 1993).
Other bacteriocins, produced by strains of Pediococcus pentosaceus, Lactobacillus plantarum, Lactobacillus paracasei, Lactobacillus rhamnosus and Lactobacillus pentosus have been reported from boza. The molecular masses of bovine bacteriocins range from 2.8 to 14 kDa, but the amino acid sequences, genetic clusters, or modes of action were not determined for any of them (von Mollendorff et al., 2006).
Materials and methods
The producing strain KM432Bz was grown overnight without agitation in 2 L MRS broth at 30 °C. Culture supernatants were separated from bacterial cells by centrifugation at 8,000 x g for 15 min at 4 °C and heated at 80 °C for 10 min. The column was previously regenerated with 80% (v/v) isopropanol in 25 mM ammonium acetate buffer pH 6.5, and washed with 200 ml of 25mM ammonium acetate buffer pH 6.5.
The bacteriocin-containing fractions (50 ml) were identified by performing the previously described radial diffusion assays using 5 µl of each fraction. Active fractions were lyophilized and purified by reverse phase high performance liquid chromatography (RP-HPLC) on an Inertsil ODS2. The tricine-SDS-PAGE gel containing the active sample was overlaid with Brain Heart Infusion (BHI) soft agar inoculated with 10 6 CFU/ml Li.
The purified peptide was subjected to reduction and alkylation using procedures already described (Bulet et al., 1992). Fractions containing KM432Bz leucocin were analyzed by matrix-assisted laser desorption ionization-time-of-flight mass spectrometry (MALDI-TOF-MS) on a Voyager-De-Pro MALDI-TOF mass spectrometer (applied positive Biosystem mode) , using α-cyano-4-hydroxycinnamic acid as a matrix. ESI-MS and MS-MS analyzes using nanoelectrospray mass spectrometry were performed on a hybrid qQ-TOF mass spectrometer (Q-Star Pulsar; Applied Biosystems, Courtaboeuf, France) operating in positive mode.
The detection wavelength was set at 226 nm and the ESI source was operated in positive mode with a spray voltage of 100 eV. Amplifications by PCR were performed with 1 UE Taq DNA polymerase (Promega), 100 nM of each primer (forward and reverse), 10 µM of each dNTP (Promega), 20 mM MgCl2 (Promega) in 1X buffer (Promega) and 1 µL of DNA.
Results and discussion
The sequence of the bacteriocin KM432Bz was also analyzed by mass spectrometry from a digestion with the GluC endoproteinase (Fig. 4, arrow). In order to determine whether the sequence of the leucocin KM432Bz leader peptide was similar to that of leucocin A or B, we attempted to sequence the gene cluster encoding leucocin KM432Bz. The general organization of the gene cluster encoding leucocin KM432Bz appears to follow the same pattern as that of leucocin A from Ln.
Translation of the nucleotide sequence of the structural gene revealed that the leader peptide was similar to that of leucocin B and leucocin A-QU15 (Figure 4). If this is the case, it does not appear to affect the regulation of KM432Bz leucocin production in this strain. Production of leucocin/mesentericin-type bacteriocins may be a general feature of Leuconostoc sp.
Molecular characterization of genes involved in the production of the bacteriocin leucocin A from Leuconostoc gelidum. Black letters show the sequence of the mature peptide and light gray letters the sequence of the leader peptide. The sequence of the leader peptide of leucocin KM432Bz was obtained by translation of the nucleotide sequence.
Cysteines involved in the formation of the conserved disulfide bridge are shown on a dark gray background. Organization of the gene cluster involved in the production and immunity of leucocin A-UAL 187 produced by Ln.
Synthèse des résultats
Le gène codant pour le précurseur de la leucocine KM432Bz a été amplifié par PCR à l'aide d'amorces dégénérées (preleuB-F et preleuB-R), cloné dans le vecteur pGEM-T Easy Vector®, puis séquencé. La séquence nucléotidique du gène codant pour le précurseur de la leucocine KM432Bz est identique à celle de la leucocine B produite par Ln. Le gène codant pour le transporteur ABC, ainsi qu'une partie d'une protéine supplémentaire impliquée dans l'exportation de la bactériocine, ont également été identifiés (Fig. II. 3).
Il possède la même séquence nucléotidique que celle codant pour le précurseur la leucocine B produit par Ln. Le gène impliqué dans l'immunité est identique au gène impliqué dans l'immunité contre la leucocine A produite par Ln. Quant au gène codant pour le transporteur de leucocine ABC KM432Bz, il partage 96 % d’identité avec la leucocine A.
L'activité antimicrobienne de la leucocine KM432Bz a été testée à 10 µM sur gélose contre diverses bactéries Gram-positives et Gram-négatives. La leucocine KM432Bz est active sur des souches phylogénétiquement proches de la souche productrice (Figure I. 3), comme Lb. Nous avons ensuite testé l'effet de la leucocine KM432Bz sur la croissance de deux bactéries sensibles en milieu liquide : Lb.
La bactériocine a été ajoutée au début de la culture bactérienne (t0) ou au début de la phase exponentielle. Enfin, la leucocine KM432Bz exerce également un effet bactéricide sur la croissance de Lb.
Résultats complémentaires
Un contrôle positif a été réalisé en testant la leucocine KM432Bz en parallèle sur la souche Li. Afin d'étudier l'effet de la leucocine KM432Bz sur la formation de biofilm, des bactéries sensibles ont été cultivées en présence de bactériocine à 5 et 10 µM. Ce test a montré que la leucocine KM432Bz à des concentrations de 5 et 10 µM inhibait la formation de biofilm par Lb.
La leucocine KM432Bz inhibe la formation de biofilm dans deux souches phylogénétiquement proches de la souche productrice, à savoir Lb. Recherchez le gène codant pour le précurseur de la leucocine KM432Bz chez d’autres espèces de Leuconostoc. Toutes les bactéries testées montrent la présence d'une amplification d'un fragment du gène codant pour le précurseur de la leucocine KM432Bz, d'une taille d'environ 178 pb (Fig. II. 8).
Le séquençage nucléotidique a confirmé que le gène codant pour le précurseur de la leucocine KM432Bz avait la même séquence nucléotidique que celui codant pour la leucocine B/A-QU15. Toutes les souches bactériennes testées portaient le gène codant pour le précurseur de la leucocine KM432Bz. Nous avons déterminé le spectre d'activité de la leucocine KM432Bz en la testant sur gélose contre des bactéries phylogénétiquement.
Le séquençage du ou des fragments obtenus permettrait de comparer sa séquence avec celle de la leucocine KM432Bz. La détermination des CMI de la leucocine KM432Bz a permis de quantifier son activité antimicrobienne.