Je tiens à remercier toutes les personnes qui m'ont aidé un jour ou l'autre dans mon travail, notamment le personnel du Centre Commun de Microscopie Appliquée de la Faculté des Sciences de Nice. Je remercie également M. Michael Pusch et M. Bernard Rossi pour leur volonté d'examiner mon travail et de participer au jury de thèse.
L'ion chlorure dans l'homéostasie
Principaux mécanismes de transport ionique
En revanche, les cellules de mammifères ne disposent pas d'une ATPase pour transporter les ions chlorure (Gerencser, 1988). Au repos, le gradient électrochimique disparaît donc, mais reste relativement faible car le potentiel d'équilibre des ions chlorure (-65 mV > Ecl > -35 mV, selon les types cellulaires) est proche du potentiel de repos de la membrane. (Vm).
A la découverte des canaux chlorure
Rôles physiologiques des canaux chlorure
Stabilisation du potentiel de membrane
- Cellules nerveuses
- L'organe électrique du poisson torpille
- Cellules musculaires
- Caractérisation fonctionnelle de canaux chlorure musculaires
- Caractérisation moléculaire d’un canal chlorure musculaire: le ClC-1
- Cellules non-excitables
La nature moléculaire de ces canaux récepteurs de chlorure est connue (pour revue, Burt, 1994, Betz et al., 1999). Les canaux chlorure en question sont sensibles au NPPB et à la cromolyne (Romanin et al., 1991).

Transports transépithéliaux
- Rôles physiologiques des épithélia
- Mécanismes de transport ionique impliqués
- Canaux chlorure impliqués dans la sécrétion gastrique
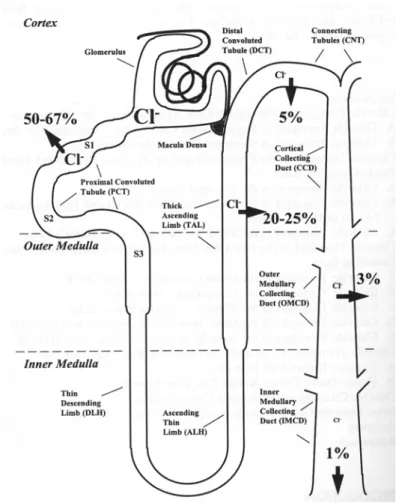
- Canaux chlorure impliqués dans la fonction rénale
Concernant l'excrétion du chlorure de sodium, le modèle présenté dans la figure 4 (emprunté à Frizzell et al., 1979) est dominant depuis une vingtaine d'années. Le clonage par homologie a permis l'isolement d'un membre de la famille ClC à partir d'une banque d'ADNc gastrique (Malinowska et al., 1995).

Régulation du volume cellulaire
- Origine des variations de volume
- Mécanismes de régulation du volume
- Caractéristiques du courant chlorure sensible au volume: I Cl swell ou I Cl vol
- Nature moléculaire du canal chlorure sensible au volume
- pICln
- p-glycoprotéine et autres transporteurs ABC
- Phospholemman
- ClC-2
- ClC-3
- Cas particulier des cellules stomatiques
La fonction de canal du phospholemman a ensuite été renforcée par la reconstitution de la protéine dans des bicouches lipidiques artificielles (Moorman et al., 1995). Sa sensibilité au volume cellulaire et son ubiquité confortaient l'hypothèse d'une implication dans la régulation du volume (Gründer et al., 1992).

Régulation du pH des organelles intracellulaires
- Mécanismes de transport impliqués au niveau des endomembranes
- Nature moléculaire des canaux chlorure
- Les canaux chlorure de la famille VDAC
- p64
- NCC27
- CFTR
- Protéines de la famille des ClC
Les protéines de la famille VDAC (Voltage-Dependant Anion-Selective Channel) constituent les voies. Le rôle physiologique de NCC27 dans la membrane nucléaire n'a pas encore été élucidé.

Présentation de la thématique et des objectifs
Modèle d'étude: la lignée cellulaire A6
La membrane basolatérale des cellules A6 contient également plusieurs voies de conduction des chlorures sensibles aux variations de volume cellulaire provoquées par un choc hypoosmotique (Banderali et Ehrenfeld, 1996). Les caractéristiques de régulation du volume et de transport transépithélial des cellules A6 sont similaires à celles des cellules des tubules distaux et des cellules des tubules collecteurs majeurs.

Thématique de recherche
L'activation des conductances basolatérales du chlorure et du potassium après le gonflement cellulaire permet aux cellules A6 d'assurer leur régulation volumique (Ehrenfeld et al., 1994 ; Brochiero et al., 1995 ; De Smet et al., 1995). Le fait que les cellules A6 aient conservé la réabsorption du sodium dans des conditions normales fait de cette lignée un modèle pour l'étude des fonctions du tubule distal, complémentaire de la lignée cellulaire MDCK, qui est également présumée provenir du tubule distal mais a perdu son transport transépithélial natif. propriétés.
Stratégie de clonage
Pour ClC-2, la structure de 10 à 12 domaines potentiellement transmembranaires et les résultats de reconstitution de ClC-0 publiés par Middleton et al. 1994) ont favorisé l'idée que ClC-2 pourrait représenter un canal chlorure. Les séquences dégénérées des amorces utilisées pour la PCR ont été définies en fonction des régions conservées des ADNc de la famille pICln ou ClC.
Présentation du travail de thèse
Nous avons ensuite étudié la glycosylation et la distribution tissulaire de la protéine chez Xenopus et/ou chez la souris. Pour cela, nous avons utilisé nos anticorps anti-xClC-3 ainsi que des anticorps polyclonaux dirigés contre une protéine de fusion contenant une partie du ClC-3 de rat.
Culture cellulaire
Constructions plasmidiques utilisées
Tout d'abord, l'ADNc xClC-5 avec ses régions non codantes natives a été sous-cloné dans le vecteur pGEM-T (Promega) en aval du promoteur de la polymérase T7. L'ADNc xClC-3 a été introduit dans le vecteur pIRES-CD8 (généreusement offert par le Dr M. Fink, Sophia Antipolis Valbonne, France) en aval d'un promoteur CMV et en amont de la surface de l'ADNc de la protéine CD8.

Expression fonctionnelle dans l'ovocyte de xénope
- Transcription in vitro
- Prélèvement et traitement des ovocytes
- Injection des ovocytes
- Voltage-clamp en double micro-électrodes
- Substances pharmacologiques
- Composition des milieux
L'observation microscopique de ces ovocytes permet de visualiser des cellules folliculaires résiduelles à la surface des ovocytes (Figure 19). L'expérience est généralement réalisée en milieu ISO 95, à l'exception des chocs hypo-osmotiques qui ont été réalisés en exposant les ovocytes au milieu HYPO 70.

Expression dans la lignée cellulaire HEK
Traduction in vitro
Immunodétection par Western blot
- Les anticorps primaires et leur purification
- L'anticorps secondaire
- Préparation des fractions membranaires
- SDS-PAGE
- Electrotransfert sur membrane de nitrocellulose
- Immunodétection
Le travail sur glace est maintenu tout au long de la préparation des fractions membranaires. Ce gel permet une migration rapide lorsque les protéines pénètrent dans le gel depuis le puits (gel "empilage"). La saturation de la membrane réduit considérablement la liaison des anticorps non spécifiques.
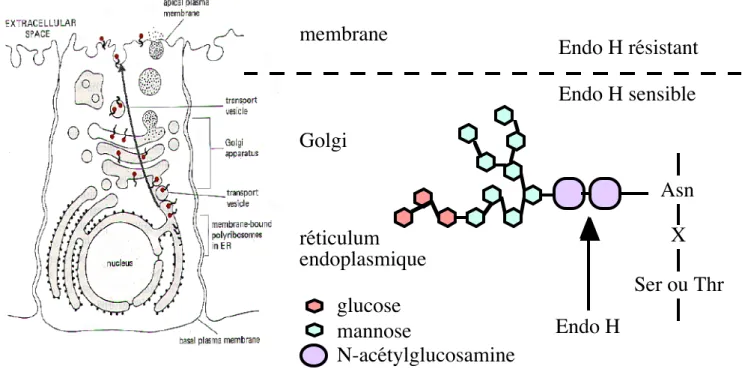
Etude de la glycosylation des protéines
- Déglycosylations enzymatiques
- Inhibition de la glycosylation par la tunicamycine
L'autoradiographie de la membrane avec le film BioMax MR-1 (Kodak) permet la visualisation du signal chimiluminescent. La sensibilité aux différentes enzymes est déterminée en comparant la migration de la protéine traitée par rapport à la protéine non traitée. Nous avons utilisé la tunicamycine pour étudier la glycosylation de la protéine xClC-5, exprimée dans l'ovocyte de Xenopus.
Immunocytochimie
- Fixation et perméabilisation des cellules
- Immunomarquage
Les cellules sont ensuite exposées pendant 2 heures à des anticorps primaires (de lapin) à la dilution appropriée. L'excès d'anticorps est lavé par 3 bains de 10 minutes et les anticorps spécifiquement liés sont reconnus par des anticorps secondaires anti-lapin (chèvre ou mouton, Sigma) conjugués à des sondes fluorescentes telles que le FITC (isothiocyanate de fluorescéine) ou le dérivé Cy3. Enfin, les cellules sont montées entre lames et lamelles avec un milieu de montage spécial conçu pour limiter le phénomène de « blanchiment », c'est-à-dire l'extinction de la fluorescence après une exposition prolongée à des rayons UV excitants. .
Microscopie
Les noyaux des cellules peuvent éventuellement être marqués avec l'agent intercalant l'ADN, Hoechst 33342 (Molecular Probes). Pour cela, une incubation de 5 minutes à 1 µg/ml, suivie de plusieurs lavages des cellules à l'eau distillée, suffit.

Caractérisation fonctionnelle et distribution du xClC-5
Caractéristiques moléculaires du xClC-5
L'analyse de l'hydrophobie de la protéine a été réalisée selon la méthode décrite par Kyte et Doolittle (1982). En revanche, les deux autres sites seront localisés sur des boucles extracellulaires et pourront être soumis à une N-glycosylation lors de la maturation post-traductionnelle de la protéine. Par conséquent, si l'on considère que la protéine commence à la cinquième méthionine, le pourcentage d'identité avec hClC-5 augmente à 84 %.
Expression fonctionnelle du xClC-5 dans l'ovocyte de xénope
- Injection de l'ARNc du xClC-5
- Injection de l'ARNc du xClC-5
- Etude comparative du I Cl swell
- Traduction in vitro des constructions plasmidiques
- Immunodétection du xClC-5 dans l'ovocyte de xénope
- Discussion
Les caractéristiques de conductance obtenues en injectant les ARNc xClC-5 présentant les régions natives non codantes sont similaires à celles décrites pour un courant endogène vers l'ovocyte, appelé gonflement ICl. Le profil pharmacologique du gonflement de l'ICl est similaire à celui de la conductance observée dans les ovocytes injectés avec l'ARNc xClC-5 présentant les régions natives non codantes. En revanche, la synthèse de la protéine xClC-5 est obtenue par injection d'ARNc, qui présente les régions non codantes de la β-globine et un site consensus Kozak.

Identification des différentes glycoformes du xClC-5
- Déglycosylation par traitement enzymatique
- Inhibition de la glycosylation par la tunicamycine
- Discussion
En effet, l’absence de N-glycosylation peut bloquer l’exportation de la protéine depuis le réticulum endoplasmique. En résumé, nous avons montré l'existence de différentes formes N-glycosylées de la protéine xClC-5, lorsqu'elle est exprimée dans l'ovocyte de Xenopus. La N-glycosylation de la protéine est impliquée dans l'établissement de l'activité des canaux dans l'ovocyte de Xenopus.
Etude de voies de signalisation
- AMPc et Ca 2+ intracellulaires. Voies protéines kinases A et C
- Voies tyrosine protéines kinases
- Effet inhibiteur de la génistéine
- Autres inhibiteurs de tyrosine protéines kinases et phosphatases
- Discussion
En effet, l'inhibition des tyrosine protéine kinases par la génistéine est compétitive au niveau du site de liaison de l'ATP (Ki = 13,7 µM selon Akiyama et Ogawara, 1991). L'implication d'une voie tyrosine protéine kinase suggère que l'on observe une stimulation du courant en présence d'inhibiteurs des tyrosine protéine phosphatases. Initialement, la génistéine est connue pour ses actions inhibitrices sur diverses tyrosine protéines kinases.

Inhibition par les ions métalliques
- Résultats
- Discussion
En revanche, l'inhibition du ClC-1 par les ions métalliques a une IC5 0 cent fois supérieure à celle du ClC-0 et semble irréversible. Quelle est la signification physiologique de la sensibilité du ClC aux ions métalliques ? Pour l’heure, le rôle physiologique de la sensibilité du ClC aux ions métalliques reste mal compris.
Sensibilité au pH
- pH extracellulaire
- pH intracellulaire
- Discussion
Cette dépolarisation correspond probablement à l'inhibition par le pH extracellulaire d'une conductance potassique de la membrane plasmique ( Burckhardt et al., 1992 ). D'autre part, l'inhibition de la conductance du sodium est considérée comme un effet de la régulation du pH intracellulaire par Chalfant et al. Le canal potassique TASK a été proposé comme capteur de pH extracellulaire par Duprat et al.

Distribution tissulaire et localisation cellulaire du ClC-5
- Spécificité des anticorps anti-xClC-5
- Distribution tissulaire du ClC-5
- Localisation cellulaire
- Discussion
Nous ne pouvons pas exclure une reconnaissance simultanée de xClC-3, spécifiquement exprimé dans les cellules A6 (voir Partie 2). Plus tard, Günther et al. 1998) ont confirmé au niveau protéique que l'expression du ClC-5 des mammifères se produit essentiellement dans le rein. Le marquage que nous avons obtenu sur les cellules A6 avec nos anticorps anti-xClC-5 est donc proche du ClC-5 dans le rein du rat.

Vers un modèle fonctionnel du ClC-5
- ClC-5 et pathologies rénales
- Apports de la caractérisation fonctionnelle du ClC-5
- Apports des études de localisation tissulaire et cellulaire
- Apports des modèles animaux transgéniques
Chez l'homme, l'expression de ClC-5 prédomine dans le rein et son dysfonctionnement altère la fonction rénale. Des études de localisation du ClC-5 dans le rein du rat ont montré qu'il est exprimé dans les endosomes précoces du tubule proximal et de la branche ascendante de l'anse de Henle, ainsi que dans les cellules intercalées du tubule collecteur. Dans ce modèle, l'inhibition de ClC-5 par un pH acide pourrait jouer un rôle de rétroaction négative, limitant l'acidification des endosomes et permettant de fixer le pH (Friedrich et al., 1999).

Expression et distribution du ClC-3
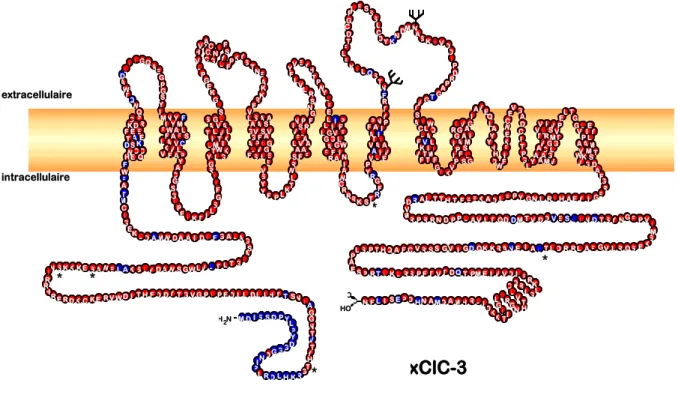
Caractéristiques moléculaires du xClC-3
L'analyse d'hydrophobicité selon Kyte et Doolittle (1982) montre que xClC-3 possède des régions hydrophobes hautement homologues aux régions hydrophobes des autres membres de la famille ClC. xClC-3 semble donc partager l'organisation structurelle en 10 à 12 domaines transmembranaires, caractéristiques de la famille ClC (Figure 50). Étant donné que xClC-3 est membre du phylum ClC-3/4/5 de la famille ClC, ses homologies de séquence nucléotidique avec d'autres membres de ce phylum sont également élevées.
Expression (fonctionnelle?) du xClC-3
- Approche électrophysiologique
- Traduction in vitro des constructions plasmidiques
- Immunodétection du xClC-3 dans l'ovocyte de xénope
- Mise en évidence de différentes glycoformes de xClC-3
- Expression du xClC-3 dans la lignée cellulaire HEK 293
L'immunodétection de xClC-5 dans l'ovocyte a également révélé plusieurs formes de protéines, qui se sont révélées être des glycoformes de la protéine. Les cellules HEK 293 ont été transfectées de manière transitoire et l'expression de xClC-3 et CD8 a été surveillée. Tout d'abord, nous avons vérifié la synthèse de la protéine xClC-3 dans des cellules injectées avec les ARNc ou transfectées avec l'ADNc à l'aide d'anticorps polyclonaux dirigés contre le peptide C-terminal de xClC-3.
Distribution tissulaire et localisation cellulaire du ClC-3
- Spécificité des anticorps anti-ClC-3
- Etude du ClC-3 chez la souris
Par conséquent, j’ai d’abord examiné l’expression de la protéine ClC-3 dans le cerveau et le cervelet de souris. En résumé, nous proposons la première étude au niveau protéique de la distribution tissulaire de ClC-3. Il sera intéressant de déterminer si cela correspond à la diversité fonctionnelle de la protéine dans les différents tissus.

Discussion générale
- Le ClC-3 est-il impliqué dans la régulation du volume?
- Le ClC-3 constitue-t-il un canal intracellulaire?
Cependant, les expériences d'immunolocalisation de ClC-6 montrent une localisation intracellulaire au niveau du réticulum endoplasmique (Buyse et al., 1998). Brygoo-Barbier sur la protéine ClC-Nt1, clonée dans le tabac Nicotiana tabacum (Lurin et al., 1996). Ce travail indique la localisation intracellulaire de ClC-Nt1, au niveau des mitochondries (Lurin et al., 2000).

Variété fonctionnelle des canaux chlorure
Variété moléculaire des canaux chlorure
Apports de notre étude
Les résultats obtenus ouvrent de nouvelles perspectives, notamment en ce qui concerne la régulation de ClC-5, qui pourraient à l’avenir contribuer à étayer notre compréhension de la fonction et du rôle physiologique de ClC-5. Nos tentatives pour exprimer fonctionnellement xClC-3 dans l’ovocyte de Xenopus, ainsi que dans les cellules HEK 293, se sont soldées par un échec. Comme je disposais d'anticorps dirigés contre xClC-3 et d'anticorps dirigés contre son homologue de mammifère, rClC-3, j'ai pu étudier l'état de glycosylation de ces protéines homologues, ainsi que la distribution tissulaire de ClC-3 chez la souris. .
Perspectives
- Perspectives concernant l'étude du ClC-5
- Perspectives concernant l'étude du ClC-3
ClC-6 and ClC-7 are two new widely expressed members of the ClC chloride channel family. Regions involved in the opening of the ClC-2 chloride channel by voltage and cell volume. Role of innervation, excitability, and myogenic factors in expression of the muscle chloride channel ClC-1.