Another method in mass spectrometry that allows elucidating the structure of a molecule is collision-induced dissociation [4,5]. In the latter case, this may be due to a difference in the nature of the gas. To elucidate the origin of [MhaCzH2H2O]zCion isobaric with [MCzHH2O]zCion, CID was performed in a collision cell on mass-selected [MhaC2H]2C and [MC2H]2C ions corresponding to the 9-mer peptide aldehyde (data not shown).
This confirms that the fragmentation of the [MhaCzH]zC initially leads to a first loss of H2O to form an ion isobar with [MCzH]zC, which subsequently loses a second H2O. The influence of the location of the modified base on the fragmentation has been shown [9,10] as well as the effect of the charge state of the studied ion [11,12]. We show that the location of the brominated base in the ODN sequence can be determined by in-source collision-induced dissociation (CID).
Selective loss of the brominated base located at the 2-position of the 5'-side versus 3'-side. This corresponds to the loss of the BrdU base, leading to the [M-zH-BrdU]z- anions. Note that the internal positions (6, 8 and 10) are compromised for the loss of the modified base.
Only at low cone voltage did mass spectrometry experiments establish the integrity of the brominated ODNs. In-source fragmentation of ODNs brominated at position 2 from 5' or 3' end as a function of the cone voltage.

INTRODUCTION A LA FRAGMENTATION DE BIOMOLECULES
Spectromètre de masse quadripolaire en ionisation électrospray (ESI-MS)
- Principe de l'ionisation électrospray (ESI)
- Spectres de masse obtenus par ionisation électrospray
- Principe de l'analyseur quadripolaire (Q)
Dissociation induite par collision (CID)
- Processus de collision
- Spectrométrie de masse en tandem (MS/MS)
- a. Collision à haute énergie
- b. Collision à basse énergie
- c. Spectromètre de masse triple quadripolaire (TQ)
- Dissociation induite par collision dans la source
- a. Principe de la collision dans la source
- b. Paramètres influençant la CID dans la source
- b.1. Tension appliquée sur le cône d'échantillonnage (Vc) ou sur l' 'orifice plate' (Vop)
- b.2. Géométrie de la source
- b.3. Gaz résiduel
- b.4. Température et pression dans la source
- b.5. Phase mobile
- Comparaison entre la CID dans la cellule de collision et la CID dans la source
- a. Comparaison entre les deux modes de fragmentation
- b. Conclusion
Fragmentation de biomolécules en spectrométrie de masse
- Les peptides
- a. Schémas de fragmentation
- b. Composition de la séquence
- c. Modèle du 'proton mobile'
- Les oligonucléotides
- a. Schémas de fragmentation
- b. Composition de la séquence
Revue
COMPARAISON DE LA FRAGMENTATION DANS LA SOURCE
- Présentation des peptides thioester modèles
- Comparaison de la fragmentation dans la source avec la fragmentation obtenue
- Efficacité de fragmentation en fonction de la longueur du peptide
- Conclusion
- Publication
La fragmentation dans la source électrospray fournit des informations structurelles similaires à la fragmentation dans la cellule de collision d'un instrument de type triple quadripôle. 1999] qui ont comparé la fragmentation dans la source électrospray d'une plate-forme quadripôle unique II (Micromass) avec la fragmentation dans la cellule de collision d'un Quattro II (Micromass) et par Sadagopan et Watson [2000] qui ont comparé la fragmentation dans la source électrospray de une Plateforme VG (Fison) et une LCQ (Finnigan) avec fragmentation dans la cellule de collision dans une API 2000 (PE Sciex). Nous avons comparé la fragmentation dans la source électrospray et la fragmentation dans la cellule de collision du spectromètre sur lequel toutes les études décrites dans cette thèse ont été réalisées : un instrument de type triple quadripôle (Quattro II, Micromass).
Comparaison de la fragmentation dans la source avec la fragmentation obtenue dans la cellule de collision. La fragmentation obtenue dans la cellule de collision. Chacun des cinq peptides thioesters (Tableau 1) a été fragmenté dans la source d'électrospray et dans la cellule de collision. La fragmentation dans la source est obtenue en augmentant la tension appliquée au cône d'échantillonnage (Vc) de 10 à 120 V et la fragmentation dans la cellule de collision est obtenue en faisant varier la tension appliquée à la cellule de collision balayée uniquement en radiofréquence (Vcell) de 0 à 54 V.
Dans ce chapitre nous avons comparé la fragmentation des peptides thioesters dans la source d'électrospray et leur fragmentation dans la cellule de collision d'un instrument de type triple quadripôle (Quattro II, Micromass).
![Figure 1 : Spectres de masse du peptide thioester Leu 2 SEt obtenu par fragmentation dans la source à Vc=35 V (a) et par CID dans la cellule de collision de [M+H] + à Vcell=10 V (b)](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465555.70706/62.892.127.786.106.316/figure-spectres-peptide-thioester-obtenu-fragmentation-cellule-collision.webp)
FRAGMENTATION DANS LA SOURCE ELECTROSPRAY DE
Fragmentation de peptides acétal et aldéhyde
- Présentation des peptides étudiés
- Comparaison entre les peptides acétal et les peptides aldéhyde
- Comparaison de la fragmentation des peptides acétal et aldéhyde dans la source et dans la
- Etude de la fragmentation dans la source des peptides acétal et aldéhyde
- Publication
- Mécanisme de fragmentation des peptides acétal et aldéhyde
The most striking observation of CID peptide aldehydes in the origin is the superposition of the aldehyde and hydrogenated aldehyde ion curves (Figure 4). This is consistent with the fact that multi-charged ions fragment more easily.20,29 We also evaluated the influence of mass on the fragmentation of peptide aldehydes in the source. The stability of the equilibrium between the peptide aldehyde and its hydrated form was further investigated for five peptide aldehydes as a function of cone tension.
These in-source CID processes were revealed to be more efficient when the m/z ratio of the peptide ion is low. The fragmentation of peptide acetals and peptide diols, corresponding to the hydrated form of the peptide aldehyde, is dominated by the successive losses of two molecules of MeOH and water, respectively. Using in-source CID, we concluded that the loss of the C-terminal functionalization, reflected by the two consecutive losses of MeOH and H2O,.
2(c)) of the picture of the equilibrium in solution between a peptide aldehyde and its hydrated form, as already reported.3.
![Figure 1 : Spectres de masse du peptide [ald↔diol] 33-mer obtenus à Vc=15 V (a), Vc=45 V (b) et Vc=60 V (c)](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465555.70706/77.892.280.691.100.816/figure-spectres-masse-peptide-ald-diol-mer-obtenus.webp)
Hydratation de peptides aldéhyde et cétone et réaction d'oximation
- Etude de l'hydratation de peptides aldéhyde et cétone
- a. Peptides modèles
- a.1. Présentation des peptides modèles
- a.2. Etude de l'hydratation des peptides par fragmentation dans la source
- a.3. Etude de l'hydratation des peptides par résonance magnétique nucléaire (RMN)
- b. Peptides naturels
- b.1. Présentation des peptides
- b.2. Etude de l'hydratation des peptides par fragmentation dans la source
- b.3. Etude de l'hydratation des peptides par résonance magnétique nucléaire
- c. Discussion
- Ligation chimique par liaison oxime
- a. Cinétique de la réaction de ligation suivie par HPLC
- a.1. Cinétique de la réaction de ligation suivie par HPLC pour les peptides modèles
- a.2. Cinétique de la réaction de ligation suivie par HPLC pour les peptides naturels
- b. Discussion
- c. Conclusion
Cinétique de réaction de ligature surveillée par HPLC pour les peptides modèles Peptides modèles. Nous avons surveillé la cinétique de la réaction de ligature entre les peptides modèles (Tableau 3) en excès et le peptide aminooxy par HPLC. Cinétique de la réaction de ligature suivie par HPLC pour les peptides naturels.
Nous avons suivi par HPLC la cinétique de la réaction de ligature entre les peptides naturels (Tableau 6) en excès et l'aminooxypeptide selon le même mode opératoire que pour. La première étape de la réaction de ligation (schéma 4) correspond à une addition nucléophile au groupe carbonyle et à la protonation de l'oxygène, induisant la formation d'une forme tétraédrique carbinolamine, et la deuxième étape correspond à la protonation de l'hydroxyle dans ce tétraédrique. forme, suivie au départ d'une molécule d'eau pour conduire à la formation de l'oxime (schéma 5). Ainsi, la première étape de la réaction de ligature semble être l’étape limitante pour les peptides cétoniques.
La première étape de la réaction de couplage semble être l’étape limitante pour les peptides cétoniques.

FRAGMENTATION DANS LA SOURCE ELECTROSPRAY
Présentation des oligodésoxynucléotides
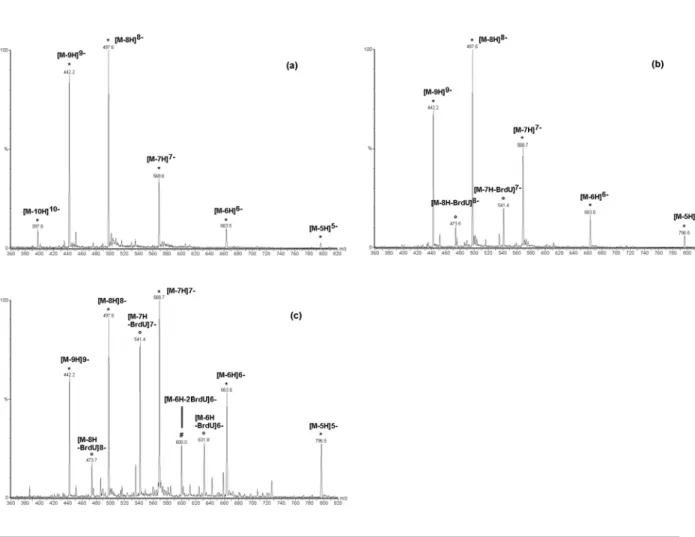
L'intégrité de la séquence de cet oligodésoxynucléotide a été établie par spectrométrie de masse en mode négatif, mais uniquement à une très faible tension appliquée au cône d'échantillonnage (-15V) (Figure 1a). Habituellement, dans notre laboratoire, la masse des oligonucléotides est déterminée sans fragmentation à des valeurs Vc comprises entre -25 et -30V. Cependant, dans le cas présent, à Vc=-25V, cet ODN se fragmente, perdant une première base bromée (Figure 1b), puis à Vc=-35V, une seconde base bromée (Figure 1c).
Le * correspond aux ions de l'ODN étudié, ° aux ions de l'ODN ayant perdu une base bromée et # aux ions de l'ODN ayant perdu deux bases bromées. La fragmentation de cet ODN étant précoce et inattendue, nous avons étudié le comportement de plusieurs ODN monobromés (Tableau 1) en modifiant la valeur de Vc de -90V à -10V. La séquence de ces oligodésoxynucléotides est la plus proche possible de la séquence initiale (séquence 0).
L'ensemble de l'étude a été réalisée en mode négatif et les valeurs Vc seront exprimées en termes relatifs dans la suite de ce rapport.
Publication
Low cone stress fragmentation produces a loss of the brominated base with a preferential loss for the modified base closed to the 5' end (2-position>4-position>12-position) as well as a preferential loss of BrdU over BrdC. The fragment anions resulting from the loss of the BrdU base are more intense for 5'-d(CBrUCTTTGTTTCUC)-3' (Figure 1c) than for 5'-d(CUCTTTGTTTCBrUC)-3' (Figure 1d). To verify the selective loss of the brominated base at the 2-position from the 5' side, a detailed study was performed using collision-induced dissociation (CID) in the source.
Likewise, the loss of the brominated base is seen at 30V for 5'-d(CUCTTTGTTTTCBrUC)-3' (Figure 2a) and at 38V for 5'- d(CUCTTTGTTTTCBrCC)-3' (Figure 2b) giving the same order of preference for loss of the modified base at position 2 from the 3' end. Partition plots corresponding to loss of the BrdU base by ODNs modified at position and 12 were generated. These ions are characteristic of backbone fragmentation resulting from loss of the modified base at the 2-position.
At medium cone tension, the largest fragmentation of ODNs modified by BrdU at different positions corresponds to the loss of the modified pyrimidine base.

Résultat complémentaire
S'il est situé à l'intérieur, l'oligodésoxynucléotide sera moins sujet à la fragmentation que s'il était situé à une extrémité de la séquence. Dans le cas où les rayons X provoquent une perte de brome ou de base bromée, vérifiée par spectrométrie de masse, il sera intéressant de poursuivre cette étude pour savoir si l'on peut trouver des doses de rayonnement qui ne causent pas de dégâts. La première étape de la réaction de ligature semble être l’étape limitante pour les peptides cétoniques en raison de l’encombrement stérique de la fonction carbonyle.
Concernant les peptides aldéhydiques, la deuxième étape de la réaction de ligation apparaît cruciale en raison de la basicité de l'oxygène de la fonction hydroxyle. L'étude des oligodésoxynucléotides bromés, cette fois en mode négatif, par fragmentation dans la source ESI, a abouti à la perte de la base bromée. Cette perte est favorisée lorsque la base modifiée est située en fin de séquence plutôt qu'en interne.
Les ions fragments correspondant aux ions complémentaires (an-Bn) et wm proches de la base bromée permettent ainsi de localiser l'emplacement de la base modifiée dans la séquence.
Etude de peptides thioester (chapitre II)
Les analyses par spectrométrie de masse ont été effectuées sur un spectromètre de masse triple quadripôle (Quattro II, Waters) équipé d'une source d'ionisation par électrospray.
Etude de peptides acétal et aldéhyde (paragraphe I du chapitre II)
- Obtention des peptides aldéhyde
- Paramètres d'analyse en spectrométrie de masse
Etude des peptides aldéhyde et cétone (paragraphe II du chapitre II)
- Obtention des peptides aldéhyde à partir de peptides acétal
- Quantification des peptides aldéhyde
- Paramètres d'analyse en spectrométrie de masse
- Paramètres d'analyse en RMN
- Ligation chimique suivie par HPLC
- a. Ligation chimique
- b. Méthode chromatographique
Chaque peptide est dissous dans 80/20 acétonitrile/acétate d'ammonium 5 mM ajusté à pH 4,6 avec de l'acide acétique à la concentration de 100 pmol/μl pour les peptides P1, P2 et P3 et à la concentration de 200 pmol/μl pour les peptides P4. . P5 et P6. 3 µl de chaque peptide sont injectés par une vanne Rheodyne 7125 avec une boucle de 10 µl et élués avec un mélange acétonitrile/eau 80/20 à 20 µl/min dans le spectromètre de masse. La résonance magnétique nucléaire est une technique extrêmement puissante pour déterminer la structure des molécules.
Les solutions aqueuses de peptides mesurées en UV ont été à nouveau séchées (« speed-vac ») et les peptides ont été stockés à -20°C. Les peptides sont redissous dans du tampon acétate de sodium 0,1 M, pH 4,6, juste avant la ligature. La concentration finale des peptides aldéhydes est de 1135 µM et celle de l'aminooxypeptide est de 757 µM, soit 1,5 fois inférieure.
C'est le résultat des interactions de solutés lors de la traversée de la phase stationnaire.
Etude des oligodésoxynucléotides (chapitre IV)
Multiresidue determination of quinolone antibiotics using liquid chromatography coupled to atmospheric pressure chemical ionization mass spectrometry and tandem mass spectrometry. Sequence dependence of peptide fragmentation efficiency curves determined by electrospray ionization/surface-induced dissociation mass spectrometry. Collision effects on the charge distribution of ions from large molecules, formed by electrospray ionization mass spectrometry.
In Proceedings of the 36th American Society for Mass Spectrometry Conference on Mass Spectrometry and Allied Topics, San Francisco, CA, June, 1988, p. In Proceedings of the 43rd American Society for Mass Spectrometry Conference on Mass Spectrometry and Allied Topics, Atlanta, GA, May, 1995, p. 600. Investigation of acetyl-charged tris(trimethoxyphenyl)phosphonium from mass spectrometry and mass peptrimetrides of acetyl-charged derivatives. spectrometry.
Fragmentation reactions of multiply protonated peptides and implications for sequencing by low-energy collision-induced dissociation tandem mass spectrometry.

![Figure 9 : Spectres de masse CID, obtenus par ESI-TQ, sur l'ion [M+2H] 2+ du peptide GGYR (a) (d'après Tang et coll](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465555.70706/38.892.152.800.152.835/figure-spectres-masse-obtenus-peptide-ggyr-après-tang.webp)


![Figure 4 : Spectres de masse du peptide thioester Leu 5 SEt obtenu par fragmentation dans la source à Vc=75 V (a) et par CID dans la cellule de collision de [M+H] + à Vcell=24 V (b)](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465555.70706/63.892.134.785.106.319/figure-spectres-peptide-thioester-obtenu-fragmentation-cellule-collision.webp)

![Figure 3 : Spectre de masse électrospray du peptide acetal 27-mer obtenu par collision dans la source à Vc=45 V (a) et par CID dans la cellule de collision sur l'ion [M+4H] 4+ , m/z 751.5 à Vcell=8 V (b) et spectre de masse électrospray du peptide [ald↔d](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465555.70706/80.892.127.812.113.747/figure-spectre-électrospray-peptide-collision-cellule-collision-électrospray.webp)