PIERRE de l'Université de Grenoble 1 qui m'a fait l'honneur de réviser cet ouvrage ; Permettez-moi de leur exprimer toute ma gratitude. Mme Audrey MARTIN, Maître Jean-Pierre MALOSSE et Major Hubert NOTO pour leur aide et leur disponibilité.
INTRODUCTION
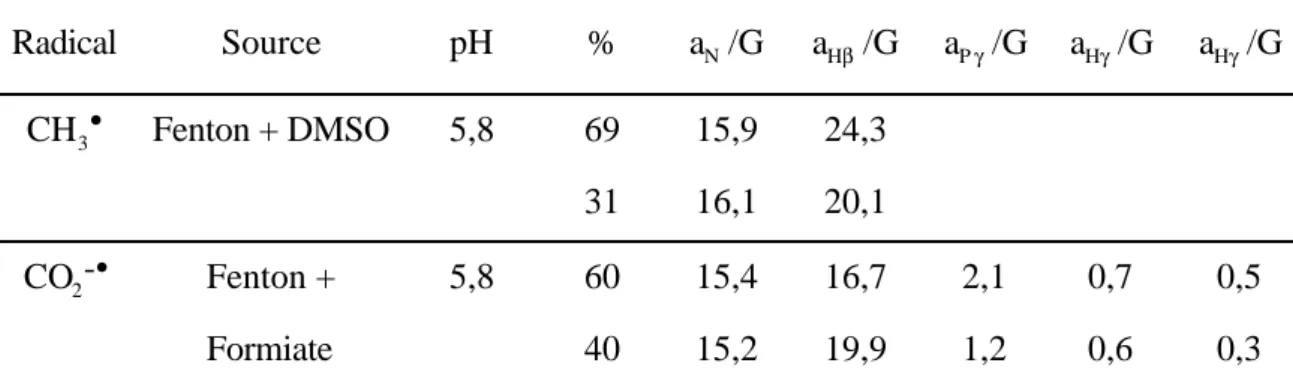
Actuellement, le 2,2-diméthyl-3,4-dihydro-2H-pyrrole-1-oxyde (DMPO) 1 est le piège le plus couramment utilisé pour le piégeage de spin, mais le DMPO présente plusieurs inconvénients. Le laboratoire SREP a développé une synthèse du 2-diéthoxyphosphoryl-2-méthyl-3,4-dihydro-2H-pyrrole-1-oxyde (DEPMPO) 2 , qui s'est avéré plus efficace que le DMPO sur certains aspects : l'absence d'addition nucléophile d'eau dans des conditions physiologiques et surtout une stabilité accrue de l'adduit superoxyde (jusqu'à 20 fois plus stable à pH 5,6)15-19.
LES RADICAUX CENTRES SUR L'OXYGENE
La chaîne respiratoire mitochondriale
Le peroxyde d'hydrogène formé lors de la dismutation du superoxyde sera éliminé naturellement de la cellule par des moyens enzymatiques (catalase et peroxydase). Sources de production in vivo de radical anion superoxyde : rôle de la xanthine oxydase (XO) et superoxyde : rôle de la xanthine oxydase (XO) et.
Sources de production in vivo du radical anion superoxyde : rôle de la xanthine oxydase (XO) etsuperoxyde : rôle de la xanthine oxydase (XO) et
McCord a découvert que la transformation de XD en XO se produit in vivo dans le tissu ischémique14. La xanthine oxydase (XO) utilise de l'oxygène moléculaire au lieu du NAD+, produisant du superoxyde, du peroxyde d'hydrogène ou les deux14,15,34 (Figure 1-7).
L'ischémie-reperfusion myocardique
Comme le montre la figure 1-8, pendant l'ischémie, il y a accumulation d'hypoxanthine7 dans les tissus myocardiques. De plus, lors de l’ischémie, les défenses naturelles présentes dans les cellules sont considérablement réduites38.
Protections non enzymatiques ou antioxydantes
Le tocophérol agit comme donneur d'hydrogène lors de la peroxydation lipidique, empêchant ainsi toute propagation32. Leur efficacité dépend de leur concentration dans la zone endommagée et de la nature de l'oxydant.
DETECTION INDIRECTE DES RADICAUX LIBRES
Il existe par exemple des radicaux stabilisés par une combinaison d’effets électroniques : c’est le cas des radicaux captodatifs64. Le principe de la méthode du spin-trapping (ou méthode au nitroxyde) sera expliqué plus en détail au chapitre 3.1.1 page 135.

SYNTHESE DES NITRONES
INTRODUCTION
Réaction des dérivés nitroso-aromatiques avec le méthylène activé : réaction avec le méthylène activé : réaction avec le méthylène activé : réaction de Kröhnke. La réaction de Kröhnke est limitée à la préparation de N-aryl nitrones et nécessite en principe un méthylène (parfois un méthylène ou un méthyle) avec un bon groupe partant (schéma 2-5).
SYNTHESE DU 2-
- Via la réaction d'Arbuzov (Voie n°1)
Anastasiou rapporte la synthèse de 23 dans les conditions de Hegedus19 qui utilise une modification de la procédure Mitsunobu (Schéma 2-12). L'activation par un agent électrophile de la double liaison des alcénylamines permet de réaliser des réactions de cyclisation de ces composés.
OCH 3R1
Via la réduction d'un groupement nitro (Voie n°3)n°3)
Schéma 2-45 : Ajout de magnésium du 3-bromo-2-méthylprop-1-ène à l'oxyde d'éthylène Lors de la réalisation de la réaction, nous avons rencontré des problèmes d'homogénéisation lors de l'ajout d'oxyde d'éthylène. Lors des premiers tests, nous avons obtenu des rendements inférieurs à ceux annoncés dans la littérature. Par ailleurs, nous avons recherché les conditions optimales pour la purification du 24 par distillation du produit brut.
Nous avons également essayé la phosphorylation par la réaction de Michaelis-Becker, pour laquelle nous avons obtenu un gel et perdu tous nos produits de départ.
Via la réduction d'un groupement nitro (Voie n°3)(Voie n°3)
Pour l'addition 1,4 du diéthyl-2-nitropropylphosphonate 29 à l'acroléine 30, nous avons utilisé du Triton B dans de l'acétonitrile comme base. L'utilisation de réactions simples et bien contrôlées en laboratoire a permis de synthétiser le 2-(diéthoxyphosphorylméthyl)-2-méthyl-3,4-dihydro-2H-pyrrole-1-oxyde 3 avec un rendement correct et une pureté suffisante. Parmi les études de spin-trapping in vitro décrites dans En conclusion sur la synthèse de la nitrone 3, nous pouvons dire que nous avons essayé plusieurs voies de synthèse (dont certaines sont présentées en annexe).
Ainsi, nous avons testé alternativement les deux méthodes les plus générales de synthèse des nitrones : l'oxydation de l'aminé secondaire et la cyclisation avec réduction du groupe nitro en groupe carbonyle.
EtOO
SYNTHESE DU 5,5-BIS
- Via l'acide (pyrrolidine-2,2-
- Via le réarrangement de Beckmann (Voie n°1)
- Via l'acide (pyrrolidine-2,2-diyl) bisphosphonique 73 (Voie n°2)bisphosphonique 73 (Voie n°2)
- Via la synthèse en une étape de (pyrrolidine- 2,2-diyl)bisphosphonate de tétraéthyle 70 (Voie
Dans des tests préliminaires, nous avons utilisé du phosphite de diéthyle sur des pyrrolidin-2-ones 74 avec de l'éther diéthylique de trifluorure de bore (BF3.OEt2) comme catalyseur (schéma 2-71). En plaçant l'acide (pyrrolidine-2,2-diyl)bisphosphonique 73 dans une solution aqueuse basique, nous avons observé un signal EPR comportant 21 raies. Cependant, le mélange réactionnel a été chauffé (entre 40 et 60 °C) et pendant la réaction nous avons effectivement observé un dégagement de chlorure d'hydrogène.
En revanche, en effectuant la réaction en présence de phosphite de triphényle, nous n'avons pas obtenu le bisphosphonate de tétraphényle (pyrrolidine-2,2-diyle) 92 attendu.
PhO)2(O)P
Nous avons ensuite répété l'expérience, toujours sous courant d'azote, mais en refroidissant avec un bain eau/glace/sel en ajoutant lentement de l'oxychlorure de phosphore. La réaction avec le phosphite de triisopropyle est similaire à tous égards à la réaction avec le phosphite de triéthyle (rendement d'environ 45, 90 % de rendement en produit brut contenant environ 50 % de phosphite de di-n-butyle.
L'utilisation de N-méthylpyrrolidin-2-one en présence de triéthylphosphite dans les mêmes conditions opératoires conduit à des rendements plus faibles (17%) (synthèse 93).
CH 2(EtO)2 (O)P
Oxydation du (pyrrolidine-2,2-
Nous avons d'abord effectué l'oxydation avec de l'acide métachloroperbenzoïque dans du chloroforme ou du dichlorométhane. Nous avons ensuite tenté l'oxydation du 70 en nitrone à l'aide de peroxyde d'hydrogène, en présence d'un catalyseur : dioxyde de sélénium ou tungstate de sodium9. Nous avons ensuite utilisé du diméthyldioxirane (DMD) 102 que nous avons préparé selon la procédure d'Adam101 (Schéma 2-77).
Nous avons ensuite oxydé cette hydroxylamine en présence de 1,5 équivalents d'oxyde mercurique jaune selon le mode opératoire de Cicchi104.
Conclusion sur la synthèse de 4
SYNTHESE DU 2,2-DIMETHYL-4-
EtO 2 C P(O)(OEt) 2
Via des réactions classiques (Voie n°1)
Les auteurs déclarent que si l'hydrure de lithium et d'aluminium (AlLiH4) possède quatre équivalents d'hydrure, qui sont suffisants pour réduire l'ester en alcool, cependant, en présence d'un excès de diéthylamine, un seul équivalent d'hydrure est disponible pour la réduction. En 1992, Cha134 a repris son étude avec l'hydrure de lithium et d'aluminium tris(diéthylamino) (LiAlH(NEt2)3) (LTDEA). En 1995, les mêmes auteurs135 ont proposé l'utilisation de l'hydrure de tris(diéthylamino)sodium et d'aluminium (STDEA) obtenu à partir de : (Schéma 2-93).
Dans une synthèse totale et stéréospécifique de l'estrone, Bartlett139 réduit l'ester méthylique en aldéhyde avec de l'hydrure d'aluminium et de bis(2-méthoxyéthoxy) sodium (NaAlH2(OCH2CH2OCH3)2) (Red-Al), avec un rendement de 95 % (Diagramme 2 -95) .
Via des réactions classiques (Voie n°1)
Enfin, l'aldéhyde 65 a été préparé en grande quantité en utilisant la triéthylamine comme base dans l'acétonitrile et un temps de réaction d'environ soixante heures66. Quelle que soit la méthode utilisant le brome en présence de carbonate de calcium, de dioxane, d'acide acétique, ou encore une méthode faisant intervenir un agent bromant synthétisé à partir de l'acide de Meldrum, l'α-bromoaldéhyde attendu n'est en aucun cas obtenu. A partir du nitroaldéhyde 65 nous avons ensuite procédé à une variante impliquant la bromation du dérivé acide 107 (Schéma 2-97).
La méthode de bromation utilisée a été testée avec succès sur l’acide valérique, mais nous n’avons pas pu bromer l’acide 107.
Via l'introduction précoce du groupement phosphoré (Voie n°2)
L'ajout d'un carbanion à un système conjugué est une réaction classique et a été réalisée selon la procédure d'Ono66. Toutes les tentatives se sont révélées infructueuses et nous n’avons récupéré que les produits originaux, qui dégageaient également une odeur forte et désagréable. Nous n’avons pas pu caractériser la lactone attendue car le nombre de produits formés est assez important.
Ce fut le même cas lorsque l'on voulut obtenir la même lactone par réduction du groupe nitro en amine avec du formiate d'ammonium avec du palladium sur charbon en quantité catalytique146.
Via l'addition d'un organomagnésien (Voie n°1) (Schéma 2-101)n°1) (Schéma 2-101)
Via la réduction d'un groupement nitro (Voie n°2) (Schéma 2-102)n°2) (Schéma 2-102)
Dans le cas de la synthèse de la phénylvinylcétone, la réaction réalisée est une élimination habituellement obtenue par pyrolyse (voir la synthèse du précurseur et la pyrolyse au § _ page 116 ou dans Vogel's157) : (Schéma 2-106). Dans le cas de la phénylvinylcétone, la réaction est réalisée à 450°C sous azote à pression normale avec un rendement de 94. Lors de la synthèse de la β-aminocétone, notamment par réduction des énaminones, Dominguez162 obtient la phénylvinylcétone comme produit secondaire.
La réaction s'effectue via une addition de Mannich qui peut se résumer ainsi : (Schéma 2-114).

Via l'addition d'un organomagnésien (Voie n°1)(Voie n°1)
On a d'abord essayé d'obtenir le 138 par oxydation de l'alcool allylique obtenu par ajout de bromure de phénylmagesium à l'acroléine. Le résultat global est décevant car la phénylvinylcétone est obtenue avec une mauvaise pureté et un rendement très faible (inférieur à 5). Le choix des conditions opératoires (température, base, solvant) doit être fait de manière à limiter la polymérisation de la phénylvinylcétone.
Nous avons effectué la réaction en présence d'une quantité catalytique de triéthylamine66 comme base, dans de l'acétonitrile comme solvant.
Conclusion sur la synthèse de 6
Un mélange de phénylvinylcétone 138, de diéthyl-1-nitroéthylphosphonate 137 et de triéthylamine est laissé à température ambiante pendant trois jours. Le schéma rétrosynthétique que nous avons choisi pour la synthèse de la nitrone 7 est une modification des réactions utilisées par Bonnet165 : (Schéma 2-122).
Synthèse du 4-formyl-2-méthyl-2- nitrobutanoate d'éthyle 166 6 6nitrobutanoate d'éthyle 1666 6
Synthèse de l'EMPO 7
CONCLUSION SUR LA SYNTHESE
Narang-ay nga Organiko a Kimika; Maikatlo nga Edision ed.; John Wiley & Sons: New York, 1985, p. 1093 ken dagiti reperensia a nadakamat.
INTRODUCTION
- Autres pièges 5
- Les dérivés nitroso
- Les nitrones
- Production de HO•
- Production du superoxyde O 2 -•
Terabe6 souligne que dans le cas du 174, la réaction de capture peut se produire soit sur l'azote, soit sur l'oxygène (Schéma 3-8). Dans le cas des nitrones, l'ajout du radical piégé R• n'est pas effectué sur l'atome d'azote, mais sur le carbone de la fonction nitrone (Schéma 3-15). En revanche, les nitrones cycliques, bien que moins sensibles que les nitrosos, doivent être conservées à l'abri de la lumière.
Dans le cas du DEPMPO, les inconvénients évoqués ci-dessus sont partiellement résolus.

CO 2 HHO2CH2C
- Logiciel de simulation RPE
- Logiciel de cinétique DAPHNIS 7 7
- RESULTATS ET DISCUSSION
- Piégeage du radical hydroxyle
- Piégeage du superoxyde
- Piégeage du radical méthyle et du radical CO 2 -•
- Autres radicaux
- Cinétiques de décroissance de l'adduit du superoxyde ESP-OOHsuperoxyde ESP-OOH
- Conclusion sur le spin-trapping avec la nitrone ESP 3ESP 3
- Piégeage du radical hydroxyle
- Piégeage du superoxyde
- Piégeage du radical méthyle et du radical CO 2 -•
- Piégeage du radical glutathionyle
- Temps de demi-vie de l'adduit DPBO-OOH
- Conclusion sur le spin-trapping avec la DPBO 4DPBO 4
- Piégeage du radical hydroxyle
- Piégeage du superoxyde
- Piégeage du radical méthyle et du radical CO 2 -•
- Autres radicaux
- Etude cinétique de la décroissance de l'adduit du superoxyde sur l'EMPOdu superoxyde sur l'EMPO
- Conclusion sur le piégeage avec l'EMPO
- Etude des effets de solvant sur les spectres RPE de 70NO et 90NOde 70NO et 90NO
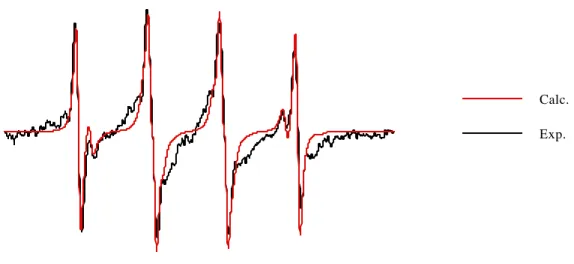
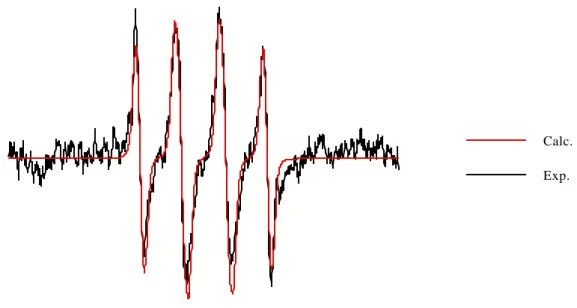
Nous avons étudié la décomposition de l'adduit ESP-OOH dans du tampon phosphate 0,1 M pH 5,8 et pH 7,0 ainsi que dans la pyridine. Après réduction de l’adduit superoxyde produit par le système hypoxanthine/xanthine oxydase, nous avons obtenu l’adduit hydroxyle relativement pur (Figure 3-9). Nous avons également réalisé la capture du superoxyde par le DPBO dans le N,N-diméthylformamide (Figure 3-12).
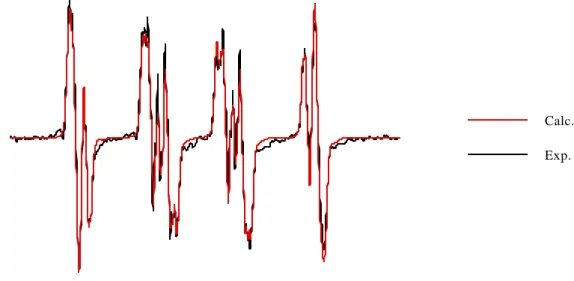
Nous avons également observé l'adduit EMPO-OH obtenu à partir de la réduction de l'adduit superoxyde (produit par le système hypoxanthine/xanthine oxydase) par le couple glutathion/glutathion peroxydase (10 unités.ml-1), à pH 5,6 et pH 7,0.