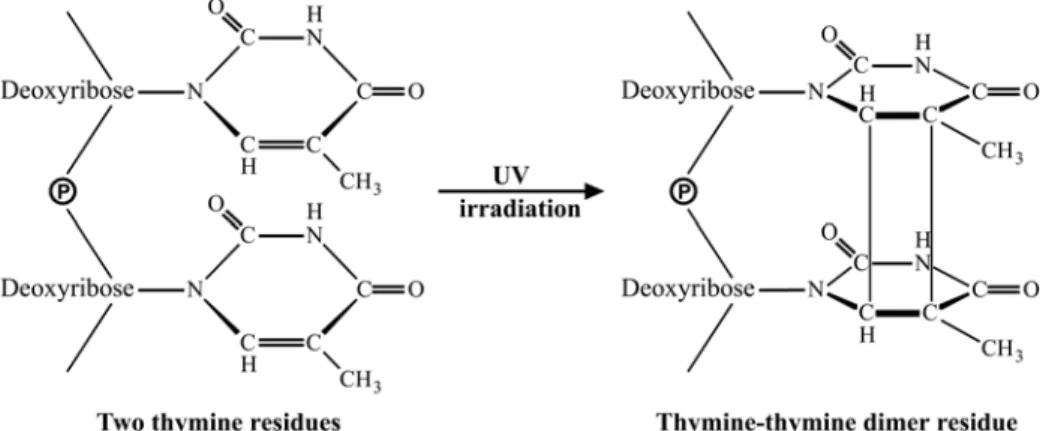
LE SYSTEME DE REPARATION DE L’ADN MISMATCH REPAIR
Chez Escherichia coli
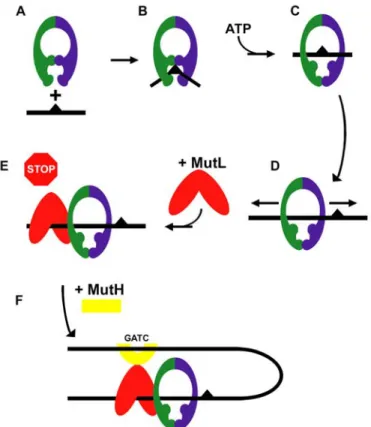
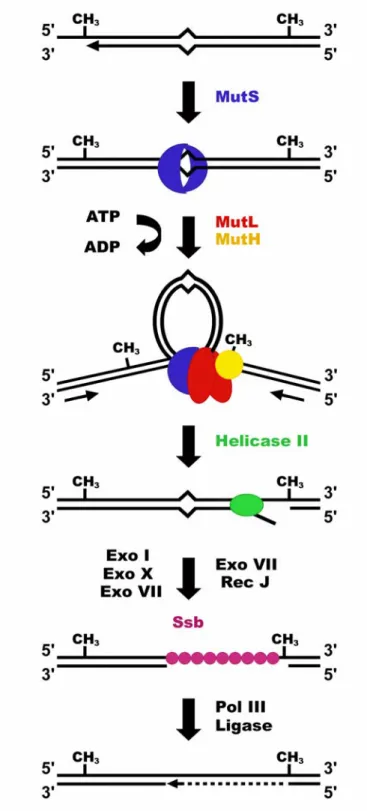
La présence d'ATP amène MutS à sortir du mésappariement par un mécanisme qui n'est toujours pas compris (Allen et al., 1997). MutL interagit également avec l'ADN hélicase II (également appelée UvrD ou MutU) et favorise la liaison de cette protéine aux cassures simple brin (Dao et Modrich, 1998 ; Yamaguchi et al., 1998).
Dans les cellules humaines …
De plus, l'affinité de MutS pour un mésappariement est modulée par la nature des bases autour du mésappariement sans règle de préférence (Brown et al., 2001). MutS reconnaît sept mésappariements sur huit avec une affinité variable (C/C est le mésappariement non reconnu) ( Su et Modrich, 1986, Su et al., 1988 ) et des ID de moins de quatre nucléotides ( Parker et Marinus, 1992 ).
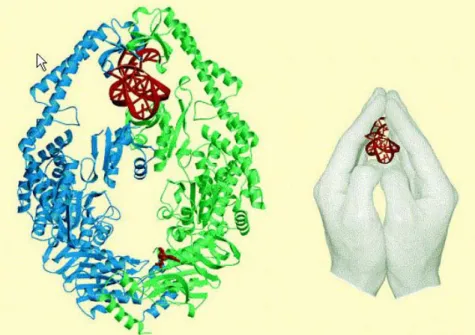
La structure de MutS
La liaison de MutS à l'ADN hétéroduplex entraîne des modifications structurelles de la protéine et de l'ADN. La seule différence observée entre les deux protéines cristallisées est la conformation de l'ADN une fois lié à MutS.
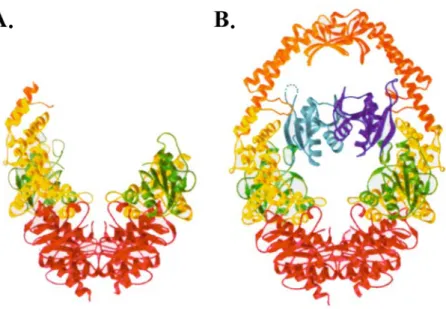
Les protéines impliquées dans la discrimination de brin
La protéine MutH clive l'ADN au niveau des séquences d(GATC) non méthylées du brin nouvellement synthétisé (Au et al., 1992). Il ne peut être exclu que cette perte soit causée par une réduction de l'interaction entre MutH et MutL (Wu et al., 2002).
Les protéines impliquées dans la réparation après la discrimination du brin
ExoVII a une double activité exonucléase et est également impliqué dans la dégradation des brins lorsque la cassure est située en 5' du mésappariement (Lovett et Kolodner, 1989 ; Cooper et al., 1993). L'étape de resynthèse est réalisée par l'holoenzyme ADN polymérase III en présence de la protéine Ssb et la ligature est catalysée par l'ADN ligase (pour revue, Harfe et Jinks-Robertson, 2000 ; Hsieh, 2001 ; Marti et al., 2002).
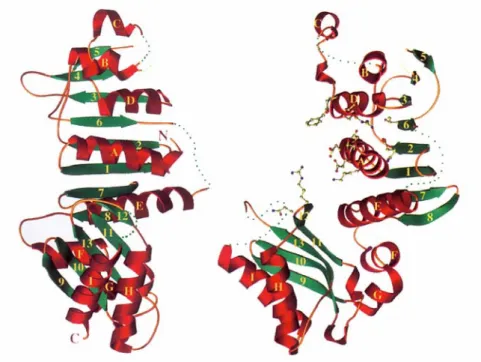
Les protéines homologues de MutS
La reconnaissance des mésappariements est influencée par la séquence de bases in vitro et in vivo (Palombo et al., 1996 ; Marsischky et Kolodner, 1999). Ils ont perdu une grande partie de leur domaine N-terminal et ne jouent aucun rôle dans la réparation des mésappariements et de l'identité, confirmant le rôle clé du domaine I dans la reconnaissance des mésappariements (Obmolova et al., 2000).
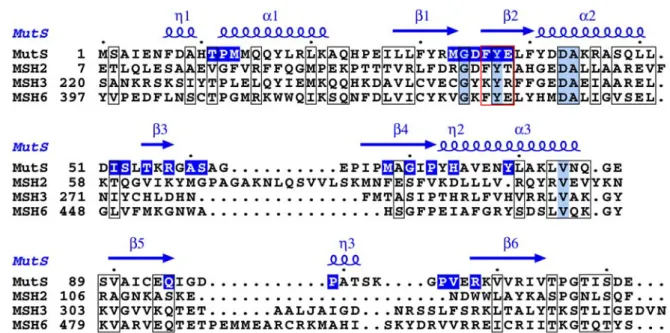
Les protéines eucaryotes impliquées dans la discrimination de brin
Le rôle de hMutLβ (hMLH1/hPMS1) et de hMLH1/hMLH3 n'a pas encore été clairement élucidé (pour revue, Marti et al., 2002). Si une mutation affecte cette région, la fonction du système MMR est abolie (Pang et al., 1997).
Les protéines eucaryotes impliquées dans la réparation des mésappariements après
La visualisation des protéines hMSH3 et hMSH6 colocalisées avec PCNA (Proliferating Cell Nuclear Antigen) et des fragments d'ADN nouvellement synthétisés suggère que le système MMR interagit avec le système de réplication (Kleczkowska et al., 2001). Une deuxième exonucléase FEN-1 (homologue de RTH1/Rad27 chez Saccharomyces cerevisiae) est ainsi impliquée dans le système MMR (Tishkoff et al., 1997 ; Xie et al., 2001).
Les protéines accessoires impliquées dans la réparation des mésappariements
Le facteur PCNA participe à l'étape de resynthèse de l'ADN en interagissant avec les protéines du système de réplication (Gu et al., 1998). Cette étape est contrôlée par la liaison de l'ATP et l'activité ATPase de MutS et MutL.
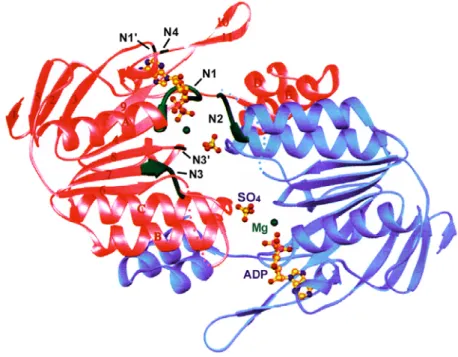
Effets de l'ATP et de l'ADP sur la conformation et les propriétés biochimiques des
Il apparaît en effet que l'activité ATPase de MutS est essentielle à l'activation de MutH, ce qui explique pourquoi l'inactivation de l'hydrolyse de l'ATP par MutS entraîne un défaut de réparation des hétéroduplexes (Junop et al., 2003). Comme MutS, la protéine MutL est une protéine homodimère régulée par des cycles de liaison et d'hydrolyse de l'ATP (Ban et al., 1999).
Les modèles proposés
Ces résultats indiquent que l'hydrolyse de l'ATP n'est pas impliquée dans le départ de hMutSα du mésappariement (Gradia et al., 1999). Hsieh sur les événements résultant de la reconnaissance des mésappariements par la protéine MutS (d'après Schofield et al., 2001b).

Chez Saccharomyces cerevisiae
Le rejet de l'intermédiaire de recombinaison semble s'accompagner d'un déroulement de l'hétéroduplex par l'ADN hélicase Ggs1 interagissant avec Msh2 ( Myung et al., 2001 ). Cette protéine, qui interagit avec Msh2, participerait au contrôle de la recombinaison (Kleczkowska et al., 2001).
Chez les eucaryotes supérieurs
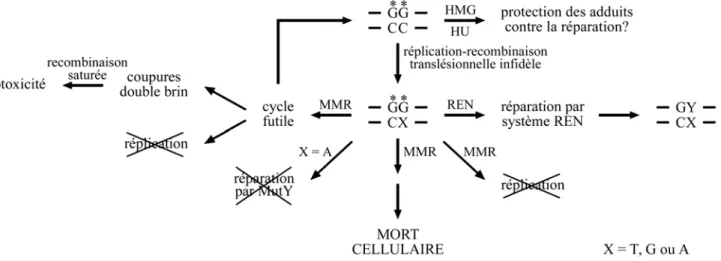
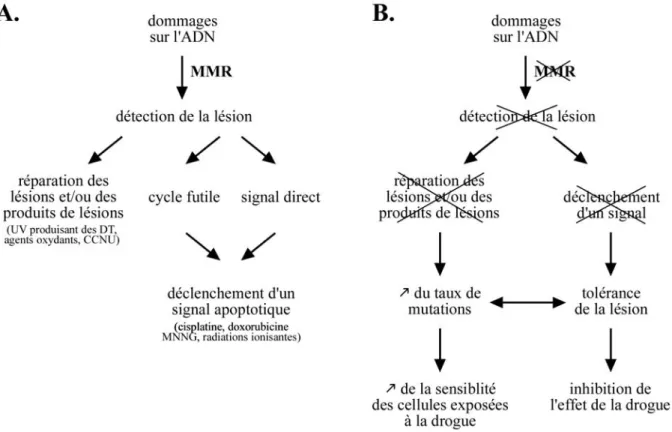
Puisque des voies de réparation de l’ADN existent pour favoriser la survie cellulaire, l’implication du système ROR dans la cytotoxicité de certains médicaments endommageant l’ADN semble paradoxale. 13 : Le rôle du système MMR dans le maintien de l'intégrité génomique après exposition des cellules à l'un des agents endommageant l'ADN (A) et les conséquences d'une déficience du système MMR dans les cellules exposées à ces mêmes agents (B).
LES AUTRES SYSTEMES DE REPARATION DE L'ADN
- Réparation par réversion …
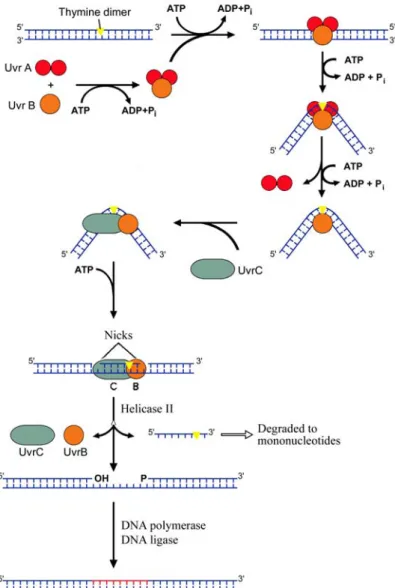
- Le système de réparation par excision de nucléotides
- La réparation des cassures de l’ADN
- La réparation par excision de base …
- Le système de réparation “very short pathway”
La continuité du brin réparé est assurée par l'ADN Ligase (pour Revue, Lodish et al., 1999). Le système VSP peut également réparer G/U mésapiquement, U à partir de la rangée de C (Gabbara et al., 1994).
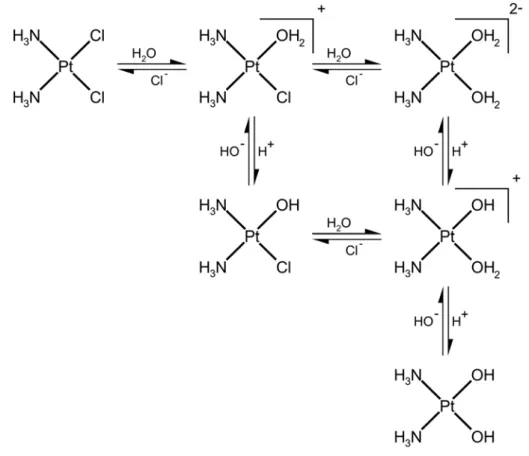
LE CISPLATINE
- Réactivité du cisplatine
- Les adduits du cisplatine
- La structure des adduits du cisplatine
- Inhibition de la réplication par le cisplatine
- Réplication translésionnelle et mutagénicité du cisplatine
- Effets du cisplatine sur la transcription
- Les protéines à boite HMG
- Protéines de réparation et cisplatine
- La protéine histone H1
In vivo, les adduits au cisplatine inhibent la transcription deux à trois fois plus que les adduits au transplatine (Mello et al., 1995). La protéine RPA a été détectée en complexe avec de l'ADN modifié par le cisplatine (Clugston et al., 1992). Il reconnaît fortement l'ADN globalement modifié par le cisplatine, mais pas les adduits du transplatine (Yaneva et al., 1997).
IMPLICATION DU SYSTEME MMR DANS LA
Le modèle du cycle futile
25 : Résumé des modèles proposés pour expliquer la mort médiée par le système ROR des cellules exposées au cisplatine (adapté de Brown, 1999). En effet, l'ADN contenant l'adduit du cisplatine sera répliqué et la base du mesapparia ne sera pas détectée et/ou éliminée par le système MMR. 26 : Cycle futile d'excision/resynthèse de l'ADN proposé pour expliquer la contribution du système de réparation du MMR à la cytotoxicité du cisplatine (de Vaismanet Coll., 1998).

Intervention de la recombinaison contrôlée par le système MMR dans la
Ce modèle est cohérent avec la corrélation entre la perte du système MFR et l'augmentation de la réplication translectuelle par les ajouts de cisplatine (Vaeman et al., 1998).
Inhibition de la réplication par le système MMR
Inhibition de la réparation
La liaison des protéines du système MMR aux adduits de cisplatine peut protéger ces adduits de la réparation via le système REN (Mello et al., 1996), permettant ainsi la persistance des lésions de cisplatine sur l'ADN. Une déficience du système ROR s'accompagnerait d'une augmentation de la réparation, provoquant la tolérance des cellules ROR exposées au cisplatine (pour revue, Lage et Dietel, 1999). La reconnaissance d'une lésion de l'ADN par les protéines du système ROR peut déclencher un signal déclenchant l'apoptose (pour revue, Karran, 2001 ; Fishel, 2001).
La voie de transduction du signal impliquant la protéine p53
La voie de transduction du signal impliquant la protéine p73
Préparation des oligonucléotides simples brins …
Après une nuit d'incubation à 37°C, l'ADN est précipité en présence d'AcONa 0,3 M pH 5,2, séché et repris dans 20 µl d'une solution aqueuse de formamide à 60% pour être déposé sur un grand gel de Polyacrylamide dans des conditions dénaturantes. (gel 24% 19:1 acrylamide:bisacrylamide ; urée 7M ; 1 TBE) pour purifier le brin platine du brin non platine (rendement platination de 50 à 60 %). La bandelette de Polyacrylamide contenant le brin de platine est récupérée, éluée et précipitée selon les modes opératoires décrits précédemment pour être reprise dans de l'eau ultra pure. Comme pour les oligonucléotides non platinés, la pureté des 24-mers platineux après radiomarquage est vérifiée en les déposant sur un gel de Polyacrylamide en conditions dénaturantes (0,45 mm d'épaisseur) dans les conditions expérimentales décrites dans la section précédente.
Préparation des sondes radiomarquées
Pour ce faire, ajouter 7,5 pmol du brin complémentaire dans le tube contenant le brin radioactif en présence de NaCl 60 mM et Tris-HCl 5 mM pH 7,5. Si l’on connaît la quantité de brin complémentaire initialement inséré et le % de duplex formé, on peut déterminer la concentration d’ADN double brin. Le complément du brin non marqué nécessaire au 100% duplex est ajouté et le mélange est réhybridé avec un gradient de température.
Transformation bactérienne …
Pour récupérer l'ADN radiomarqué purifié à partir des nucléotides présents dans le milieu réactionnel, l'échantillon est placé sur une colonne chromatographique Sephadex G50 avant d'être centrifugé 5 min à 1100 tr/min et température ambiante. 2 ng de plasmide sont ajoutés pour 40 µl de bactéries et le mélange est incubé une minute sur de la glace avant électroporation à l'aide d'un pulseur 2,5 kV (MicroPulser, Biorad). 1 ml de milieu de culture Luria-Bertani (milieu LB) est rapidement ajouté et le tout est incubé 45 min à 37°C sous agitation avant d'étaler sur une plaque de LB-agar contenant 100 µg/ml d'ampicilline et 34 µg/ml. chloramphénicol.
Production de la protéine MutS
Purification de la protéine MutS
Figure 28 : Effet de l'ADP, de l'ATP et de l'AMPPNP sur l'affinité de la protéine MutS pour les duplex GG/CT et G*G*/CT. Ces interactions peuvent participer à l’augmentation de l’affinité de MutS pour un composé dommageable au cisplatine. Figure 38 : Effet de l'ADP, de l'ATP et de l'AMPNPP sur l'affinité de la protéine MutS pour les duplex G*G*/CT et G*G*/CT DACH Pt.
Production de la protéine MutY
Estimation de l’affinité relative de la protéine MutS
L'analyse de la quantité d'ADN complexé et d'ADN libre permet d'estimer la valeur des constantes d'association et de dissociation selon le principe suivant. On peut alors tracer les courbes représentant la fraction d'ADN complexé en fonction de la concentration en protéines. La constante de dissociation, qui correspond à la concentration en protéines nécessaire pour complexer 50 % de l'ADN, est déterminée à partir de cette courbe théorique.
Expériences de compétition
Ce protocole est appliqué à l'étude de l'interaction de MutS avec 46 paires de bases d'oligonucléotides dans un tampon de complexation contenant 50 mM Tris-HCl pH 7,5 ; 2% de glycérol ; NaCl 50 mM ; 0,1 mM d'EDTA pH 8 ; 80 µg/ml de BSA acétylée et 1 mM de DTT.
Mesure des constantes de vitesse d’association et de dissociation des complexes
Chaque essai comprenait une phase d'association de 200 s et une phase de dissociation de 150 s. Pour chaque duplex testé, six expériences sont réalisées en injectant des concentrations croissantes de protéine (entre 0 et 1000 µM). Pour chaque duplex étudié et à une concentration protéique saturante, MutS se lie à l'ADN avec un rapport molaire de 1:1, calculé selon la formule stoechiométrique.
Etude de l’activité glycosylase de la protéine MutY d’E. coli
De plus, les adduits du cisplatine sont susceptibles de former des composés endommageant le cisplatine in vivo par duplication de translésion (Hoffmann et al., 1996a; Vaisman et Chaney, 2000; Vaisman et al., 2000). Ces composés de lésion (ou produits de lésion) du cisplatine proviennent de l'incorporation d'une base non complémentaire opposée à l'une des deux purines pontées par le cisplatine lors de la réplication. D'autre part, dans une étude utilisant de l'ADN natif modifié avec du cisplatine ou du DACH Pt, MutS a reconnu les adduits au cisplatine deux fois plus efficacement que ceux du DACH Pt.
INTERACTION DE LA PROTEINE MutS AVEC DES LESIONS
En particulier, l’un des résultats est que la diminution de l’affinité de MutS pour l’ADN mésapparié en présence d’ATP ou d’AMPNPP est supprimée par la présence de l’adduit. Ainsi, la présence de cisplatine semble inhiber l'effet de l'ATP et de l'AMPNPP sur l'affinité de la protéine pour le duplex contenant le défaut G/T. Quelle est la raison de l’affinité anormalement élevée de MutS pour le duplex G*G*/CT en présence d’ATP ou d’AMPNPP ?
Ce résultat suggère que la forte affinité de MutS pour l'ADN contenant un composant de dommage par adduit intrabrin en vrac en présence d'AMPNPP est due en partie à une diminution de l'affinité de la protéine pour le nucléotide. Ces résultats suggèrent que l'activité ATPase est impliquée dans l'inhibition de la diminution de l'affinité de MutS pour un composé lésionnel dérivé de DACH.