Je remercie également le Dr Cyrille Boyer de m'avoir donné l'opportunité de travailler au laboratoire de l'Université de Nouvelle-Galles du Sud à Sydney. Je remercie également le Dr. Hien Duong et Jonhan Basuki pour leur aide au laboratoire de Sydney.
Réactivité du cycle furane des POE vis-à-vis d'une réaction de Diels-Alder
Rappels bibliographiques sur la réaction de Diels-Alder en synthèse
Etude de la réaction de Diels-Alder sur molécule modèle 88
Réactivité des POE à extrémité acide phosphonique 101
Stabilisation de la surface des nanoparticules par POEs à extrémité acide phosphonique
INTRODUCTION GENERALE
Les POE terminés par l'acide phosphonique et fonctionnalisés par le furane ont ensuite été ancrés à des nanoparticules d'oxyde de fer via une stratégie de greffage. Avant de développer ces différents points, le premier chapitre est consacré à une étude bibliographique sur la synthèse et la stabilisation et/ou fonctionnalisation de nanoparticules d'oxyde de fer.
Introduction
Méthodes de synthèse des nanoparticules magnétiques
Parmi les nombreuses méthodes chimiques pouvant être utilisées pour synthétiser des nanoparticules d’oxyde de fer, la co-précipitation7, la synthèse hydrothermale30, la synthèse micellaire inverse31 et la décomposition et/ou réduction thermique32 sont actuellement les méthodes les plus utilisées. La synthèse des nanoparticules d’oxyde de fer est un processus complexe en raison de leur nature colloïdale.
1. La coprécipitation
2. La synthèse hydrothermale
3. La synthèse en microémulsion inverse
La variation de la température de réaction permet ainsi de moduler la taille des nanoparticules d'oxyde de fer de 3 à 12 nm. De même, les concentrations de métaux et de bases peuvent être modulées pour faire varier la taille des nanoparticules.
4. La décomposition thermique
Le principal avantage de cette technique est que l’on peut contrôler la taille des nanoparticules en fonction de la taille des gouttelettes d’eau. Bien que la décomposition thermique donne accès à des nanoparticules d’oxyde de fer ayant une distribution de taille étroite, elle présente l’inconvénient de produire des nanoparticules qui ne sont généralement solubles que dans des solvants non polaires49.
Stabilisation de la surface des nanoparticules magnétiques
Les nanoparticules ont ensuite été transformées en nanocristallites gFe2O3 monodispersées par oxydation contrôlée en utilisant de l'oxyde de triméthylamine comme oxydant doux.
1. Phénomènes intervenant lors de la stabilisation
Les stabilisations électrostatique et stérique sont essentielles pour obtenir des nanoparticules d'oxyde de fer stables dans le temps. Présentation de différentes structures de nanoparticules d'oxyde de fer stabilisées et fonctionnalisées avec des matériaux organiques.
2. Stabilisation par des molécules organiques
Suggestions sur la nature de l'interaction entre les groupes phosphonates et la surface des nanoparticules d'oxyde de fer. Cette étude démontre que les groupes phosphonate et phosphate se lient efficacement à la surface des nanoparticules d'oxyde de fer.
3. Procédés utilisés pour la stabilisation et/ou fonctionnalisation
Stabilisation de surface des nanoparticules magnétiques nues Les nanoparticules d'oxyde de fer nu ne sont pas stables et sont insolubles dans l'eau. Mohapatra et al.99 ont synthétisé des nanoparticules d'oxyde de fer à partir de sulfate ferreux (FeSO4) et de chlorure ferrique (FeCl3) par la méthode de co-précipitation.
Fonctionnalisation des nanoparticules magnétiques par des polymères
Les auteurs ont ensuite introduit des alcools pour remplacer la monocouche d'alkylamine des nanoparticules de g-Fe2O3 par la méthode d'échange de ligand (Schéma I-19). Il existe deux stratégies pour greffer des polymères à la surface de nanoparticules magnétiques : le greffage sur le procédé et le greffage à partir du procédé.
1. La stratégie grafting from
Une copolymérisation aléatoire du méthacrylate d'éther de méthyle de poly(éthylène glycol) (PEGMA) et de 2-vinyl-4,4-diméthylazlactone (VDM) par ATRP a ensuite été réalisée en présence d'un système catalyseur CuBr/tris [2-(diméthylamino)éthyle ]amine (Me6TREN ) à partir de nanoparticules d'oxyde de fer fonctionnalisées. Greffage selon la stratégie de greffage de polyglycérol hyperbranché à la surface de nanoparticules d'oxyde de fer par ROP glycidol.123.
2. La stratégie grafting onto
Synthèse de poly(N-isopropylacrylamide) à terminaison bisphosphonate utilisés pour stabiliser et fonctionnaliser des nanoparticules d'oxyde de fer par la stratégie de greffage. Fonctionnalisation de nanoparticules d'oxyde de fer stabilisées par une molécule organique avec une fonction cliquable pour ancrer des (macro)molécules selon la stratégie.
Conclusion
De notre côté, nous avons choisi de concentrer nos travaux sur le greffage de POE à extrémités acide phosphonique et à fonctionnalité furane sur des nanoparticules d'oxyde de fer en utilisant la stratégie de greffage. La synthèse des éthers monométhyliques de poly(oxyde d'éthylène) ayant pour fonction finale l'acide phosphonique et le furane fait l'objet du chapitre suivant.
Synthèse de poly(oxyde déthylène)s à extrémité phosphonate par combinaison des réactions dAtherton-Todd et de chimie click
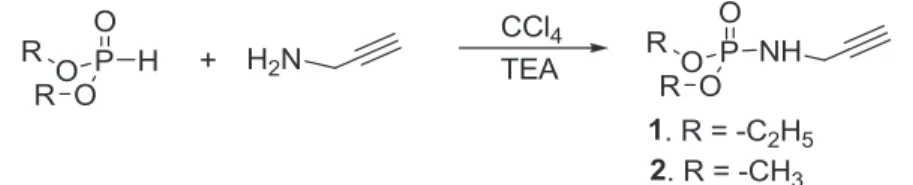
Tout d’abord, les hydrogénophosphonates de diméthyle et de diéthyle ont été fonctionnalisés avec un groupe alcyne par une réaction d’Atherton-Todd avec la N-propargylamine. Les N-di(m)éthoxyphosphorylprop-2-yn-1-amines obtenues ont été liées à un azoture de POE par une réaction de chimie clic.
1. Rappels bibliographiques sur la réaction d'Atherton-Todd
Cliquez sur la réaction chimique entre l'éther monométhylique de poly(oxyde d'éthylène) azoture 2000 et l'éther monométhylique de N-di(m)éthoxyphosphorylprop-2-yn-1-amine 2000 et la N-di(m))éthoxyphosphorylprop-2-yn-1-amine. Cliquez sur la réaction chimique entre l'azide de poly(oxyde d'éthylène) monométhyléther 2000 et la di(m)éthoxyphosphorylprop-2-yn-1-amine.
5. Conclusion
La réaction de chimie click entre la di(m)éthoxyphosphorylprop-2-yn-1-amine et l'azoture du poly(oxyde d'éthylène)monométhyléther 2000, réalisée en présence du système catalytique Cu(I)Br/PMDETA dans le DMF. accès aux poly(oxydes d'éthylène) à terminaison di(m)éthylphosphonate, comme le montrent les analyses MALDI-TOF. Ces résultats nous ont amenés à proposer une nouvelle stratégie pour la préparation de poly(oxyde d'éthylène) à terminaison acide phosphonique en introduisant une liaison P-C plus forte entre l'extrémité phosphoryle et la chaîne poly(oxyde d'éthylène) en utilisant la réaction de Kabachnik-Fields.46, 47.
Synthèse de poly(oxyde déthylène)s à extrémité acide phosphonique par combinaison des réactions de Kabachnik-Fields et de chimie click
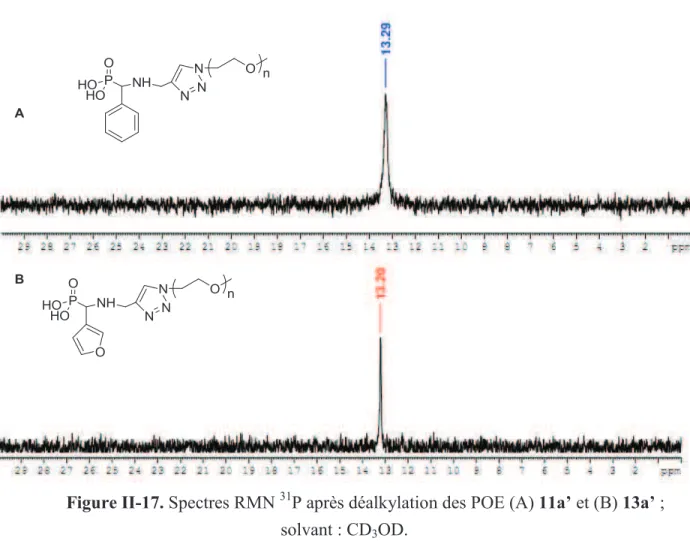
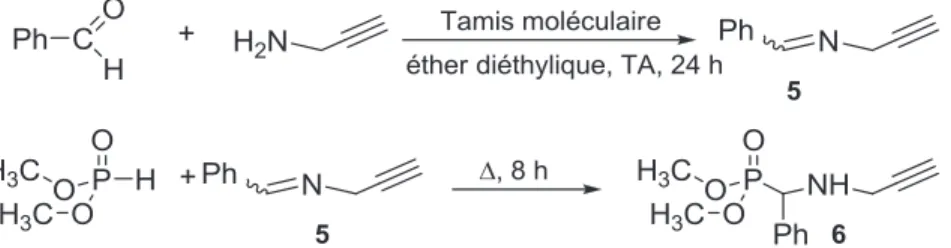
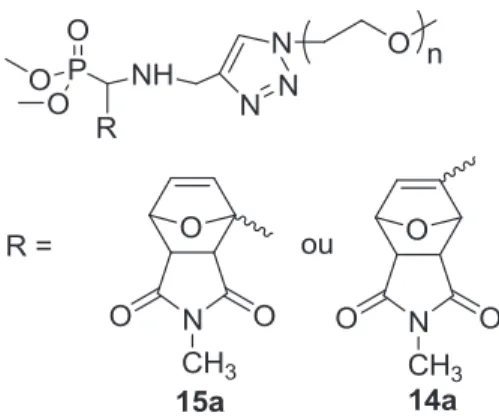
D'autre part, la réaction de désalkylation pour générer l'extrémité acide phosphonique, réalisée en présence de TMSBr, a conduit à la rupture de la liaison P-N et a abouti à des poly(oxydes d'éthylène) à extrémité triazole-aminoalkyle. La synthèse des a-aminophosphonates a d'abord été étudiée à partir d'une molécule modèle, le benzaldéhyde, puis à partir de carboxaldéhyde furanes, dont la fonctionnalité furane pourrait ensuite être mobilisée pour ancrer des (bio)molécules à extrémités maléimide, selon la réaction chimique click de Diels-Alder.20 , 21 Les furanes 2- et 3-carboxaldéhyde ont été utilisés pour déterminer l'influence de la position du site d'ancrage du POE sur la capacité du furane à subir une réaction de Diels – Alder.
1. Rappels bibliographiques sur la réaction de Kabachnik-Fields
Cet auteur a étudié l'influence de la nature du dérivé carbonylé (pentanal, propanone, fluorénone et benzophénone) sur la réaction de Kabachnik-Fields réalisée en présence de n-butylamine et d'hydrogénophosphonate de diéthyle. Synthèse d'un copolymère poly(N-vinylpyrrolidone-co-vinylamine) portant des groupements latéraux aminophosphonate par la réaction de Kabachnik-Fields.
2. Synthèse des a-aminophosphonates
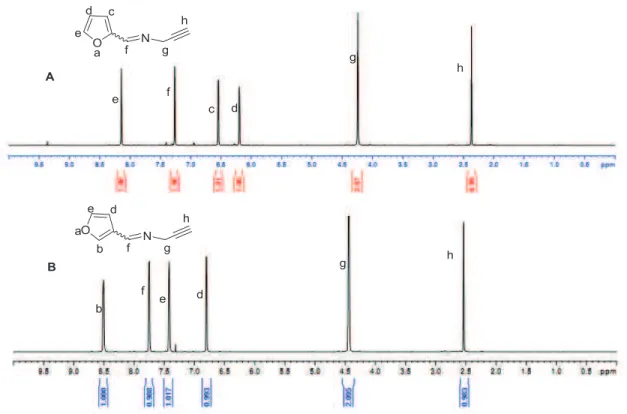
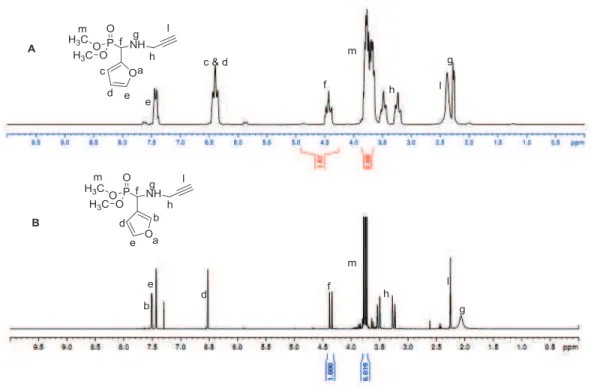
La réaction de Kabachnik-Fields entre le 2- ou 3-carboxaldéhyde furane, la N-propargylamine et l'hydrogénophosphonate de diméthyle est réalisée comme suit (Schéma II-23). La synthèse du poly(oxyde d'éthylène) avec le phosphonate se termine par la réaction de chimie clic.
4. Synthèse des poly(oxyde déthylène)s à extrémité acide phosphonique par la réaction de déalkylation
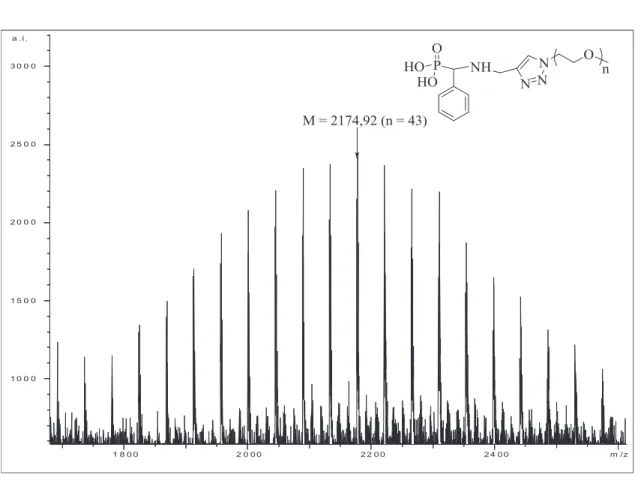
D'autre part, une analyse MALDI-TOF des POE avec les terminaisons acide phosphonique obtenues a été réalisée (Tableau II-2 et Figure II-18). De plus, le pic à m/z = 2174,92 correspond au POE avec une extrémité acide phosphonique déprotonée avec 43 unités POE contenant le groupe d'une part.
5. Synthèse des poly(oxyde déthylène)s à extrémité acide phosphonique par hydrolyse
Pour la deuxième stratégie, la réaction de Diels-Alder est d'abord réalisée entre la (bio)molécule fonctionnalisée par maléimide et le POE à extrémité acide phosphonique ou phosphonate et fonctionnalité furane, puis le POE à extrémité acide phosphonique (après désalkylation en phosphonate) et à fonctionnalité oxanorbornène. est ensuite utilisé pour stabiliser les nanoparticules d'oxyde de fer (Schéma III-2, stratégie B). Etude de la réactivité du cycle furane des POE en lien avec une (rétro) réaction de Diels-Alder.
Rappels bibliographiques sur la réaction de Diels-Alder en synthèse macromoléculaire
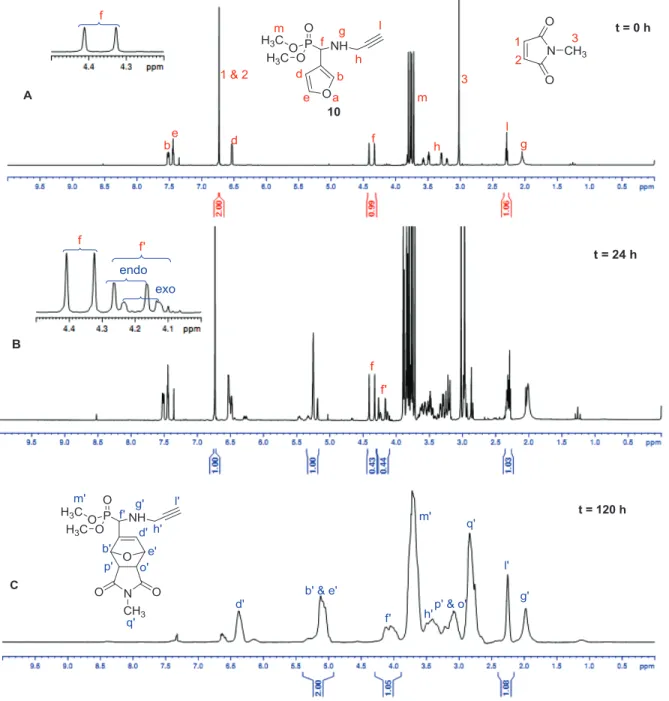
La réaction Diels – Alder a été initialement étudiée en utilisant la molécule modèle diméthyl 3-furanyl (prop-2-ynylamino) méthylphosphonate (10) avec le N -méthylmaléimide. Les diènes et les diénophiles, qui sont les plus utilisés dans la synthèse de polymères pour la réaction de Diels-Alder.
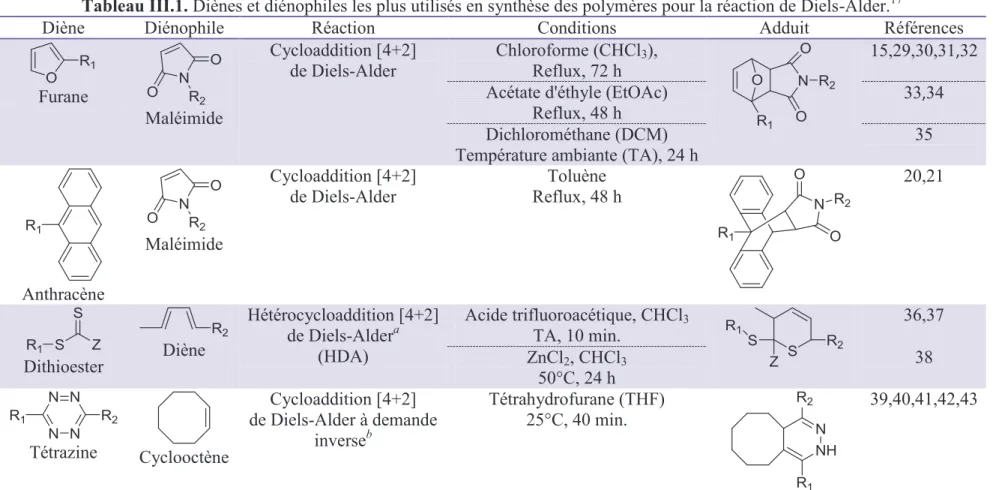
Etude de la réaction de Diels-Alder sur molécule modèle
Etude cinétique de la réaction de Diels-Alder entre le 10 et le N-méthylmaléimide en absence de catalyseur à 40 °C dans CDCl3. Spectres RMN 31P découplés 1H de (A) avant la réaction de Diels-Alder et (B) après la réaction de Diels-Alder ; solvant : CDCl3.
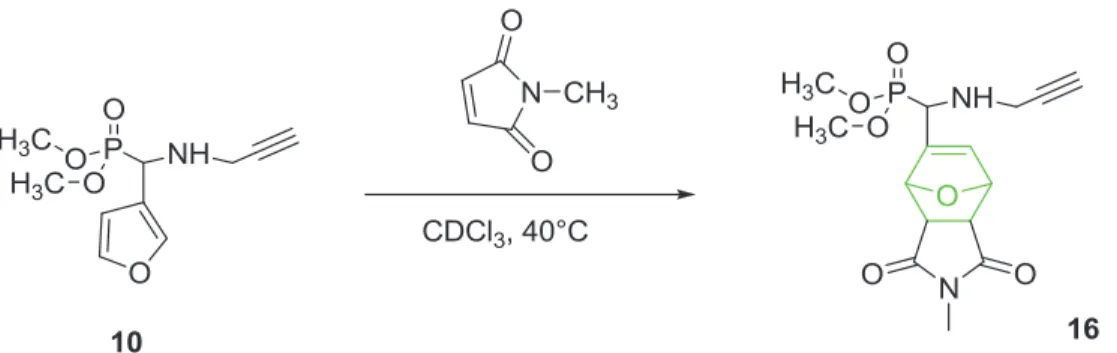
Réactivité des POEs à extrémité phosphonate
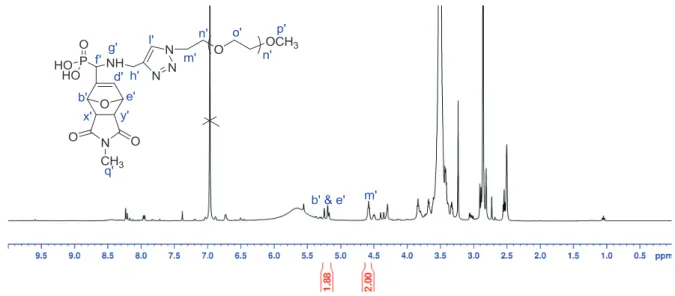
L'acquisition de quatre pics s'explique par la présence de 5 centres stéréogéniques dans la molécule 16 et par la relation configurationnelle sans ambiguïté entre b' et e' et entre p' et o', qui conduit à la formation de 4 diastéréoisomères différents.
1. Influence de la substitution du furane
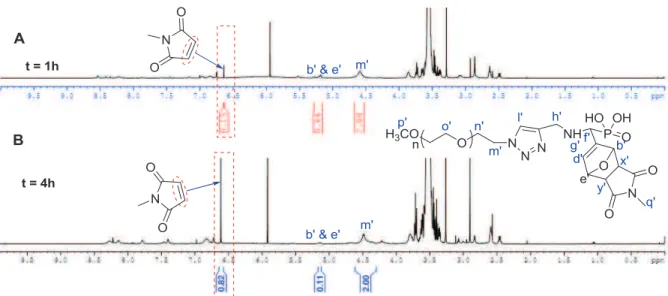
Ces conditions ont également permis d'observer la réaction de Diels-Alder à partir du diène 12a, mais avec une conversion limitée à 36 % (Tableau III-3, entrée 7). L'analyse RMN 1H (Figure III-3) montre la disparition de signaux à 7,51 ppm, 7,44 ppm et 6,55 ppm, respectivement, caractéristiques des protons des groupes CH du furane, et l'apparition de signaux à 5,13-5,39 ppm (pics b & e, Fig. III-3), les caractéristiques CH-O des groupes oxanorbornène, qui soulignent que la réaction de Diels-Alder de 14a est efficace.
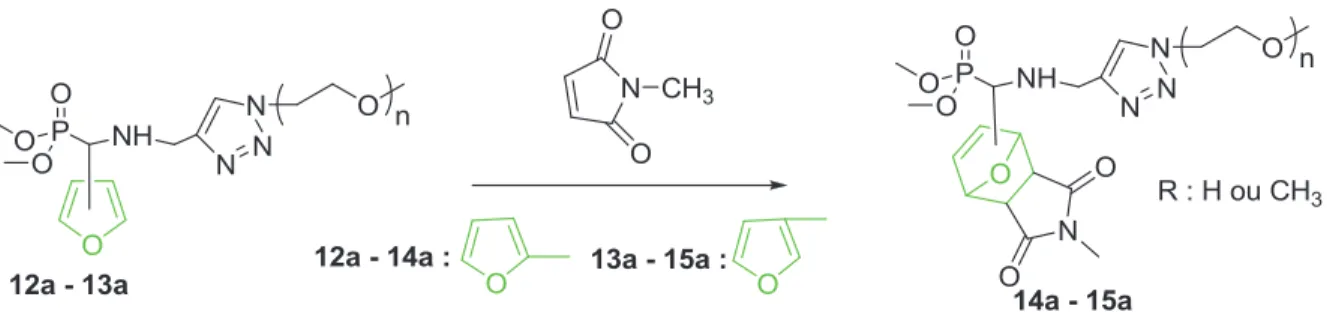
2. Influence des conditions de réaction
Nous allons maintenant étudier l'adéquation à la réaction de Diels-Alder de ce POE 13a dans des conditions compatibles avec les milieux biologiques.55. Résultats de la réaction de Diels-Alder entre le diméthylphosphoryl(3-N-(5-méthyltriazole)méthylamino)furane à terminaison 13a et le N-méthylmaléimide.
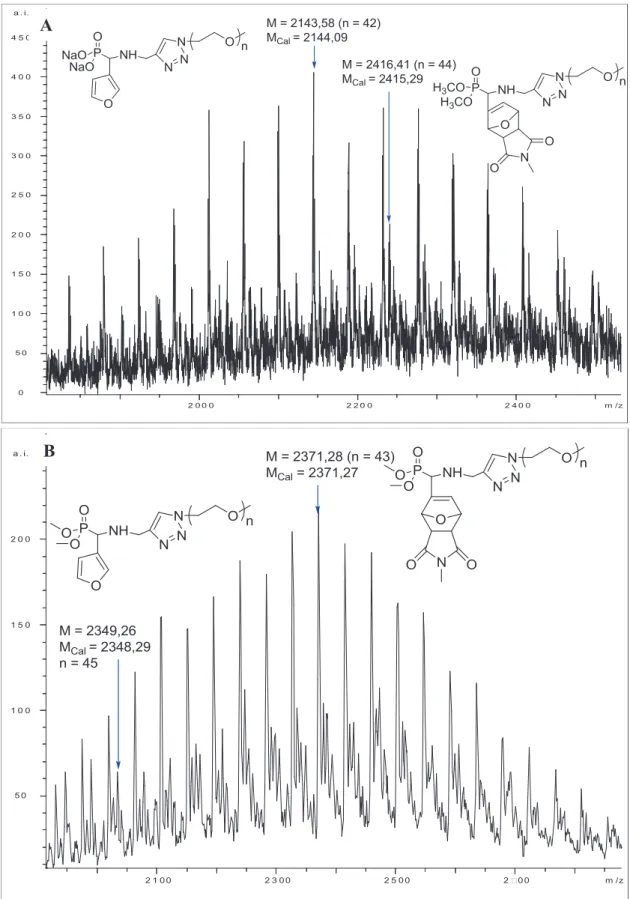
3. Réaction de rétro Diels-Alder
La réaction rétro Diels – Alder de 14a a été réalisée dans un solvant deutéré pour surveiller la cinétique de la réaction. La réaction rétro Diels – Alder de 14a a été réalisée avec succès dans DMSO-d6 et TCE-d2 avec des conversions de l'ordre de 90% après 11 h de réaction à 110°C.
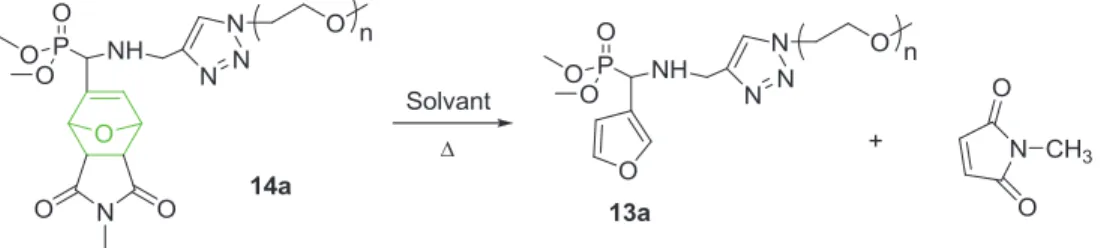
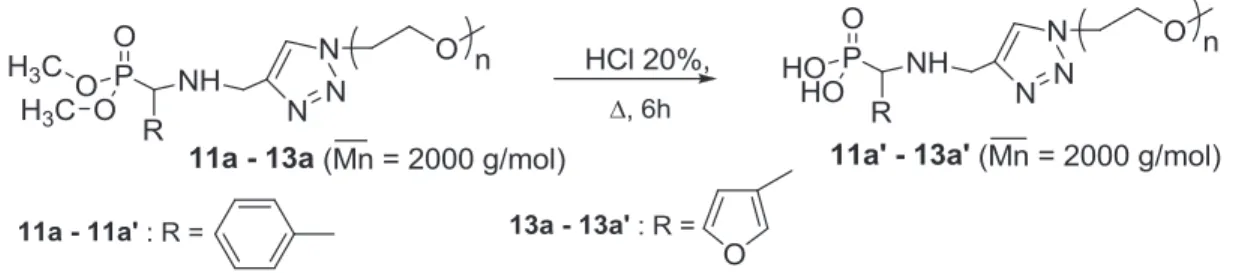
4. Déalkylation du POE à extrémité phosphonate de diméthyle fonctionnalisé par un groupement oxanorbornène
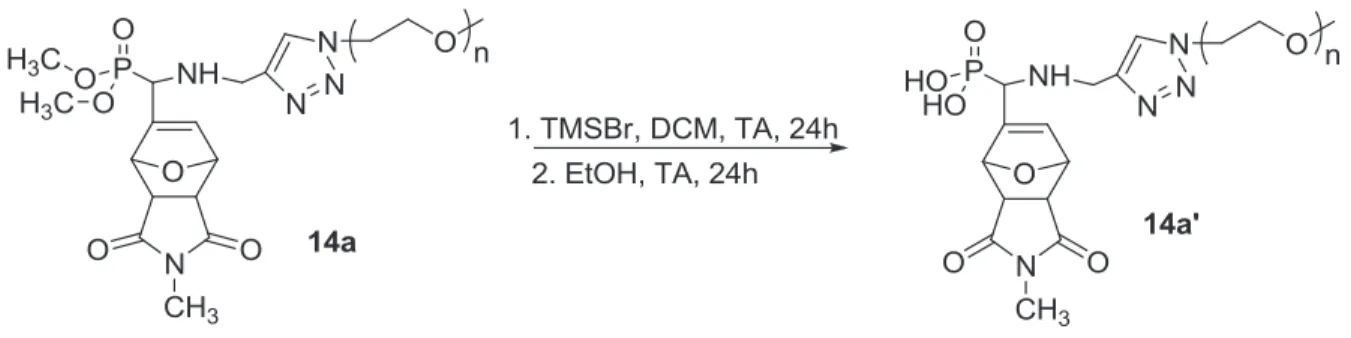
Le spectre RMN 31P montre la disparition totale des pics caractéristiques du phosphore 14a à 24,36 ppm, 23,34 ppm, 23,18 ppm et 22,90 ppm et l'apparition de quatre pics correspondant aux luminophores des quatre diastéréoisomères de 14a' aux déplacements chimiques, caractéristiques de phosphore d'un groupe acide phosphonique, de 10,01 ppm, 9,29 ppm, 8,87 ppm et 8,16 ppm (Figure III-7). Par ailleurs, la spectroscopie infrarouge à transformée de Fourier (FT-IR) de 14a montre l'apparition d'une nouvelle bande à 3367 cm-1, caractéristique du groupement acide phosphonique.
Réactivité des POE à extrémité acide phosphonique
1. Réaction de Diels-Alder
Spectre RMN 1H du 14a obtenu par réaction de Diels-Alder à 40°C pendant 5 jours entre le 13a et le N-méthylmaléimide ; solvant : DMSO-d6. Les réactivités du POE 13a' terminé par l'acide phosphonique et du POE 13a terminé par le diméthylphosphonate par rapport à la réaction de Diels-Alder dépendent de la nature du solvant.
2. Réaction de rétro Diels-Alder
Stabilisation et fonctionnalisation de nanoparticules d'or par un ligand à fonctionnalité furane suivie d'une réaction de Diels-Alder avec un oligo(p-phénylévinylène). Modification de nanoparticules d'or par un POE fonctionnalisé par l'oxanorbornène suite à une réaction rétro Diels-Alder par irradiation photothermique.
Synthèse et caractérisation de nanoparticules doxyde de fer
1. Synthèse de nanoparticules doxyde de fer par la méthode de coprécipitation
2. Caractérisation des nanoparticules doxyde de fer nues
La distribution en taille des nanoparticules d'oxyde de fer synthétisées a ensuite été mesurée dans l'eau à pH = 5,5 par DLS (Figure IV-2B). L’analyse thermogravimétrique (ATG) a ensuite été utilisée pour déterminer la quantité d’eau adsorbée à la surface des nanoparticules nues d’oxyde de fer.
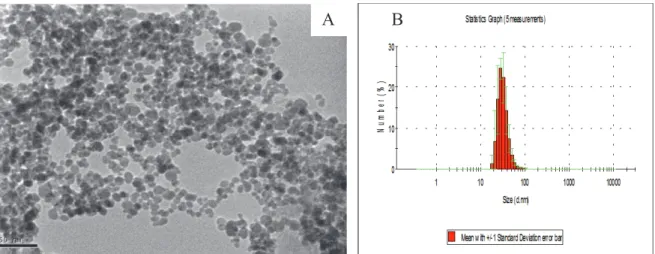
Les analyses ATG et FTIR-ATR des nanoparticules d'oxyde de fer nu confirment la présence d'une couche d'eau absorbée à la surface des particules, ce qui peut expliquer la différence observée lors des mesures des diamètres des nanoparticules avec TEM et DLS.
Stabilisation et fonctionnalisation de nanoparticules d'oxyde de fer nu avec POE terminé par de l'acide phosphonique et fonctionnalité furane ou oxanorbornène. Les nanoparticules fonctionnalisées ont été lavées trois fois dans de l'eau ultrapure par centrifugation (15 000 tr/min pendant 40 min) pour éliminer l'excès de POE non greffé à la surface des nanoparticules d'oxyde de fer.
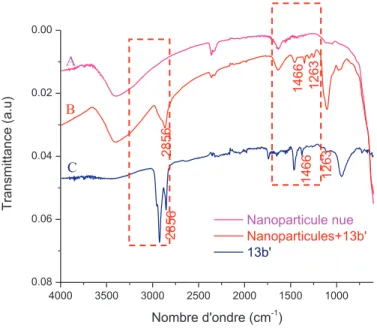
2. Mise en évidence de la fonctionnalisation des nanoparticules
Spectres FTIR-ATR de nanoparticules d'oxyde de fer (A) avant et (B) après greffage avec 13b et (C) 13b. Spectres XPS (A) avant et (B) après greffage du poly(oxyde d'éthylène) à terminaison acide phosphonique 13a' à la surface de nanoparticules d'oxyde de fer.
Quant aux nanoparticules nues, la taille des nanoparticules greffées par les POE avec des points d'acide phosphonique déterminés par DLS était supérieure à celle observée par TEM. Caractérisation de nanoparticules d'oxyde de fer greffées par des POE à extrémité acide phosphonique et à fonctionnalité furane ou oxanorbornène.
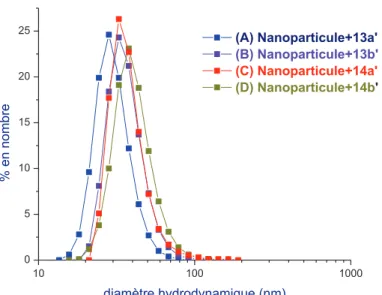
5. Etude de la stabilité des nanoparticules greffées
Taille et stabilité des nanoparticules greffées au POE avec des extrémités acide phosphonique : (A) Images de nanoparticules et (B) évolution de la taille des nanoparticules. Evolution de la taille des nanoparticules greffées en 13b et 14b dans un tampon phosphate (concentration 0,1 M ; pH = 7,4) en fonction de la concentration en BSA.
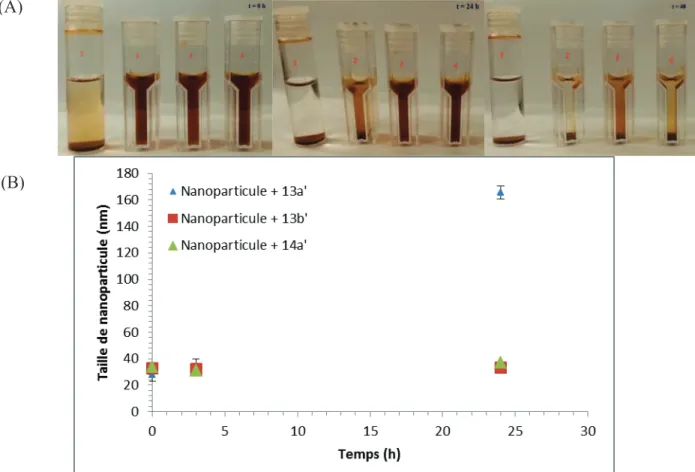
En conclusion, les nanoparticules d'oxyde de fer fonctionnalisées par des POE à terminaison acide phosphonique présentent une cytotoxicité compatible avec les applications biologiques envisagées. De plus, leur capacité de relaxation s’est avérée comparable aux agents de contraste commerciaux, confirmant leur potentiel en tant qu’agent de contraste pour l’IRM.
1. Réactivité de la fonctionnalité furane des nanoparticules greffées
La figure IV-22 montre que la durée de vie (t) du maléimide de tétraméthylrhodamine-5-C2 libre est de 2 s (figure IV-22, courbe verte). Répartition des durées de vie du maléimide de tétraméthylrhodamine-5-C2 (courbe verte), nanoparticules d'oxyde de fer greffées en 13a avec fonctionnalité.
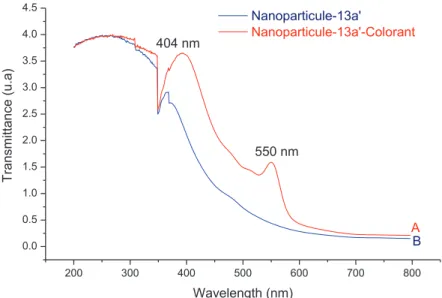
2. Réactivité de la fonctionnalité oxanorbornène des nanoparticules greffées
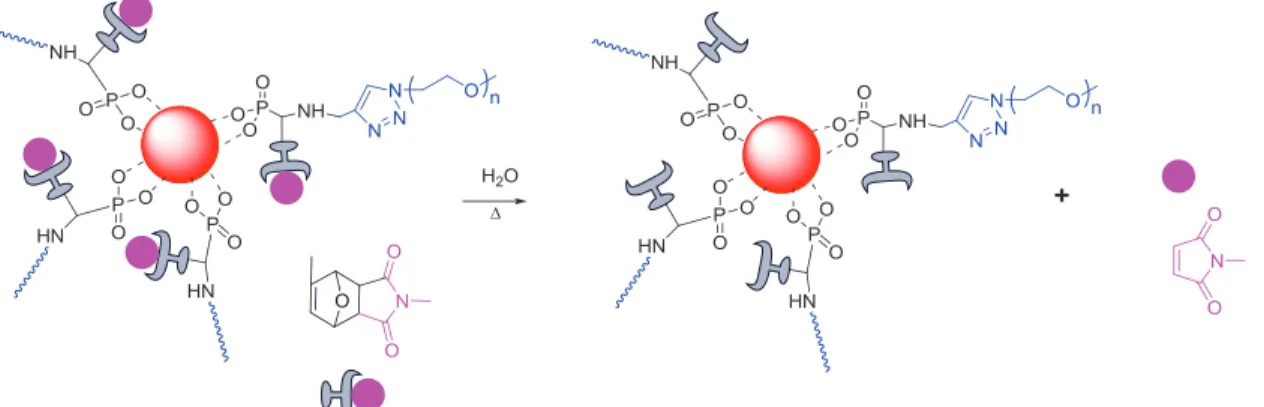
Rétroréaction de Diels-Alder de nanoparticules d'oxyde de fer greffées par POE 14a avec terminaison acide phosphonique. La rétroréaction Diels-Alder de nanoparticules d'oxyde de fer greffées avec 14a a été testée dans de l'eau ultrapure à 70°C pendant 24 heures.
CONCLUSION
CONCLUSION GENERALE
La réaction rétro-Diels – Alder du POE terminé par l'acide phosphonique et fonctionnalisé par l'oxanorbornène a été réalisée avec succès en 6 heures dans le TCE-d2. La densité de greffage des nanoparticules d'oxyde de fer fonctionnalisées par des POE à terminaisons acide phosphonique est d'environ chaîne/nm2.
PARTIE EXPERIMENTALE
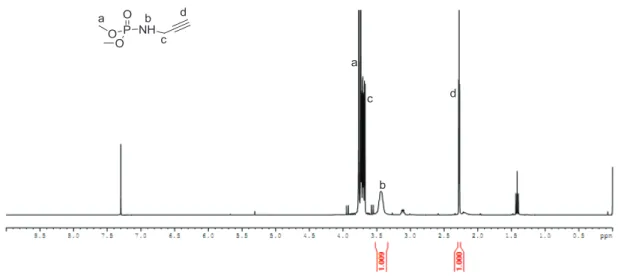
Dans un erlenmeyer de 100 mL contenant un barreau magnétique, on introduit successivement : 0,05 mole de N-propargylamine, 0,06 mole de TEA utilisée comme base, 10 mL de tétrachlorure de carbone et 25 mL de DCM. A ce mélange réactionnel placé sous agitation magnétique à température ambiante (TA), on ajoute goutte à goutte une solution contenant 0,05 mole d'hydrogénophosphonate de di(m)éthyle et 15 ml de tétrachlorure de carbone.
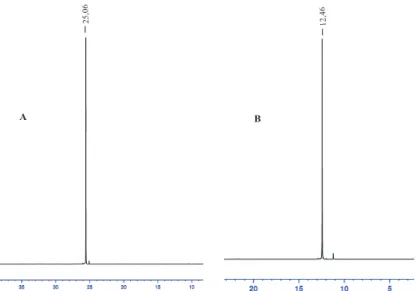
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 8,25
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 10,86
La solution est diluée dans 70 ml de DCM puis cette solution est lavée deux fois à l'eau salée. Après filtration, le solide blanc cassé obtenu est séché sous vide à 40°C jusqu'à poids constant.
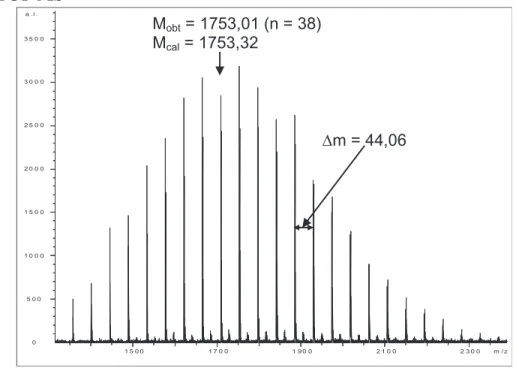
Le mélange est placé sous atmosphère d'azote à 0°C et du bromure de triméthylsilyle (0,46 g, 1,35 mmol) est ajouté goutte à goutte. Le mélange est placé sous atmosphère d'azote à 0°C, après quoi 0,96 g (6,4 mmol) de bromure de triméthylsilyle sont ajoutés goutte à goutte.
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 25,06
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 22,86
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 25,34
cliquez sur la réaction chimique entre le poly(oxyde d'éthylène) monométhyléthérazide et le diméthylphényl(prop-2-ynylamino)méthylphosphonate ou le diméthyl 2(3)-furanyl(prop-2-ynylamino)méthylphosphonate diméthyle. Dans un Schlenk A contenant une bande magnétique, on introduit séquentiellement 0,5 mmol de poly(oxyde d'éthylène) monométhyléther 2000 azide ou mmol de diméthylphényl(prop-2-ynylamino)méthylphosphonate ou 2(3)-furanyl(prop-2-ynylamino)méthylphosphonate, 0,1 g (0,6 mmol) de PMDETA et 5 ml de DMF.
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 25,52
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 23,04
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 25,40
RMN 31 P (CDCl 3 , 161,96 MHz), d (ppm) : 25,47
RÉACTION DIELS-AULNE ENTRE LES NANOPARTICULES D'OXYDE DE FER GREFFÉ 13a ET LA TÉTRAMETHYLRHODAMINE-5-C2 MALÉIMIDE. Poly(oxyde d'éthylène terminé par l'acide phosphonique), chimie "Click", Kabachnik-Fields, réaction de Diels-Alder, nanoparticules d'oxyde de fer.
Les POE obtenus ont ensuite été greffés à la surface de nanoparticules d'oxyde de fer selon la stratégie. De plus, les nanoparticules d’oxyde de fer, une fois greffées, ont conservé leurs propriétés de relaxation, permettant leur utilisation en imagerie médicale.