En vue d'obtenir un doctorat de l'Université de LILLE 1. Caractérisation des liaisons hydrogène dans les systèmes moléculaires d'intérêt biologique. Il est également responsable des propriétés remarquables de la glace et de l'eau (réduction de volume lors de la fusion, densité maximale à 3 984°C).
Mise en évidence de l’existence de la liaison hydrogène
La liaison hydrogène provoque un allongement du En spectrométrie de résonance magnétique nucléaire, la formation de la liaison hydrogène réduit la densité électronique autour des protons, entraînant un déplacement du signal RMN vers les basses fréquences de quelques ppm.

Nature de la liaison hydrogène
L'énergie d'une liaison hydrogène est de quelques dizaines de kilojoules par mole, tandis qu'une liaison de Van der Waals a une énergie comprise entre 1 et 4 kJ/mol, plusieurs centaines de kJ pour les liaisons covalentes. Cette énergie de liaison hydrogène est de l'ordre de l'énergie mise en jeu dans les fluctuations thermiques à température ambiante (300 K), ce qui explique son rôle essentiel dans les processus biologiques dont la réactivité est souvent conditionnée par le développement dynamique du réseau de liaisons hydrogène.
Propriétés de la liaison hydrogène
Elle revêt une grande importance dans l'architecture moléculaire de la glace ou de l'eau à courte distance, ou encore dans l'organisation de structures biologiques régulières comme les protéines (comme celle de l'hélice α) ou l'ADN. c) processus collaboratif (P2, P3). Cela a pour effet d'augmenter la capacité des autres atomes de la molécule, qui ne sont pas encore impliqués dans une liaison hydrogène, à être donneurs ou accepteurs de protons, favorisant ainsi la formation d'une seconde liaison, et ainsi de suite.
Spectroscopies de la liaison hydrogène
Dans l'exemple de l'eau liquide, le spectre de diffusion Raman révèle une bande d'absorption d'intensité croissante lorsque la température diminue, en raison du couplage et de la phase des oscillateurs intermoléculaires composés de liaisons O-H-. Le champ magnétique externe est en fait modifié localement par un champ magnétique induit dû aux mouvements électroniques de l'atome et de ses voisins.

Effets de la deutération
Nous présenterons ensuite, et indépendamment de ce qui précède, les fonctions de distribution de paires (§7) et de corrélation de Van Hove (§8) pour un liquide monoatomique. Nous présenterons ensuite les aspects expérimentaux (source de neutrons, diffractomètres, etc.) rencontrés lors de ces travaux.
Le neutron
Intérêt des neutrons
Diffusion des neutrons par un atome
La diffusion s'effectue sous la forme d'une onde sphérique (figure 5) qui est caractérisée par la longueur de diffusion b qui est un nombre complexe. La partie imaginaire de la longueur de diffusion correspond à l'absorption du neutron, et la partie réelle à la diffusion.

Diffusion élastique et inélastique
Des corrections sont alors nécessaires lors de l’analyse d’expériences dont les échantillons incluent des noyaux légers. Dans le cas d'une diffusion inélastique, on détermine l'énergie échangée entre le neutron et le système de diffusion par
Diffusion cohérente et incohérente
Avec l'expression de la section efficace totale :. nous pouvons enfin dériver l'expression de la section efficace de diffusion incohérente. La partie cohérente de la diffusion est donc celle qui correspond à une valeur moyenne de la longueur de diffusion attribuée à tous les atomes à chaque instant.
Diffusion par une assemblée d’atomes
A est tel que A pζ A'. le développement détaillé du calcul est donné en Annexe I intitulée « Calcul de l'expression simplifiée de la section efficace différentielle partielle. Compte tenu du fait que c’est la partie réelle de la longueur de diffusion qui est impliquée dans la diffusion, l’équation devient la section efficace différentielle partielle.
La fonction de distribution de paires
Donc ρ(2)(r1,r2)dr1dr2 est la probabilité moyenne de trouver un atome dans le volume d et un autre dans r1 d en même temps. Mais si les volumes r2d et r1d sont proches l'un de l'autre, la probabilité r2 de trouver un atome dans d peut dépendre de la probabilité d'occupation de r2d.
La fonction de corrélation de van Hove
Notons que pour t = 0 on est dans le cas de la section précédente, c'est à dire une investigation du système à un instant donné, et qu'il faut alors pouvoir relier les différents résultats. Notons que nous avons désormais ρ0, et non plus ρ02, comme c'était le cas dans l'équation (28), car nous sommes désormais sûrs d'avoir un atome à l'origine.
Le facteur de structure dynamique
C'est donc le facteur de structure dynamique auquel nous accédons grâce à une expérience de diffusion de neutrons, et qui nous donnera ensuite la fonction de corrélation spatio-temporelle par double transformation de Fourier.
Approximation statique
Notez que cette limite pour les petits vecteurs de diffusion du facteur de structure tient compte de la thermodynamique du système. On voit encore, via la fonction de corrélation spatio-temporelle avec t = 0, que le facteur de structure nous donne un "instantané" du système diffuseur d) Cas d'un système homogène et isotrope.

Cas d’un liquide moléculaire constitué de plusieurs espèces atomiques, dans le cadre
Elles sont alors négligeables pour les valeurs de transfert aux grands moments, comme le montre l'exemple de la figure 8, et on peut schématiser les zones où les différentes contributions prédominent. A noter qu'on peut également approximer ces données via la représentation graphique de la transformée de Fourier dont la pente à l'origine est (− π ρ2 2 mr).

Le spectromètre D4c, spectromètre de type « 2 axes »
On voit sur la figure 14 que la « banane », située à un rayon de 1146 mm du centre de l'échantillon, est composée de 9 détecteurs de dimension angulaire de 8°, avec un angle de séparation de 7,5°. L'expression (50) du facteur de structure est donc peu affectée. Figure 14 : schéma général du diffractomètre D4 version C. vu de dessus) (de référence I1).

Le spectromètre SANDALS, spectromètre à temps-de-vol
Comme c'est le cas pour le spectromètre D4c, l'environnement de l'échantillon dépend des conditions expérimentales souhaitées. D1 : Structure de l'adamantane deutéré par diffusion neutronique, C.Siat, Université des Sciences et Technologies de Lille, (1995).

Calibration de la longueur d’onde et de l’angle incident
Soustraction du bruit de fond
Diffusion multiple
Si nous connaissons les longueurs de diffusion et pouvons estimer la diffusion multiple et la valeur de S(0), nous avons un système de deux équations à deux inconnues M et I(∞), que nous pouvons alors évaluer. Cependant, nous ne connaissons précisément que les valeurs de I(0) et la longueur de diffusion, et la diffusion multiple et le facteur d'amplitude M seront toujours sujets à ajustement au final.

Correction de l’approximation statique
Il en est alors de même pour le spectre NMA obtenu sur le spectromètre D4c, dont le transfert de moment maximum est de même valeur. Cependant cette correction sera prise en compte pour le spectre NMF dont Qmax = 23 Å-1.
Fonction d’ajustement
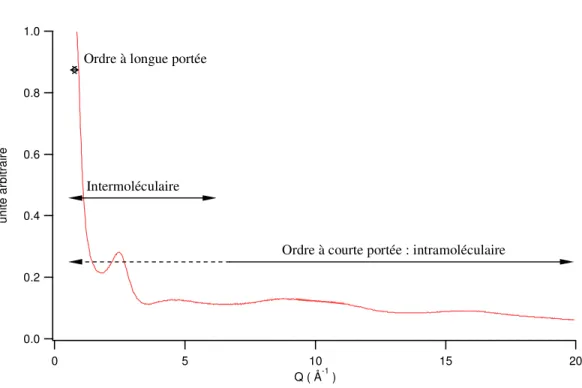
Cette méthode développée en laboratoire pour analyser les spectres de diffusion des neutrons sur les liquides moléculaires consiste à ajuster le facteur de forme de la molécule aux transferts de moments importants et à le soustraire du spectre total, pour isoler la contribution des interactions intermoléculaires telles que les liaisons hydrogène.
Diminution du nombre de paramètres ajustables
Méthode de composition des déviations quadratiques moyennes
Dans le cas des molécules, les différentiels peuvent être identifiés par des écarts par rapport à la moyenne et on peut remplacer la notation « d » par « δ ». Pour valider notre méthode, nous avons effectué des simulations dans le cas de deux composés, dont certains sont présentés en Annexe III.
Etude des déviations quadratiques moyennes angulaires dans le cas d’un groupement
Etude des déviations quadratiques moyennes angulaires dans le cas de trois liaisons
Si désormais un seul maillon constitue l'axe de symétrie, deux des écarts angulaires carrés moyens (ceux répartis de part et d'autre de l'axe) sont identiques. Bien qu'il soit possible d'ajuster seulement deux des angles lors de nos ajustements, nous devrons ajuster les trois écarts quadratiques moyens.
Détermination de la zone d’ajustement
Prenons l'atome central comme point fixe du plan et considérons l'oscillation des liaisons a, b et c, qui peuvent s'écarter de leurs directions moyennes de l'angle noté respectivement δa, δb et δc (voir Figure 21). Le choix de Qmin peut être guidé par la simulation des premières contributions intermoléculaires (telles que les liaisons hydrogène), ce qui donne une première idée de la limite inférieure du domaine à ajuster.
Passage de l’espace réciproque à l’espace direct
Il doit en effet être choisi très soigneusement et déterminé par une série d'ajustements faisant varier Qmin, de sorte que la contribution intermoléculaire au spectre total au moment de la transmission soit supérieure à Qmin.
Substitution isotopique
La substitution la plus courante est la substitution hydrogène/deutérium, particulièrement adaptée au monde biologique où les objets sont complexes et les protons omniprésents. Notons que si notre objectif est de caractériser la liaison hydrogène à proprement parler, notre choix se réduit à deux possibilités, la substitution de l'atome accepteur ou celle de l'hydrogène.
Avantage de notre méthode
La longueur de la liaison hydrogène est de 2,25 Å avec moins de 2 atomes d'hydrogène attachés à chaque atome d'azote. Nous avons décidé de reprendre l'étude de la structure locale de l'ammoniac liquide en utilisant deux approches complémentaires.

Caractérisation de la liaison H par ajustement du facteur de forme de la molécule aux
Pour aller plus loin dans l'interprétation du spectre dans la région de 1 à 3 Å, nous supposons que la contribution de la liaison hydrogène au facteur de forme peut s'écrire comme pour une liaison covalente sous la forme . La longueur de la liaison hydrogène reste d'environ 1,72 Å et le nombre de liaisons H par atome d'hydrogène n'est pas bien défini par l'ajustement ; en effet les valeurs du facteur Debye-Waller et le nombre de liaisons H sont fortement corrélées.

Caractérisation de la liaison H par la méthode de substitution isotopique
Nous avons appliqué notre méthode analytique à l'ammoniac liquide et obtenu un résultat qui remet en question les caractéristiques des liaisons hydrogène dans ce liquide. Les paramètres de liaison hydrogène (distances O---H et O---N) ont également été étudiés dans les deux cas conformationnels.

Modélisation de la molécule
Représentation des contributions des distances intramoléculaires au facteur de structure,
Nous voyons sur la figure 40 qu'aucun domaine de transfert de moment ne peut expliquer à lui seul le facteur de forme des connexions. Les simulations nous portent à croire que nous pouvons régler un facteur de forme simplifié impliquant uniquement les distances les plus courtes sur une plage supérieure à 14,5 Å-1 (voir Figure 40).

Détermination des paramètres et de la conformation de la molécule par ajustement du
L'ajustement dans le cas de la rotation libre du méthyle est présenté sur la figure 43. Nos valeurs pour les longueurs de liaison C=O (resp. Cm-H) sont supérieures (resp. inférieures) à celles de la littérature, mais dans l'ordre obtenu par Neuefeind (P5) et al.

Caractérisation de la liaison hydrogène
Il ne nous a pas été possible d’ajuster directement la liaison hydrogène au facteur de structure expérimental en abaissant la valeur de la limite inférieure du domaine d’ajustement. Pour un transfert de moment supérieur à 18 Å-1, le facteur de structure ne dépend pas de la conformation des méthyles.