Megtiszteltetés Oroszlán Mártonnak és Gábornak, hogy az elmúlt években nemcsak szakmailag, hanem barátként is mellettem álltak. Továbbá szeretném megköszönni a Szerkezeti Biofizikai csoport és az Enzimológiai Tanszék minden munkatársának, hogy bármilyen kérdéssel fordulhattam hozzájuk. Külön szeretnék köszönetet mondani munkámhoz való hozzájárulásukért, ami segített abban, hogy alaposabban áttekintsem az általam vizsgált témákat, és ezáltal teljesebb képet kapjak eredményeimben a vizsgált kérdésekről.
BEVEZETÉS
IRODALMI ÁTTEKINTÉS
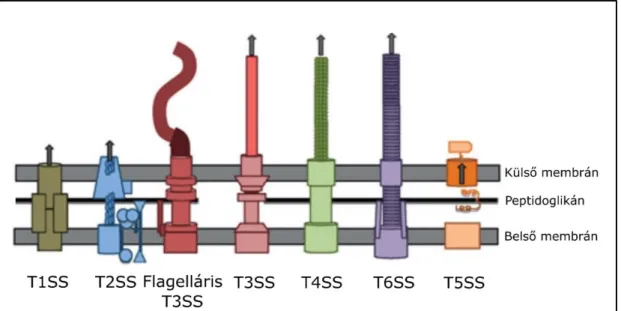
Bakteriális szekréciós rendszerek
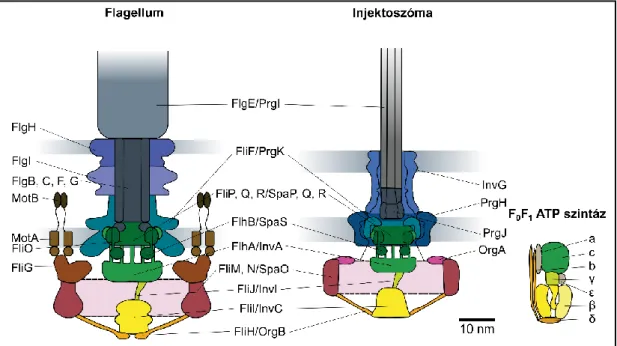
A flagellum, az injektoszóma és a III-as típusú szekréciós apparátus
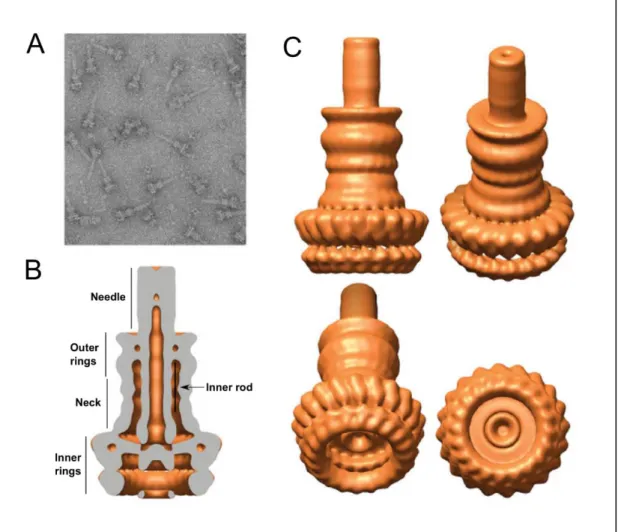
Mindkét T3SS-ben található komponensek középen helyezkednek el, csak a flagelláris alegységek a bal oldalon, míg a csak az injectoszómában jelenlévő alegységek az injectoszóma jobb oldalán találhatók. A belső membránban található az FliF monomerekből álló MS gyűrű, melynek citoplazmatikus oldalához kapcsolódik a C gyűrű, amelyet a FliG, FliM és FliN fehérjék alkotnak. A két szerkezet extracelluláris része már jelentős eltéréseket mutat, a flagellummal ellentétben az injektszómában a horog és a hosszú filamentum helyett egy rövid egyenes tű kapcsolódik az alaptesthez.
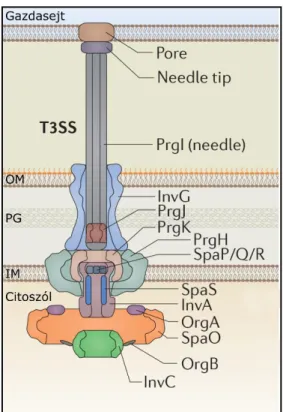
Az injektoszóma
A belső gyűrűk fölé a szekretin fehérjék családjába tartozó InvG építi fel a külső membránba ékelődő külső gyűrűket és a belső gyűrűkkel összefüggő nyakat (Costa et al., 2015). Ismeretes, hogy a citoplazmatikus SpaO, OrgA és OrgB fehérjék válogatóplatformot képeznek a tűkomplexum alján, és ebből ismerhető fel a szubsztrát-chaperon komplex. Az egyes chaperonok különböző affinitással kötődnek ehhez a platformhoz, ezáltal biztosítják, hogy a transzlokátor fehérjék a megfelelő sorrendben és az effektor fehérjék előtt szekretálódnak (Costa et al., 2015).
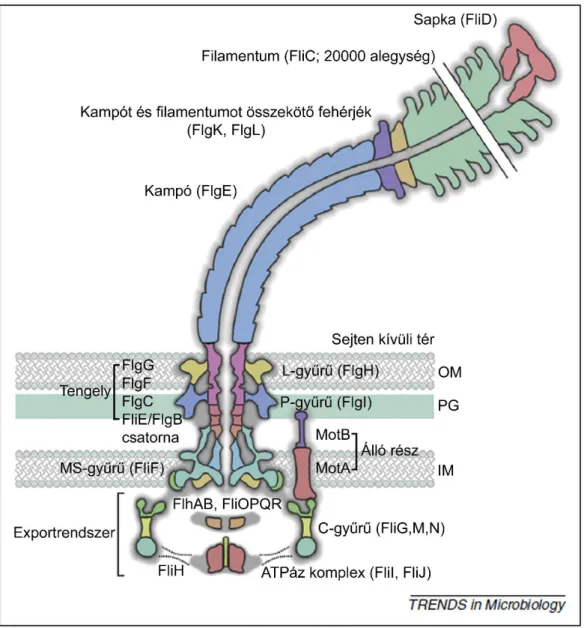
A flagellum
Ezt követően a C gyűrű, amely a rotor/kapcsoló komplex (FliG, FliM és FliN fehérjékből áll), kötődik az MS gyűrű citoplazmatikus oldalához (Erhardt et al., 2010). A protonmozgató erő két összetevőből áll: a potenciál (ΔΨ) és a protonkoncentráció (ΔpH) a membrán két oldala között változik (Paul et al., 2008). Leírták, hogy ezeknek a késői fehérjéknek az exportálásához szubsztrát-chaperon komplexek szükségesek ahhoz, hogy az ATPáz komplexhez kötődjenek (Thomas et al., 2004).
A késői fehérjék és az exportchaperonok
Ennek alapján a FliJ az alacsony kópiaszámú késői szubsztrátok szekrécióját is elősegíti a flagellin előtt (Bange et al., 2010; Evans et al., 2006).
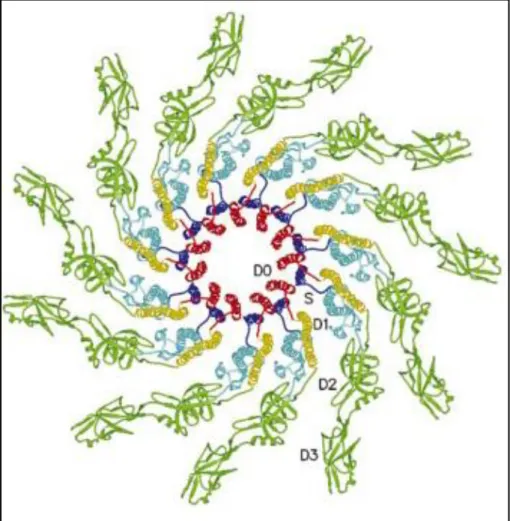
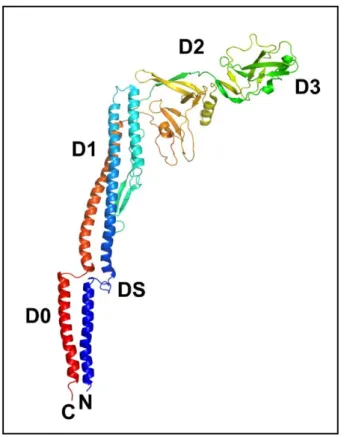
A flagellin és a filamentum szerkezete
Az N-terminális vége a D0 doménben kezdődik és a D1, D2 láncon keresztül a D3 doménig folytatódik, majd visszatér és a lánc ismét a D2, D1 doménen megy keresztül, míg végül a molekula C-terminálisa ismét a D0 doménben helyezkedik el. Bár a domének közötti régiók mindegyikét egy-egy rövid antiparallel lánc alkotja, a D0 és D1 doméneket összekötő régió hosszabb, mint a másik kettő, ezért pl. régiónak (DS) is nevezik. A filamentum fejlődése során a laza másodlagos struktúrát a rendezetlen régiók stabilizálják, így kompakt struktúra jön létre (Aizawa et al., 1990; Vonderviszt et al., 1989).
FliS
Bár szerkezetét még nem határozták meg, valószínűleg nagyrészt α-helikális (Auvray et al., 2001).
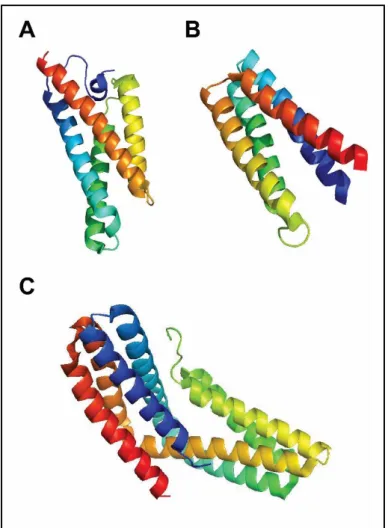
A szolubilis exportkomponensek
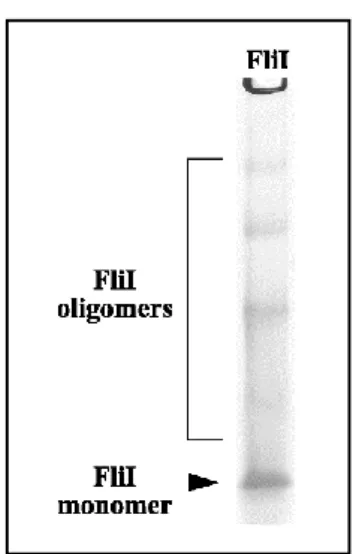
A FliJ szintén növeli a FliI ATPáz aktivitását, valószínűleg a hexamerizáció elősegítésével is (Ibuki et al., 2011). Kimutatták, hogy az FliH a FliI N-terminális részéhez kötődik, ezáltal gátolja a hexamerizációt és csökkenti az FliI ATPáz aktivitását (Minamino et al., 2006). Egy másik lehetséges forgatókönyv szerint a komplex a FliH-FlhAC kölcsönhatáson keresztül horgonyoz le (Hara et al., 2012).
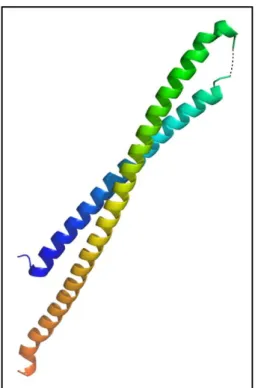
Az exportszignál
CÉLKITŰZÉS
ANYAGOK ÉS MÓDSZEREK
- Fehérjék előállítása
- Klónozás, DNS konstrukciók
- Elektrokompetens sejtek készítése, elektroporálás
- Fehérjék expressziója és tisztítása
- Fehérje-fehérje kölcsönhatások vizsgálata
- Kvarc kristály mikromérleg (QCM)
- ATPáz aktivitásmérés
- Exporthatékonyság vizsgálata
- SDS-PAGE és Western blot
- A bazális lízis mértékének meghatározása
- Exporthatékonyság meghatározása
- Enterokinázos hasítás, funkcionális vizsgálat
- Homológiamodell készítés és molekuladinamikai szimulációk
- Szerkezeti mérések
- Differenciális pásztázó kalorimetria (DSC)
- Cirkuláris dikroizmus (CD)
- Triptofán fluoreszcencia
- Proteolitikus emésztés
Az FliI-t tartalmazó frakciókat egyesítettük, majd egy éjszakán át dializáltuk 20 mM Tris, 200 mM NaCl, 1 mM EDTA pH 7,8 pufferrel szemben. Az FliH-t tartalmazó frakciókat egyesítettük, majd egy éjszakán át dializáltuk 20 mM Tris, 20 mM NaCl, 1 mM EDTA, pH 7,5 pufferrel szemben. A fehérjék tisztaságát minden esetben SDS-PAGE-val ellenőriztük (12,5%-os Laemmli gélen), majd centrifugális koncentrátorral koncentráltuk, 3 kDa-ra vágva, majd aliquot részekben lefagyasztottuk és -20°C-on tároltuk.
Centrifugálás után a szignálkonstrukciókat tartalmazó sejteket eredeti térfogatuk 1/10-ének megfelelő térfogatú desztillált vízben újraszuszpendáltuk, majd a sejteket melegítéssel és vortexeléssel lizáltuk azonos térfogatú SDS-PAGE standard redukáló pufferben. A már sejteket nem tartalmazó tápoldatot centrifugális koncentrátorral (Millipore) 50-szer betöményítettük, azonos mennyiségű standard SDS-PAGE mintaredukciós puffert vettünk, majd a sejteket és a tápközeget is tartalmazó mintákat 12,5%-os gélen futtattuk standard trisz-glicin pufferrendszerrel. Az SDS-PAGE mintapuffert tartalmazó mintákból 20-20 µl-t Coomassie kékkel festett gélekre, 10-10 µl-t Western blottoláshoz használt gélekre vittem fel.
Mindkét frakcióhoz standard SDS-PAGE mintaredukciós puffert adtunk 1:1 térfogatarányban, és 3 perces 95 °C-os forralás után mindkét frakcióból 20-20 µl mintát vittünk fel mind a Coomassie kékkel festett gélre, mind a Western blot gélre. SDS-PAGE és Western blot gélek esetén 15-15 µl SDS-PAGE standard redukáló mintapuffert adtunk 15-15 µl sejttisztított MBP-hez, majd 95 °C-on 3 percig forralva töltöttük a gélre. 16%-os végkoncentrációjú triklór-ecetsavval kicsaptam, majd a pelletet nem szabványos SDS-PAGE mintapufferben (250 mM Tris–HCl, pH glicerin, 4,5% SDS, 0,03% brómfenol kék, 5% β-merkaptoetanol) vettem, és SDS-tbloage módszerrel azonos módon Western-blot módszerrel analizáltam.
Különböző időpontokban 20-20 µl mintát vettünk az emésztőkeverékből, 20-20 µl standard SDS-PAGE mintapuffert adtunk hozzá, amely 0,3 mg/ml TLCK vagy PMSF proteáz inhibitort tartalmazott, majd azonnal inkubáltuk 10 percig 100°C-on.
EREDMÉNYEK ÉS ÉRTELMEZÉSÜK
Fúziós fehérjék exportja a flagelláris szekréciós rendszeren keresztül
- Problémafelvetés
- Konstrukciók
- Az exporthatékonyságot befolyásoló tényezők
- Az exportszignál kérdése
- Biotechnológiai alkalmazhatóság
- Eredmények értelmezése
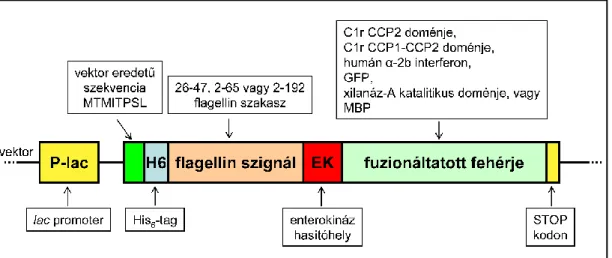
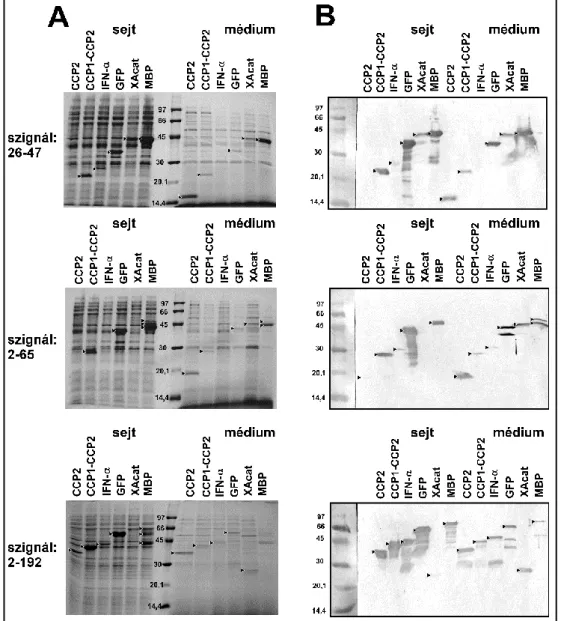
Ezekhez a fehérjékhez 3 különböző hosszúságú jelet fuzionáltam: az exporthoz minimálisan szükséges legrövidebbet (26-47 aminosavak között), az N-terminális rendezetlen régiót tartalmazó szegmenst (2-65 aminosavak között) és a teljes N-terminális konzervált régiót (2-192 aminosavak közötti rész). 8 esetben az ép fehérjék exportja rendkívül alacsony (< 5%) volt, vagy egyáltalán nem volt kimutatható. Ezzel szemben a flagellint meglehetősen hatékonyan exportálják, bizonyos mutáns sejtvonalak esetében hasonló sejtsűrűség mellett 6-10 mg/l monomer flagellin szekretálódott a táptalajba (Homma és mtsai, 1984; Ikeda és mtsai, 1983; Komoriya és mtsai, 1999), a flagellin jelenlegi oldata pedig a legnagyobb mennyiségben.
A legrövidebb jelhossz esetén az egyes fehérjék megoszlása az oldható és zárványtest frakciók között. A táptalajban ép 2-192-MBP volt jelen, de az export mértéke, valószínűleg a degradáció miatt, nem volt jelentős. Emellett leírták, hogy a részben vagy teljesen átfedő szegmensek (1-35 vagy 1-48 aminosav között) elősegítik a hozzájuk kapcsolódó fehérje exportját (Sun et al., 2007).
Ezért egy 3-as típusú szekréciós jel-előrejelző szerveren, az Effective-n ellenőriztem, hogy mit jósol a program jelként (Jehl et al., 2011). Azt tapasztaltam, hogy ha csak a 26-47. aminosavig lépek be a szakaszba, akkor azt túl rövidnek minősíti ahhoz, hogy hatékony exportjel legyen, a 25 aminosavnál rövidebb szekvenciák előrejelzése szerint nem adnak jelet. Egyrészt a 26-47-MBP konstrukció esetében ellenőriztem, hogy mikor szekretálódik, kivágva a többi N-terminális szegmenst, amely megelőzi a jelet és a fehérje eredményt.
Mind a hat fehérje esetében a 26-47 jelekhez fuzionált konstrukciót feketével, a 2-65 jelekhez fuzionált konstrukciót pirossal, végül a leghosszabb jelhez fuzionált konstrukciót kékkel jelöltem.
A szolubilis exportkomponensek szerepe a flagellin exportjában
- Problémafelvetés
- A vizsgált fehérjék
- A FliC és a FliC-FliS komplex nem köt a FliI-hoz
- A FliC és a FliC-FliS komplex nem köt a FliJ-hez illetve a FliH-hoz
- A FliC illetve a FliC-FliS komplex nem köt a FliI-hoz FliJ és/vagy FliH jelenlétében
- Kölcsönhatások liposzómák jelenlétében
- Eredmények értelmezése
Az ATPáz assay-hez használt pufferben az FliS 5 µM végső koncentrációig stabil, ezért a következő kísérletben a FliC-FliS komplexet 1 µM FliI-hez adtam 5 µM végső koncentrációban. Ez azt mutatja, hogy maga az FliI valójában nem köti sem a flagellint, sem a FliC-FliS komplexet. FliC, FliC-FliS, FliI, FliJ és ovalbumin permetezésével a FliH tárgylemez felületére a FliI és FliJ kölcsönhatást mutatott.
A QCM méréseket összegezve elmondható, hogy sem a FliC, sem a FliC-FliS komplex nem kötődik az egyes oldható export komponensekhez. A FliC vagy a FliC-FliS komplex nem kötődik FliI-hez FliJ és/vagy FliH vagy FliH jelenlétében. Annak megállapítására, hogy a FliC vagy a FliC-FliS komplex kötődik-e a FliI-FiJ komplexhez, megmértem a FliI-FliJ ATPáz aktivitást.
Végül megvizsgáltam, hogy a teljes FliI-FliJ-FliH komplex képes-e felismerni a FliC-t vagy a FliC-FliS-t. FliH és FliC jelenlétének hatása a FliI ATPáz aktivitásra, FliJ hozzáadásának hatása a FliI-FliH komplex aktivitására, valamint a teljes oldható FliC és FliC-FliS export komplex aktivitására. Sem a flagellin, sem a FliC-FliS komplex hozzáadása nem befolyásolta szignifikánsan a FliI-FliJ-FliH komplex ATPáz aktivitását.
Fontos megemlíteni, hogy liposzómák jelenlétében a FliS és a FliC-FliS komplex csökkenti a FliI-FliJ komplex ATPáz aktivitását, így kézenfekvőnek tűnik, hogy a FliS elősegítheti a membránhoz kötött komplex szétesését, de ennek bizonyítására további kísérletekre lesz szükség.
A FliS biofizikai jellemzése
- Problémafelvetés
- A FliS hődenaturációja
- A Salmonella FliS szerkezeti jellemzése
- A FliS dinamikus szerkezete
- Eredmények értelmezése
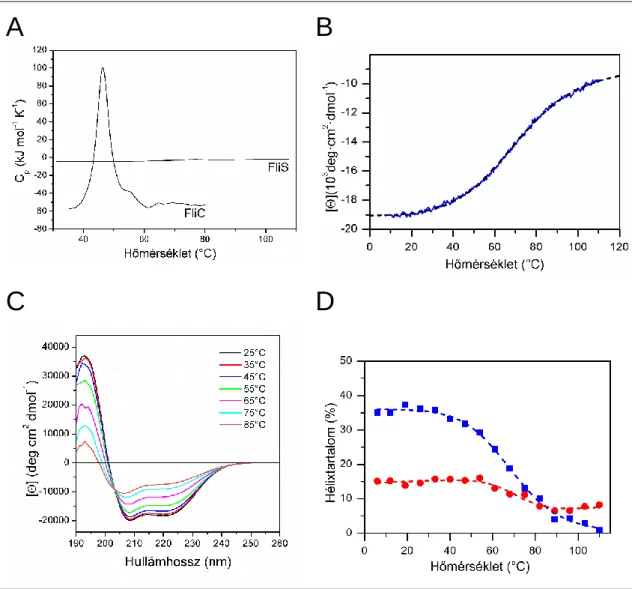
Mivel a Salmonella FliS valószínűleg nagymértékben α-helikális is (Evdokimov és mtsai, 2003; Galeva és mtsai, 2014), a növekvő hőmérséklet által kiváltott konformációs változásokat 220 nm-en követték nyomon. Feltételezve, hogy a 220 nm-en mért CD jel nagyjából arányos az α-hélixek mennyiségével, látható, hogy 110°C-on az α-hélixek aránya kb. Mivel a Salmonella FliS szokatlan módon viselkedett a hődenaturációs kísérletek során, szükségesnek láttuk annak bizonyítását, hogy a felhasznált fehérje funkcionálisan aktív az adott mérési körülmények között.
Izoterm titráló kalorimetria segítségével megállapítottuk, hogy a korábbi eredményekkel összhangban (Muskotál et al., 2006) a FliS szubmikromoláris disszociációs állandóval kötődik fő kötőpartneréhez, a flagellinhez. Jól látható, hogy mindkét proteáz többé-kevésbé ugyanazt az emésztési mintát adta, ami arra utal, hogy a Salmonella FliS feltekeredett maggal rendelkezik, de a végéről emésztett oligopeptid nem része ennek a kompakt szerkezetnek. Az Aquifex aeolicus, Helicobacter pylori és Bacillus subtilis baktériumokból származó FliS molekulák röntgenszerkezete négy antiparallel hélix elrendeződést mutat (Badger et al., 2005; Evdokimov et al., 2003; Lam és mtsai, 2010).
A 30 v/v%-nál kisebb koncentrációban alkalmazott TFE stabilizálja azokat a szegmenseket, amelyekben már nagy a hajlam a hélixképződésre (Bruch et al., 1989; Nelson és Kallenbach, 1986). Bár a proteolízis azt mutatja, hogy a FliS kompakt maggal rendelkezik, a DSC mérések nem mutatnak kooperatív átmenetet. A közelmúltban leírták, hogy az olvadt gömböcskék enzimatikus aktivitással is rendelkezhetnek (Pervushin et al., 2007; Vamvaca és mtsai, 2004), és specifikusan felismerhetnek bizonyos molekulákat (Bachmann és mtsai, 2011; Kjaergaard és mtsai, 2010).
Mivel harmadlagos szerkezetük nem állandó, olvadt golyóknak is tekinthetők (Kjaergaard et al., 2010; Mok et al., 2005).
ÖSSZEFOGLALÁS
Ezek a molekulák kis számú kópiában vannak jelen a sejten belül, ellentétben a flagellinnel, amely több mint 10 000 példányban lehet jelen egy baktériumban. Ez alapján kézenfekvőnek tűnik, hogy a kis példányszámban jelenlévő komponensek exportkapuig történő szállítását oldható exportkomplexnek kell támogatnia, míg a nagy mennyiségben jelenlévő flagellin diffúzió útján juthat el az exportkapuhoz. Ebben az esetben a FliS és a FliC-FliS komplex csökkenti a FliI-FliJ komplex ATPáz aktivitását, ami azzal magyarázható, hogy a FliS elősegíti a membránhoz kötött komplex szétesését, de ennek teljes bizonyításához további kísérletekre lenne szükség.
NMR és proteolitikus mérések segítségével megállapítottuk, hogy a FliS egy jól hajtogatott fehérje, kompakt maggal.
TÉZISEK
PUBLIKÁCIÓS LISTA
IRODALOMJEGYZÉK
Substrate specificity of type III flagellar protein export in Salmonella is controlled by subdomain interactions in FlhB. Molecular dissection of Salmonella FliH, a regulator of the ATPase FliI and the type III flagellar protein export pathway. Interaction of the extreme N-terminal region of FliH with FlhA is required for efficient export of bacterial flagellar proteins.
Structural insight into the regulatory mechanisms of the interactions of the type III flagellar chaperone FliT with its binding partners. FliH, a soluble component of the Salmonella type III flagellar export apparatus, forms a complex with FliI and inhibits its ATPase activity. Distinct roles of FliI ATPase and proton motive force in bacterial flagellar protein export.
The ATPase FliI can interact with the type III flagellar protein export apparatus in the absence of its regulator, FliH. Roles of the extreme N-terminal region of FliH for efficient localization of the FliH-FliI complex to the bacterial flagellar type III export apparatus: localization of the Salmonella FliH-FliI complex. Comparative analysis of the secretory capacity of early and late flagellar type III secretion substrates.
Docking of cytosolic chaperone-substrate complexes to a membrane ATPase during type III flagellin protein export.