Mátyus Péter irányításával diplomáztam a Semmelweis Egyetem Szerves Kémiai Intézetében, ahol 2004 szeptemberében bekapcsolódtam a terc-amino-hatás vizsgálatával kapcsolatos kutatómunkába. A 2-es típusú terc-amino-hatás kiterjesztése érdekében a biaril-rendszerekre a vinil- és terc-amino-csoportokat orto, orto' helyeztük el a két aromás gyűrűn. A doktori munkában a terc-amino-effektus 2004 szeptembere óta elért új alkalmazásait ismertetem.
The name tert-amino effect was originally coined by Meth-Cohn and Suschitzky in 1972, to describe the thermal isomerization with a ring closure reaction of ortho-substituted tertiary anilines. Two main lines were followed in my research: the first was related to the type 2 tert-amino effect of anilines with tertiary amino groups containing a series of aza rings and containing several cyclic and acyclic electron withdrawing groups in the vinyl group. The possible extension of the type 2-tert-amino effect to biaryl ring systems was also investigated.
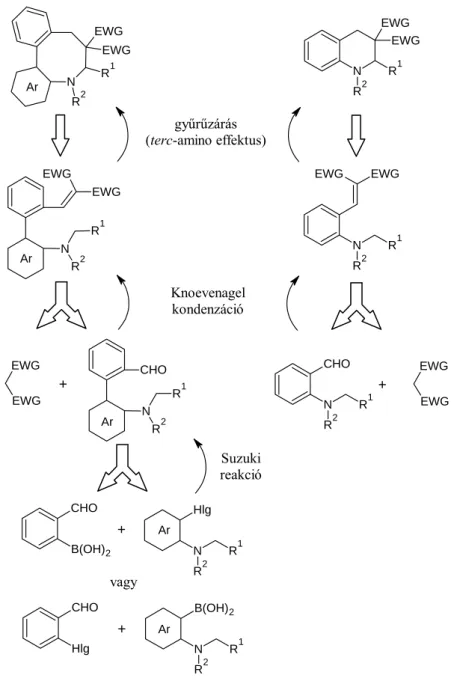
In two series of biaryl compounds, vinyl and tertiary amino groups were attached to the two aromatic rings in ortho, ortho' position for extension of type 2 tert-amino effect to biaryl ring systems. The modes of formation of phenanthridinium compounds and azoynes, respectively, represent two new types of the tert-amino effect.
Bevezetés, célok
Irodalmi rész
A terc-amino effektus
- A terc-amino effektus típusai
- A terc-amino effektus 2. típusának alkalmazása tetrahidrokinolin-származékok előállítására
- A terc-amino effektus 2. típusa nagyobb gyűrűtagszámú terc-aminocsoporttal
- A terc-amino effektus 2. típusának alkalmazása tetrahidropirido-piridazinok előállítására . 18
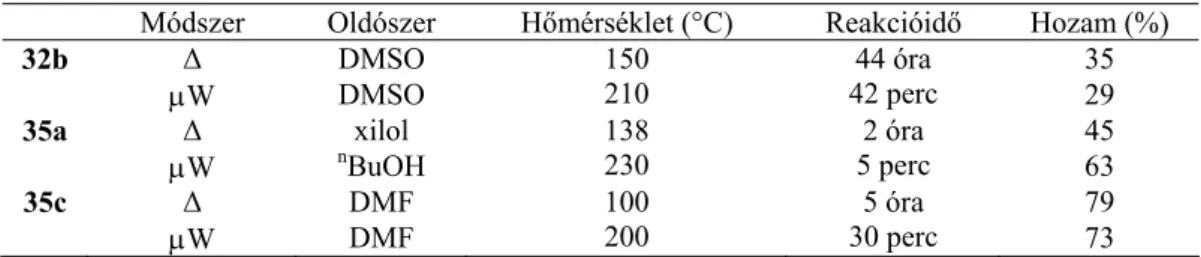
Végül a két ellentétes töltésű C1 és C6 szénatom között jön létre az új C-C kötés, amely egy tetrahidropiridin gyűrűt képez (2.4 reakcióvázlat).6,7 A reakció sebességét meghatározó lépése az [1, 5]- vándorlása. hidrogenit. amely Reinhoudt és munkatársai következtetései szerint intramolekulárisan, arc feletti átrendeződés, de nem szigmotrop. A reakció intramolekuláris természetét 9 deuterált vinilvegyület izomerizációja igazolta, mivel a gyűrűzárás során nem veszít deutérium (2.5 reakcióséma) 7 Az 1H NMR-rel végzett kinetikai vizsgálatok során azt találták, hogy 9 deuterált vinilvegyület zárja a gyűrűzáródást. lényegesen lassabban cseng (n-butanol, forrás, 4 óra), mint a nem deuterált származék (15c) (n-butanol, forrás, 2 óra). A két elektronszívó csoport jelenlétének jelentőségének bizonyítására D'yachenko és munkatársai a β egyik cianocsoportját, a β-dikanoetilént a kevésbé elektronszívó észtercsoportra cserélték, aminek eredményeként a reakciósebesség megnőtt. szignifikánsan csökkent, sőt, ha a β-szénatomon csak egy észtercsoportot helyeztek (16), egyáltalán nem történt gyűrűzáródás (2.7 reakcióvázlat).12 Az észtercsoportokat tartalmazó vinilvegyületek csökkent reakcióképességének oka nyomon követhető arra, hogy észtercsoportok jelenlétében a vinilcsoport β-szénatomján képződött negatív töltés kevésbé delokalizálódik, így a köztes termék kevésbé lesz stabil.
Míg a 14c vegyületet 2 óra elteltével butanolban visszafolyató hűtő alatt forralva gyűrűzárt termékké lehetett alakítani, addig a (18) nem aromás analóghoz 48 óra volt szükséges (2.8 reakcióvázlat). A dipoláris, aprotikus dimetil-szulfoxidban lezajlott reakciók gyorsabban mentek végbe, mint a toluolban.7 Ebből arra a következtetésre jutottunk, hogy a reakció sebességét meghatározó lépése ([1,5]-hidrogén migráció) egy poláris átmeneti állapoton keresztül megy végbe. reakcióséma 2.4). Meth-Cohn és kutatócsoportja dibenz[b,f][1,5]diazocinokat (29) állított elő para-szubsztituált tercier anilinek (25) és N-formil-N-szubsztituált arilamidok (26) Vilsmeier-reakciója során. POCl3 jelenléte (2.11. reakcióvázlat).
A terc-amino-hatás révén keletkezett első piridazin-származékok előállítását Mátyus és mtsai. 1994-ben.26 Ebben az eljárásban a 32 vinilpiridazinonokat 30 5-morfolinopiridazinon származékokból 31 aldehiden keresztül állítottuk elő két lépésben (2. re.). Wallis és munkatársai 40 vegyület ciklizációs reakcióját vizsgálták azepángyűrűkben 90 °C-on végzett NMR mérésekkel (2.16. reakcióséma).30 Feltételezésük szerint első lépésben egy 40 ikerionból álló gyűrű nyílik, amelyben a.
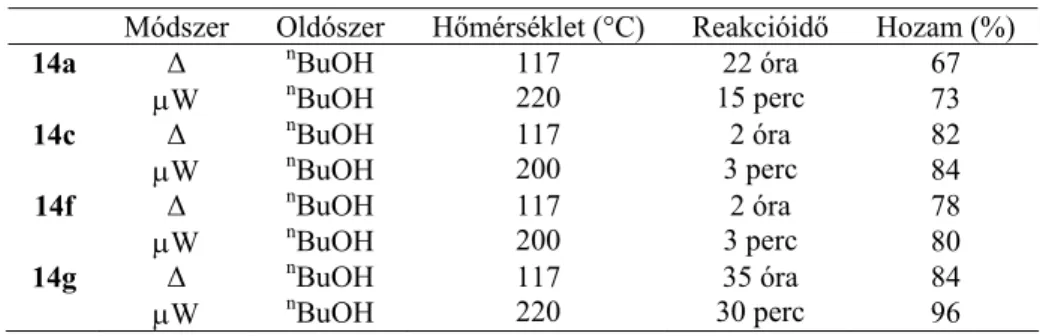
A terc-amino effektus kiterjesztéséhez szükséges modellvegyületek
- A Suzuki reakció
- Bifenilszármazékok előállítása Suzuki reakcióval
- Fenilpiridazinon-származékok előállítása Suzuki reakcióval
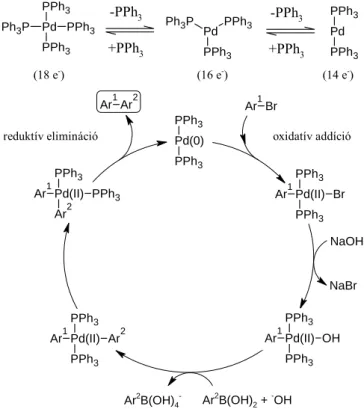
Az oxidatív addíció jellegében hasonló az aromás nukleofil szubsztitúcióhoz, de ebben az esetben a második lépés a sebesség meghatározó (2.18. reakcióséma). Az (51) aril-halogenidet benzolban forraljuk tetrakisz(trifenilfoszfin)palládium és 2 M nátrium-karbonát jelenlétében, így 52 bifenileket kapunk (2.20 reakcióvázlat).41. Wolfe aril-kloridból (56) kiindulva sztérikusan torlódó biaril-származékot (58) állított elő Pd(OAc)2, KF és 59, 60 ligandumok jelenlétében tetrahidrofuránban szobahőmérsékleten (2.22 reakcióvázlat).45.
Dai és munkatársai a 61. számú diazóniumvegyületek Suzuki-reakcióját végezték metanolban, Pd(OAc)2 és a 64. ligandum jelenlétében, szobahőmérsékleten (2.23. reakcióséma).46. A reakció kiindulási vegyülete az orto-N,N-dimetil-fenil-bórsav (66), amely N,N-dimetil-anilinből (65) lítációval, majd trimetil-boráttal végzett reakcióval állítható elő (2.24 reakcióvázlat).47 A kapott bórsav. sav (66) Suzuki orto-brómbenzaldehiddel történő kapcsolásával 2'-(dimetil-amino)-bifenil-2-karbaldehidet (41) kaphatunk.29. Ebből a megfontolásból csak 4,5-diarilpiridazin-3(2H)-onok állíthatók elő hatékonyan 2-szubsztituált 4,5-diklór-piridazin-3(2H)-onokból feleslegben lévő fenil-bórsav jelenlétében (2.26. reakcióvázlat).
A metoxicsoport bevezetése megoldást adott a szelektivitási problémák leküzdésére (2.27 reakcióséma) az alkalmazott oldószer polaritása .53. Az elektrondonor metoxicsoport jelenléte ellenére 72,73 klórmetoxipiridazin-3(2H)-on reagál a tetrakisz(trifenilfoszfin)palládiummal az oxidatív addíciós lépésben és az aril-bórsavval való Suzuki-reakciójuk során – a szerzők szerint – kvantitatív termékek 74, 75 ( 2.28 és reakcióséma 2.29).49.
Biológiai kapcsolódási pontok bemutatása
- Antimaláriás hatású vegyületek
- Szemikarbazid-szenzitív amin-oxidáz enzim (SSAO) szubsztrátum és inhibítor vegyületek
- Tumorgátló hatású allokolhicinoidok
Kísérleti rész
A kísérletek összefoglalása
A kísérletek leírása
- Az alkalmazott vizsgálati módszerek
- Új vegyületek előállítása és analitikai jellemzése
- Új tetrahidrokinolin-származékok előállítása és analitikai jellemzése
- Új bifenil- és fenilpiridazinon-származékok előállítása és analitikai jellemzése
- Aminometil-fenilpiridazinonok előállítása
Az általam előállított, az irodalomban már ismert vegyületek esetében az általunk mért spektroszkópiai adatok a szerkezettel összhangban voltak, vagy megegyeztek a publikált adatokkal. A két fázist elválasztottuk, a vizes fázist 2x20 ml kloroformmal extraháltuk, majd az egyesített szerves fázisokat 1x20 ml vízzel mostuk. A reakciót vékonyréteg-kromatográfiával követjük (eluens: n-hexán-etil-acetát 4:1 a 89g és 91a esetében; kloroform-etil-acetát 9:1 a 93f-hez).
1',2',3',3a'-tetrahidro-5'H-spiro[indén-2,4'-pirrolo[1,2-a]kinolin-]-1,3-dion (93b) A reakcióelegy bepároljuk, az olajos nyersterméket flash szilikagélen oszlopkromatográfiásan tisztítjuk (eluens: kloroform-etil-acetát 9:1). A reakcióelegyet bepároljuk, és az olajos nyersterméket flash szilikagélen oszlopkromatográfiásan tisztítjuk (eluens: 2'-piperidin-1-il-bifenil-2-il)-metilidén]-malononitril (99b). A reakcióidő letelte után az olvadékot hagyjuk szobahőmérsékletre hűlni, majd szilikagélen oszlopkromatográfiásan tisztítjuk (eluens: n-hexán-etil-acetát 5:1).
A reakcióelegyet bepároljuk, vízmentes dimetil-szulfoxidban (7 ml) oldjuk, és olajfürdőn 160 °C-on 24 órán át argonatmoszférában keverjük.
Diszkusszió
- A terc-amino effektus
- A terc-amino effektus 2. típusának vizsgálata: tetrahidrokinolin-származékok előállítása
- A terc-amino effektus 2. típusának vizsgálatához szükséges intermedierek előállítása
- A terc-amino effektus 2. típusának vizsgálata: Vinilvegyületek és tetrahidrokinolinok
- Azepán- és azokán-annelált tetrahidrokinolinok előállítása
- A terc-amino effektus vizsgálata és kiterjesztése bifenil- és fenilpiridazinon
- A terc-amino effektus kiterjesztésének vizsgálatához szükséges intermedierek előállítása
- A terc-amino effektus kiterjesztésének vizsgálatához szükséges intermedierek előállítása
- A terc-amino effektus kiterjesztése
- Aminometil-fenilpiridazinonok előállítása
A 88a-c,f,g vinilvegyületeket általában jó hozammal kaptuk rövid idő alatt az aldehidek (13a,d,e,f,i) malononitrillel végzett Knoevenagel kondenzációs reakciója során, amelyhez csak a 88a azetidin-származék előállítása volt szükséges. hosszabb reakcióidő volt (24 óra) (3.13 reakcióséma). Korábbi tapasztalataink azt mutatták, hogy a vinilvegyületen a gyűrűs elektronszívó csoportok jelenléte elősegíti az izomerizációs reakciót.23 Ezen megfontolás alapján 2-(azetidin-1-il)benzaldehid kondenzációs reakciójával állítottuk elő a 90a azetidin vegyületet ( 13f) és N,N-dimetil-barbitursav (3.14 reakcióvázlat). Továbbá a 13a,e származékokat 1H-indén-1,3(2H)-dionnal kondenzáltuk, és megvizsgáltuk az ilyen típusú elektronvonó szubsztituensek hatását az izomerizációs reakcióra (3.15. reakcióvázlat).
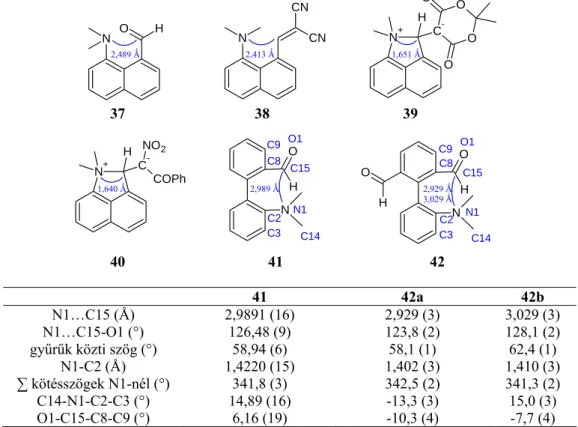
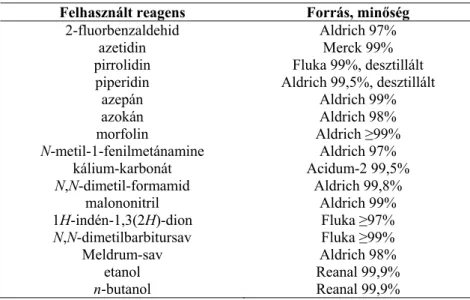
A dicianonanalógokhoz hasonlóan a Knoevenagel kondenzációs reakció során közvetlenül gyűrűzárt termékek keletkeztek, vinilvegyületeket ebben az esetben sem sikerült izolálni (3.16. reakcióséma). A közeg polaritásától függően 4- és 5-amino-származékok állíthatók elő 4,5-dihalogén-piridazinonokból.70 A 109a-c piridazinonokat 4,5-diklór-2-metil-piridazin-3(2H)-ból (67a) állítják elő. A 63 vegyületet megfelelő bázissal (a : pirrolidin, b: piperidin c: dimetil-amin etanolos oldata) a 71 vegyületet vizes etanolban forralva kapjuk (3.18. reakcióvázlat). A nitrogénatom és a karbonil-szénatom közötti kölcsönhatás bizonyítására a 41 és 98a aldehidek gyűrűjét enyhe körülmények között (NMR csőben, CDCl3 oldószerben, csepp CF3CO2D jelenlétében, kb. 25 °C) (3.19. reakcióséma), amely ikerionos 107a,c-t eredményezett, elérkeztünk a szerkezetekhez.
A 99a-c és 111a-c vinilvegyületeket jó hozammal kaptuk a 41, 98a,b és 110a-c aldehidek Knoevenagel kondenzációs reakciója során malononitrillel szobahőmérsékleten (3.20 reakcióvázlat). Korábbi tapasztalataink alapján várható volt, hogy az ilyen gyűrűben lévő β-vinil szénatomot tartalmazó származékok ezt követő izomerizációs reakciója a terc-amino-hatás miatt gyorsabban megy végbe.23 A bifenil-karbaldehidek 41, 98a,b 1H - indén-1.)-dion, a várt (100b) vinilvegyület izolálható volt (3.21 reakcióvázlat). Egy esetben sikerült mindkét típusú terméket előállítani: a korábban izolált 99c vinilvegyületet diklór-metánnal szilikagélen tovább tisztítva a 101c ikerionos származékot kaptuk (3.23 reakcióvázlat).
Az új hattagú gyűrűs szerkezetek kialakulása egy új típusú terc-amino-effektussal magyarázható, melynek során a vinilcsoport pozitívan polarizált α-szénatomja és a tercier aminocsoport nitrogénje között gyűrűzáródás történik. A 110a–c aldehidek 1H-indén-1,3(2H)-dionnal 1H-indén-1,3(2H)-dionnal szobahőmérsékleten végzett Knoevenagel-kondenzációjában, ellentétben a bifenilek fenantridiniumképződő gyűrűzárására való készséggel, csak a 112a–c viniltermékek keletkeztek. . piperidin katalizátor jelenléte (3.24 reakcióvázlat). Munkánk további céljának megfelelően a bifenil- és fenantridinium-származékok dibenzazocinokká történő izomerizációs reakcióját vizsgáltuk a terc-amino-hatáson keresztül.
Az eredmény meglepő volt: két gyűrűrendszer alakult ki, a várt dibenzazocin 104a (csak 23%-os hozam) és fenantridin) (3.27. ábra). Röntgen-diffrakciós vizsgálataink megerősítik, hogy az orto-(orto-vinil-aril)-aril-terc-aminok terc-amino- és vinilcsoportjai a biaril-rendszer azonos oldalán, térben nagyon közel helyezkednek el egymáshoz. A Szerves Kémiai Intézetben az SSAO enzimgátlókkal kapcsolatos kutatómunkához csatlakozva a 110a–c aldehidekből 119a–c oximokon keresztül 120a–c aminokat állítottunk elő (3.31 reakcióséma).
Összefoglalás
Függelék
Irodalomjegyzék
The tertiary amino effect in heterocyclic synthesis: mechanistic and computational study of the formation of six-membered rings. Rusanov: The tert-amino effect in the synthesis of hetaryl- and arylsulfonyl-substituted pyrrolo- and. Mátyus: Thermochemical study of the ring closure reaction of 5-morpholino-4-vinylpyridazinones by tert-amino effect.
Van der Eyken: Practical and rapid microwave-assisted synthesis of pyrido-fused ring systems utilizing the tert-amino effect. Van der Eyken: An efficient microwave-assisted solvent-free synthesis of pyrido-fused ring systems utilizing the tert-amino effect. Applications of tert-amino effect and a nitrone-olefin 1,3-dipolar cycloaddition reaction: synthesis of novel diazino-heterocycles.
Yang: Synthesis of a new C-2-symmetric thiourea and its application in the Pd-catalyzed cross-coupling reactions with arendiazonium salts under aerobic conditions. Ravina: Pyridazines XVII: An efficient palladium-catalyzed cross-coupling reaction for the synthesis of 5-substituted 6-phenyl-(2H)-pyridazin-3-ones. Géritte: Application of palladium-catalyzed borylation/Suzuki coupling (BSC) reaction for the synthesis of biologically active biaryl lactams.
Synthesis of the dibenzo[f,h]phthalazine and dibenzo[f,h]cinnoline backbone via a 'Suzuki-Pd-catalyzed intramolecular arylation' and a. New extensions of the tert-amino effect: formation of phenanthridines and diarene- fused azocines from ortho-ortho'-functionalized biaryls. Ring closure reactions of ortho-vinyl-tert-anilines and (di)aza-heterocyclic analogues via the tert-amino effect: recent developments.
New extensions of the tert-amino effect: formation of phenanthridines and diarene-fused azoynes from ortho-ortho'-functionalized biaryls. Mátyus: A new type of the tert-amino effect: Application to the synthesis of fused macrocyclic compounds. Mátyus: Synthesis of dibenzozocines and a pyridazino-fused benzazocine by application of a new type of tert-amino effect.