Bevezetés
A biotechnológiai készítmények az eddigi tapasztalatok alapján számos előnnyel rendelkeznek a vegyi úton előállított termékekkel szemben. Az iparban jelenleg alkalmazott szárítási technológiák (pl. porlasztva szárítás, fagyasztva szárítás) azonban a bioaktív anyagok érzékenysége miatt degradációt okozhatnak.
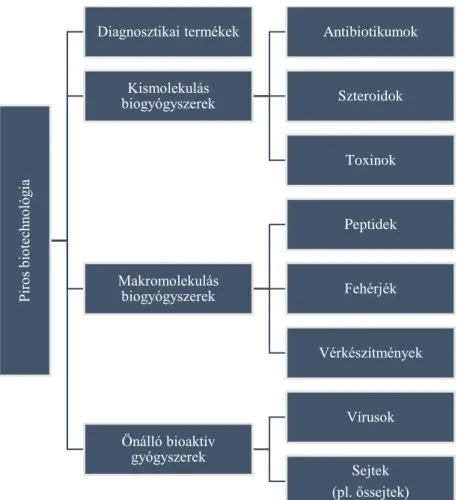
Szakirodalmi áttekintés
A Process Analytical Technology (PAT) módszer a
- A PAT megvalósítására alkalmas analitikai eszközök
- PAT fontossága az emlőssejtes tenyésztések során
A bioreaktorok fizikai-kémiai paramétereinek (pl. pH, hőmérséklet, keverő fordulatszám, nyomaték, DO és szén-dioxid) mérésére alkalmas klasszikus érzékelők széles körben használatosak. A felvett spektrumok minőségi és mennyiségi információkat tartalmaznak a vizsgált oldat (pl. fermentlé) kémiai összetételéről és a sejtek állapotáról.
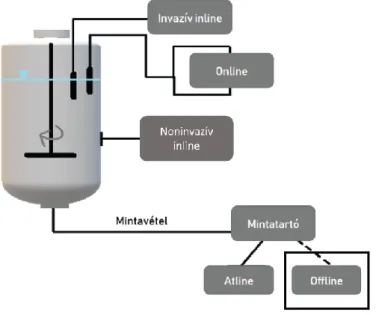
Adatelemzési módszerek alkalmazása PAT adatok feldolgozására
Raman spektroszkópia, mint PAT eszköz
Raman spektroszkópia alkalmazása biotechnológiai folyamatok monitorozásában
- Élesztő fermentáció vizsgálata Raman spektroszkópiával
- Emlőssejtes tenyészetek vizsgálata Raman spektroszkópiával
- Emlőssejtes tenyésztési folyamatok Raman spektroszkópia alapú
A Raman spektroszkópia alapján információkat kaptak a tenyészetről, ami lehetőséget teremtett az esetleges hibák korai felismerésére (minőségellenőrzés). Abu Absi és munkatársai34 elsőként bizonyították, hogy az in-line Raman spektroszkópia alkalmas több tenyésztési paraméter egyidejű vizsgálatára emlős sejt bioreaktor tenyésztések során.
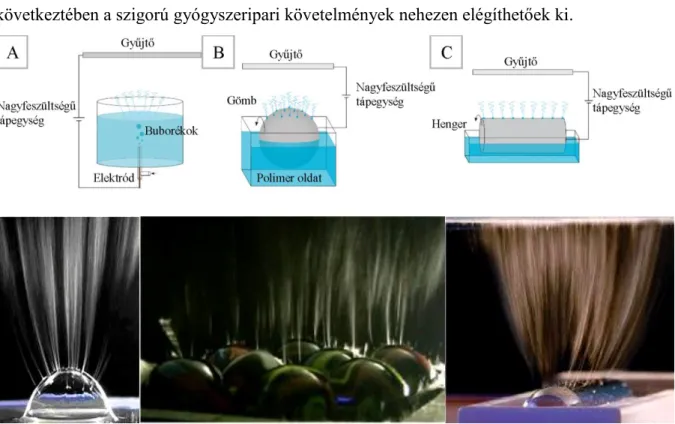
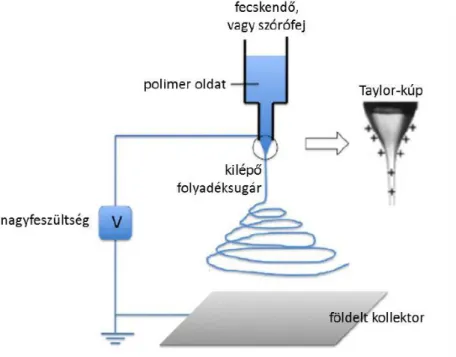
Elektrosztatikus szálképzés
Az elektrosztatikus szál kialakítása során a permetezőfej és az alaplemez távolsága, a feszültség és a polimeroldat betáplálási sebessége változtatható. A következőkben részletesebben bemutatom az elektrosztatikus rostok képzésének hasznosságát a szövetmérnökség területén háromdimenziós vázanyagok fejlesztésére, valamint bioaktív anyagok szilárd formáinak előállítására.
Vázstruktúrák fejlesztése háromdimenziós szövettenyésztésekhez
- Sejtek mikrokörnyezete
- A háromdimenziós szövetek felhasználása
- Vázstruktúrák típusai
A gyógyszerfejlesztés során a preklinikai fázisban in vitro és in vivo toxikológiai és farmakológiai kísérleteket végeznek állati és emberi eredetű sejt- és szövettenyészet modellek felhasználásával. Jól megtervezett keretanyagok felhasználásával 3D in vitro modell készíthető, amely képes az eredetihez hasonló környezetet reprodukálni.
Biohatóanyagok gyógyszerformái
A PCL és a zselatin különböző összetételű keverékének vizsgálatakor azt találták, hogy a zselatintartalom hatással volt a rostok átmérőjére, porozitására és hidrofilitására.94 A PCL-t PLA-val kopolimerizálva pedig a mechanikai tulajdonságok javulását tapasztalták. Az így előállított vázszerkezetek nem deformálódtak, és sokkal jobban hatottak a sejtproliferációra.95 A szakirodalomban olyan példák is találhatók, ahol PCL és HA keverékéből vázrendszert készítettek, és egy háromkomponensű rendszer is készült: PCL. /kollagén /HA 50:30:20 arányú keverékből, amelynek tulajdonságai kiugróan jónak bizonyultak.96 A fenti példákon kívül poli(hidroxi-butirát) (PHB) és hidroxi-butirát és hidroxivalerát oldataiból is készültek rostok. kopolimer (PHBHV) állványok gyártásához, de ezek előállítását és alkalmazását nem vizsgálták alaposan.
Szilárd bio-gyógyszerforma előállításának lehetőségei
- Elektrosztatikus szálképzés és a biohatóanyagok stabil formái
Az elektrosztatikus szálképzés során létrejövő nagy fajlagos felület rendkívül gyors (~1 másodperc) száradást tesz lehetővé atmoszférikus nyomáson és szobahőmérsékleten. A biológiai eredetű hatóanyagok nagyon érzékenyek, így esetükben a szerves oldószerek helyett a vizes oldatok használatát részesítették előnyben az elektrosztatikus szálképzés során.
Elektrosztatikus szálképzés méretnövelési lehetőségei
Ha a tárolási hőmérséklet meghaladja az üvegesedési hőmérsékletet, akkor a molekulák mobilitása megnő, és ez nagymértékben befolyásolhatja a hatóanyag stabilitását a tárolás során.121,122 Fontos a víztartalom és a termék feldolgozhatóságának monitorozása a tárolás során. tárolás.ellenőrzés. elektrosztatikus szálak képződése. Az elektrosztatikus szálalakítás méretének növelése nagyon nehéz feladat, a rendelkezésre álló lehetőségeknek számos hátránya van, ezért további fejlesztésekre van szükség.
A szakirodalom alapján megfogalmazott célkitűzések
Célunk volt a Raman spektroszkópia alkalmazhatóságának vizsgálata a glükózkoncentráció monitorozására adalimumab-termelő emlős sejttenyészetek során. Ezért célul tűztük ki a kutatócsoportunk által kifejlesztett nagy sebességű elektrosztatikus szálak vizes oldatok szárítására való alkalmazhatóságának vizsgálatát.
Anyagok és módszerek
Kísérleti módszerek és felhasznált anyagok
- Laktóz hidrolízis
- Élesztő fermentáció
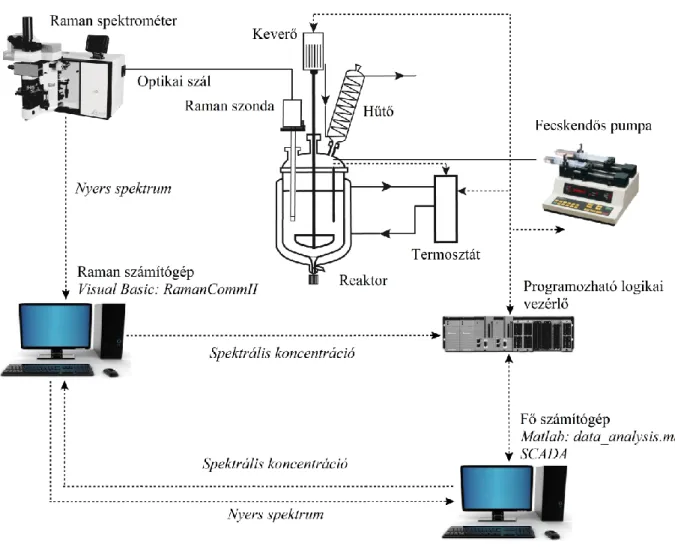
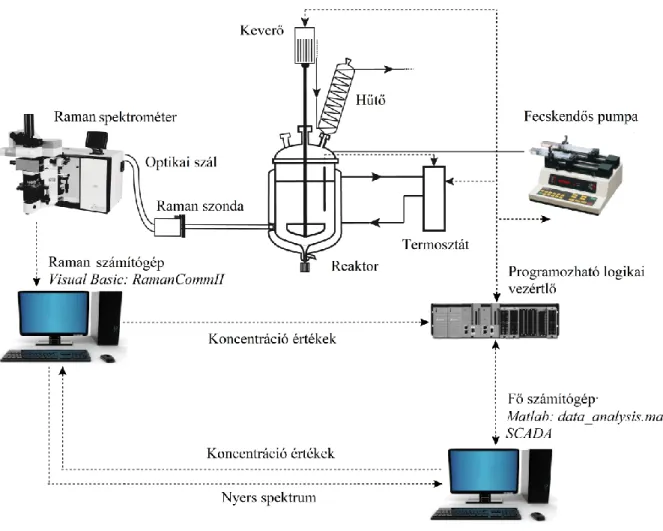
- Monitorozó és szabályozó rendszer
- Emlőssejtek tenyésztése
- Emlőssejtek rázatott lombikos tenyésztése
- Rázatott lombikos tenyészetek Raman spektroszkópiás vizsgálata
- Emlőssejtek bioreaktoros tenyésztése
- Raman spektrumok előfeldolgozási műveletei
- Modellépítés, regressziós módszerek
- Elektrosztatikus szálképzés során felhasznált anyagok
- Cseppszálképző (SDES)
- Egytűs elektrosztatikus szálképzés (SNES)
- Nagy-sebességű elektrosztatikus szálképzés (HSES)
- Utószárítás
- Őrlés
- Felületkezelés levegőplazmával
A reaktortenyészet Raman-spektrumait (RNX2 hibrid, Kaiser Optical Systems, USA, Section 3.2.1) az iC RamanTM programmal rögzítettük, a reaktort védőfóliával letakarva és a Raman spektrométer érzékenysége miatt a világítást kikapcsolva. A laktóz hidrolízis során (4.1. fejezet) az alapvonal eltávolítására a spektrumgörbe kiválasztott pontjaira periodikusan lineáris függvényt illesztettünk, majd ezt a függvényt kivontuk az összes spektrumból, ezt a módszert egyszerűen lineáris alapvonal korrekciónak nevezzük. A kiválasztott pontokhoz polinomok is illeszthetők, mint például az élesztő fermentáció (4.2. fejezet) és az emlős sejtkultúrák (4.3. fejezet), valamint az elektrosztatikus rostképzéssel előállított készítmények vizsgálata során alkalmazott automatikus Whittaker-szűrő típusú alapvonal-korrekció. (4.5.7. fejezet).
A teljes spektrumra vonatkozó normalizálást a laktóz hidrolízis során a PLS módszer alkalmazásakor (4.1.4) és az elektrosztatikus szálképzéssel előállított készítmények vizsgálatakor (4.5.7. fejezet) alkalmaztuk. 42 Az élesztőfermentáció (4.2. fejezet), az emlős sejtkultúrák (4.3. fejezet) és a laktózhidrolízis vizsgálata során a spektrumok átlagolása minden esetben PLS módszerrel történt (4.1.4. fejezet). Ezenkívül a részleges legkisebb négyzetek (PLS) módszere, azaz egy lineáris regressziós módszer, amely az eredeti változóteret (a hullámszámok intenzitásértékeit) egy ortonormális térre vetíti matematikai transzformáció, új változók (látens változók) segítségével, amelyek maximalizálják a kovariancia a függő változóval (koncentráció).141 A PLS regressziós módszert a laktóz hidrolízis (4.1.4. fejezet), az élesztőfermentáció (4.2. fejezet) és az emlős sejtkultúra (4.3. fejezet) vizsgálata során alkalmaztuk.

Vizsgálati módszerek
- Raman spektroszkópiás analízis
- HPLC vizsgálatok
- Pásztázó elektronmikroszkóp (SEM)
- Peremszög mérése
- Röntgen fotoelektron spektroszkópia (XPS)
- Oldatok viszkozitásának mérése
- Részecskeméret eloszlás
- Nedvességtartalom meghatározása
- Differenciális pásztázó kalorimetria, modulált mérések (DSC)
- Röntgendiffrakciós analízis (XRD)
48 Az emlős sejttenyészetek vizsgálatakor (4.3. fejezet) Kaiser Raman RXN2® Hybrid készüléket (Kaiser Optical Systems, USA) használtunk a Raman-spektrumok rögzítésére. Az elektrosztatikus szálképzéssel előállított minták vizsgálatához (4.5. fejezet) a szilárd minták mérésére alkalmas PhAT (Pharmaceutical Area Testing) szondához a Kaiser RamanRxn2® Hybrid spektrométert (Kaiser Optical Systems, USA) csatlakoztattuk. Az elektrosztatikus szálképzéssel előállított szálak morfológiáját és átmérőjét JEOL JSM-6380LA pásztázó elektronmikroszkóppal vizsgáltuk 15 kV-os gyorsítófeszültséggel és 10-15 mm-es mintatávolsággal nagyvákuumban.
Az elektrosztatikus szálképzéssel előállított minták nedvességtartalmának meghatározásához tömegveszteség mérésen alapuló Sartorius MA40 (Németország) készüléket használtunk, amely a mintákat (≥100 mg) 105°C-on tartotta 10 percig.

Kísérleti eredmények és kiértékelésük
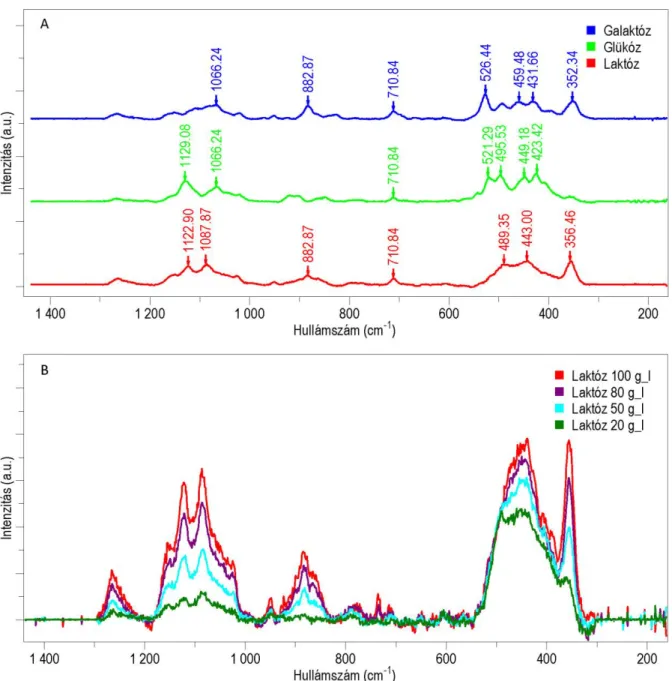
Laktóz hidrolízis Raman spektroszkópia alapú monitorozása és szabályozása
- Referencia spektrumok
- Optimalizáció: Oligoszacharidok képződésének visszaszorítása
- Laktóz hidrolízis monitorozása és szabályozása CLS kemometriai módszer
- Laktóz hidrolízis monitorozása és szabályozása PLS kemometriai módszer
- Laktóz hidrolízis vizsgálatának összefoglalása
Az oligoszacharidok képződése a reakció optimalizálásával gátolható, amit a hőmérséklet, pH, kezdeti laktózkoncentráció és enzimkoncentráció változtatásával vizsgáltunk. Az oligoszacharidok mennyiségét a teljes cukortartalom, valamint a laktóz és monoszacharid (glükóz és galaktóz) tartalom különbségéből határoztuk meg. Az eredmények alapján a 37°C, pH 4 és a 100 g/l kezdeti laktózkoncentráció bizonyult a legalkalmasabbnak, amikor az oligoszacharidok mennyisége nagyon gyorsan 5% alá csökken.
Az enzim mennyiségének hatása az oligoszacharidok mennyiségére jelentős volt, az enzim mennyiségének növelése csökkentette az oligoszacharidok hidrolízisének idejét. Az optimalizálással sikeresen csökkentettük az oligoszacharidok mennyiségét, lehetővé téve a CLS módszer alkalmazását a hidrolízis valós idejű monitorozására. A hőmérséklet emelése és a kezdeti laktózkoncentráció csökkentése csökkentette a termelődő oligoszacharidok maximális mennyiségét, a pH csökkentése nemcsak az oligoszacharidok mennyiségére, hanem hidrolízisük sebességére is hatással volt.
![21. ábra A laktóz hidrolízis és a transzglikozilációs folyamat mechanizmusa. E: enzim; [E – Laktóz]: enzim- enzim-laktóz komplex; [E – Gaenzim-laktóz] + : enzim-galaktóz komplex; ROH: cukor; Galaktóz-OR:](https://thumb-eu.123doks.com/thumbv2/9dokorg/2499070.294652/56.892.239.667.110.445/hidrolízis-transzglikozilációs-folyamat-mechanizmusa-laktóz-gaenzim-galaktóz-galaktóz.webp)
Élesztő fermentáció Raman spektroszkópia alapú monitorozása és szabályozása 61
- PLS modell kalibrációja
- Glükóz és etanol koncentráció Raman spektroszkópiás monitorozása
- Glükóz koncentráció szabályozása az élesztő fermentáció során
- Élesztő fermentáció vizsgálatának összefoglalása
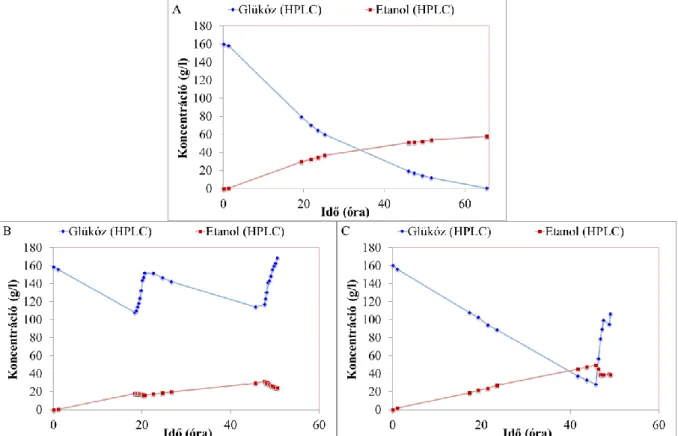
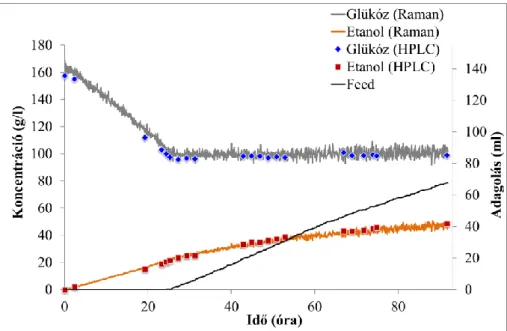
Az élesztő fermentáció monitorozása és szabályozása Raman spektroszkópia alapján A kísérletek során az etanolra toleráns Saccharomyces cerevisiae törzset használtuk. A glükóz és etanol koncentráció meghatározására alkalmas PLS modell kalibrálásához 5 szakaszos (adalék nélkül) és 2 adagolásos (adagolással) kísérletet végeztünk. Átlagosan a glükóz koncentráció 98,08 g/l volt a kontrollidő (óra) alatt, ami egyértelműen mutatja a Raman spektroszkópia alkalmazhatóságát a glükózkoncentráció szabályozására.
A Raman-spektroszkópia használatával lehetővé válik az élesztősejtekkel történő etanolgyártás során a fejlett optimalizálás és szabályozás. A PLS modell használható a glükóz és etanol koncentrációjának becslésére az élesztő fermentációja során, alacsony előrejelzési hibával. Megvalósítottuk az élesztő fermentáció visszacsatolásos szabályozását Raman-spektroszkópián, és sikeresen szabályoztuk a glükóz koncentrációt 100 g/l-ig, tömény glükózoldat automatikus adagolásával.
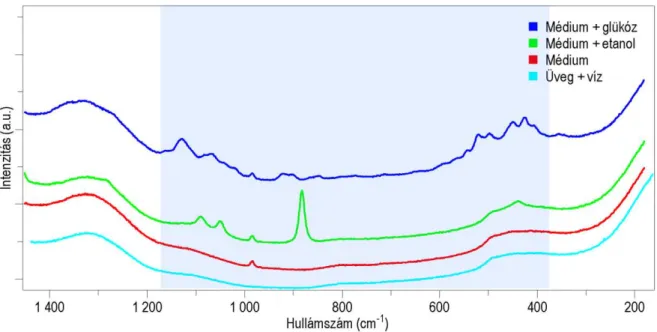
Emlőssejtes tenyészetek Raman spektroszkópia alapú monitorozása
- Rázatott lombikos tenyészetek vizsgálata Raman spektroszkópiával
- A PLS kalibrációs modell felépítése
- Modell transzferálhatóságának vizsgálata
- A kalibrációs modell fejlesztése
- Bioreaktoros tenyésztés valós-idejű monitorozása Raman
- Emlőssejtes tenyészetek Raman spektroszkópiás vizsgálatának
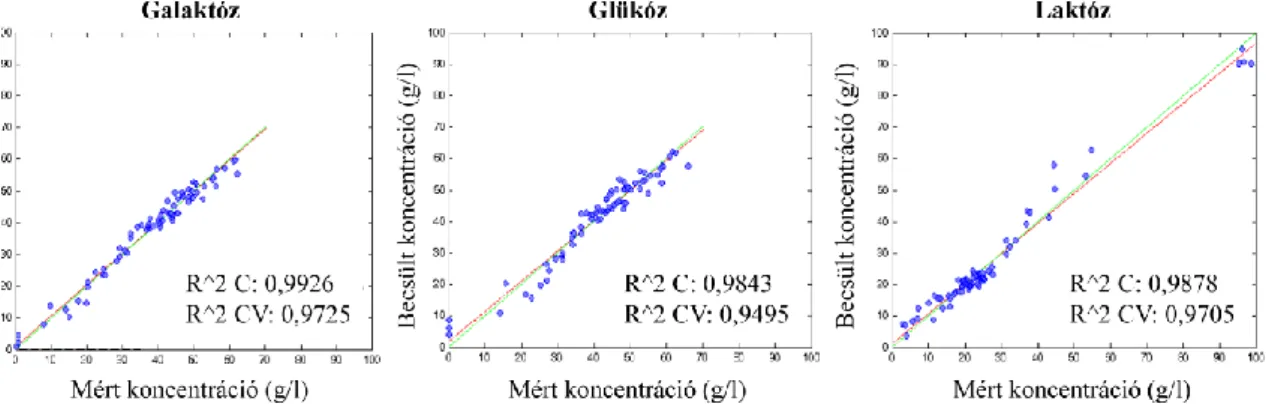
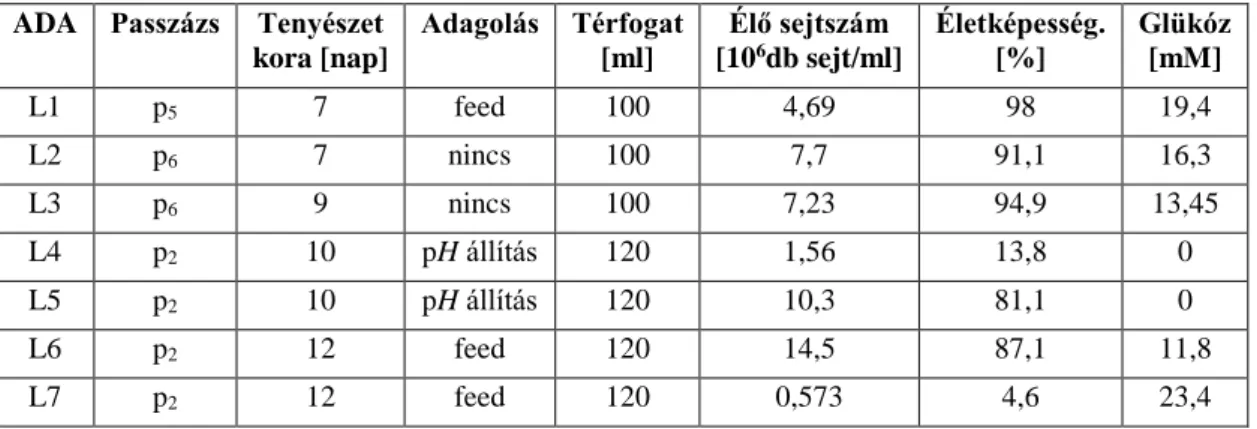
A Raman-spektrumokat többváltozós adatelemzési módszerekkel értékeltük ki, amelyekhez a rázatott lombik és bioreaktor sejtkultúrák során referenciapontokat kaptunk. A CHO bioreaktor sejttenyészet glükózkoncentrációjának Raman spektroszkópiai monitorozásához szükséges kalibrációs modell elkészítéséhez rázatott lombiktenyészeteket használtunk, amelyekben a Raman spektroszkópiai mérések sokkal gyorsabban és költséghatékonyabban végezhetők el, mint a bioreaktor kísérletei. Következésképpen a Raman-spektroszkópia megfelelő analitikai módszer az adalimumab-termelő CHO-sejttenyészet glükózkoncentrációjának vizsgálatára, valamint rázatott lombiktenyészetekben annak változásainak nyomon követésére.
Így a PLS kalibrációs modell átvihető volt rázólombik és bioreaktor műveletek között, és megállapítható, hogy a Raman spektroszkópiai mérések nem érzékenyek a művelet méretének változására. A rázólombik és bioreaktor adatpontokat tartalmazó modell 2,84 mM kalibrációs hibával (RMSEC) és 3,32 mM kereszt-validációs hibával (RMSECV) rendelkezett. A rázatott lombikkísérletek és egy bioreaktor kísérlet adatpontjainak felhasználásával a glükózkoncentráció monitorozására alkalmas PLS-modellt lehetett létrehozni, melynek predikciós hibája 5,20 mM volt.
Elektrosztatikus szálképzés sejttenyésztésre alkalmas vázanyagok előállítására . 78
- Nanoszálas vázrendszerek vizsgálata és összehasonlítása
- Vázanyagok előállításának és karakterizációjának összefoglalása
Elektrosztatikus szálképzés sejttenyésztésre alkalmas vázanyagok előállításához Az elektrosztatikus szálképzés ígéretes technológia az egészségiparban, amely. Az elektrosztatikus szálképzés során a fúvóka és a kollektor távolságát (30-35 cm), az adagolási sebességet (7-9 ml/h) és a feszültséget (25 kV) polimer rendszerenként egyedileg optimalizáltuk, hogy megakadályozzuk a képződést. gyöngyök és egyéb felületi hibák (3.1.12. fejezet). Az állványokban az oxigénatomok aránya alacsonyabb, a szénatomok aránya magasabb volt a plazmakezelés előtti elméleti értékhez képest.
Az elektrosztatikus szálképzés során a poláris oldószer először elpárolog a polimer szál felületéről, aminek következtében a polimer láncokon lévő poláris csoportok a szál belsejébe fordulnak, ahol a maradék oldószermolekulák találhatók. Az XPS mérés során meghatároztuk az atomok kötési energiáját, amelyből a polimerláncban lévő atomok egymáshoz viszonyított helyzete alapján azonosíthatók. Az elektrosztatikus szálak kialakulása során a polimer láncok poláris csoportjai a szál belseje felé néznek, csökkentve a felület polaritását.
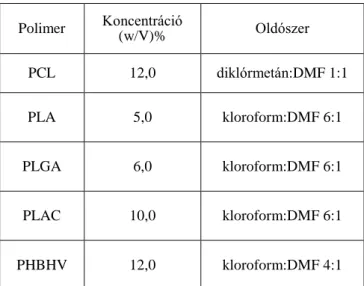
Vizes oldat alapú elektrosztatikus szálképzés
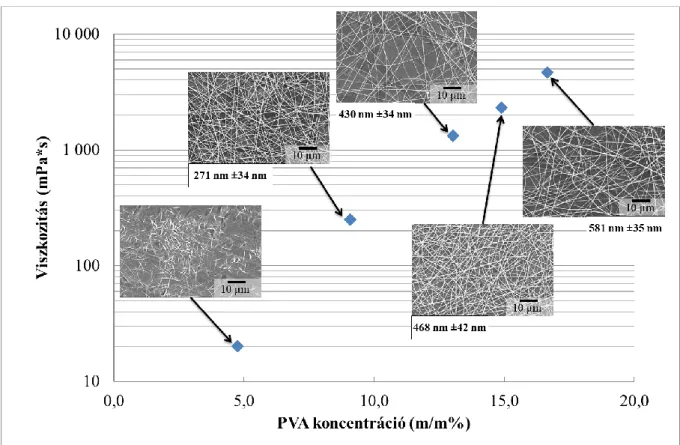
- Vizes PVA oldatok szálképezhetőségének vizsgálata
- Elektrosztatikus szálképző módszerek összehasonlítása
- Polimer oldat összetételének optimalizációja
- Szálképzési paraméterek hatásának vizsgálata
- Elektrosztatikus szálképzés (HSES) méretnövelése
- PVA-PEO-cukor tartalmú formulációk vizsgálata
- A polimerek és segédanyagok fizikai állapota a szálakban
- Vizes szálképzés technológiai fejlesztésének összefoglalása
A mannitot tartalmazó rostrendszer az elektrosztatikus szálképzés után azonnal őrölhető volt, azonban a glükózt, laktózt, szacharózt és trehalózt tartalmazó minták ragacsosak voltak, így nem őrölhetőek. A referenciák és készítmények üvegesedési hőmérsékletei közötti különbségeket nyilvánvalóan a PVA, PEO és a cukormolekulák közötti molekuláris kölcsönhatás okozza. A mannitot tartalmazó minta alacsony üvegesedési hőmérséklete miatt a molekulamozgás nagy volt, így azonnali kristályosodás volt megfigyelhető.
Továbbá megvalósítottuk a vizes PVA-PEO-mannit oldatok elektrosztatikus szálképzésének méretnövelését a kutatócsoportunk által kifejlesztett HSES technológiával. Az oldat összetételét laboratóriumi méretű HSES berendezésen optimalizáltuk, majd az eredmények alapján kiválasztott PVA-PEO-mannit készítményt átvittük a féloperatív HSES berendezésbe, ahol 450 ml/h adagolási sebesség és 106 g termelékenység. /h érték el. A szacharózt, laktózt és trehalózt tartalmazó amorf készítmények megőrizték stabilitásukat a tárolás során, mivel üvegesedési hőmérsékletük jóval a tárolási hőmérséklet felett volt.
Tézispontok
Elsőként állítottam elő vizes oldatok elektrosztatikus rostosításával marható, szubmikron méretű szálakat, amelyek alkalmasak bioaktív anyagok szilárd gyógyszerformáinak előállítására. Elsőként hasonlítottam össze egy új technológia lehetőségeit megnövelt termelékenységgel, nagy sebességű elektrosztatikus szálképzéssel, egytűs elektrosztatikus szálképzéssel a laborban vizes rendszerekkel. Vizes PVA-PEO-mannit oldatok elektrosztatikus szálképzését a nagy sebességű elektrosztatikus szálképző berendezéssel valósítottam meg, 1000-szeres termelékenységnövekedést érve el az egytűs elektrosztatikus szálképzéshez képest.
Publikációk listája
Hirsch, Continuous drying of a proteinaceous drug using graded fiber formation with HP-β-CD matrix resulting in a directly compressible tablet powder, European J. Nagy, Investigation of impaired dissolution of amorphous Itraconazole: Description of Incompatibility with Magnesium Stearate and Possible Solutions, Mol. Nagy, Scalable preparation of electrospun drug-loaded polymer fibers and investigation of their continuous processing into tablet form, Express Polymer Letters DOI: 10.3144/expresspolymlett.2018.37.
Huszthy, Synthesis and enantioselective transport studies of optically active lipophilic protonizable crown ethers containing a diarylphosphinic acid unit, Tetrahedron: Asymmetry DOI: 10.1016/j.tetasy. Marosi, Raman spectroscopy-based feedback control of enzymatic hydrolysis of lactose, 7th BBBB International Conference on Pharm. Nagy, Production of millable PVA nanofibers from aqueous solution using high-speed electrospinning, 11th World Meeting on Pharmaceutics, Biopharmaceutics and Pharmaceutical Technology, Granada, 2018.
Irodalomjegyzék
Real-time monitoring of multiple components in wine fermentation using on-line auto-calibration Raman spectroscopy. Real-time monitoring of a batch process of Phaffia rhodozyma by in situ dispersive Raman spectroscopy. Real-time monitoring of multiple parameters in mammalian cell culture bioreactors using a Raman spectroscopy probe.
Non-contact Raman spectroscopy for in-line monitoring of glucose and ethanol during yeast fermentations. Real-time monitoring of antibody glycosylation site occupancy by in situ Raman spectroscopy during bioreactor CHO cell cultures. In Situ Raman Spectroscopy for Simultaneous Monitoring of Multiple Process Parameters in Mammalian Cell Culture Bioreactors.
Melléklet