UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE BIOCIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA
JOANNA GARDEL VALVERDE GALVÃO
PERFIL IMUNOLÓGICO ASSOCIADO À SUSCEPTIBILIDADE,
RESISTÊNCIA E CURA NA INFECÇÃO POR
Leishmania
(
Leishmania
)
infantum
JOANNA GARDEL VALVERDE GALVÃO
PERFIL IMUNOLÓGICO ASSOCIADO À SUSCEPTIBILIDADE,
RESISTÊNCIA E CURA NA INFECÇÃO POR
Leishmania
(
Leishmania
)
infantum
Tese apresentada ao Departamento de Bioquímica da Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Doutora em Bioquímica.
Orientadora: Professora Dra. Selma Maria Bezerra Jeronimo.
Dedico esta obra
Aos meus pais, Katia Gardel e Paulo Valverde, pelo apoio incondicional, ao meu
AGRADECIMENTOS
A toda minha família, em especial os meus queridos pais, Paulo Valverde e Katia Gardel, pelo amor, conselhos, paciência, incentivo durante meus primeiros passos.
Ao meu marido Josélio Galvão, pelas palavras de conforto nos momentos de ansiedade e preocupação. Pelo grande exemplo como profissional, que sempre me
inspirou.
Aos meus sogros Francisco Galvão e Ivanice Galvão e família, que me acolheram em Natal, me dando suporte e carinho.
À Professora Dra. Selma Jerônimo, por quem tive o privilégio e a honra de ser orientada, muito obrigada pela oportunidade de aprender a buscar sempre mais.
Pelo grande exemplo de perseverança e comprometimento com trabalho.
À Professora Dra. Tatjana Keesen, pela grande ajuda no desenvolvimento do trabalho e também pela amizade.
Agradeço aos pacientes e voluntários, pois sem a colaboração deles minha pesquisa não avançaria.
Aos médicos, residentes e alunos do hospital Giselda Trigueiro, pela colaboração esclarecimentos e informações sobre diagnóstico e tratamento dos pacientes
portadores de Leishmaniose Visceral arrolados neste trabalho.
À equipe do Laboratório de Imunogenética, agradeço a todos pela oportunidade de trabalhar com amigos, pelo companheirismo e espírito de equipe. Por toda a ajuda
no campo e no laboratório.
À Glória, João, Bruna, Paulo, Virgínia, Eliana, Daniella, Francianne, Freire, Núbia, Patrícia, Cláudio, Carol, Eliene, Leonardo, Sérgio, Margarita e Pinheiro pela amizade
e pela ajuda imprescindível no desenvolvimento deste trabalho.
Aos colegas, administradores e funcionários do Departamento de Bioquímica, assim como aos demais funcionários e alunos do Instituto de Medicina Tropical.
Quanto mais aumenta nosso conhecimento, mais evidente fica nossa ignorância.
RESUMO
A leishmaniose visceral (LV) é endêmica no Brasil, sendo a região nordeste a que apresenta maior incidência desta doença, apesar de nos últimos 30 anos ter aumentado o número de casos em outras regiões do país. Leishmania infantum é o
principal agente etiológico da LV na América Latina, Europa e norte da África. No entanto, nem todas as pessoas infectadas desenvolvem LV; a maioria apresenta resolução espontânea da infecção, sem apresentar sintomas característicos. A avaliação do perfil imunológico tem sido realizada utilizando a estimulação, com antígeno de leishmânia, de células mononucleares de sangue periférico de pessoas com LV. Esses estudos mostram que pacientes LV apresentam inibição da proliferação linfocitária e resposta inflamatória frente ao antígeno de Leishmania spp.
O presente trabalho teve por objetivo avaliar a resposta imunológica na LV sintomática, cura pós-tratamento e em pessoas com infecção assintomática. Para isso, analisamos características imunofenotípicas de linfócitos relacionadas à ativação, Treg e memória, assim como a produção de citocinas, ex vivo e após
cultura de sangue total. Para os voluntários LV ativa, foi realizado um estudo longitudinal com reavaliação aos 4 e 14 meses após a cura clínica. O grupo controle incluiu pessoas provenientes de região endêmica para leishmaniose, sendo dividido em Controle Positivo, formado por pessoas que apresentaram anticorpo anti-leishmânia e∕ou PCR para leishmânia positivo e Controle Negativo, formado por pessoas com anticorpo anti-leishmânia e PCR para leishmânia negativo. Durante a LV os linfócitos CD4 apresentam um maior perfil de ativação e memória, além de serem maiores produtores de citocinas em cultura, quando comparado aos linfócitos CD8, contudo essa ativação não é Leishmania específica, visto que ocorreu tanto
em ausência quanto em presença de antígenos solúveis de L. infantum (SLA). Há
ativação de linfócitos durante a LV (CD4+CD69+: 4,9%), quando comparado aos
grupos Controle, Positivo (CD4+CD69+: 2,0% p=0,004) e Negativo (CD4+CD69+:
1,4% p=0,006), mas esta ativação também não é Leishmania específica. O perfil de
ativação linfocitária permanece elevado mesmo 14 meses após o fim do tratamento, porém após a cura a ativação é Leishmania específica (CD4+CD25+ em ausência de
SLA: 8,4%, presença de SLA: 10,7% p=0,0279). Linfócitos CD8+CD25+ foram
capazes de produzir IFN-γ em presença de antígeno tanto em Controles Positivos (ausência de SLA: 5,2%, presença de SLA: 9,5% p=0,039) como em LV curados (Curado 4 meses: ausência de SLA: 3,9%, presença SLA: 10,70% p=0,009). Células presentes no sangue total de pessoas com LV ativa são capazes de produzir IFN-γ em resposta ao SLA (IFN-γ em ausência de SLA: 3,61 pg∕mL e em presença de SLA: 44,3 pg∕mL; p=0,0020), assim como LV recuperado (IFN-γ em ausência de SLA: 2,3 pg∕mL e presença de SLA: 139,8 pg∕mL; p=0,0005). Contudo o elevado nível de IL-10 inibe a atividade pro-inflamatória de IFN-γ e TNF-α em pacientes na fase sintomática. Contrariamente às demais citocinas pro-inflamatórias, a cultura de sangue total do grupo LV ativa não apresentou produção de IL-2 Leishmania
específica (em ausência de SLA: 2,4 pg∕mL e em presença de SLA: 2,6 pg∕mL). Com base nesses dados nós concluímos que a restauração da ativação de linfócitos e a diminuição da produção de IL-10, Leishmania específica, estão relacionados a um
perfil imunológico protetor.
ABSTRACT
Visceral Leishmaniasis (VL) is endemic in Brazil and the northeast region had the highest incidence of the disease, despite, in the last 30 years, it has spread to all geographic regions of the country. Leishmania infantum is the main etiological agent
of VL in Latin America, Europe and North Africa. However, not all infected individuals develop the disease; in fact, the majority present spontaneous resolution of infection without symptoms. The evaluation of the immunological profile has been mostly conducted stimulating, with Leishmania spp. antigen, peripheral blood mononuclear
cells isolated from subjects with VL. These studies showed that VL patients had an inhibition of both, lymphocyte proliferation and proinflammatory response to
Leishmania spp. antigen. Our study aimed to evaluate the immune response in active
LV, cured post treatment and asymptomatic infection. To reach this aim, we analyzed immunophenotypic features related to activation, Treg and memory lymphocytes, by flow cytometry, as well as, evaluation of cytokine production, in ex vivo or in whole
blood culture. In active VL volunteers, a longitudinal study was conducted with reassessment at 4 and 14 months after clinical cure. The control group included individuals that lived in endemic region and were either Positive Control, consisting of individuals with positive anti-Leishmania spp. serology and/or positive PCR for
Leishmaniaspp. and Negative Control composed by individuals with negative
anti-Leishmania antibodies serology and negative PCR for anti-Leishmania. During VL, CD4 lymphocytes showed greater activation and memory profiles and were the major source of cytokines in culture when compared to CD8 lymphocytes, and these were
not Leishmania specific. There were activated lymphocytes during VL (CD4+
CD69+:4.9%) when compared to control groups, Positive (CD4+CD69+:1.96%,
p=0.0045) and Negative (CD4+CD69+:1.35%, p=0.006), on the other hand, this was
non-specific activation. The lymphocyte activation profile remained elevated even 14 months post treatment. After clinical cure, the activation was Leishmania specific
(CD4+CD25+ absence of SLA: 8.4%, and presence of SLA: 10.7% p=0.0279).
CD8+CD25+ lymphocytes were able to produce Leishmania specific IFN-γ in both,
Positive Controls (absence of SLA 5.2% and presence of SLA: 9.5%, p=0.0391) and Cured 4 month (absence of SLA: 3.9%; presence of SLA: 10.7% p=0.0098). Whole blood culture cells, of VL patients, were able to produce IFN-γ, by SLA stimulation (absence of SLA: 28.0 pg∕mL, and presence: 44.γ pg∕mL p=0.00β0) as well as recovered groups (absence of SLA β.γ pg∕mL and presence of SLA 1γ9.8 pg∕mL, p=0.0005). However, the high level of IL-10 seemed to inhibit pro-inflammatory activity of IFN-γ and TNF-α during symptomatic disease. Unlike other pro-inflammatory cytokines, active VL group did not produce Leishmania specific IL-2
(absence of SLA β.4 pg∕mL and presence of SLA: β.6 pg∕mL). Based on these data we conclude that the restoration of lymphocyte activation and decreased in IL-10
Leishmania specific production were related to a protective immune profile.
LISTA DE FIGURAS
Figura 1. Desenho esquemático do ciclo evolutivo da Leishmania spp...21
Figura 2. Desenho esquemático da resposta imunológica na infecção por
Leishmania spp...28
Figura 3. Delineamento experimental dos desenhos dos subestudos e marcadores moleculares analisados...40
Figura 4. Correlação entre os níveis de IgG anti-rK39 e anti-SLA e parasitemia KDNA-7 e Mag-1 no sangue periférico dos indivíduos dos grupos LV ativa, curados e controles...44
Figura 5. Perfil da distribuição pontual de células do sangue periférico no gráfico de tamanho (FSC) versus granulosidade (SSC) e controle de isotipo...50
Figura 6. Sequência de procedimentos para a análise de linfócitos com fenótipo CD4+CD25+...51
Figura 7. Sequência de procedimentos para a análise de linfócitos produtores de citocinas...52
Figura 8. Sequência de procedimentos para a análise de células Treg com fenótipo CD4+CD25HIGH. ...53
Figura 9. Frequência de subpopulações de células de sangue periférico de pacientes do grupo LV ativa...57
Figura 10. Frequência de subpopulações de células de sangue periférico de pacientes do grupo LV ativa cultivados em ausência e presença de antígeno de
L.infantum...58
Figura 11. Frequência de subpopulações de células após cultivo de sangue periférico de pacientes do grupo LV ativa cultivados em ausência e presença de antígeno de L. infantum...59
Figura 13. Frequência de subpopulações de células após cultivo de sangue periférico de paciente do grupo LV ativa, em ausência ou presença de antígeno de
L.infantum...61
Figura 14. Correlação entre os níveis de IgG e IL-10 no sangue periférico dos indivíduos dos grupos LV ativa e controles endêmicos...62
Figura 15. Quantidade de subclasses de IgG no soro de indivíduos dos grupos LV ativa e Controles...63 Figura 16. Frequência ex vivo de subpopulações de células ativadas em sangue
periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...64
Figura 17. Frequência ex vivo de subpopulações de células de memória no sangue
periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...65
Figura 18. Frequência de subpopulações de células ativadas após cultura de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...66
Figura 19. Frequência de subpopulações de células Treg após cultura de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...67
Figura 20. Frequência de subpopulações de células de memória após cultura de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo....68
Figura 21. Frequência de subpopulações de células, produtoras de IFN-γ, após cultivo de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo. ...69
Figura 22. Frequência de subpopulações de células de memória após cultivo de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...70
Figura 23. Frequência de subpopulações de células, produtoras de IL-10, após cultivo de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...71
Figura 24. Frequência de subpopulações de células Treg após cultivo de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...72
Figura 26. Frequência de subpopulações de células de memória, produtoras de IL17, após cultivo de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...75
Figura 27. Frequência de subpopulações de células Treg, produtoras de IL-17, após cultivo de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...76
Figura 28. Quantidade de citocinas no sobrenadante após cultivo de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...78
Figura 29. Razão da quantidade de citocinas no sobrenadante após cultivo de sangue periférico dos grupos LV ativa, Controle Positivo e Controle Negativo...79
Figura 30. Quantidade de subclasses de IgG no soro de indivíduos dos grupos LV ativa e Curados...81
Figura 31. Avaliação longitudinal da frequência ex vivo de subpopulações de células
ativadas em sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses....82
Figura 32. Avaliação longitudinal da frequência ex vivo de subpopulações de células de memória em sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses....83
Figura 33. Avaliação longitudinal da frequência de subpopulações de células ativadas após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses...84
Figura 34. Avaliação longitudinal da frequência de subpopulações de células de memória após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses...85
Figura 35. Frequência de subpopulações de células Treg após cultura de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses....85
Figura 37. Avaliação longitudinal da frequência de subpopulações de células de memória, produtoras de IFN-γ, após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses....88
Figura 38. Avaliação longitudinal da frequência de subpopulações de células, produtoras de IL-10, após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses...89
Figura 39. Avaliação longitudinal da frequência de subpopulações de células Treg, produtoras de IL-10, após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses. ...90 Figura 40. Avaliação longitudinal da frequência de subpopulações de células, produtoras de IL-17, após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses...91
Figura 41. Avaliação longitudinal da frequência de subpopulações de células de memória, produtoras de IL-17, após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses...92
Figura 42. Avaliação longitudinal da frequência de subpopulações de células Treg, produtoras de IL-17, após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses...93
Figura 43. Avaliação longitudinal da quantidade de citocinas no sobrenadante após cultivo de sangue periférico dos grupos LV ativa, Curado 4 meses e Curado 14 meses...96
LISTA DE TABELAS
Tabela 1. Características demográficas, epidemiológicas e clínicas dos voluntários estudados...39 Tabela 2. Sequência de iniciadores e sonda usados na identificação de Leishmania
spp. através do PCR quantitativo...43
Tabela 3. Anticorpos monoclonais marcados com fluorocromos utilizados para análise de populações e subpopulações celulares na marcação “ex vivo”...47
Tabela 4. Anticorpos monoclonais marcados com fluorocromos utilizados para análise de populações e subpopulações celulares e alvos intracelulares...49
Tabela 5. Avaliação laboratorial dos grupos LV ativa e Controle Positivo...55
Tabela 6. Avaliação laboratorial dos pacientes com leishmaniose visceral ativa durante o tratamento...56
Tabela 7. Avaliação laboratorial dos grupos LV ativa e Curados...80
LISTA DE ABREVIATURAS / SIGLAS
APC: Aloficocianina
APCCY7: Aloficocianina-Cy7
Alexa 488: Alexa Fluor excitável à 488nm
BD: Becton Dickinson
BSA: do inglês, Bovine serum albumin, ou seja, albumina bovina sérica
CBA: Cytometric Bead Array
CC: quimiocinas que possuem duas cisteínas adjacentes próximas à região
N-terminal
CCR5: receptor 5 das quimiocinas do grupo CC
CD: do inglês “Cluster of diferentiation”, grupamento de diferenciação.
CD25: cadeia α do receptor de IL-2, marcador de ativação celular e de células
reguladoras
CD4: molécula de superfície de linfócitos T com função auxiliadora
CD45RO: isoforma pesada da molécula de superfície celular (CD45), marcador
de células de memória
CD62L: molécula de adesão celular (selectina) de células não primadas
CD69: molécula de superfície, marcador de ativação celular inicial
CD8: molécula de superfície de linfócitos T com funções citotóxicas e, ou
supressoras.
CMSP: células mononucleadas do sangue periférico
CO2: fórmula química da molécula de dióxido de carbono
CTLA-4: antígeno 4 associado a linfócitos T citotóxicos
CXCR3: receptor 3 das quimiocinas do grupo CXC
ELISA: ensaio imunoenzimático
et al: do latim, significa colaboradores
Facs: do inglês, “Fluorescence Activated Cell Sorter”
FITC: isotiocianato de fluoresceína
Foxp3: fator de transcrição da família “forkhead”
FSC: sigla para parâmetro de tamanho celular em ensaios de citometria
g: grama
GATA-3: Fator de transcrição GATA ligadora da proteína 3
gp63: glipoproteína de 63kD
HIV: do inglês human immunodeficiency vírus
HO-1: enzima Heme-oxigenase
HTLV: do inglês Human T lymphotropic vírus
IFN-γ: interferon gama
IgG: imunoglobulina G
IgG1: isotipo 1 da imunoglobulina da classe G
IgG2: isotipo 2 da imunoglobulina da classe G
IgG3: isotipo 3 da imunoglobulina da classe G
IgG4: isotipo 4 da imunoglobulina da classe G
IL: interleucina
KDNA: do inglês “kinetoplast DNA” ou DNA de cinetoplasto.
L: litro
LPG: lipofosfoglicana
LRV1: do inglês Leishmania RNA vírus. Vírus RNA de Leishmania
LPS: Lipopolissacarídeo
M: molar
Mag: do inglês “MSP-associated gene”. Gene associado à MSP
mg: miligrama, 10-3 grama
mL: mililitro, 10-3 litro
Na2CO3: Carbonato de sódio
NaHCO3: Bicarbonato de sódio
NK: do inglês Natural Killer
PBS: do inglês, “Phosphated Buffer Saline”, ou seja, solução tamponada salínico
fosfatado
PE: ficoeritrina
PERCP: Peridinin chlorophyll
PECY7: Ficoeritrina-Cy7
pH: potencial hidrogeniônico
RORγt: do inglês related orphan receptor gamma highly restricted to the thymus
ROS: do inglês reactive oxygen species, ou seja, espécies reativas do oxigênio
RPMI 1640: solução nutritiva para cultivo celular e que não contém timidina na
sua composição química
SLA: do inglês “soluble Leishmania antigen”. Antígeno solúvel de Leishmania
SSC: sigla para parâmetro de complexidade ou granulosidade intracelular
T-bet: fator de transcrição de camundongo ortólogo ao humano TBX21, do inglês
T-box: transcription fator
TCR: Receptor de célula T
TGO:transaminase glutâmico-oxalacética
TGP: transaminase glutâmico-pirúvica
Th1: linfócitos T auxiliares que secretam citocinas do tipo 1
Th2: linfócitos T auxiliares que secretam citocinas do tipo 2
TNF-α: fator de necrose tumoral alfa
Treg: linfócitos T reguladores
Tween 20: polioxietilensorbitano monolaurato
TGF- : do inglês “transforming growth factor beta”. Fator de transformação do
crescimento beta.
UFRN: Universidade Federal do Rio Grande do Norte
μg: micrograma, 10-6 grama
SUMÁRIO
1. INTRODUÇÃO ... 19
1.1 AS LEISHMANIOSES ... 19
1.2 DIAGNÓSTICO E TRATAMENTO ... 21
1.3 ASPECTOS SÓCIO-ECONÔMICOS E AMBIENTAIS ... 22
1.4 A EVOLUÇÃO DA INFECÇÃO POR LEISHMANIA SPP. ... 24
1.5 IMUNOLOGIA DAS LEISHMANIOSES ... 26
1.6 GENÉTICA E IMUNOLOGIA DA LEISHMANIOSE VISCERAL (LV) ... 30
2. JUSTIFICATIVA ... 36
3. OBJETIVO ... 37
3.1 OBJETIVOS ESPECÍFICOS: ... 37
4. MATERIAL E MÉTODOS ... 38
4.1 ÁREA DE ESTUDO, POPULAÇÃO E DESENHO DE ESTUDO: ... 38
4.2CONSIDERAÇÕES ÉTICAS ... 40
4.3 DIAGNÓSTICO DA INFECÇÃO POR LEISHMANIA SPP. ... 41
4.3.1 Preparo do antígenos solúveis de promastigotas de Leishmania infantum ... 41
4.3.2. Avaliação dos níveis de anticorpos anti-leishmânia utilizando antígenos recombinante K39 (rK39) e antígeno solúvel de Leishmania infantum (SLA). .. 41
4.3.3 Estimativa da carga parasitária por PCR quantativo ... 42
4.4 AVALIAÇÃO DA QUANTIDADE SÉRICA DE TRANSAMINASES TGO E TGP, E PROTEÍNAS TOTAIS EM PACIENTES DO GRUPO LEISHMANIOSE VISCERAL ATIVA. ... 44
4.6 AVALIAÇÃO DOS NÍVEIS SÉRICOS DE IL-10 ... 45
4.7.1 – Obtenção de leucócitos e marcação de superfície para citometria de fluxo “ex vivo”. ... 46
4.7.2 Obtenção de leucócitos e marcação intracelular e extracelular para citometria de fluxo após cultivo de células estimuladas e não estimuladas com antígeno de Leishmania infantum. ... 47
4.7.3 Estratégia de análise citoflorimétrica de linfócitos: ... 50
4.7.4 Metodologia de análise de células ativadas ... 51
4.8 DETECÇÃO DO NÍVEL DE CITOCINAS POR CITOMETRIA DE FLUXO (CBA) ... 53
4.9 ANÁLISE ESTATÍSTICA ... 54
5. RESULTADOS: ... 55
5.1 CARACTERIZAÇÃO DA POPULAÇÃO ESTUDADA ... 55
5.1.1 Resposta humoral e parasitemia na LV ativa e grupos controle. ... 55
5.2 PERFIL IMUNOLÓGICO DOS PACIENTES NA LEISHMANIOSE VISCERAL ATIVA ... 56
5.2.2. Comparação entre subpopulações de linfócitos de pacientes LV ativa .. 57
5.2.3 Estudo comparativo do perfil imunológico de pacientes LV ativa e grupos controle. ... 62
5.3 ESTUDO LONGITUDINAL DO PERFIL IMUNOLÓGICO DOS PACIENTES NA FASE ATIVA DA LV, 4 E 14 MESES APÓS O TRATAMENTO. ... 79
6. DISCUSSÃO ... 99
REFERÊNCIAS BIBLIOGRÁFICAS ... 111
1. INTRODUÇÃO
1.1 AS LEISHMANIOSES
As leishmanioses são um complexo de doenças e apresentam um espectro de manifestações clínicas que vão desde lesões tegumentares até doença visceral (ANTINORI; SCHIFANELLA; CORBELLINO, 2012). Essa evolução depende, principalmente, da resposta imunológica do hospedeiro, assim como de características intrínsecas da espécie de Leishmania spp. envolvida na infecção
(COUTINHO et al., 1987). São doenças que ocorrem predominantemente em regiões tropicais e subtropicais, tendo primordialmente um caráter endêmico. As leishmanioses geralmente se restringem às áreas geográficas infestadas pelos insetos vetores, os quais são dípteros da subfamília Phlebotominae, pertencentes aos gêneros Lutzomyia (Novo Mundo) e Phlebotomus (Velho Mundo). Somente as
fêmeas são hematófagas e, portanto, são os vetores capazes de transmitir o parasito ao hospedeiro vertebrado durante a hematofagia (CUNNINGHAM, 2002; WORLD HEALTH ORGANIZATIONWHO, 2014).
Os agentes etiológicos dessas doenças são protozoários da ordem Kinetoplastida, família Trypanosomatidae, gênero Leishmania. A classificação
desses protozoários era baseada, principalmente, em perfis eletroforéticos de izoenzimas, e através dele foi detectado 44 zimodemas diferentes (CUPOLILLO; GRIMALDI; MOMEN, 1994). Esses zimodemas podem ainda ser subdivididos em dois grandes grupos Leishmania e Viannia (LAINSON, R; SHAW, JJ, 1987). Dentre as espécies responsáveis pela leishmaniose visceral, o complexo donovani
compreende as espécies Leishmania (L.) donovani e Leishmania (L.) infantum no
Velho Mundo e Leishmania (L.) chagasi nas Américas (SECRETARIA DE
VIGILÂNCIA EM SAÚDE, 2006). Estudos recentes comprovaram que essas duas últimas espécies são geneticamente idênticas sendo atualmente considerada uma única espécie denominada Leishmania (Leishmania) infantum (KUHLS et al., β011;
MAUŔCIO; STOTHARD; MILES, β000).
A Leishmania spp. é um patógeno dimórfico, sendo a forma extracelular
promastigotas metacíclicas do parasita se destacam do epitélio, migrando para cavidade bucal do inseto. Durante o repasto, estas formas infectivas são transmitidas ao hospedeiro vertebrado e, neste, as formas promastigotas são fagocitadas por células, principalmente por macrófagos e neutrófilos. O parasita utiliza como principal mecanismo de entrada a endocitose mediada por receptor, podendo ainda ser facilitada através da opsonização pelo complemento ou por imunoglobulinas, ou mesmo pela ligação de moléculas como glicoproteína (gp63) e lipofosfoglicana (LPG) aos receptores do macrófago. Dentro dessas células, a
Leishmania spp. torna-se mais arredondada ou oval (2,5-5 μm) com um flagelo curto
1.2 DIAGNÓSTICO E TRATAMENTO
A droga de primeira escolha no tratamento das leishmanioses é o antimônio pentavalente, um composto descrito por Gaspar Vianna no início do século XX para o tratamento da leishmaniose tegumentar (VIANNA, 1912), sendo mais tarde sua eficácia comprovada no tratamento da leishmaniose visceral (DI CRISTINA; CARONIA, 1915). Sua administração é parental, principalmente por via intravenosa ou intramuscular. No Brasil, a única formulação disponível é o antimoniato N-metil glucamina, conhecido comercialmente como Glucantime, que é distribuído pelo Ministério da Saúde. Essa droga foi, por muitos anos, usada sem se conhecer ao certo o seu mecanismo de ação. Estudos recentes revelaram que ela altera o metabolismo de compostos oxidativos do parasita, atuando sobre as enzimas tripanotiona e glutationa redutase, aumentando assim a susceptibilidade da
Leishmania spp. ao estresse oxidativo (WYLLIE; CUNNINGHAM; FAIRLAMB, 2004).
Em algumas regiões da Índia e Sudão, tem sido cada vez mais frequente a resistência ao Glucantime, sendo assim adotado o uso da anfotericina B desoxicolato como esquema alternativo. A anfotericina B se liga aos esteróis presentes na membrana, apresentando maior afinidade ao ergosterol, comumente encontrado na membrana da Leishmania spp. Essa interação com a membrana leva
à formação de poros e consequente perda de cátions (SEIFERT, 2011). Preparações lipossomais de anfotericina B são também disponibilizadas, sendo a Anfotericina lipossomal a droga de escolha para tratamento da LV nos Estados Unidos e na Europa. A eficácia do uso da Anfotericina lipossomal em dose única foi demonstrada na Índia, contudo o custo é muito elevado (SUNDAR et al., 2010). O Miltefosine é a primeira droga de uso oral para o tratamento de LV, sendo demonstrada sua eficácia em estudos realizados na Índia (SUNDAR et al., 2010). No Brasil, ainda não são frequentes casos de resistência aos antimoniais, sendo usada a Anfotericina B nos casos de resposta insatisfatória aos antimoniais ou em presença de alguma outra comorbidade (SECRETARIA DE VIGILÂNCIA EM SAÚDE, 2006).
1.3 ASPECTOS SÓCIO-ECONÔMICOS E AMBIENTAIS
do ser humano ao flebotomíneo; além de existência de comorbidade e o estado nutricional (ALVAR; YACTAYO; BERN, 2006; ROMERO; BOELAERT, 2010)(ALVAR; YACTAYO; BERN, 2006; CARRILLO et al., 2014; ROMERO; BOELAERT, 2010). Mudanças ambientais como o desmatamento, urbanização e migração de pessoas às zonas endêmicas modificaram o perfil geral da LV no mundo (JERONIMO et al., 1994, 2004; PALATNIK-DE-SOUSA; DAY, 2011).
As zonas endêmicas têm se expandido nos últimos 10 anos, principalmente nos países como Bangladesh, Brasil, Índia, Nepal e Sudão que são responsáveis por 90% dos casos de leishmaniose visceral no mundo (ALVAR et al., 2012; DESJEUX, 1996). É descrita a incidência de 500.000 novos casos de leishmaniose visceral por ano no mundo (WORLD HEALTH ORGANIZATION, [s.d.]). Contudo é possível que esses números sejam ainda maiores devido subnotificação, principalmente porque a doença não é de notificação compulsória para alguns países e os sistemas de notificação tendem a ser frágeis, além de existência de novas áreas geográficas relatando endemização da leishmaniose, como o caso recente da Georgia (Alvar et
al., 2012; Giorgobiani et al., 2011). A taxa de mortalidade nos casos de LV varia de 5
a 10% entre os países e subnotificações de mortes por LV também dificultam as estimativas (Alvar et al., 2012). Os casos de LV sintomáticos correspondem a
minoria, com estimativa, no Brasil, no passado, de 1 caso de LV para 6 crianças assintomáticas e 1 caso para 18, entre os adultos; enquanto na Europa a razão é maior, estimando-se 1 caso de doença para cada 48 pessoas infectadas. (Lima et
al., 2012; Singh et al., 2014).
No Brasil, a região nordeste é responsável por 56% dos casos de leishmaniose visceral (SISTEMA DE VIGILÂNCIA EM SAÚDE, 2013). No passado, a distribuição da LV se restringia às regiões rurais, afetando crianças abaixo de 10 anos (VIEIRA; LACERDA; MARSDEN, 1990), mas atualmente a maioria dos casos ocorre em áreas urbanas e periurbanas, sendo a urbanização explicada por razões demográficas, ambientais e sanitárias de ocupação (WERNECK, 2008). A urbanização da LV também foi observada no estado do Rio Grande do Norte (JERONIMO et al., 1994, 2004), onde a incidência no ano de 2011 foi de 2,1 casos por 100.000 habitantes (SISTEMA DE VIGILÂNCIA EM SAÚDE, 2013).
As infecções por espécies de Leishmania spp. responsáveis pela leishmaniose
constatou essa forma de infecção na região metropolitana de Natal (LIMA et al., 2012).
1.4 A EVOLUÇÃO DA INFECÇÃO POR Leishmania spp.
A fonte de infecção no ciclo de transmissão da Leishmania infantum humana
pode ser zoonótica, onde o reservatório são animais domésticos ou animais silvestres, frequente no Brasil; ou antroponótica, como ocorre na Índia e outros países da Ásia, onde a espécie humana parece ser o principal reservatório (WORLD HEALTH ORGANIZATION, 2010). A maioria dos reservatórios, incluindo o homem, apresenta raras ou poucas amastigotas circulantes no sangue periférico. Contudo, o cão (Canis familiaris) frequentemente apresenta alta carga parasitária em vários
tecidos, principalmente pele e vísceras(WORLD HEALTH ORGANIZATION, 2010). O cão é considerado o maior reservatório doméstico da Leishmania infantum na
América Latina e na Europa (ROMERO; BOELAERT, 2010; WORLD HEALTH ORGANIZATION, 2010). As medidas de controle da LV no Brasil têm se baseado, principalmente, na eutanásia de animais infectados e borrifação das residências em um raio de 300 m onde o caso humano de leishmaniose visceral ocorreu. O tratamento dos cães parece não ser efetivo, com frequentes recidivas, além do risco de induzir resistência parasitária às drogas, em um arsenal terapêutico já pequeno (MIRÓ et al., 2008). Em adição, o tratamento não promove a cura parasitológica de cães, permanecendo estes como reservatórios para o inseto vetor (MIRÓ et al., 2008; RIBEIRO et al., 2008). Com base nesses dados, o Ministério da Saúde do Brasil recomenda a eutanásia dos cães soropositivos para Leishmania spp. e proíbe
o tratamento de cães infectados.
Pessoas que apresentam autoresolução da infecção por Leishmania spp. podem
ser detectadas pela avaliação da resposta celular, determinada pela intradermo-reação (Teste de Montenegro) ou por estimulação de células mononucleares de sangue periférico (CMSP), seguida de determinação de citocinas no sobrenadante da cultura. Já a forma assintomática apresenta uma alta taxa de proliferação de CMSP e produção de IFN-γ frente ao antígeno de Leishmania spp. (WILSON;
JERONIMO; PEARSON, 2005). Pessoas com LV não têm a capacidade de montar uma reação de hipersensibilidade tardia aos antígenos de Leishmaniaspp., mas a
antígeno de Leishmania infantum (CARVALHO et al., 1985; CARVALHO; TEIXEIRA;
JOHNSON, 1981). Sendo assim, é importante notar que existe uma correlação negativa entre a resposta celular e a resposta humoral em indivíduos com leishmaniose visceral (MILES et al., 2005).
O indivíduo infectado por Leishmania spp. pode evoluir para LV num período
que pode variar de semanas a dois anos, caso contrário essa progressão torna-se improvável (JERONIMO et al., 2000). Embora o desenvolvimento tardio da leishmaniose não seja naturalmente observado, esse paciente poderá desenvolver a doença em função de um imunocomprometimento como a AIDS, neoplasias, ou infecções por microrganismos patogênicos (BADARÓ et al., 1986; DELETONA, 1986), sendo esse evento explicado pela provável inexistência de cura estéril, uma vez infectado pela Leishmania spp. (BADARÓ et al., 1986; MARY et al., 2006).
Nesse contexto, a leishmaniose visceral já vem sendo considerada como uma doença de caráter oportunista, apresentando-se na maioria dos casos sob a forma assintomática (BADARÓ et al., 1986; DELETONA, 1986).
Baseado no fato da resposta imunológica ter um papel importante na patogênese da LV, a avaliação de coinfecções revela-se importante no entendimento da doença. Sendo assim, vale notar que o surto de infecção pelo HIV mudou a epidemiologia da leishmaniose visceral na Europa, de uma doença predominantemente encontrada em crianças para uma doença mais comum em adultos (ALVAR et al., 1997). Já em países subdesenvolvidos ou em desenvolvimento, como o Brasil, a infecção por helmintos é frequente, por isso alguns estudos têm sido realizados buscando avaliar a capacidade desses parasitas intestinais em modular a resposta imunológica em diversas patologias, inclusive na leishmaniose cutânea (O’NEAL et al., β007). Dessa forma, pacientes com neoplasias também apresentam elevado risco de desenvolvimento das leishmanioses. O câncer apresenta uma sintomatologia parecida com a LV, o que dificulta o diagnóstico de ambas as doenças (ANTINORI; SCHIFANELLA; CORBELLINO, 2012).
O exato mecanismo pelo qual uma mesma espécie de Leishmania spp. pode
et al., 2008), a resposta imunológica ou mesmo questões socioeconômicas (CALDAS et al., 2002).
1.5 IMUNOLOGIA DAS LEISHMANIOSES
A resposta imune inata apresenta um importante papel não só no controle do parasitismo inicial mas também na ativação da resposta imunológica adquirida. O infiltrado inflamatório formado nas primeiras horas após a infecção é constituído por células polimorfonucleares, principalmente neutrófilos (SOLBACH; LASKAY, 2000). Essa célula apresenta um papel fagocítico, funcionando como um hospedeiro temporário (ZANDBERGEN et al., 2004). Apesar dos neutrófilos apresentarem pouca longevidade, o processo normal de apoptose é retardado pela presença de
Leishmania spp. viva no interior destas células (AGA et al., 2002). Após essas
primeiras horas de infecção, o infiltrado passa a ser formado predominantemente por macrófagos, que irão então fagocitar os neutrófilos apoptóticos, sendo essa uma via alternativa de entrada da Leishmania spp. no macrófago. As interações de
membrana entre essas células impedem a ativação do macrófago e propiciam a sobrevivência da Leishmania spp. no interior do mesmo, mostrando assim que os
neutrófilos desempenham um papel de “Cavalo de Tróia” na infecção (ZANDBERGEN et al., 2004). Dentro do macrófago as formas promastigotas vão para o fagolisosomos onde se diferenciam em amastigotas. Sob essa forma, os parasitos proliferam e eventualmente rompem a célula, permitindo assim a infecção de outros macrófagos (CUNNINGHAM, 2002).
Leishmania sp. (NATHAN et al., 1983). A importância da enzima iNOS no controle
da infecção pela Leishmaniamajor foi mostrada em estudo utilizando camundongos
deficientes desta enzima, que mostraram-se altamente susceptíveis à infecção, apesar da presença do IFN-γ (SANTOS et al., 2006, p. 6). Além do IFN-γ, outras citocinas inflamatórias como a IL-1, TNFα, IFN-α e IFN- também estão envolvidas na ativação do macrófago pela ativação da enzima iNOS (BLOS et al., 2003; BRONTE; ZANOVELLO, 2005; ROCHA et al., 2007).
Tanto na leishmaniose cutânea como na leishmaniose visceral, a ativação da via clássica iniciada pelas citocinas IL-12 e IFN-γ apresentam um papel importante na ativação do macrófago e controle da infecção. Contudo a ativação dessa resposta inflamatória pode ocorrer de forma descontrolada e assim levar a uma elevada destruição tecidual, como ocorre na leishmaniose mucosa causada pela
L.braziliensis. Na forma mucosa encontramos lesões com um perfil Th1 exacerbado
(BACELLAR et al., 2002), ativação de macrófagos que leva à destruição tecidual, onde são observados poucos parasitas na lesão (CASTÉS; AGNELLI; RONDON, 1984).
No hospedeiro, diversas funções de defesa são realizadas por subpopulações fenotipicamente heterogêneas, sendo essas caracterizadas pela presença ou não de diversos antígenos de membrana que são distintamente expressos por células. Com relação à resposta imunológica adaptativa, foi inicialmente demonstrada a presença de duas subpopulações imunomoduladoras de células T CD4, Th1 e Th2, com importante papel no curso de infecções por patógenos (MOSMANN et al., 2005). A diferenciação dos linfócitos em Th1 e Th2 ocorre em consequência do perfil de citocinas inicialmente presente e em função de alguns fatores transcricionais, sendo as citocinas IL-4 e o fator transcricional GATA-3 importantes no estágio inicial de diferenciação do linfócito em Th2, assim como as citocinas IL-12 e IFN-γ e o fator transcricional T-bet importantes para a diferenciação dos linfócitos TCD4 para o perfil Th1 (SEDER; PAUL, 1994; WEAVER et al., 2006).
A susceptibilidade e resistência à infecção de camundongos por L. major, foi
co-cultivados com linfócitos TCD4 apresentaram uma menor taxa de infecção, o mesmo não foi visto para linfócitos TCD8 (SANTOS et al., 2013).
CCR4+, ambas características de direcionamento para pele e linfonodo
(ACOSTA-RODRIGUEZ et al., 2007). Dentre as células CCR6+ e CXCR3+ foi identificada uma
maior fração de células Th1, bem como uma população menor de células produtoras de ambas citocinas IL-17 e IFN- γ (ACOSTA-RODRIGUEZ et al., 2007).
Outra linhagem de células TCD4 são as conhecidas como células T reguladoras (Treg), que podem ser caracterizadas pela expressão elevada de receptores de IL-2, também conhecidos como CD25 (TCD4+CD25high). A presença de IL-2 mostrou ser
importante na proliferação e sobrevivência dessas células (PAPIERNIK et al., 1998). As células Treg possuem a capacidade de suprimir a proliferação de células T efetoras, tanto CD4 como CD8, e essa supressão ocorre via TCR (contato célula-célula) (DIECKMANN et al., 2002). Essa resposta reguladora é amplificada através de células TCD4+CD25- que passam a produzir IL-10, que atua como fator solúvel
capaz de tornar outras células anérgicas (DIECKMANN et al., 2002). Existem dois tipos principais de células Treg, uma que se diferencia ainda no timo, conhecida como célula Treg natural, e outra que tem origem nas células T CD4 e são conhecidas como células Treg adaptativa (periférica). Dentre esta última, existem ainda as Treg produtoras de TGF- e que expressam Foxpγ e as grandes produtoras de IL-10 e que não expressam Foxp3 (WEAVER et al., 2006).
A ativação de células T em repouso é acompanhada pelo aparecimento de novos antígenos de superfície celular, tais como CD69 e receptores de IL-2 (ou CD25). O CD69 é o primeiro a ser expresso; em menos de uma hora após a ativação, seu transcrito já é detectado (LÓPEZ-CABRERA et al., 1993). Essa ativação pode ocorrer por várias formas incluindo ativação de TCR e IL-2 (LÓPEZ-CABRERA et al., 1993). O CD69 pode ser expresso em muitos tipos celulares, como células NK e plaquetas, porém é mais expresso em linfócitos maduros (JUNG et al., 1990). A expressão de CD25 em linfócitos ocorre dentro de 6 a 24 horas após o estímulo e persiste por alguns dias, tendo um pico 48 horas após o estímulo (POULTON et al., 1988). Sua expressão varia pouco entre 24 a 72 horas (POULTON et al., 1988). Estudo em leishmaniose cutânea revelou correlação negativa entre tempo de cura e ativação celular (CD69+). A diminuição da ativação
Outros antígenos de membrana que são distintamente expressos por células T humanas são CD45RA e CD45RO, que são isoformas marcadoras de célula naive e
células de memória respectivamente (CLEMENT, 1992). A IL-2 é a principal citocina implicada nessa mudança do perfil CD45RA+ para CD45RO+ (ROTH, 1994). A
importância da presença do perfil de memória CD45RO está na capacidade do indivíduo em responder mais rapidamente frente a uma nova estimulação com o mesmo antígeno (BEVERLEY, 1992). Isso ocorre pelo fato de uma parcela dos linfócitos ativados persistirem de forma a garantir uma resposta mais rápida e efetiva em função de uma reinfecção. Dentre essas células de memória, existem duas sub-populações, as que expressam moléculas de direcionamento para o linfonodo CCR7 assim como CD62L, conhecidas como células T de memória central (Tcm), e as que migram para o sítio de infecção e não apresentam essas moléculas de superfície que são as células T de memória efetora (Tme) (SALLUSTO et al., 1999; SCOTT, 2005).
As células T CD8+ revelaram ser importantes no controle de agentes
patogênicos pela produção de citocinas, assim como pela atividade citolítica ou ambas, sendo essas atividades bem estabelecidas em infecções virais (JORDAN; HUNTER, 2010). Estudos em lesões metastáticas humanas causadas pela L.
braziliensis revelaram uma elevada expressão de genes associados à via lítica,
sendo a célula TCD8+ a principal implicada. Essa atividade citolítica é estudada
através dos marcadores de perforina e granzima (Grazima B e CD107a) (NOVAIS et al., 2013; SANTOS et al., 2013). Quando a célula CD8 encontra a célula alvo, a granzima B é liberada levando à fragmentação do DNA (NOVAIS et al., 2013; SANTOS et al., 2013). Já a CD107a é uma proteína lisossomal que é temporariamente exposta na superfície da célula após a degranulação (BETTS et al., 2003). No entanto, em alguns estudos, as células CD8+ foram relacionadas à
cura das lesões de leishmaniose tegumentar (DA-CRUZ et al., 2005).
A Leishmania spp. são protozoários que também podem ser parasitados. Essa
infecção é dada por um vírus RNA chamado LRV1. A coinfecção protozoário-vírus foi observada na América do Sul em isolados de L. braziliensis, e parece ser um dos
fatores implicados no desenvolvimento de lesões metastáticas, devido a uma resposta inflamatória exacerbada (IVES et al., 2011; SCOTT, 2011).
A susceptibilidade e resistência à leishmaniose visceral já foi relacionada à genética do hospedeiro, tanto em estudos com humanos como em modelos experimentais (BLACKWELL et al., 2009; BRADLEY et al., 1979; JAMIESON et al., 2007), sendo muitos destes genes relacionados à resposta imunológica. Estudos em imunogenética podem fornecer pistas importantes para a melhoria das drogas, revelando novos alvos terapêuticos (BLACKWELL et al., 2009). Dentre os genes alvos, o que revela-se mais promissor é o gene do complexo de histocompatibilidade (BLACKWELL; FREEMAN; BRADLEY, 1980; JAMIESON et al., 2007; JORDAN; HUNTER, 2010) sendo esse envolvido tanto na resposta inata como na resposta adaptativa.
Outro gene envolvido na resposta imunológica inata relacionado à susceptibilidade à LV é o SLC11A1, também conhecido como NRAMP1 (VIDAL et al., 1995). Esse gene codifica uma proteína transmembrana presente no lisossoma e endossoma tardio de macrófagos e está relacionado à susceptibilidade a doenças causadas por parasitas intracelulares como M. leprae e M. tuberculosis
(BLACKWELL et al., 2001). Ele é um transportador simporte de cátion divalente, como o ferro Fe++ por exemplo (BLACKWELL et al., 2001), e parece estar envolvido
também no aumento da produção de óxido nítrico induzido (iNOS), sendo essencial no controle da infecção de macrófagos por parasitas intracelulares.
produzir IFN-γ e uma diminuição na produção de IL-10 em cultura (CALDAS et al., 2005).
Uma possível explicação para a diferença nas quantidades de citocinas presentes na cultura de CMSP e no plasma se baseava no fato dessas citocinas terem origem em uma resposta pró-inflamatória, característica de órgãos linfoides secundários, sendo uma produção tecido-específica (GOTO; PRIANTI, 2009; NYLEN et al., 2007), ou mesmo pela possibilidade das citocinas presentes no plasma terem sido produzidas de forma inespecífica. Neste último caso, o próprio LPS, que encontra-se elevado no plasma de paciente com LV, pode levar ao aumento dessas citocinas (SANTOS-OLIVEIRA et al., 2011).
Estudos recentes em pacientes da Índia com a doença ativa, revelou que a cultura de sangue total frente ao antígeno de L. donovani apresentava elevadas
quantidades de ambas as citocinas IFN-γ e IL-10, resultado contraditório em relação à cultura de CMSP (SINGH et al., 2012). A utilização da cultura de sangue total é uma metodologia mais barata, mais rápida e que requer um menor volume de sangue quando comparado com o cultivo de células purificadas. Associado a isso, levanta-se a hipótese de que essa metodologia reproduz de forma mais fidedigna o que acontece no sangue periférico (APPAY et al., 2006), uma vez que inclui na cultura diversos fatores presentes no plasma do indivíduo, como granulócitos e plaquetas, que apresentam um papel importante no desenvolvimento da resposta imunológica (ERFE et al., 2012).
Considerando citocinas pró e anti-inflamatórias no plasma, a diferença entre indivíduo infectado e controle sadio é mais expressiva para IL-10 (NYLEN et al., 2007). Essa citocina moduladora tem sido implicada como o principal fator imunossupressor tanto na doença humana como na leishmaniose experimental (CLARÊNCIO et al., 2009; MURPHY et al., 2001; RODRIGUES et al., 2009). Experimentos in vitro utilizando o cultivo de macrófagos (MILES et al., 2005; NYLEN
et al., 2007) e avaliando sangue periférico de pacientes (VERMA et al., 2010) têm mostrado uma correlação positiva entre níveis de IL-10 e a carga parasitária. Ainda em relação a essa citocina, é sabido que os níveis de IL-10 diminuem no baço de pacientes após o tratamento, assim como estudos in vitro utilizando CMSP de
pacientes frente ao estímulo com antígeno de L. infantum mostram uma diminuição
Os anticorpos estão presentes na infecção por Leishmania spp., mas não são
protetores e parecem estar envolvidos com a patogênese (MILES et al., 2005). Essa susceptibilidade conferida pela IgG está diretamente relacionada aos níveis de IL-10 e esse à carga parasitária (HOLADAY et al., 1993; KANE; MOSSER, 2001; MILES et al., 2005; NYLEN et al., 2007; VERMA et al., 2010). Monócitos infectados in vitro
com L. infantum produzem IL-10 elevado, quando, à cultura, é acrescido soro de
paciente com leishmaniose visceral. Essa respostas não é observadas quando soro de indivíduo sadio é acrescentado (MILES et al., 2005; NYLEN et al., 2007). Contudo a utilização de anti IL-10 nessas culturas diminui significativamente a quantidade de L.donovani em macrófagos (NYLEN et al., 2007).
Indivíduos e modelos experimentais infectados apresentam elevados níveis de IgG total anti-leishmânia. Por outro lado, a determinação de diferentes subclasses de anticorpos específicos fornece uma boa indicação da natureza Th1/Th2 da resposta imunológica (CALDAS et al., 2005; HAILU et al., 2001). Nesse contexto, IgG1 e IgG3 estão relacionadas ao polo Th2, ou seja, à susceptibilidade à doença, mas IgG2 não parece ter relação. IgG4 encontra-se elevada durante a doença mas cai após tratamento (CALDAS et al., 2005).
Os linfócitos T são as principais células implicadas na produção de IL-10 assim como na produção de IFN-γ e estes encontram-se aumentados no baço de pacientes com doença ativa quando comparados a indivíduos normais (NYLEN et al., 2007). A infecção de macrófagos e subsequente co-cultivo com linfócitos T, revelou um aumento na expressão de citocinas pró-inflamatórias (IFN-γ, IL-6, IL-1a, IL-1 ) e simultaneamente regulatória (IL-10, TGF- ) pelos linfócitos (ETTINGER; WILSON, 2008). O estudo do perfil de célula implicado na produção de IL-10 revelou que essa citocina é produzida por células CD4+CD25−Foxp3− em pacientes
infectados por L. donovani (NYLEN et al., 2007). O mesmo evento foi descrito para
infecção experimental por L. major e L. donovani (ANDERSON et al., 2007; STAGER
et al., 2006).
arginina como substrato e consequente formação de ROS. Sendo assim, diversos patógenos, inclusive a Leishmania spp. (BISWAS et al., 2011), induz o aumento da
arginase para garantir sua sobrevivência no macrófago (GIORDANENGO et al., 2002; GOBERT et al., 2001; LAHIRI; DAS; CHAKRAVORTTY, 2008, p. 7). Estudo do nosso grupo revelou que a expressão do gene arginase 1 (ARG1) encontra-se aumentado em CMSP em pacientes com a doença ativa quando comparado com curado (GLORIA REGINA DE GÓIS MONTEIRO, 2014).
Um outro regulador da resposta imune, que age prevenindo a inflamação é a enzima Heme-oxigenase (HO-1) (ORIGASSA; CAMARA, 2013). Este gene também está mais expresso na fase sintomática da LV (GLORIA REGINA DE GÓIS MONTEIRO, 2014). A HO-1 é responsável pela degradação do heme, liberando ferro livre, monóxido de carbono e biliverdina (LUZ et al., 2012; ORIGASSA; CAMARA, 2013). Esta última é então convertida em bilirrubina, uma molécula com atividade anti-inflamatória, com papel já descrito na infecção por Leishmania pifanoi
(PHAM; MOURIZ; KIMA, 2005). A infecção de macrófagos com L. infantum leva ao
aumento da expressão de HO-1 e consequente aumento da carga parasitária (LUZ et al., 2012).
Diferentemente da IL-10, o estudo de citocinas do perfil Th17 revelou que L.
donovani estimula a produção de IL-17 e IL-22 por CMSP de indivíduos sadios
(PITTA et al., 2009). Indivíduos assintomáticos provenientes de região endêmica produzem muito mais IL-17 quando comparado a indivíduos curados; assim, os dados sugerem que na infecção por L. donovani a produção de IL-17 e IL-22
apresenta um papel complementar às demais citocinas relacionadas à resposta do tipo 1, sendo importantes na proteção contra o desenvolvimento da doença (PITTA et al., 2009).
É descrita uma supressão da resposta proliferativa específica a antígenos de
L.infantum em pacientes com leishmaniose visceral (WILSON; JERONIMO;
PEARSON, 2005), contudo resultados contraditórios são encontrados quando avaliadas alterações nas frequências de células CD4+ e CD8+ (NYLEN et al., 2007;
(HO et al., 1983; ROTH, 1994). Em indivíduos doentes foram descritas diminuições de linfócitos CD8 ativados (CD8+CD25+) assim como de linfócitos CD4 ativados
(CD4+CD25+) e aumento de linfócitos em apoptose (Anexina V+ e CD95+) no sangue
periférico, contudo, após o tratamento, essas células retornam a frequências observadas em indivíduos sadios (CLARÊNCIO et al., 2009).
Em pessoas infectadas por L. donovani e que desenvolveram a doença, é
descrita uma baixa frequência de célula de memória (CD4+ CD25+ CD45RO+) assim
como uma baixa expressão de Foxp3 (NYLEN et al., 2007). Essa baixa frequência pode ser explicada por uma migração ou retenção dessas células em órgãos infectados como medula óssea, mas não no baço (CLARÊNCIO et al., 2009; NYLEN et al., 2007).
2. JUSTIFICATIVA
Os eventos imunológicos desencadeados durante o tratamento da leishmaniose visceral, assim como aqueles presentes durante a infecção assintomática, podem representar ferramentas para a definição de um perfil relacionado à cura, recidiva ou mesmo um perfil imunológico protetor. A análise da imunidade celular inata e adaptativa, assim como a humoral na LV, demonstrou altos níveis de anticorpos circulantes, diminuição da resposta celular tipo 1 e alta produção de citocinas tipo 2, assim como os macrófagos desativados. A intradermo-reação de Montenegro nesses pacientes é negativa. Os pacientes curados apresentam, por algum tempo, altos níveis de IgG, e o sucesso no tratamento depende de uma mudança no perfil de resposta imunológica. Por outro lado, indivíduos assintomáticos apresentam um perfil de citocinas misto. Esses indivíduos apresentam ainda imunidade celular, avaliada pela intradermo-reação a antígenos de Leishmania spp. (Teste de
Montenegro) e resposta humoral reativa por longo período, indicando assim a presença do parasito (ou mesmo antígenos) depois da infecção inicial, revelando com isso a importância da avaliação da carga parasitária nesses indivíduos.
Os estudos em humanos trazem informações relevantes quanto à descrição de fenômenos imunológicos, porém poucos são os estudos que revelam mudança do padrão imunológico em um mesmo indivíduo após o tratamento, dificultando assim o estabelecimento dos determinantes implicados na dinâmica da cura da leishmaniose visceral. Visto que o acompanhamento de pacientes ao diagnóstico e após a cura é lento e dificultoso, a maioria dos estudos utiliza grupos de estudo em detrimento do estudo individual. No entanto é sabido que diversos são os fatores individuais relacionados ao processo de doença como a genética do indivíduo, estado nutricional ou mesmo questões socioeconômicas.
Neste sentido, a composição da estratégia de estudo deve incluir não apenas os parâmetros da resposta celular de indivíduos sadios, assintomáticos e doentes em processo de cura, mas também avaliar a resposta imunológica como um todo, avaliando em um mesmo indivíduo a carga parasitária, o efeito da resposta humoral sobre a resposta celular, subclasses de imunoglobulinas predominantes em cada etapa do tratamento. Destarte, o presente trabalho objetiva caracterizar o perfil imunológico em resposta a L. infantum no homem e entender os mecanismos
3. OBJETIVO
Avaliar a resposta imunológica em sangue total na infecção por
Leishmania(Leishmania) infantum: sintomática, pós-tratamento e assintomática.
3.1 OBJETIVOS ESPECÍFICOS:
3.1.1 Determinar o perfil de ativação, memória e produção de citocinas por linfócitos CD4 e CD8 durante a leishmaniose visceral e nos controles endêmicos.
3.1.2 Comparar a carga parasitária e os níveis séricos de IgG e IL-10 na leishmaniose visceral ativa e nos controles endêmicos.
3.1.3 Comparar o perfil fenotípico de linfócitos circulantes e os tipos celulares envolvidos na produção de citocinas em indivíduos com leishmaniose visceral ativa e nos controles endêmicos.
3.1.4 Comparar a carga parasitária e o perfil de resposta imunológica humoral na leishmaniose visceral ativa e nos curados.
4. MATERIAL E MÉTODOS
4.1 ÁREA DE ESTUDO, POPULAÇÃO E DESENHO DE ESTUDO:
Área de estudo: Rio Grande do Norte (RN) é um estado formado por uma população estimada de 3.374.000 habitantes, dispersos em uma área total de 52.811,047 Km2, cuja capital é Natal. O Hospital Giselda Trigueiro, localizado em
Natal, é referência em doenças infecciosas para o RN. A maior parte dos casos de LV ocorre na região litoral oriental do Estado (XIMENES, 2007). No entanto, nos últimos anos, tem sido crescente o número de casos de LV na região Oeste do RN. No ano de 2010, o RN notificou 67 novos casos de LV (SINAN/SVS, 2013), perfazendo uma taxa de incidência de 2,67 casos por 100.000 habitantes (REDE INTERAGENCIAL DE INFORMAÇÕES PARA A SAÚDE, 2014).
População estudada: Foram recrutados voluntários com LV (n=16) internados no Hospital Giselda Trigueiro no período de 2011 a 2012. Dentre esses pacientes, 81% (n=13) eram do sexo masculino e 19% do sexo feminino (n=3). Foram recrutados voluntários acima de 18 anos com idade média de 37 ± 15 anos. Dos 16 pacientes arrolados, 87,5% (n=14) receberam tratamento com Glucantime (20mg de Sb+5
kg/dia), apenas dois pacientes apresentaram complicações e o protocolo de tratamento foi alterado para Anfotericina B, de acordo com as recomendações do Ministério da Saúde do Brasil (SECRETARIA DE VIGILÂNCIA EM SAÚDE, 2006). O período médio de tratamento foi de 23 ± 8 dias. A metade da população (n=8) estudada possuía cães em casa. O diagnóstico parasitológico pelo padrão ouro foi realizado em dez (62,5%), e, dentre esses, seis (60%) apresentaram a cultura de aspirado de medula positiva. O diagnóstico dos demais pacientes foi realizado com base em dados clínicos-epidemiológicos assim como sorológicos. Não foram incluídos no estudo indivíduos que apresentaram teste rápido para HIV positivo, assim como indivíduos que apresentavam quadro clínico de infecção por esquistossomose. Foi realizado exame parasitológico de fezes em 8 dos 16 pacientes arrolados no estudo e apenas um paciente apresentou exame positivo para ameba.
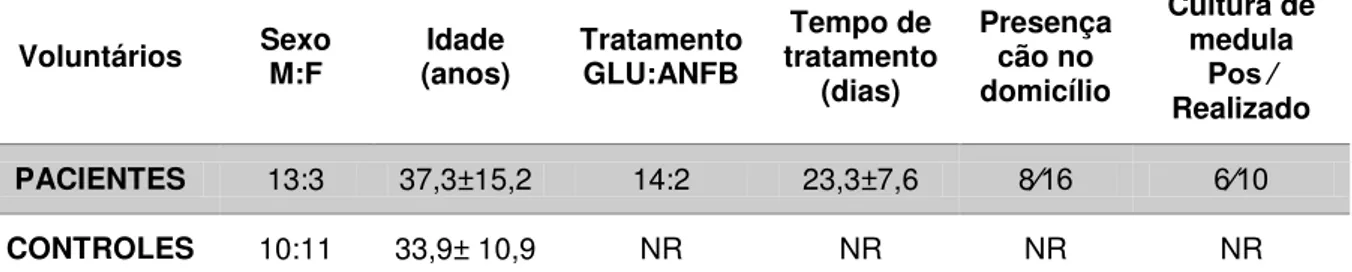
Tabela 1. Características demográficas, epidemiológicas e clínicas dos voluntários estudados
Voluntários Sexo M:F (anos) Idade Tratamento GLU:ANFB tratamento Tempo de (dias)
Presença cão no domicílio
Cultura de medula
Pos ∕
Realizado
PACIENTES 13:3 37,3±15,2 14:2 23,3±7,6 8∕16 6∕10
CONTROLES 10:11 33,9± 10,9 NR NR NR NR
M-masculino, F-feminino, TTT- tratamento, GLU-Glucantime, ANFB-Anfotericina B, Tempo (dias) de tratamento na coleta inicial, NR-não realizado; POS - positivo
Pacientes - Indivíduos sintomáticos com cultura de medula e ∕ ou sorologia positiva: Foram incluídos neste grupo 16 indivíduos com diagnóstico clínico-epidemiológico, sorologia e∕ou cultura positiva para Leishmania spp.
Controles - Indivíduos residentes na área endêmica para leishmaniose visceral. Um total de 21 indivíduos provenientes de região endêmica, que moravam ou eram vizinhos de casos de LV, foram arrolados como controles. Neste grupo, foram incluídos indivíduos a) Controle Positivo: sem história de LV, mas que apresentaram sinais de infecção por Leishmania spp, seja presença de anticorpos
anti-leishmânia e ∕ ou PCR positivo para Leishmania spp.; b) Controle Negativo:
pessoas saudáveis, com sorologia negativa para anticorpos anti-leishmânia e PCR negativo para Leishmania spp.
Estudo longitudinal para avaliação imunológica do processo de cura na Leishmaniose visceral
Dos 16 pacientes com LV que foram arrolados inicialmente, 12 foram acompanhados em 2 tempos subsequentes 4 meses e 14 meses após o término do tratamento. Quatro pacientes foram excluídos do estudo de seguimento. Os motivos para perda dos pacientes durante o estudo foi mudança do estado do RN e dificuldade de localização. Dentre os 12 indivíduos, 10 eram do sexo masculino e 2 do sexo feminino.
Tempo 0 – Coleta do sangue e avaliação clínica do indivíduo com LV recentemente diagnosticada com sorologia positiva.
Tempo 2 – Foi realizada uma terceira avaliação e coleta de sangue dos mesmos indivíduos após 14 meses do início do tratamento.
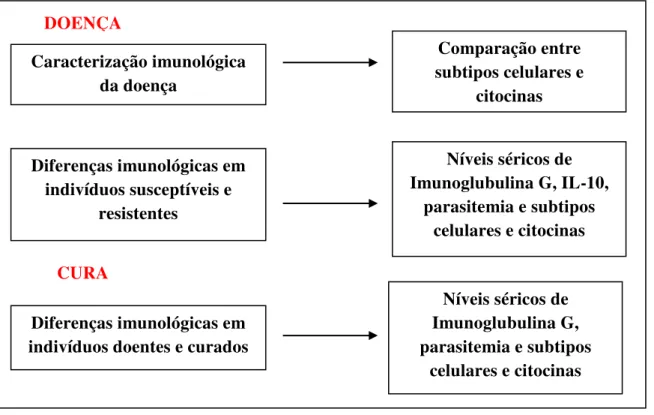
Sendo assim o presente estudo será dividido em sub-estudos, conforme os objetivos específicos apresentados anteriormente (Figura 3):
Sub-estudo 1: Caracterização do perfil imunológico dos pacientes LV ativa Sub-estudo 2: Comparação do perfil imunológico dos pacientes LV ativa e controles endêmicos.
Sub-estudo 3: Estudo longitudinal do perfil imunológico dos pacientes durante o processo de cura da LV.
Figura 3. Delineamento experimental dos desenhos dos sub-estudos e marcadores moleculares analisados
4.2CONSIDERAÇÕES ÉTICAS
Este estudo cumpriu com as disposições da resolução 196/96, do Conselho Nacional de Saúde, que regulamentava a pesquisa envolvendo seres humanos até 2013, quando então foi substituída pela Resol 466/12, tendo sido aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal do Rio Grande do Norte (CEP-UFRN 94/06) (Anexo 2). Os indivíduos foram esclarecidos quanto ao estudo
Caracterização imunológica da doença
Comparação entre subtipos celulares e
citocinas
Diferenças imunológicas em indivíduos susceptíveis e
resistentes
Níveis séricos de Imunoglubulina G, IL-10,
parasitemia e subtipos celulares e citocinas
Diferenças imunológicas em indivíduos doentes e curados
Níveis séricos de Imunoglubulina G, parasitemia e subtipos
celulares e citocinas
DOENÇA
e, aqueles que concordaram em participar, assinaram o Termo de Consentimento Livre e Esclarecido para Pacientes Voluntários (Anexo 3).
4.3 DIAGNÓSTICO DA INFECÇÃO POR Leishmania spp.
4.3.1 Preparo do antígenos solúveis de promastigotas de Leishmania infantum
A preparação de antígenos solúveis de promastigotas de Leishmania infantum
teve por objetivo a realização dos ensaios de avaliação de resposta imune específica. Esse antígeno foi obtido através de métodos previamente descritos (SOUZA et al., 2004), com algumas modificações. Resumidamente, formas promastigotas de L. infantum, isolada de caso confirmado de LV (IOC3052), foram
cultivadas em meio Schneider até atingir a fase estacionária. Posteriormente, essa cultura foi ajustada para a concentração de 107 promastigotas/mL e centrifugada à
2.500 x g por 10 minutos a 4ºC. Foi então lavada 3 vezes com salina estéril seguida de uma última centrifugação à 2.500 x g por 10 minutos à 4°C. O sedimento foi suspenso em solução tamponada salínico fosfatada (PBS) estéril e acrescido de inibidores de proteases (PMSF e leupeptina), sendo submetido a congelamento-descongelamento (3 vezes), seguido de centrifugação. O sobrenadante continha a fração solúvel de antígenos. A concentração de proteína foi mensurada através do Kit para detecção de proteína com ácido bicinconínico (Sigma-Aldrich, St. Louis, EUA), e a solução estoque de proteína mantida a -80º C.
4.3.2. Avaliação dos níveis de anticorpos anti-leishmânia utilizando antígenos recombinante K39 (rK39) e antígeno solúvel de Leishmania infantum (SLA).
Anticorpos anti-leishmânia foram quantificados pelo método ELISA, seguindo protocolo previamente descrito, mas com algumas modificações (BRAZ et al., 2002). Em resumo, placas de 96 poços (Linbro, Ohio, EUA) foram sensibilizadas com 50 ng/poço de antígeno rK39 (Infectious Diseases Research Institute, Seattle, WA) e 500 ng/poço de antígeno solúvel de L. infantum (SLA), sendo incubadas por 18