UNIVERSIDADE ESTADUAL PAULISTA “JULIO DE MESQUITA FILHO”
FACULDADE DE CIÊNCIAS AGRONÔMICAS
CAMPUS DE BOTUCATU
AVALIAÇÃO FITOQUÍMICA E MICROBIOLÓGICA DA ESPÉCIE
Artemisia annua
L., SUBMETIDA A TRATAMENTOS DE
ARMAZENAMENTO E CONDIÇÕES DE AMBIENTE
THALITA CRISTINA MARQUES CERVEZAN
Dissertação apresentada à Faculdade de Ciências Agronômicas da UNESP – Campus
de Botucatu, para obtenção do título de Mestre em Agronomia (Energia na Agricultura)
CAMPUS DE BOTUCATU
AVALIAÇÃO FITOQUÍMICA E MICROBIOLÓGICA DA ESPÉCIE
Artemisia annua
L., SUBMETIDA A TRATAMENTOS DE
ARMAZENAMENTO E CONDIÇÕES DE AMBIENTE
THALITA CRISTINA MARQUES CERVEZAN
Orientador: Fernando Broetto
Dissertação apresentada à Faculdade de Ciências Agronômicas da UNESP – Campus
de Botucatu, para obtenção do título de Mestre em Agronomia (Energia na Agricultura)
5
DEDICO
A Deus por estar sempre presente, me guiando e
iluminando.
Aos meus pais Catarina e Jader, pelo amor,
paciência, incentivo e por serem meus exemplos.
Ao meu irmão Jader Augusto pela alegria,
companheirismo e cumplicidade.
A minha família por fazer parte desta caminhada,
por se manterem ao meu lado me auxiliando,
acolhendo e incentivando a realização dos meus
“Ensinar não é transferir conhecimento, mas criar
as possibilidades para sua própria produção ou a
sua construção”
(Paulo Freire)
“Natureza é apenas um nome para um efeito cuja causa é Deus”
(Cowper)
“Se o sábio lhes der ouvidos, aumentará o seu
conhecimento, e quem tem discernimento obterá
orientação”
7
AGRADECIMENTOS
A Coordenação de Aperfeiçoamento Pessoal de Nível Superior - CAPES pela bolsa concedida.
Ao professor Dr. Fernando Broetto pela oportunidade, orientação e ensinamentos.
A Dra. Glyn Mara Figueira pela amizade, coorientação, disponibilidade de tempo e prontidão.
Ao Laboratório Agrotecnologia do Centro de Pesquisas Químicas, Biológicas e Agrícolas - CPQBA/UNICAMP por ceder o espaço e permitir a execução do presente trabalho.
Ao Dr. Pedro Mellilo Magalhães pelos ensinamentos e auxilio decorrentes do projeto Pronex-Rede Malaria (MS-CNPq 555672/2009-3 e FAPESP 2009/53639-3).
A Ilza Maria de Oliveira Souza e Mary Ann Foglio do Departamento de Fitoquímica - CPQBA/UNICAMP, pela colaboração e por permitir a execução das análises laboratoriais.
A Aline Cristina Rabonato, pela amizade, disponibilidade, atenção e companheirismo.
Aos meus amigos, Felipe Vitório Farias, Mariana da Silva Caldeira, Maysa Areas e Renata Coscolin pela contribuição e incentivo na execução do trabalho.
Aos membros da banca examinadora Filipe Pereira Giardini Bonfim, Marcos Antônio M. Biaggioni, Pedro Mellilo Magalhães e a Glyn Mara Figueira pelos ensinamentos, disponibilidade, sugestões e contribuição.
E a todos meus amigos e familiares que contribuíram e me
LISTA DE TABELAS ...IX
LISTA DE FIGURAS ... X
RESUMO ... 11
SUMMARY ... 12
1. INTRODUÇÃO ... 13
2. REVISÃO DE LITERATURA ... 15
2.1. Considerações sobre a cultura ... 15
2.2. Secagem de plantas medicinais...17
2.3. Armazenamento a vácuo ... 18
2.4. Armazenamento refrigerado ... 19
3. MATERIAL E MÉTODOS ... 20
3.1. Material vegetal ... 20
3.2. Secagem do material vegetal ... 21
3.3. Condições de armazenamento ... 21
3.4. Teor de umidade ... 23
3.5. Ensaios microbiológicos ... 24
3.6. Quantificação da artemisinina por cromatografia de camada delgada ... 24
4. RESULTADOS E DISCUSSÃO ... 26
4.1. Análises microbiológicas ... 26
4.2. Teor de umidade ... 27
4.3. Análises de quantificação da artemisinina... 29
4.31. Quantificação da artemisinina correlacionados aos tratamentos ... 29
4.32. Quantificação do teor da artemisinina em relação ao tempo de armazenamento... ... 31
5. CONCLUSÃO ... 33
6. ANEXOS ... 34
6.1. Análises microbiológicas ... 34
6.2. Placas de CCD ... 37
IX
LISTA DE TABELAS
Páginas
Tabela 1. Avaliação microbiológica de bactérias heterotróficas dos tratamentos em relação aos dias de armazenamento... 26
Tabela 2. Teor de umidade das amostras ao final do processo de
armazenamento... 28
LISTA DE FIGURAS
Páginas
Figura 1. Estrutura química da artemisinina (RODRIGUES et al., 2006)... 16
Figura 2. Campo experimental do cultivo de Artemisia annua ... 20
Figura 3. Amostras armazenadas em prateleiras de armário... ... 22
Figura 4. Amostra armazenadas em geladeira. ... 22
Figura 5. Corrida de placa de CCD em eluente dentro da cuba de vidro... 25
Figura 6. Teor de artemisinina em amostras de A.annua em função dos tratamentos de armazenamento durante o tempo ... 30
11
RESUMO
A espécie Artemisia annua, Asteraceae, nativa da China, tem a
artemisinina como seu principal componente ativo, é considerado um potente antimalárico. Com o aumento do valor dos princípios ativos naturais, estudos relacionados à pós-colheita e armazenamento de material vegetal tornam-se importantes para melhor conservação de suas propriedades fitoterápicas. O presente estudo teve como objetivo definir as melhores condições de armazenamento para preservar a qualidade da droga vegetal. Folhas de A. annua
secas foram armazenadas por seis meses em sacos de polietileno envolto por papel Kraft e acondicionadas em quatro tratamentos: em condição ambiente e refrigerada a 4º±2C, em embalagem normal e em embalagem sob vácuo. No tempo zero e nos períodos de 30, 90, 120 e 180 dias foram realizados as análises microbiológicas e avaliação do teor de artemisinina. Os resultados dos ensaios microbiológicos não demonstraram contaminação significante, assim como o teor de umidade do material armazenado, que permanecem entre 5% a 10%, mantendo-se dentro do parâmetro aceitável. O tratamento sem vácuo ambiente (SVA) foi o que melhor manteve estabilidade de armazenamento durante os 180 dias, no entanto, foi o sem vácuo refrigerado (SVR) que apresentou maior eficiência para a conservação do teor de artemisinina.
________________________
SUMMARY
Artemisia annua is an Asteracea native to China, its principal active
component, artemisinin, is considered a potent antimalarial drug. With the increased interest in natural active principles, studies related to post-harvest and storage of vegetable material become important for better conservation of its phytotherapic properties. Therefore, the present study had as objective define best storage conditions to preserve and keep the quality of phytotherapic Leaves of A. annua dried were stored for six months in polyethylene bags wrapped in Kraft paper and packed in four treatments: at ambient condition, at ambient condition with vacuum packing in refrigerated conditions at 4° ± 2C normal and vacuum packing. At time zero, and the periods of 30, 90, 120 and 180 days were performed microbiological analyzes and evaluation of the level of artemisinin. The results of microbiological tests showed no significant contamination, as well as the moisture content of stored (biological) material, which remain between 5% and 10%, keeping within acceptable parameters. The vacuum environment without treatment (SVA) was the best storage stability maintained during 180 days, however, no vacuum was refrigerated (SVR) showed that greater efficiency to conserve the content of artemisinin, compared to the others.
________________________
13
1.
INTRODUÇÃO
A utilização e comercialização de plantas medicinais estimulado a demanda crescente da indústria por novas fontes naturais de medicamentos. Por outro lado, o consumo também é incentivado devido aos efeitos colaterais causados pelos fármacos sintéticos (BERG, 1993). Os medicamentos fitoterápicos apresentam diferenças importantes quando comparados com os sintéticos. A primeira, é que ao contrario dos medicamentos sintéticos, os princípios ativos dos fitoterápicos raramente são conhecidos. Outra diferença fundamental é que o controle da qualidade e a padronização dos fitoterápicos são tarefas bem mais complexas do que no caso dos medicamentos sintéticos (CALIXTO, 2001).
À medida que estudos químicos e farmacológicos confirmam cientificamente suas ações terapêuticas, aumenta a demanda por matéria-prima envolvida na elaboração destes fitomedicamentos e a busca por produto de alta qualidade torna-se cada vez maior. Sejam estas espécies provenientes do extrativismo ou do cultivo, o material vegetal produzido deve passar pelo processo de secagem e armazenamento a fim de atender às exigências do mercado (FIGUEIRA et al. 2004).
Várias espécies medicinais e/ou aromáticas têm sido alvo de estudo quanto à produção e composição de seus princípios ativos. Devido ao seu efeito antimalárico a
Artemisia annua tem se tornado cada vez mais importante, assim como a sua comercialização.
O Relatório Mundial da Malária de 2012 resume os dados recebidos de 104 países com paludismo endémico e territórios para 2011. Noventa e nove desses países tinham em curso a transmissão da malária. Segundo as últimas estimativas da Organização Mundial da Saúde - OMS, havia cerca de 219 milhões de casos de malária em 2010 e estima 660.000 mortes. A África é o continente mais afetado: cerca de 90% de todas as mortes por malária ocorrem lá.
Entre 2000 e 2010, as taxas de mortalidade por malária caíram 26% em todo o mundo. Segundo a OMS, a região africana apresentou uma queda de 33%. Durante este período, cerca de 1,1 milhões de mortes de malária foram evitadas globalmente, principalmente como resultado de um aumento de escala das intervenções. No entanto, a malária continua a tirar a vida de uma criança africana a cada minuto de cada dia. A Nigéria tem uma das maiores cargas de malária no mundo. Em 2010, 489 mil casos de malária grave foram relatados, resultando em 200.000 mortes.
A malária coloca uma carga pesada no Brasil, onde 40 milhões de pessoas estão em risco de contrair a doença. Em 2010, o país teve 334.618 casos confirmados de malária, dos quais 283.383 eram de Plasmodium vivax e 47.406 de Plasmodium falciparum
(Reddy, 2013). Em 2011, registaram-se 270.000 casos confirmados e 2,6 milhões de casos
suspeitos de malária (LACERDA, 2013). A Sociedade Brasileira de Medicina Tropical, criado em 1962, está envolvido na luta contra tropicais, doenças infecciosas e parasitárias e é questão de fomentar a partilha de conhecimento entre pesquisadores nacionais e internacionais e parcerias público-privadas como Medicines for Malaria Venture – MMV (Reddy, 2013).
Pesquisas recentes sobre condições de armazenamento estão sendo desenvolvidas para que o material vegetal mantenha ao máximo suas propriedades antimaláricas.
15
2. REVISÃO DE LITERATURA
2.1. Considerações sobre a cultura
Com o progresso da química de síntese, as plantas medicinais caíram em descrédito na comunidade, até o surgimento de efeitos colaterais provocados pelos medicamentos sintéticos. Na Europa e nos Estados Unidos mercado de produtos naturais cresce a uma taxa maior que a do mercado de medicamentos sintéticos. Os consumidores típicos desses medicamentos são representantes da classe média alta que exigem cada vez mais alimentos sem a presença de pesticidas ou qualquer outra substância tóxica e que acreditam que o que é natural é bom (FERREIRA, 1998; STIX, 1993).
O mercado mundial de fitoterápicos é estimado em mais de US$ 20 bilhões anuais e, somente na Europa, atinge cerca de US$ 7 bilhões ao ano, sendo que a Alemanha é responsável por cerca de 50% desse total (SIANI, 2003). No Brasil, não existem dados oficiais atualizados, porém, estima-se que esse mercado gire em torno de US$ 160 milhões por ano. Em toda a cadeia produtiva, o setor fitoterápico movimenta anualmente cerca de R$ 1 bilhão (CARVALHO et al., 2008).
de alivio para alguma sintomatologia desagradável. Deste total, pelos menos 30% ocorre por indicação médica (SILVA & CASALI, 1999).
Com o aumento gradativo da medicina alternativa a busca por fitoterápicos tem proporcionado o desenvolvimento de pesquisas e estudos clínicos. Nesse contexto, pode se citar a Artemisia annua como sendo uma das principais plantas de interesse.
A. annua é uma planta herbácea fortemente aromática com hábito de
crescimento determinado e altura variando entre 0,8 e 2,0 metros de altura (JANICK, 1996). É uma espécie nativa da China, cujo princípio ativo, a artemisinina, tem propriedade antimalárica bem estabelecida, enquanto seu óleo essencial tem características de produto sanitário (MAGALHÃES et al., 1997). No Brasil, a introdução da A. annua ocorreu em 1987,
por pesquisadores do CPQBA/UNICAMP (FIGUEIRA, 1996).
Atualmente, o cultivo mundial de A. annua é dominado pela Ásia,
principalmente China e Vietnam, que produzem cerca de 70% da oferta global de artemisinina. O leste da África produz 20% e uma pequena quantidade é produzida em outros países como Brasil, Índia, Ghana, Kenya, Tanzânia, Uganda, Nigéria, Moçambique e Madagascar (LUTHRIA, 2010). Na Romênia e na Bulgária a planta é cultivada como fonte de óleo essencial (JANICK, 1996; HEEMSKERK; SCHALLIG; PITERS, 2006).
A. annua produz uma série de compostos bioativos incluindo
flavonoides, cumarinas, esteroides, fenóis, purinas, lipídios, compostos alifáticos, além de terpenos (monoterpenos, triterpenos e sesquiterpenos) (BRISIBE et al., 2009). Contudo, o composto mais importante produzido pela espécie é a artemisinina (Figura 1), uma lactona sesquiterpênica eficaz contra cepas resistentes de Plasmodium falciparum causador da malária
cerebral (FERREIRA; JANICK, 1996; MARCHESE et al., 2005).
17
2.2. Secagem de plantas medicinais
Segundo Hertwig, (1986), citado por Martins (2000), a alta sensibilidade do principio biologicamente ativo e sua preservação no produto final constituem os maiores desafios no processo de secagem e armazenamento de plantas medicinais e aromáticas.
A secagem é o processo de retirada de água por evaporação. O equilíbrio entre a temperatura, a circulação e a umidade relativa do ar define o processo de secagem. O sucesso da secagem depende da técnica utilizada para aumentar a capacidade higroscópica do ar, isto é, a capacidade de absorver a umidade. Se a temperatura for muito baixa, ou a umidade muito alta, o produto secará lentamente, permitindo a proliferação de microrganismos. Por outro lado, se a temperatura for muito alta formará no produto algo assemelhado a uma casca externa que impedirá a saída da umidade causando, deste modo, a deterioração do produto.
A secagem interrompe a degradação metabólica, e impede o desenvolvimento de microrganismos. A temperatura do ar de secagem pode variar entre 35 a 70 ºC dependendo da parte da planta e das características da substância de interesse (MARCHESE & FIGUEIRA, 2005). Segundo Martins (2000), as plantas contendo substâncias voláteis devem ser secas em temperaturas inferiores a 40ºC, principalmente se a substância de interesse for o óleo essencial e este contiver o princípio ativo. A perda do princípio ativo em muitos casos não pode ser evitada, mas cuidados no processo de secagem minimizam tal perda, sabendo-se que a presença de água após a colheita também levaria a perdas por degradação e deterioração (MARCHESE & FIGUEIRA, 2005).
O excesso de umidade em matérias-primas vegetais permite a ação de enzimas, podendo acarretar a degradação de constituintes químicos, além de possibilitar o desenvolvimento de fungos e bactérias. Além disso, para realização de estudos fitoquímicos é recomendado que haja uma redução de 90 a 95% da umidade da planta. Portanto, assim como na determinação do teor de cinzas totais, a quantificação do teor de umidade serve como parâmetro para estabelecer a qualidade das matérias-primas vegetais (SIMÕES et. al., 2000).
maneira é pesar uma amostra da planta no início da secagem e nos dias consecutivos, ir monitorando a massa até apresentar peso constante, quando estará apto para ser embalada.
Nascimento el al., (2005) avaliaram a qualidade de 32 amostras de plantas medicinais (oito amostras de erva-doce, dez de quebra-pedra, seis de espinheira santa e oito de camomila) comercializados na cidade do Recife, em farmácias. As análises realizadas foram de rótulos e bulas, controle botânico, teste fitoquímicos, teores de matérias estranha e umidade. Os resultados obtidos mostram qualidade insatisfatória devido ao grande índice de reprovação. Das 32 amostras analisadas, 96,87% foram reprovadas por apresentarem rótulos e bulas contendo informações imprecisas; 12,50% não apresentaram bons resultados em análises botânicas; 34,37% foram inadequadas nos testes fitoquímicos; 65,63% obtiveram matéria estranha e cerca de 50% demonstraram ter o teor de umidade fora da especificação.
O teor de umidade ideal após a secagem deve ser 5 a 10% em folhas e flores nas cascas e raízes esta umidade deve estar entre 12 a 20%, em base úmida (MARTINS et al., 1994). O local de armazenamento deve ser limpo e sanitizado previamente cada vez que nova planta entra no galpão.
O tipo de acondicionamento vai depender do volume que se deseja armazenar. Pequenas quantidades podem ser armazenadas em vidro ou sacos de polietileno, que permitem boa conservação. A armazenagem incorreta pode levar à perda de material, seja por motivos de ordem física, seja por ação biológica (MARTINAZO, 2006).
2.3. Armazenamento a vácuo
A perda de princípios ativos que ocorrem após a colheita deve-se a várias razões, dentre elas, a degradação por processos metabólicos, hidrólise, degradação pela luz, enzimática, oxidação, fermentação, calor e contaminação microbiológica (SILVA et al., 1999).
19
2.4. Armazenamento refrigerado
Segundo Silva (2000), temperaturas baixas são utilizadas a fim de retardar as ações enzimáticas e químicas e também retardar ou mesmo inibir o crescimento e atividade microbiana nos alimentos. A conservação pelo frio pode ser realizada através do resfriamento seguido de armazenamento refrigerado e por congelamento, o qual deve ser armazenado congelado.
O armazenamento sob-refrigeração tem sido usualmente recomendado para países em desenvolvimento, visando à redução de deterioração dos produtos perecíveis, principalmente em climas tropicais e subtropicais. A temperatura de armazenamento é, portanto, o fator ambiental mais importante, não só do ponto de vista comercial, como também, por controlar a senescência, uma vez que regula a taxa de todos os processos fisiológicos e bioquímicos associados (CHITARRA, 2005).
As medidas pós-colheita exercem papel fundamental no atendimento dos anseios dos consumidores. Tão importante quanto o papel da produção, são as atividades de classificação, tipos de embalagens e o uso da tecnologia do frio desde o campo até o consumidor, na organização dos produtores (CORTEZ et al., 2002).
Também em formulação farmacêuticas vários fatores, tais como
temperatura, umidade, radiação, luz, ar (especificamente oxigênio, dióxido de carbono e vapor
3.
MATERIAL E MÉTODOS
3.1. Material vegetal
A espécie de A. annua em estudo foi cultivada no campo experimental do Centro Pluridisciplinar de Pesquisas Químicas, Biológicas e Agrícolas (CPQBA) da Universidade Estadual de Campinas (Unicamp), localizada em Paulínia, SP (Figura 2).
Figura 2. Campo experimental do cultivo de Artemisia annua
21
3.2. Secagem do material vegetal
As folhas recém-colhidas passaram por processo de limpeza retirando impurezas e galhos, sendo submetida à secagem em estufa com circulação de ar a temperatura de ± 40º C, até que a massa de matéria seca se mantivesse constante. Após a secagem, o material vegetal foi submetido a armazenamento em sacos de polietileno envoltos de papel Kraft, visando reproduzir a mesma embalagem utilizada pela maioria dos produtores de plantas medicinais e aromáticas.
3.3. Condições de armazenamento
Primeiramente, para cada tratamento, foram pesadas cerca de 40g de folhas secas moídas e acondicionadas nas embalagens de polietileno com quatro repetições. As embalagens foram seladas em Seladora com sistema de vácuo e, posteriormente envolvidas em papel Kraft. As folhas secas embaladas foram submetidas aos quatro tipos de armazenamento:
¾ Condições de vácuo (0,1 atm) em temperatura ambiente de 25º ± 3
¾ Condições sem vácuo em temperatura ambiente de 25º ± 3;
¾ Condições de vácuo (0,1 atm) em temperatura refrigerada de 4º ±2
¾ Condições sem vácuo em temperatura refrigerada de 4º ±2;
Figura 3. Amostras armazenadas em prateleiras de armário.
Figura 4. Amostras armazenadas em geladeira.
Para cada tratamento, o material foi avaliado quanto à atividade microbiológica e quantificação do principio ativo. Estas avaliações foram realizadas no tempo inicial (após a secagem das folhas) e aos 30, 90, 120 e 180 dias de armazenamento.
23
O congelamento comum se baseia na conservação de agentes em temperaturas relativamente baixas entre -4ºC e -20°C. Apresenta-se como um dos métodos de manutenção mais simples e baratos, além de oferecer boa segurança para o armazenamento de diversos microrganismos por períodos de 3 meses a 2 anos, devido a uma redução significativa no metabolismo celular (SOLA et al, 2012).
SILVA et al. (2008) buscando avaliar a viabilidade dos microrganismos presentes em uma coleção de cultura, semearam um total de 328 leveduras dos gêneros Candida,
Cryptococcuss, Trichosporon, Rodothorulla em caldo cérebrocoração contendo glicerol,
mantendo-as sob refrigeração por sete dias e posterior congelamento a -20°C, sob três diferentes períodos de tempo. Após três anos de congelamento, observaram recuperação de 99,0% das leveduras (72 viáveis/73 microrganismos congelados). No segundo período (três anos e seis meses) observaram a viabilidade de 100% das cepas congeladas (96 leveduras congeladas e viáveis após o descongelamento). No último grupo, após o congelamento de 159 leveduras por quatro anos, notaram uma redução da viabilidade das culturas com 90,6% de recuperação (144 leveduras). Diante dos resultados, observaram que o emprego de baixas temperaturas foi vantajoso por seu baixo custo, fácil execução, além de ter favorecido a conservação de quase totalidade das leveduras por 48 meses (SOLA et al, 2012).
3.4. Teor de umidade
O teor de umidade de um produto é a proporção entre a quantidade de água (em massa) existente no material e a massa seca (que não contém água, ou seja, sólidos totais como proteínas, cinzas, etc.). A determinação do teor de umidade é a quantidade de água que pode ser removida do material sem alteração da estrutura molecular do sólido.
3.5. Ensaios microbiológicos
Após os tempos de 30, 90 e 180 dias (incluindo o tempo zero), coletou-se 10 g do material vegetal que foi congelado, para posterior análise microbiológica. As análises microbiológicas foram feitas na Fundação André Toselle, utilizando metodologias propostas pela Farmacopeia Brasileira 5º - Edição – 2010. Os parâmetros microbiológicos
avaliados foram: Contagem Padrão de Bactérias Heterotróficas, Contagem total de Fungos (Bolores e Leveduras), Microrganismos viáveis Totais (Fungos e Bactérias), Coliformes Totais e Coliformes Termotolerantes/ Escherichia coli.
3.6. Quantificação da artemisinina por cromatografia em camada delgada
A avaliação cromatográfica foi realizada no Departamento de Fitoquímica do CPQBA/ UNICAMP, em Paulínia - SP. Realizou-se uma quantificação semi-analítica comparativa do teor de artemisinina utilizando a técnica de Cromatografia em Camada Delgada com detecção por Densitometria.
Para cada amostra, foram retirados, em triplicatas, 1g de folhas finamente moídas, extraídas em 5 mL de diclorometano. Posteriormente, o extrato foi levado a uma mesa agitadora por uma hora e meia, sendo subsequentemente filtrado. Esse procedimento foi repetido por 3 vezes, tendo o volume líquido total obtido avolumado em balão de 10 mL.
Com auxílio de microseringa, 10 μL de cada extrato foi aplicado sobre
placa de sílica-gel. Cada placa recebeu seis diferentes concentrações do padrão artemisinina (2,0; 4,0; 6,0; 8,0; 10,0 e 12,0 μg) ao centro, mais 6 aplicações laterais, em triplicatas, das
25
Figura 5. Corrida da placa de CCD em eluente dentro da cuba de vidro.
4. RESULTADOS E DISCUSSÃO
4.1. Análises microbiológicas
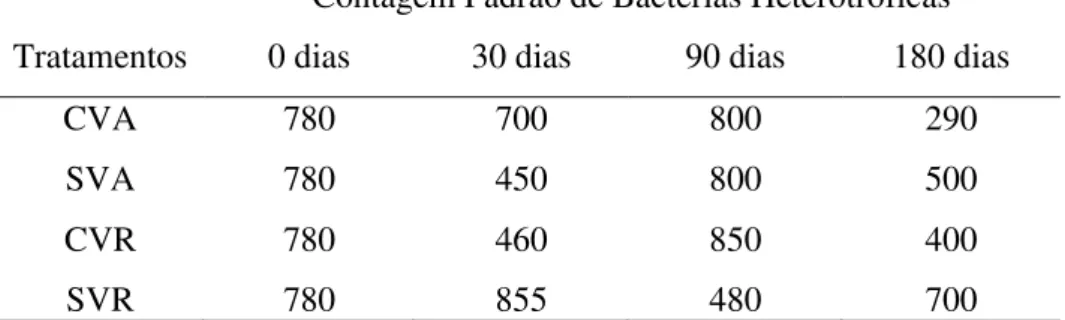
Os resultados obtidos (Tabela 1) nos ensaios microbiológicos feitos na Fundação André Tosello, indicam que não há contaminação significante em relação aos parâmetros estabelecidos pela Farmacopeia Brasileira 5º Edição – 2010.
Tabela 1. Avaliação microbiológica de bactérias heterotróficas dos tratamentos em relação aos dias de armazenamento.
Contagem Padrão de Bactérias Heterotróficas Tratamentos 0 dias 30 dias 90 dias 180 dias
CVA 780 700 800 290 SVA 780 450 800 500 CVR 780 460 850 400 SVR 780 855 480 700
*Valores expressos em Unidades Formadores de Colônias (U.F.C./g); CVA=com vácuo/ ambiente; SVA=sem vácuo/ ambiente; CVR=com vácuo/refrigerado; SVR=sem vácuo refrigerado.
27
especificação a qual estabelece como ideal <5700 U.F.C./g. As demais análises comprovaram ausência de coliformes totais, coliformes termotolerantes e Escherichia coli (Anexo 6.3).
Fidelis et al., (2005) avaliaram o armazenamento de Sphagneticola trilobata em embalagens de vidro, polipropileno e papel metalizado por período de 12 meses,
sob condição ambiente (20-25ºC) e refrigerado (5ºC). Foram avaliados o crescimento microbiológico e a concentração de tanino durante o tempo de armazenamento. A quantificação de fungos filamentosos e leveduras apresentaram variações, constatando-se tendência de diminuição do número desses microrganismos no produto armazenado em condição ambiente, em embalagens de papel e vidro. Em condições refrigeradas, independente da embalagem ou período de armazenamento, apresentou valores maiores do que a condição ambiente.
Para a quantificação de coliformes totais, os resultados encontrados por Fidelis et al., (2005) foram semelhantes aos anteriores, apresentando tendência de decréscimo para as condições ambientes e acondicionadas em embalagens de polipropileno ou papel metalizado. O número desse microrganismo aumentou no produto refrigerado em todas as embalagens utilizadas após o período de incubação. Nos resultados para bactérias aeróbicas mesófilas, não houve variação para o produto em condição ambiente, independente da embalagem, com 105 U.F.C./g. Já sob-refrigeração, houve aumento para embalagens de vidro e papel metalizado, sendo encontrado o valor máximo de 106 U.F.C./g.
Também houve presença de Staphylococcus spp. em todas as
condições de armazenamento, independente do tipo de embalagem. Em média, o aumento destes microrganismos foi de dez vezes no armazenamento em condições ambientes e de cem vezes sob-refrigeração. Para o microrganismo Staphylococcus aureus, pode-se estimar que o
número encontrado nas amostras, independente da condição e do período de armazenamento, estava abaixo de 102 U.F.C./g (FIDELIS et al., 2005).
4.2. Teor de umidade
Tabela 2. Valores médios do teor de umidade das amostras ao final do processo de armazenamento
Tratamentos 30 dias 90 dias 120 dias 180 dias
CVA 8,8966 a 10,7572 a 10,6783 a 10,0688 ab SVA 8,4666 a 9,2195 ab 10,6681 a 10,8876 a CVR 8,1014 a 9,3656 ab 8,995 a 9,4152 ab SVR 8,8281 a 7,8457 b 8,8217 a 7,7725 b CV% 4.26 8.18 9.22 12.41
As médias diferem estatisticamente entre si pelo teste de Tukey de 5% de probabilidade. CVA= com vácuo/ ambiente; SVA= sem vácuo/ ambiente; CVR= com vácuo/refrigerado; SVR =sem vácuo refrigerado.
Pela análise estatística (Tabela 2), percebe-se que aos 30 dias e 120 dias não houve diferença significativa entre os tratamentos quanto aos teores de umidade. Somente houve uma diferença expressiva nos tempos de 90 dias e 180 dias, correspondentes ao tratamento de SVR que, ao contrário dos outros tratamentos, perdeu umidade.
Entre todos os tratamentos avaliados, os refrigerados adquiriram menos umidade devido ao fato que geladeira possui uma pressão de água menor, sendo assim, um produto armazenado em um ambiente com baixa atividade de água sofre uma redução de umidade na tentativa de entrar em equilíbrio com o ambiente externo.
Guedes et al., (2012) propuseram armazenar sementes de
Myracrodruon urundeuva em intervalos pré-determinados (0, 30, 60, 90, 120, 150, 180, 210 e
29
demais sementes apresentaram uma variação de 10-11% em alumínio e 10-13% em papel e pano. Em câmara fria, a embalagem plástica e a de alumínio mantiveram os índices de 10-12% de umidade e para a embalagem de pano e papel apresentaram uma faixa de 11-20%. As amostras acondicionadas em freezer apresentaram teores de 10-16% em alumínio, 12-14% para plástico e 11-16% para o pano e papel.
Fidelis et al., (2005) avaliaram o armazenamento de Sphagneticola trilobata em embalagens de vidro, polipropileno e papel metalizado por período de 12 meses,
sob condição ambiente (20-25ºC) e refrigerado (5ºC). O teor de umidade sob-refrigeração e acondicionadas em papel metalizado tiveram as menores variações de umidade, com variação de 8,8-10,5%. As amostras armazenadas sob-refrigeração em polipropileno apresentaram variação de 10,1-12,2%. Em condição ambiente, independente da embalagem, sempre esteve, em média, acima de 10%, sendo os maiores valores 14,2 e 14,4 nas embalagens de vidro e papel metalizado, respectivamente.
4.3. Teor de artemisinina.
4.3.1. Teor de artemisinina dos tratamentos
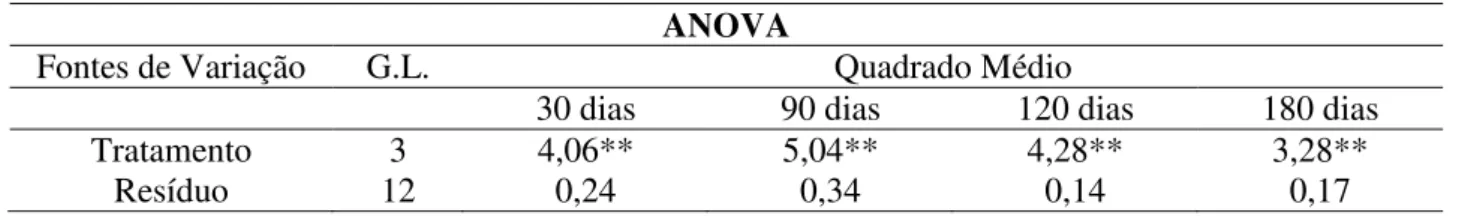
Para estudar o efeito dos tratamentos e do tempo de armazenamento, foram realizadas análises de variância (Tabela 3).
Tabela 3. Efeito dos tratamentos e do tempo de armazenamento.
** Probabilidade menor que 1%
O efeito do tempo de armazenamento dentro de cada tratamento foi estudado utilizando análise de regressão e, para fazer as comparações entre os tratamentos, foi aplicado o teste de Tukey ao nível de significância de 5 % de probabilidade. Os dados foram analisados no programa SAEG (Sistemas de Análises Estatísticas e Genéticas). Houve uma
ANOVA
Fontes de Variação G.L. Quadrado Médio
30 dias 90 dias 120 dias 180 dias Tratamento 3 4,06** 5,04** 4,28** 3,28**
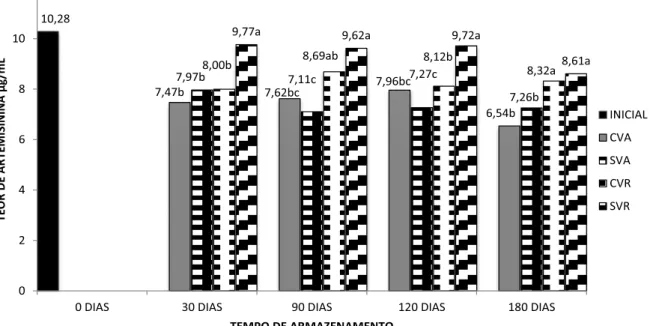
variação significativa no teor de artemisinina tanto entre os tratamentos quanto ao decorrer do período de armazenamento (Figura 6).
10,28
7,47b 7,62bc
7,96bc
6,54b
7,97b 7,11c 7,27c
7,26b
8,00b 8,69ab 8,12b
8,32a
9,77a 9,62a 9,72a
8,61a 0 2 4 6 8 10 12
0 DIAS 30 DIAS 90 DIAS 120 DIAS 180 DIAS
TE
OR DE
ARTE
MISININA
µg/mL
TEMPO DE ARMAZENAMENTO
INICIAL CVA SVA CVR SVR
Médias seguidas da mesma letra, na coluna, não diferem entre si pelo teste de Tukey (5%); Tratamentos, com vácuo ambiente; CVA, sem vácuo ambiente; SVA, com vácuo refrigerado; CVR, sem vácuo refrigerado; SVR.
Figura 6. Teor de artemisinina em amostras de A.annua em função dos tratamentos de
armazenamento durante o tempo.
Devido à variação do teor de água nas amostras armazenadas, os resultados do teor de artemisinina foram corrigidos conforme os seus valores correspondentes na Tabela 2.
Durante os 30 primeiros dias houve uma diferença expressiva entre os tratamentos de SVR em relação aos demais. Essa característica se manteve contínua durante quase todo o tempo de armazenamento. No período de 180 dias os tratamentos de SVR e CVR se assemelham, não havendo diferença significativa entre os mesmos.
31
Cutllan e outros (2000) verificaram teores de 0 a 1,68% de partenolídeo (lactona sesquitepênicas) em produtos comerciais constituídos de folhas de Artemísia. Além da variação no teor de partenolídeo em função da variedade, uma das possíveis causas de variação é a condição de armazenamento, uma vez que o teor de partenolídeo se reduz com o tempo de armazenamento devido à degradação (HEPTINSTALL et al., 1992). Jin e outros (2007) verificaram que a temperatura e a umidade relativa exercem importante papel na taxa de degradação. Com seis meses de armazenamento a 5°C e umidade relativa de 31% o teor de partenolídeo se mantém, no entanto se houver aumento na umidade relativa de 0 a 75% a taxa de degradação aumenta em até 32%.
Fidelis et al., (2005) avaliaram o armazenamento de Sphagneticola trilobata em embalagens de vidro, polipropileno e papel metalizado por período de 12 meses,
sob condição ambiente (20-25ºC) e refrigerado (5ºC). Foram avaliados o crescimento microbiológico e a concentração de tanino durante o tempo de armazenamento. Os resultados avaliados mostraram que, em condição refrigerada, houve uma maior preservação de tanino do que em condição ambiente. Sob-refrigeração, a concentração de tanino nas embalagens e no período de armazenamento ficou entre 1,10 e 1,64%, com média acima de 1%. A embalagem de papel metalizado preservou melhor a concentração de tanino durante todo o tempo de armazenamento, sendo de 1,34% (3 meses), 1,13% (6 meses), 1,35% (9 meses) e 1,64% (12 meses). A maior preservação da concentração de tanino.
4.3.2. Quantificação do teor da artemisinina em relação ao tempo de armazenamento.
A
B
C
D
(A) Com vácuo ambiente, (B) Sem vácuo ambiente, (C) Com vácuo refrigerado, (D) Sem vácuo refrigerado.
Figura 7. Variação do teor de artemisinina durante o tempo de armazenamento.
O gráfico (A) mostra que houve um declínio no teor no primeiros 30 dias de armazenamento, mantendo-se estável até os 90 dias, após este período a teor de artemisinina tem um pequeno aumento. O tratamento sem vácuo ambiente (B) foi o que melhor manteve uma tendência. Houve um declínio consideravel no teor de artemisinina durante os primeiros 30 dias, mantendo-se assim até o final dos 180 dias.
33
5. CONCLUSÃO
O tratamento mais eficiente para a conservação da droga vegetal foi o sem vácuo refrigerado (SVR). Este tratamento proporcionou a melhor manutenção do teor de artemisinina durante o período de armazenamento, comparado aos demais tratamentos. Houve diferença significativa entre os tratamentos, sendo que aqueles mantidos sob-refrigeração foram os que melhor preservaram o principio ativo de A. annua. O fato das amostras terem
6. ANEXOS
6.1. Análise Microbiológicas
Tempo 0: Início do Armazenamento
Parâmetros Analíticas Unidades Análise da Amostra
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 780 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Tempo 1: Amostras com 30 dias de armazenamento
Parâmetros Analíticas Unidades SVA
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 450 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Parâmetros Analíticas Unidades CVA
35
Parâmetros Analíticas Unidades CVR
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 460 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Parâmetros Analíticas Unidades SVR
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 855 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Tempo 3: Amostras com 90 dias de armazenamento
Parâmetros Analíticas Unidades SVA
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 800 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Parâmetros Analíticas Unidades CVA
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 800 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Parâmetros Analíticas Unidades SVR
Parâmetros Analíticas Unidades CVR
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 850 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Tempo 6: Amostras com 120 dias de armazenamento
Parâmetros Analíticas Unidades SVR
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 700 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Parâmetros Unidades
Analíticas CVR
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 400 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Parâmetros Analíticas Unidades SVA
Contagem Padrão de Bactérias Heterotróficas U.F.C./g 500 Contagem Total de Fungos (Bolores e Leveduras) U.F.C./g >5700 Microrganismos viáveis Totais (Fungos e Bactérias) U.F.C./g >5700 Coliformes Totais P-A/g Ausência Coliformes Termotolerantes/ Escherichia coli P-A/g Ausência
Parâmetros Analíticas Unidades CVA
37
6.2. Placas de CCD
Ponto 1 (Abril): 30 dias de armazenamento
Com Vácuo Refrigerado
Sem Vácuo Refrigerado
39
Ponto 3 (Junho): 90 dias de armazenamento
Com Vácuo Refrigerado
Sem Vácuo Refrigerado – Ponto 3 (Junho)
41
Ponto 4 (Julho): 120 dias de armazenamento
Com Vácuo Refrigerado
Sem Vácuo Refrigerado
43
Ponto 6 (Setembro): 180 dias de armazenamento Com Vácuo Refrigerado
Sem Vácuo Refrigerado
45
7.
REFERÊNCIAS
BERG, Maria Elisabeth Van Den. Plantas medicinais na Amazônia: contribuição ao seu conhecimento sistemático. 2º Ed. Belém: Supercores, 1993. 207 p.
BRASIL 2001. Agência Nacional de Vigilância Sanitária. Resolução RDC n° 10, de 2 de janeiro de 2001. Diário Oficial da República Federativa do Brasil, Poder Executivo, Brasília.
BRISIBE, Ebiamadon A. Et Al.; AL., Et. Nutritional characterisation and antioxidant capacity of different tissues of Artemisia annua L. Food Chemistry, Calabar, n. , p.1240-1246, 2009.
BRODY, Aaron L.. Controlled Modified Atmosphere Vacuum Packaging of Foods.
Trumbull: Food & Nutrition Press, 1989. 179 p.
CABRAL, A.C.D.; ORTIZ, S.A.; MADI, L.F.C.; SOLER, R.M.; Gazeta, E.F. Embalagem das frutas tropicais e seus produtos. In: Aspectos tecnológicos das frutas tropicais e seus produtos. Campinas: ITAL, 1980, cap. 4, p. 199-296. (Série Frutas Tropicais).
CARVALHO, Ana C. B. et al. Situação do Registro de Medicamentos Fitoterápicos no Brasil. Sp: Revista Brasileira de Farmacognosia, Abr./Jun. p.314-319, 2008.
CHITARRA, Maria Isabel Fernandes; CHITARRA, Adimilson Bosco. Pós-colheita de frutas e hortaliças. 2. ed. Lavras (mg): Ufla, 2005. 783 p.
CORTEZ, L. A. B.; HONÓRIO, S. L.; NEVES FILHO, L. C.; MORETTI, C. L. Importância do resfriamento para frutas e hortaliças no Brasil. In: Cortez, L. A. B. et al. (ed.) Resfriamento de frutas e hortaliças. Embrapa Hortaliças. pg. 18-35, 2002.
CUTTLAN, H. R.; BONILLA, L. E.; SIMON, J. E. et al. E. Intra- specific variability of feverfew: correlations between parthenolide, morphological traits and seed origin. Planta Medica, Stuttgart-Alemanha Ocidental, v. 66, p. 612-617, 2000.
GUEDES, R. S. et al. Armazenamento de sementes de Myracrodruon urundeuva Fr. All. em diferentes embalagens e ambientes. Revista Brasileira de Plantas Medicinais, Botucatu, v. 14, n. 1, p.68-75, 2012.
FERREIRA, S .. Medicamentos A Partir de plantas medicinais. Rio de Janeiro: Academia Brasileira de Ciências, 1998.
FIDELIS, Iraci et al. Influência das embalagens e do armazenamento no crescimento microbiológico e na concentração de tanino em Sphagneticola trilobata (L.) PRUSKI. Ceres,
São Paulo, v. 52, n. 303, p.647-657, 2005.
FIGUEIRA, Glyn Mara. Mineral nutrition, production, and artemisinin content in Artemisia annua L. Acta Horticulturae, USA, v. 426, n. , p.573-577, 1996.
47
FLEURY, Sonia. A questão Democrática na Saúde: Saúde e democracia. In: JANICK, J..
Progress in new crops. Arlington: Ashs Press, 1996. p. 579-584.
GORRIS, L.G.M.; PEPPELENBOS, H.W. Modified atmosphere and vacuum packaging to extend the shelf life of respiring food products. HortTechnology, v.2, n.3, p.303-309, 1992. HEEMSKERK, Willem; SCHALLIG, Henk; PITERS, Bart de S. The world of Artemisia in 44 questions. 2006. 81p.
HEPTINSTALL, S.; AWANG, D. V.; DOWSON, B. A. et al. Parthenolide content and bioactivity of feverfew (Tanacetum parthenium (L.) Schultz-Bip). Estimation of commercial and authenticated feverfew products. Journal of Pharmacy and Pharmacology, Belfast, v.44, p. 391-395, 1992.
HINTLIAN, C. B.; HOTCHKISS, J. H.. The safety of modified atmosphere packaging: a review. Food Technology, Chicago, v. 40, n. , p.70-76, 1986.
JANICK, J. Distribution of artemisinin in Artemisia annua. In: J. JANICK. (ed.) Arlington:
Progress in new crops, p. 579-584,1996.
JIN; P.; MADIEH, S.; AUGSBURGER, L. L. The solution and solid state stability and excipient compatibily of parthenolide in feverfew. AAPS PharmSciTech, Virginia, v.8, p.E105, 2007.
LACERDA, M. A Malária no Brasil. Medicines for Malaria Venture. Abril, 2013.
LUTHRIA, D. L. Drying affects artemisinin, dihydroartemisinic acid, artemisinic acid, and the antioxidant capacity of Artemisia annua L. leaves. Journal Agriculture and Food
MAGALHÃES, P.M.; DELABAYS, N.; SARTORATTO, A.. New hybrid lines of antimalarial species Artemisia annua L. guarantee its growth in Brazil. Ciência e Cultura, Urca, v. 09, n. , p.413-415, 1997.
MARCHESE, J.A., FIGUEIRA, G.M. O uso de tecnologia pré e pós-colheita e boas práticas agrícolas na produção de plantas medicinais e aromáticas. Revista Brasileira de Plantas Medicinais, Botucatu,v.7, n.3, p.86-96, 2005.
MARTINAZZO, A P. Secagem, armazenamento e qualidade de folhas de Cymbopogon citratus (D.C.). 2006. 156 f. Tese (Doutorado) - Universidade Federal de Viçosa, Viçosa, MG, 2006.
MARTINS, P. M.. Influência da temperatura e velocidade do ar de secagem no teor e na composição química do óleo essencial de capim limão (Cymbopogon citratus (D.C.) STAPF.). 2000. 77 f. Dissertação (Mestrado) - Universidade Federal de Viçosa, Viçosa, 2000.
MARTINS, E.R, CASTRO, D.M, CASTELLANI, D. C., DIAS, J. E. Plantas Medicinais. Viçosa: UFV, 1994. 220p.
NASCIMENTO, V. T. et al. Controle de qualidade de produtos à base de plantas medicinais comercializados na cidade do Recife-PE: erva-doce (Pimpinella anisum L.), quebra-pedra (Phyllanthus spp.), espinheira santa (Maytenus ilicifolia Mart.) e camomila (Matricaria recutita L.). Revista Brasileira de Plantas Medicinais, Botucatu, v.7, n.3, p.56-64, 2005.
REDDY, D. Malária no Brasil: Sociedade Brasileira de Medicina Tropical. Medicines for Malaria Venture. Abril, 2013.
49
RODRIGUES, A.F.R. et al. Otimização do processo de extração e isolamento do antimalárico artemisinina a partir de Artemisia annua L. Revista Brasileira de Plantas Medicinais, São Paulo, v. 29, n. 2, p.89-93, 2006.
SAÚDE, O. M. da. Disponível em: http://www.who.int/en/. Acessado em 18 de abril de 2013.
SIANI, A. C.. Desenvolvimento Tecnológico de Fitoterápicos:Plataforma metodológica. Rio de Janeiro: Scriptorio, 2003. 97 p.
SILVA, F.; CASALI, V.W.D. Plantas medicinais e aromáticas: Pós-colheita e óleos essenciais. Viçosa: Arte e Livros, 2000. 135p.
SILVA, F., CaSALI, V.W.D., LIMA, R. R. A., N.J.(1999). Qualidade pós colheita de Achillea millefolium L., Origanum vulgare L. e Petroselium crispum (miller) A.W.Hill em três embalagens. Revista Brasileira de plantas medicinais, v.2, n.1, p.37-41, 1999.
SILVA, F.. Avaliação do teor e da composição química do óleo essencial de plantas medicinais submetidas a processos de secagem e armazenamento. 2005. 142 f. Dissertação (Doutorado) - Universidade Estadual de Campinas, Campinas, 2005.
SILVA, J. O.; COSTA, P. P. RECHE, S. H. C. Manutenção de leveduras por congelamento a -20°C. Revista Brasileira Análises Clínicas, São Paulo, v. 40, n. 1, p. 73-74, 2008.
SILVA, Paulo de A. et al. Efeito de temperatura, embalagem e tempo de armazenamento na germinação de sementes de erva cidreira verdadeira (Melissa officinalis L.). Horticultura Brasileira, Recife, v. 21, n.43 , p.1-4, 2013.
SOLA, M.C. et al. Manutenção de Microrganismos: Conservação e Viabilidade. Enciclopédia Biosfera, Centro Científico Conhecer - Goiânia, v.8, n.14, 1398-1418 p. 2012.