KARINA ANA DA SILVA
EFEITOS DO EXERCÍCIO FÍSICO SOBRE PROPRIEDADES
ESTRUTURAIS E MECÂNICAS DO FÊMUR DE RATOS COM DIABETES MELLITUS EXPERIMENTAL
Dissertação apresentada à
Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Educação Física, para obtenção do título de Magister Scientiae.
VIÇOSA
ii A Deus, por mais essa benção.
Aos meus pais, pelo exemplo de perseverança.
Ao meu irmão, pelo apoio constante
.
De tudo ficaram três coisas...
A certeza de que estamos começando...
A certeza de que é preciso continuar...
A certeza de que podemos ser interrompidos
antes de terminar...
Façamos da interrupção um caminho novo...
Da queda, um passo de dança...
Do medo, uma escada...
Do sonho, uma ponte...
Da procura, um encontro!
iii AGRADECIMENTOS
À Deus, pela oportunidade concedida, pelo alento e pela força quando os desafios pareciam intransponíveis.
Aos meus pais, Adão e Aparecida, pelo amor incondicional, por não me deixarem abater e pela confiança de que tudo daria certo.
Ao meu irmão, Paulinho e à minha cunhada, Ana Paula, pelas palavras de conforto nesta caminhada.
Ao professor e orientador Antônio José Natali, pela confiança, pela oportunidade e pelo exemplo de ética.
Aos meus coorientadores, professores Ricardo Junqueira Del Carlo, Sérgio Luis Pinto da Matta e Carlos Henrique Osório, pela presteza em atender-me quando era necessário, pelos conselhos e por terem aceitado este convite.
Aos grandes e eternos companheiros do G-8, Cynthia, Schin, Rodrigo, Ana Luiza, Erivelton, Thiago e Ariana, que sempre acreditaram no êxito deste sonho.
Aos grandes amigos, Miguel, Judson, Lucas, Bárbara e Juliana, pela paciência com os momentos de extremo estresse e, também, pelas horas de divertimento singular.
À Aurora, nova amiga, pela serenidade com que me acompanhou durante esta trajetória.
Aos amigos do biotério, Filipe Rios, Márcia, Vitor, Felipe Belfort, Matheus, Regiane, Ângela, Arlete, pela parceria e boa vontade em ajudar.
Ao Professor Mário Jefferson Quirino, pela disponibilidade e simpatia em me receber, por abrir as portas para a realização de um sonho e por ser essa figura carismática e singular.
À Bruna Biffe, pelo auxílio indispensável, pela nova amizade e pela adorável acolhida em Araçatuba, SP.
Ao professor Lino, pela atenção dispensada.
A Universidade Federal de Viçosa, pelo conhecimento adquirido.
v ÍNDICE
LISTA DE ABREVIATURAS E SIGLAS ... VII LISTA DE FIGURAS ... IX LISTA DE TABELAS ... X RESUMO ... XI ABSTRACT ... XII
1 INTRODUÇÃO ...1
2 OBJETIVOS ...3
2.1 Objetivo Geral ...3
2.2 Objetivos Específicos ...3
3 REVISÃO BIBLIOGRÁFICA ...4
3.1. Diabetes Mellitus ...4
3.1.1 O modelo experimental de diabetes tipo 1 induzido por estreptozotocina ... 5
3.2. Tecido ósseo ...6
3.2.1 Crescimento, modelação e remodelação óssea ... 9
3.2.2 Biomecânica do osso ... 11
3.3. Diabetes mellitus e tecido ósseo ... 12
3.4. Diabetes mellitus e exercício físico ... 13
3.5. Tecido ósseo e exercício físico ... 15
4 MATERIAL E MÉTODOS ... 18
4.1. Animais de experimentação e tratamentos ... 18
4.2. Indução de Diabetes ... 19
4.4. Avaliação da Densidade Mineral Óssea ... 20
4.5. Avaliação da Resistência Óssea ... 21
4.6. Exame Histomorfométrico ... 23
vi
5 RESULTADOS E DISCUSSÃO ... 26
5.1. Peso corporal e glicemia ... 26
5.2. Propriedades estruturais do fêmur. ... 29
5.2.1. Peso e comprimento do fêmur dos animais dos grupos experimentais. ... 29
5.2.2. Área, conteúdo mineral e densidade mineral do fêmur ... 31
5.3. Propriedades mecânicas do fêmur ... 35
5.3.1. Propriedades mecânicas do colo do fêmur ... 35
5.3.2. Ensaio mecânico da diáfise do fêmur ... 38
5.4. Histomorfometria do fêmur. ... 40
6 CONCLUSÕES ... 46
vii
LISTA DE ABREVIATURAS E SIGLAS
ADA – Associação Americana de Diabetes ad libitum - do latim “à vontade”
ANOVA – análise de variância
BMP – proteínas morfogenéticas ósseas BC –baseline controle
BD –baseline diabético
ºC – temperatura (graus Celsius) CE – controle exercitado
CS – controle sedentário
CMO – conteúdo mineral ósseo
COBEA – Colégio Brasileiro de Experimentação Animal DE – diabético exercitado
DM –diabetes mellitus
DMO – densidade mineral óssea DS – diabético sedentário
FCF – força no colo do fêmur FDF – força na diáfise do fêmur GH – hormônio de crescimento
GLUT- 4 – Transportador de glicose tipo 4
IGF-1 – fator de crescimento semelhante à insulina IRS – substrato do receptor de insulina
MEC – matriz extracelular cartilaginosa OPG – osteoprotegerina
post-hoc –do latim “depois disto” PTH – hormônio da paratireoide
RANK –receptor ativador do fator nuclear kβ
RANK-L ligante do receptor ativador do fator nuclear kβ RCF – rigidez no colo do fêmur
RDF – rigidez na diáfise do fêmur STZ – estreptozotocina
viii UBM – unidade básica do metabolismo
ix
LISTA DE FIGURAS
Figura 1. Fotografia do ensaio mecânico de flexão em três pontos, em diáfise de fêmur. ... 22
Figura 2. Representação sistemática da curva da carga de deformação de um teste de três pontos para osso ... 22
Figura 3. Fotografia do ensaio mecânico de flexão no colo do fêmur de rato ... 23
Figura 4.Desenho esquemático da determinação da espessura de osso cortical. ... 24
Figura 5. Peso e comprimento do fêmur dos animais dos grupos experimentais ... 30
Figura 6. Área, conteúdo mineral ósseo (CMO) e densidade mineral óssea (DMO) do fêmur dos animais dos grupos experimentais ... 33
Figura 7. Rigidez, força máxima de fratura e tenacidade no colo do fêmur dos animais dos grupos experimentais ... 36
Figura 8. Rigidez, força máxima e tenacidade na diáfise do fêmur dos animais dos grupos experimentais ... 39
Figura 9. Fotomicrografias da região do colo do fêmur de animais dos grupos experimentais... 41
Figura 10. Volume trabecular ósseo (VTO) do fêmur dos animais dos grupos experimentais... 42
x
LISTA DE TABELAS
Tabela 1. Progressão de Treinamento dos animais ... 20
Tabela 2. Peso corporal dos animais durante o período experimental. ... 26
xi
RESUMO
SILVA, Karina Ana da, M.Sc., Universidade Federal de Viçosa, maio de 2011. Efeitos do exercício físico sobre propriedades estruturais e mecânicas do fêmur de ratos com Diabetes mellitus experimental. Orientador: Antônio José Natali. Coorientadores: Ricardo Junqueira Del Carlo, Sérgio Luis Pinto da Matta e Carlos Henrique Osório Silva.
xii
ABSTRACT
SILVA, Karina Ana da, M.Sc., Universidade Federal de Viçosa, May, 2011. Effects of exercise on structural and mechanical properties of the femur isolated from rats with experimental Diabetes mellitus. Adviser: Antônio José Natali. Co-advisers: Ricardo Junqueira Del Carlo, Sérgio Luis Pinto da Matta and Carlos Henrique Osório Silva.
1
1 INTRODUÇÃO
O diabetes mellitus (DM) é uma doença metabólica, caracterizada por hiperglicemia, resultante de defeitos na secreção da insulina e ação da insulina, ou ambos (ADA, 2009; 2010).
Há diferentes classes clínicas de diabetes: DM tipo1, DM tipo 2, outros tipos específicos de DM e DM gestacional. Há ainda, duas categorias referidas como pré-diabetes, que são a glicemia de jejum alterada e a tolerância à glicose diminuída. O tipo mais comum de DM é o 1 que é evidenciado pela deficiência absoluta de insulina, resultante da destruição autoimune, ou por causas desconhecidas, das células beta pancreáticas. O DM tipo 2, é distinguido pela incapacidade das células musculares e adiposas metabolizar a glicose presente da corrente sanguínea, apesar da contínua produção de insulina pelo pâncreas. Esta anomalia é chamada de “resistência insulínica” (OLIVEIRA; MILECH, 2004; KAHN et al., 2009; ADA, 2009; 2010).
No final da década de 1980, estimou-se que o diabetes ocorria em cerca de 8% da população, de 30 a 69 anos de idade, residente em áreas metropolitanas brasileiras. Essa prevalência variava de 3% a 17%, entre as faixas de 30-39 e 60-69 anos; assim como a tolerância à glicose diminuída era igualmente de 8%, variando de 6 a 11% entre as mesmas faixas etárias (CADERNO DE ATENÇÃO BÁSICA MINISTÉRIO DA SAÚDE, 2006). Segundo a Sociedade Brasileira de Diabetes (2009), atualmente, não se tem ao certo a estimativa do número de pessoas no Brasil que possui o diabetes diagnosticado, uma vez que o estudo realizado pelo Ministério da Saúde aconteceu na década de 1980 e não foi repetido na população atual.
O DM tipo 1 está associado a muitas complicações, inclusive perda óssea e retardo na cicatrização óssea (MOTYL ; MCCABE, 2009). Nesse caso, é denominada “doença óssea do diabético” ou “osteopatia diabética” (RETZEPI; DONOS, 2010). Pacientes diabéticos exibem densidade mineral óssea reduzida nas vértebras lombares e na região proximal do fêmur (LU et al., 2003). Há evidências de que ocorre diminuição do crescimento, durante o estirão da puberdade, e alterações relacionadas aos processos de formação óssea em diabéticos (INZERILLO; EPSTEIN, 2004).
2 compressão e cisalhamento e a deformação mecânica repetida das contrações musculares resultam em um aumento das correntes elétricas pulsáteis no osso, por causa dos fenômenos piezoelétrico e de fluxo, que também são capazes de provocar alterações na estrutura óssea (TUREK, 1991). Essas forças mecânicas impostas pelo exercício exercem influência anabólica sobre os ossos (SOUZA et al., 2005).
Em indivíduos diabéticos, além dessas ações mecânicas, o exercício físico regular pode aumentar a sensibilidade à insulina, em indivíduos com DM tipo 2 (DE FEO et al., 2006; KAHN et al., 2009). A diminuição da glicemia e o aumento dos níveis de GH e IGF-1, em indivíduos treinados, podem promover o desenvolvimento ósseo (SOUZA et al., 2005).
Acredita-se que a prática regular de exercício físico pode contrapor os efeitos deletérios do DM sobre o sistema ósseo. Este estudo teve como objetivo avaliar os efeitos de um programa de exercício físico sobre propriedades estruturais e mecânicas do fêmur de ratos com DM experimental.
Neste trabalho, portanto, foram formuladas as seguintes hipóteses: H 0 - O exercício físico não altera as propriedades estruturais e mecânicas do fêmur de ratos com diabetes mellitus experimental.
3
2 OBJETIVOS
2.1 Objetivo Geral
Investigar os efeitos de um programa de natação sobre propriedades estruturais e mecânicas do fêmur de ratos com diabetes mellitus experimental.
2.2 Objetivos Específicos
Verificar como um programa de natação afeta os animais com diabetes mellitus experimental, em relação as seguintes variáveis:
Densidade mineral óssea e conteúdo mineral ósseo do fêmur.
Resistência à fratura do colo e da diáfise do fêmur.
4
3 REVISÃO BIBLIOGRÁFICA
3.1. Diabetes Mellitus
O diabetes mellitus (DM) é uma doença metabólica, caracterizada por hiperglicemia, resultante de defeitos na secreção da insulina e da ação da insulina, ou ambos (ADA, 2009; 2010).
A hiperglicemia crônica do diabetes está associada aos danos no longo prazo, às disfunções e à falência de vários órgãos, especialmente olhos, rins, nervos, coração e vasos sanguíneos (SBD, 2007; ADA, 2009; 2010). Os sintomas da hiperglicemia incluem poliúria, polidipsia, perda de peso e, algumas vezes, polifagia e visão turva. Em longo prazo, o DM causa retinopatia acompanhada de perda da visão, nefropatia e falência renal e neuropatia, resultando em ulcerações nos pés, amputações e articulações de Charcot (doença neuropática articular)(ADA, 2009; 2010).
A classificação proposta pela Organização Mundial da Saúde (OMS) e pela Associação Americana de Diabetes (ADA) inclui algumas classes clínicas: DM tipo1, DM tipo 2, outros tipos específicos de DM, e DM gestacional, havendo, ainda, duas categorias referidas como pré-diabetes, que são a glicemia de jejum alterada e a tolerância à glicose diminuída. Essas categorias não são entidades clínicas, mas fatores de risco para o desenvolvimento do DM e de doenças cardiovasculares (SBD, 2007).
5 O diabetes mellitus tipo 2 (90% a 95% do total de casos de diabetes) é caracterizado pela incapacidade de absorção das células musculares e adiposas. Por muitas razões, as células não conseguem metabolizar a glicose presente na corrente sanguínea, apesar da contínua produção de insulina pelo pâncreas. Essa anomalia é chamada de “resistência insulínica”. Os pacientes com DM tipo 2 podem responder ao tratamento com dieta e exercício físico, medicamentos orais e, por fim, da combinação desses com a insulina (SBD, 2009). A cetoacidose ocorre raramente nesse tipo de diabetes, mas pode acontecer em associação com o estresse de outras doenças como as infecções (ADA, 2010). A hiperglicemia no DM tipo 2 geralmente se desenvolve de forma gradual, não sendo suficiente nos estágios iniciais para promover o aparecimento dos sintomas clássicos. A causa desse desenvolvimento gradual é a evolução da doença que se inicia com leve resistência à ação da insulina, podendo culminar com a deficiência na produção dessa (OLIVEIRA; MILECH, 2004; ADA, 2009; 2010).
A ação diabetogênica da estreptozotocina (STZ), substância isolada do Streptomyces achromogenes, foi descrita inicialmente por Rakieten et al. (1963) e depois por Evans et al.(1965). A injeção intravenosa de soluções de STZ induziu diabetes em ratos e cães e, a partir desses achados, o diabetes passou a ser induzido com sucesso em diferentes modelos experimentais. Os mecanismos da ação diabetogênica da STZ estão relacionados à citotoxidade e glicosilação de proteínas das ilhotas pancreáticas, uma vez que STZ inibe seletivamente a enzima O-GLcNAcase, responsável pela remoção de N-acetilglucosamina da proteína. Tal ação causa apoptose das células beta pancreáticas (KONRAD et al., 2001); e promove lesão nas células beta pancreáticas, por reduzir os níveis de NAD (nicotinamida adenina dinucleotídeo) disponível nessas células (AKBARZADEH et. al., 2007).
6 aumento nos níveis dos marcadores da adipogênese (MOTYL; MCCABE, 2009).
3.2. Tecido ósseo
O tecido ósseo é um tecido conjuntivo rígido, flexível, em que a matriz extracelular foi impregnada com sais de cálcio e fosfato amorfos, por um processo chamado de mineralização. Esse tecido é altamente vascularizado e metabolicamente muito ativo (KIERSZENBAUM, 2008). Suas principais funções são sustentação e proteção para o corpo e órgãos e reservatório para íons cálcio e fosfato.
Sob o aspecto morfológico, esse tecido ainda pode ser dividido, em cortical e trabecular. O cortical é um tecido ósseo compacto, predominante na haste central, ou diáfise dos ossos longos (como o fêmur), que delimita um cilindro oco, com um espaço central chamado de cavidade ou canal medular. O osso trabecular ou esponjoso é um tecido ósseo formado por trabéculas e encontrado na extremidade dos ossos longos, que é chamada de epífise que delimitam o espaço ocupado pela medula óssea e recoberta por uma fina camada de tecido ósseo compacto (AIRES, 2008; KIERSZENBAUM, 2008).
A superfície externa dos ossos é revestida pelo periósteo, que é formado de tecido conjuntivo, contendo na camada mais superficial principalmente fibras colágenas e fibroblastos. A porção mais interna desses ossos é mais celular e apresenta células osteoprogenitoras, que se multiplicam por mitose e se diferenciam em osteoblastos, desempenhando papel importante no crescimento dos ossos e na reparação de fraturas (JUNQUEIRA; CARNEIRO, 2008). A camada externa é rica em vasos sanguíneos, alguns desses penetram pelos forames nutrícios; e em espessas fibras colágenas de ancoragem, chamadas de fibras de Sharpey, que penetram profundamente nas lamelas circunferenciais externas (KIERSZENBAUM, 2008).
O endósteo é formado por células pavimentosas e fibras do tecido conjuntivo, que revestem as paredes do tecido ósseo esponjoso, abrigando a medula óssea e se estendendo para todas as cavidades do osso, incluindo os canais de Havers e Volkmann (KIERSZENBAUM, 2008).
7 correspondem a uma pequena parte da massa óssea, sendo responsáveis pela função de regulação da distribuição e do conteúdo do componente inorgânico; portanto, pela manutenção dos níveis circulantes de cálcio (homeostase mineral) e pela contínua reabsorção e formação (modelação e remodelação) da matriz óssea, fazendo com que o sistema esquelético responda às forças mecânicas, geradas pela sustentação de pesos e atividade física (homeostase esquelética) (AIRES, 2008).
O osteoblasto, localizado na superfície de formação óssea, é uma célula secretora versátil, que retém a capacidade de se dividir e secreta tanto o colágeno tipo 1 (que constitui 90% das proteínas do osso) quanto as proteínas da matriz óssea que constituem o osso desmineralizado inicial, ou osteóide. As proteínas da matriz óssea produzidas pelo osteoblasto incluem proteínas de ligação com o cálcio como a osteocalcina e a osteonectina. Essa célula também é responsável pela calcificação da matriz óssea. O processo de calcificação parece ser iniciado pelo osteoblasto, por meio da secreção para dentro de pequenas vesículas da matriz, limitadas por membranas. As vesículas são ricas em fosfatase alcalina e ativamente secretadas, apenas durante o período em que a célula produz a matriz óssea (ROSS; PAWLINA, 2008).
A função osteoblástica é controlada por fatores endócrinos, parácrinos e autócrinos. Hormônios como PTH, vitamina D3, glicocorticoides e esteroides gonadais atuam diretamente sobre os osteoblastos (KHAN et al., 2001).
Em contraste com os osteoblastos secretores encontrados na deposição ativa da matriz, os osteoblastos inativos são células achatadas, que cobrem a superfície óssea, e se assemelham às células osteoprogenitoras. Os osteoblastos respondem aos estímulos mecânicos para mediar as alterações no crescimento ósseo e na remodelação óssea. À medida que ocorre a deposição de osteoide, o osteoblasto é circundado mais adiante por matriz de osteoide e, em seguida, transforma-se em osteócito (ROSS; PAWLINA, 2008).
8 rede de extensões celulares, que alcança esses osteoblastos, por meio de canalículos ósseos (AIRES, 2008). Os osteócitos são as células responsáveis por manter a matriz óssea. Um dos papéis dessas células é o de mecanotransdução, em que o osteócito responde às forças mecânicas aplicadas ao osso. Diferentes estímulos mecânicos alteram não somente a expressão gênica, mas também o mecanismo apoptótico da célula (ROSS; PAWLINA, 2008).
Os osteoclastos são macrófagos policarióticos, formados a partir das células precursoras, localizadas na medula óssea, de origem hematopoética. A presença de células do estroma ou da medula óssea é fundamental para que ocorra essa diferenciação, o que sugeria que fatores produzidos por essas células estimulariam esse processo. Atualmente sabe que dois componentes são necessários e suficientes para desencadear esse processo: a citocina RANKL (ligante do receptor ativador do fator nuclear κB) e o fator de crescimento CSF-1 (fator estimulador de colônia tipo 1). Juntos, o CSF-1 e a RANKL são capazes de induzir a expressão de genes que caracteriza o osteoclasto, incluindo aqueles que tipificam a fosfatase alcalina ácida tártaro-resistente, a catepsina K, o receptor de calcitonia e de β3 – integrina (AIRES, 2008). O processo de reabsorção depende de características especiais entre o osteoclasto e a superfície óssea, onde um espaço fechado forma-se entre a célula e a matriz. Nesse espaço, os osteoclastos liberam enzimas lisossomais mantendo um pH ácido, a fim de possibilitar a dissolução da matriz óssea (KHAN et al., 2001; MOTTA, 2003) Em consequência da atividade osteoclástica (aparecimento da borda em escova), uma baía de reabsorção (lacuna de Howship), pode ser observada no osso, diretamente sob o osteoclasto (ROSS; PAWLINA, 2008).
A densidade mineral óssea (DMO) trata-se do equilíbrio entre o processo de formação e reabsorção, denominado remodelação. A formação está diretamente ligada à reconstrução e ao fortalecimento do tecido ósseo, enquanto a reabsorção se responsabiliza pela deterioração desse mesmo tecido (CADORE et al., 2005).
9 respostas fisiológicas que permitam níveis mais elevados de obtenção de massa óssea (VICENTE-RODRIGUEZ et al., 2008).
As propriedades mecânicas do osso são estabelecidas pela matriz colágena e pelo grau de mineralização, ou seja, pela quantidade de cristais de hidroxiapatita de cálcio depositada entre as fibras colágenas. A resistência óssea é determinada pela massa do tecido ósseo e pela rigidez dela, que é delimitada principalmente pela fase mineral, enquanto a matriz de colágeno contribui principalmente para aumentar a capacidade de o osso pode ser flexionado sem se romper (GUADALUPE-GRAU et al., 2009).
O tecido ósseo é um tecido dinâmico, que está em constante modificação, basicamente em razão dos três principais processos: o crescimento, a modelação e a remodelação óssea. (AIRES, 2008).
Segundo Aires (2008), durante o desenvolvimento dos vertebrados, o osso pode ser formado pela, ossificação intramembranosa, que é efetuada por osteoblastos originários diretamente da diferenciação de células mesenquimais primitivas. O tecido ósseo primordialmente desenvolvido é desorganizado, sendo gradativamente substituído por um osso de conformação lamelar; e pela ossificação endocondral que ocorre a partir de um molde cartilaginoso feito por condrócitos. É o mecanismo mais comum, responsável pelo aparecimento dos ossos longos, coluna vertebral, bacia e a base do crânio. Esse molde sofre erosões, sendo substituído por tecido ósseo, pela síntese e mineralização da matriz óssea pelos osteoblastos. Após a ossificação, surge a placa epifisária, uma camada cartilaginosa na região da epífise óssea, responsável pelo crescimento longitudinal do osso (AIRES, 2008).
Embora o crescimento ósseo cesse a partir de uma determinada idade com o desaparecimento das placas epifisárias, os processos de modelação e remodelação persistem durante toda vida (Aires, 2008).
10 persistem no longo da vida, sempre com o objetivo de melhorar a resistência mecânica do osso (AIRES, 2008).
A remodelação óssea é um processo contínuo, caracterizado pela sequência de ativação-reabsorção-formação. Os fenômenos que levam à ativação ainda são pouco conhecidos. Tanto estímulos sistêmicos (PTH) como locais (por tensão mecânica ou microfraturas) podem iniciar essa ativação. Esse papel tem sido atribuído aos osteócitos, que determinam o local de remodelação (AIRES, 2008).O osso é então reabsorvido pelos osteoclastos e formado na mesma região pelos osteoblastos. Essas células formam a unidade básica do metabolismo (UBM), que o reconstrói em locais distintos nos três componentes (endocortical, intracortical e trabecular) do respectivo envoltório interno (endósteo) e num grau muito menor no envoltório externo (periósteo) (BILEZIKIAN et al., 2008). Os objetivos da remodelação são atingir um ponto ótimo de resistência óssea, por meio do reparo de lesões microscópicas (microfissuras), ocorridas pela atividade normal do peso; manter a homeostase do cálcio; e também fornecer um quadro para a mobilização de cálcio; durante estados fisiológicos excepcionais como a lactação (BILEZIKIAN et al., 2008; ROSEN, 2007).
A remodelação ocorre tanto no osso cortical como no trabecular, porém, é mais intensa no trabecular, em razão da disposição e função de trabéculas ósseas. Em situações fisiológicas, a reabsorção e a formação são fenômenos acoplados e dependentes; e o predomínio de um sobre o outro pode resultar em ganho ou perda de massa óssea (SARAIVA; LAZARETTI-CASTRO, 2002).
11 osteoclastos ativos e induzindo a apoptose de osteoclastos maduros (ROBLING et al., 2006; PROFF; RÖMER, 2009).
A formação inicia-se com a diferenciação dos pré-osteoblastos em osteoblastos. Admite-se que há proteínas liberadas durante a degradação da matriz orgânica, como o transforming growth factor-β, capazes de recrutar células osteoprogenitoras para os sítios de formação óssea e induzir a diferenciação até osteoblastos e osteócitos (AIRES, 2008).
Os componentes do material e a organização estrutural do osso influenciam as maneiras que o osso responde às cargas mecânicas. A composição e a estrutura do osso dão origem a um material que é resistente para seu peso relativamente leve. Os principais componentes do osso são carbonato de cálcio, fosfato de cálcio, colágeno e água, os percentuais relativos desse material variam com a idade e a saúde do osso. Os minerais conferem ao osso a sua rigidez e são os determinantes primários da resistência compressiva dele; já o colágeno é uma proteína que atribui a flexibilidade, o que contribui para a resistência tensiva (resistência à tração). O conteúdo de água presente no tecido ósseo (25% a 30%) contribui de maneira significativa para a resistência desse tecido (HALL, 2005).
A saúde óssea é um dos fatores mais importante relacionado à fratura; menor rigidez, força e tenacidade óssea aumentam a probabilidade do risco de fraturas, que é um grande problema de saúde pública, por estar associado à morbidade, mortalidade e alto custo econômico (GALVÃO; CASTRO, 2010).
12 elasticidade do osso trabecular variam consideravelmente com a localização no corpo, bem como a idade e a saúde do indivíduo.
Além das forças de tensão, compressão e cisalhamento, outra forma de estresse imposto ao tecido ósseo é o resultado final da deformação mecânica repetida das contrações musculares que resultam em um aumento das correntes elétricas pulsáteis no osso, por causa dos fenômenos piezoelétricos e de fluxo que também são capazes de provocar alterações na estrutura óssea (TUREK, 1991).
3.3. Diabetes mellitus e tecido ósseo
A presença de DM tipo 1 provoca várias consequências deletérias para saúde esquelética, como menor crescimento da estatura durante a puberdade, menor densidade óssea na idade adulta, aumento no risco de osteoporose e fratura, má cicatrização óssea e embriopatia esquelética, processo que depende de nova formação óssea (INZERILLO; EPSTEIN, 2004).
Segundo Hofbauer et al. (2007), a osteoporose é a mais importante doença metabólica em indivíduos com DM. Cerca de 20% dos idosos são afetados pelo DM; nessa fase a importância da saúde óssea é grande uma vez que os riscos de fraturas aumentam exponencialmente (SCHWARTZ, 2003). Apesar da osteoporose ser considerada uma doença de adultos com DM tipo 1, a situação se torna diferente, sendo capaz de atingir pessoas de todas as idades (TRAILKILL et al., 2005).
13 gerar fraturas. O DM tipo 2 também está associado à má qualidade óssea, à retinopatia, à neuropatia periférica e ao derrame (SCHWARTZ, 2003).
A insulina tem sido reconhecida como regulador do metabolismo ósseo e promove estimulação da matriz óssea e formação de cartilagem (KAGEL; EINHORN, 1996); a falta dela tem sido vista como potencial motivo para explicar a menor densidade mineral óssea em DM tipo 1 (RÄKEL et al., 2008). Há evidências que sugerem que a deficiência de insulina no DM tipo 1 pode interferir na formação de novo osso, possivelmente em razão do mau funcionamento dos osteoblastos (MIAZGOWSKI et al., 2007). Além dos efeitos diretos da insulina nas células ósseas, essa também pode exercer efeitos sinérgicos com outros agentes anabólicos no osso como o fator de crescimento semelhante à insulina-1 (IGF-1) e PTH (THRAILKILL et al., 2005).
Os mecanismos celular e molecular subjacentes à perda de massa óssea por deficiência de sinalização de insulina e IGF-1 ainda não foi esclarecido; entretanto sabe-se que a IRS-1 osteoblástica desempenha importante papel na manutenção óssea, não só porque é essencial para a sinalização de IGF-1 e insulina, mas também porque pode estar envolvido na transdução de sinal para outros fatores. Entre outras funções, o IGF-1 aumenta a produção de colágeno, que é incorporado à matriz óssea, bem como pode regular a função osteoblástica, durante reabsorção do osteoclasto (OGATA et al., 2000).
Outros aspectos também estão envolvidos com a perda óssea em DM, como a inflamação, que pode contribuir para a perda óssea, visto que o DM tipo 1 é o resultado da destruição inflamatória autoimune do pâncreas e, portanto, perfis de citocinas e de suas vias sinalizadoras são susceptíveis de serem alteradas durante a fase aguda e crônica do DM tipo 1. Os níveis elevados de citocinas podem ativar a reabsorção osteoclástica do osso, não sendo um fator importante na perda óssea diabética; suprimir a diferenciação osteoblástica e a formação óssea, e podem contribuir para a perda óssea em indivíduos com DM tipo 1 (MCCABE, 2007).
3.4. Diabetes mellitus e exercício físico
14 com DM tipo 1, o exercício físico tem importante efeito sobre a insulina; desse modo, a dieta deve ser observada para que não ocorra severa hipo ou hiperglicemia. Nos com DM tipo 2, a atividade física aeróbica regular é uma ferramenta eficaz na prevenção e tratamento da doença (DE FEO et al., 2006).
O exercício físico eleva a sensibilidade à insulina em indivíduos com DM tipo 2. Acredita-se que esse aumento da sensibilidade seja causada pela melhoria na captação da glicose via GLUT4, resultante do efeito do exercício na expressão e translocação do transportador, para a membrana plasmática do músculo esquelético. Esse estado de sensibilidade alterada pode durar diversas horas. Os atletas altamente treinados possuem melhor tolerância à glicose, melhor eficiência das células beta e melhor utilização da glicose que os indivíduos não treinados; além disso, podem exibir maior resposta glicêmica à glicose oral, secundária a adaptações na absorção da glicose. As adaptações associadas ao treinamento são revertidas rapidamente, assim que esses interrompem os programas de exercício (KAHN et al., 2009).
Em indivíduos com DM tipo 1, ao contrário daqueles sem diabetes, os eventos regulatórios nas ilhotas pancreáticas induzidos pelo exercício não podem diminuir a secreção da insulina, pois essa é exógena (injetada). Como os níveis de insulina são sustentados, o efeito supressivo dela no fígado continua e a produção hepática de glicose permanece baixa, ao mesmo tempo em que a utilização da glicose do músculo se eleva, o que resulta em um risco substancial de hipoglicemia. Esse risco ainda pode aumentar, quando os pacientes injetam insulina em um local subcutâneo, em um membro que se está exercitando, pois o fluxo sanguíneo aumentado pode acelerar a absorção dela (KAHN et al., 2009).
Em alguns pacientes com DM tipo 1, a melhoria da sensibilidade à insulina exógena pode persistir por diversas horas, após esses pararem de se exercitar, podendo os efeitos durarem até 24 horas. O mecanismo não é totalmente compreendido, mas aceita-se que a sensibilidade aumentada seja em virtude da taxa relativamente alta de captação de glicose pelos músculos em exercício e da produção hepática menor de glicose, à medida que os depósitos de glicogênio são repostos (KAHN et al., 2009).
15 físicos, não há consenso geral sobre esse tema. Os benefícios de uma atividade física de longo prazo que são descritos para a população em geral, podem ser estendidos para os indivíduos com DM tipo 1.
Os diabéticos devem ser encorajados a realizar a prática diária de exercícios. Entretanto, esses indivíduos, antes de começar as sessões de exercício, devem ser cuidadosamente informados sobre os efeitos dessa atividade sobre a sua glicose sanguínea e sobre as modificações apropriadas na dieta, na sua terapia insulínica ou na utilização de hipoglicemiantes orais (DE FEO et al., 2006).
3.5. Tecido ósseo e exercício físico
Os efeitos osteogênicos do exercício físico sobre a saúde óssea são conhecidos (SOUZA; LUCIANO, 2005). Clinicamente, a DMO e ou o CMO são dois indicadores da saúde óssea (Huang et al., 2010), e a manutenção da DMO é importante para a prevenção da osteoporose (Cadore et al., 2005).
Os efeitos benéficos do exercício físico sobre o tecido ósseo têm sido extensivamente avaliados, por meio de vários estudos. No entanto, os mecanismos específicos pelos quais a atividade física atua no metabolismo ósseo ainda não estão completamente entendidos. O ganho de massa óssea conseguida com o exercício físico é, principalmente, em resposta a um aumento da tensão mecânica (TUREK, 1991). Durante o exercício, as forças de tensão, compressão e cisalhamento, associadas à deformação mecânica das contrações musculares, são capazes de provocar alterações na estrutura óssea. Acredita-se que correntes de baixa energia, geradas pela resposta piezoelétrica do cristal de hidroxiapatita ao estresse imposto a esse tecido, possam estar envolvidas nesse processo (AIRES, 2008; TUREK, 1991). Outros parâmetros, como, estímulos endócrinos, têm prováveis contribuições às adaptações esqueléticas (MAÏMOUN; SULTAN, 2010).
16 composição relativa dos minerais e da matriz de colágeno é deslocada pelo exercício, em favor da região óssea mais mineralizada (ISAKSSON et al., 2009).
No entanto, Isaksson et al. (2009) ainda afirmaram que a rede de colágeno também pode ser afetada pela estimulação mecânica, sendo aumentada como resultado do exercício, principalmente durante o crescimento e a maturação. O exercício pode afetar o conteúdo de colágeno no tecido ou a sua estabilidade molecular. Além de mudar o ritmo de remodelação das suas redes, a atividade física pode afetar significativamente a produção do colágeno e, consequentemente, as propriedades mecânicas do osso.
Em relação à natação, apesar de não haver impacto como acontece em exercício de corrida, o aumento da DMO, proporcionado pela natação, pode estar ligado à intensidade da atividade muscular. Estudos destacam a influência da força muscular sobre a massa óssea (BAYRAMOGLU et al., 2005). A contração muscular atua direta ou indiretamente sobre os ossos produzindo um estímulo osteogênico. De acordo com Iwamoto et al. (1999) Mais de 70% da tensão sofrida pelo osso é transmitida pela força muscular e não pelo peso corporal.
Em animais jovens, o exercício de natação foi correlacionado com maior aposição periosteal, crescimento longitudinal do osso, aumento do conteúdo mineral ósseo e força óssea. Outros estudos relataram alterações na geometria do osso de animais treinados com natação, o que reflete uma distribuição mais favorável do tecido ósseo; portanto, esse tecido capaz de fortalecer essa estrutura (HART et al., 2001).
Bourrin et al. (1992), utilizando análise histomorfométrica, apresentaram que o exercício de natação reduziu a reabsorção e a superfície osteoide em ratos jovens, indicando diminuição do turnover ósseo.
17 animais sedentários diabéticos apresentaram-se aumentados na quarta e oitava semana de estudo.
18
4 Material e Métodos
4.1. Animais de experimentação e tratamentos
Foram utilizados ratos (Rattus norvegicus), da linhagem Wistar, com 30 dias de idade e peso corporal médio de 87,42 g, provenientes do Biotério Central do Centro de Ciências Biológicas e da Saúde, da Universidade Federal de Viçosa. Após a aclimatação de sete dias, no Biotério de Experimentação do Departamento de Educação Física da UFV, os animais foram distribuídos aleatoriamente em seis grupos experimentais, a saber:
Baseline Diabético (BD, n= 15). - animais que receberam a injeção de estreptozotocina e foram sacrificados após 45 dias da indução do diabetes; Baseline Controle (BC, n= 15). - animais que receberam a injeção de tampão citrato de sódio e foram sacrificados juntamente com o grupo BD.
Controle Sedentário (CS, n=10). - animais que receberam injeção de tampão citrato de sódio; no entanto não foram sacrificados após 45 dias da indução do diabetes e não exercitaram;
Controle Exercitado (CE, n= 10). - animais que receberam injeção de tampão citrato de sódio; no entanto não foram sacrificados após 45 dias da indução do diabetes e exercitaram;
Diabético Sedentário (DS, n=10). - animais que receberam injeção de estreptozotocina, não foram sacrificados após 45 dias da indução do diabetes e não exercitaram (item 4.2);
Diabético Exercitado (DE, n=10). - animais que receberam injeção de estreptozotocina , não foram sacrificados após 45 dias da indução do diabetes e exercitaram (item 4.2).
Baseline Sedentários Exercitados
19 Os animais dos respectivos grupos experimentais foram alojados em gaiolas coletivas, cinco animais por gaiola, em ambiente com temperatura média de 22 °C e regime de luminosidade invertido de 12 horas de escuridão e 12 horas de claridade, e receberam água e ração comercial ad libitum. Todos os animais foram pesados, no primeiro dia de cada semana, ao longo do período experimental, em balança eletrônica digital (Marte Brasil, modelo AS5500C),com precisão de 0,01g.
Os procedimentos experimentais foram realizados, de acordo com os Princípios Éticos na Experimentação Animal, elaborados pelo Colégio Brasileiro de Experimentação Animal (COBEA). O projeto recebeu aprovação da Comissão de Ética do Departamento de Veterinária da Universidade Federal de Viçosa (Processo nº 03/2009).
4.2. Indução de Diabetes
20 4.3. Programa de Treinamento
Após 45 dias de hiperglicemia (diabetes), os animais do grupo DE e CE foram submetidos a um programa de treinamento de natação, adaptado de Medeiros et al. (2000), por oito semanas.
Tabela 1. Progressão de Treinamento dos animais experimentais
S
SEEMMAANNAA CCAA((R%%RGG))AA SSEEGGUUNNDDAA TTEERRÇÇAA QQUUAARRTTAA QQUUIINNTTAA SSEEXXTTAA
1
1 00%% 1100mmiinn 2200mmiinn 3300mmiinn 4400mmiinn 5500mmiinn
2
2 11%% 6600mmiinn 7700mmiinn 8800mmiinn 9900mmiinn 9900mmiinn
3
3 22%% 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn
4
4 33%% 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn
5
5 44%% 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn
6
6 44%% 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn
7
7 44%% 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn
8
8 44%% 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn 9900mmiinn
O treinamento físico foi realizado no Laboratório de Biologia do Exercício (BioEx), do Departamento de Educação Física da UFV. Foram utilizados tanques de alvenaria quadrados (55 cm de largura por 65 cm de profundidade), com água na temperatura de 28 °C a 30 °C e profundidade de 45 cm. Os animais dos grupos DS e CS foram colocados em uma caixa de polipropileno com água aquecida (28 °C –30 °C) e profundidade de 10 cm.
4.4. Avaliação da Densidade Mineral Óssea
Após eutanásia (CO2), o fêmur esquerdo foi removido, pesado em balança eletrônica digital (Marte – Brasil, modelo AS5500C) com precisão de 0,01g. Os tecidos moles foram dissecados e o osso foi envolvido em uma gase embebida com soro fisiológico e armazenado em freezer a -20 ºC. As amostras foram descongeladas imediatamente antes das análises.
21 A densidade mineral óssea foi automaticamente obtida pelo sistema, a partir da fórmula:
DMO (g/cm2) = CMO (g) / ÁREA (cm2)
4.5. Avaliação da Resistência Óssea
A análise da resistência óssea foi realizada no mesmo fêmur esquerdo, logo após à da DMO, realizado por Vicentini et al. (2007). O osso foi submetido a ensaio mecânico em máquina universal de ensaio (EMIC®, modelo DL 3000), com carga aplicada a uma velocidade de 5 mm/min. Um sistema computadorizado acoplado ao aparelho registrou a força (carga) e o deslocamento, sendo possível controlar todos os parâmetros do ensaio mecânico e obter o valor da força referente a cada deslocamento. A aquisição desses pontos foi realizada em intervalos de tempo padronizados, definidos pelo programa. A análise foi realizada tanto no colo do fêmur, com predomínio de osso esponjoso, como também no terço médio da diáfise, com predomínio de osso cortical. Os ensaios foram realizados no Departamento de Materiais Dentários da Faculdade de Odontologia da UNESP, Araçatuba, SP.
22
Figura 1. Fotografia do ensaio mecânico de flexão em três pontos, em diáfise de fêmur.
Figura 2. Representação sistemática da curva da carga de deformação de um teste de três pontos para osso.
Fonte : Mello, 2003
Também foi realizado o ensaio de flexão na cabeça do fêmur, com a amostra fixada em um aparato mecânico, ficando em posição vertical, mimetizando a posição fisiológica (Figura 3). Os mesmos parâmetros foram calculados nesse ensaio (força máxima, rigidez e tenacidade). O programa emitiu um arquivo com todos os pontos adquiridos durante os ensaios [Tempo
(Tecido mineral)
Matéria Or
gânica
Tena
ci
d
a
23 (s) x Deslocamento (mm) x Força (N)]. Esses valores foram transferidos para as planilhas Microsoft Office Excel 2007, permitindo a construção dos gráficos e o cálculo das propriedades mecânicas.
Figura 3. Fotografia do ensaio mecânico de flexão no colo do fêmur de rato
.
4.6. Exame Histomorfométrico
Após eutanásia, o fêmur direito foi dissecado e o osso, livre dos tecidos moles, foi fixado em formol 10%, neutro tamponado, em temperatura ambiente. Posteriormente, os fêmures foram colocados em cuba descalcificadora, contendo solução com citrato de sódio, água destilada e ácido fórmico. Após a descalcificação, o fêmur foi medido com paquímetro universal (Digimess – SP), para que se realizasse, em sua porção média, um corte transversal para análise da espessura do osso cortical. Após a retirada dessa amostra, o osso foi cortado longitudinalmente da região proximal (cabeça do fêmur) até sua porção média. As amostras retornaram à cuba descalcificadora, agora armazenada em cassetes, onde permaneceram por mais sete dias. Posteriormente, as amostras foram incluídas em parafina como rotina histológica. Em sequência, foram obtidos cortes de cinco micrômetros (μm) de espessura com micrótomo (LEICA, modelo RM2245 - Alemanha), e as lâminas foram coradas com Hematoxilina e Eosina (HE) e montadas com Entellan.
24 E600), com objetiva de 20x, ligado a uma câmera (Feldmann Wild Leitz Digi-Pro 5.0M) e software (Micrometrics SE Premium), para análise do osso trabecular. No osso trabecular, foram feitas de três a seis imagens por animal dependendo das condições da amostra, em campos distintos, garantindo maior fidelidade dos resultados encontrados. Sobre cada imagem foi sobreposta uma grade (gratícula), com dez linhas e dez colunas totalizando cem pontos de interseção. Os pontos coincidentes com osso foram contabilizados e o volume trabecular ósseo (VTO) foi dado em porcentagem pela fórmula a seguir:
número de pontos sobre osso
VTO (%) = _________________________________ X 100
número total de pontos
Para quantificação da espessura de osso cortical, uma câmera fotográfica (NIKON D700) acoplada a um microscópio estereoscópico (OLYMPUS SZ H10) foi utilizada, para visualização do corte como um todo. O mesmo software (Micrometrics SE Premium) foi usado agora fazendo o contorno do periósteo, assim como do canal medular; o resultado da subtração entre esses foi empregado como a espessura cortical óssea (Figura 4).
Figura 4. Desenho esquemático da determinação da espessura de osso cortical. Perímetro de A (Periósteo) – Perímetro B (Endósteo) = espessura de osso cortical.
A
25 4.7. Análise Estatística
26
5 RESULTADOS E DISCUSSÃO
Durante o período experimental, antes de completar 45 dias de hiperglicemia, três animais do grupo CE morreram e antes de concluir o período experimental total, mais um animal desse grupo morreu.
5.1. Peso corporal e glicemia
Os dados de ganho de peso dos animais, em diferentes grupos, aos 45 dias após a indução do diabetes e ao final de oito semanas de exercício, estão apresentados na Tabela 2.
Tabela 2. Peso corporal dos animais durante o período experimental Grupos (45 dias) n 45 dias (g) Peso aos (final) n final (g) Peso
BC 15 246,0 ± 26,9 0 -
BD 15 71,8 ± 30,8a 0 -
CS 10 277,1 ± 25,1 10 361,1 ± 18,7
CE 7 261,4 ± 31,7 6 320,7 ± 24,0
DS 10 86,3 ± 27,8b 10 106,5 ± 18,6b
DE 10 101,1 ± 34,1bc 10 107,2 ± 16,3bc
Os dados estão expressos em média ± DP(desvio padrão). n = número de animais.
(BC) Baseline de controle; (BD) Baseline diabético; (CS) controle sedentário; (CE)
controle exercitado; (DS) diabético sedentário; (DE) diabético exercitado; (a) diferente
de BC na mesma coluna (p<0,05); (b) diferente de CS; e (c) CE na mesma coluna
(p<0,05).
27 associada às forças de tensão, compressão e cisalhamento, é capaz de provocar alterações na estrutura óssea (AIRES, 2008; TUREK, 1991). Essas ações mecânicas geram diferenças no potencial elétrico dos ossos, que agem como campo elétrico (efeito piezoelétrico), estimulador da atividade celular, levando à deposição de minerais nos pontos de estresse (CADORE et al.,2005) O menor peso corporal final bem como o menor tamanho do fêmur em animais diabéticos, apresenta que esses animais tiveram o crescimento prejudicado. Sabe-se que a insulina é importante hormônio anabólico e sua deficiência pode afetar ainda a quantidade de outros hormônios, como hormônio de crescimento (GH), o que pode inibir o crescimento de animais com diabetes (GOMES et al. 2009).
28 Na Tabela 3 são apresentados os dados referentes à glicemia dos animais, durante o mesmo período experimental.
Tabela 3. Glicemia de jejum dos animais ao início do experimento, aos 45 dias e ao final do período experimental.
Grupos inicial n Glicemia inicial (mg/dL) 45 n dias
Glicemia aos 45
dias (mg/dL) final n Glicemia final (mg/dL)
BC 15 84,73 ± 2,73 15 82,73 ± 16,17 - -
BD 15 94,46 ± 4,27 15 536,26 ± 2,37 a - -
CS 10 82,60 ± 4,24 10 79,20 ± 1,93 10 79,70 ± 19,24
CE 10 78,57 ± 5,08 7 75,57 ± 3,37 6 80,17 ± 24,83
DS 10 88,90 ± 3,45 10 504,80 ± 15,22 b 10 480,40 ± 19,24 b
DE 10 93,00 ± 3,10 10 514,60 ± 20,64 bc 10 506,90 ± 19,24bc
Os dados estão expressos em média ± DP. n = número de animais. (BC) Baseline de
controle; (BD) Baseline diabético; (CS) controle sedentário; (CE) controle exercitado;
(DS) diabético sedentário; (DE) diabético exercitado; (a) diferente de BC na mesma
coluna (p<0,05); (b) diferente de CS; e (c) CE na mesma coluna (p<0,05).
29 glicose insulino-sensíveis (GLUT 4). Além disso, sabe-se que, em situações em que a produção de insulina encontra-se diminuída, ocorre aumento da regulação dos receptores, um dos fatores que explica a maior sensibilidade a esse hormônio.
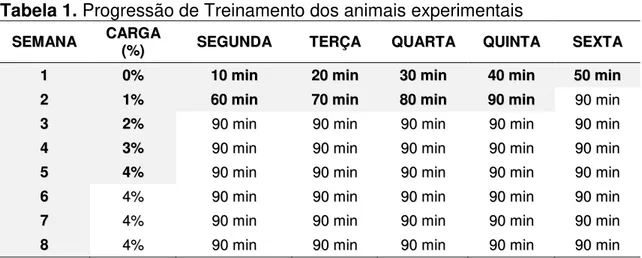
5.2. Propriedades estruturais do fêmur.
O grupo BD apresentou peso do fêmur significativamente menor (39%) que o BC (Figura 5A). Indicando que aos 45 dias havia prejuízo do desenvolvimento ósseo, em razão do diabetes. Ao final do experimento, os valores dos animais do grupo DS foram significativamente menores (39%) que os encontrados no CS. O grupo CE apresentou valores maiores (45%) que os encontrados no DE. O programa de exercício aplicado, entretanto, não afetou o peso do fêmur nos animais diabéticos e nos de controles (CS = CE e DS = DE, Figura 5A).
30
BC BD CS CE DS DE
0 1 2 3 4 5 b a a B Co m p ri m en to d o F êm u r (c m ) c
BC BD CS CE DS DE
0.0 0.5 1.0 1.5 2.0 b a a A P es o d o F êm u r (g ) c
Figura 5 - Peso (A) e comprimento (B) do fêmur dos animais dos grupos experimentais. Os dados estão expressos em média ± DP. (BC) Baseline controle;
(BD) Baseline diabético; (CS) controle sedentário; (CE) controle exercitado; (DS)
diabético sedentário; (DE) diabético exercitado; (a) diferente de BC (p<0,05); (b)
diferente de CS; e (c) diferente de CE (p<0,05).
Uma possível justificativa para esse peso reduzido do fêmur dos animais diabéticos (DS e DE) é a deficiência de insulina, pois acredita-se que essa estimula a síntese nucleotídea pelos osteoblastos, além de promover o acúmulo intracelular de aminoácidos em ossos. Fatores de crescimento semelhantes à insulina promovem a síntese do colágeno ósseo e aumentam a deposição de cálcio no esqueleto, ou seja, se houver redução dos níveis de insulina, a síntese da matriz óssea fica inadequada, impedindo a calcificação adequada do osso (BILEZIKIAN et al 2008).
31 aplicado não afetou esse parâmetro ósseo nos ratos diabéticos, possivelmente por causa da deficiência de insulina nesses animais
O grupo BD evidenciou comprimento do fêmur significativamente menor (16%) que o BC (Figura 5B), o que indica que aos 45 dias havia prejuízo do desenvolvimento ósseo, em razão do diabetes. Ao final do experimento, os valores dos animais do grupo DS foram significativamente menores (18%) que os encontrados no CS. O comprimento do fêmur dos animais DE apresentou valores menores (19%), em comparação aos seus pares CE. O programa de exercício aplicado, entretanto, não afetou o comprimento do fêmur dos animais diabéticos e dos controles (CS=CE e DS=DE, Figura 5B).
Nos animais diabéticos, o menor comprimento do fêmur pode ser consequência da insulinopenia, causada pelo DM tipo 1, uma vez que a insulina também possui ação sobre o crescimento epifiseal (GOMES et al, 2009). Souza et al. (2005) verificaram alterações nas placas epifisárias da tíbia de ratos Wistar diabéticos, com cerca de 60 dias de idade e sacrificados aos 10, 20 e 30 dias de treinamento. Tais amostras demonstraram evidentes degenerações nos condrócitos dos animais com diabetes experimental o que aumenta a possibilidade do não crescimento ósseo uma vez que havendo um dano no molde precursor do osso, toda a estrutura final será prejudicada. Além disso, Silva et al. (2009) demonstraram que ratos Sprague-Dawley, com 12 semanas de diabetes, apresentaram redução na espessura da placa epifisária, o que pode afetar o crescimento ósseo.
32 programa de exercício aplicado, entretanto, não afetou a área do fêmur nos animais diabéticos e nos de controles (CS = CE e DS = DE, Figura 6A).
A redução da área do fêmur dos ratos diabéticos ocorreu, possivelmente, pela deficiência de insulina nesses animais, pois a insuficiência desse hormônio é capaz de provocar evidentes degenerações nos condrócitos encontrados na placa epifisária dos animais com diabetes experimental, prejudicando o seu crescimento, uma vez que a área óssea depende do comprimento do osso (SOUZA et al. 2005).
Os animais do grupo BD apresentaram valores de CMO significativamente menores (55%), em relação aos do BC (Figura 6B), pois, o diabetes aos 45 dias já havia comprometido o CMO dos animais desse grupo. O grupo CS apresentou CMO significativamente maior (20%) que o do BC, o que indica que os animais, ao final do experimento, identificaram maior deposição mineral que aos 45 dias, mostrando possível relação da idade com o CMO. Os animais de CE foram significativamente maiores (14%) que os de CS, determinando o efeito benéfico da atividade física em aumentar a deposição mineral nos grupos que foram submetidos ao protocolo de natação. Os dados do grupo DS foram significativamente menores (58%), quando comparados aos do CS, o que prenuncia que, assim como ocorreu aos 45 dias com os animais comprometidos pelo diabetes, ao final do experimento, esses ainda expuseram menores valores de CMO que os do grupo de controle. Os resultados encontrados do grupo DE foram menores (64%), quando comparados aos do CE,indicando que o exercício, sem a secreção normal de insulina, não foi capaz de aumentar o CMO dos animais com diabetes. O programa de exercício aplicado, entretanto, não afetou o CMO do fêmur nos ratos diabéticos (DS = DE, Figura 6B).
Os dados da DMO estão evidenciados na Figura 6C. Os animais do grupo BD apresentaram valores significativamente menores (45%) que os do BC, o que indica que aos 45 dias havia prejuízo na DMO, provocado pelo diabetes, nesse grupo de animais. Do mesmo modo, aconteceu ao final do experimento, uma vez que a DMO do grupo DS foi significativamente menor (44%) quando comparada à do CS.
33 apresentaram valores significativamente menores (49%) que os do CE e não diferentes do DS.
BC BD CS CE DS DE 0.0 0.5 1.0 1.5 2.0 2.5 b a a A Á re a (c m
2 ) c
BC BD CS CE DS DE 0.0 0.2 0.4 0.6 a b a b B CM O (g ) c
BC BD CS CE DS DE 0.0 0.1 0.2 0.3 b a b C DM O (g /c m 2 ) c
Figura 6 - Área (A); conteúdo mineral ósseo (CMO) (B); e densidade mineral óssea (DMO) (C) do fêmur dos animais dos grupos experimentais. Os dados estão expressos em média ± DP. (BC) Baseline de controle; (BD) Baseline diabético; (CS) controle
sedentário; (CE) controle exercitado; (DS) diabético sedentário; (DE) diabético exercitado; (a) diferente de BC (p<0,05); (b) diferente de CS; e (c) diferente de CE
(p<0,05).
34 osteoblastos (MIAZGOWSKI et al., 2007). Os mecanismos celular e molecular, subjacentes à perda de massa óssea por deficiência de sinalização de insulina e IGF-1, ainda não foiram completamente esclarecidos. Entretanto, a deficiência no substrato do receptor de insulina (IRS-1) de osteoblastos dificulta a proliferação e diferenciação desses, bem como o apoio da osteoclastogênese, resultando em osteopenia; sendo assim, IRS-1 osteoblástica desempenha importante papel na manutenção óssea, não só porque é essencial para a sinalização de IGF-1 e insulina, mas também porque pode estar envolvida na transdução de sinal para outros fatores. Entre outras funções, o IGF-1 aumenta a produção de colágeno, que será incorporado à matriz óssea; pode regular a função osteoblástica, durante reabsorção do osteoclasto, e a reabsorção óssea, por meio de efeitos diretos e indiretos na diferenciação e ação de osteoclasto (OGATA et al., 2000).
Além de todos esses fatores, também podem vir a auxiliar no processo de redução da CMO: o aumento da excreção de cálcio pela urina, juntamente com diminuição na absorção de cálcio intestinal, levando à deficiência crônica de cálcio; os efeitos no longo da vida da hiperglicemia crônica sobre a função dos osteoblastos; os efeitos negativos do acúmulo produtos finais glicação na formação óssea; a insulinopenia; e o diabetes induzido por desregulação do eixo GH-IGF (THRAILKILL, et al., 2005).
35 insulina, não é capaz de manter ou aumentar o CMO de ossos nos animais diabéticos.
5.3. Propriedades mecânicas do fêmur
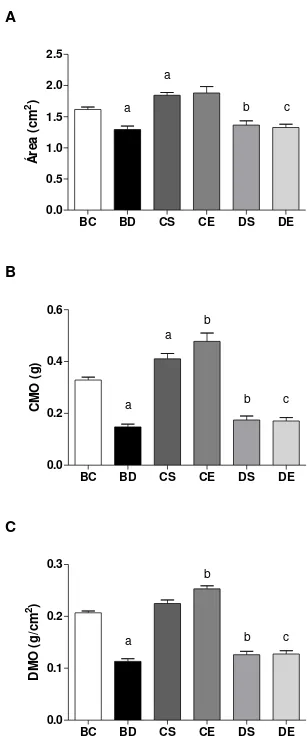
O grupo BD apresentou rigidez à flexão na região do colo do fêmur significativamente menor (48%), quando comparado ao BC (Figura 7A), indicando que o diabetes aos 45 dias prejudicou a deposição mineral desses animais. O grupo CE evidenciou uma rigidez significativamente maior (34%) que o CS, o que prenuncia que o protocolo de natação utilizado afetou de forma benéfica esse parâmetro. Os animais DS demonstraram valores significativamente menores (47%) que os CS, expondo, mais uma vez, que, ao final do experimento, o prejuízo do diabetes continuou, assim como ocorreu aos 45 dias. O grupo DE evidenciou valores inferiores (33%) em comparação com o CE, demonstrando que o diabetes interfere na ação do exercício sobre o parâmetro analisado (Figura 7A).
36
BC BD CS CE DS DE 0 50 100 150 200 b a b A Ri gi de z (n /m m ) c
BC BD CS CE DS DE 0 50 100 150 200 b a B Fo rç a (N) c
BC BD CS CE DS DE 0 50 100 150 a C Te na ci da de ( n. m m )
Figura 7 - Rigidez (A); Força máxima de fratura (B); e Tenacidade (C), no colo do fêmur dos animais dos grupos experimentais. Os dados estão expressos em média ± DP. (BC) Baseline controle; (BD) Baseline diabético; (CS) controle sedentário; (CE)
controle exercitado; (DS) diabético sedentário; (DE) diabético exercitado; (a) diferente
de BC (p<0,05); (b) diferente de CS; e (c) diferente de CE (p<0,05)
37 experimento, os danos causados pelo diabetes permaneceram nesses ratos. Os animais do grupo DE apresentaram valores inferiores (54%) quando comparados aos do grupo CE, indicando que o exercício não foi eficiente em aumentar a força máxima à flexão, em uma situação de carência de insulina.
Para a tenacidade óssea no colo do fêmur (Figura 7C), a única diferença encontrada foi para o grupo BD que apresentou valores significativamente menores (38%), quando comparados ao BC, o que evidencia que a tenacidade óssea desses animais estava prejudicada aos 45 dias pelo diabetes. Não houve diferença estatística entre os grupos DE e CE.
Os principais componentes do osso são carbonato de cálcio, fosfato de cálcio, colágeno e água; os percentuais relativos desse material variam com a idade e a saúde do osso. Os minerais conferem ao osso sua rigidez e são os determinantes primários de sua resistência compressiva. O colágeno é uma proteína que atribui ao osso sua flexibilidade o que contribui para sua resistência tensiva (resistência à tração) (HALL, 2005). A integridade do osso é importante para a fratura. A menor rigidez, força e tenacidade óssea aumentam a probabilidade do risco de fraturas, que é grande problema de saúde pública, pois essas estão associadas à morbidade, mortalidade e alto custo econômico (GALVÃO; CASTRO, 2010).
A região mineralizada do osso controla a rigidez, enquanto o colágeno, a força máxima e a tenacidade do osso. Estudos indicaram que a composição relativa dos minerais e da matriz de colágeno é deslocada pelo exercício em favor da região óssea mais mineralizada (ISAKSSON et al., 2009). A rede de colágeno também pode ser afetada pela estimulação mecânica, sendo aumentada como resultado do exercício, principalmente durante o crescimento e maturação. O exercício pode afetar o conteúdo de colágeno no tecido ou a sua estabilidade molecular, mudar o ritmo de remodelação das suas redes e alterar a produção de colágeno; consequentemente, as propriedades mecânicas do osso (ISAKSSON et al., 2009).
38 metabolismo ósseo já foi descrita na literatura e sabe-se que os osteoblastos contêm receptores para essa e sua ação no crescimento somático ocorre via alterações na expressão genética e biossíntese protéica, que culminam da transdução dos sinais iniciados na membrana celular (PRICE et al.,1994 apud SOUZA et al., 2005). A deficiência de insulina prejudica a ação osteoblástica, o que resulta em redução na deposição mineral, alterando o CMO e, consequentemente, a rigidez.
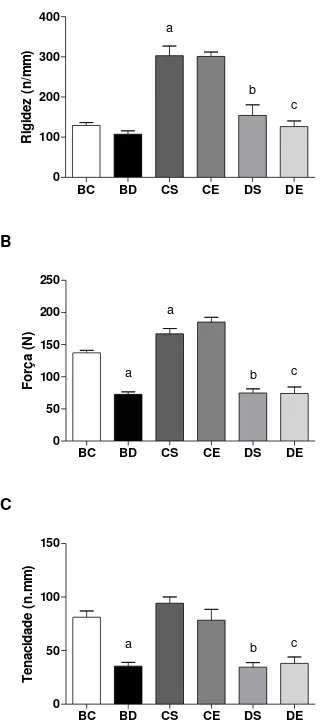
A rigidez à flexão na diáfise do fêmur não foi diferente entre os grupos BC e BD; entretanto, nos animais CS foi maior (57%) que nos BC (Figura 8A); indicando que o tempo afeta a deposição mineral óssea para indivíduos normais. O grupo DS apresentou rigidez menor (49%) em relação ao CS, o que evidenciou que, ao final do experimento, o DM causou prejuízo à deposição mineral óssea nesses ratos. Os resultados encontrados nos animais do grupo DE foram menores (58%) que os encontrados nos do CE, expondo a ineficiência do exercício, quando há carência de insulina. Todavia, o programa de natação não alterou esse parâmetro nos animais de controles ou diabéticos. A força máxima até a fratura na diáfise do fêmur foi menor (47%) no grupo BD que no BC (Figura 8B); em 45 dias de hiperglicemia, a força óssea à fratura desses animais estava prejudicada. O grupo CS apresentou valores maiores (18%) que o grupo BC, o que indica que os animais de controle, ao final do experimento, tiveram maior deposição de minerais, em razão da idade. A força de fratura do grupo DS foi menor (55%) que a do CS, demonstrando que ao final do experimento, o diabetes comprometeu a deposição mineral nesses animais, como ocorreu com o grupo diabético, aos 45 dias de experimento (Figura 8B). Os animais do grupo DE apresentaram valores inferiores (60%), quando comparados aos do grupo CE, indicando que o exercício não é eficiente quando há deficiência de insulina. Porém, o programa de natação não alterou esse parâmetro nos animais de controles ou diabéticos.
39 experimento, o prejuízo identificado aos 45 dias nos grupos comprometidos pelo diabetes ainda permanecia (Figura 8C). O grupo DE demonstrou valores inferiores (51%), quando comparados ao CE, indicando que o diabetes interfere na ação positiva do exercício no osso. Entretanto, o programa de natação não alterou este parâmetro nos animais de controles ou diabéticos.
BC BD CS CE DS DE
0 100 200 300 400 b a A Ri gi de z (n /m m ) c
BC BD CS CE DS DE
0 50 100 150 200 250 b a a B Fo rç a (N) c
BC BD CS CE DS DE
0 50 100 150 b a C Te na ci da de ( n. m m ) c
Figura 8 - Rigidez (A); força máxima (B) e tenacidade (C) na diáfise do fêmur dos animais dos grupos experimentais. Os dados estão expressos em média ± DP. (BC)
Baseline controle; (BD) Baseline diabético; (CS) controle sedentário; (CE) controle
exercitado; (DS) diabético sedentário; (DE) diabético exercitado; (a) diferente de BC
40 Os dados da diáfise do fêmur apresentaram comportamento similar aos do colo do fêmur, observando-se maior fragilidade óssea para os grupos comprometidos pelo diabetes. Porém, os efeitos do programa de natação nos animais de controles não foram neste estudo.
A insulina tem participação no metabolismo ósseo, uma vez que, os osteoblastos contêm receptores para esse hormônio. A sua ação no crescimento somático, esta ligada às alterações na expressão genética e síntese de proteínas que ocorrem em razão, da transdução de sinais que se iniciam na membrana celular (PRICE et al.,1994 apud SOUZA et al., 2005). A insulina pode atuar como hormônio do crescimento, estimulando a síntese de colágeno e a multiplicação dos osteoblastos (CANALIS et al., 1980 apud SOUZA et al., 2005). Sendo assim, a deficiência de insulina comprometeu a saúde óssea dos animais diabéticos diminuindo a capacidade do osso em resistir á fratura.
Outros estudos demonstraram que a carga máxima suportada até a fratura no fêmur de ratos Sprague-Dawley diabéticos, com dez semanas de idade, foi menor que a de seus respectivos controle (REDDY et al., 2001; ERDAL et al., 2010), por causa das mudanças metabólicas causadas pelo distúrbio da insulina e IGF-1. Erdal et al. (2010), trabalhando com ratos Wistar machos albinos, com doze semanas de idade, afirmaram que ocorreu também alteração no metabolismo da rede de colágeno dos animais diabéticos.
O aumento da rigidez do grupo CS, em relação ao grupo BC, pode ser explicado pelo próprio crescimento dos animais, este crescimento associado ao ganho de peso, durante esse período, pode ter influência sobre os resultados encontrados.
5.4. Histomorfometria do fêmur.